Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.2 Santa Marta July/Dec. 2012
VARIACIÓN ESPACIO-TEMPORAL DE LA FAUNA MACROBENTÓNICA ASOCIADA A FONDOS BLANDOS Y SU RELACIÓN CON FACTORES AMBIENTALES EN EL PARQUE NACIONAL NATURAL GORGONA, PACÍFICO COLOMBIANO*
SPATIO-TEMPORAL VARIATION OF SOFT-BOTTOM MACROBENTHIC FAUNA AND RELATION TO ENVIRONMENTAL FACTORS IN GORGONA NATURAL NATIONAL PARK, COLOMBIAN PACIFIC
Fabián A. Cortés1, Óscar D. Solano2 y José A. Ruiz-López1
1 Instituto de Investigaciones Marinas y Costeras -Invemar-. Cerro Punta de Betín, Santa Marta, Colombia. fabian.cortes@invemar.org.co; jose.ruiz@invemar.org.co.
2 Investigador independiente, Cali, Colombia. odsolano@gmail.com.
RESUMEN
Entre los meses de enero y diciembre de 1999 (con excepción de julio), se realizó la caracterización de la macroinfauna bentónica de fondos blandos en cuatro sectores del Parque Nacional Natural Gorgona: Punta Brava, Yundigua, El Remanso y La Máncora. Para tal fin fueron recolectadas muestras de fondo en ocho estaciones ubicadas a 5 y 15 m de profundidad por medio de un corazonador de PVC de 15 cm de diámetro, el cual se introdujo 10 cm en el sedimento. Se determinó la densidad, biomasa húmeda y composición de organismos, los cuales fueron identificados hasta el nivel taxonómico de familia. Técnicas estadísticas univariadas y multivariadas permitieron definir y caracterizar espacial y temporalmente la comunidad, examinar el grado de perturbación de la misma y relacionar el patrón biológico encontrado con variables ambientales del sedimento y columna de agua. Se encontraron diferencias significativas (p < 0.05) entre El Remanso y los demás sectores de muestreo, generadas por los mayores valores en densidad y riqueza de dicho sector. La clasificación y el ordenamiento exhibieron un cambio en la comunidad entre los períodos enero-junio y agosto-diciembre, ocasionado por diferencias en la composición de familias, menor riqueza y abundancia de organismos para el segundo semestre de 1999, donde las curvas ABC mostraron fuerte perturbación en la comunidad. Así mismo, los contenidos de cieno y materia orgánica en el sedimento disminuyeron en el período agosto-diciembre, mientras que los valores de carbonatos totales y la transparencia del agua se incrementaron. Los gránulos y cienos fueron las variables mejor correlacionadas (rρ = 0.327, p < 0.01) con la distribución y estructura de la macrofauna en el área de estudio, no obstante, es muy probable que existan otros factores ambientales mejor asociados con la comunidad.
PALABRAS CLAVE: Macrofauna bentónica, variación espacio-temporal, factores ambientales, Gorgona.
ABSTRACT
From January to December 1999 (excepting July) the characterization of soft bottom macrobenthic fauna was performed in four different areas of Gorgona Natural National Park: Punta Brava, Yundigua, El Remanso, and La Máncora. Eight samples were taken at depths from 5 to 15 m using a PVC cylinder with an inner diameter of 15 cm and buried 10 cm into the seabed. Abundance, wet biomass, and organism composition were determinated. Organisms were identified up to family level. Univariate and multivariate statistical techniques allowed to define and characterize spatially and temporally the community to examine levels of disturbance and to relate the biological pattern to environmental variables of sediment and deep water. Significant differences (p < 0.05) between El Remanso and other sampled areas were found due to the higher value of abundance and richness in El Remanso but with no differences in family composition. Clustering and ordination showed changes in the community between January-June and August-December caused by differences in family composition and reduced richness and organisms abundance in the second semester, when ABC curves showed a polluted community. In the same way, mud and organic matter values in the sediment diminished in August-December, but total carbonates and water transparency increased. Granules and muds were the variable best correlated (rρ = 0.327, p < 0.01) to macrofauna distribution and structure, but other environmental factors may show stronger affinities to the community.
KEY WORDS: Benthic macrofauna, space-temporal variation, enviromental factors, Gorgona.
INTRODUCCIÓN
Los fondos blandos son el ecosistema marino más extenso y el menos conocido. Se definen como agregaciones de sustrato particulado, cuyo tamaño es del mismo orden de magnitud o menor al de la mayoría de organismos allí presentes (Eleftheriou y Moore, 2005). De estos últimos, la fauna macrobentónica (denominada así por tener tamaños mayores a 0.5 mm) representa una comunidad de gran importancia en la cadena trófica como alimento de especies comerciales de peces e invertebrados y dado que está conformada por organismos sésiles que pueden tolerar o no la contaminación, el estudio y monitoreo de sus patrones espaciales y temporales se ha convertido en una técnica relativamente sensible y efectiva para detectar en forma temprana cambios drásticos del ambiente (Pohle y Thomas, 2001).
En Colombia, las comunidades macrobentónicas han sido más estudiadas en localidades del Caribe que en el Pacífico y, por lo tanto, de las primeras se deriva el conocimiento actual de dichas comunidades. Sin embargo, es poco lo que se conoce acerca de ellas en áreas someras de nuestros mares, menos aun en ecosistemas de islas, que en las regiones tropicales han sido poco estudiadas en comparación con las de regiones subtropicales y templadas (Guzmán-Alvis y Solano, 2002). En dicho contexto, en el Parque Nacional Natural Gorgona ubicado en el Pacífico colombiano, el ecosistema marino es un enclave ecológico estratégico y altamente representativo del Pacífico debido a su gran diversidad, resultado de su ubicación como punto de confluencia de larvas que entran al sistema por diferentes corrientes marinas (Wyrtki, 1973), características que han ameritado su estudio y conservación, Sin embargo, los estudios realizados sobre macrofauna bentónica de fondos blandos en esta isla, se restringen a tratar aspectos taxonómicos y descriptivos, destacando los realizados en los principales grupos: poliquetos (Prahl et al., 1979b; Laverde- Castillo, 1986), moluscos (Cantera et al., 1979; Cosel, 1984; Prahl, 1986), crustáceos (Prahl et al., 1978, 1979a; Prahl, 1986; Murillo, 1988; Lemaitre y Álvarez-León, 1992) y equinodermos (Cantera y Neira, 1988; Cantera et al., 1988); así como sobre estructura de macrofauna asociada a fondos blandos los trabajos de Dexter (1974) y Solano et al. (2001). Estos últimos autores presentaron una primera aproximación sobre la variabilidad espacio-temporal de la comunidad bentónica.
La investigación de la estructura en el espacio y tiempo de las comunidades bentónicas, no solo es importante desde el punto de vista científico ante la escasez de esta información, sino también en el establecimiento de una línea base para futuros programas de monitoreo (Guzmán-Alvis, 1993) y planes de manejo, principalmente en áreas marinas tan importantes como las del PNN Gorgona. Por lo tanto, teniendo en cuenta que los patrones espaciales y temporales de las especies del bentos de fondos sedimentarios en todas las latitudes están determinados por la producción primaria de la columna del agua, el tipo de sedimento, las condiciones fisicoquímicas asociadas (Alongi, 1990) y sus relaciones biológicas, la presente investigación pretende caracterizar la estructura de la comunidad macrozoobentónica asociada a sustratos blandos con el fin de actualizar y ahondar en el entendimiento de la ecología de estos organismos en la isla, apreciando su variabilidad espacio-temporal y su distribución de acuerdo con las características del sustrato y condiciones fisicoquímicas de agua y los sedimentos.
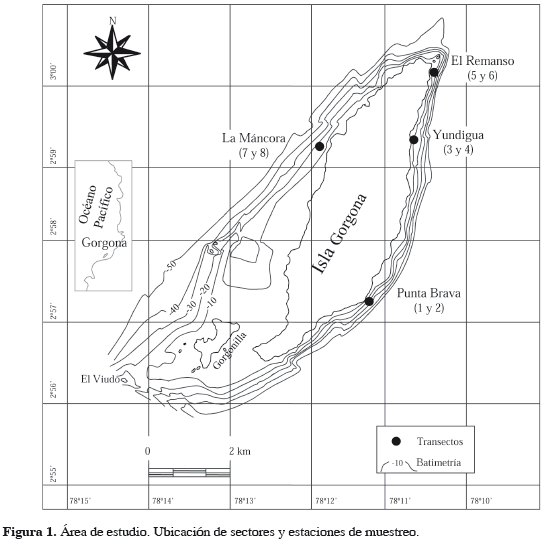
ÁREA DE ESTUDIO
El Parque Natural Nacional (PNN) Gorgona está ubicado al sur de la plataforma continental del Pacífico colombiano (2°55'45"-3°00'55"N, 78°09'00"- 78°14'30"W), abarca en sus 616.8 km2 de extensión, las islas Gorgona y Gorgonilla, los promontorios rocosos aledaños (El Viudo y El Horno) y las aguas y fondos marinos circundantes (Figura 1). La distancia más corta entre las islas y la costa continental (poblado de Bazán, Valle del Cauca) es de 30 km, con profundidad predominante de los fondos marinos que oscila entre 70-80 m entre ambos dominios (Díaz et al., 2001). Más del 80% de la superficie de Gorgona está constituida por rocas de origen volcánico, el resto corresponde a rocas sedimentarias. Las arenas de grano grueso mezcladas con cascajo bioclástico son el tipo de sustrato sedimentario que predomina en los fondos marinos, alrededor de la isla, hasta los 30 m de profundidad. Por debajo de esta cota las fracciones finas se van haciendo cada vez más importantes, hasta que a profundidades por debajo de 40-50 m los fondos adquieren una naturaleza lodosa especialmente en el costado oriental (Díaz et al., 2001).
El PNN Gorgona está dentro de la Zona de Convergencia Intertropical (ZCI), se caracteriza por una alta pluviosidad, que oscila entre 4164 y 8172 mm anuales. La humedad relativa promedio es superior al 90% y la temperatura media anual del aire es de 26 °C, con pocas variaciones intranuales. Presenta dos épocas climáticas, una lluviosa entre mayo y octubre, seguida por una de menores precipitaciones entre noviembre y abril. Los vientos son suaves y de dirección variable, principalmente provenientes del sur (Díaz et al., 2001).
Las masas de aguas superficiales recorren el área del PNN Gorgona permanentemente en dirección NE. La velocidad de la corriente tiende a ser mayor en los primeros y últimos meses del año, mientras que las menores intensidades corresponden a los meses intermedios. La amplitud de las mareas presenta valores máximos de 5.0 m y mínimos de 0.6 m (Ideam, 2000) y éstas son de tipo semidiurno, o sea que el ciclo mareal se repite completamente dos veces en algo más de 24 h, alternando dos mareas altas y dos bajas (Díaz et al., 2001). La circulación de las masas de agua en el Pacífico colombiano hace parte del sistema anticiclónico de corrientes del Pacífico oriental; específicamente para el área de Gorgona, el patrón hidrodinámico está dominado por un remolino anticiclónico que se desarrolla frente a las costas colombianas conocido como la corriente ciclónica de Panamá, cuyo componente en dirección norte, alimentado parcialmente por un brazo de la corriente del Perú, constituye la denominada corriente de Colombia (Wyrtki, 1973).
MATERIALES Y MÉTODOS
Recolección y procesamiento de muestras
Los muestreos se realizaron mensualmente entre enero y diciembre de 1999 (con excepción de julio debido a aspectos logísticos), en cuatro sectores de la isla: Punta Brava, Yundigua, El Remanso y La Máncora, ubicándose los tres primeros al costado oriental y el último en el occidental, buscando tener representatividad de las áreas, como también facilidad de acceso para la recolección de las muestras. De acuerdo con las profundidades establecidas en los parámetros de buceo seguro sin descompresión, se ubicaron en cada uno de los sectores dos estaciones de muestreo a 5 y 15 m de profundidad sobre un transecto perpendicular a la costa (Figura 1). Se recolectaron en cada estación cinco o seis muestras con un corazonador de PVC de 15 cm de diámetro introduciéndolo 10 cm en el sustrato, que es el estrato de sedimento en donde se concentran las mayores densidades de organismos de la fauna macrobentónica (Eleftheriou y Moore, 2005). Una de las muestras se utilizó para el análisis de sedimentos y las restantes para el análisis biológico (área total por estación: 0.071 a 0.088 m2), valores próximos a los sugeridos por la literatura para el análisis de comunidades macrobentónicas (Eleftheriou y Moore, 2005) y representativos de acuerdo con curvas de diversidad desarrolladas durante los primeros meses de muestreo (Ruiz-López, 2001).
Las muestras biológicas fueron tamizadas por una malla de 0.5 mm, se fijaron en formalina al 5% neutralizada con bórax y los organismos se tiñeron con rosa de bengala (1%) para facilitar su posterior separación en laboratorio. Estos últimos se preservaron en alcohol etílico al 70% y posteriormente fueron identificados por medio de claves hasta nivel de familia, el cual es apto para determinar diferentes medidas de la estructura de la comunidad y de variación espacio-temporal en ensamblajes naturales (Heip et al., 1988; Ferraro y Cole, 1990; Ferraro y Cole, 1992; James et al., 1995), sin que exista pérdida de información relevante comparándolo con un nivel de identificación a especie (Warwick, 1988). Además, se presenta una considerable redundancia en el análisis multivariado de datos entre especies y géneros, ya que igual inferencia de información es obtenida a niveles más altos (Gray et al., 1988).
Se emplearon claves taxonómicas generales para el Pacífico centro-oriental de Fischer et al. (1995) y más específicas de acuerdo con el grupo [Anfioxos: Bigelow y Pérez-Farfante (1948); antozoarios: Carlgren y Hedgpeth (1952) y Correa (1964); crustáceos: Manning (1969), Rodríguez (1980) y Calero (1982); moluscos: Keen (1960, 1971), Abbott (1974), Roper et al. (1990) y Cruz y Jiménez (1994); peces: Fisher (1978), Rubio et al. (1987) y Collette et al. (1989); poliquetos: Fauchald (1977), Salazar-Vallejo y León-González (1988) y Amaral y Nonato (1996); y sipuncúlidos: Cutler (1994)]. Para cada uno de los taxones identificados por unidad de muestreo se registró la abundancia y la biomasa como el peso húmedo de los organismos (g), esta última con el fin de evitar el deterioro de las muestras para conservar una colección de referencia y además poder comparar los resultados con estudios en los cuales se emplearon métodos similares. La muestra de sedimentos restante fue secada a temperatura ambiente para retirar el exceso de agua, posteriormente se introdujo en la estufa a 75 ºC hasta obtener peso constante y luego realizar los análisis granulométrico de sedimentos, calcimetría y contenido de materia orgánica (Eleftheriou y Moore, 2005). Se tomaron dos muestras de agua por estación (columna de agua y sobre el sustrato) durante cada uno de los meses de muestreo, con el fin de determinar temperatura y salinidad. La transparencia del agua se midió por medio del disco Secchi.
Análisis de datos
Con los valores de densidad y biomasa por familia y estación estandarizados para todos los meses a 0.071 m2 de área de muestreo, se obtuvieron dos matrices básicas de datos, para un total de 11 meses y 87 muestras recolectadas a lo largo de 1999. El análisis de similaridad Anosim (a dos vías y cruzado) se usó a priori para evaluar si existían diferencias en términos de composición y abundancia de familias entre los cuatro sectores y entre las dos épocas climáticas, aplicándolo independientemente a las estaciones someras (5 m) y a las profundas (15 m) aislando el efecto que el margen de diferencia en la profundidad (10 m aproximadamente) pueda tener sobre la comunidad macrobentónica de la isla y a su vez en los resultados del análisis, ya que la profundidad es uno de los factores determinantes en la distribución de los organismos macrobentónicos asociados a fondos blandos (Guzmán-Alvis y Díaz, 1993, 1996; Guzmán-Alvis y Solano, 1997; Guzmán-Alvis et al., 2001). A partir de la matriz básica de abundancia reducida a solo aquellas familias que alcanzaron o superaron en al menos una de las estaciones el 3% de abundancia respecto al total por estación (102 familias), se originó una matriz de similitud con base en el índice de Bray-Curtis, previa transformación de los datos con raíz cuarta, con el fin de ponderar la contribución de las familias comunes y raras en el análisis comunitario (Clarke y Warwick, 2001). Las familias que contribuyeron a las diferencias entre grupos encontradas por el Anosim fueron evaluadas con Simper (Clarke y Warwick, 2001). Esta técnica permitió ver la contribución de las familias a la disimilitud promedio entre los grupos creados a priori y examinar cuales de estas fueron las causantes de discriminación entre los grupos de estaciones, evaluando el cociente entre la disimilitud promedio y la desviación estándar.
Para definir la comunidad y establecer patrones de distribución espacial y temporal, se emplearon técnicas multivariadas de ordenación y clasificación, estos análisis utilizan la matriz de rangos de similitud obtenida a partir de los datos de densidad (Clarke y Warwick, 2001). La ordenación se realizó por medio de la técnica de escalamiento multidimensional no métrico (NMDS) y el dendrograma de clasificación se generó uniendo los grupos obtenidos con el método de ligamento promedio no ponderado (Field et al., 1982; Clarke y Warwick, 2001). Una vez definidas las asociaciones en las técnicas de clasificación, mediante la metodología descrita por Kaandorp (1986) se buscaron las familias "características", definidas como aquellas que se encontraron confinadas a un grupo en un porcentaje de dominancia por encima del 70% y frecuencia del 70%, y las familias "exclusivas", las cuales presentaron dominancia de 100% en un solo grupo. El resultado final de este análisis presenta las familias responsables de los grupos formados teniendo en cuenta la concentración relativa de la abundancia y frecuencia de cada familia dentro de cada uno de ellos, de acuerdo con el esquema del dendrograma obtenido en el análisis multivariado de clasificación.
Se desarrollaron dos técnicas para examinar el grado de asociación entre la distribución de la comunidad bentónica con las variables determinadas tanto en la columna de agua [salinidad (S), transparencia (Tr) y temperatura (T)], como en los sedimentos [carbonatos totales (CT), materia orgánica (MO) y las fracciones granulométricas (en valores relativos)], y con la precipitación (Pr) tomada de los datos del Ideam durante 1999. La primera técnica es una forma sencilla de relacionar el ordenamiento biológico con cada variable superponiendo en el NMDS original el valor de cada una de las variables. Para ello se utilizaron símbolos cuyo tamaño es proporcional al valor de la variable, obteniendo una distribución de la misma que puede ser fácilmente comparada con el ordenamiento biológico. Este método sólo puede graficar una variable a la vez (Field et al., 1982; Clarke y Warwick, 2001). La segunda técnica fue el Bio-Env (Clarke y Ainsworth, 1993; Clarke y Warwick, 2001). Para su realización, las variables ambientales tenidas en cuenta se sometieron primero a un análisis de correlación de Pearson y a un gráfico de dispersión de puntos (draftsman plot); con el fin de detectar y visualizar las variables correlacionadas entre sí que resultarían redundantes al momento de implementar el análisis del Bio-Env (Clarke y Warwick, 2001). Se identificaron las variables que presentaron correlaciones absolutas entre sí mayores o iguales a 0.95 y un nivel de significancia p < 0.05, incluyendo en el análisis a una variable como representante de la otra en cada caso. Los gránulos (G), arenas muy gruesas (Amg), arenas gruesas (Ag), arenas medias (Am), arenas finas (Af), arenas muy finas (Amf) y cienos (C) presentaron concentración de puntos en un extremo de los gráficos y fueron transformadas con raíz cuarta para dispersarlas y de este modo hallar la normalidad univariada (Clarke y Ainsworth, 1993; Clarke y Warwick, 2001).
El Bio-Env se fundamenta en maximizar la correlación de los elementos de las matrices triangulares de similaridad biótica (Bray-Curtis) y abiótica (distancia euclidiana sobre las variables ambientales normalizadas). El proceso se repite con grupos crecientes de k variables ambientales, dando como resultado una serie de coeficientes de correlación. El coeficiente máximo obtenido de todas las posibles combinaciones de las k variables, indica que esa combinación es la que mejor se asocia con el patrón biológico obtenido en la ordenación y clasificación (Clarke y Ainsworth, 1993; Clarke y Warwick, 2001). Se empleó para este propósito, el coeficiente armónico por rangos de Spearman, debido a las diferentes unidades y modos de construcción de las dos matrices (Clarke y Ainsworth, 1993).
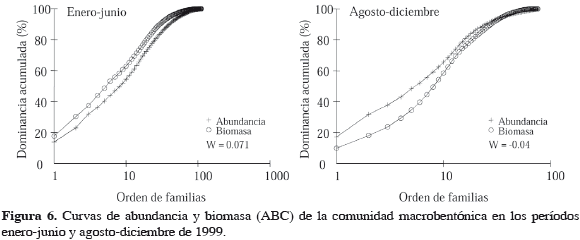
Para evaluar perturbaciones en la comunidad se utilizaron las curvas ABC (comparación entre abundancia-biomasa) (Warwick y Clarke, 1994; Clarke y Warwick, 2001). En condiciones de ausencia de perturbación, la curva de abundancia corre siempre por debajo de la biomasa y en situaciones perturbadas las curvas se invierten; este análisis arroja además un valor estadístico (W) por cada curva, siendo positivo o negativo respectivamente para cada caso.
RESULTADOS
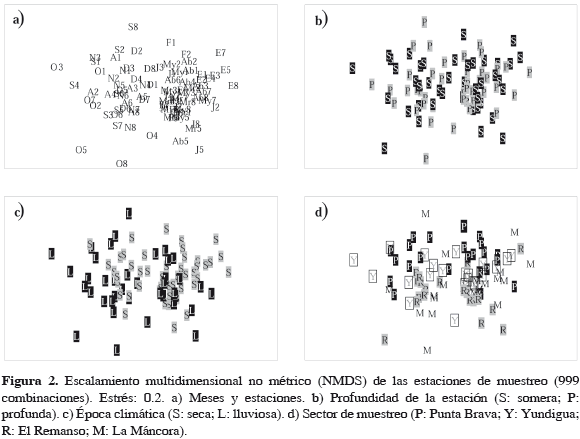
Previo al desarrollo del presente estudio, se retomaron algunos resultados puntuales del trabajo de Solano et al. (2001), los cuales se describen a continuación. En dicho estudio realizaron ordenaciones por medio de la técnica NMDS con el fin de establecer patrones de distribución espacial y temporal en la comunidad en términos de su composición de familias y abundancia de individuos (Figura 2), sin encontrar una distribución clara de las estaciones determinada por la profundidad (somera y profunda), por las épocas climáticas (seca y lluviosa), ni por los sectores de muestreo (Punta Brava, Yundigua, El Remanso y La Máncora). Sin embargo, se observa una leve tendencia de las estaciones a separarse sobre el eje horizontal por período climático (Figura 2c) y sobre el eje vertical por sectores de muestreo, presentándose en la parte superior las estaciones de Punta Brava y Yundigua, y en la inferior las estaciones de El Remanso y La Máncora (Figura 2d).
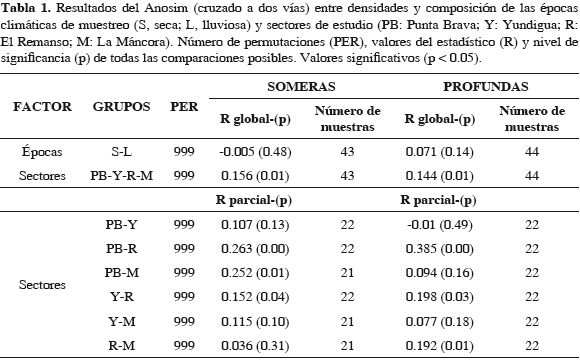
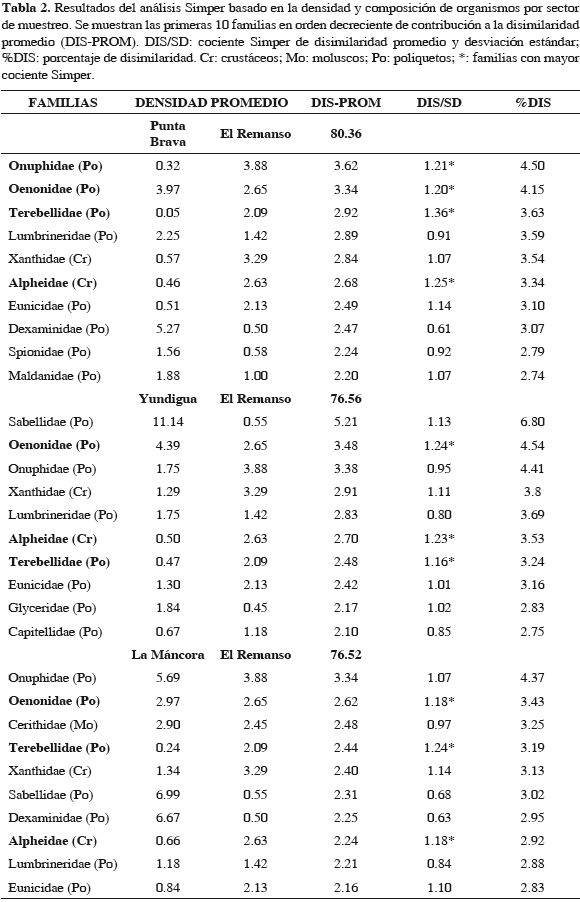
En el trabajo actual, los resultados del Anosim indicaron la ausencia de diferencias significativas en términos de densidad y composición de organismos entre los períodos climáticos de muestreo, pero sí entre sectores, siendo El Remanso significativamente diferente de los otros sectores (Tabla 1), excepto con La Mancora en las estaciones de muestreo someras. El análisis Simper reveló que El Remanso obtuvo el mayor promedio de disimilaridad de familias con Punta Brava (80.4%) lo que se refleja en el mayor valor del estadístico R en el Anosim. En relación a los sectores de Yundigua y La Máncora, el promedio de disimilaridad con El Remanso fue ligeramente inferior (76.6%) (Tabla 2). Las familias Onuphidae, Oenonidae, Terebellidae y Alpheidae fueron las que tuvieron la mayor contribución discriminando El Remanso de los demás sectores debido a que obtuvieron el mayor cociente Simper, exhibiendo mayores promedios de abundancia en El Remanso, excepto Oenonidae que registró promedios inferiores. Si bien el análisis refleja cambios en los valores de abundancia de algunas familias entre los sectores, no se observa una diferenciación ocasionada por cambios en la composición de familias entre estos.
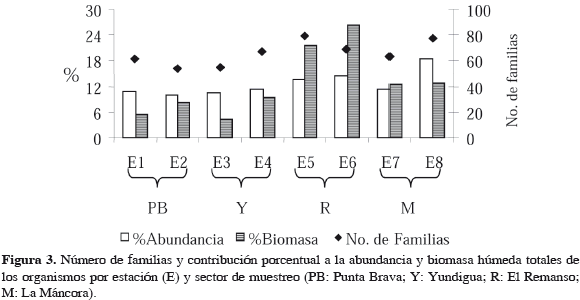
En términos generales, en el área de estudio se recolectó un total de 3927 individuos con una densidad promedio por estación de 491 ± 112 individuos × 0.071 m-2. Estos organismos se repartieron en 132 familias cuyo promedio por estación fue de 66 ± 9 familias * 0.071 m-2 y registraron una biomasa húmeda total de 104 g, siendo el promedio por estación de 13 ± 9 g * 0.071 m-2. El Remanso fue el sector donde se encontraron los mayores valores de estos tres atributos (Figura 3), observándose una concordancia con el comportamiento del tipo de sedimentos, que fue dominado por los gránulos en los cuatro sectores (66.4 ± 21.3%), exhibiendo el mayor contenido de estos en El Remanso (82.3 ± 12.7%), seguido por Yundigua y La Máncora con valores similares entre sí (66.7 ± 22.6 y 66.0 ± 21.9%) y con el menor registro en Punta Brava (50.6 ± 14.4 %).
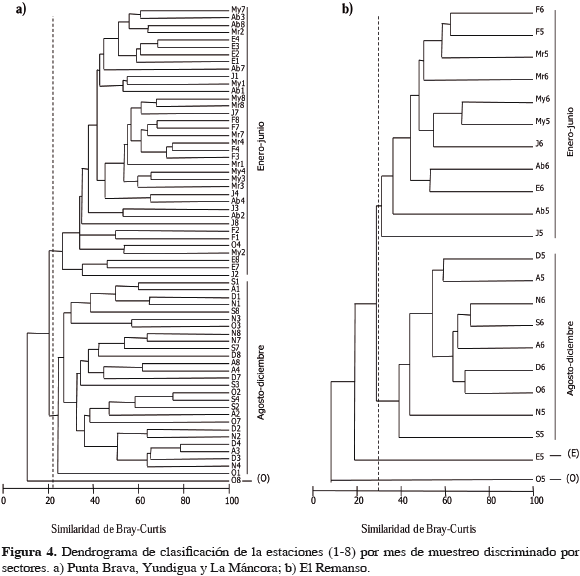
Con base en las diferencias significativas encontradas en términos de composición y densidad de organismos entre sectores, se realizaron los análisis de clasificación de forma independiente para el conjunto de sectores Punta Brava, Yundigua, La Máncora (Figura 4a) y para El Remanso (Figura 4b). En ambos casos la técnica separó las estaciones en dos grupos principales que correspondieron a los muestreos realizados en enero-junio y en agosto-diciembre, resultado que había sido señalado por Solano et al. (2001). Además, se encontraron algunos grupos menores que corresponden a tres estaciones aisladas con variaciones en composición y abundancia de individuos para los meses de enero (E) y octubre (O) (Figura 4).
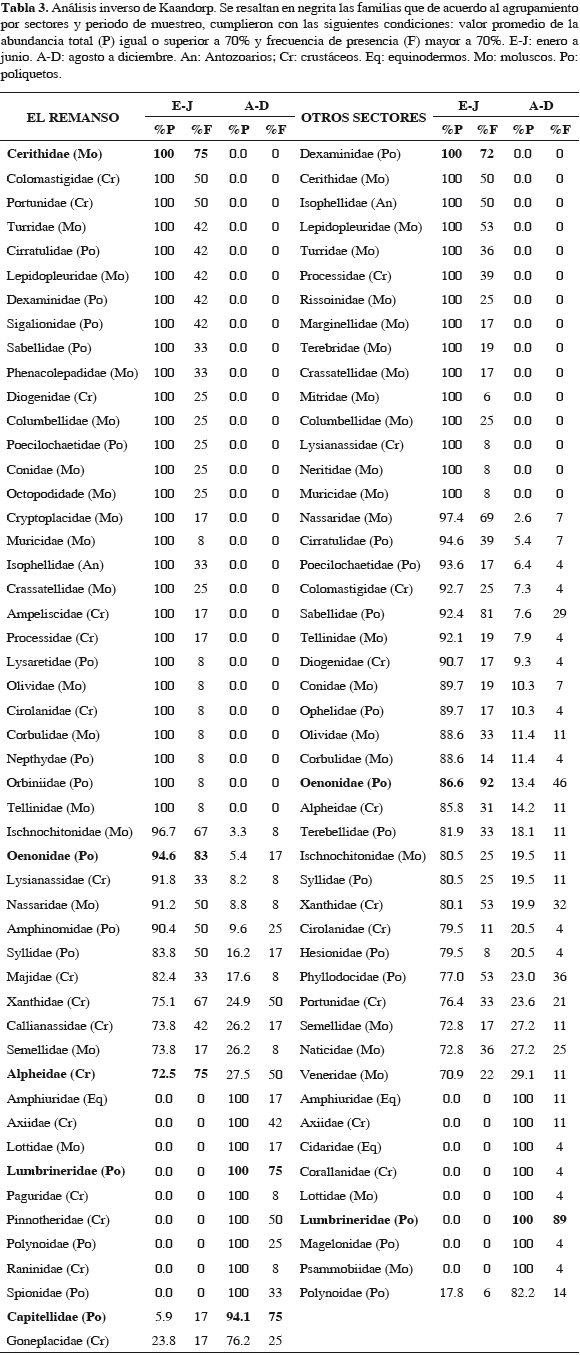
Con el objetivo de examinar cuáles familias fueron las responsables en la separación de las muestras entre los dos períodos de muestreo, grupos principales de la Figura 4, se combinaron los resultados de la clasificación y el análisis inverso de Kaandorp (Tabla 3). En El Remanso, durante el período enero-junio, se presentaron 28 familias exclusivas (13 pertenecen a los moluscos), lo que indica que en el siguiente período de muestreo, agosto-diciembre, dichas familias no se encontraron en ninguna estación; además los valores de abundancia se concentraron en la primera asociación, presentando como familias "características" a Cerithidae, Oenonidae y Alpheidae. En el período agosto-diciembre solo se registraron nueve familias exclusivas con Lumbrineridae y Capitellidae como "características". Igual comportamiento se observó en el análisis desarrollado para los otros sectores de muestreo, donde se determinaron 16 familias exclusivas (11 son moluscos) y mayores abundancias en el primer semestre del año, donde las familias Dexaminidae y Oenonidae son "características". En el segundo período se presentaron ocho familias exclusivas con Lumbrineridae como "característica" (Tabla 3).
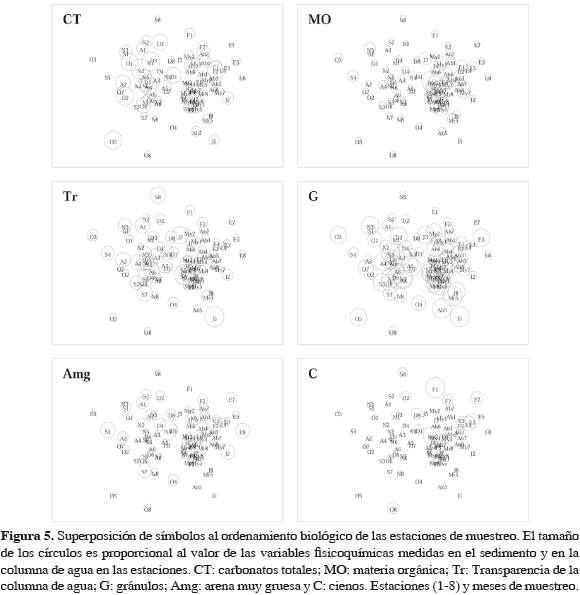
Al superponer las variables ambientales en la ordenación de las estaciones, se observa que tal como ocurrió con los valores de densidad y composición de organismos, durante el período enero-junio (E-J) se presentó una tendencia de mayores contenidos de materia orgánica (E-J: 8.6 ± 3.0%; A-D: 5.9 ± 1.6%) y cienos (E-J: 0.2 ± 0.3%; A-D: 0.1 ± 0.2%), mientras que el período agosto-diciembre (A-D) exhibió mayores contenidos de carbonatos totales en sedimentos (E-J: 34.0 ± 20.0%; A-D: 45.1 ± 29.3%) y transparencia en la columna de agua (E-J: 7.3 ± 3.4 m; A-D: 9.8 ± 3.2 m) (Figura 5). Así mismo, las estaciones de El Remanso en relación con los demás sectores mostraron los menores contenidos de arena muy gruesa (5.9 ± 4.5% frente a 10.3 ± 6.6%) y los mayores de gránulos (82.3 ± 12.7% frente a 61.0 ± 21.0%) (Figura 5). Los resultados del Bio-Env indicaron que la combinación de gránulos y cienos fue el grupo de variables mejor correlacionado con el componente biológico encontrado (rρ = 0.327; p = 0.01) y por lo tanto, las que probablemente tuvieron una mayor influencia en su distribución espacio-temporal (Tabla 4).
Las aguas costeras y las comunidades macrobentónicas de fondos blandos están sujetas a cambios fisicoquímicos, los cuales varían espacio-temporalmente en frecuencia e intensidad, y por lo tanto, la estructura (composición, abundancia y biomasa) de estas comunidades y su estabilidad puede cambiar en respuesta a perturbaciones ambientales (Turner et al., 1995). La Figura 6 muestra las curvas ABC para el periodo enero-junio y agosto-diciembre, revelando una fuerte perturbación en la comunidad establecida en el segundo semestre de 1999 ya que la curva de abundancia se desarrolla por encima de la de biomasa.
DISCUSIÓN
En términos generales, los resultados arrojaron que los gránulos y los cienos en los sedimentos fueron las variables que en conjunto mostraron la mejor correlación con la distribución espacio-temporal de la fauna macrobentónica establecida en las estaciones de muestreo (Tabla 4). La primera de estas características físicas del sustrato (gránulos) se encontró relacionada con una diferenciación espacial observada en términos de la composición y densidad de organismos, y la segunda (cienos) con una variación de estos mismos atributos comunitarios entre el primero y segundo semestre de 1999.
Una posible explicación de la asociación entre los gránulos y las diferencias en la comunidad macrobentónica entre los sectores, radica en que los sustratos gruesos, que predominaron en El Remanso, generalmente sostienen ensamblajes más diversos que los que están conformados por fangos y arenas finas, como consecuencia de la heterogeneidad y complejidad del sustrato, estos sedimentos además presentan un mayor espacio entre los granos de arena, pueden contener una mayor cantidad de agua rica en microorganismos, y conferir una mayor oferta alimentaria para la fauna bentónica en relación con sedimentos finos (Méndez et al., 1986). Por lo tanto, los organismos establecidos en los sedimentos de El Remanso posiblemente no son una comunidad distinta de la encontrada en los demás sectores de muestreo, sino parte de la misma comunidad que se manifestó significativamente con el mayor número de familias y densidad de individuos, ocupando un sector donde las condiciones del sustrato fueron más propicias para su desarrollo por la heterogeneidad de hábitat y posible oferta alimentaria (Calnan y Littelton, 1989; Fernández et al., 2003).
Según Snelgrove y Butman (1994), además del tipo de sedimento, la materia orgánica, que estuvo incluida dentro de los 10 coeficientes de correlación más altos para el estudio, puede ser un factor condicionante para el desarrollo de una comunidad por ser una fuente dominante de alimento para los organismos que viven en el fondo; esta se encuentra íntimamente relacionada con los cienos, presentándose grandes cantidades donde los sedimentos son más finos (De la Lanza, 1986). En dicho contexto, y en términos de la variación de los atributos comunitarios entre el primero y segundo semestre de 1999, se observó que, a pesar del predominio en el área de estudio de los contenidos de gránulos respecto a las demás fracciones granulométricas a lo largo de todo el muestreo, los escasos contenidos de cienos y la materia orgánica disminuyeron en el período agosto-diciembre (Figura 5), cambiando el entorno físico y la oferta alimentaria que estos proporcionan, reflejándose en la reducción de la biomasa húmeda (E-J: 1.4152 ± 0.98 g * 0.071 m-2; A-D: 0.9288 ± 0.96 g * 0.071 m-2), en el cambio de composición de familias y en la menor densidad de los organismos en este mismo período, cuando no se registró un gran número de familias, principalmente de moluscos, respecto a enero-junio (Tabla 3 y Tabla 5).
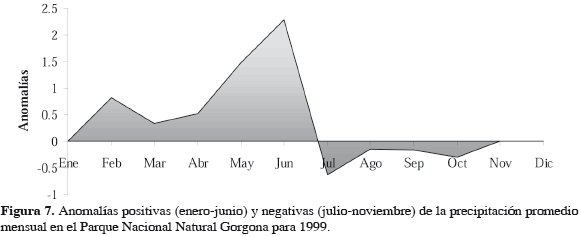
Este cambio temporal en la comunidad se desvía uno o dos meses del patrón climático definido para la isla, con una estación seca (menores precipitaciones) que va de noviembre a abril y una lluviosa de mayo a octubre. Esto podría indicar, según Solano et al. (2001), que hay un ligero desfase en el patrón climático y la respuesta de las comunidades asociadas a fondos blandos, evento que ha sido documentado por Guzmán-Alvis y Solano (2001) y Guzmán-Alvis y Carrasco (2005) en al menos dos regiones del Caribe colombiano. La influencia de la precipitación, que en últimas es una medida indirecta de la escorrentía, ha sido identificada como una de las principales variables reguladoras de la estructura de estas comunidades en zonas costeras, ya que refleja la mayor o menor entrada de material orgánico particulado y disuelto al mar (Guzmán-Alvis y Solano, 2001; Guzmán-Alvis y Carrasco, 2005). Según Alongi (1990), como consecuencia de que la variación climática en los mares tropicales es muy pequeña, la distribución de las comunidades bentónicas someras tropicales se encuentra regulada por las lluvias. Quizás ese desvío en la respuesta de la comunidad que se observa en la Figura 4 y en la Tabla 3 con respecto al patrón climático ya establecido, sea el resultado de la alta pluviosidad de mayo a junio de 1999 (Figura 7), que ha sido una de las mayores en los últimos años.
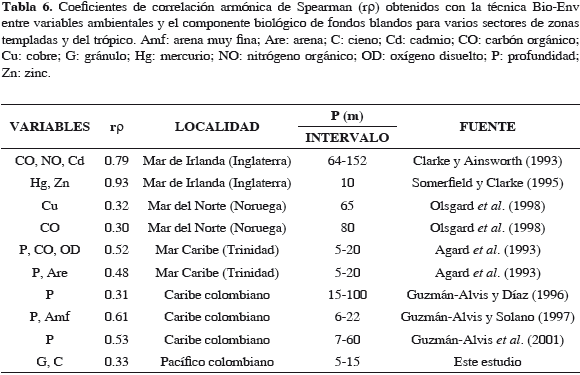
Los patrones espaciales y temporales de las especies del bentos de fondos blandos en todas las latitudes están determinados por la producción primaria de la columna del agua, el tipo de sedimento, las condiciones fisicoquímicas asociadas y sus relaciones biológicas. Las variaciones sedimentarias en particular, se encuentran íntimamente ligadas a la disponibilidad del alimento determinando así la morfología, hábitos alimentarios, patrones de dominancia, interacciones de las especies y por lo tanto la distribución de los organismos (Alongi, 1990). Para el área de estudio, fueron algunas fracciones granulométricas del sedimento las mejor asociadas con el componente biológico; sin embargo, su poder explicativo es bajo si se compara con los resultados obtenidos en otras áreas de zonas templadas contaminadas y cercano a los registrados en otros estudios del trópico y para zonas templadas prístinas (Noruega) (Tabla 6). Olsgard et al. (1998) encontraron para zonas templadas correlaciones bajas en áreas no contaminadas, sugiriendo que las interacciones biológicas son más importantes en la estructuración de la comunidad que las variaciones en los factores ambientales. No obstante, en fondos no contaminados, las comunidades bentónicas establecidas en sedimentos más homogéneos, como es el caso del área de estudio, presentaron correlaciones más bajas que las establecidas en diferentes tipos de sedimentos (Guzmán-Alvis y Díaz, 1996; Guzmán-Alvis y Solano, 1997; Guzmán-Alvis et al., 2001).
Solano et al. (2001) registraron que la combinación de los contenidos de carbonatos totales y materia orgánica en los sedimentos y la transparencia del agua son las variables mejor correlacionadas con la comunidad biológica, con un coeficiente de correlación de 0.499. Esta diferencia con el resultado actual se debe a que en dicho estudio no se exploraron las posibles diferencias entre El Remanso y los demás sectores en densidad y riqueza de familias, lo que conllevó a un tratamiento de datos diferente (promedio por mes entre todos los sectores de muestreo); además, no incluyeron todas las fracciones granulométricas del sedimento como variables a correlacionar con el componente biológico, debido a que los gránulos fueron el tipo de sedimento predominante. No obstante, y a pesar de ser dominantes en el sedimento, los gránulos variaron entre sectores y en el tiempo, como también las demás fracciones granulométricas, pudiendo afectar a la comunidad macrobentónica, por lo que fueron incluidas en el presente estudio.
Otra expresión de la variación temporal en la comunidad macrobentónica consistió en el cambio a condiciones perturbadas para el período agosto-diciembre de 1999, evento que ayuda a explicar el cambio en la composición de familias entre el primero y segundo semestre de ese año. Los organismos oportunistas se caracterizan por presentar cortos ciclo de vida, tamaño de población variable y dominancia numérica; en tanto que los organismos conservativos, que presentan como atributos grandes tamaños corporales, largos ciclos de vida y tamaño de población constante, son raramente dominantes en abundancia pero tienden a dominar en biomasa. Cuando una comunidad es perturbada se presenta un cambio de phyla, apareciendo especies indicadoras, especialmente pertenecientes al grupo de los poliquetos, que reflejan el cambio de animales con cuerpos grandes por organismos de cuerpos pequeños (Clarke y Warwick, 2001), tal como se registró en el presente estudio donde la riqueza y abundancia de moluscos se redujo durante el período agosto-diciembre y aparecieron como representativos (característicos) de este período los poliquetos de la familia Lumbrineridae y organismos oportunistas de Capitellidae. Por lo tanto, las variaciones temporales en los factores ambientales mencionados anteriormente, sin descartar las ocurridas en los contenidos de carbonatos totales en el sedimento, en la transparencia del agua y en otras características fisicoquímicas del agua y del sedimento no analizadas en este trabajo, como contenidos de nitrógeno y fósforo orgánicos, oxígeno disuelto y las mismas interacciones biológicas, como depredación y competencia por alimento, entre otras, fueron las posibles causas de los cambios en la comunidad y el origen de la perturbación en detrimento de la densidad y biomasa de los organismo, alterando el equilibrio entre éstos.
CONCLUSIÓN
La diversidad biológica en el bentos de fondos blandos puede ser afectada por la relación organismo-sedimento respecto a la estabilidad del fondo marino, tipos de sustrato y diversidad de las partículas alimentarias. Esto hace que el tipo de sedimento sea un parámetro de máximo efecto sobre los organismos, ya sea por el tamaño de grano en sí o por la cantidad de agua y materia orgánica retenida en los espacios intersticiales de éstos. En dicho contexto, en El Remanso aparecieron los mayores porcentajes de gránulos en el sedimento respecto a los otros sectores de la isla, y registró las mayoras abundancias, biomasas y riqueza de familias del muestreo. Así mismo, en el área del PNN Gorgona se encontró una variación en la composición, riqueza y abundancia de organismos entre el primero y segundo semestre de 1999, relacionado con cambios en los contenidos de cienos y a su vez de materia orgánica como fuente de alimento, que pueden ser respuestas tardías a cambios en factores climáticos tan importantes como la precipitación, que pueden incluso en conjunto con otras variables ambientales, causar perturbación a la comunidad como la observada en el área de muestreo para el período agosto-diciembre de 1999.
AGRADECIMIENTOS
A la Unidad Administrativa Especial del Sistema de Parques Naturales, en especial a la directora del PNN Gorgona en 1999, Claudia Acevedo y a su personal en la isla. A Jorge Pinzón y Adriana Perdomo por su ayuda en los muestreos y en general durante nuestra permanencia en el PNN Gorgona. A Juan Manuel Díaz, Néstor Campos, Juan Laverde, Arturo Acero y Ángela Guzmán, por la confirmación de las familias identificadas. A todo el personal que apoyó el muestreo en la isla y los trabajos en el Invemar, y a la Universidad de Bogotá Jorge Tadeo Lozano en Santa Marta.
BIBLIOGRAFÍA
1 Abbot, R. 1974. American seashells. Segunda edición, Van Nostrand Reinhold Company. New Jersey, EE. UU. 663 p. [ Links ]
2 Agard, J. B., J. Gobin y R. M. Warwick. 1993. Analysis of marine macrobenthic community structure in relation to pollution, natural oil seepage and seasonal disturbance in a tropical environmental (Trinidad, West Indies). Mar. Ecol. Prog. Ser., 92: 233-243. [ Links ]
3 Alongi, D. M. 1990. The ecology of tropical soft-bottom benthic ecosystems. Oceanogr. Mar. Biol. An. Rev., 28: 381-496. [ Links ]
4 Amaral, A. y E. Nonato. 1996. Annelida Polychaeta: Caracteristicas, glossário e chaves para familias e generos de costa brasileira. Editora da Unicamp. Sao Paulo, Brasil. 124 p. [ Links ]
5 Bigelow, H. B. e I. Pérez-Farfante. 1948. Fishes of the western north Atlantic: Lancelets. Sears Found. Mar. Res. Mem., 1 (1): 1-28. [ Links ]
6 Calero, L. 1982. Anfípodos bentónicos de la bahía de Cartagena (Caprellidea y Gammaridea). Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 79 p. [ Links ]
7 Calnan, T. y T. Littelton. 1989. Correlation of live mollusks with sediment and bathymetry on the Texas inner shelf. The Veliger, 32 (2): 130-146. [ Links ]
8 Cantera, J. y R. Neira. 1988. Notas taxonómicas y ecológicas de los equinodermos de la bahía de Málaga (costa pacífica colombiana). 121-130. En: Comisión Colombiana de Oceanografía y Universidad de Bogotá Jorge Tadeo Lozano (Eds.). VI Seminario Nacional de Ciencias y Tecnologías del Mar. Gran Premio Ltda. Editorial, Bogotá. 619 p. [ Links ]
9 Cantera, J., E. Rubio, F. Borrero, R. Contreras, F. Zapata y E. Buttkus. 1979. Taxonomía y distribución de los moluscos litorales de la isla Gorgona. 141-167. En: Prahl, H.v., F. Guhl y M. Grögl (Eds.). Gorgona. Universidad de los Andes, Futura Grupo Editorial, Bogotá. 279 p. [ Links ]
10 Cantera, J., R. Neira y R. Pardo. 1988. Taxonomía y ecología de equinodermos litorales del Pacífico colombiano. 115-120. En: Comisión Colombiana de Oceanografía y Universidad de Bogotá Jorge Tadeo Lozano (Eds.). VI Seminario Nacional de Ciencias y Tecnologías del Mar. Gran Premio Ltda. Editorial, Bogotá. 619 p. [ Links ]
11 Carlgren, O. y J. Hedgpeth. 1952. Actiniaria, Zoantharia and Ceriantharia from shallow water in the northwestern Gulf of Mexico. Publ. Inst. Mar. Sci., 2: 141-142. [ Links ]
12 Clarke, K. R. y M. Ainsworth. 1993. A method of linking multivariate community structure to environmental variables. Mar. Ecol. Prog. Ser., 92: 205-219. [ Links ]
13 Clarke, K. R. y R. M. Warwick. 2001. Change in marine communities: An approach to statistical analysis and interpretation. Segunda edición, Primer-E, Plymouth, Reino Unido. 164 p. [ Links ]
14 Collette, B., D. Cohen, W. Eschmeyer, R. Gibbs, W. Hartman, T. Pietsch, W. Richards y K. Thomson. 1989. Fishes of the western North Atlantic: Anguilliformes and Saccopharyngiformes, Leptocephali. Sears Found. Mar. Res. Mem., Tomo 1 Vol. 9. New Haven, EE. UU. 1017 p. [ Links ]
15 Correa, D. 1964. Corallimorpharia e acttiniaria do Atlántico oeste tropical. Tesis para Profesor catedrático de zoología. Univ. Sao Paulo, Sao Paulo. 139 p. [ Links ]
16 Cosel, R.v. 1984. Moluscos de la isla Gorgona (costa del Pacífico colombiano). An. Inst. Invest. Mar. Cost., 14: 175-257. [ Links ]
17 Cruz-Soto, R. y R. Jiménez. 1994. Moluscos asociados a las áreas de manglar de la costa pacífica de América Central. Guía. Editorial Fundación UNA, Heredia, Costa Rica. 182 p. [ Links ]
18 Cutler, E. B. 1994. The Sipuncula: their systematics, biology and evolution. Cornell University Press. Nueva York, EE. UU. 453 p. [ Links ]
19 De la Lanza, G. 1986. Materia orgánica de los sedimentos del sistema lagunar Huizache y Caimanero. Importancia y significancia en modelos de predicción. An. Inst. Cienc. Mar Limnol., 13 (1): 251-286. [ Links ]
20 Dexter, D. M. 1974. Sandy beach fauna of the Pacific and Atlantic coasts of Costa Rica and Colombia. Rev. Biol. Trop., 22 (1): 51-66. [ Links ]
21 Díaz, J. M., J. H. Pinzón, A. M. Perdomo, L. M. Barrios, M. López-Victoria. 2001. Generalidades. 17-26. En: Barrios, L. M. y M. López-Victoria (Eds.). Gorgona marina. Contribución al conocimiento de una isla única. Instituto de Investigaciones Marinas y Costeras (Invemar), Serie Publ. Espec. 7, Santa Marta. [ Links ] 160 p.
22 Eleftheriou, A. y D. C. Moore. 2005. Macrofauna techniques. 160-209. En: Eleftheriou, A. y A. McIntyre (Eds.). Methods for the study of marine benthos. Tercera edición, Blackwelll Science Ltd., Oxford. 418 p. [ Links ]
23 Fauchald, K. 1977. The polychaete worms: Definitions and keys to the orders, families and genera. Natural History Museum of the Angeles country, Science Series 28, Los Ángeles, EE. UU. 188 p. [ Links ]
24 Fernández, M., A. Roux, E. Fernández, J. Caló, A. Marcos y H. Aldacur. 2003. Grain-size analysis of superficial sediments from golfo San Jorge, Argentina. J. Mar. Biol. Assoc. UK, 83: 1193-1197. [ Links ]
25 Ferraro, S. y F. Cole. 1990. Taxonomic level and sample size sufficient for assessing pollution impacts on the Southern California Bight macrobenthos. Mar. Ecol. Prog. Ser., 67: 251-262. [ Links ]
26 Ferraro, S. y F. Cole. 1992. Taxonomic level sufficient for assessing a moderate impact on macrobenthic communities in Puget Sound, Washington. Can. J. Fish. Aquat. Sci., 49: 1184-1188. [ Links ]
27 Field, J., K. Clark y R. M. Warwick. 1982. A practical strategy for analysing multispecies distribution pattern. Mar. Ecol. Prog. Ser., 8: 37-52. [ Links ]
28 Fischer, W. (Ed.) 1978. FAO species identification sheets for fishery purposes, Western Central Atlantic fishing area 31. Vol. 1, FAO, Roma. 286 p. [ Links ]
29 Fischer, W., F. Krupp, W. Schneider, C. Sommer, K. Carpenter y V. Niem. 1995. Guía FAO para la identificación de especies para los fines de pesca. Pacífico centro-oriental. Volúmenes I, II y III, FAO, Roma. 1813 p. [ Links ]
30 Gray, J., M. Aschan, M. Carr, R. Clarke, R. Green, T. Pearson, R. Rosenberg y R. Warwick. 1988. Analysis of community attributes of the benthic macrofauna of Frierfjord/Langesundfjord and in a mesocosm experiment. Mar. Ecol. Prog. Ser., 46: 151-165. [ Links ]
31 Guzmán-Alvis, A. I. y F. Carrasco. 2005. Influence of a tropical lagoon discharge and depth on the structure of adjacent shelf macroinfauna (Southerm Caribbean). Cah. Biol. Mar., 46: 81-93. [ Links ]
32 Guzmán-Alvis, A. I. y J. M. Díaz. 1993. Distribución espacial de la taxocenosis Annelida-Mollusca en la plataforma continental del golfo de Salamanca, Caribe colombiano. An. Inst. Invest. Mar. Cost., 22: 45-59. [ Links ]
33 Guzmán-Alvis, A. I. y J. M. Díaz. 1996. Soft-bottom macrobenthic assemblages off Santa Marta, Caribbean coast of Colombia. Carib. J. Sci., 32: 176-186. [ Links ]
34 Guzmán-Alvis, A. I. y O. D. Solano. 1997. Estructura de la taxocenosis Annelida-Mollusca en la región de Mingueo, La Guajira (Caribe colombiano). Bol. Invest. Mar. Cost., 26: 35-52. [ Links ]
35 Guzmán-Alvis, A. I. y O. D. Solano. 2001. Cambios temporales en la estructura comunitaria de la macroinfauna y su relación con la precipitación (Caribe colombiano). 493. En: Santos, A. (Ed.). Resúmenes IX Congreso Latinoamericano sobre Ciencias del Mar. Instituto de Estudios Caribeños, Universidad Nacional de Colombia, Editorial Unibiblos, San Andrés Isla, Colombia. 535 p. [ Links ]
36 Guzmán-Alvis, A. I. y O. D. Solano. 2002. Estado de los fondos blandos de la plataforma continental. 71-75. En: Ospina-Salazar, G. y A. Acero P. (Eds.). Informe del estado de los ambientes marinos y costeros en Colombia: año 2001. Instituto de Investigaciones Marinas y Costeras (Invemar), Serie de publicaciones periódicas No. 8, Medellín. 178 p. [ Links ]
37 Guzmán-Alvis, A., O. D. Solano, M. Córdoba-Tejada y A. López-Rodríguez. 2001. Comunidad macroinfaunal de fondos blandos someros tropicales (Caribe colombiano). Bol. Invest. Mar. Cost., 30: 39-66. [ Links ]
38 Heip, C., R. Warwick, M. Carr, P. Herman, R. Huys, N. Smol y K. Holsbeke. 1988. Analysis of community attributes of the benthic maiofauna of Frierfjord/Langesundfjord. Mar. Ecol. Prog. Ser., 46: 171-180. [ Links ]
39 Ideam. 2000. Pronóstico de pleamares y bajamares en la costa pacífica colombiana para el año 2000. Instituto de Asuntos Ambientales, Bogotá [ Links ].
40 James, R., M. Lincoln y P. Fairweather. 1995. Sieve mesh-size and taxonomic resolution needed to describe natural spatial variation of marine macrofauna. Mar. Ecol. Prog. Ser., 118: 187-198. [ Links ]
41 Kaandorp, J. 1986. Rocky substrate communities of the infralitoral fringe of the Boulonnais coast, NW France: a quantitative survey. Mar. Biol., 92: 255-265. [ Links ]
42 Keen, M. 1960. Sea shells of tropical west America. Stanford University Press, Stanford, EE. UU. 1065 p. [ Links ]
43 Keen, M. 1971. Sea shells of tropical west America. Stanford University Press, segunda edición, Stanford, EE. UU. 1064 p. [ Links ]
44 Laverde-Castillo, J. 1986. Lista anotada de los poliquetos (Annelida) registrados para el Pacífico colombiano, con notas preliminares sobre su zoogeografía. Actual. Biol., 15 (58): 123-132. [ Links ]
45 Lemaitre, R. y R. Álvarez-León. 1992. Crustáceos decápodos del Pacífico colombiano: lista de especies y consideraciones zoogeográficas. An. Inst. Invest. Mar. Punta Betín, 21: 33-76. [ Links ]
46 Manning, R. 1969. Stomatopod crustacea of the western Atlantic. Stud. Trop. Oceanogr., 8: 1-380. [ Links ]
47 Méndez, M. N., V. Solis-Weiss y A. Carranza-Edwards. 1986. La importancia de la granulometría en la distribución de organismos bentónicos. Estudio de playas del estado de Veracruz, México. An. Inst. Cienc. Mar Limnol., 13 (3): 45-56. [ Links ]
48 Murillo, C. 1988. Estomatópodos de la costa pacífica de Colombia e isla Gorgona (Crustacea: Stomatopoda: Squillidae, Gonodactylidae y Pseudosquillidae). An. Inst. Inv. Mar. Punta Betín, 18: 95-112. [ Links ]
49 Olsgard, F., P. Somerfield y M. Carr. 1998. Relationships between taxonomic resolution, macrobenthic community pattern and disturbance. Mar. Ecol. Prog. Ser., 172: 25-36. [ Links ]
50 Pohle, G. y M. Thomas. 2001. Marine biodiversity monitoring. Monitoring protocol for marine benthos: intertidal and subtidal macrofauna. A report by the marine biodiversity monitoring committee (Atlantic Maritime Ecological Science Cooperative, Huntsman Marine Science Center) to the ecological monitoring and assessment network of environment data. Huntsman Marine Science Center, New Brunswick, Canadá. 28 p. [ Links ]
51 Prahl, H. v. 1986. Notas sobre la zoogeografía de corales, crustáceos, moluscos y peces. 89-125. En: Prahl, H. v. y M. Alberico (Eds.). Isla Gorgona. Universidad del Valle, Editorial Banco Popular, Bogotá. 244 p. [ Links ]
52 Prahl, H. v., F. Guhl y M. Grögl. 1978. Carídeos (Decápodos, Natantia, Palaemonidae) de Gorgona. Cespedesia, 8 (25-26): 49-65. [ Links ]
53 Prahl, H. v., F. Guhl y M. Grögl. 1979a. Crustáceos decápodos y su distribución en Gorgona. 41-81. En: Prahl, H. v., F. Guhl y M. Grögl (Eds.). Gorgona. Universidad de Los Andes, Futura Grupo Editorial, Bogotá. 279 p. [ Links ]
54 Prahl, H. v., F. Guhl y M. Grögl. 1979b. Poliquetos de Gorgona. 131-140. En: Prahl, H. v., F. Guhl y M. Grögl (Eds.). Gorgona. Universidad de los Andes, Futura Grupo Editorial, Bogotá. 279 p. [ Links ]
55 Rodríguez, G. 1980. Crustáceos decápodos de Venezuela. IVIC, Caracas. 444 p. [ Links ]
56 Roper, C. F., M. Sweeney y C. Naven. 1990. Cephalopods of the world. FAO Spec. Cat., FAO Fish. Synop., 3 (125), 277 p. [ Links ]
57 Rubio, E., B. Gutiérrez y R. Franke. 1987. Peces de la isla Gorgona. Centro de Publicaciones de la Facultad de Ciencias del Valle, Cali. 315 p. [ Links ]
58 Ruiz-López, J. A. 2001. Caracterización de la macroinfauna bentónica asociada a fondos blandos del Parque Nacional Natural Gorgona (Pacífico colombiano) y su variación espacio-temporal entre enero y junio de 1999. Trabajo de grado, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 126 p. [ Links ]
59 Salazar-Vallejo, S. y J. León-González. 1988. Poliquetos (Annelida: Polichaeta) de México. Univ. Autónoma de Baja California-Sur, Libros Universitarios, La Paz, México. 212 p. [ Links ]
60 Snelgrove, P. y C. Butman. 1994. Animal-sediment relationships revisited: cause versus effect. Oceanogr. Mar. Biol. Annu. Rev., 32: 111-177. [ Links ]
61 Solano, O. D., F. Cortés y J. Ruiz-López. 2001. Ambientes marinos y comunidades de fondos blandos. Capítulo 5. 65-77. En: Barrios, L. M. y M. López-Victoria (Eds.). Gorgona marina: Contribuciones al conocimiento de una isla única. Instituto de Investigaciones Marinas y Costeras (Invemar), Serie de publicaciones especiales No. 7, Santa Marta. 160 p. [ Links ]
62 Somerfield, P. J. y K. R. Clarke. 1995. Taxonomic levels, in marine communities studies, revisited. Mar. Ecol. Prog. Ser., 127: 113-119. [ Links ]
63 Turner, S., S. Thrush, R. Pridmore, J. Hewitt, V. Cummings y M. Maskery. 1995. Are soft-sediment communities stable? An example from a windy harbour. Mar. Ecol. Prog. Ser., 120: 219-230. [ Links ]
64 Warwick, R. M. 1988. The level of taxonomic discrimination required to detect pollution effects on marine benthic communities. Mar. Poll. Bull., 19 (6): 259-268. [ Links ]
65 Warwick, R. M. y K. R. Clarke. 1994. Relearning the ABC: taxonomic changes and abundance/biomass relationships in disturbed benthic communities. Mar. Biol., 118: 739-744. [ Links ]
66 Wyrtki, K. 1973. Teleconnections in the Equatorial Pacific Ocean. Science, 180: 66-68. [ Links ]
FECHA DE RECEPCIÓN: 29/09/2009 FECHA DE ACEPTACIÓN: 15/08/2012
*Contribución No. 1110 del Instituto de Investigaciones Marinas y Costeras -Invemar-.