Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.2 Santa Marta July/Dec. 2012
AGREGACIÓN REPRODUCTIVA DEL CAMARÓN DE AGUAS PROFUNDAS SOLENOCERA AGASSIZI (CRUSTACEA: DECAPODA) EN EL PACÍFICO COLOMBIANO*
REPRODUCTIVE AGGREGATION OF DEEP WATER SHRIMP SOLENOCERA AGASSIZI (CRUSTACEA: DECAPODA) IN THE COLOMBIAN PACIFIC
Alfredo Rodríguez1,2, Mario Rueda2 y Luis A. Cubillos1
1 Universidad de Concepción, Facultad de Ciencias Naturales y Oceanográficas, Departamento de Oceanografía, Programa Magíster en Ciencias con Mención Pesquerías. Casilla 160-C, Cabina 10. Concepción, Chile. arodriguezj@udec.cl, lucubillos@udec.cl.
2 Instituto de Investigaciones Marinas y Costeras -Invemar-. Cerro Punta Betín, Santa Marta, Colombia. Apartado aéreo 1016. alfredo.rodriguez@invemar.org.co, mario.rueda@invemar.org.co.
RESUMEN
En Colombia, Solenocera agassizi es una de las especies que sustenta la pesquería del camarón de aguas profundas (CAP) que opera en el Pacífico, constituyéndose en una de las más relevantes para la economía nacional. El conocimiento de los aspectos reproductivos es fundamental para la conservación del recurso y en particular la distribución de las agregaciones reproductivas es desconocida. Con el objeto de determinar la estructura espacial de S. agassizi y su relación con las condiciones ambientales durante la época de desove, se realizó un crucero de prospección entre enero y febrero de 2009 en el Pacífico colombiano (6°59'N, 1°33'S). La estructura espacial fue analizada usando técnicas geostadísticas y la relación con el ambiente a través de modelos aditivos generalizados. Solenocera agassizi presentó una agregación reproductiva localizada cerca a Bahía Solano y Juradó en el norte del área de estudio. Este patrón espacial se asoció principalmente con aguas frías (< 13 °C) y con una alta productividad fitoplanctónica derivada de la surgencia que ocurre en el golfo de Panamá al inicio del año. Las condiciones oceanográficas presentes en la zona norte del Pacífico colombiano modulan la estrategia reproductiva de S. agassizi, principalmente por la disponibilidad de alimento para larvas y postlarvas. Además, porque el borde costero tiene áreas de manglar que ofrecen refugio y alimento para los estadios juveniles, lo cual es clave para la sobrevivencia y el éxito del reclutamiento. Se sugieren medidas de manejo para este recurso, basadas en vedas espacio-temporales para la protección del stock desovante.
PALABRAS CLAVE: Agregación reproductiva, camarón de aguas profundas, ambiente, Pacífico colombiano.
ABSTRACT
In Colombia, Solenocera agassizi is a species that supports the Deep Water Shrimp (DWS) fishery operating in the Pacific, and is one of the most relevant for the national economy. Knowledge of reproductive aspects is essential for resource conservation, and to date little information has been published concerning the distribution of the spawning aggregations. To determine the spatial structure of S. agassizi and its relationship with environmental conditions during the spawning season, a survey was conducted from January to February 2009 in the Colombian Pacific (6°59'N, 1°33'S). The spatial structure was analized using geostatistical techniques and the relationship with the environment through generalized additive models. Solenocera agassizi showed a reproductive aggregation near Bahía Solano and Juradó in the northern of study area. This spatial pattern was associated mainly with cold water (< 13 °C) and high phytoplankton productivity, due to the upwelling that occurs in the Panamá Gulf at the beginning of the year. The oceanographic conditions in the north zone of Colombian Pacific modulate the reproductive strategy of S. agassizi, due to mainly food availability for larvae and postlarvae. Also, mangrove forests along the coastline provide shelter and food for juvenile stages, which is key to the survival and recruitment success. Fishery management decisions for this resource are suggested, based on spatial-temporal fishing closures, which protect the spawning stock.
KEY WORDS: Reproductive aggregation, deep water shrimp, environment, Colombian Pacific.
INTRODUCCIÓN
El conocimiento de los aspectos reproductivos de una especie sometida a explotación pesquera es fundamental, particularmente sobre la estación y el área de desove, así como el tamaño del stock desovante, información que permite diseñar e implementar estrategias de extracción, monitoreo y conservación de los recursos (Crocos y van der Velde, 1995; Ramírez-Llodra, 2002; Aragón-Noriega y García- Juárez, 2007). En la actualidad, el camarón de aguas profundas (CAP) se valora como un recurso con alto potencial pesquero, y por lo tanto, las especies que hacen parte de este grupo son consideradas como objetivo para la pesquería de arrastre (Figueiredo et al., 2001; Pezzuto et al., 2006; Gracia et al., 2010; Briones-Fourzán et al., 2010; Paramo y Saint-Paul, 2011). Aunque los camarones de la familia Solenoceridae se distribuyen a profundidades que alcanzan 384 m, se les considera como crustáceos de aguas profundas. Estos camarones son reconocidos por su gran abundancia en la Costa pacífica de América Central y del Sur, y por la selección de hábitats con características específicas y determinantes para su ciclo de vida tales como fondos blandos y zonas de manglares (Hendrickx, 1995; Wehrtmann y Nielsen-Muñoz, 2009).
En el Pacífico colombiano, la pesquería del CAP es una de las más importantes a nivel social y económico, destacándose el camarón Solenocera agassizi como una de las especies objetivo más representativas en las capturas de la flota industrial de arrastre destinadas a cubrir mercados internacionales (Rueda et al., 2010; Rueda et al., 2011). La especie S. agassizi tiene actividad reproductiva a lo largo del año, con un período reproductivo principal centrado al final e inicio del año y con la incorporación de reclutas a la pesquería entre los meses de abril y junio (Puentes et al., 1994; García, 2009). Una de las regulaciones establecidas para la pesquería consiste en un período de veda fijado al inicio del año (enero-marzo) para todo el Pacífico colombiano. No obstante, a la fecha, no se conoce el componente espacial que permita identificar las zonas donde ocurre el desove del camarón y su asociación con las condiciones ambientales. En la administración de los recursos marinos el conocimiento de las agregaciones reproductivas y el grado con que estas son afectadas por variables ambientales, es fundamental para ordenar y mejorar el funcionamiento de las pesquerías (Caddy y Seijo, 1998; Rivoirard et al., 2000).
En las especies de camarón se ha identificado que existen patrones de segregación espacial y que en efecto están influenciados por el ambiente, siendo considerados importantes para la distribución, reproducción y el reclutamiento de estas especies de crustáceos (Browder et al., 1999; Gribble et al., 2007). El período reproductivo del camarón está relacionado particularmente con el incremento de la productividad primaria y la concentración del fitoplancton en la columna del agua (Gómez y Gracia, 2003, 2007). Por otro lado, debido que los camarones cumplen gran parte de su ciclo de vida como organismos bentónicos, es racional su vinculación con el fondo marino, constituyéndose en uno de los componentes principales que modula la distribución y abundancia. Particularmente, variables como la profundidad y tipo de sustrato (sedimento y materia orgánica) ofrecen condiciones óptimas para la disponibilidad de alimento y protección (Somers, 1994; Roux et al., 1995; Fernández et al., 2007).
El objetivo de este estudio fue determinar el patrón de distribución espacial de la fracción reproductiva del camarón S. agassizi durante el período reproductivo y su relación con las condiciones ambientales en el Pacífico colombiano. Lo anterior, aportará un conocimiento clave para mejorar en el diseño de medidas de manejo y ordenamiento, especialmente aquellas relacionadas con la protección del stock desovante (i. e., vedas espacio-temporales, áreas protegidas). Tales medidas pueden contribuir a minimizar el riesgo de sobreexplotación y mantener la sustentabilidad de la pesquería del CAP.
ÁREA DE ESTUDIO
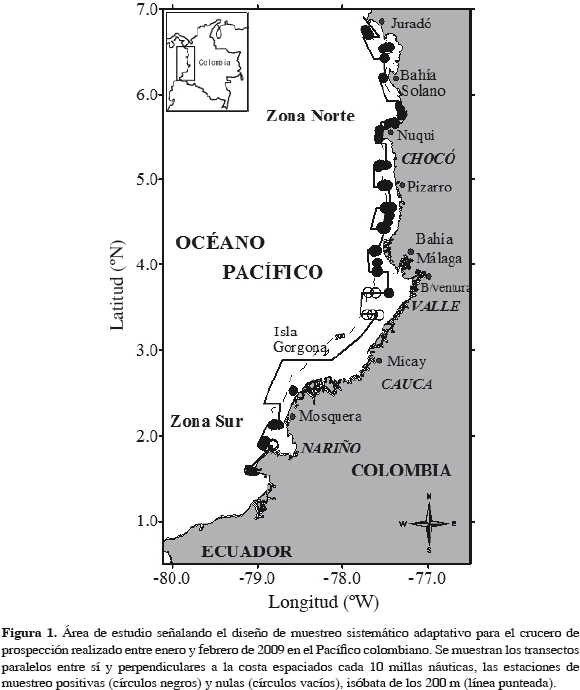
Este estudio comprendió la costa del Pacífico de Colombia desde Bahía Ancón de Sardinas (1°33'N, 79°20'W) en el sur, hasta cercanías de Juradó (6°58.8'N, 77°40.7'W) en el norte (Figura 1). El Pacífico colombiano abarca tres importantes zonas, la norte, que se extiende desde los límites con Panamá hasta Cabo Corrientes en Chocó y se caracteriza por la presencia de acantilados y el dominio de las estribaciones de la serranía del Baudó. Posee una plataforma estrecha de aproximadamente 1 ó 2 millas náuticas con sustrato predominantemente rocoso, aunque también se identifican arenas carbonatadas biogénicas y arenas lodosas (Cantera y Contreras, 1993; Díaz et al., 1998). La zona centro-sur, que comprende desde Cabo Corrientes hasta Pasacaballos en Nariño, presenta una plataforma más extensa rellena de sedimentos marinos en su mayoría de origen fluvial provenientes de numerosos ríos que desembocan en la costa, lo cual determina que la costa sea baja, con playa arenosa y extensas formaciones de manglares con diversas áreas estuarinas (Díaz et al., 1998).
El clima en el área de estudio está influenciado por la Zona de Convergencia Intertropical (ZCIT), que favorece el desarrollo de nubosidad alta y lluvias ocasionadas por la inestabilidad de las masas de aire húmedo y caliente (Tchantsev y Cabrera, 1998; Poveda et al., 2001). Además, los patrones de circulación atmosférica en el área oceánica favorecen la divergencia del agua costa afuera al inicio del año, con incrementos de la productividad debido a la surgencia en el golfo de Panamá (Rodríguez-Rubio y Stuardo, 2002; Rodríguez-Rubio et al., 2003).
MATERIALES Y MÉTODOS
Diseño de muestreo
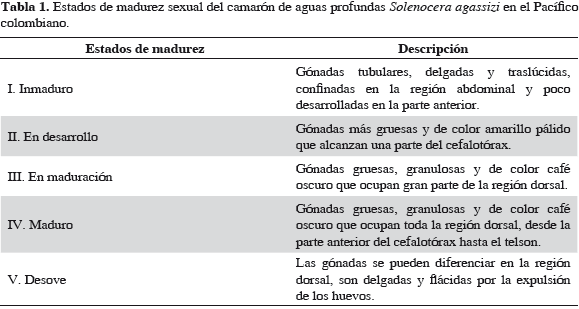
Se realizó una prospección directa sobre el recurso durante el período enero-febrero de 2009, para determinar la distribución espacial de S. agassizi durante la época de desove en el Pacífico de Colombia. Se empleó un diseño de muestreo sistemático adaptativo con transectos paralelos entre sí y perpendiculares a la costa y espaciados cada 10 millas náuticas, a bordo de un barco característico de la flota industrial camaronera (Figura 1). Se muestrearon 83 estaciones que cubrieron profundidades entre 50 y 450 m. La condición reproductiva de camarón fue evaluada mediante observación macroscópica del grado de desarrollo ovárico, color y volumen ocupado por la gónada (López-Martínez, 1999; García, 2009). Para los análisis se consideró los estados I y II como inmaduros, y estados III, IV y V como maduros (Tabla 1).
Para caracterizar las condiciones oceanográficas se tomó in situ la temperatura de fondo y profundidad mediante una sonda CTDO Ocean Seven Plus316. Además, se utilizó información de fitoplancton superficial (células/L) colectado en marzo de 2009 (período de alta productividad) por el Centro Control Contaminación del Pacífico (CCCP) de la Dirección General Marítima (Dimar). Mediante una draga Van Venn se colectaron muestras del sustrato para determinar el tipo de sedimento y su contenido de materia orgánica (Buchanan, 1984).
Análisis de información
Madurez sexual. La talla media de madurez (LT50%) de las hembras se determinó utilizando un modelo logístico (King, 2007):
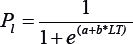
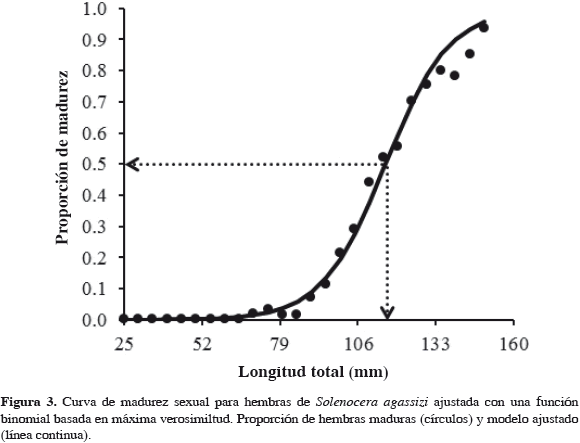
donde Pl es la proporción de hembras maduras, LT es la longitud total (mm), a (intercepto) y b (pendiente) son parámetros estimados en la función logística. La talla media de madurez (LT50%), se estimó mediante la relación -a/b. La curva de madurez se ajustó aplicando una función binomial, que considera el punto donde el producto de las funciones de masa binomiales es máximo (verosimilitud máxima de los datos dentro del modelo). Los parámetros e intervalos de confianza (IC 95%) de LT50% se estimaron mediante simulación MonteCarlo (Roa et al., 1999). Se utilizó para el análisis la plataforma computacional AD Model Builder (Fournier, 2012).
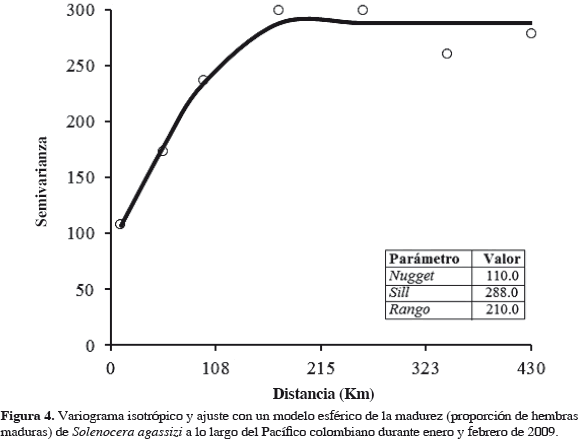
Distribución espacial. Con el objeto de identificar el patrón de distribución espacial de la fracción reproductiva de S. agassizi se realizó un análisis geoestadístico. En primer lugar, se caracterizó la estructura espacial de la madurez (proporción de hembras maduras), a través de la construcción de un variograma experimental. El variograma experimental mide la diferencia cuadrática media de dos puntos separados por una distancia h (Rivoirard et al., 2000):
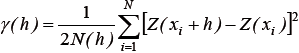
donde γ es el variograma en función de la distancia h medida en km; N es el número de pares de datos separados por h; Z(xi) es el valor de la variable en la muestra (xi); Z(xi + h), es el valor de la variable separada por xi y h. En segundo lugar, se ajustó un modelo de variograma (esférico, gaussiano y exponencial) al variograma experimental con el objeto de estimar los parámetros que definen la estructura espacial, tales como, efecto nugget (Co), sill (C) y rango (Ao) (Petitgas, 1996). El modelo esférico presentó mejor ajuste al variograma experimental y fue seleccionado mediante la validación cruzada que produjo el menor valor del cuadrado medio del error (Bez, 2002):
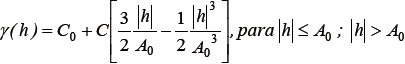
donde γ es el variograma modelo en función de la distancia h, Co es el efecto nugget que indica las variaciones que ocurren a una escala espacial no explicada por el modelo, C es el sill parcial que representa la varianza explicada por el modelo, C0 + C define el sill y el valor máximo de semivarianza de la variable regionalizada, A0 es el rango o la distancia hasta la cual existe autocorrelación espacial.
Finalmente, se usó el algoritmo de interpolación kriging puntual ordinario para predecir la agregación reproductiva (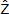 ) del camarón en sitios no muestreados y realizar el mapa del área evaluada:
) del camarón en sitios no muestreados y realizar el mapa del área evaluada:
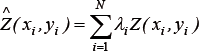
donde N es el número de muestras, λi es la ponderación atribuida a la muestra (xi,yi) y Σλi = 1. Las condiciones oceanográficas (temperatura del fondo y fitoplancton) fueron descritas mediante cartografía. Los análisis espaciales se realizaron en la plataforma computacional R-Project 2.9.2, usando la librería "geoR" (R Development Core Team, 2012).
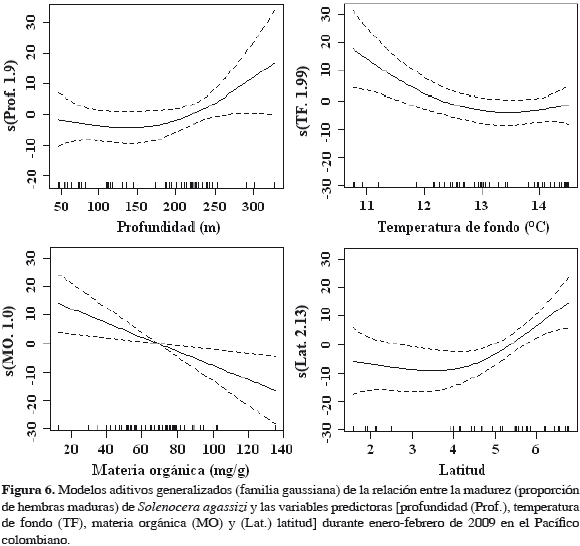
Relación madurez-hábitat. Para determinar la relación entre la madurez sexual (proporción de hembras maduras) y las variables ambientales (profundidad, temperatura de fondo, materia orgánica en sedimentos) y espaciales (latitud), se utilizaron modelos aditivos generalizados. Los modelos aditivos se derivan de los modelos lineales generalizados, y permiten estimar la relación entre una variable respuesta (i. e. madurez) y predictores aditivos (i. e. profundidad, temperatura), mediante el uso de funciones suavizadoras (Hastie y Tibshirani, 1990; Wood, 2006; Crawley, 2007):
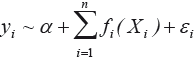
donde yi es la función que define la variable respuesta con el predictor aditivo, α es el intercepto, Xi son los predictores aditivos, fi son las funciones suavizadoras, εi es el error con 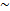 N(0,σ2). Se usó la librería "mgcv" para la plataforma computacional R (R Development Core Team, 2012), que permite determinar el nivel de significancia (valor p) y el grado de validación de las predicciones hechas por el modelo usando el Criterio de Validación Cruzada Generalizado (CVG):
N(0,σ2). Se usó la librería "mgcv" para la plataforma computacional R (R Development Core Team, 2012), que permite determinar el nivel de significancia (valor p) y el grado de validación de las predicciones hechas por el modelo usando el Criterio de Validación Cruzada Generalizado (CVG):
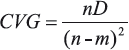
donde n el número de datos, D es la devianza y m son los grados de libertad efectivos del modelo. Por último, se consideró la devianza explicada como análogo de la varianza explicada por el modelo (Stoner et al., 2001):

El valor p, CVG y la devianza explicada fueron utilizados para seleccionar los modelos que mejor explicaron la relación entre la madurez y las variables predictoras.
RESULTADOS
Madurez sexual
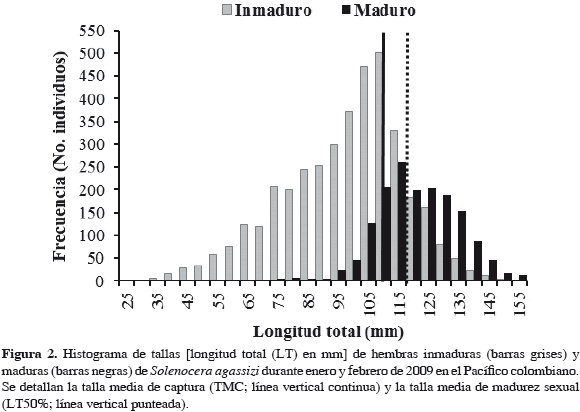
Se registraron un total de 1767 camarones, con rangos de tallas entre 28 y 153 mm de LT para hembras inmaduras (N = 1060) y las maduras (N = 707) entre 72 y 155 mm de LT (Figura 2). La talla media de madurez se estimó en 116 mm (IC inferior: 109 mm, IC superior: 123 mm), con valores de intercepto y pendiente de 10.4 ± 0.33 y -0.1 ± 0.003, respectivamente (Figura 3). Esta talla fue similar a la reportada en estudios anteriores (111 mm; Madrid y Angulo, 2002), sin embargo, fue mayor que la Talla Media de Captura (TMC) reportada recientemente en 108 mm LT ± 1.2 mm (Figura 2; Invemar, 2010), lo que representa un impacto sobre la especie al considerarse la LT50% un punto de referencia límite para el manejo de la pesquería.
Distribución espacial
El análisis de la estructura espacial de S. agassizi fue explicado por un variograma omnidireccional isotrópico, ajustado mediante un modelo esférico con rango de autocorrelación de 210 km y cuadrado medio del error de 0.05 (Figura 4). El variograma presentó una estructura espacial no resuelta por el modelo de 31.0 % de la varianza total. El valor del efecto nugget medido puede estar asociado a la escala espacial de muestreo usada para el estudio de la distribución de la proporción de hembras maduras en S. agassizi, lo que indica que la separación entre estaciones no fue la óptima, pero fue suficiente para determinar el patrón de distribución espacial exhibido. El rango de autocorrelación fue mayor que la distancia entre estaciones y representa el tamaño de la agregación reproductiva del camarón.
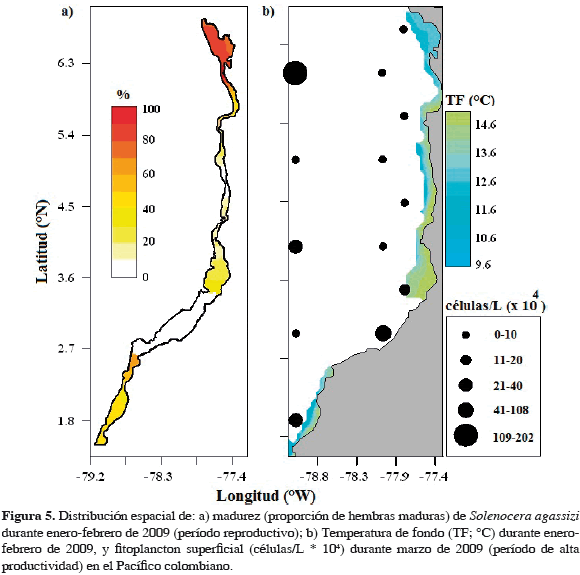
Se identificó una agregación de hembras maduras de S. agassizi (> 60 %) localizada principalmente cerca al sector de Bahía Solano y Juradó en el norte del área de estudio (Figura 5a). La distribución espacial de la temperatura de fondo y el fitoplancton mostraron un patrón similar al camarón, localizando aguas frías (< 13 °C) y con alta densidad fitoplanctónica (> 160 células/L * 104) hacia la zona norte del Pacífico colombiano (Figura 5b).
Relación madurez-hábitat
Los resultados de la modelación mostraron que la fracción reproductiva de S. agassizi está asociada significativamente con las condiciones del hábitat que caracterizan la zona norte del Pacífico colombiano: alta latitud con una plataforma considerablemente estrecha y profunda (> 200 m) y presencia de aguas frías derivada de la surgencia costera que ocurre en la zona al inicio del año. Valores altos de individuos maduros se asociaron particularmente con un rango de profundidad entre 200 y 300 m, y con temperaturas entre 10.5 y 13.0 °C (Figura 6; Tabla 1).
El análisis consideró dos modelos aditivos para evitar la autocorrelación de los predictores ambientales profundidad y temperatura de fondo (Tabla 2).
DISCUSIÓN
La talla media de captura se encontró por debajo de la talla media de madurez estimada (108.0 mm < 116.0 mm), lo que indica un riesgo para la fracción reproductiva de la población de S. agassizi. Lo anterior ocurre como consecuencia de la poca selectividad y la escasa innovación tecnológica de las redes de arrastre que operan en la pesquería, las cuales tienden a maximizar la captura de individuos que no han alcanzado a reproducirse por primera vez (Rico-Mejía y Rueda, 2007). Esta condición está generando una sobrepesca por crecimiento, reduciendo la posibilidad que nuevos reclutamientos se integren al stock parental (King, 2007), aumentado así el riesgo a la sobreexplotación del CAP (Rico-Mejía y Rueda, 2010). Al respecto, los antecedentes de investigación indican que en la pesquería la especie S. agassizi se captura en un 47% por debajo de LT50%, mientras que el 54% ocurre en Farfantepenaeus brevirostris (Rueda et al., 2012).
La fracción reproductiva de S. agassizi se encontró concentrada principalmente en el norte del área de estudio, entre la localidad de Bahía Solano y Juradó, cerca de donde ocurre el afloramiento fitoplanctónico y enfriamiento de las masas de agua como producto de la surgencia que se presenta al inicio del año en el golfo de Panamá (Rodríguez-Rubio y Stuardo, 2002; Devis-Morales et al., 2008). En esta zona la mezcla del agua y los procesos de advección vertical también llevan aguas ricas en nutrientes desde la nutriclina hasta la capa superficial resultando en altos niveles relativos de producción nueva que son favorables para la disponibilidad de recursos pesqueros (Rodríguez-Rubio y Stuardo, 2002).
Aunque existe una diferencia espacial longitudinal en la ocurrencia del enriquecimiento de las masas de agua (más oceánico) y el desove (cerca a la costa), se puede interpretar como un escenario que representa una "ventana ambiental óptima" en el camarón, donde las larvas tienen disponibilidad de alimento y poca turbulencia que favorece las tasas de encuentro con el alimento y el transporte larval hacia la costa (Rothschild y Osborn, 1988; Cury y Roy, 1989). Además, esta condición ambiental brinda la oportunidad para que ocurra la retención y concentración larval cerca de la costa, evitando la advección hacia el área oceánica (Bakun, 1996). A la fecha no existen estudios sobre el camarón que describan la distribución de huevos y larvas en el Pacífico colombiano. No obstante, se conoce que la zona norte particularmente el sector del golfo de Cupica y Juradó se presenta alta disponibilidad de larvas de peces principalmente de la familia Engraulidae (Giraldo, 2007). Rodríguez (2012) identificó un patrón de distribución espacio-temporal en S. agassizi con camarones de tallas mayores en la zona norte y tallas menores en el sur del Pacífico colombiano, destacando que a mediados del año se encontraron abundancias altas hacia latitudes medias, lo cual podría describir un patrón migratorio reproductivo (sur-norte) de camarones adultos al inicio del año. Esta distribución espacial fue consistente con la relación exhibida entre el camarón y las variables ambientales, encontrando las tallas mayores asociadas con profundidades superiores a los 200 m y aguas frías (< 13°C) (Rodríguez, 2012). En general, los reportes para esta especie indican alta abundancia de camarón en la zona norte al inicio del año (Arenas, 2010; Rodríguez, 2012; Rodríguez et al., 2012), lo cual puede estar enlazado a la ocurrencia del evento reproductivo.
Los resultados sugieren que la distribución espacial de la fracción reproductiva de S. agassizi está asociada con aguas frías y de alta productividad del Pacífico norte, lo cual modula su estrategia reproductiva al garantizar la disponibilidad de alimento y refugio para larvas y postlarvas en virtud de la presencia de extensas áreas de manglar en el borde costero, claves para la sobrevivencia y el éxito en el reclutamiento (Cury et al., 1998; Castilho et al., 2007). El patrón espacial de S. agassizi en este estudio coincide con lo reportado por Gómez y Gracia (2003, 2007) para camarones del género Solenocera, donde el pico reproductivo y alta abundancia de estadios larvales se encontraron asociados al período de alta productividad primaria y disponibilidad de alimento en la capa superior de la columna del agua con giros ciclónicos de mesoescala determinantes para la retención larval en el golfo de México. Lo anterior indica que en organismos con ciclo de vida corto y sometidos a presión pesquera, los procesos biológicos como cambios ambientales y factores limitantes como el alimento pueden afectar fuertemente la dinámica reproductiva y la abundancia anual del stock (Leal-Gaxiola et al., 2001; Castilho et al., 2007).
Finalmente, el patrón de agregación reproductiva de S. agassizi y la relación con las condiciones ambientales encontrada en este estudio, puede ayudar a fortalecer las decisiones de manejo sobre el recurso en el Pacífico colombiano, mediante el diseño de una veda espacio-temporal y/o el establecimiento de un área protegida para la protección del stock desovante hacia el norte del departamento del Chocó. Se recomiendan estudios experimentales para evaluar la selectividad de las redes de arrastre en la pesquería del CAP, con el fin de reducir su efecto sobre la captura de camarones por debajo de la talla media de madurez.
AGRADECIMIENTOS
Este trabajo hace parte de los estudios de Magíster en Ciencias Mención Pesquerías del primer autor y contó con el apoyo de la Escuela de Graduados de la Universidad de Concepción de Chile y el Fondo de Becas Henry von Prahl del Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" -Invemar-. El trabajo fue patrocinado por los proyectos códigos 031 2007T6650-909-07 y 2105-327-18502 financiados por el Ministerio de Agricultura y Colciencias, respectivamente. Se agradece el apoyo logístico de la Asociación Colombiana de Armadores Pesqueros -Acodiarpe- y la Sociedad Comercializadora Internacional Pez a Mar Ltda. Así mismo se agradece el apoyo del ICA e Incoder en lo que respecta al encargo de la administración pesquera del país en sus momentos. Nuestros agradecimientos especiales al CCCP de la Dimar por suministrar los datos de fitoplancton superficial y al Grupo de Investigación Pesquera de la sede Pacífico del Invemar (Farit Rico, Wilberto Angulo, Alexander Girón, Edgar Arteaga, Luisa García, Laura Arenas y Germán Angulo). Finalmente agradecemos a dos revisores anónimos por sus valiosos comentarios en el manuscrito.
BIBLIOGRAFÍA
1 Aragón-Noriega, E. A. y A. R. García-Juárez. 2007. Comparison of two methods to determine the maturity period in penaeid shrimps (Decapoda, Penaeidae). Crustaceana., 80 (5): 513-521. [ Links ]
2 Arenas, L. 2010. Distribución espacio-temporal del camarón coliflor (Solenocera agassizi; Faxon: 1893) y su relación con variables fisicoquímicas en el Pacífico colombiano. Tesis. Biol., Univ. Quindío, Armenia. 75 p. [ Links ]
3 Bakun, A. 1996. Patterns in the ocean: ocean processes and marine population dynamics. University of California Sea Grant, UCSD, San Diego, CA/ Centro de Investigaciones Biológicas de Noroeste, La Paz, Baja California. 323 p. [ Links ]
4 Bez, N. 2002. Global fish abundance estimation from regular sampling: the geostatistical transitive method. Can. J. Fish. Aquat. Sci., 59: 1921-1931. [ Links ]
5 Briones-Fourzán, P., C. Barradas-Ortíz, F. Negrete-Soto y E. Lozano-Álvarez. 2010. Reproductive traits of tropical deep-water pandalid shrimps (Heterocarpus ensifer) from the SW Gulf of Mexico. Deep Sea Res. I., 57: 978-987. [ Links ]
6 Browder, J., V. Restrepo, J. Rice, M. Robblee y Z. Zein-Eldin. 1999. Environmental influences on potential recruitment of pink shrimp, Farfantepenaeus duorarum, from Florida Bay nursery grounds. Estuaries., 22 (28): 484-499. [ Links ]
7 Buchanan, J. B. 1984. Sediment analysis. 41-45. En: Holme, N. A. y A. D. Mclntyre (Eds.). Methods for the study of marine benthos. Blackwell, Oxford. 387 p. [ Links ]
8 Caddy, J. F. y J. C. Seijo. 1998. Application of a spatial model to explore rotating harvest strategies for sedentary species. Spec. Publ. Fish.Aquat. Sei., 125: 359-365. [ Links ]
9 Cantera, J. y R. Contreras. 1993. Ecosistemas costeros. 65-79. En: Leyva, P. (Ed.). Colombia Pacífico. Fondo FEN Colombia, Bogotá. 396 p. [ Links ]
10 Castilho, A. L., R. C. Costa, A. Fransozo y E. Boschi. 2007. Reproductive pattern of the South American endemic shrimp Artemesia longinaris (Decapoda: Penaeoidea), off São Paulo State, Brazil. Rev. Biol. Trop., 55 (1): 39-48. [ Links ]
11 Crawley, M. 2007. The R Book. John Wiley and Sons, Nueva York. 942 p. [ Links ]
12 Crocos, P. J. y T. D. van der Velde. 1995. Seasonal, spatial and interannual variability in the reproductive dynamics of the grooved tiger prawn, Penaeus semisulcatus de Haan, in Albatross Bay, Gulf of Carpentaria, Australia: the concept of effective spawning. Mar. Biol., 122: 557-570. [ Links ]
13 Cury, P. y C. Roy. 1989. Optimal environmental window and pelagic fish recruitment success in upwelling areas. Can. J. Fish. Aquat. Sci., 46: 670-680. [ Links ]
14 Cury, P., C. Roy y V. Faure. 1998. Environmental constraints and pelagic fisheries in upwelling areas: The Peruvian Puzzle. S. Afr. J. Mar. Sci., 19: 159-167. [ Links ]
15 Devis-Morales, A., W. Schneider, R. A. Montoya-Sánchez y E. Rodríguez-Rubio. 2008. Monsoonlike winds reverse oceanic circulation in the Panama Bight. Geophys. Res. Lett., (35): L20607, doi:10.1029/2008GL035172. [ Links ]
16 Díaz, J., C. Velasco y A. Ramírez. 1998. Monitoreo de la pesquería del camarón de aguas someras del Pacífico colombiano en 1997. Informe técnico INPA, Buenaventura, Colombia. 32 p. [ Links ]
17 Fernández, M., D. Hernández y A. Roux. 2007. Spatial distribution of the red shrimp (Pleoticus muelleri (Bate, 1888)) and its relationship with the environmental variables, San Jorge Gulf, Argentina. Rev. Biol. Mar. Oceanogr., 42 (3): 335-344. [ Links ]
18 Figueiredo, M. J., I. Figueiredo y P. B. Machado. 2001. Deep-water penaeid shrimps (Crustacea: Decapoda) from off the Portuguese continental slope: an alternative future resource? Fish. Res., 51 (2-3): 321-326. [ Links ]
19 Fournier, D. A., H. J. Skaug, J. Ancheta, J. Ianelli, A. Magnusson, M. N. Maunder, A. Nielsen y J. Sibert. 2012. AD Model Builder: using automatic differentiation for statistical inference of highly parameterized complex nonlinear models. Optim. Methods Softw., 27: 233-249. [ Links ]
20 García, L. 2009. Biología reproductiva de dos de las principales especies de camarón de aguas profundas (Farfantepenaeus brevirostris y Solenocera agassizi) del Pacífico colombiano. Tesis Biol., Univ. Valle, Cali. 88 p. [ Links ]
21 Giraldo, A. 2007. Evaluación de medianos pelágicos en el Pacífico colombiano: componente oceanográfico, bentónico y pesquero. Informe final, Corporación Colombia Internacional, Incoder y Univ. Valle, Cali. 139 p. [ Links ]
22 Gómez, M. A. y A. Gracia. 2003. Distribution and abundance of larvae and adults of Solenocera (Decapoda, Solenoceridae) in the southwestern Gulf of Mexico. Crustaceana., 76 (6): 681-698. [ Links ]
23 Gómez, M. A. y A. Gracia. 2007. Dispersal patterns of shrimp larvae and postlarvae of the genus Solenocera. Rev. Biol. Mar. Oceanogr., 42 (2): 157-165. [ Links ]
24 Gracia, A., A. Vázquez-Bader, E. Lozano-Alvarez y P. Briones-Fourzán. 2010. Deep-water shrimp (Crustacea: Penaeoidea) off the Yucatan Peninsula (Southern Gulf of Mexico): A potential fishing resource? J. Shellfish. Res., 29 (1): 37-43. [ Links ]
25 Gribble, N. A., T. J. Wassenberg y C. Burridge. 2007. Factors affecting the distribution of commercially exploited penaeid prawns (shrimp) (Decapod:Penaeidae) across the northern Great Barrier Reef, Australia. Fish. Res., 85: 174-185. [ Links ]
26 Hastie, T. J. y R. J. Tibshirani. 1990. Generalized additive models. Chapman and Hall, Londres. 344 p. [ Links ]
27 Hendrickx, M. 1995. Camarones. 417-537. En: Fischer, W., F. Krupp, W. Schneider, C. Sommer, K. Carpenter y V. H. Niem (Eds.). Guía FAO para la identificación de especies para los fines de pesca. Pacífico centro-oriental. Vol. I. Plantas e invertebrados. FAO, Roma. 646 p. [ Links ]
28 Invemar. 2010. Informe del estado de los ambientes y recursos marinos y costeros en Colombia: año 2009. Serie de publicaciones periódicas No. 8, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 319 p. [ Links ]
29 King, M. 2007. Fisheries biology, assessment and management. Wiley-Blackwell, Londres. 400 p. [ Links ]
30 Leal-Gaxiola, A., J. López-Martínez, E. A. Chávez, S. Hernández-Vázquez y F. Méndez-Tenorio. 2001. Interannual variability of reproductive period of the brown shrimp, Farfantepenaeus californiensis (Holmes, 1900) (Decapoda, Natantia). Crustaceana., 74: 839-851. [ Links ]
31 López-Martínez, J. 1999. Período reproductivo y talla de madurez masiva del camarón de roca Sicyonia penicillata (Decápoda: Sicyoniidae) en Bahía Kino, Sonora, México. Rev. Biol. Trop., 47 (1-2): 109-117. [ Links ]
32 Madrid, N. y W. Angulo. 2002. Evaluación biológico-pesquera del recurso camarón de aguas profundas en el Pacífico colombiano. Marzo 2001-Febrero 2002. Informe técnico, Agropesquera Bahía Cupica Ltda., Buenaventura, Colombia. 70 p. [ Links ]
33 Paramo, J. y U. Saint-Paul. 2011. Deep-sea shrimps Aristaeomorpha foliacea and Pleoticus robustus (Crustacea: Penaeoidea) in the Colombian Caribbean Sea as a new potential fishing resource. J. Mar. Biol. Ass. U.K. doi:10.1017/S0025315411001202. [ Links ]
34 Petitgas, P. 1996. Geostatistics and their applications to fisheries survey data. 113-142. En: Megrey, A. y E. Moskness (Eds.). Computers in fisheries research. Chapman and Hall, Londres. 254 p. [ Links ]
35 Pezzuto, P., J. Pérez y R. Wahrlich. 2006. Deep-sea shrimps (Decapoda: Aristeidae): New targets of the deep-water trawling fishery in Brazil. Braz. J. Oceanogr., 54 (2-3): 123-134. [ Links ]
36 Poveda, G., A. Jaramillo, M. Gil, N. Quinceno y R. Mantilla. 2001. Seasonality in ENSO-related precipitation, river discharges, soil moisture, and vegetation index in Colombia. Water. Resour. Res., 37: 2169-2178. [ Links ]
37 Puentes, V., N. Madrid, L. Zapata y W. Niño. 1994. Estudio sobre la biología, dinámica poblacional y pesquería del camarón de aguas profundas Solenocera agassizi (Faxon, 1893) en el Pacífico colombiano. Bol. Cient. INPA, 2: 124-133. [ Links ]
38 Ramírez-Llodra, E. 2002. Fecundity and life-history strategies in marine invertebrates. Adv. Mar. Biol., 43: 87-170. [ Links ]
39 R Development Core Team. 2012. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna. <http://www.R-project.org/>. 13/04/2012. [ Links ]
40 Rico-Mejía, F. y M. Rueda. 2007. Evaluación experimental bioeconómica de cambios en la tecnología de captura de camarón con redes de arrastre en aguas someras del Pacífico colombiano. Bol. Invest. Mar. Cost., 36: 79-109. [ Links ]
41 Rico-Mejía, F. y M. Rueda. 2010. Evaluación del impacto de la pesca industrial de arrastre de camarón en el Pacífico colombiano. 345-350. En: Invemar y Acimar (Eds.). Libro de resúmenes extendidos XIV Seminario Nacional de Ciencias y Tecnologías del Mar (Senalmar). Serie de Publicaciones Especiales No. 21, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 578 p. [ Links ]
42 Rivoirard, J., J. Simmonds, K. G. Foote, P. Fernandes y N. Bez. 2000. Geostatistic for estimating fish abundance. Blackwell Science Ltd., Londres. 205 p. [ Links ]
43 Roa, R., B. Ernst y F. Tapias. 1999. Estimation of size at sexual maturity: an evaluation of analytical and resampling procedures. Fish. Bull., 97: 570-580. [ Links ]
44 Rodríguez, A. 2012. Estructura espacial del camarón de aguas profundas y su relación con las condiciones del hábitat a lo largo de la costa del Pacífico de Colombia. Tesis M. Sc., Univ. Concepción, Concepción, Chile. 89 p. [ Links ]
45 Rodríguez, A., M. Rueda, J. Viaña, C. García, F. Rico, L. García y A. Girón. 2012. Evaluación y manejo de la pesquería de camarón de aguas profundas en el Pacífico colombiano 2010-2012. Invemar, Colciencias, Incoder. Serie de publicaciones generales del Invemar No. 56. Santa Marta, Colombia. 114 p. [ Links ]
46 Rodríguez-Rubio, E. y J. Stuardo. 2002. Variability of photosynthetic pigments in the Colombian Pacific Ocean and its relationship with the wind field using ADEOS-I data, Proc. Indian. Acad. Sci. Earth Planet. Sci., 111 (3): 227-236. [ Links ]
47 Rodríguez-Rubio, E., W. Schneider y R. Abarca del Río. 2003. On the seasonal circulation within Panama Bight derived from satellite observations of winds, altimetry and sea surface temperature. Geophys. Res. Lett., 30: 1410-1413. [ Links ]
48 Rothschild, B. J. y T. R. Osborn. 1988. Small scale turbulence and plankton contact rates. J. Plankton. Res., 10: 465-474. [ Links ]
49 Roux, A., M. Fernández y C. Bremec. 1995. Preliminary survey of the benthic communities of patagonian shrimp fishing grounds in San Jorge Gulf (Argentina). Cienc. Mar., 21 (3): 295-310. [ Links ]
50 Rueda, M., F. Rico-Mejía, W. Angulo, A. Girón, A. Rodríguez, L. García y L. Arenas. 2010. Evaluación biológico-pesquera del estado de las poblaciones de camarón de aguas profundas, mediante la aplicación de métodos directos (prospección pesquera) e indirectos (estadísticas de captura y esfuerzo) en el Pacífico colombiano. Informe final, Instituto de Investigaciones Marinas y Costeras (Invemar) y Ministerio de Agricultura y Desarrollo Rural, Santa Marta. 130 p. [ Links ]
51 Rueda, M., F. Rico-Mejía, A. Rodríguez, C. García, J. Viaña y R. Riascos. 2011. Programa de investigación para el desarrollo de nuevas pesquerías de aguas profundas en el Pacífico colombiano con énfasis en el recurso camarón. Segundo informe de avance, Instituto de Investigaciones Marinas y Costeras (Invemar), Colciencias, Incoder y Acodiarpe, Santa Marta. 10 p. [ Links ]
52 Rueda, M., A. Rodríguez, J. Viaña, C. García, F. Rico, A. Girón y L. García. 2012. Programa de investigación para el desarrollo de nuevas pesquerías de aguas profundas en el Pacífico colombiano con énfasis en el recurso camarón. Informe final, Invemar y Colciencias. Santa Marta, Colombia. 90 p. [ Links ]
53 Somers, I. F. 1994. Species composition and distribution of commercial penaeid prawn catches in the Gulf of Carpentaria, Australia, in relation to depth and sediment type. Aust. J. Mar. Freshwater Res., 45: 317-335. [ Links ]
54 Stoner, A. W., J. P. Manderson y J. P. Pessutti. 2001. Spatially explicit analysis of estuarine habitat for juvenile winter flounder: combining generalized additive models and geographic information systems. Mar. Ecol. Prog. Ser., 213: 253-271. [ Links ]
55 Tchantsev, V. y E. Cabrera. 1998. Algunos aspectos de investigación de la formación del régimen oceanográfico en el Pacífico colombiano. Bol. Cient. CCCP, 7: 7-19. [ Links ]
56 Wehrtmann, I. y V. Nielsen-Muñoz. 2009. The deepwater fishery along the Pacific coast of Costa Rica, Central America. Lat. Am. J. Aquat. Res., 37 (3): 543-554. [ Links ]
57 Wood, S. 2006. Generalized additive models: An introduction with R. Chapman and Hall/CRC, Nueva York. 385 p. [ Links ]
FECHA DE RECEPCIÓN: 16/08/2011 FECHA DE ACEPTACIÓN: 25/09/2012
*Contribución No. 1114 del Instituto de Investigaciones Marinas y Costeras -Invemar-.