Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.2 Santa Marta July/Dec. 2012
BIOECOLOGÍA DE LA LISA (MUGIL INCILIS HANCOCK) EN LA BAHÍA DE CISPATÁ, CARIBE COLOMBIANO
BIO-ECOLOGY OF THE MULLET (MUGIL INCILIS HANCOCK) IN CISPATÁ BAY, COLOMBIAN CARIBBEAN
Diana Bustos-Montes1, Angie Santafé-Muñoz1, Marcela Grijalba-Bendeck1, Aminta Jáuregui1, Andrés Franco-Herrera1 y Adolfo Sanjuan-Muñoz1,2
1 Universidad de Bogotá Jorge Tadeo Lozano sede Santa Marta, Programa de Biología Marina. Carrera 2 No. 11-68, Edificio Mundo Marino, Santa Marta, Colombia. dianabustosm@gmail.com, angie.santafe@hotmail.com, marcela.grijalba@utadeo.edu.co, aminta.jauregui@utadeo.edu.co, andres.franco@utadeo.edu.co, adolfo.sanjuan@utadeo.edu.co.
2 Convenio Universidad de Bogotá Jorge Tadeo Lozano-Corporación Autónoma de los Valles del Sinú y del San Jorge. Montería, Colombia.
RESUMEN
Se determinaron aspectos bioecológicos de 561 ejemplares de Mugil incilis capturados con atarraya (75.4%) y trasmallo (24.6%) en la bahía de Cispatá entre julio y diciembre de 2007. La longitud total (LT) estuvo entre 17.5 y 44.5 cm, siendo la mayoría juveniles, lo que se refleja en el crecimiento alométrico minorante observado: W (g) = 0.01 LT (cm)2.83 (r2 = 0.92). El 48% de los ejemplares fueron machos (n = 221) y el 52% hembras (n = 240); no se presentó una desviación significativa de la proporción 1:1 (χ2 = 0.39; p = 0.53). La talla media de madurez sexual fue calculada en 30.5 cm de LT para los sexos combinados, 30.3 cm de LT para las hembras (n = 188) y 35.6 para los machos (n = 231). Los índices gonadosomático y hepatosomático y la proporción de estados III, IV y V de madurez aumentaron hacia el final del año, sugiriendo que M. incilis se encuentra en su período reproductivo. A partir de 177 peces examinados se determinó la prevalencia (65% de peces parasitados), abundancia (3.4 ± 0.5 parásitos/ pez) e intensidad media de endoparásitos (5.4 parásitos/pez infestado). Los parásitos fueron identificados como: Ergasilus sp., Caligus sp., Contracaecum sp. y acantocéfalo, aunque este último grupo no es considerado como patógeno, es necesario desarrollar investigaciones más detalladas al respecto que permitan explicar su representatividad. A partir de la información generada, se sugieren medidas para el manejo pesquero de M. incilis en la bahía de Cispatá.
PALABRAS CLAVE: Mugil incilis, bioecología, parásitos, bahía de cispatá, Caribe colombiano.
ABSTRACT
Bioecological aspects of 561 M. incilis captured by casts-net (75.4%) and gill net (24.6%) in Cispatá bay, between July and December 2007 were determined. Total length (TL) was between 17.5 to 44.5 cm TL, most of the individuals were juvenile, which is reflected in the allometric growth: W (g) = 0.01 TL (cm)2.83 (r2 = 0.92). 48% were males (n = 221) and 52% females (n = 240); there was no significant deviations of the 1:1 sex ratio (χ2 = 0.39; p = 0.53). Maturity size was estimated on 30.5 cm TL for both sexes, 30.3 cm TL for females (n = 188) and 35.6 for males (n = 231). Gonadosomatic and hepatosomatic indices increased at the end of the year, in the same way as the gonad development stages III, IV and V, suggesting a reproductive peak of M. incilis. Out of the 177 fishes examined, it was determined that 65% contained parasites, with an abundance of 3.4 ± 0.5 parasites/fish and a mean intensity of 5.4 endoparasites/infected fish. Parasitic fauna were identified as: Ergasilus sp., Caligus sp., Contracaecum sp. and Acantocephalans; although the latter group is not considered a pathogen, further research is necessary to explain its representation. From the information generated, a fisheries management improvement was suggested for M. incilis in Cispatá bay.
KEY WORDS: Mugil incilis, bio-ecology, parasites, Bahía de Cispatá, Colombian Caribbean.
INTRODUCCIÓN
La lisa Mugil incilis Hancock se encuentra especialmente asociada a costas y estuarios (Blanco, 1983; Cervigón, 1993). Se distribuye en el Caribe desde Haití y Panamá bordeando la costa occidental atlántica de América del Sur hasta el sureste de Brasil (Harrison, 2002). En Colombia, está registrada desde la bahía de Cispatá hasta Portete, incluyendo estuarios y lagunas costeras de la franja continental (Rey y Acero, 2002). Los estudios sobre esta especie son diversos y se han enfocado desde sus inicios al conocimiento de aspectos tróficos, pesqueros y reproductivos (Blanco, 1980, 1983; Sánchez et al., 1998; Rueda y Defeo, 2003; Mármol et al., 2010), sin dejar de lado los relacionados con el parasitismo (Olivero-Verbel et al., 2005), que han contribuido en mayor o menor medida a determinar algunas características biológicas de la especie. Además se ha evidenciado la influencia antropogénica sobre su distribución y abundancia como consecuencia de las actividades pesqueras que se efectúan a nivel local (Narváez et al., 2008; Mármol et al., 2010). La bahía de Cispatá no ha sido ajena a esta problemática, la cual se ha manifestado específicamente en los cambios de abundancia de la ictiofauna y de la dinámica hídrica de la zona estuarina (Invemar et al., 2002). Entre los recursos pesqueros se encuentra M. incilis, considerado como uno de los más importantes desde el punto de vista comercial y que además presenta una situación pesquera similar a la documentada en otras pesquerías (Narváez et al., 2008; Mármol et al., 2010). Por ejemplo, Martínez et al. (2006) evaluaron el efecto de las redes de enmalle fija en la bahía de Cispatá sobre varias especies comerciales, entre ellas M. incilis. Estos autores determinaron una sobrepesca sobre las tallas menores a la talla media de madurez sexual (TMM). Sin embargo, la TMM que utilizaron como referencia fue tomada a partir de la población de otro sistema natural, demostrando la importancia de realizar estudios biológicos de esta especie en el sector. Por este motivo, en este estudio se investigaron por primera vez aspectos de la biología reproductiva de M. incilis en la bahía Cispatá, como también su condición sanitaria mediante una caracterización de endoparásitos.
ÁREA DE ESTUDIO
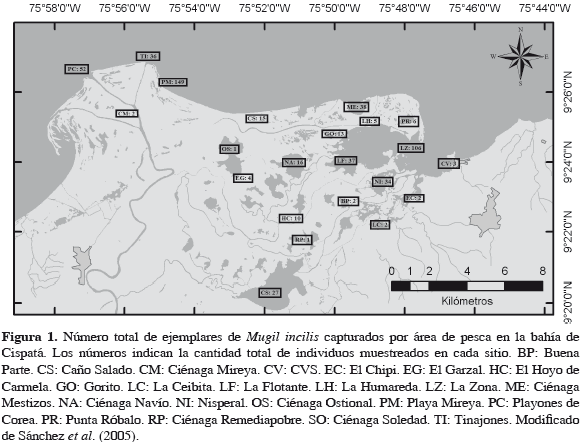
La bahía de Cispatá se ubica en el departamento de Córdoba (Caribe colombiano), comprendiendo el antiguo delta del río Sinú al suroeste del golfo de Morrosquillo (9°20'- 25'N y 75°40'-50'W; Olaya et al., 1987; Figura 1); cuenta con una extensión de 30 km2 aproximadamente (Patiño y Flórez, 1993) y una profundidad promedio de 6 m (Moreno, 1988). Se considera como un ambiente estuarino, compuesto por un complejo lagunar de 16000 ha, de las cuales 9000 ha corresponden a espejo de agua (caños y lagunas) y 7000 ha a bosque de manglar (Gobernación de Córdoba, 2008).
El río Sinú es la principal arteria fluvial, con una longitud aproximada de 415 km. Se desliza entre las serranías de Abibe y San Jerónimo, hasta desembocar actualmente en la zona de llanura en la Boca de Tinajones (Gobernación de Córdoba, 2008). Dentro de los aspectos económicos, la principal actividad desarrollada en Córdoba es la agropecuaria; no obstante, un alto porcentaje de la población costera de la región se dedica a la labor pesquera y hoy, luego de cinco siglos, esta continúa siendo una de las más relevantes (Barreto et al., 1999). En general, la pesca es artesanal, con un mercado local muy limitado, existiendo poca tecnificación y escasa diversificación de los artes (Invemar et al., 2002).
MATERIALES Y MÉTODOS
Entre julio y diciembre de 2007 se llevaron a cabo muestreos mensuales de tres días en el complejo lagunar de la bahía de Cispatá. De acuerdo con el gradiente de salinidad, se consideraron áreas de pesca con características marinas (playa Mireya y playones de Corea), costero-estuarinas (ciénagas Mestizos, La Zona, La Flotante, Nisperal, Punta Róbalo, Tinajones y CVS), estuarinas (Gorito, El Garzal, El Chipi, La Humareda, El Hoyo de Carmela, Buena Parte, La Ceibita, ciénagas Soledad y Remediapobre) y dulceacuícolas (ciénagas Mireya, Ostional, Navío y Caño Salado). Los ejemplares fueron adquiridos de la actividad pesquera de pescadores que utilizaron atarrayas (tamaño de malla entre 3.8 y 7.6 cm) y redes de enmalle fija (de uno a seis paños con dimensiones de 1 a 2 m de alto, 100 m de longitud y entre 2 y 4 cm de tamaño de malla). El primer arte operaba entre las 8 a. m. y 4 p. m., mientras que las faenas del segundo eran nocturnas, entre 4 p. m. y 8 a. m. (revisando cada 5 a 6 h aproximadamente). A cada individuo se le midió la longitud total (LT) y estándar (LE) sobre su costado izquierdo. Las gónadas en fresco se pesaron con una balanza de 0.01 g de precisión y se valoraron cualitativamente para definir el sexo y estado de madurez sexual a nivel macroscópico teniendo en cuenta la escala propuesta para mugílidos (Álvarez-Lajonchere, 1976). Para la búsqueda de endoparásitos, se extrajeron el hígado, estómago e intestino y se conservaron en solución de formalina al 4%. En el laboratorio se separaron y contaron los parásitos hallados en los órganos internos extraídos, que se identificaron posteriormente con bibliografía especializada (Yamaguti, 1961; Olsen, 1977; Roberts, 1981).
Análisis de datos
Estructura de tallas y aspectos reproductivos
Se evaluó la distribución temporal de la longitud total, se estimó la relación longitud-peso y la proporción de sexos. Esto último se comparó con la proporción esperada (1:1) con una prueba de chi cuadrado (χ2) con la corrección de continuidad de Yates (Zar, 2010).
En el componente reproductivo se determinó la progresión mensual e intervalos de tallas de los estados de madurez sexual y se calculó la talla mínima de madurez sexual, entendida como la longitud total del individuo maduro de menor tamaño observado en la muestra (Conrath, 2005). Se estimó la talla media de madurez (TMM) mediante la determinación de la frecuencia de longitud total a la que el 50% de los ejemplares se encontraron maduros (Holden y Raitt, 1975) y estimando los parámetros de la función de madurez, minimizando el negativo del logaritmo de la función de verosimilitud de acuerdo con lo propuesto por Roa et al. (1999). La TMM se determinó por sexo y combinando los sexos. Adicionalmente, se calculó mensualmente el promedio del factor de condición (K) y de los índices gonadosomático (IGS) y hepatosomático (IHS), para analizar de manera gráfica su variación a través del tiempo. El factor de condición fue calculado como K = W/a × LT -b; donde W es el peso eviscerado de cada individuo en gramos, LT es la longitud total en centímetros y las constantes a y b son el intercepto y la pendiente de la relación, respectivamente (Anderson y Gutreuter, 1983). El IGS se calculó utilizando la relación entre el peso de las gónadas y el peso corporal eviscerado y el IHS la relación entre el peso del hígado y el peso corporal eviscerado (Anderson y Gutreuter, 1983).
Composición y prevalencia de parásitos
Se evalúo la composición de especies de parásitos y el grado de infestación de cada una. Para esto último, se calcularon los índices siguiendo los criterios de Bush et al. (1997): prevalencia (número de peces parasitados con una especie de parásito/ total de peces examinados), intensidad media (número total de individuos de una especie de parásito en una muestra de pez hospedero/número de peces infestados) y abundancia (número de individuos de una especie de parásito/pez infestado).
RESULTADOS
Estructura de tallas y aspectos reproductivos
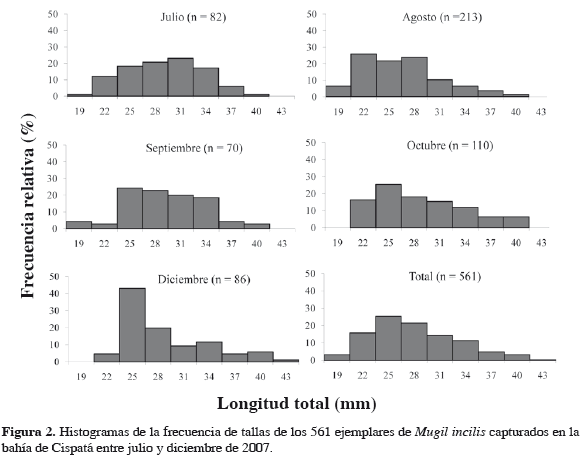
Se capturaron 561 ejemplares de M. incilis, siendo las áreas de mayores capturas playa Mireya, La Zona y playones de Corea (Figura 1). El ámbito de talla estuvo entre 17.5 y 44.5 cm de longitud total (LT), con un intervalo modal entre 23.5 y 26.5 cm de LT (Figura 2). La mayoría de ejemplares fueron jóvenes, lo que se refleja en el crecimiento alométrico minorante observado: W (g) = 0.01 LT2.83 (r2 = 0.92).
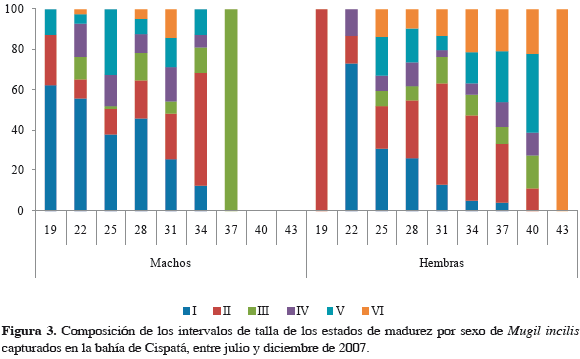
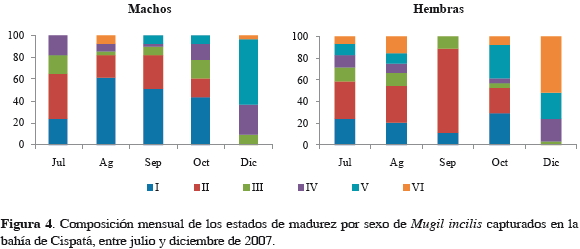
Fue posible determinar el sexo a 461 ejemplares, de los cuales 48% correspondieron a machos (n = 221) y 52% a hembras (n = 240), no presentándose una desviación significativa de la proporción 1:1 (χ2 = 0.39; p = 0.53). La composición porcentual de los estados de madurez por tallas para machos y hembras no evidencia una progresión en la madurez sexual gonadal relacionada directamente con el incremento en tamaño (Figura 3). Entre julio y octubre, el número de individuos inmaduros predominó sobre los maduros tanto en hembras como en machos (Figura 4). Los individuos en proceso de maduración o maduros aumentaron ostensiblemente su proporción en diciembre, con la aparición además de especímenes desovados.
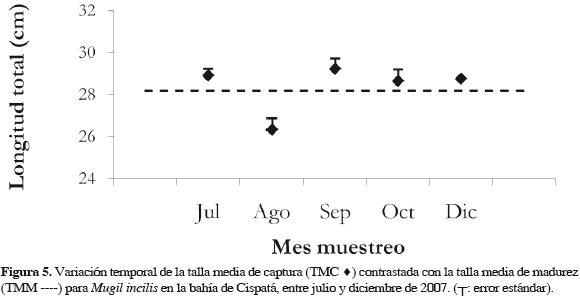
La talla mínima de madurez (20.5 cm para machos; 24.0 cm para hembras y 20.5 cm para sexos combinados) y media de madurez sexual (35.7 cm para machos; 30.3 cm para hembras y 30.5 cm para sexos combinados), indica que las hembras tienden a madurar más tempranamente que los machos. Al comparar la TMM con la talla media de captura de los individuos muestreados (TMC = 27.9 cm), se evidenció que generalmente la especie es capturada sin haber alcanzado la longitud necesaria para su primera madurez, a pesar de que en algunos meses la TMC para sexos combinados haya estado cerca de la TMM (Figura 5).
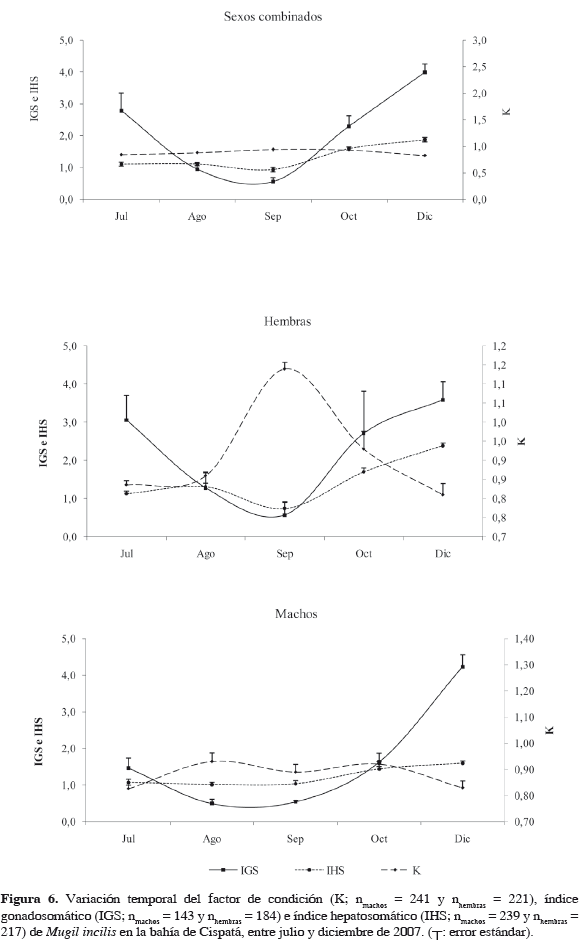
El valor mensual del factor de condición para sexos combinados fue aumentando hasta septiembre, cuando alcanzó un promedio máximo de 0.94 ± 0.04 y luego disminuyó en diciembre; al discriminar por sexos, la tendencia a lo largo del tiempo fue similar a la anteriormente descrita (Figura 6). El comportamiento del IGS e IHS en general fue inverso a K, con los valores más bajos en agosto y septiembre, y los más altos en julio y diciembre (Figura 6).
Composición y prevalencia de parásitos
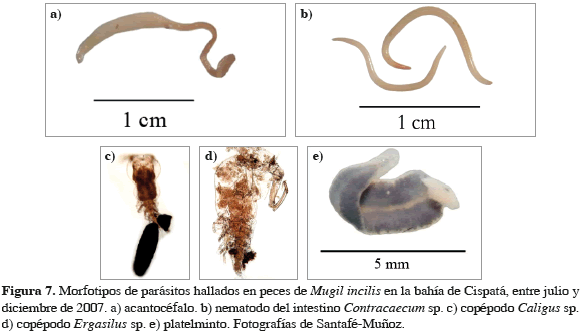
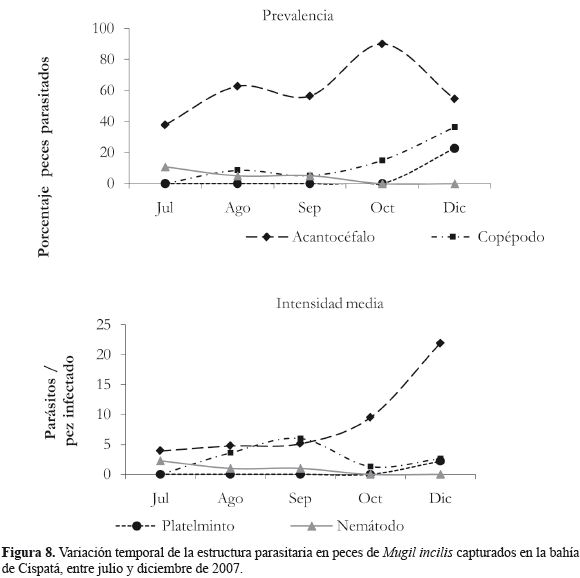
La composición parasitaria de M. incilis estuvo representada por cinco morfotipos: un acantocéfalo; los copépodos Caligus sp. y Ergasilus sp.; un platelminto y el nematodo Contracaecum sp. (Figura 7). En cuanto al grado de infestación se observó que el 65% (n = 115) de los peces estaban parasitados, con una intensidad media parasitaria de 5.4 parásitos/pez infestado. La abundancia promedio fue de 3.4 ± 0.5 parásitos/pez. Acantocéfalo fué el morfotipo más abundante (4.40 ± 0.80 parásitos/pez), seguidos por copépodos (0.31 ± 0.09 parásitos/pez), nematodos (0.08 ± 0.04 parásitos/pez) y finalmente por platelmintos (0.06 ± 0.03 parásitos/pez). En cuanto a la intensidad media parasitaria, los acantocéfalos representaron 7.5 parásitos/pez infestado, los copépodos presentaron 3.06 parásitos/pez infestado, seguidos por los platelmintos con 2.20 parásitos/pez infestado. La menor intensidad media se evidenció para los nematodos con 1.56 parásitos/pez infestado. En la Figura 8 se muestra el comportamiento temporal de este índice, de manera que el morfotipo nematodo disminuyó hacia el mes de diciembre, mientras que los acantocéfalos, platelmintos y copépodos se incrementaron hacia fin de año. La prevalencia máxima para los acantocéfalos se dio en octubre, mientras que los nematodos y copépodos en ese mismo período exhibieron un número menor de parásitos/pez infestado (Figura 8). A nivel de órganos, los acantocéfalos se encontraron en el intestino (sólo en un pez se detectó en branquias), los nematodos (Contracaecum sp), se encontraron parasitando tanto el hígado como el intestino, observándose diferencias cualitativas anatómicas entre individuos, ya que los parásitos del hígado se hallaron enrollados y envueltos por una cápsula de tejido delgado, mientras que los del intestino estaban libres. Los copépodos fueron registrados siempre en las branquias y los platelmintos en el hígado.
DISCUSIÓN
Estructura de tallas y aspectos reproductivos Aunque el ámbito de tallas de este estudio se encuentra dentro de los límites descritos por otros autores en el país, la longitud total máxima hallada (44.5 cm) fue menor a la registrada para M. incilis por Narváez et al. (2008), para la Ciénaga Grande de Santa Marta y Complejo de Pajarales (CGSM-CP) (49.0 cm de LT) pero mayor a la encontrada por Invemar (1999) para el antiguo delta del río Sinú (37.7 cm de LT); por Bustos y Pérez (2003) para la laguna de Camarones en La Guajira (37.9 cm de LT) y por Mármol et al. (2010) de 29.9 cm en la CGSM-CP. Esta comparación debe examinarse con precaución, ya que durante el muestreo realizado, únicamente se encontró un ejemplar de ese tamaño (44.5 cm). A nivel temporal se observó un mayor porcentaje de juveniles para los tres primeros meses de muestreo, a partir de septiembre y hasta fin de año fue incrementando el porcentaje de adultos (> 28.0 cm), sustentando la hipótesis de una migración con fines reproductivos de las ciénagas al mar adyacente, entre noviembre y marzo (Thomson, 1978; Blanco, 1980; Velasco y Villegas, 1985; Santos-Martínez y Acero, 1991).
En diciembre se observó la mayor cantidad de ejemplares maduros, incluyendo hembras desovadas, lo que parece indicar un pico reproductivo para este mes. Este evento coincide con lo descrito por Perdomo (1973), Blanco (1980) y Velasco y Villegas (1985), quienes consideran que la migración al mar y la temporada de desove para M. incilis suceden en el Caribe colombiano a finales del año. Mármol et al. (2010), afirman que cuando M. incilis se encuentra en su pico reproductivo es más apetecida comercialmente por su condición, contenido de ovarios maduros y vulnerabilidad debido que se desplaza en cardumen para la migración reproductiva. Por otro lado, Martínez et al. (2006) comprobaron que en la zona deltaica estuarina del río Sinú, área que comprende a la bahía de Cispatá, el trasmallo ejerce una presión negativa sobre M. incilis y otras especies de peces, cuando se usan tamaños de malla inferiores a 7.6 cm. Por lo anterior, se propone que en la bahía de Cispatá exista mayor control y vigilancia en la explotación de este recurso en diciembre, y restricciones totales sobre el uso de trasmallo con ojos de malla menores a 7.6 cm.
Para M. incilis la talla media de madurez determinada en este estudio correspondió a 30.5 cm, valor superior al definido por Velasco y Villegas (1985) para la ciénaga de Tesca, la cual fue de 22.5 cm de LT, y a los propuestos por Sánchez et al. (1998) y Mármol et al. (2010) para la CGSM-CP de 25.7 y 23.8 cm de LT, respectivamente. Las diferencias evidenciadas en este último ecosistema pueden ser explicadas por el grado de explotación al que se ha sometido la especie en la CGSM-CP, ya que la fuerte presión pesquera ejercida a través del tiempo ha reducido sus volúmenes y talla media de captura (Narváez et al., 2008). Según la relación entre la TMM y la TMC establecida para la bahía de Cispatá, M. incilis se halla afectada por la explotación pesquera, debido a que los individuos están siendo capturados por debajo o muy cercanos a la TMM durante los meses muestreados, de modo que la renovación natural de esta especie no ocurre de manera óptima.
Dentro de los índices biológicos, el factor de condición se mantuvo relativamente estable en el tiempo y debido a que presenta un comportamiento inverso al gonadosomático y hepatosomático, es más factible que no responda al período reproductivo, sino más bien a la oferta alimentaria del sistema (Yañez-Arancibia et al., 1985). Tanto el IGS como el IHS muestran un aumento hacia los meses de mayor madurez gonadal (julio-agosto y diciembre), tal y como lo documentaron Velasco y Villegas (1985), indicando que en esos momentos M. incilis se encuentran en su período reproductivo.
Composición y prevalencia de parásitos
Los morfotipos de parásitos hallados en M. incilis comprendieron dos grupos principales; el primero constituido por individuos pertenecientes a las clases Acanthocephala y Nematoda, que se caracterizan por tener ciclos de vida complejos que requieren la intervención de hospederos intermedios, generalmente invertebrados (Kinkelin et al., 1985). El segundo grupo compuesto por los platelmintos de vida libre y los copépodos de las familias Ergasilidae y Siphonostomatidae (clase Crustacea). Aunque el ciclo de vida de ambos es directo y no requiere de hospederos intermedios para completarlo, los últimos pasan por diversos estadios larvarios libres antes de la fijación del nuevo adulto en el pez (Kinkelin et al., 1985).
A nivel de morfotipos, de los parásitos observados el grupo más abundante es el de los acantocéfalos, los cuales no son considerados como organismos patógenos (Kinkelin et al., 1985). En este estudio sólo una reducida fracción de peces presentó un número de acantocéfalos superior a 10. Sin embargo, es importante resaltar que, aunque este grupo de parásitos en otros estudios no ha sido el más importante (Valles-Ríos et al., 2000; Olivero-Verbel et al., 2005), su alta abundancia en el presente trabajo constituye una base importante para que se elaboren investigaciones más detalladas que permitan explicar su representatividad. El hecho que los acantocéfalos sólo se hayan encontrado en el intestino, puede deberse a que estos organismos son parásitos permanentes, por lo que en este órgano podrían sobrevivir absorbiendo los nutrientes de su hospedero (Amlacher, 1964). Los nematodos del género Contracaecum presentes en el hígado se hallaron enrollados y envueltos por una cápsula de tejido delgado, similar a la descrita por Amlacher (1964). Pese a que su abundancia no fue la más alta, el registro de estos ejemplares tiene gran importancia por ser de interés zoonótico, razón por la cual el consumo de estos peces infestados puede representar un riesgo para la salud humana al consumirse crudos o semicocidos (Olivero-Verbel et al., 2005; Nuchjangreed et al., 2006).
AGRADECIMIENTOS
Esta investigación se realizó gracias al apoyo logístico y financiero de la Corporación Autónoma Regional de los Valles del Sinú y del San Jorge (CVS) y la Universidad de Bogotá Jorge Tadeo Lozano (UJTL), Facultad de Ciencias Naturales e Ingeniería, Programa de Biología Marina como parte del proyecto “Aspectos biológicos y ecológicos del cangrejo azul, chipichipi y mugílidos en la bahía de Cispatá”, ejecutado en el marco del Convenio Específico y de Cooperación Técnica No. 102/2006. Los autores agradecen especialmente a Iván Rey Carrasco y Rafael Espinosa Forero por su gestión y apoyo para el desarrollo de este proyecto, a los evaluadores anónimos por sus valiosos aportes para mejorar el manuscrito y al Instituto de Investigaciones Marinas y Costeras -Invemar-, por permitir a D. Bustos terminar con el proceso de publicación de este trabajo.
BIBLIOGRAFÍA
1 Álvarez-Lajonchere, L. 1976. Contribución al estudio del ciclo de vida de Mugil curema (Pisces: Mugilidae). Rev. Invest. Mar., 28: 1-130. [ Links ]
2 Amlacher, E. 1964. Manual de enfermedades de los peces. Editorial Acribia, Zaragoza, España. 319 p. [ Links ]
3 Anderson, R. O. y S. J. Gutreuter. 1983. Length, weight, and associated structural indices. 283-300. En: Nielsen, L. A. y D. L. Johnson (Eds.). Fisheries techniques. American Fisheries Society, Bethesda, EE. UU. 468 p. [ Links ]
4 Barreto, M., R. Barrera, J. Benavides, E. Cardozo, H. Hernández, L. Marín, B. Posada, C. Salvatierra, P. Sierra y A. Villa. 1999. Diagnóstico ambiental del golfo de Morrosquillo (Punta Rada, Tolú). Una aplicación de sensores remotos y SIG como contribución al manejo integrado de zonas costeras. Editorial IGAC/CIAF. Tolú, Colombia. 217 p. [ Links ]
5 Blanco, J. 1980. Algunos aspectos ecológicos y biológico-pesqueros de la lisa, Mugil incilis Hancock 1830, en la Ciénaga Grande de Santa Marta (Colombia) (Pisces: Mugilidae). Tesis Biol., Univ. Nacional de Colombia, Bogotá. 50 p. [ Links ]
6 Blanco, J. 1983. The condition factor of Mugil incilis Hancock (Pisces: Mugilidae) and its seasonal changes in the Ciénaga Grande de Santa Marta (Colombia). An. Inst. Invest. Mar. Punta Betín, 13: 133-142. [ Links ]
7 Bush, A. O., K. D. Lafferty, J. M. Lotz y A. W. Shostak. 1997. Parasitology meets ecology on its own terms. J. Parasitol., 84 (4): 575-583. [ Links ]
8 Bustos, D. y D. Pérez. 2003. Ecología trófica y algunos aspectos biológicos de las especies pertenecientes a las familias Mugilidae y Centropomidae en la laguna Navío Quebrado, Guajira, Caribe colombiano. Trabajo de grado, Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 122 p. [ Links ]
9 Cervigón, F. 1993. Los peces marinos de Venezuela. Vol. II. Fundación Científica los Roques, Caracas. 497 p. [ Links ]
10 Conrath, C. 2005. Reproductive biology. 103-126. En: Musik, J. y R. Bonfil (Eds.). Management techniques for elasmobranch fisheries. FAO Doc. Técn. Pesca 474, Roma. 251 p. [ Links ]
11 Gobernación de Córdoba. 2008. El departamento de Córdoba: geografía, hidrografía y orografía. <www.cordoba.gov.co>. 01/01/2008. [ Links ]
12 Harrison, I. J. 2002. Mugilidae. 1071-1083. En: Carpenter, K. E. (Ed.). The living marine resources of the Western Central Atlantic. Volume 2: Bony fishes, Part 1 (Acipenseridae to Grammatidae). FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5, FAO, Roma. 773 p. [ Links ]
13 Holden, M. y D. Raitt. 1975. Manual de ciencia pesquera. Parte 2. Métodos para investigar los recursos y su aplicación. Roma. Documento Técnico FAO, 115: 214 p. [ Links ]
14 Invemar. 1999. Diagnóstico y evaluación ecológica del antiguo delta del río Sinú con énfasis en la bahía de Cispatá y ciénagas aledañas. Informe final. Instituto de Investigaciones Marinas y Costeras (Invemar), Santa Marta. 168 p. [ Links ]
15 Invemar, Carsucre y CVS. 2002. Formulación del Plan de Manejo Integrado de la Unidad Ambiental Costera Estuarina del río Sinú y golfo de Morrosquillo, Caribe colombiano. Fase I: Caracterización y Diagnóstico. Instituto de Investigaciones Marinas y Costeras (Invemar), Corporación Autónoma Regional de Sucre (Carsucre) y Corporación Autónoma Regional de los Valles del Río Sinú y del San Jorge (CVS), Santa Marta. 802 p. [ Links ]
16 Kinkelin, P., C. Michel y P. Ghittino. 1985. Tratado de la enfermedades de los peces. Editorial Acribia, Zaragoza. 353 p. [ Links ]
17 Mármol, D., E. Viloria y J. Blanco. 2010. Efectos de la pesca sobre la biología reproductiva de la lisa Mugil incilis (Pisces: Mugilidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano. Bol. Invest. Mar. Cost., 39 (2): 215-231. [ Links ]
18 Martínez, H., J. C. Narváez B., R. Rivera y O. D. Solano. 2006. Evaluación de la selectividad del trasmallo en la pesquería artesanal de la zona deltaica estuarina del río Sinú, Caribe colombiano. Intrópica, 3 (1): 33-41. [ Links ]
19 Moreno, A. 1988. Estructura poblacional de post-larvas de camarones Penaeidae en la bahía de Cispatá, golfo de Morrosquillo, departamento de Córdoba, Colombia. Tesis Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Cartagena. 141 p. [ Links ]
20 Narváez, J., F. Herrera y J. Blanco. 2008. Efecto de los artes de pesca sobre el tamaño de los peces en una pesquería artesanal del Caribe colombiano. Bol. Invest. Mar. Cost., 37 (2): 163-187. [ Links ]
21 Nuchjangreed, C., Z. Hamzah, P. Suntornthiticharoen y P. Sorosjinda-Nuntawarasilp. 2006. Anisakids in marine fish from the coast of Chon Buri province, Thailand, Southeast Asian. J. Trop. Med. Public Health, 37 (3): 35-39. [ Links ]
22 Olaya, H., D., Centenaro, I. Leguízamo y F. Pineda. 1987. Los bosques de mangle del antiguo delta del río Sinú (Córdoba, Colombia). Estudio de la vegetación y aprovechamiento. Univ. Córdoba e Instituto Colombiano para el Fomento de la Educación Superior (Icfes), Montería. 30 p. [ Links ]
23 Olivero-Verbel, J., R. Baldiris-Ávila y B. Arroyo-Salgado. 2005. Nematode infection in Mugil incilis (lisa) from Cartagena bay and Totumo marsh, north of Colombia. J. Parasitol., 91 (5): 1109-1112. [ Links ]
24 Olsen, W. O. 1977. Parasitología animal. Vol II: Platelmintos, acantocéfalos y nematelmintos. Tercera edición, Editorial Aedos, Barcelona. 721 p. [ Links ]
25 Patiño, F. y F. Flórez. 1993. Ecología marina del golfo de Morrosquillo. Univ. Nacional de Colombia y Fondo FEN Colombia, Bogotá. 109 p. [ Links ]
26 Perdomo, J. 1973. Contribución al estudio biológico pesquero de la lisa Mugil incilis. Tesis Lic. Cienc. Mar., Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 57 p. [ Links ]
27 Rey, I. y A. Acero P. 2002. Biodiversidad íctica del Caribe colombiano. Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 190 p. [ Links ]
28 Roberts, J. 1981. Patología de los peces. Ediciones Mundi-Prensa, Madrid. 351 p. [ Links ]
29 Roa, R., B. Ernst y F. Tapia. 1999. Estimation of size at sexual maturity: an evaluation of analitycal and resampling procedures. Fish. Bull., (97): 570-580. [ Links ]
30 Rueda, M. y O. Defeo. 2003. Spatial structure of fish assemblages in a tropical estuarine lagoon: combining multivariate and geostatistical techniques. J. Exp. Mar. Biol. Ecol., 296: 93-112. [ Links ]
31 Sánchez, C., M. Rueda y A. Santos. 1998. Dinámica poblacional y pesquería de la lisa, Mugil incilis en la Ciénaga Grande de Santa Marta, Caribe colombiano. Rev. Acad. Colomb. Cienc., 22 (85): 507-517. [ Links ]
32 Sánchez-Páez, H., G. Ulloa-Delgado, H. Tavera-Escobar y W. Gil-Torres. 2005. Plan de manejo integral de los manglares de la zona de uso sostenible sector estuarino de la bahía de Cispatá, departamento de Córdoba. OIMT, CVS, Conif, Ministerio de Ambiente, Vivienda y Desarrollo Territorial, Bogotá. 202 p. [ Links ]
33 Santos-Martínez, A. y A. Acero P. 1991. Fish community of the Ciénaga Grande de Santa Marta (Colombia): composition and zoogeography. Ichthyol. Explor. Freshwater., 2 (3): 247-263. [ Links ]
34 Thomson, O. 1978. Mugilidae. 1071-1085. En: Fischer, W. (Ed). FAO species identification sheets for fishery purposes. Western Central Atlantic (Fishing Area 31), Vol. 3, FAO. Roma. 130 p. [ Links ]
35 Valles-Ríos, M., G. Ruiz-Campos y L. Galaviz-Silva. 2000. Prevalencia e intensidad parasitaria en Mugil cephalus (Pisces: Mugilidae) del río Colorado, Baja California, México. Rev. Biol. Trop., 48 (2-3): 495-501. [ Links ]
36 Velasco, A. y P. Villegas. 1985. Aportes al conocimiento de la historia de vida de Mugil incilis (Hancock, 1830), Mugil liza (Valenciennes, 1836) y Mugil curema (Valenciennes, 1836) en la ciénaga de Tesca (Bolívar, Colombia). Tesis Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Cartagena. 55 p. [ Links ]
37 Yamaguti, S. 1961. Sistema Helminthium. Interscience publishers, Inc. Nueva York. 679 p. [ Links ]
38 Yáñez-Arancibia, A., A. Lara-Domínguez, A. Aguirre-León, S. Díaz-Ruíz, F. Amezcua-Linares, D. Flores-Hernández y P. Chavance. 1985. Ecology of dominant fish populations in tropical estuaries: environmental factors regulating biological strategies and production. 311-365. En: Yáñez-Arancibia, A. (Ed.). Fish community ecology in estuaries and coastal lagoons: towards an ecosystem integration. UNAM Press, México. 654 p. [ Links ]
39 Zar, J. 2010. Biostatistical analysis. Prentice-Hall International, 5a. Edición, New Jersey, EE. UU. 960 p. [ Links ]
FECHA DE RECEPCIÓN: 09/06/2008 FECHA DE ACEPTACIÓN: 27/09/2012