Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.42 no.1 Santa Marta ene./jun. 2013
MORFOLOGÍA DEL SISTEMA DIGESTIVO DE LA RAYA MARIPOSA GYMNURA MICRURA (BATOIDEA: GYMNURIDAE)
MORPHOLOGY OF THE DIGESTIVE SYSTEM OF THE SMOOTH BUTTERFLY RAY GYMNURA MICRURA (BATOIDEA: GYMNURIDAE)
Abraham Kobelkowsky
Universidad Autónoma Metropolitana, Unidad Iztapalapa, Departamento de Biología, Laboratorio de Peces. Av. San Rafael Atlixco 186, Col. Vicentina, Iztapalapa, 09340 México, D. F., México. akd@xanum.uam.mx.
RESUMEN
Con el objeto de conocer la organización morfológica del sistema digestivo de la raya mariposa Gymnura micrura, se colectaron 23 ejemplares con red de arrastre en lagunas costeras y el litoral del estado de Veracruz en el golfo de México. Las muestras se fijaron en formaldehído y se conservaron en alcohol etílico. En el laboratorio, se realizó el análisis anatómico de los componentes del tracto digestivo y de sus glándulas anexas. Así mismo se llevó a cabo la comparación con especies representativas de las familias Rhinobatidae, Rajidae, Urotrygonidae y Dasyatidae, permitiendo reconocer que la organización general del sistema digestivo de G. micrura corresponde al patrón morfológico general de Batoidea. Sin embargo, se identificaron como diferencias significativas entre esta especie y las restantes rayas el carácter esbelto de las mandíbulas, el reducido volumen de la musculatura mandibular y la formación de dos lóbulos hepáticos anteriores bien definidos y separados entre sí. Se resalta como carácter morfológico compartido con otros Myliobatoidei, el número de dos lóbulos hepáticos posteriores. Se determinó el dimorfismo sexual dentario de la especie, consistente en el mayor tamaño de la cúspide de cada diente en los machos.
PALABRAS CLAVE: Batoidea, Gymnura, morfología, sistema digestivo, dimorfismo sexual dentario.
ABSTRACT
In order to know the morphological organization of the digestive system of the smooth butterfly ray Gymnura micrura, specimens were collected with a trawl net in coastal lagoons and littoral of the Gulf of Mexico. Samples were fixed in formaldehyde and preserved in ethylic alcohol. In the laboratory, the anatomic analysis of the digestive tract components and its glands, together with the comparison with representative species of the Rhinobatidae, Rajidae, Urotrygonidae, and Dasyatidae families, allowed for the recognition that the general organization of the digestive system of G. micrura fits to the general morphological pattern of Batoidea. However, some significant differences were recognized between this species and the remaining rays, such as the slender nature of its jaws, the reduced volume of the mandible musculature, and the welldefined development of two anterior hepatic lobes separated from each other. It is outstanding the number of two posterior hepatic lobes as a shared morphological character with other Myliobatoidei. This species shows sexual dental dimorphism, consisting in a greater size of the dental cuspid in each tooth of males.
KEY WORDS: Batoidea, Gymnura, morphology, digestive system, dental sexual dimorphism.
INTRODUCCIÓN
La raya mariposa Gymnura micrura (Bloch y Schneider) se distribuye en el Atlántico occidental, desde la bahía de Chesapeake, Estados Unidos, hasta Brasil; en el Atlántico oriental, desde Senegal hasta Congo; y en el Índico, desde India hasta Borneo (McEachran y Séret, 1990). La especie tiene una abundancia relativamente alta en aguas estuarinas de la costa septentrional de Sudamérica (Cervigón et al., 1992). Autores como Mejía-Falla et al. (2007) la registran en aguas estuarinas y costeras del Caribe colombiano.
Aunque los batoideos constituyen más del 50% de las especies de condrictios (Nelson, 2006), su anatomía ha sido escasamente estudiada. Mientras que en la literatura se encuentran más estudios sobre el endoesqueleto de las rayas (Capetta, 1987; Compagno, 1999), el sistema digestivo solo ha sido parcialmente descrito. Las mandíbulas y la musculatura de los batoideos han sido examinadas por autores como Nishida (1990), Wilga y Motta (1998), Liem y Summers (1999), Summers (2000), Pantano-Neto y de Souza (2002), González-Isáis (2003), Dean y Motta (2004) y Dean et al. (2005). El esqueleto visceral de las rayas ha sido descrito por autores como Miyake y McEachran (1991). La principal literatura sobre el sistema digestivo de los batoideos está orientada a su dentición (Kajiura y Tricas, 1966; Feduccia y Slaughter, 1974; McEachran, 1977; McCourt y Kerstitch, 1980; Taniuchi y Shimizu, 1993; Saez y Lamilla, 1997).
Entre los escasos trabajos sobre la morfología del tracto digestivo de los batoideos se encuentran Bertin (1958) y Holmgren y Nilsson (1999), quienes describen aspectos del intestino, y Kobelkowsky (2010), quien describe el sistema digestivo de Urotrygon chilensis y Dasyatis sabina. Particularmente sobre aspectos morfológicos del sistema digestivo del género Gymnura se encuentran los estudios de Miyake y McEachran (1991) sobre el esqueleto visceral de G. micrura, González-Isáis (2003) sobre la musculatura visceral de G. marmorata y G. micrura y Kobelkowsky (2004) sobre la esplacnología de G. micrura. Considerando la importancia del conocimiento de la morfología de los órganos implicados en la alimentación de las rayas con distribución en mares y sistemas estuarino lagunares del golfo de México, se tiene como objetivo la descripción morfológica del sistema digestivo de G. micrura.
MATERIALES Y MÉTODOS
Se obtuvieron 23 ejemplares de G. micrura, de varias tallas en las lagunas costeras de Pueblo Viejo, Tampamachoco y Alvarado, Estado de Veracruz, y en el litoral de dicho estado en el golfo de México, mediante el uso de una red de arrastre camaronera de prueba. Los ejemplares se fijaron con formaldehído al 10% y se conservaron en alcohol etílico al 70%. Se procesaron anatómicamente diez ejemplares adultos, de los cuales se retiró la piel de la región ventral del cuerpo, con el objeto de observar los músculos superficiales y el esqueleto apendicular. Se expuso y analizó la musculatura visceral retirando la piel tanto del dorso como del vientre de la región anterior.
Se separó la musculatura mandibular y se extrajeron las mandíbulas con el propósito de analizar su dentición bajo un microscopio estereoscópico Olympus SZ61. Se observó en ambas mandíbulas la secuencia de las hileras de dientes y la forma de los mismos, tanto en hembras como en machos. Se seleccionaron dos ejemplares adultos, hembra y macho, de aproximadamente la misma talla, de cuya dentición se tomaron fotografías mediante una cámara digital acoplada al microscopio estereoscópico.
Con la finalidad de exponer la cavidad visceral, así como también las cinturas escapular y pélvica, se removió la musculatura ventral hasta el nivel de la cloaca. Se quitaron las cinturas escapular y pélvica mediante secciones de sus extremos, permitiendo la vista completa de la cavidad visceral.
Se seccionaron transversalmente el esófago y el recto, así como también las venas hepáticas, para extraer el tracto digestivo y el hígado. Se separó el hígado mediante cortes del conducto del colédoco y los vasos sanguíneos adyacentes. Se practicó un corte frontal al tracto digestivo, con la finalidad de observar su superficie interna. Se realizó un corte sagital de la cavidad bucofaríngea, así como también se seccionaron transversalmente las cavidades bucofaríngea y visceral.
Se realizó una comparación cualitativa de la morfología del sistema digestivo de G. micrura con especies representativas de las familias Rhinobatidae (Rhinobatos lentiginosus Garman), Rajidae (Raja texana Chandler), Urotrygonidae [Urotrygon chilensis (Günther)] y Dasyatidae [Dasyatis sabina (LeSueur)]. La terminología de la musculatura visceral siguió el criterio de Liem y Summers (1999) y la del tracto digestivo el de Holmgren y Nilsson (1999). Las ilustraciones se realizaron mediante el uso de una cámara lucida acoplada a un microscopio estereoscópico Leica Wild M3Z.
RESULTADOS
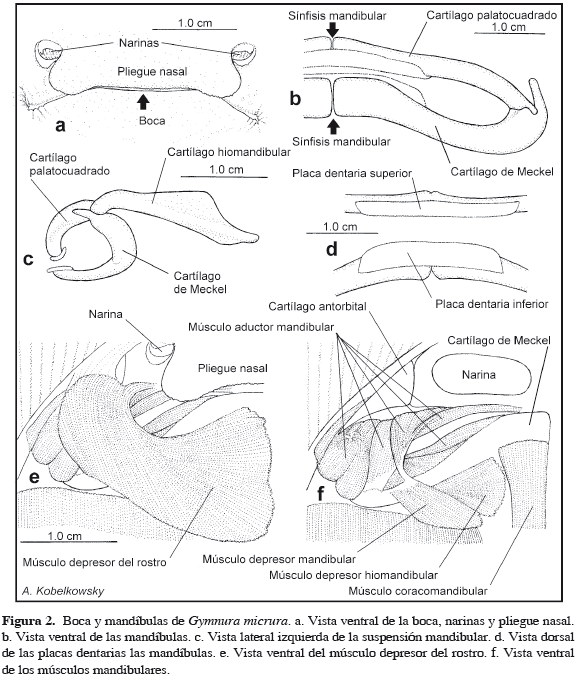
Boca y mandíbulas
La boca de la raya mariposa G. micrura es ventral (Figura 1) y está precedida por el pliegue nasal (Figura 2a), el cual se extiende entre las narinas. Las mandíbulas son delgadas y están formadas por los cartílagos palatocuadrados y los cartílagos de Meckel, los que muestran libres ambas sínfisis (Figura 2b). La mandíbula superior es más esbelta que la inferior. La distancia entre los extremos laterales de las mandíbulas es mayor que la anchura del neurocráneo. El cartílago palatocuadrado muestra un cóndilo articular, el cual se acopla a una fosa en el extremo lateral del cartílago de Meckel (Figura 2b), desde la que se desarrolla hacia delante un proceso anterior que (Figura 2c) recibe mediante ligamentos al hiomandibular.
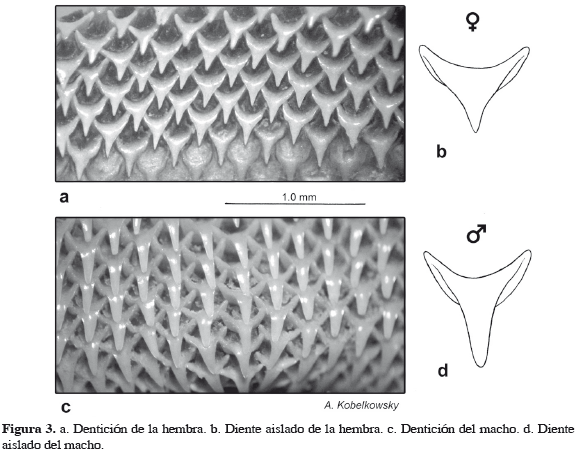
Los dientes de G. micrura son pequeños, numerosos y constituyen en conjunto placas dentarias (Figura 2d) soportadas por las mandíbulas y están organizados en 63 hileras verticales en la mandíbula superior y 51 en la inferior. Cada diente tiene una raíz y desarrolla una cúspide media aguda, la cual es más pronunciada en los machos que en las hembras (Figura 3).
La suspensión mandibular se da a través de los cartílagos hiomandibulares (Figura 2c), que se unen a las cápsulas óticas del neurocráneo y mediante fibras elásticas a los cartílagos de Meckel. Los hiomandibulares se encuentran separados del basihial, mientras que este se une con los hipobranquiales número 1.
Los músculos relacionados directa e indirectamente con las mandíbulas de G. micrura se encuentran cubiertos por el músculo depresor del rostro (depressor rostri) y son los siguientes: aductor mandibular (adductor mandibulae), que incluye al preorbital (preorbitalis), depresor mandibular (depressor mandibularis), elevador del palatocuadrado (levator palatoquadrati) y coracomandibular (coracomandibularis) (Figuras 2e y 2f). El músculo de mayor volumen y complejidad es el aductor mandibular, el cual está compuesto por varias secciones, que se extienden del cartílago de Meckel al cartílago palatocuadrado.
El preorbital, el cual se encuentra ventralmente al aductor mandibular, se origina en el borde posterior de la cápsula olfatoria y se inserta mediante un tendón en el borde posterior del cartílago de Meckel. El coracomandibular (Figura 2f) es un músculo impar, aplanado, que se origina dorsalmente a los dos coracoarcuales (coracoarcualis) y se inserta posterior a la sínfisis de la mandíbula inferior, cubriendo la glándula tiroides.
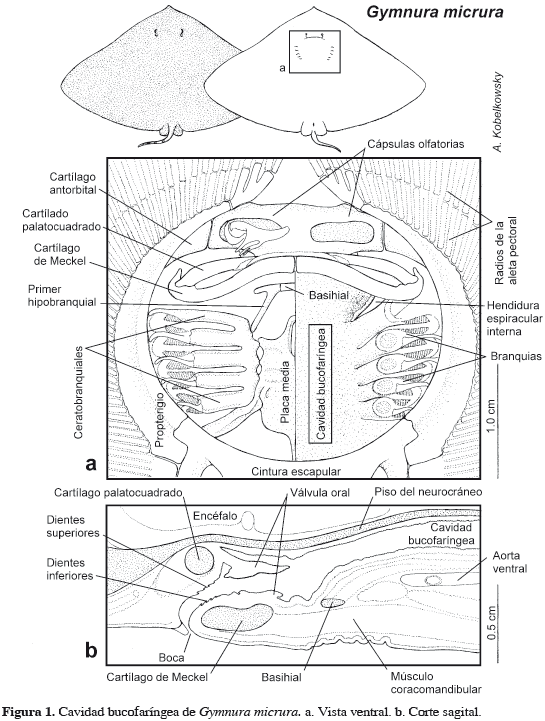
Cavidad bucofaríngea
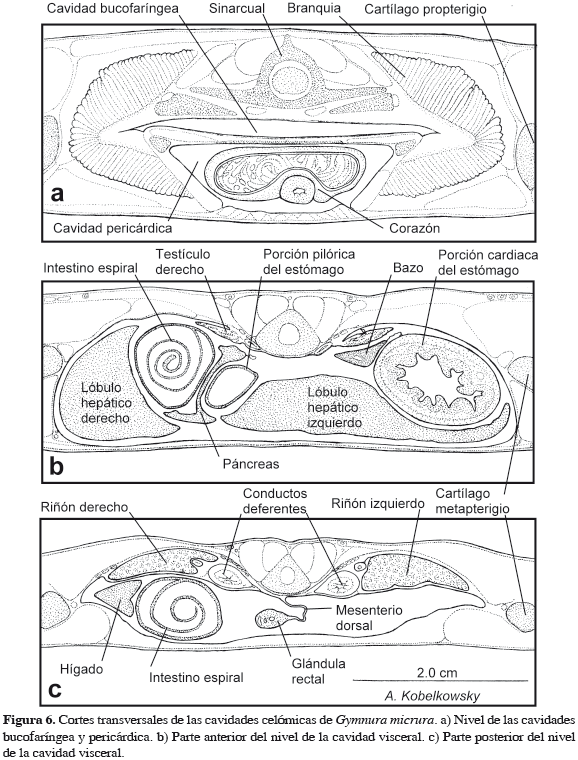
La cavidad bucofaríngea es deprimida (Figura 1b) y su aspecto ventral es circular (Figura 1a). Está delimitada anteriormente por la abertura bucal y las mandíbulas, posteriormente por el septo transverso y a los lados por los cartílagos propterigios; mientras que el techo de la cavidad bucofaríngea corresponde al piso del neurocráneo. El piso de la cavidad bucofaríngea está formado por el conjunto de cartílagos ceratobranquiales, el basihial, el primer hipobranquial y la amplia placa media (Figura 1a).
Inmediatamente detrás de la dentadura se forma la válvula oral, cuyo componente dorsal es considerablemente más amplio que el ventral (Figura 1b). En el techo de la cavidad se ubican las aberturas espiraculares internas (Figura 1a). Los cinco pares de hendiduras branquiales internas, separadas por las correspondientes branquias se extienden desde el techo hasta el piso de la cavidad bucofaríngea.
Cavidad visceral
La cavidad visceral es deprimida y su aspecto ventral es ovalado (Figura 4a). Se encuentra delimitada anteriormente por el septo transverso y la cintura escapular, lateralmente por los cartílagos metapterigios, ventralmente por la amplia cintura escapular y la musculatura axial y posteriormente por la cintura pélvica y las aletas pélvicas.
Tracto digestivo y glándulas anexas
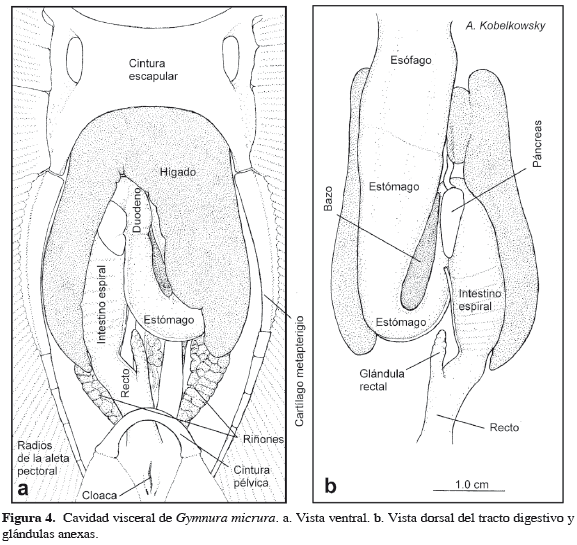
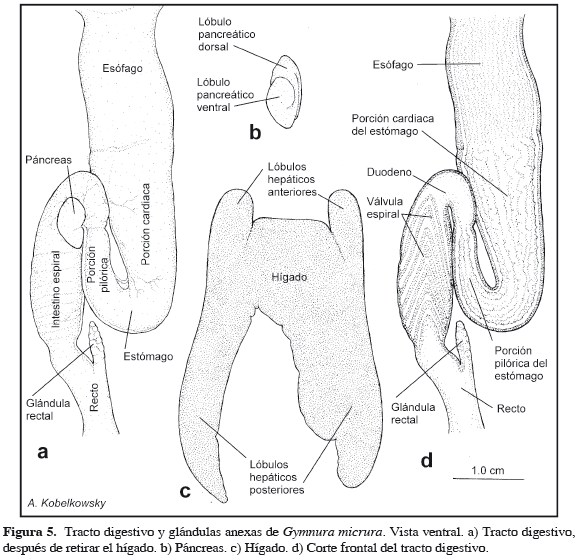
El esófago es recto, notablemente alargado (Figuras 4b, 5a), e internamente muestra numerosos pliegues y surcos finos (Figura 5d). El estómago ocupa la porción izquierda de la cavidad visceral y tiene forma de J, con la porción cardiaca más larga y ancha que la pilórica. Entre ambas porciones del estómago se localiza el bazo, el cual es oblongo (Figura 4b). La superficie interna del estómago muestra pliegues longitudinales paralelos, que disminuyen su grosor gradualmente desde la porción cardiaca hasta el píloro (Figura 5d).
El duodeno, el intestino espiral y el recto ocupan la porción derecha de la cavidad visceral. El duodeno es relativamente corto, forma una marcada curva y tiene la superficie interna lisa. El intestino espiral es de mediana longitud y muestra internamente el pliegue espiral con nueve vueltas, que forman conos pronunciados hacia delante (Figura 5d). El recto es relativamente largo, notablemente aplanado y en su parte anterior se ubica la glándula rectal. El mesenterio dorsal en esta especie se restringe a la glándula rectal y al recto (Figura 6c). El ano se abre a la cloaca, sin mostrar un esfínter definido. La abertura de la cloaca es longitudinal y se localiza en la parte ventral, posterior a la cintura pélvica y entre las aletas pélvicas (Figura 4a).
El hígado de G. micrura es deprimido y muestra bien definidos dos pequeños lóbulos anteriores y dos lóbulos posteriores grandes (Figura 5c). Los lóbulos anteriores están ventralmente cubiertos por la cintura escapular. Las venas hepáticas salen del hígado por la parte interna de cada lóbulo hepático anterior. De los lóbulos hepáticos posteriores, el izquierdo es más amplio y cubre de forma parcial al intestino (Figura 4a). La vesícula biliar se localiza en el contacto de ambos lóbulos hepáticos posteriores, cerca del duodeno. El conducto biliar entra al duodeno cerca del páncreas.
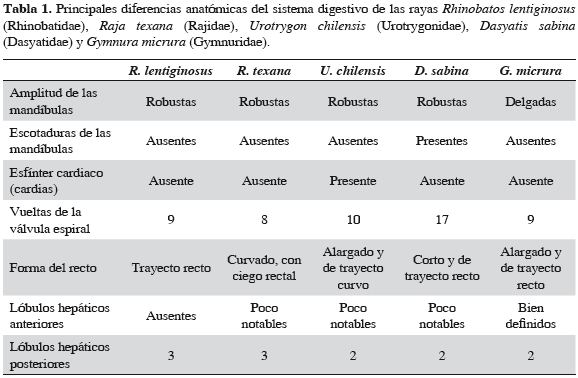
El páncreas es ovalado y está formado por dos lóbulos de superficie plana (Figuras 4b, 5b y 6b). El lóbulo ventral se localiza entre el duodeno y el intestino espiral, mientras que el lóbulo dorsal se ubica entre el bazo y el intestino espiral. De acuerdo con la Tabla 1, G. micrura difiere de R. lentiginosus (Rhinobatidae), R. texana (Rajidae), U. chilensis (Urotrygonidae) y D. sabina (Dasyatidae) principalmente en el carácter esbelto de las mandíbulas, el reducido volumen de la musculatura mandibular y en la mejor definición de los lóbulos hepáticos anteriores.
DISCUSIÓN
De acuerdo con las dietas registradas por varios autores (Kyne y Bennett, 2002; Lobato y da Silva, 2003; Morato et al., 2003; Dolgov, 2005; Scenna et al., 2006; Mejía-Falla et al., 2007; Belleggia et al., 2008; Bornatowski et al., 2010; Flores-Ortega et al., 2011; Jacobsen y Bennett, 2011; Lipej et al., 2012; López- García et al., 2012; Shibuda et al., 2012), los batoideos son depredadores que se alimentan principalmente de crustáceos y en segundo término de teleósteos bentónicos. Particularmente sobre la alimentación del género Gymnura solo se encuentra el trabajo de Jacobsen et al. (2009), quienes registran para G. australis una dieta principalmente de teleósteos.
En el presente estudio se reconoce que la organización del sistema digestivo de la raya mariposa G. micrura corresponde al patrón morfológico general de Batoidea, sin embargo, muestra algunas diferencias en las mandíbulas, en el volumen de la musculatura mandibular y en la forma del hígado. La posición ventral de la boca y la presencia de placas dentadas están relacionadas con el hábito bentófago de alimentación de la mayoría de los batoideos. El carácter libre de la sínfisis de los cartílagos palatocuadrados y de la de los cartílagos de Meckel y la individualidad de los dientes de G. micrura, contrasta con la fusión de las sínfisis de las especies de la familia Myliobatidae y la fusión de sus dientes en placas trituradoras, aspectos descritos por Summers (2000).
Mientras que el dimorfismo sexual dentario ha sido observado en especies de Urolophus, Urotrygon, Raja, Breviraja, Bathyraja y Dasyatis (Feduccia y Slaugther, 1974; McEachran, 1977; McCourt y Kerstich, 1980; Taniuchi y Shimizu, 1993; Kajiura y Tricas, 1996; Saez y Lamilla, 1997; Kobelkowsky, 2010), este es el primer registro en una especie de Gymnura. Varios autores concluyen que el dimorfismo sexual dentario no implica diferencias en la dieta entre sexos, sin embargo, es importante en la reproducción (McEachran, 1977; Morato et al., 2003; Scenna et al., 2006).
Comparativamente con otros batoideos, las mandíbulas de G. micrura corresponden en términos generales al patrón morfológico descrito por Liem y Summers (1999) en R. erinacea, por Dean y Motta (2004) en N. brasiliensis y, particularmente, al descrito por González-Isáis (2003) en el género Gymnura. Esta última autora comenta que la musculatura cefálica y branquial de las rayas es más compleja que la de los tiburones, lo cual se manifiesta en el presente estudio sobre G. micrura, reconociéndose como el músculo más complejo al aductor mandibular, por estar formado por varias secciones, con fibras musculares en diferentes sentidos. La masa de la musculatura mandibular de G. micrura es notablemente menor a la de otras rayas como N. brasiliensis, R. texana, U. chilensis y D. sabina ya que solamente cubre cerca del 30% del cartílago de Meckel, mientras que en las restantes especies lo hace en más del 50%. Autores como Wilga y Motta (1998) y Dean y Motta (2004) denominan al aductor mandibular como cuadratomandibular (quadratomandibular) en R. lentiginosus y N. brasiliensis.
La morfología del tracto digestivo de G. micrura corresponde en general a la descrita en otros batoideos, con la excepción de la presencia del esfínter cardiaco que Kobelkowsky (2010) señala en U. chilensis. Aunque la forma del estómago de G. micrura coincide con el patrón morfológico general de los elasmobranquios, descrito por Holmgren y Nilsson (1999), se identifica como un carácter exclusivo de la especie en estudio la menor longitud relativa de la región pilórica.
De acuerdo con Wilson y Castro (2011), la función de la cavidad bucofaríngea de los peces es adquirir y procesar mecánicamente el alimento, la del esófago conducirlo, la del estómago iniciar la digestión química, la del duodeno continuarla y la del intestino espiral absorberlo. Como en otros elasmobranquios, la presencia del pliegue espiral del intestino en G. micrura implica un aumento del área de absorción del alimento y el número de vueltas puede tener valor taxonómico. El intervalo del número de vueltas de 8 a 17 de dicho pliegue en las especies de rayas comparadas en el presente trabajo, contrasta con el que registra Bertin (1958) de dos o tres en el holocéfalo Chimaera monstrosa y de 50 del tiburón peregrino Cetorhinus maximus.
Mientras que en otros batoideos, como R. lentiginosus, R. texana, U. chilensis y D. sabina, los lóbulos hepáticos anteriores son extensiones redondeadas poco notables del hígado, en G. micrura están bien definidos y diferenciados del resto del órgano. La especie en estudio muestra, como en U. chilensis y D. sabina, dos lóbulos hepáticos posteriores, carácter que podría ser común de los Myliobatoidei. Aparentemente la diferencia en la definición de los lóbulos hepáticos anteriores y en el número de los lóbulos hepáticos posteriores es resultado del desarrollo embrionario del hígado en los espacios entre las paredes de la cavidad visceral y el tracto digestivo.
Entre las múltiples funciones del hígado se encuentran las relacionadas con la alimentación como el metabolismo del alimento y la formación de la bilis y, de acuerdo con autores como Phleger (1998), además está implicado en la flotabilidad de los peces. Así, las rayas, como peces bentónicos, tienen una flotabilidad negativa, que implica que para nadar y mantenerse fuera del sustrato deben liberar energía, mientras que en los tiburones el hígado contiene una gran cantidad de escualeno y otros lípidos, que les proporcionan una flotabilidad positiva. La descripción general de la morfología del sistema digestivo de G. micrura contribuye a la ulterior interpretación de los mecanismos de obtención, transporte y procesamiento del alimento de la especie, y proporciona caracteres a considerar en estudios filogenéticos de los Myliobatoidei.
BIBLIOGRAFÍA
1 Belleggia, M., E. Mabragaña, D. E. Figueroa, L. B. Scenna, S. A. Barbini y J. M. Díaz de Astarloa. 2008. Food habits of the broad nose skate, Bathyraja brachyurops (Chondrichthyes, Rajidae), in the southwest Atlantic. Scientia Marina, 72: 701-710. [ Links ]
2 Bertin, L. 1958. Appareil digestif. 1248-1302. En: Grassé, P. P. (Ed.). Traité de Zoologie. Anatomie, Systematique, Biologie. Vol. 13. Masson et Cie Éditeurs. París. 2396 p. [ Links ]
3 Bornatowski, H., R. M. de Castro y L. Costa. 2010. Feeding of guitarfish Rhinobatos percellens (Walbaum, 1972) (Elasmobranchii, Rhinobatidae) the target of artisanal fishery in southern Brazil. Braz. J. Oceanogr., 58: 45-52. [ Links ]
4 Capetta, H. 1987. Chondrichthyes II. Mesozoic and Cenozoic Elasmobranchii. Gustav Fischer Verlag, Stuttgart, Nueva York. 192 p. [ Links ]
5 Cervigón, F., R. Cipriano, W. Fischer, L. Garibaldi, M. Hendrickx, A. J. Lemus, R. Márquez, J. M. Poutiers, G. Robaina y B. Rodríguez. 1992. Guía de campo de las especies comerciales marinas y de aguas salobres de la costa septentrional de Sur América. Organización de las Naciones Unidas para la Agricultura y la Alimentación, Roma. 523 p. [ Links ]
6 Compagno, L. J. V. 1999. Checklist of living elasmobranchs. 471-498. En: Hamlett, W. C. (Ed.). Sharks, skates, and rays. The biology of elasmobranch fishes. The John Hopkins University Press, Baltimore. 514 p. [ Links ]
7 Dean, M. N. y P. J. Motta. 2004. Anatomy and functional morphology of the feeding apparatus of the lesser electric ray, Narcine brasiliensis (Elasmobranchii: Batoidea). J. Morphol., 262: 462-483. [ Links ]
8 Dean, M. N., D. R. Huber y H. A. Nance. 2005. Functional morphology of jaw trabeculation in the lesser electric ray Narcine brasiliensis, with comment on the evolution of structural support in the Batoidea. J. Morphol., 267: 1137-1146. [ Links ]
9 Dolgov, A.V. 2005. Feeding and food consumption by the Barents Sea skates. J. Northw. Atl. Fish. Sc., 35: 495-503. [ Links ]
10 Feduccia, A. y B. H. Slaughter. 1974. Sexual dimorphism in skates (Rajidae) and its possible role in differential niche utilization. Evolution, 28: 164-168. [ Links ]
11 Flores-Ortega, J. R., E. Godínez-Domínguez, G. González-Sansón, J. A. Rojo-Vázquez, A. Corgos y M. Y. Morales-Jáuregui. 2011. Feeding habits of three round stingrays (Rajiformes: Urotrygonidae) in the central Mexican Pacific. Cienc. Mar., 37: 279-292. [ Links ]
12 González-Isáis, M. 2003. Anatomical comparison of the cephalic musculature of some members of the superfamily Myliobatoidea (Chondrichthyes): Implications for evolutionary understanding. Anat. Rec. Part A., 271a: 259-272. [ Links ]
13 Holmgren, S. y S. Nilsson. 1999. Digestive system. 144-173. En: Hamlett, W. C. (Ed.). Sharks, skates, and rays. The biology of elasmobranch fishes. The John Hopkins University Press, Baltimore. 514 p. [ Links ]
14 Jacobsen, I. P. y M. B. Bennett. 2011. Feeding ecology and dietary comparisons among three sympatric Neotrygon (Myliobatoidei: Dasyatidae) species. J. Fish. Biol., 80: 1580-1594. [ Links ]
15 Jacobsen, I. P., J. W. Johnson y M. B. Bennett. 2009. Diet and reproduction in the Australian butterfly ray Gymnura australis from northern and north-eastern Australia. J. Fish. Biol., 75: 2475-2489. [ Links ]
16 Kajiura, S. M. y T. C. Tricas. 1966. Seasonal dynamics of dental dimorphism in the Atlantic stingray Dasyatis sabina. J. Exp. Biol., 199: 2297-2306. [ Links ]
17 Kobelkowsky, A. 2004. Esplacnología de la raya mariposa Gymnura micrura (Rajiformes: Gymnuridae). Vertebrata Mexicana, 14: 1-8. [ Links ]
18 Kobelkowsky, A. 2010. Anatomía comparada del sistema digestivo de las rayas Urotrygon chilensis y Dasyatis sabina (Myliobatiformes). Rev. Chil. Hist. Nat., 83: 387-394. [ Links ]
19 Kyne, P. M. y M. B. Bennett. 2002. Diet of the Eastern shovelnose ray, Aptychotrema rostrata (Shaw and Nodder, 1794), from Moreton Bay, Queensland, Australia. Mar. Freshwater. Res., 53: 679-686. [ Links ]
20 Liem, K. F. y A. P. Summers. 1999. Muscular system. Gross anatomy and functional morphology of muscles. 93-114. En: Hamlett, W. C. (Ed.). Sharks, skates, and rays. The biology of elasmobranch fishes. The John Hopkins University Press, Baltimore. 314 p. [ Links ]
21 Lipej, L., B. Mauric, D. Paliska y C. Capapé. 2012. Feeding habits of the pelagic stingray Pteroplatytrygon violacea (Chondrichthyes: Dasyatidae) in the Adriatic Sea. J. Mar. Biol. Assoc. UK., 2012: 1-6. [ Links ]
22 Lobato, C. y Z. da Silva. 2003. Hábito alimentar de Urotrygon macrophthalmum Delsman, 1941 (Elasmobranchii, Urolophidae) em Tutóia-Maranhao. Bol. Lab. Hidrobiol., 16: 47-54. [ Links ]
23 López-García, J., A. F. Navia, P. A. Mejía-Falla y E. A. Rubio. 2012. Feeding habits and trophic ecology of Dasyatis longa (Elasmobranchii: Myliobatiformes): sexual, temporal and ontogenetic effects. J. Fish Biol., 80: 1563-1579. [ Links ]
24 McCourt, R. M. y A. N. Kerstich. 1980. Mating behavior and sexual dimorphism in dentition in the stingray Urolophus concentricus from the Gulf of California. Copeia, 1980: 900-901. [ Links ]
25 McEachran, J. D. 1977. Replay to "sexual dimorphism in skates (Rajidae)". Evolution, 31: 218-220. [ Links ]
26 McEachran, J. D. y B. Séret. 1990. Gymnuridae. 64-66. En: Quero, J. C., J. C. Hureau, C. Karrer, A. Post y L. Saldanha (Eds.). Checklist of the fishes of the Eastern tropical Atlantic, Vol. 1. JNICT, Lisboa, SEI, París y Unesco, París. 1492 p. [ Links ]
27 Mejía-Falla, P. A., A. F. Navia, L. M. Mejía-Ladino, A. Acero P. y E. A. Rubio. 2007. Tiburones y rayas de Colombia (Pisces Elasmobranchii): lista actualizada, revisada y comentada. Bol. Invest. Mar. Cost., 36: 111-149. [ Links ]
28 Miyake, T. y J. D. McEachran. 1991. The morphology and evolution of the ventral gill arch skeleton in batoid fishes (Chondrichthyes: Batoidea). Zool. J. Lin. Soc., 102: 75-100. [ Links ]
29 Morato, T., M. Encarnación Solá y G. Menezes. 2003. Diets of thornback ray (Raja clavata) and tope shark (Galeorhinus galeus) in the bottom longline fishery of the Azores, northeastern Atlantic. Fish. Bull., 101: 590-602. [ Links ]
30 Nelson, J. S. 2006. Fishes of the world. John Wiley and Sons, Inc., Nueva York. 601 p. [ Links ]
31 Nishida, K. 1990. Phylogeny of the suborder Myliobatoidei. Mem. Fac. Fish. Hokkaido Univ., 37: 1-108. [ Links ]
32 Pantano-Neto, J. y A. M. de Souza. 2002. Anatomia da musculatura orobranquial associada à alimentaçao de duas espécies de raias de água doce (Potamotrygonidae: Elasmobranchii). Publs. Avulsas Inst. Pau. Brasil, 5: 53-66. [ Links ]
33 Phleger, C. F. 1998. Buoyancy in marine fishes: direct and indirect role of lipids. Amer. Zool., 38: 321-330. [ Links ]
34 Saez, S. y G. J. Lamilla. 1997. Morfología y disposición de los dientes en una especie con heterodontia sexual: Raja (Dipterus) chilensis Guichenot, 1848. Biol. Pesq., 26-41. [ Links ]
35 Scenna, L. B., S. B. García de la Rosa y J. M. Díaz de Astarloa. 2006. Trophic ecology of the Patagonian skate, Bathyraja macloviana, on the Argentine continental shelf. ICES J. Mar. Sci., 63: 867-874. [ Links ]
36 Shibuda, A., J. Zuanon y S. Tanaka. 2012. Feeding behaviour of the neotropical freshwater stingray Potamotrygon motoro (Elasmobranchii: Potamotrygonidae). Neotrop. Ichthyol., 10: 189-196. [ Links ]
37 Summers, A. P. 2000. Stiffening the stingray skeleton. An investigation of durophagy in myliobatid stingrays (Chondrichthyes, Batoidea, myliobatidae). J. Morphol., 243: 113-126. [ Links ]
38 Taniuchi, T. y M. Shimizu. 1993. Dental sexual dimorphism and food habits in the stingray Dasyatis akajei from Tokyo Bay, Japan. Nippon Suisan Gakk, 59: 53-60. [ Links ]
39 Wilga, C. D. y P. J. Motta. 1998. Feeding mechanisms of the Atlantic guitarfish Rhinobatos lentiginosus: modulation of kinematic and motor activity. J. Exp. Biol., 201: 3167-3184. [ Links ]
40 Wilson, J. M. y L. F. C. Castro. 2011. Morphological diversity of the gastrointestinal tract in fishes. 1-55. En: Grosell, M., A. P. Farrell y C. J. Brauner (Eds.). The multifunctional gut of fish. Academic Press, Ámsterdam. 444 p. [ Links ]
FECHA DE RECEPCIÓN: 25/04/2011 FECHA DE ACEPTACIÓN: 05/12/2012