Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.42 no.1 Santa Marta ene./jun. 2013
INFLUENCIA DE LA DENSIDAD LARVAL INICIAL DE SIEMBRA Y LA CONCENTRACIÓN DE ALIMENTO SOBRE LA LARVICULTURA DE ARGOPECTEN NUCLEUS (OSTREOIDA: PECTINIIDAE)*
INFLUENCE OF LARVAL DENSITY AT THE INITIAL SEEDING AND THE CONCENTRATION OF FOOD ON ARGOPECTEN NUCLEUS LARVICULTURE (OSTREOIDA: PECTINIIDAE)
Ernesto Acosta Ortiz y Javier Gómez-León
Instituto de Investigaciones Marinas y Costeras (Invemar), Grupo de Bioprospección Marina, El Rodadero, Santa Marta, Colombia. eracorz77@hotmail.com, javier.gomez@invemar.org.co.
RESUMEN
Aun cuando Argopecten nucleus es un pectínido nativo del Caribe colombiano que presenta gran potencial para cultivo, su producción a gran escala se enfrenta con la escasez de semilla en el medio natural. Por tal motivo, la producción de semilla en el laboratorio es la fuente más prometedora. Dentro de los numerosos estudios que se han realizado al respecto, no se ha logrado un consenso sobre la alimentación y densidad larval durante el cultivo. El presente estudio determinó el efecto conjunto de la densidad inicial de siembra y de la ración alimenticia, utilizando tres densidades (5, 10 y 15 larvas mL-1) y tres concentraciones de microalgas Isochrysis galbana (20000, 40000 y 70000 células mL-1). Se evaluó la supervivencia larval, el crecimiento, la deformidad, el estado de condición de la glándula digestiva (llena, semillena y vacía) y la aparición de la mancha ocular. Se determinó que no hubo interacción entre los factores con respecto a la supervivencia, crecimiento y deformidad, pero sí sobre el estado de condición. No se obtuvieron diferencias significativas en la supervivencia con ninguna de las combinaciones probadas, mientras que la densidad larval ejerció gran influencia sobre el crecimiento y el estado de condición, siendo mayor en los cultivos con 10 y 15 larvas mL-1. En ninguno de los casos hubo influencia significativa por parte de la concentración de alimento. Aun así, los porcentajes obtenidos con la combinación de 10 larvas mL-1 y 20000 células mL-1 de alimento (L10-20C) en la mayoría de las variables medidas presentaron los mayores valores. En este experimento no se obtuvieron larvas con mancha ocular.
PALABRAS CLAVE: Argopecten nucleus, densidad, alimento, supervivencia, crecimiento.
ABSTRACT
Argopecten nucleus is a scallop bivalve native from the Colombian Caribbean, with great potential culture, but the critic point for a large-scale production is the scarce seed spat available in the environment. For this reason, its production in the laboratory is the most promising source. There is no consensus about feeding with respect to the larval sowing density after several studies, since generally each factor is worked separately. Therefore, in this research we studied the joint effect of the larval initial density and the feed ration, testing three different densities, 5, 10, and 15 larvae mL-1 and three feed concentrations, 20000, 40000, and 70000 cells mL-1 of Isochrysis galbana, over the surviving, growth, condition state (full, halffull, and empty larvae), deformity or malformation, and development of the eye spot. There was not interaction between factors with regard to surviving, growth, and deformity, but over condition state. There were not significant differences with regard to survival with any of combinations tested, whereas larval density make a greatly influence in the growth and condition state, being higher in the 10 and 15 larvae mL-1 culture for the first variable and in the 10 larvae mL-1 culture for the second one. There was no significant influence by feed concentration in any case. Even so, the percentages obtained with the combination of 10 larvae mL-1 and 20000 cells mL-1 of food (L10-20C) was higher in most cases. There were not eye spot larvae in this experiment.
KEY WORDS: Argopecten nucleus, density, food, survival, growth.
INTRODUCCIÓN
El cultivo de bivalvos pectínidos o pectinicultura se considera dentro de la maricultura como una de las actividades con mayor rentabilidad, presentando en la última década un crecimiento superior al 100% (Velasco, 2008). El éxito alcanzado por esta actividad ha permitido el nacimiento de toda una industria en torno al cultivo de estos organismos en países como Noruega, Inglaterra, China, Japón y algunos cercanos como México, Chile y Perú (Akaboshi e Illanes, 1983; Lobos, 1992; Illanes, 1995; Maeda et al., 1996). Sin embargo, a pesar de que en alguno de estos países es posible la captación de semilla del medio natural, aun dependen en gran medida de la semilla producida en laboratorio para abastecer los cultivos en el mar (Helm et al., 2006).
En Colombia, el cultivo de pectínidos inició en 1994 con la identificación del potencial para cultivo de varias especies, destacándose entre estas Argopecten nucleus por su rápido crecimiento, producción de carne y por tener un cultivo intermedio y final relativamente económico (Urban, 1999). Esta especie se distribuye desde el sureste de Florida, el golfo de México y el mar Caribe, hasta Surinam (Díaz y Puyana, 1994). Habita fondos arenosos y con presencia de pastos marinos, especialmente en zonas arrecifales desde 10 hasta 50 m de profundidad (Lodeiros et al., 1993; Díaz y Puyana, 1994), posee fecundación externa y presenta hermafroditismo funcional (Urban, 1999).
A pesar de ser un pectínido nativo del Caribe colombiano, la abundancia de su semilla en el medio natural es baja, variable y poco predecible (De la Roche y Vélez, 1997; Valero et al., 2000), por lo que la producción en laboratorio se considera como la única fuente de abastecimiento confiable de esta. En este sentido, en los últimos años se han realizado grandes avances en las metodologías necesarias para la producción de semilla de esta especie en Colombia (Urban, 1999; Velasco et al., 2007; Velasco y Barros, 2008), lográndose la inducción al desove, el cultivo larval y la obtención de semilla a nivel experimental, permitiendo entender el proceso de desarrollo y crecimiento de larvas y postlarvas de esta especie. Sin embargo, los costos de producción son aún demasiado altos, lo cual obliga al desarrollo de investigaciones tendientes a optimizar los procesos de producción y, de esa manera, reducir los costos en el laboratorio.
Dentro de la producción de semilla de moluscos bivalvos, la larvicultura es una de las etapas de mayor costo y en donde también se presentan las mayores mortalidades. Entre las principales causas que influyen en el aumento de los costos y la mortalidad en la larvicultura, se encuentra el manejo de la densidad larval y la concentración del alimento suministrado. En este sentido, autores como McDonald (1988), Ortiz (1994) y Uriarte et al. (2001) indican que el correcto manejo de la densidad durante el cultivo es un factor determinante en la supervivencia y crecimiento de las larvas. Del mismo modo, se ha establecido que concentraciones muy altas o demasiado bajas de alimento tienen un efecto negativo en el crecimiento de las larvas (Bayne, 1983; Lu y Blake, 1996; Uriarte et al., 2001), además, las microalgas residuales, es decir las no consumidas, tienen efectos tóxicos y microbiológicos al descomponerse, que pueden afectar la supervivencia de las larvas (Rojas et al., 1988). A pesar de la importancia en la determinación de la ración alimenticia y de la gran cantidad de estudios que existen con relación a este tema, no hay un consenso para la alimentación de larvas de pectínidos la cual, según autores como Blacio y Álvarez (2001), Farías-Molina (2001) y Winkler y Estévez (2003) entre otros, varía desde 4000 hasta 50000 células mL-1, para especies como Argopecten purpuratus, A. circularis y Nodipecten nodosus.
Finalmente, Helm et al. (2006) sostienen que el aumento de la densidad larval, sumado a un adecuado manejo en la alimentación, podría elevar significativamente los niveles de producción de un laboratorio, sin incrementar el componente de mano de obra necesaria para su manejo. Por las razones expuestas anteriormente en este estudio se investigó la influencia de tres densidades iniciales de cultivo larval y tres concentraciones de alimento sobre la supervivencia, estado de condición y crecimiento de las larvas de A. nucleus.
ÁREA DE ESTUDIO
Las larvas fueron obtenidas de reproductores provenientes de la estación experimental de cultivo de bivalvos del Invemar, ubicada en la bahía de Nenguange (playa del Muerto) (11°20'N, 74°05'W), Parque Natural Nacional Tayrona, Santa Marta. La temperatura del agua de mar oscila entre 22 y 30 °C según la época del año y la salinidad entre 33 y 37 (López et al., 2010). Los experimentos de larvicultura se realizaron cerca a la costa, a 4 km de Punta Canoa, corregimiento de Cartagena (Bolívar) (10º23'N, 75°32'W) en las instalaciones de la empresa camaronera Hidrocultivos de la Costa Ltda.
MATERIALES Y MÉTODOS
Colecta, maduración en laboratorio, desove de reproductores y fecundación
Se realizó una selección de los reproductores por el método directo de observación de la apariencia morfocromática de la gónada (Velasco, 2008), escogiendo entre 20 y 30 individuos de A. nucleus en un estado avanzado de madurez sexual. Los organismos colectados se transportaron dentro de cavas térmicas entre esponjas húmedas, mantenidas a una temperatura aproximada de 21 °C, para evitar que se produjeran desoves espontáneos al llegar al laboratorio. Una vez allí, los organismos se aclimataron a 25 °C, manteniéndolos en agua de mar filtrada (AMF) a 5 µm con aireación suave, con una concentración constante de 40000 células mL-1 de las microalgas Isochrysis galbana, Chaetoceros calcitrans y Tetraselmis suecica, en una relación 1:1:1 y una salinidad de 33.5 ± 2.1 durante 10 días, tiempo en el cual alcanzaron el máximo estado de madurez sexual. Posteriormente, se seleccionaron 20 individuos, los cuales se indujeron al desove por medio de choques térmicos (de 23 a 28 °C, cada 30 minutos), y exposición a desecación por 5 minutos cada 30 minutos, sumado a un proceso de irradiación constante con luz UV del agua utilizada. Los ovocitos y espermatozoides obtenidos fueron combinados en una relación espermatozoide:ovocito de 100:1 por 30 minutos.
Experimentos de densidad inicial larval y concentración de alimento
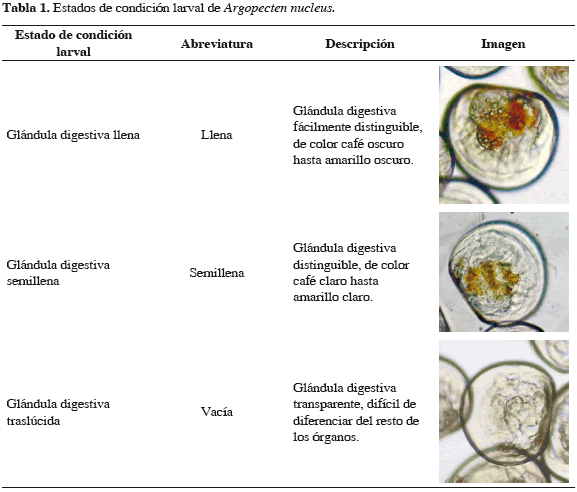
Con el fin de determinar el efecto de la densidad inicial larval y la concentración de alimento sobre el crecimiento, la supervivencia y deformidad, al igual que sobre el estado de condición de la glándula digestiva (Tabla 1) y la aparición de la mancha ocular de las larvas de A. nucleus, se llevó a cabo un experimento factorial en el que se evaluaron tres densidades iniciales de cultivo: 5 larvas mL-1 (L5); 10 larvas mL-1 (L10); 15 larvas mL-1 (L15) y tres diferentes concentraciones de alimento, utilizando la microalga Isochrysis galbana: 20000 células mL-1 (20C), 40000 células mL-1 (40C) y 70000 células mL-1 (70C), evaluando la influencia de cada uno de estos factores por medio de las siguientes combinaciones: L5-20C; L10-20C; L15-20C; L5-40C; L10-40C; L15-40C; L5- 70C; L10-70C y L15-70C.
Cada tratamiento estuvo constituido por dos réplicas, conformada cada una por un tanque de policarbonato de 15 L, provisto de AMF a 1 µm e irradiada con luz UV, aireación suave y termorregulada a 24 ± 1°C. Cada 24 horas se drenaron los tanques reteniendo las larvas en un tamiz de 40 µm y suspendiéndolas en un nuevo tanque provisto de agua limpia, aireación y alimento.
El crecimiento, el estado de condición y la supervivencia de las larvas se determinaron diariamente mediante la revisión de tres muestras de agua de 1 mL de cada una de las réplicas en los diferentes tratamientos. Las muestras se colocaron sobre una cámara Sedgewick Rafter, realizándose el conteo de las larvas por observación directa a través del microscopio. Posteriormente, se estimó el número de larvas presentes aplicando la siguiente fórmula: TL = NL * V, en donde, TL = Número total de larvas; NL = Número de larvas presentes en 1 mL; V = Volumen total (mL) del agua en el que se encuentran las larvas. Para las observaciones del estado de condición diaria se empleó una escala de medición subjetiva dividida en tres niveles: larvas llenas, larvas semillenas y larvas vacías, basada en la coloración de la glándula digestiva (Tabla 1) y se estimó el porcentaje de larvas deformes, considerando deformes aquellas que presentaron irregularidades en el contorno de la concha o en la forma. Sumado a esto, a través de una reglilla dispuesta en uno de los oculares del microscopio, se midió la longitud (µm) de 30 larvas, previamente fijadas con formol al 4%, seleccionadas al azar en cada réplica,. Por último, diariamente se registraron los parámetros fisicoquímicos de temperatura y salinidad. Este experimento concluyó al momento de alcanzar el estado de larva con ojo o mancha ocular o al presentarse el 100% de mortalidad en los tratamientos.
Análisis estadístico
Para determinar la influencia de las diferentes densidades de cultivo y las distintas concentraciones de alimento se aplicó un análisis de varianza (Anova) de dos vías, previa verificación de los supuestos de normalidad y homocedasticidad. Seguido del Anova se realizó una prueba de comparaciones múltiples de Tukey. En los casos en donde no se cumplieron los supuestos se aplicaron transformaciones a los datos como logaritmo natural. Los análisis se llevaron a cabo utilizando el programa Statgraphics Plus 4.0 y las decisiones se tomaron teniendo en cuenta un alfa de 0.05.
RESULTADOS
Supervivencia larval
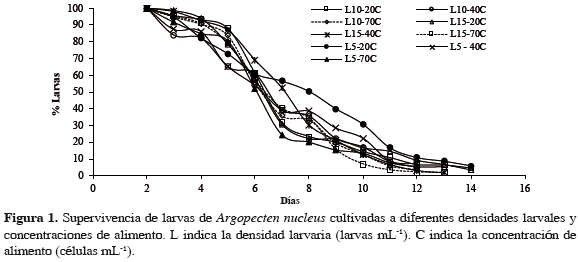
Todos los tratamientos presentaron un comportamiento muy similar en su supervivencia a lo largo del cultivo, registrando un ritmo de descenso que varió entre 8.0 y 9.7% diario, a pesar de que los grupos conformados por L10-70C (3.4%), L5-40C (6.9%) y L5-70C (5.2%) mantuvieran larvas vivas hasta el día 12 de cultivo y los grupos L10-40C (5.3%), L15-40C (1.6%) y L15-70C (1.6%) las mantuvieron hasta el día 13 (Figura 1). Además de la similitud en la variación de la supervivencia entre los distintos tratamientos, fue posible observar que en todos los tratamientos, el período de tiempo comprendido entre el sexto y el décimo día de cultivo se caracterizó por una fuerte disminución en la supervivencia con un promedio del 11% diario, coincidiendo este período con la formación del umbo.
Cabe resaltar que solo permanecieron hasta el final del experimento (día 14) los tratamientos alimentados a una concentración de 20000 células mL-1, representados por L5-20C, L10-20C y L15-20C con una supervivencia de 5.8, 4.5 y 3.4% respectivamente. Sin embargo, el análisis estadístico demostró que no existen diferencias significativas que permitan suponer que haya una relación entre la densidad inicial larval o las concentraciones de alimento utilizadas con la supervivencia alcanzada por las larvas en cada uno de los tratamientos, con valores p = 0.973 y 0.732 respectivamente. De igual manera, se determinó que no existe interacción entre la densidad inicial larval y la concentración de alimento que pueda influir en la supervivencia larval, con un valor p = 0.944 (Tabla 2).
Crecimiento
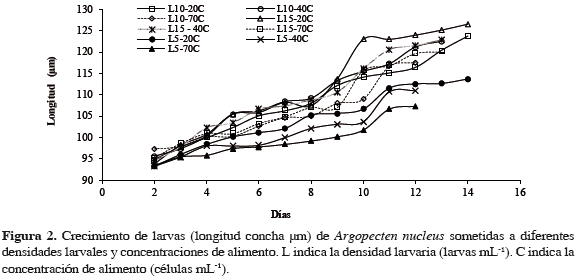
Las mayores tasas de crecimiento diario se presentaron en los tratamientos L15-20C (2.8 µm/día), L15-40C (2.5 µm/día) y L10-40C (2.4 µm/día), registrando tallas a los 13 días de cultivo de 126, 123 y 122 µm respectivamente. En contraste, las menores tallas se presentaron en los tratamientos mantenidos a una densidad de 5 larvas mL-1, representados por L5-20C (1.7 µm/día), L5-40C (1.8 µm/día) y L5- 70C (1.4 µm/día), alcanzando una talla final de 112, 111 y 107 µm respectivamente (Figura 2).
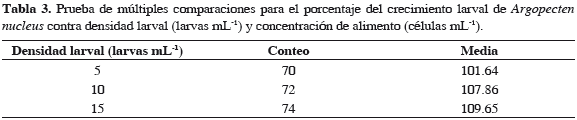
Al realizarse el análisis estadístico de los datos, se determinó que existe una influencia altamente significativa de la densidad inicial larval sobre el crecimiento alcanzado por las larvas, con un valor p = 0.0; mientras que la concentración de alimento no influyó significativamente sobre el crecimiento de las larvas, con un valor p = 0.158; de igual modo no se observó interacción entre la densidad larval inicial y la concentración de alimento, con un valor p = 0.596 (Tabla 2). La prueba de múltiples comparaciones reveló que el grupo homogéneo con mejor crecimiento promedio lo conformaron los tratamientos mantenidos a densidades larvales de 10 y 15 larvas mL-1 (Tabla 3).
Estado de condición diaria
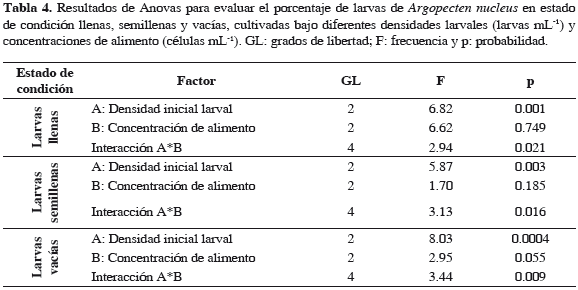
El mejor estado de condición (larvas llenas) durante el cultivo se presentó en los tratamientos con densidad inicial de 10 larvas mL-1, representados por L10- 40C, L10-20C y L10-70C, registrando porcentajes promedio de 98.5, 92.3 y 91.6% respectivamente; de igual manera, este grupo mostró los menores porcentajes promedio de larvas semillenas (1.3; 7.4 y 6.2%, respectivamente) y larvas vacías (0.0; 0.57 y 1.7%, respectivamente) (Figura 3). La densidad que presentó el segundo mejor porcentaje de larvas llenas fue 15 larvas mL-1, constituidos por L15-20C (91.0%), L15-70C (89.3%) y L15-40C (88.1%) y finalmente, los valores más bajos de larvas llenas correspondieron a los tratamientos con 5 larvas mL-1, representados por L5-20C (87.7%), L5-40C (88.1%) y L5-70C (81.4%) (Figura 3).
A lo largo del cultivo, los menores porcentajes de larvas en estado de condición llena en todos los tratamientos se presentaron entre el séptimo y el noveno día, comportamiento que coincidió con el período de mayor disminución de la supervivencia en las larvas. Durante este mismo período los tratamientos que mantuvieron los mayores porcentajes de larvas llenas fueron L10-40C, L10-20C y L15-20C, manteniendo el 96.0, 88.5 y 86.5% respectivamente, mientras que los porcentajes más bajos se presentaron en los tratamientos L5-70C (68%), L5-40C (80.7%) y L10-70C (81%) (Figura 3).
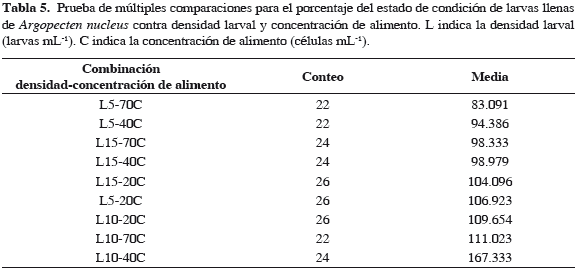
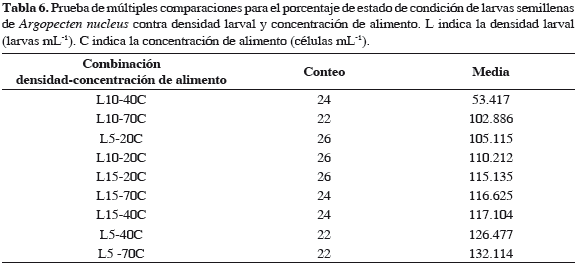
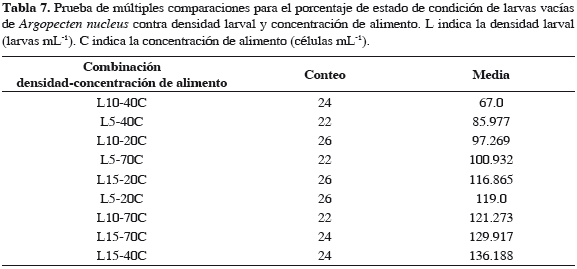
El análisis de los datos indicó que la densidad inicial larval ejerce influencia significativa sobre los porcentajes de larvas en estado de condición llenas, semillenas y vacías, con valores p = 0.001, 0.003 y 0.0004 respectivamente, mientras que la concentración de alimento no influye significativamente en esta variable, con valores p = 0.749, 0.185 y 0.055. Igualmente, se determinó que existe interacción altamente significativa entre la densidad larval y la concentración de alimento en los tres estados de condición, con valores p = 0.021, 0.016 y 0.009 (Tabla 4). Las pruebas de múltiples comparaciones establecieron que el tratamiento L10-40C presentó el valor más alto de larvas llenas y a la vez el menor de larvas semillenas (Tablas 5 y 6), del mismo modo, los menores porcentajes de larvas vacías se presentaron en el grupo homogéneo constituido por L10-40C y L5-40C (Tabla 7).
Deformidad larval
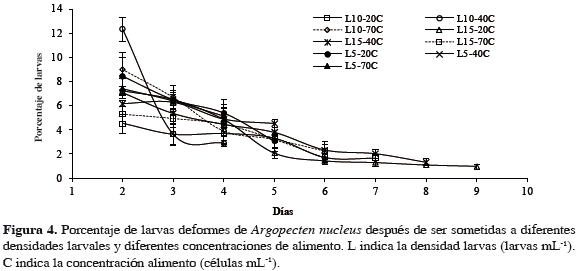
La presencia de larvas deformes no se prolongó más allá del noveno día de cultivo, registrándose los mayores ritmos de descenso en los tratamientos L10- 40C, L10-70C y L5-20C, con 4.1, 1.8 y 1.7% diario respectivamente, siendo estos mismos tratamientos los que mostraron los mayores porcentajes de deformidad al inicio del cultivo con 12.3, 8.9 y 8.4%. En contraste, el menor ritmo de descenso en el número de estas larvas se presentó en los tratamientos L15-70C, L10-20C y L5-40C con 0.7, 0.6 y 0.5% diario respectivamente. De igual manera, estos últimos presentaron los menores porcentajes de deformidad al inicio del cultivo larval con 5.3, 4.5 y 6.1, respectivamente (Figura 4).
El análisis de los datos determinó que no existe influencia significativa de la densidad inicial larval, ni de la concentración de alimento sobre el porcentaje de larvas deformes, con valores p = 0.965 y 0.796. De igual manera, no se detectó interacción entre estos dos factores, con un valor p = 0.814 (Tabla 2).
DISCUSIÓN
Supervivencia y crecimiento
Los resultados obtenidos en esta investigación concuerdan con los de Ibarra et al. (1997), quienes probaron densidades de 5, 10 y 20 larvas mL-1 en A. ventricosus, sin registrar variaciones significativas en la supervivencia de las larvas, observando un mejor crecimiento en las mayores densidades. Sin embargo, contradicen lo mencionado por autores como Rojas et al. (1988), Ortiz (1994) y Velasco y Barros (2008) quienes trabajaron densidades de 1, 5, 10, 15, 20 y 30 larvas mL-1 en Pecten ziczac, 2.5 a 10 larvas mL-1 en N. subnodosus, y 1 y 5 larvas mL-1 en A. nucleus respectivamente, observando menor supervivencia y crecimiento al aumentar la densidad, debido posiblemente a la competencia por alimento y los choques entre las larvas, lo cual produce una alimentación discontinua y el incremento en la concentración de productos de excreción como el amonio.
Por su parte, la escasa influencia de la concentración de alimento sobre la supervivencia de las larvas concuerda con lo obtenido por Ortiz (1994) quien, al probar concentraciones microalgales desde 1250 hasta 10000 células/larva en la alimentación de larvas de N. subnodosus, no encontró diferencias significativas en la supervivencia. De igual manera, el crecimiento de las larvas no se vio afectado por la concentración de alimento suministrada, resultado que difiere con autores como Lu y Blake (1996) y Velasco y Barros (2008), quienes registran un menor crecimiento en las larvas de A. irradians concentricus y A. nucleus cuando las concentraciones de alimento superaban las 20000 células mL-1, argumento respaldado por Bayne (1983), Roman et al. (2001) y Helm et al. (2006), quienes afirman que altas concentraciones de alimento tienen un efecto negativo en el crecimiento de las larvas.
La ausencia de diferencias significativas en la supervivencia larval bajo las distintas densidades evaluadas en este trabajo podría atribuirse a los estrechos ámbitos manejados entre las densidades, que fueron de solo 5 larvas mL-1 entre tratamientos, indicando que la supervivencia de las larvas de A. nucleus reacciona de manera similar al ser cultivadas entre ámbitos de 5 a 15 larvas mL-1. En este mismo sentido, autores como Ibarra et al. (1997) y Liu et al. (2006), trabajando con 5, 10, 20 y 40 larvas mL-1 en A. ventricosus y M. meretrix, sostienen que, siempre y cuando se tengan buenas condiciones de alimentación, calidad de agua y oxígeno, es posible mantener un cultivo a altas densidades sin comprometer la supervivencia de las larvas. Sin embargo, cuando se exceden ciertos valores de densidad según la especie, independientemente de la cantidad de alimento que se suministre y de la buena calidad de agua que se brinde, se presentan problemas en la supervivencia y el crecimiento (Farías-Molina, 2001).
En lo concerniente a la similitud entre la supervivencia de las larvas sometidas a las diferentes concentraciones de alimento en este trabajo, Bayne (1983) sostiene que el aumento o disminución de la ración alimenticia tiene muy poca influencia sobre la supervivencia de las larvas, siendo más determinante sobre el crecimiento, dado que cuando se maneja una dieta con baja concentración microalgal, la ganancia neta de energía proveniente del alimento proporciona estrictamente las necesidades básicas para el mantenimiento del animal, dejando muy poco o nada para ser utilizado en el incremento de masa corporal. Igualmente, cuando la concentración de alimento es demasiado alta se aumenta la tasa de rechazo de partículas o producción de seudoheces, que posiblemente interfieren en el proceso de alimentación, reduciendo la tasa de ingestión y, en consecuencia, el crecimiento. Sin embargo, Helm et al. (2006) afirman que, realizando un correcto manejo de la densidad larval, la concentración de alimento y la estrategia con que este se administra, es posible mantener un cultivo a alta densidad larval incrementando la concentración de alimento sin que esto afecte la supervivencia o el crecimiento de las larvas.
En cuanto al crecimiento experimentado por las larvas durante los tratamientos con las distintas densidades larvales, posiblemente estuvo influenciado por el reajuste natural sufrido en la densidad inicial de siembra, sumado a las distintas concentraciones de alimento utilizadas en cada tratamiento, pues a medida que transcurrían los días y el número de larvas en cada tratamiento disminuía debido a la mortalidad natural, también lo hacia la densidad larval, mientras que la concentración de alimento se mantenía constante, lo cual generó un incremento gradual en la relación del número de células microalgales presentes por larva. Esta situación afectó significativamente el crecimiento de las larvas, principalmente aquellas expuestas a las menores densidades iniciales (5 larvas mL-1) y las mayores concentraciones de alimento (70000 células mL-1) y, como ya fue mencionado anteriormente por autores como Bayne (1983), Cragg y Crisp (1991) y Uriarte et al. (2001), el incremento en la concentración de células microalgales aumenta la tasa de rechazo de partículas o producción de seudoheces interfiriendo en el proceso de alimentación y reduciendo el crecimiento de las larvas. Esto explicaría porque la densidad inicial de 5 larvas mL-1 registró el menor crecimiento y por ende mientras mayor era la concentración de alimento utilizada en esta densidad, menor era su ritmo de crecimiento.
Los tratamientos expuestos a densidades iniciales de 10 y 15 larvas mL-1 y concentraciones de alimento de 20000 y 40000 células mL-1 presentaron las mayores tasas de crecimiento, debido posiblemente a que el incremento gradual en el número de células microalgales producido por la reducción en el número de larvas en estos tratamientos, estuvo más acorde con el aumento en la tasa de filtración que experimentan las larvas normalmente a medida que crecen (Bayne, 1983; MacDonald, 1988; Uriarte et al., 2001) y a los efectos tóxicos y microbiológicos de las microalgas residuales en descomposición, favoreciendo las condiciones de cultivo y mejorando el crecimiento (Rojas et al., 1988). Con relación a lo anterior, Helm et al. (2006) afirman que es posible duplicar e incluso triplicar la densidad normal de las larvas si se administra una alimentación de acuerdo con el número de larvas en un tanque y su tamaño, en lugar de alimentar las larvas de acuerdo con la unidad de volumen de los tanques de cultivo.
Estado de condición de las larvas
La notable superioridad en el estado de condición que reflejan las densidades de 15 y 10 larvas mL-1 frente a la de 5 larvas mL-1, podría estar influenciada, al igual que en la supervivencia y el crecimiento, por la utilización de la densidad inicial de siembra y su comportamiento frente a las diferentes concentraciones de alimento probadas pues, como se mencionó anteriormente, los problemas de sobrealimentación que experimentó la menor densidad (5 larvas mL-1) generan una influencia negativa sobre la tasa de ingestión (Bayne, 1983; Cragg y Crisp,1991; Uriarte et al., 2001). Lo anterior explicaría por qué en estos tratamientos y en aquellos que utilizaron la mayor concentración de alimento (70000 células mL-1) se presentaron los mayores porcentajes de larvas con glándula digestiva semillena y vacía, mientras que en las mayores densidades en donde se presentó un mejor equilibrio entre el número de larvas y la concentración de alimento, se obtuvo el mayor porcentaje de larvas con glándula digestiva llena.
Sin embargo, el hecho que entre las densidades de 10 y 15 larvas mL-1, la primera presentara el mayor porcentaje de larvas con glándula digestiva llena, principalmente al utilizar la concentración de 40000 células mL-1, indicaría que el uso de esta densidad y concentración de alimento permite maximizar la ingestión de células microalgales por parte de las larvas, sin llegar a saturarlas. Respecto a esto, Bayne (1983) y Lu y Blake (1996) mencionan que el mejoramiento en la eficiencia de la ingestión se ve reflejado en un mejor crecimiento y una mayor sobrevivencia de las larvas, condiciones que cumple el tratamiento L10-40C que, a pesar de presentar un crecimiento menor (no significativo) que el L15-20C, refleja en compensación, una mayor estabilidad en la supervivencia.
Deformidad larval
La presencia de larvas deformes en el presente experimento parece no guardar ninguna relación con las densidades larvales utilizadas ni con las concentraciones de alimento administradas. Estas están más relacionadas con la calidad de los ovocitos utilizados y sus niveles de lípidos y problemas de poliespermia y autofecundación, muy comunes en bivalvos hermafroditas (Salaun et al., 1991). No obstante, la permanencia de este tipo de larvas en el cultivo depende del grado de deformidad de la larva y de su capacidad para alimentarse y desarrollar sus demás funciones vitales y, según Avendaño et al. (2001), las larvas de A. purpuratus no superan los diez días de vida.
Larvas con mancha ocular
De acuerdo con Velasco (2008), para que se dé esta última fase larvaria se deben haber acumulado suficientes reservas energéticas y, dado que en este experimento no se presentaron larvas con mancha en ninguno de los tratamientos, podría suponerse que la calidad y/o cantidad de la dieta suministrada no suplió plenamente las necesidades de las larvas, tal vez por el hecho de haber utilizado una dieta monoalgal. Velasco y Barros (2008) registran la formación de mancha ocular en larvas de A. nucleus cuando estas han alcanzado una talla de 200 µm en 12 días de cultivo, sin embargo la talla alcanzada por las larvas en este trabajo no superó los 123 µm en 13 días de cultivo, evidenciando un retraso en su desarrollo, ocasionado posiblemente por un desbalance o deficiencia nutricional.
Con respecto a lo anterior, Villavicencio (1997) menciona que al alimentar larvas de Lyropecten subnodosus con una dieta monoalgal compuesta por I. galbana no fue posible alcanzar el estadio de mancha ocular, mientras que se obtuvo con la mezcla de las microalgas Chaetoceros gracilis y Monochrysis lutheri. Del mismo modo, autores como Bayne (1983), Millán-Tovar (1997) y Uriarte et al. (2001) afirman que las larvas que se alimentan con mezclas de dos o más tipos de microalgas tienen mayor crecimiento y supervivencia que las alimentadas con un solo tipo, por lo tanto mayor posibilidad de alcanzar el estado de mancha ocular.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al Departamento Administrativo de Ciencia Tecnología e Innovación (Colciencias) por la financiación de este estudio, el cual estuvo enmarcado en el proyecto "Optimización de la producción de postlarvas del ostión Nodipecten nodosus y la conchuela Argopecten nucleus en el Caribe colombiano", código 2105-09-17982. De igual manera al Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (Invemar), por el apoyo prestado en esta investigación. Así mismo, a la empresa Hidrocultivos de la Costa Ltda., Claudia Castellanos, Katerine Carreño y Johann López por su importante colaboración.
BIBLIOGRAFÍA
1 Akaboshi, S. y J. E. Illanes. 1983. Estudio sobre la captación, precultivo y cultivo en ambiente natural de Chlamys (Argopecten) purpurata, Lamarck 1819, en Bahía Tongoy, IV región, Coquimbo. Simposio Internacional de Acuacultura, Coquimbo, Chile. 251 p. [ Links ]
2 Avendaño, M., C. E. Riquelme, R. Escribano y N. Reyes. 2001. Sobrevivencia y crecimiento de postlarvas de Argopecten purpuratus (Lamarck, 1819) en bahía Inglesa, Chile: efectos del origen, distribución en la bahía y bacterioflora larval. Rev. Chil. Hist. Nat., 74: 669-679. [ Links ]
3 Bayne, B. L. 1983. Physiological ecology of marine molluscan larvae. 299-343. En: Verdonk, N. H., J. A. M. val der Biggelaar y A. S. Tompa (Eds.). The mollusca. Academic Press, Orlando. 258 p. [ Links ]
4 Blacio, E. y R. Álvarez. 2001. Tecnología para el cultivo de scallops (Argopecten circularis Sowerby, 1835) en Ecuador. IV Congreso Ecuatoriano de Acuicultura, 8 (1): 56-58. [ Links ]
5 Cragg, S. M. y D. Crisp J. 1991. The biology of scallop larvae. 75-132. En: Shumway, S. (Ed.). Scallops: biology, ecology and aquaculture. Elsevier Science, Ámsterdam. 1096 p. [ Links ]
6 De la Roche, J. P. y A. Vélez. 1997. Descripción del desarrollo larval de la vieira "pata de león" Nodipecten nodosus bajo condiciones de laboratorio. VII Congreso Latinomaricano en Ciencias del Mar (Colacmar), São Paulo. 238 p. [ Links ]
7 Díaz, J. M. y M. Puyana. 1994. Moluscos del Caribe colombiano. Un catálogo ilustrado. Colciencias, Fundación Natura e Invemar, Bogotá. 291 p. [ Links ]
8 Farías-Molina, A. 2001. Nutrición en moluscos pectínidos. 89-104. En: Maeda-Martínez, A. N. (Ed.). Los moluscos pectínidos de Iberoamérica: ciencia y acuicultura. McGraw-Hill Interamericana Editores S. A., La Paz, México. 501 p. [ Links ]
9 Helm, M., M. N. Bourne y A. Lovatelli. 2006. Cultivo de bivalvos en criadero. Un manual práctico. Documento técnico de pesca número 471. FAO, Roma. 182 p. [ Links ]
10 Ibarra, A. M., J. L. Ramírez y G. A. García. 1997. Stocking density effects on larval growth and survival of two catarina scallop, Argopecten ventricosus (=circularis) (Sowerby II, 1842), populations. Aquaculture Res., 28: 443-451. [ Links ]
11 Illanes, J. E. 1995. Cultivo de larvas y postlarvas. Mem. 8o. Curso Internacional en Cultivo de Moluscos. Univ. Católica de Chile, JICA. Coquimbo. 384 p. [ Links ]
12 Lobos, G. 1992. Análisis del mercado mundial para el ostión de Chile y evaluación económica de un centro de cultivo de ostión del Norte. Tesis de postgrado Economía Agraria, Pontificia Universidad Católica de Chile, Coquimbo. 167 p. [ Links ]
13 Lodeiros, C., L. Freites, M. Núñez y J. H. Himmelman. 1993. Growth of the Caribbean scallop Argopecten nucleus (Born 1970) in suspended culture. J. Shell. Res., 12 (2): 291-294. [ Links ]
14 López, J., J. Gómez-León, C. Castellanos y E. Acosta. 2010. Efecto de la densidad de siembra sobre el crecimiento y la supervivencia de Nodipecten nodosus (Bivalvia: Pectinidae) en un nuevo arte de cultivo. Bol. Invest. Mar. Cost., 39 (1): 177-189. [ Links ]
15 Liu, B., B. Dong, B. Tang, T. Zhang y J. Xiang. 2006. Effect of stocking density on growth, settlement and survival of clam larvae, Meretrix meretrix. Aquaculture, 258: 344-349. [ Links ]
16 Lu, Y. T. y N. Blake. 1996. Optimum concentrations of Isochrysis galbana for growth of larval and juvenile bay scallops, Argopecten irradians concentricus (Say). J. Shell. Res., 15 (3): 635-643. [ Links ]
17 Maeda, A., P. Ormart, T. M. Cano y V. Osorio. 1996. Cultivo de scallops en Ecuador: una alternativa en desarrollo. Acuacultura del Ecuador, 13: 30-36. [ Links ]
18 McDonald, B. A. 1988. Physiological energetics of the Japanese scallop Patinopecten yessoensis larvae. J. Exp. Mar. Biol. Ecol., 120: 155-170. [ Links ]
19 Millán-Tovar, M. M. 1997. Experimentos de inducción a la maduración de Argopecten venticosus (Sowerby, 1842) y estudio del valor nutricional de Isochrysis galbana y Chaetoceros gracilis, durante su crianza larvaria. Tesis de maestría. Área interdisciplinaria de Ciencias del Mar, Univ. Autónoma de Baja California Sur, México. 140 p. [ Links ]
20 Ortiz, G. 1994. Efecto de la ración alimenticia y la densidad de cultivo sobre el desarrollo larval de Lyropecten subnodosus. Tesis en Oceanología, Univ. Autónoma de Baja California Sur, La Paz, México. 135 p. [ Links ]
21 Rojas, L. M., A. Vélez y O. Azuaje. 1988. Efectos individuales y combinados de la densidad larval y la ración de alimento sobre la supervivencia y el crecimiento de la vieira Pecten ziczac. Bol. Inst. Oceanogr., 27: 57-62. [ Links ]
22 Román, G., G. Martínez, O. García y L. Freites. 2001. Reproducción. 27-51. En: Maeda-Martínez, A. N. (Ed.). 2001. Los moluscos pectínidos de Iberoamérica: ciencia y acuicultura. McGraw-Hill Interamericana Editores S. A., La Paz, México. 501 p. [ Links ]
23 Salaun, M., J. Y. Boucher y M. Le Pennec. 1991. Prodissoconch shell characteristics as indicators of larval growth and viability in Pecten maximus (Linnaeus, 1758). J. Shell. Res., 10: 37-44. [ Links ]
24 Urban, H. J. 1999. Diagnóstico y evaluación de la factibilidad biológica, técnica y económica del cultivo experimental de bivalvos de interés comercial en el Caribe colombiano. Informe técnico final, Instituto de Investigaciones Marinas y Costeras (Invemar), Santa Marta. 212 p. [ Links ]
25 Uriarte, I., G. Rupp y A. Abarca. 2001. Producción de juveniles de pectínidos iberoamericanos bajo condiciones controladas. 147-171. En: Maeda-Martínez, A. N. (Ed.). Los moluscos pectínidos de Iberoamérica: ciencia y acuicultura. McGraw-Hill Interamericana Editores S. A., La Paz, México. 501 p. [ Links ]
26 Valero, A. P., S. Sánchez, C. García, A. J. Córdoba, J. P. de la Roche, J. Gómez, C. Castellanos, C. Torres, M. E. Rueda, K. Hernández, R. Bautista, J. P. Assmus e Y. Caballero. 2000. Guía práctica para el cultivo de bivalvos marinos del Caribe colombiano. Serie de Documentos Generales No. 10, Instituto de Investigaciones Marinas y Costeras (Invemar), Santa Marta. 40 p. [ Links ]
27 Velasco, L. A. 2008. Biología y cultivo de los pectínidos de interés comercial de Colombia. Univ. Magdalena, Santa Marta. 258 p. [ Links ]
28 Velasco, L. A. y J. Barros. 2008. Experimental larval culture of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture Res., 39: 603-618. [ Links ]
29 Velasco, L. A., J. Barros y E. Acosta. 2007. Spawning induction and early development of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus. Aquaculture, 272: 767-773. [ Links ]
30 Villavicencio, G. 1997. Acondicionamiento gonadal, desarrollo embrionario y cultivo de larvas de la almeja mano de león, Lyropecten subnodosus (Sowerby, 1835), alimentadas con cuatro especies de microalgas. Tesis de pregrado Ing. Acuicultura, Inst. Tec. del Mar, La Paz, México. 93 p. [ Links ]
31 Winkler, F. M. y B. F. Estévez. 2003. Effects of self-fertilization on growth and survival of larvae and juveniles of the scallop Argopecten purpuratus L. J. Exp. Mar. Biol. Ecol., 292: 93-102. [ Links ]
FECHA DE RECEPCIÓN: 20/01/2011 FECHA DE ACEPTACIÓN: 07/12/2012
*Contribución No. 1118 del Instituto de Investigaciones Marinas y Costeras (Invemar).