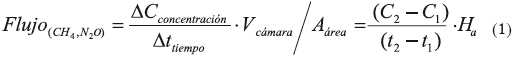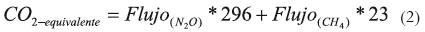Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.42 no.1 Santa Marta Jan./June 2013
EMISIÓN DE METANO Y ÓXIDO NITROSO DE LOS SEDIMENTOS DE MANGLAR DE LA CIÉNAGA GRANDE DE SANTA MARTA, CARIBE COLOMBIANO*
METHANE AND NITROUS OXIDE EMISSION OF MANGROVE SEDIMENTS AT THE CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIAN CARIBBEAN
Julián Mauricio Betancourt-Portela1, Juan Pablo Parra2 y Carlos Villamil1
1 Instituto de Investigaciones Marinas y Costeras (Invemar), Playa Salguero, El Rodadero, Santa Marta, Colombia. julian.betancourt@invemar.org.co, carlos.villamil@invemar.org.co.
2 Ministerio de Minas y Energía. Apartado aéreo 80319, Bogotá, Colombia. pablochem@hotmail.com.
RESUMEN
En Colombia existe muy poca información sobre la función de los manglares en relación con los gases de efecto invernadero (GEI), sus tasas de liberación bajo diferentes condiciones ambientales o su papel en el ciclo global del carbono. Por tales razones, en este estudio se evaluaron los flujos de CH4 y N2O, en cuatro sectores de la Ciénaga Grande de Santa Marta (CGSM) con diferentes grados de conservación de sus bosques de mangle, para determinar su función como fuente o sumidero de GEI. Los flujos se midieron por el método de cámaras estáticas y mostraron variaciones entre 34.7-1179.7 y nd-31569.2 µg.m-2.h-1 para el N2O y CH4 respectivamente., demostrando que los sedimentos de manglar de la CGSM son una fuente neta de estos gases; además fueron de la misma magnitud de los registros a nivel mundial en manglares sujetos a descargas residuales. El análisis estadístico mostró diferencias entre sectores y no entre épocas climáticas. Las emisiones de N2O más altas correspondieron al sector Aguas Negras (AN, 847.3 ± 265.7 µg.m-2.h-1), localidad en proceso de regeneración natural pero con influencia directa del río Magdalena y en Caño Dragado (CD, 438.7 ± 235.3 µg.m-2.h-1); y las menores a los sitios en recuperación Caño Grande (CG) y Rinconada (RIN) (104.7 ± 49.4 y 152.1 ± 36.0 µg.m-2.h-1, respectivamente). La emisión más alta de CH4 se registró en los sectores en recuperación: CG y AN (9573.4 ± 8623.8 y 4328.2 ± 7569.5 µg.m-2.h-1, respectivamente). En términos de CO2-equivalente, la emisión de N2O representó más del 50% del total, situación que ha sido documentada para sistemas agrícolas y se constituye en evidencia del deterioro de CD. Un análisis de correlación con los factores ambientales mostró que las emisiones de N2O presentan una variación inversa con la salinidad y positiva con los nitritos, lo que sugiere que su producción se da básicamente por vía de nitrificación. Finalmente, una estimación gruesa de la emisión por hectárea indicó que, dependiendo del estado de conservación o deterioro del manglar, las emisiones pueden variar de 10.2 a 27.1 tCO2-eq.ha-1.a-1.
PALABRAS CLAVE: Gases de efecto invernadero, flujo de metano, flujo de óxido nitroso, manglares.
ABSTRACT
In Colombia there is little information on the role of mangroves in relation to greenhouse gases (GHG), their release rates under different environmental conditions, or their role in the global carbon cycle. For these reasons, in this study we evaluated the fluxes of CH4 and N2O, in four sectors of the Ciénaga Grande de Santa Marta (CGSM) with different degrees of conservation of mangrove forests, to determine their role as a source or sink of GHG. The fluxes were measured by the method of the static chambers and showed variations between 34.7-1179.7 and nd-31569.2 µg.m-2.h-1 for N2O and CH4, respectively, showing that mangrove sediments of CGSM are a net source of GHG, and furthermore are of the same magnitude as levels recorded world-wide in mangroves subjected to sewage input. Statistical analyses showed differences between sectors but not between climatic periods. N2O emissions were highest in the Agua Negras station (AN, 847.3 ± 265.7 µg.m-2.h-1), a locality in the process of natural regeneration with a direct influence from the Magdalena River and in Caño Dragado (CD, 438.7 ± 235.3 µg.m-2.h-1); while emissions were lower in the recovery sites Caño Grande (CG) and Rinconada (RIN), (104.7 ± 49.4 and 152.1 ± 36.0 µg.m-2.h-1, respectively). The highest CH4 emission was recorded in recovery sectors: CG and AN (9573.4 ± 8623.8 and 4328.2 ± 7569.5 µg.m-2.h-1, respectively). In terms of CO2-equivalent, N2O emissions account for over 50% of the total, and this has been documented for agricultural systems and constitutes evidence of deterioration of CD. A correlation analysis with environmental factors showed that N2O emissions vary inversely with salinity and positively with nitrites, suggesting production mainly via nitrification. Finally, a coarse estimation of GHG emissions per hectare indicated that, depending on the state of conservation or deterioration of the mangrove, emissions can vary from 10.2 to 27.1 tCO2-eq.ha-1.a-1.
KEY WORDS: Greenhouse gases, methane flux, nitrous oxide flux, mangroves.
INTRODUCCIÓN
La medición de gases como el metano (CH4) y el óxido nitroso (N2O) en ecosistemas de manglar es un tema de gran interés, tanto a nivel mundial como nacional, porque se requiere de información exacta para determinar los flujos globales de estos gases de efecto invernadero (GEI). El Panel Intergubernamental para el Cambio Climático realizado en 2001 ha mostrado una tendencia creciente de las concentraciones de N2O y CH4 desde el inicio de la industria; y pese a que son más bajas que las de dióxido de carbono (CO2), la preocupación se fundamenta en que tienen un potencial de calentamiento mucho mayor que este (IPCC, 2001). Por tal razón la Convención Mundial alienta para la compilación de los inventarios nacionales de gases que contribuyen al cambio climático.
Aunque juegan un papel importante en el balance energético y químico del planeta, los cálculos globales de GEI no son bien conocidos (Steele et al., 1992; Whalen, 2005; Allen et al., 2007). Actualmente, los estimados globales de GEI en humedales son inciertos, debido a la falta de mediciones de flujos y de entendimiento sobre los factores ambientales que los controlan: las diferencias geológicas, tipos de suelos, entradas de nutrientes y la vegetación; factores que cambian incluso entre humedales del mismo tipo (Yi Lu et al., 1999). Se estima que su concentración en la atmósfera se está incrementando a una velocidad de 0.5-0.8% anual desde el inicio de la revolución industrial y a una velocidad de 4.9 ppb.año-1 en el período de 1992-1998 (IPCC, 2001).
La mayoría de estudios sobre emisiones de CH4 y N2O se han enfocado en humedales y cuerpos de aguas continentales, donde ocurren los más grandes flujos (Giani et al., 1996; Yi Lu et al., 1999), y en sistemas agrícolas como los arrozales (Gogoi et al., 2005). También se han documentado mediciones en marismas templadas (Bartlett et al., 1987; Chang et al., 1999), lagos boreales (Huttuene et al., 2003) y la tundra antártica (Zhu y Sun, 2005). Sin embargo, los manglares tropicales y subtropicales son los ecosistemas relativamente menos estudiados con relación a la emisión de estos gases traza (Sotomayor et al., 1994; Mukhopadhyay et al., 2002).
Si bien algunas investigaciones han sugerido que las emisiones de gases de los manglares no son significativas, comparadas con las de humedales continentales (Sotomayor et al., 1994), y en otras no se detectó la liberación de CH4, como al sureste de Tailandia y Brasil (Alongi et al., 2001; Furtado et al., 2002). Otros investigadores, como Corredor et al. (1999) y Purvaja y Ramesh (2001), consideran que los sedimentos de manglar son fuentes netas de N2O y CH4. No obstante, se ha demostrado que los manglares son especialmente sensibles a la metanogénesis cuando son intervenidos (Patterson, 1999; Purvaja y Ramesh, 2001) o cuando la cobertura vegetal ha sido eliminada (Giani et al., 1996).
Con relación al NO2, algunos estudios indican que las fuentes de sistemas naturales dominan la emisión de este gas a la atmósfera y entre ellos los ambientes marinos constituyen una fuente significativa pero muy poco caracterizada de este gas a la atmósfera (Allen et al., 2007). Otros estudios demuestran que la entrada de desechos nitrogenados a los manglares incrementa las emisiones de N2O (Morell et al., 2001; Bauza et al., 2002). En consecuencia, la conservación de los ecosistemas de manglar es importante para mitigar el aumento de las emisiones de GEI.
Los servicios ambientales que proporcionan los manglares se consideran de suma importancia pero difícilmente mensurables. En estas áreas los bosques no solamente ocupan el espacio físico, sino que de muchas maneras determinan la naturaleza de la interfase entre la tierra y el mar y los flujos a través de esta (Sánchez- Páez et al., 2000); además de proveer energía a ecosistemas adyacentes, los manglares también son capaces de almacenar grandes cantidades de carbono. Alongi et al. (2001) hallaron que en el sur de Tailandia los manglares retienen aproximadamente el 60% de la entrada total de carbono orgánico al sedimento; gracias a sus rápidas tasas de productividad primaria y bajas velocidades de descomposición de materia orgánica en el sedimento con relación a otros ecosistemas (Raigh y Tufekeioghu, 2000), jugando de esta forma un papel primordial en el ciclo biogeoquímico del carbono.
En 1966, Colombia poseía una extensión aproximada de 501300 ha de bosques de manglar, en la actualidad quedan aproximadamente 312536 ha (Perdomo, 2008). En las últimas cuatro décadas, el país ha perdido cerca de 188764 ha, equivalentes a una tasa de deforestación de 4719 ha.año-1. Esta pérdida en la cobertura de manglar se encuentra directamente asociada con la disminución en la oferta de bienes y servicios ambientales. A pesar de esto, existe muy poca información en el país sobre la función de los ecosistemas de manglar como fuentes y sumideros de GEI, de sus tasas de liberación bajo diferentes condiciones ambientales, o de su papel en el ciclo global del carbono.
En este estudio se evaluó la producción de CH4 y N2O en sedimentos de un manglar tropical localizado en el delta geográfico del río Magdalena, en el complejo lagunar de la Ciénaga Grande de Santa Marta (CGSM), norte de Colombia. Los flujos de estos gases fueron medidos usando la técnica de las cámaras cerradas sobre los sedimentos y áreas inundadas de cuatro sectores, con el objeto de estimar las magnitudes y las diferencias en la emisión de gases a la atmósfera en comparación con el estado de conservación del manglar. El trabajo se constituye en la primera información generada al respecto para Colombia.
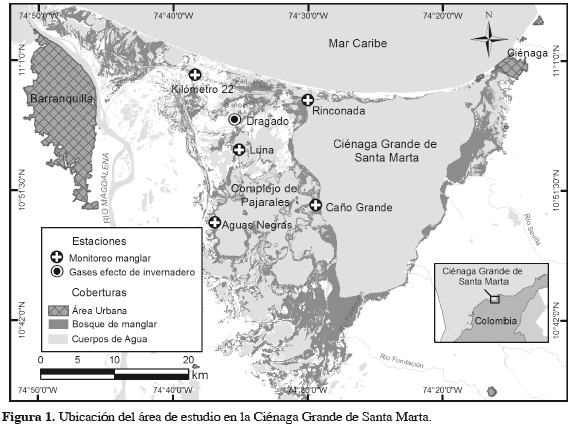
ÁREA DE ESTUDIO
La CGSM está localizada en la costa Caribe colombiana entre 10°43'- 11°00'N y 74°16'-74°38'W (Figura 1), pertenece al sistema deltaico del río Magdalena y es considerada el ecosistema más grande de lagunas costeras del Caribe. Tiene una extensión de 128000 ha (incluyendo lagunas, caños y pantanos). Está compuesta por dos cuerpos de agua principales, la Ciénaga Grande (45000 ha) y el Complejo de Pajarales (12000 ha), así como por algunas de menor tamaño (Twilley et al., 1998). Por sus características hidrológicas, ecológicas y geomorfológicas, es considerada uno de los ecosistemas tropicales más productivos (Day et al., 1989).
Hasta 1995 la CGSM poseía un área de manglar vivo cercana a 258.3 km2, entre manglares de franja y ribereños que sufrieron diferentes alteraciones en el tiempo, correspondiendo aproximadamente a la mitad de la cobertura estimada para el año 1956. Esta pérdida en cobertura fue consecuencia de diferentes manipulaciones sobre el sistema (construcción de carreteras y diques, drenaje, uso de la tierra, expansión de la agricultura y desarrollo urbano), bajas precipitaciones (400 mm.año-1), alta evapotranspiración (1431 mm.año-1) y eventos como El Niño (1991-1995), que sumados originaron un marcado incremento en la salinidad de aguas y suelos de manglar (>100 unidades; Espinosa, 2005).
El clima de la zona es árido-tropical, con seis a siete meses secos al año y un déficit hídrico de 1031 mm.año-1. Se presentan dos épocas climáticas, un período seco de diciembre a abril y uno lluvioso de mayo a noviembre, las lluvias más intensas ocurren entre septiembre y diciembre. Los cambios en el nivel del agua, causados principalmente por la lluvia y el efecto de las mareas, solo se observan en la Barra (Garay et al., 2004). Por lo cual la altura de las aguas responde principalmente a la entrada de aguas provenientes del río Magdalena y de los ríos de la Sierra Nevada de Santa Marta.
MATERIALES Y MÉTODOS
Estaciones de monitoreo
Los sitios de estudio fueron seleccionados de acuerdo con el estado del ecosistema de manglar circundante. Se escogieron cuatro zonas con diferente grado de conservación del manglar (Figura 2).
Estación de Rinconada (RIN, 10°57'41.4"N-74°29'37.6"W). Caracterizada por tener el mejor estado de conservación, tradicionalmente ha sido considerada la estación de referencia durante la rehabilitación de la CGSM (Cadavid et al., 2011). Presenta un bosque de cuenca, con densidad total de 1246 ind.ha-1 y área basal (AB) mayor a 22.3 m2 ha-1. El bosque está compuesto por árboles de Avicennia germinans, Laguncularia racemosa y Rhizophora mangle con densidades superiores a 673, 253 y 40 ind.ha-1, respectivamente. Avicennia germinans es la especie dominante del bosque ya que aporta más de 70% de la densidad total y 79% del AB, con individuos adultos bien desarrollados hasta de 44.4 cm de diámetro a la altura del pecho (DAP) y 22 m de altura. Laguncularia racemosa le sigue en importancia con 26.2% de la densidad y 12% del AB, los árboles de esta especie forman rodales mixtos de menor porte y mayor altura (hasta 18.5 cm de DAP y 21.2 m de altura). Rhizophora mangle es la menos representativa de la estación (4.1% de la densidad total), se localiza exclusivamente al borde del cuerpo de agua principal. A pesar de la baja densidad aporta 8.8% del AB, ya que se pueden observar árboles adultos hasta de 36.4 cm de DAP y 17.1 m de altura (Villamil, 2010). Los suelos son lodosos con bastante contenido orgánico, hojarasca en descomposición y fuerte olor a sulfuro de hidrógeno.
Estación Caño Dragado (CD, 10°55'40.2"N-74°34'42.4"W). Se considera el área con más alta intervención, el bosque de manglar murió en esta zona debido a la hipersalinización de los suelos y la cobertura vegetal desapareció totalmente, observándose en la actualidad únicamente los troncos de árboles muertos. El sustrato presenta alto contenido de detritos vegetales gruesos. Permaneció inundada durante el tiempo de muestreo.
Estación Caño Grande (CG, 10°51'42.8"N-74°28'52.9"W). Está cubierta en su mayoría por individuos de Rhizophora mangle, con una densidad de 1180 ind.ha-1 que corresponde a 69% del total. Esta alta densidad es producto de la reforestación con esta especie a partir de 2000, la cual fue establecida detrás de la franja de mangle original de 18 m de ancho aproximadamente, en donde coexisten las tres especies de mangle estudiadas. En esta franja externa predomina A. germinans que aportó 6.48 m2.ha-1 de AB, con árboles de hasta 27.2 cm de DAP y 22.3 m de altura. Es importante el aporte de AB de R. mangle con árboles que alcanzan hasta 25.4 cm de DAP y 26.8 m de altura. Laguncularia racemosa es la menos frecuente en este bosque (66.7 ind.ha-1; Villamil, 2010).
Estación Aguas Negras (AN, 10°48'32.2"N-74°36'26.9"W). Ubicada en el Complejo de Pajarales, aledaña al margen sur del canal Aguas Negras. Sitio altamente perturbado y en proceso de recuperación a partir de la reapertura del canal Aguas Negras. Actualmente se evidencia un bosque de mangle joven regenerado naturalmente, compuesto principalmente por árboles de L. racemosa y A. germinans con densidades de 326.7 y 306.7 ind.ha-1, respectivamente, y pocos individuos de R. mangle (6.7 ind.ha-1). El AB total de la estación es de 8.49 m2.ha-1, de los cuales A. germinans y L. racemosa aportan en igual proporción (4.24 y 4.22 m2.ha-1, respectivamente; Villamil, 2010).
Diseño del muestreo
Las campañas de muestreo fueron realizadas durante 11 meses entre junio de 2005 y abril de 2006, cubriendo las dos épocas climáticas existentes para el área (lluviosa y seca). En cada estación de muestreo se realizó una medición mensual de los flujos de GEI entre 10:00 y 16:00 horas del día instalándose cuatro cámaras de forma aleatoria. Adicionalmente se colectaron muestras de agua y de sedimento para la caracterización ambiental.
Determinación de los flujos de CH4 y N2O
Las mediciones de flujos fueron realizadas usando la técnica de cámaras estáticas, consistente en una cámara cilíndrica de PVC con septum plástico en el extremo superior y un área de intercambio de 213.8 cm2. El volumen de la cámara fue variable y dependió de la altura de la inundación. La forma de la cámara permitía que se introdujera 10 cm en el sedimento para minimizar la pérdida lateral de gas; en algunos casos dependiendo de la textura, la profundidad de inserción pudo variar, sin embargo, esto fue registrado para calcular correctamente el volumen libre de la cámara. Las cámaras se mantuvieron abiertas de 10 a 15 minutos, tiempo suficiente para disminuir los efectos que pudieran haber ocurrido al disturbar el sedimento y las raíces durante la inserción. Luego fueron selladas y del interior de cada cámara se extrajeron muestras de aire usando una jeringa (15 mL) a intervalos de tres minutos desde 0 a 9 minutos. Las muestras de gas se almacenaron en viales de vidrio previamente desocupados al vacío; y fueron transportadas al laboratorio para medir los incrementos (o descensos) en las concentraciones de CH4 y NO2 en el espacio de aire y realizar el cálculo de los flujos promedios de acuerdo con la ecuación (1).
Donde Ha es la altura de la cámara sobre la interfase aire-agua o airesedimento, C1 y C2 representan las concentraciones inicial y final de CH4 y N2O en el interior durante el período de observación (t2 - t1 = 3 min) y las concentraciones fueron corregidas con la presión y temperatura ambiental al momento del muestreo.
La concentración de cada gas se determinó mediante cromatografía de gases (en un equipo Shimadzu GC14A) adaptado con dos columnas empacadas. Las concentraciones de CH4 se determinaron con un detector de ionización de llama (FID) y las de N2O con un detector de captura de electrones (ECD), usando nitrógeno como gas de arrastre. Las concentraciones fueron cuantificadas comparando las áreas de las muestras contra estándares. Para esto se usaron estándares de mezclas de aire comprimido Scotty con contenido de 1 a 3 ppm de CH4 y N2O.
Ocasionalmente los valores extremos en las series de tiempo fueron omitidos si las observaciones al tiempo cero (0 min) diferían marcadamente de los niveles ambientales, indicando disturbios de la estación durante la instalación. Menos del 10% de los datos fueron rechazados al aplicar este criterio.
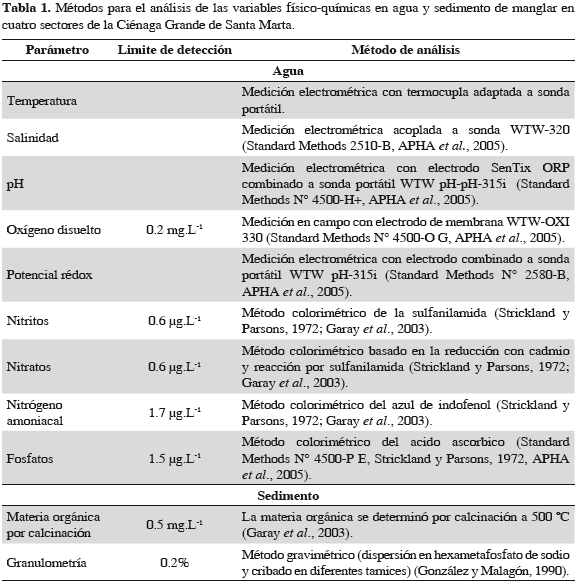
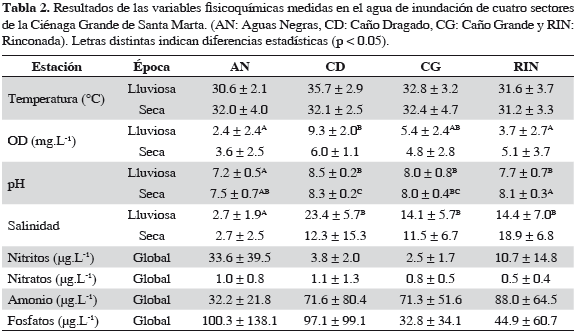
Medición de factores ambientales
Durante los monitoreos mensuales se midieron salinidad, pH y oxígeno disuelto (OD) en el agua superficial alrededor de las cámaras, usando equipos portátiles de acuerdo con la Tabla 1. Adicional a las variables anteriores (excepto OD), se midió en el sedimento superficial el potencial redox (Eh) (Tabla 1).
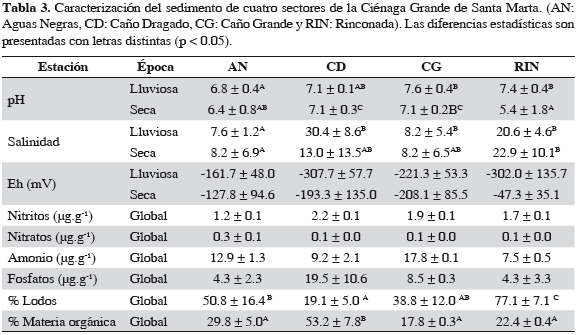
Al inicio del monitoreo en cada sector se tomaron muestras de sedimento superficial para su caracterización. Los sedimentos se tomaron con espátulas de los primeros 5 cm y se almacenaron refrigerados hasta la recepción en el laboratorio, donde se determinó su contenido de nutrientes, materia orgánica por calcinación y granulometría.
Tanto en las muestras de agua como en las de sedimento se determinaron nutrientes (fosfatos, nitratos, nitritos y amonio) mediante técnicas colorimétricas (Tabla 1). En sedimento se utilizaron las mismas técnicas, previa extracción con una solución de KCl 1N, siguiendo las metodologías descritas por Garay et al. (2003).
Estimación del CO2 equivalente
Para comparar los impactos de efecto invernadero, los flujos de N2O y CH4 fueron convertidos a emisiones de CO2-equivalente (CO2-eq) usando los potenciales de calentamiento del N2O (296) y 23 para el CH4 (IPCC, 2001) según la ecuación (2):
Análisis de la información
La información obtenida fue clasificada en las dos épocas climáticas principales para la región: seca correspondiente a los meses entre diciembre y junio, y lluviosa entre julio y noviembre. Se realizaron Anovas con el uso del software estadístico Infostat para determinar la diferencia espacial entre sectores y la temporal por época climática. Las diferencias estadísticas fueron determinadas mediante la prueba de Tukey con un nivel de significancia de p = 0.05. Para garantizar los supuestos del análisis de varianza, los datos de flujos de CH4, N2O, CO2-eq y valor absoluto del Eh fueron transformados utilizando la función logaritmo natural; y la salinidad del sedimento por raíz cuadrada. La información de las variables: temperatura, pH y salinidad en el agua, y pH en el sedimento fue comparada usando el análisis no-paramétrico de Kruskal-Wallis, estableciendo comparaciones por pares de estaciones a partir de las medias de rangos. Se determinaron los coeficientes de correlación de Pearson entre los flujos de gases y las variables ambientales en aguas y sedimentos para cada sector.
RESULTADOS Y DISCUSIÓN
Factores ambientales La temperatura presentó una alta variabilidad durante todo el monitoreo relacionada con la hora de medición, los datos registrados se hallaron entre 26.1 y 41.1 ºC, el sector donde se presentaron los valores puntuales más altos correspondió a Caño Dragado (CD), sin embargo, estadísticamente no se observaron diferencias entre sectores y la época climática. La temperatura no mostró correlación con los flujos de CH4 y N2O, aunque varios autores coinciden en que es un factor que incrementa la velocidad de producción de CH4 cuando la fuente de materia orgánica es alta (Heyer y Berger, 2000). Observaciones realizadas en la bahía de Bengala muestran que las emisiones de CO2 y CH4 en suelos de manglar tienen variaciones diurnas y estacionales ante la llegada del monzón, pero sólo para el CH4 se encontró una correlación positiva significativa con la temperatura (Mukhopadhyay et al., 2002).
La salinidad es una variable dependiente de la precipitación y de la entrada de agua dulce, estadísticamente entre sectores se hallaron claras diferencias. El sector de Aguas Negras (AN) presentó los niveles de salinidad más bajos y el menor ámbito de variación (6.2 a 0.1) debido al aporte constante de agua desde el río Magdalena. La mayor amplitud en el ámbito de salinidad se observó en CD desde los primeros meses de muestreo (junio), cuando se registraron valores de 38.4 hasta 0.5 en diciembre. Rinconada (RIN) y Caño Grande (CG) presentaron un comportamiento similar con ámbitos intermedios y salinidades de 6.4 a 26.4 y de 3.9 a 21.6, respectivamente.
El pH fluctuó entre 6.56 y 8.84 (Tabla 2), los mayores valores se registraron en CD variando desde 8.05 a 8.84 sin observarse una tendencia con referencia al tiempo; en CG y RIN los valores estuvieron entre 7.17 y 8.74 respectivamente, mientras que los menores se midieron en AN (6.6-8.2). Con relación a las épocas de sequía y lluvia, solo el sector de CD presentó diferencias estadísticas (p = 0.0368), con valores promedios más altos durante el período de lluvias. Si bien el pH no mostró correlación con los flujos de gases, se conoce que el N2O es producido principalmente por nitrificación (Bauza et al., 2002), y que las bacterias nitrificantes se favorecen a pH neutros o ligeramente básicos (Granier et al., 2004), lo que podría explicar los flujos más altos de N2O en la estación CD.
Por otro lado, el CH4 se favorece en suelos reductores con alto contenido de materia orgánica y pH bajo (Heyer y Berger, 2000). No obstante, Hirota et al. (2007) afirman que variables como el pH no presentan correlación significativa con la producción de GEI, debido a que son variables que cambian en una escala de corto tiempo (diurno) por factores bióticos y ambientales.
El oxígeno disuelto (OD) fue en promedio inferior a 4.2 ± 2.8 mg.L-1 en todos los sectores excepto en CD, donde las concentraciones promedio fueron las más altas (4.2-11.9 mg.L-1). Si bien, OD se registró por encima del nivel de saturación, es común encontrar en este sector valores altos durante el día debido a la alta producción fitoplanctónica (0.8-12 mg.L-1; Cadavid et al., 2011).
Temporalmente, CD fue el único sector que presentó diferencias estadísticas entre las dos épocas (p = 0.0368). En promedio, los niveles de OD de la época de lluvias fueron más altos que los de la seca (9.3 ± 2.0 y 6.0 ± 1.1 mg.L-1, respectivamente), debido a la mayor profundidad de la columna de agua en la época de lluvias, lo que disminuye el efecto de la demanda bentónica de oxígeno.
En los sectores que aún conservan cobertura vegetal, como RIN, el OD fue menor que el registrado en CD (3.7 ± 2.7 y 5.1 ± 3.7 mg.L-1 en lluvia y seca, respectivamente), debido a que la incidencia de la luz solar sobre el agua estimula la producción fotosintética de OD durante el día en CD, pero no en los otros sectores que cuentan con vegetación. Se estima que esta situación puede revertirse en la noche pero se sale del alcance de este estudio.
El análisis de textura del sedimento indica que están constituidos principalmente por material fino, excepto el sector CD que presentó el menor contenido de lodos (19.1 ± 5.0%, Tabla 3), pero el mayor contenido orgánico (53.2 ± 7.8% MO) en forma de restos de madera de los árboles muertos. Los sedimentos menos salinos y con pH más bajos se hallaron en el sector de AN debido a la entrada de agua del río Magdalena. Estadísticamente las variables ambientales medidas en el sedimento no presentaron diferencias entre épocas climáticas, sólo se presentaron entre sectores. Los sedimentos presentaron características anóxicas (Eh < 0), lo cual favorece la producción de metano (Li, 2000).
La correlación entre las emisiones de CH4 y N2O y los factores ambientales se presentan en la Tabla 4. Los resultados no mostraron correlación de las emisiones con la temperatura, lo que pudo conducir a que no existieran diferencias significativas de las emisiones entre épocas climáticas (p < 0.05). Sin embargo, la emisión de N2O presentó una correlación inversa con la salinidad. La emisión de CH4 presentó una relación inversa con la concentración de OD en el agua sobrenadante y una alta correlación positiva con el contenido de materia orgánica del sedimento, factores que afectan la producción de metano debido al carácter anaerobio y alto requerimiento de materia orgánica de las bacterias metanogénicas (Purvaja y Ramesh, 2001).
Con respecto al contenido de nutrientes se halló que la concentración de nitritos se correlaciona positivamente con la emisión de N2O, lo cual sugiere la producción de este gas básicamente por vía nitrificación, como lo han determinado otros autores (Bauza et al., 2002; Liikanen y Martikainen, 2003). Los resultados encontrados concuerdan con lo hallado en otras investigaciones, donde se relaciona la salinidad y los sulfatos (presentes en altas concentraciones en el agua marina), que tienen un efecto negativo sobre la producción de metano (Yi Lu et al., 1999); la presencia de sulfatos puede actuar por dos mecanismos: a) el CH4 es consumido por las bacterias sulfato-reductoras; b) la sulfatoreducción y la metanogénesis compiten por los donadores de electrones disponibles. En este sentido, el sector AN presenta una mayor emisión debido a la baja salinidad y el ingreso de nutrientes desde el río Magdalena. Algunos estudios realizados coinciden en que un incremento en las descargas orgánicas hacia los ecosistemas costeros producen aumentos significativos en la liberación de N2O y CH4 (Muñoz-Hincapie et al., 2002; Chiu et al., 2004; Punshon y Moore, 2004); y también de CH4 (Purvaja y Ramesh, 2001).
Flujos de N2O y CH4
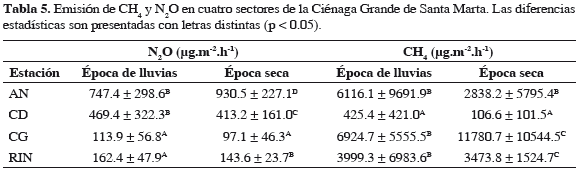
Las emisiones de N2O estuvieron en el ámbito de 34.7 a 1179.7 µg.m-2.h-1 (Figura 3), los resultados mostraron fluctuaciones sucesivas en cada una de las estaciones en el transcurso del tiempo por lo cual estadísticamente no se encontraron diferencias entre las épocas climáticas (p > 0.05, Figura 3). Entre sectores, se encontró que las emisiones más altas en las dos épocas corresponden al sector AN que se encuentra en proceso de regeneración natural, 747.4 ± 298.6 µg.m-2.h-1 en la época de lluvias y 930.5 ± 227.1 µg.m-2.h-1 en seca; le siguieron las emisiones del sector CD, sitio totalmente degradado (promedio 438.7 ± 235.3 µg.m-2.h-1), y las menores se registraron en los sitios en recuperación CG y RIN, 104.7 ± 49.4 y 152.1 ± 36.0 µg.m-2.h-1, respectivamente (Tabla 5).
Las emisiones de CH4 variaron entre nd-31569.2 µg.m-2.h-1, al igual que las emisiones de N2O no se hallaron diferencias significativas entre épocas (p > 0.05, Figura 3), pero sí entre sectores (Tabla 5); el sector degradado (CD) presentó las menores emisiones tanto en la época de lluvias como en la seca (425.4 ± 421.0 y 106.6 ± 101.5 µg.m-2.h-1, respectivamente, Tabla 5). Los sectores de mayor emisión de CH4 fueron los que se encuentran en estado de recuperación, como los sectores de CG (9573.4 ± 8623.8 µg.m-2.h-1) y AN (4328.2 ± 7569.5 µg.m-2.h-1). De los anteriores resultados se puede inferir que los sedimentos de manglar de la CGSM son una fuente neta de N2O y CH4.
En este estudio no se hallaron variaciones temporales en las emisiones de CH4, a diferencia de otras investigaciones (Sotomayor et al., 1994; Mukhopadhyay et al., 2002; Purvaja et al., 2004; Allen et al., 2007). Sin embargo, Whalen (2005) observó que en regiones boreales y templadas las emisiones de CH4, además de ser muy altas, están gobernadas por la latitud y la variabilidad estacional; en contraste, la variación de temperatura en humedales tropicales y subtropicales es menos extrema y las emisiones están enlazadas principalmente a los ciclos de inundación anual.
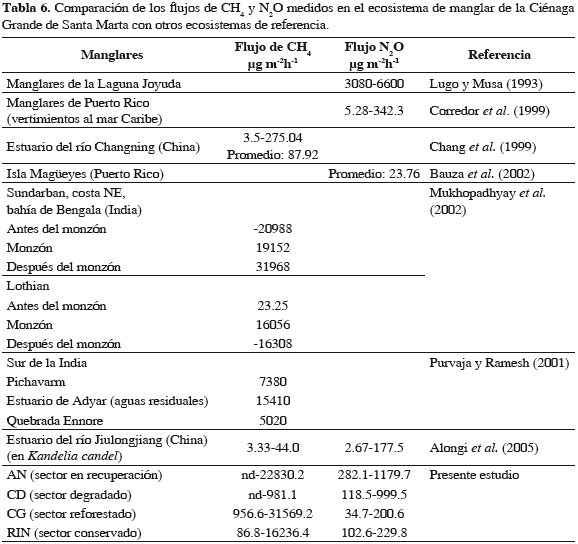
Al comparar los flujos medidos en la CGSM con los de otros manglares a nivel mundial, se encontró que las emisiones de N2O fueron más altas que las registradas en manglares que reciben aguas residuales de plantas de tratamiento (Puerto Rico, 5.28-342.3 µg m-2h-1; Corredor et al., 1999, Tabla 6) o el estuario del río Jiulongjiang, 2.67 -177.5 µg m-2h-1 (Alongi et al., 2005); sin embargo, estuvieron por debajo de las registradas por Lugo y Musa (1993) en manglares de la laguna Joyuda en Puerto Rico. De los cuatro sectores estudiados las mayores emisiones correspondieron a AN y CD, en el primero debido a la entrada constante de nutrientes desde el río Magdalena y en el segundo debido a la alteración de los factores ambientales como consecuencia de la pérdida de vegetación.
Los manglares no sólo fijan grandes cantidades de carbono a través de la fotosíntesis, sino que también exportan materia orgánica como hojarasca, razones por las cuales son considerados ecosistemas altamente productivos (Citrón-Molero y Schaeffer-Novelli, 1983; Field, 1996). Los bosques de mangle de la CGSM producen entre 15.7 t.ha-1.a-1 (Zamorano, 1983) y 28.8 t.ha-1.a-1 (Ochoa-Bejarano, 1988), valores mayores a los registrados para otros manglares del Caribe y Pacífico colombianos (Palacios et al., 1990; Palacios y Mosquera, 1992; Satizábal et al., 1993; Rodríguez-Ramírez, 2004; Lema-Vélez y Polanía, 2006) e inclusive mayores a otros bosques en América continental e insular (Juman, 2005; Menéndez et al., 2006; Vega-Rodríguez, 2008), incluyendo unos ubicados en la cuenca norte del Amazonas (Nascimiento et al., 2006). Esta alta producción de materia orgánica y las condiciones reductoras del sistema favorecen la transformación de moléculas complejas ricas en energía en productos inorgánicos sencillos solubles (fosfatos, sulfatos, nitratos) o gaseosos (CO2, CH4, NH3) y agua (Couteaux et al., 1995); a este eficiente reciclaje de nutrientes y a las tasas de generación y descomposición de hojarasca, se les atribuye la alta productividad de los ecosistemas de manglar (Bosire et al., 2005).
Las emisiones de CH4 también fueron de igual magnitud a las registradas en manglares próximos a vertimientos de aguas residuales tratadas (15410 µg.m-2.h-1; Purvaja y Ramesh, 2001; Tabla 6), manglares afectados por grandes descargas de ríos como Sundarban en la India (15400-32000 µg.m-2.h-1, Mukhopadhyay et al., 2002) e incluso de igual magnitud que las emisiones de los campos de arroz (21600 µg.m-2.h-1, Wagner- Riddle et al., 1996), pero fueron inferiores a las emisiones de los sedimentos eutroficados del mar Báltico (104000 µg.m-2.h-1; Heyer y Berger, 2000). El sector CD, aunque presentó las emisiones más bajas de los cuatro sectores de la CGSM, superó las registradas en algunos estuarios de la China (3.33-44 µg.m-2.h-1, Alongi et al., 2005). Esto puede estar relacionado con el efecto de la alta productividad que tiene lugar en la CGSM.
Aunque la emisiones de CH4 en cd fueron bajas, las de N2O estuvieron entre las más altas (18.5-999.5 µg m-2h-1), situación que se asoció a la actividad aerobia de bacterias nitrificantes que son favorecidas por los altos niveles de OD en el agua; así fue registrado por Liikanen y Martikainen (2003). La disponibilidad de oxígeno tiene influencia sobre la producción de gases, disminuyendo la liberación de CH4 y aumentando vía nitrificación la de N2O.
Emisión de CO2-equivalente
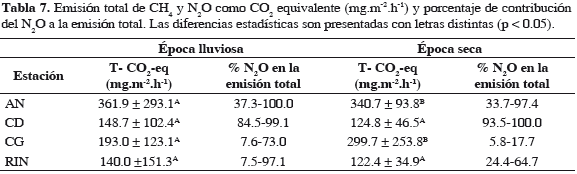
Al expresar las emisiones de N2O y CH4 en términos de CO2-eq la emisión total se calculó entre 41.5-838.0 mg.m-2.h-1. Espacialmente, en la época de lluvias no se hallaron diferencias significativas entre sectores; sin embargo, en la época seca los sectores en proceso de recuperación presentaron las emisiones más altas de CO2-eq (p = 0.0045; AN: 340.7 ± 93.8 y CG: 299.7 ± 253.8 mg.m-2.h-1).
De la emisión de CO2-eq, el flujo de N2O, representó entre 6 y 100% del total; el sector CD (manglar degradado) presentó la mayor participación del N2O en la emisión neta de CO2-eq (entre un 84.5-100 %; Tabla 7). Esta situación ha sido documentada por algunos investigadores en sistemas agrícolas en los cuales se considera que el N2O domina la emisión de CO2-eq (Mosier et al., 2005), debido a la altos niveles de nitrógeno fertilizante que reciben, lo que promueve los procesos de nitrificación (principal ruta de emisión de N2O). Esto se constituye en evidencia del deterioro del sector CD, el cual ha dejado de comportarse totalmente como un ecosistema de manglar.
Con las emisiones de CO2-eq se estimó la emisión por unidad de área (o emisión integrada). Los sectores que presentaron menor emisión fueron RIN (10512.3 ± 2957 kg.ha-1) y CD (10160.3 ± 2565.1 kg.ha-1), sector conservado y sector degradado respectivamente. Mientras que los sitios en recuperación CG (18973.8 ± 7507 kg.ha-1 y AN (27100.1 ± 2120.5 kg.ha-1) presentaron las más altas. Lo anterior significa que, dependiendo del estado de conservación del manglar, las emisiones pueden variar de 10.2-27.1 ton de CO2-eq por hectárea en un año. Inicialmente estos sectores en recuperación presentan emisiones altas de GEI debido a la introducción continua de nutrientes, pero comienzan a atrapar CO2 al recuperarse el bosque, y con el tiempo llegarán a las condiciones del sector preservado y disminuirán sus emisiones netas de GEI.
Aunque estos valores son un estimado grueso de la emisión de GEI en la CGSM, ellos corresponden a la primera información generada para manglares en Colombia y deben ser considerados como un indicador de la magnitud de las emisiones de estos dos gases traza. Un refinamiento mayor de la emisión de GEI debe incluir la medición de otros gases como CO2 y evaluar las emisiones durante un ciclo de 24 horas, ya que se hallaron correlaciones de los flujos con variables como el oxígeno disuelto el cual cambia drásticamente en horas de la noche en estas lagunas.
CONCLUSIONES
Las emisiones de N2O y CH4 en los cuatros sectores de manglar en la CGSM son del mismo orden de magnitud y en algunos casos superiores a las registradas en otras regiones del mundo en donde los sedimentos de manglar reciben descargas de aguas residuales, demostrando con esto el efecto de la alta productividad de los bosques de manglar.
Temporalmente no se encontraron diferencias significativas por época climática en las emisiones de CH4 y N2O, sin embargo, sí se hallaron diferencias espaciales, dependiendo del estado de conservación del bosque de manglar, las emisiones de CH4 fueron mayores en los dos sectores en recuperación (AN y CG) y menores en el sitio más degradado (CD); mientras que las de N2O fueron altas en el sector degradado. Debido al mayor potencial de calentamiento del N2O, el sector degradado resulta en una emisión equivalente más alta. La estimación de este flujo equivalente indica que la emisión total de GEI puede variar de 10.2-27.1 ton de CO2-eq por hectárea en un año, dependiendo del estado de conservación del manglar.
Lo anterior, en términos de alternativas para recuperación del manglar, indica que un sector degradado (CD) se convierte en un sitio netamente emisor de GEI debido a que no hay captura de CO2 en forma de biomasa. Un bosque en conservación (RIN) también presenta emisiones de GEI; sin embargo, estas son relativamente más bajas y la emisión neta disminuye si se considera la captura de CO2 en forma de biomasa (cuantificación que no era del alcance de este estudio).
BIBLIOGRAFÍA
1 Allen, D. E., R. C. Dalal, H. Rennenberg, R. L. Meyer, S. Reeves y S. Schmidt. 2007. Spatial and temporal variation of nitrous oxide and methane flux between subtropical mangrove sediments and the atmosphere. Soil Biol. Biochem., 39: 622-631. [ Links ]
2 Alongi, D. M., G. Wattayakorn, J. Pfitzner, F. Tirendi, I. Zagorskis, G. J. Brunskill, A. Davidson y B. F. Clough. 2001. Organic carbon accumulation and metabolic pathways in sediments of mangrove forests in southern Thailand. Mar. Geol., 179: 85-103. [ Links ]
3 Alongi, D. M., J. Pfitzner, L. A. Trott, F. Tirendi, P. Dixon y D. W. Klumpp. 2005. Rapid sediment accumulation and microbial mineralization in forests of the mangrove Kandelia Candel in the Jiulongjiang Estuary, China. Estuar. Coas. Shelf Sci., 63: 605-618. [ Links ]
4 APHA, AWWA y WEF. 2005. Standard methods for the examination of water and waste water. 20 edición, American Public Health Association, American Water Works Association y Water Environment Federation, Washington. 1325 p. [ Links ]
5 Bartlett, K. B., D. S. Bartlett, R. C. Harriss y D. I. Sebacher. 1987. Methane emissions along a salt marsh salinity gradient. Biogeochemistry, 4: 183-202. [ Links ]
6 Bauza, J. F., J. M. Morell y J. E. Corredor. 2002. Biogeochemistry of nitrous oxide production in the red mangrove (Rhizophora mangle) forest sediments. Mar. Coas. Shelf Sci., 55: 697-704. [ Links ]
7 Bosire, J., F. Dahdouh-Guebas, J. Kairo, J. Kazungu, F. Dehairs y N. Koedam. 2005. Litter degradation and C: N dynamics in reforested mangrove plantations at Gazi Bay, Kenya. Biol. Conserv., 126: 287-95. [ Links ]
8 Cadavid, B. C., P. A. Bautista, L. F. Espinosa, A. J. Hoyos, A. M. Malagón, D. Mármol, A. M. Orjuela, J. P. Parra, L. V. Perdomo, M. Rueda, C. A. Villamil y E. A. Viloria. 2011. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe técnico final, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 127 p. [ Links ]
9 Chang, Y. L., Y. S. Wong, N. F. Tam, Y. Ye y P. Lin. 1999. Methane flux and production from sediments of a mangrove wetland on Hainan Island, China. Mangroves and Salt Marshes, 3: 41-49. [ Links ]
10 Chiu, C. Y., S. C. Lee, T. H. Chen y G. Tian. 2004. Denitrification associated N loss in mangrove soil. Nutrient Cycling in Agroecosystems, 69: 185-189. [ Links ]
11 Citrón-Molero, G. y Y. Schaeffer-Novelli. 1983. Introducción a la ecología del manglar. Rostlac/Unesco, Montevideo. 109 p. [ Links ]
12 Corredor, J. E., J. M. Morell y J. Bauza. 1999. Atmospheric nitrous oxide fluxes from mangrove sediments. Mar. Pollut. Bull., 38 (6): 473-478. [ Links ]
13 Couteaux, M., P. Bottner y B. Berg. 1995. Litter decomposition, climate and litter quality. Tree, 10: 63-66. [ Links ]
14 Day, J. W, C. Hall, W. M. Kemp y A. Yáñez-Arancibia. 1989. Estuarine ecology. Wiley-Interscience, John Wiley, Nueva York. 558 p. [ Links ]
15 Espinosa, L. F. (Ed.). 2005. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe técnico final, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 83 p. [ Links ]
16 Field, C. 1996. La restauración de ecosistemas de manglar. Organización Internacional de Maderas Tropicales (OIMT), Sociedad Internacional para los Ecosistemas de Manglar (ISME), Managua. 278 p. [ Links ]
17 Furtado, A. L. S., P. Casper y F. Assis E. 2002. Methanogenesis in an impacted and two dystrophic coastal lagoons (Macaé, Brazil). Braz. Arch. Biol. Technol., 45 (2): 195-202. [ Links ]
18 Garay, J. A., J. M. Betancourt, G. Ramírez, B. Marín, B. Cadavid, L. Panizzo, L. Lesmes, E. Sánchez, H. Lozano y A. Franco, 2003. Manual de técnicas analíticas para la determinación de parámetros fisicoquímicos y contaminantes marinos: aguas, sedimentos y organismos. Serie de documentos generales No. 13, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 177 p. [ Links ]
19 Garay, J., J. Restrepo, O. Casas, O. Solano y F. Newmark (Eds.). 2004. Los manglares de la ecorregión Ciénaga Grande de Santa Marta: pasado, presente y futuro. Serie Publ. Espec. 11, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 236 p. [ Links ]
20 Giani, L., Y. Bashan, G. Holguin y A. Strangmann. 1996. Characteristics and methanogenesis of the Balandra lagoon mangrove soils, Baja California Sur, Mexico. Geoderma, 72: 149-160. [ Links ]
21 Gogoi, N., K. K. Baruah, B. Gogoi y P. K. Gupta. 2005. Methane emission characteristics and its relations with plant and soil parameters under irrigated rice ecosystem of northeast India. Chemosphere, 59: 1677-1684. [ Links ]
22 González Fletecher, A. y D. Malagón Castro. 1990. Métodos analíticos del laboratorio de suelos. Quinta edición, Instituto Geográfico Agustín Codazzi, Bogotá. 502 p. [ Links ]
23 Granier, C., P. Artaxo y C. E. Reeves. 2004. Emissions of atmospherics trace compounds. Kluwer Academic Publishers. Ámsterdam. 545 p. [ Links ]
24 Heyer, J. y U. Berger. 2000. Methane emission from the coastal area in the Southern Baltic Sea. Estuar. Coas. Shelf Sci., 51: 13-30. [ Links ]
25 Hirota, M., Y. Senga, Y. Seike, S. Nohara y H. Kunii. 2007. Fluxes of carbon dioxide, methane and nitrous oxide in two contrastive fringing zones of coastal lagoon, Lake Nakaumi, Japan. Chemosphere; 68: 597-603. [ Links ]
26 Huttunen, J. T., J. Alm, A. Liikanen, S. Juutinen, T. Larmola, T. Hammar, J. Silvola y P. J. Martikainen. 2003. Fluxes of methane, carbon dioxide and nitrous oxide in boreal lakes and potential anthropogenic effects on the aquatic greenhouse gas emissions. Chemosphere, 52: 609-621. [ Links ]
27 IPCC. 2001. Atmospheric chemistry and greenhouse gases. 239-287. En: Houghton, J. H., Y. Ding, D. J. Griggs, M. Noguer, P. J. van der Linden, X. Dai, K. Maskell y C. A. Johnson (Eds.). Climate change 2001: The scientific basis. Cambridge University Press, Nueva York. 892 p. [ Links ]
28 Juman, R. A. 2005. Biomass, litterfall and decomposition rates for the fringed Rhizophora mangle forest lining the Bon Accord lagoon, Tobago. Rev. Biol. Trop, 53 (Sup. 1): 207-217. [ Links ]
29 Lema-Vélez, L. y J. Polanía. 2006. Estructura y dinámica del manglar del delta del río Ranchería, Caribe colombiano. Biología Tropical, 55: 11-21. [ Links ]
30 Li, C. 2000. Modeling trace gas emissions from agricultural ecosystems. Nutr. Cycl. Agroecosys., 58: 259-276. [ Links ]
31 Liikanen, A. y P. J. Martikainen. 2003. Effect of ammonium and oxygen on methane and nitrous oxide fluxes across sediment-water interface in a eutrophic lake. Chemosphere, 52: 1287-1293. [ Links ]
32 Lugo, A. E. y J. C. Musa. 1993. Mangroves of Laguna Joyuda. Acta Cient., 7: 67-90. [ Links ]
33 Menéndez, L., J. M. Guzmán y R. T. Capote-Fuentes. 2006. Manglares cubanos: biomasa de hojarasca. 90-107. En: Menéndez, L. y J. M. Guzmán (Eds.). Ecosistemas de manglar en el archipiélago cubano. Editorial Academia, La Habana, Cuba. 473 p. [ Links ]
34 Morell, J. M., J. Capella, A. Mercado, J. Bauza y J. E. Corredor. 2001. Nitrous oxide fluxes in Caribbean and tropical Atlantic waters: evidence for near surface production. Mar. Chem., 74: 131-143. [ Links ]
25 Mosier, A. R., A. D Halvorson, G. A. Peterson, G. P. Robertson y L. Sherrod. 2005. Measurement of net global warming potential in three agroecosystems. Nutr. Cycl. Agroecosys., 72: 67-76. [ Links ]
36 Mukhopadhyay, S. K., H. Biswas, T. K. De, B. K. Sen, S. Sen y T. K. Jana. 2002. Impact of Sundarban mangrove biosphere on the carbon dioxide and methane mixing ratios at the NE Coast of Bay of Bengal, India. Atmos. Environ., 36: 629-638. [ Links ]
37 Muñoz-Hincapié, M., J. M. Morell y J. E. Corredor. 2002. Increase of nitrous oxide flux to the atmosphere upon nitrogen addition to red mangroves sediments. Mar. Pollut. Bull., 44: 992-996. [ Links ]
38 Nascimiento, R., U. Mehlig, M. Oliveira-Abreu y M. P. Machado de Menezes. 2006. Produção de serapilheira em um fragmento de bosque de terra firme e um manguezal vizinhos na Península de Ajuruteua, Bragança, Pará. Bol. Mus. Para. Emílio Goeldi. Ciências Naturais, 2: 55-60. [ Links ]
39 Ochoa-Bejarano, G. 1988. Algunas características funcionales del manglar de la Ciénaga Grande de Santa Marta, con énfasis en Rhizophora mangle y Avicennia germinans. Trabajo de grado, Biología, Univ. del Valle, Cali. 143 p. [ Links ]
40 Palacios-Moreno, M. A. y A. I. Mosquera. 1992. Estudio de la productividad primaria del ecosistema de manglar en la zona de hojas blancas, costa Pacífica nariñense. Bol. Cient. CCCP, 3, 29 p. [ Links ]
41 Palacios-Moreno, M., E. Vargas-Polonia y M. de la Pava. 1990. Determinación del aporte de materia orgánica del manglar en la zona de Bocagrande. Bol. Cient. CCCP, 1. 72 p. [ Links ]
42 Patterson, J. 1999. Wetlands and climate change. Feasibility investigation of giving credit for conserving wetlands as carbon sinks. Wetlands International Special Publication 1, Wageningen, Holanda. 35 p. [ Links ]
43 Perdomo, L. (Ed). 2008. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe técnico, Instituto de Investigaciones Marinas y Costeras; Ministerio de Ambiente, Vivienda y Desarrollo Territorial y Corporación Autónoma Regional del Magdalena, Santa Marta. 102 p. [ Links ]
44 Punshon, S. y R. Moore. 2004. Nitrous oxide production and consumption in a eutrophic coastal embayment. Mar. Chem., 91 (1-4): 37-51. [ Links ]
45 Purvaja, R. y R. Ramesh. 2001. Natural and anthropogenic methane emission from coastal wetlands of South India. Environ. Manage., 27 (4): 547-557. [ Links ]
46 Purvaja, R., R. Ramesh y P. Frenzel. 2004. Plant-mediated methane emission from an Indian mangrove. Glob. Change Biol., 10: 1825-1834. [ Links ]
47 Raigh, J. W. y A. Tufekeioghu, 2000. Vegetation and soil respiration: correlations and controls. Biogeochemistry, 48: 213-232. [ Links ]
48 Rodríguez-Ramírez, A., J. Nivia-Ruiz y J. Garzón-Ferreira. 2004. Características estructurales y funcionales del manglar de Avicennia germinans en la bahía de Chengue (Caribe colombiano). Bol. Invest. Mar. Cost., 33: 223-244. [ Links ]
49 Sánchez-Páez, H., R. Álvarez-León, O. A. Guevara-Mancera y G. A. Ulloa-Delgado. 2000. Lineamientos estratégicos para la conservación y uso sostenible de los manglares de Colombia. Proy. PD 171/91 Rev. 2 (F) Fase II (Etapa II). Conservación y manejo para el uso múltiple y el desarrollo de los manglares de Colombia, Minambiente-OIMT, Bogotá. 81 p. [ Links ]
50 Satizábal, A., A. Bejarano y F. Zapata. 1993. Producción de hojarasca y descomposición de materia orgánica de un manglar de ribera de Nariño, Costa Pacífica. Bol. Cient. CCCP, 4, 36 p. [ Links ]
51 Sotomayor, D., J. E. Corredor y J. M. Morell. 1994. Methane flux from mangrove sediments along the southwestern coast of Puerto Rico. Estuaries, 17 (16): 140-147. [ Links ]
52 Steele, L. P., E. J. Dlugokencky, P. M. Lang, P. P. Tans, R. C. Martin y K. A. Masarie. 1992. Slowing down of the global accumulation of atmospheric methane during the 1980's. Nature, 358: 313-316. [ Links ]
53 Strickland, J. D. H. y T. R. Parsons. 1972. A practical handbook of seawater analysis. Fish Research Board of Canada. Segunda Edición, Otawa. 295 p. [ Links ]
54 Twilley, R. R., V. H. Rivera-Monroy, R. Chen y L. Botero. 1998. Adapting an ecological mangrove model to simulate trajectories in restoration Ecology. Mar. Pollut. Bull., 37 (8-12): 404-419. [ Links ]
55 Vega-Rodríguez, M. 2008. Estimating primary productivity of red mangroves in southwestern Puerto Rico from remote sensing and field measurements. Tesis Master de Ciencias Marinas (Oceanografía biológica). Universidad de Puerto Rico, Mayagüez. 92 p. [ Links ]
56 Villamil, C. 2010. Evaluación de ecosistemas de manglar con diferente cobertura en cuanto a los procesos de retención, absorción y acumulación de metales pesados (Cr, Cd, Pb, Zn y Cu). Tesis Maestría, Univ. Nacional Colombia, Bogotá. 65 p. [ Links ]
57 Wagner-Riddle, C., G. W. Thurtell, G. E. Kidd, G. C. Edwards y I. J. Simpson. 1996. Micrometeorological measurements of trace gas fluxes from agricultural and natural ecosystems. Infrared Phys. Technol., 37: 51-58. [ Links ]
58 Whalen, S. C. 2005. Biogeochemistry of methane exchange between natural wetlands and the atmosphere. Environ. Eng. Sci., 22: 73-94. [ Links ]
59 Yi Lu, C., Y. S. Wong, N. F. Y. Tam, Y. Ye y P. Lin. 1999. Methane flux and production from sediments of a mangrove wetland on Hainan Island, China. Mangroves and Salt Marshes, 3: 41-49. [ Links ]
60 Zamorano, D. 1983. Productividad del manglar y su importancia para el pelagial de la Ciénaga Grande de Santa Marta. Trabajo de grado, Maestría en Ciencias, Univ. Nacional de Colombia, Bogotá. 124 p. [ Links ]
61 Zhu, R. y L. Sun. 2005. Methane fluxes from tundra soils and snowpack in the maritime Antarctic. Chemosphere, 59: 1583-1593. [ Links ]
FECHA DE RECEPCIÓN: 10/08/2010 FECHA DE ACEPTACIÓN: 15/02/2013
*Contribución No. 1121 del Instituto de Investigaciones Marinas y Costeras (Invemar).