Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.42 no.1 Santa Marta Jan./June 2013
NOTA:
COMPORTAMIENTO CIRCADIANO DEL GASTERÓPODO NERITA SCABRICOSTA EN EL INTERMAREAL ROCOSO DE ISLA LA PALMA, PACÍFICO COLOMBIANO
CIRCADIAN BEHAVIOR OF THE GASTEROPOD NERITA SCABRICOSTA IN THE INTERTIDAL ROCKY SHORE OF ISLA LA PALMA, COLOMBIAN PACIFIC
Luz Ángela Flórez-Jaramillo1 y José Luis Cuéllar2
1 Universidad del Valle, Facultad de Ciencias, Departamento de Biología, Cali, Colombia. luzanflo@gmail.com.
2 Universidad Icesi, Facultad de Ciencias Naturales, Departamento de Biología, Cali, Colombia. jose.cuellar@correo.icesi.edu.co.
ABSTRACT
We studied the circadian behavior during the foraging activity of the gastropod Nerita scabricosta at low tide. To measure the behavior we recorded the traveled distance and corresponding duration during foraging activity, according to the dial periods (day and night) in April 2010. Gastropods were measured and weighed after finishing their activity. Finally, values of air temperature and humidity were recorded for each sampling time and dial period. The foraging activity by N. scabricosta did not vary significantly between day and night. However duration increased at night, period characterized by lower temperature and higher humidity. In addition, it was found that the activity was continuous, regardless the period.
KEY WORDS: Circadian behavior, Nerita scabricosta, physiological stress.
En las zonas intermareales rocosas se han descrito dos factores reguladores de las comunidades animales y vegetales. El primero es la depredación (carnivoría y herbivoría), el cual juega un papel importante en la regulación comunitaria de las franjas intermareales media y baja (Menge y Sutherland, 1976; Lubchenco y Menge, 1978; Navarrete, 2007). El segundo es el estrés físico -principalmente la desecación causada por el viento, la incidencia solar, la refracción del sustrato, la amplitud mareal, entre otros (Dayton, 1971)-, que actúa principalmente en la franja alta, la cual permanece más tiempo expuesta a estos factores, por lo que los organismos que la habitan presentan adaptaciones para soportar el alto estrés ambiental (Lewis, 1964; Garrity, 1984; Reichert et al., 2008).
Las respuestas de los individuos para poder sobrevivir a la presión ejercida por el ambiente en estas zonas, pueden ser fisiológicas (estructuras especializadas) y de comportamiento (cambios en los horarios de actividad) (Devi et al., 1985; Menge y Sutherland, 1987). Considerando que las especies intermareales son principalmente marinas, es probable que los factores abióticos (cambios en la temperatura y la salinidad, aumento de la radiación solar, disminución de la disponibilidad de agua, entre otros) sean más determinantes durante la marea baja (Garrity, 1984). Por esto, este trabajo evaluó el comportamiento circadiano del gasterópodo Nerita scabricosta (Lamarck) (Archaeogastropoda; Familia: Neritidae) durante la marea baja.
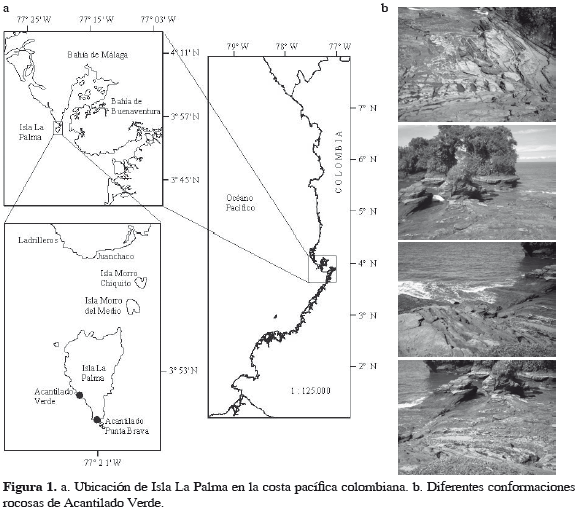
El estudio se realizó en Isla La Palma, ubicada a la entrada de Bahía de Málaga (4ºN-77º20'W), en la región central de la costa pacífica colombiana (Figura 1a). La isla presenta alta pluviosidad (6000 mm anuales en promedio), 90% de humedad relativa durante la mayor parte del año, la temperatura del agua varía entre 26.6 y 29.7 °C y la salinidad entre 1.3 y 30 (Cantera, 1991). Las mareas son semidiurnas con un ámbito promedio de 4 m (Ideam, 2008). La isla presenta acantilados compuestos principalmente por lodolitas y limolitas (López-Victoria et al., 2004), con alturas máximas entre 4 y 5 m, puntos con pendientes intermedias (escalonados) y playas con cantos rodados. Para el desarrollo de este trabajo se seleccionó el intermareal rocoso conocido como Acantilado Verde, una playa rocosa escalonada, ubicada al noroccidente de la isla (Figura 1b).
Inicialmente se localizaron las agrupaciones de N. scabricosta (Figura 2a) ubicadas en la franja alta del intermareal. El registro de los datos se realizó durante las mareas más bajas (puja) de abril de 2010, durante el día y la noche, en el momento en que los organismos salían de sus refugios para forrajear. Se tomaron 36 individuos en marea diurna y 36 en marea nocturna. A medida que salían de sus refugios, fueron aleatoriamente marcados con números sobre las conchas, luego se señaló la posición inicial de cada individuo enterrando en el sustrato una banderilla con el número respectivo (Figura 2b). Cada cinco minutos se registró la distancia recorrida en línea recta, desde la marca de inicio hasta la nueva posición, reubicando en esta la banderilla correspondiente a cada nerita. Se sumaron los valores de distancia y duración total de los desplazamientos, obteniendo un valor total para cada individuo. Finalizado el desplazamiento del forrajeo, se registró el peso total (masa corporal y concha) y las dimensiones (largo y ancho) de la concha de cada individuo. Adicionalmente se tomaron datos de temperatura y humedad del aire (con un termohigrómetro General Tools PTH 8708) cada cinco minuntos, desde el inicio de la actividad de los caracoles hasta el momento en que retornaban a su refugio, estos fueron promediados obteniendo un registro de temperatura y humedad para el día y otro para la noche.
Se realizaron pruebas t-Student para comparar la temperatura y la humedad entre el día y la noche. Se realizaron análisis de varianza de una vía (Anova) para evaluar el comportamiento de las neritas, representado por el desplazamiento (min) y la distancia recorrida (cm), teniendo como fuente de variación el período (día y noche). Los datos de desplazamiento fueron previamente transformados con logaritmo natural (Ln). Para obtener una medida unificada del tamaño se realizó un análisis de componentes principales utilizando las variables largo, ancho y peso, dando como resultado un índice compuesto del tamaño (PC1), donde el peso fue la característica con mayor representatividad. Este índice fue correlacionado con la distancia y el período de actividad (día/noche), usando correlaciones de Pearson en las cuales no se encontraron relaciones lineales significativas. Para evaluar si los períodos de actividad de los caracoles eran continuos se correlacionaron los datos de distancia recorrida contra los datos de duración de la actividad tanto de día como de noche usando una correlación de Pearson.
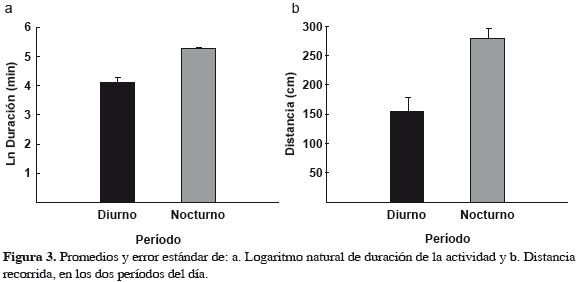
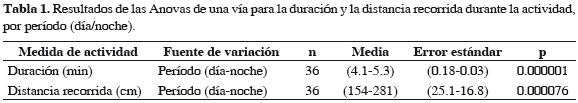
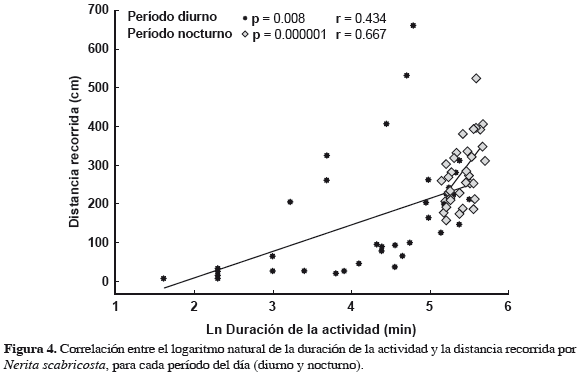
Se encontraron diferencias significativas entre los períodos diurno y nocturno en la duración de la actividad (Figura 3, Tabla 1; p = 0.000001) y en la distancia recorrida (Figura 3, Tabla 1; p < 0.000076), encontrando que las neritas presentan mayor actividad durante las mareas bajas nocturnas. Al comparar los resultados obtenidos de temperatura y humedad del aire, entre los períodos diurno y nocturno, se encontraron diferencias significativas, presentándose durante las mareas nocturnas los promedios más altos de humedad y bajos de temperatura (Tabla 2). En cuanto al tamaño, no se encontró ninguna relación de este con la actividad (duración: p = 0.457; distancia: p = 0.750), durante las mareas diurnas. Sin embargo, durante las mareas nocturnas se encontró una correlación negativa con la duración de la actividad (p = 0.0039, r = 0.436), aunque no con la distancia recorrida (p = 0.09). Finalmente, se encontró una correlación positiva entre la duración y distancia recorrida, tanto durante el día como en la noche (Figura 4; día: p = 0.008, r = 0.434; noche p = 0.000001, r = 0.667). Es decir que presentan un desplazamiento continuo y no tienen largos períodos de descanso o quietud durante el forrajeo.
Newell (1976) discutió acerca de cómo los organismos marinos pueden lidiar con el estrés físico en la zona intermareal, a través de la selección de microhábitats, cambios de comportamiento y adaptaciones estructurales y fisiológicas. En el caso de los gasterópodos se sabe que buscan un microhábitat que les sirva de refugio (Leviten y Kohn, 1980) durante las mareas bajas diurnas y en las mareas altas en general, alimentándose activamente lejos de estos refugios solo por períodos limitados de tiempo, cuando el estrés abiótico es mínimo (Bertness et al., 1981; Garrity y Levings, 1981, 1983; Levings y Garrity, 1983; Gray y Hodgson, 2004). Esto es coherente con los resultados obtenidos en este trabajo, en el cual los caracoles fueron más activos en la noche, cuando el estrés abiótico es bajo, mientras que durante el día se observó una disminución en la duración de su actividad de forrajeo. Incluso, resultó difícil encontrarlos fuera de sus refugios durante el día, mientras que en horas de la noche la gran mayoría salían a alimentarse.
Aunque la diferencia de la temperatura y la humedad entre el día y la noche no es tan grande, se puede inferir que pequeños cambios en la temperatura y la humedad influyen sobre el comportamiento de las neritas, ya que parecen estar reduciendo el estrés generado por la marea baja, a través de una prolongación de la duración y la distancia de sus recorridos durante el forrajeo, en las mareas nocturnas. Además se mantienen en movimiento constante la mayor parte del tiempo que pasan fuera de sus refugios, reduciendo así los efectos del estrés ambiental, ya que los individuos no se detienen durante el proceso de forrajeo, lo que supone recorridos más provechosos.
Por supuesto, estos resultados no son concluyentes y deben tomarse con cautela, ya que las medidas de peso se cuantificaron teniendo en cuenta la concha del individuo y no solo la masa corporal. El peso tuvo mayor representatividad en la medida unificada de tamaño (PC1) y esto pudo incidir sobre los resultados obtenidos ya que la masa corporal (el peso del individuo sin la concha) contiene más información sobre la capacidad fisiológica del individuo para responder al estrés ambiental (Vermeij, 1973). Nerita scabricosta presenta un comportamiento diferencial, tanto en la duración del desplazamiento como en la distancia recorrida entre el día y la noche. Lo anterior puede ser una estrategia usada para disminuir los efectos de la temperatura y la humedad, logrando así un forrajeo óptimo (costo-beneficio) en la zona alta del intermareal rocoso, la cual presenta un alto estrés ambiental.
BIBLIOGRAFÍA
1 Bertness, M. D., S. D. Garrity y S. C. Levings. 1981. Predation pressure and gastropod foraging: a tropical-temperate comparison. Evolution, 35: 995-1007. [ Links ]
2 Cantera, J. R. 1991. Etude structurale des mangroves et des peuplements littoraux des deux baies du pacifique colombien (Malaga et Buenaventura). Rapport avec les conditions du milieu et les perturbations anthropiques. Tesis Doctoral en Ciencias. Universidad de Aix-Marseille II. Marsella, Francia. 429 p. [ Links ]
3 Dayton, P. K. 1971. Competition, disturbance, and community organization: The provision and subsequent utilization of space in a rocky intertidal community. Ecol. Monogr., 41 (4): 351-389. [ Links ]
4 Devi, V. U., Y. P. Rao y D. G. V. Rao. 1985. Influence of temperature and size on the respiration of a tropical intertidal gastropod, Morula granulata (Duclos), in air and water. J. Comp. Phys., 156 (2): 247-250. [ Links ]
5 Garrity, S. D. 1984. Some adaptions of gasteropods to physical stress on a tropical rocky shore. Ecology, 65 (2): 559-574. [ Links ]
6 Garrity, S. D. y S. C. Levings. 1981. A predatory-prey interaction between two physically and biologically con-strained tropical rocky shore gastropods: direct, indirect, and community effects. Ecol. Monogr., 51: 267-286. [ Links ]
7 Garrity, S. D. y S. C. Levings. 1983. Homing to scars as a defense against predators in the pulmonate limpet Siphonaria gigas (Gastropoda). Mar. Biol., 72: 319-324. [ Links ]
8 Gray, D. R. y A. N. Hodgson. 2004. The importance of a crevice environment to the limpet Helcion pectunculus (Patellidae). J. Moll. Stud., 70: 67-72. [ Links ]
9 Ideam. 2008. Pronóstico de pleamares y bajamares costa pacífica colombiana. Informe técnico, Instituto de Hidrología, Meteorología y Estudios Ambientales, Bogotá. 85 p. [ Links ]
10 Levings, S. C. y S. D. Garrity. 1983. Diel and tidal movement of two co-occurring neritid snails: differences in grazing patterns on a tropical rocky shore. J. Exp. Mar. Biol. Ecol., 67: 261-278. [ Links ]
11 Leviten, P. J. y A. J. Kohn. 1980. Microhabitat resource use, activity patterns, and episodic catastrophe: Conus on tropical intertidal reef rock benches. Ecol. Monogr., 50: 55-75. [ Links ]
12 Lewis, J. R. 1964. The ecology of rock shores. English Univ. Press. Ltda., Londres. 323 p. [ Links ]
13 López-Victoria, M., J. R. Cantera, J. M. Díaz, D. M. Rozo, B. O. Posada y A. Osorno. 2004. Estado de los litorales rocosos en Colombia: acantilados y playas rocosas. 171-182. En: Invemar (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: año 2003. Serie de publicaciones periódicas No. 8, Invemar. Santa Marta. 329 p. [ Links ]
14 Lubchenco, J. y B. Menge, 1978. Community development and persistence in a low rocky intertidal zone. Ecol. Monogr., 59: 67-94. [ Links ]
15 Menge, B. A. y J. P. Sutherland. 1976. Species diversity gradients: synthesis of the roles of predation, competition, and temporal heterogeneity. Amer. Nat., 110 (973): 351-369. [ Links ]
16 Menge, B. A. y J. P. Sutherland. 1987. Community regulation: variation in disturbance, competition, and predation in relation to environmental stress and recruitment. Amer. Nat., 130: 730-757. [ Links ]
17 Navarrete, S. A. 2007. Maintenance of biodiversity. 76-81. En: Denny, M. W. y S. D. Gaines, editors. Encyclopedia of tidepools and rocky shores. University of California Press, Los Ángeles. 735 p. [ Links ]
18 Newell, R. C. 1976. Adaptations to intertidal life. 1-82. En: Newell, R. C. (Ed.). Adaptations to environment: essays on the physiology of marine animals. Butterworths, Londres. 544 p. [ Links ]
19 Reichert, K., F. Buchholz y L. Giménez. 2008. Community composition of the rocky intertidal at Helgoland (German Bight, North Sea). Helgol Mar. Res., 62: 357-366. [ Links ]
20 Vermeij, G. J. 1973. Morphological patterns in high-intertidal gastropods: adaptive strategies and their limitations. Mar Biol., 20: 319-346. [ Links ]
FECHA DE RECEPCIÓN: 23/11/2010 FECHA DE ACEPTACIÓN: 04/12/2012