Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.42 no.2 Santa Marta July/Dec. 2013
ABUNDANCIA Y MADUREZ SEXUAL DE ANADARA SIMILIS EN EL MANGLAR DE LUISICO, BAHÍA MÁLAGA, PACÍFICO COLOMBIANO*
ABUNDANCE AND SEXUAL MATURITY OF THE BIVALVE ANADARA SIMILIS IN LUISICO MANGROVE, BAHÍA MÁLAGA, COLOMBIAN PACIFIC
Alex E. Manjarrés-Villamil1 , Carlos H. Lucero-Rincón1, William O. Gualteros1, Jaime R. Cantera-Kintz2 y Diego L. Gil-Agudelo3
1 Instituto de Investigaciones Marinas y Costeras (Invemar) sede Pacífico, Cali, Colombia. ing.alexmanjarres@hotmail.com, carlucer01@yahoo.es, wgualteros@hotmail.com.
2 Universidad del Valle, Facultad de Ciencias Naturales y Exactas, Cali, Colombia. jcantera@univalle.edu.co.
3 Empresa Colombiana de Petróleos-Instituto Colombiano del Petróleo (ICP-Ecopetrol), Kilómetro 7 vía Piedecuesta-Bucaramanga, Colombia. diego.gil@ecopetrol.com.co, dl_gil@yahoo.com.
RESUMEN
La abundancia y madurez sexual de la piangua Anadara similis fue analizada mensualmente entre septiembre de 2009 y agosto de 2010 en el archipiélago de La Plata, Bahía Málaga, Pacífico colombiano. La madurez sexual se analizó a nivel macroscópico mediante la observación del tejido reproductivo en fresco y microscópico por medio de métodos histológicos estándares. Se estimó una densidad media de 0.130 ± 0.098 ind/m2 y una talla media de 42.30 ± 5.00 mm. Los meses de mayor densidad fueron mayo (0.295 ind/m2) y agosto (0.195 ind/m2). La talla media de madurez sexual fue de 41.8 ± 4.5 mm y talla media de 41 mm donde 50% de la población ha tenido mínimo un desove (L50%). Se registraron picos máximos reproductivos durante marzo (83.3%) y abril (75.0%), aunque durante todos los meses de estudio se evidenció actividad reproductiva. El 4.30% de los individuos presentaron casos de hermafroditismo, representando el primer registro de este tipo para la especie. La mayor densidad, mayor talla media, mayor rendimiento de carne en hembras y la presencia de un mayor volumen de tejido reproductivo femenino en hermafroditas, sugiere procesos de reversión sexual en esta especie, lo cual debería ser estudiado en detalle. Las bajas tallas de captura y de madurez sexual, así como la baja densidad de individuos encontrada, pueden ser producto de la alta presión por pesca, modificaciones de hábitat y procesos de contaminación, los cuales deben ser estudiados con el fin de implementar estrategias de manejo para este recurso en el área.
PALABRAS CLAVE: Anadara similis, madurez sexual, densidad, hermafroditismo, estructura de tallas.
ABSTRACT
The abundance and sexual maturity of piangua Anadara similis in La Plata Archipelago, Bahía Málaga, Pacific coast of Colombia, was analyzed between September 2009 and August 2010. Sexual maturity of these organisms was studied at macroscopic level using fresh samples and at microscopic level using standard histological techniques. The mean density was estimated in 0.130 ± 0.098 ind/m2 and the mean size was 42.30 ± 5.00 mm. Months with the presence of the highest densities of piangua were May (0.295 ind/m2) and August (0.195 ind/m2). The mean sexual maturity size was estimated in 41.8 ± 4.5 mm, while the size at which at least 50% of the population of A. similis have had its first spawn was estimated in 41 mm. Reproductive activity of the species was present year-round with higher peaks in March (83.33%) and April (75.00%). 4.30% of organisms analyzed showed signs of hermaphroditism, being this the first record of this kind for the species. Higher density, larger mean size, higher meat yield in females as well as the presence of more female reproductive tissue, suggest a process of sexual reversion in the species, which have to be further studied. Low capture and sexual maturity sizes, as well as the low density of organisms found during the present work, might be the product of high fishery pressure, habitat modifications, and pollution processes in the area, factors that have to be studied in detail in order to implement management strategies for the species.
KEY WORDS: Anadara similis, sexual maturity, density, hermaphroditism, size structure.
INTRODUCCIÓN
La piangua es un molusco bivalvo común en los ecosistemas de manglar del Pacífico colombiano. Son conocidas vulgarmente de esta forma dos especies de la familia Arcidae: Anadara tuberculosa (piangua hembra) y A. similis (piangua macho). Esta familia tiene una distribución circuntropical y las especies que incluye son comunes en zonas arenosas y fangosas, frecuentemente asociadas a la vegetación de manglar (Pathansali y Soong, 1958; Chanley, 1966; Squires et al., 1975).
Estas especies se asocian al ecosistema de manglar por debajo de las raíces de Rhizophora mangle y R. racemosa (Cantera y Contreras, 1978; Herrán, 1983), enterradas en sustratos fangosos típicos de este. Anadara tuberculosa habita por debajo de las raíces de entre 5 y 30 cm de profundidad, mientras que A. similis prefiere fondos blandos de la zona sublitoral, entre 15 y 50 cm de profundidad y en espacios abiertos (Mora, 1990; Borda y Cruz, 2004). Su hábitat está limitado por el tipo de sustrato y el nivel de las mareas, siendo restringido a un sustrato suave, tipo arcilloso a limo-arcilloso, en las partes externas de los canales y donde el movimiento del agua es constante (Herrán, 1983).
Anadara similis posee una amplia distribución a lo largo de la costa del Pacífico americano, desde Corinto en Nicaragua, hasta Tumbes en Perú (Musello et al., 2002); sin embargo, es en general menos abundante que la piangua hembra, razón por la cual ha sido menos estudiada. Esta especie presenta una concha blanca de forma ovalada relativamente delgada con los extremos redondeados y cubierta por un periostraco café oliváceo. Posee entre 40 y 44 costillas axiales, cubiertas con pequeños tubérculos, especialmente cerca del margen ventral (Mijail et al., 2002). Su ciclo reproductivo es continuo durante todo el año, semejante al de A. tuberculosa (Herrán, 1983).
Anadara similis, al igual que A. tuberculosa, es de gran importancia económica y social y es un recurso costero que ha venido siendo utilizado por las comunidades afrodescendientes habitantes del litoral Pacífico colombiano desde tiempos muy antiguos, como lo demuestran los restos de conchas que se encuentran en muchas regiones de la costa pacífica (Lucero y Cantera, 2008). En Colombia, más de 6000 familias derivan su sustento de este recurso (Gil-Agudelo et al., 2011). En la costa pacífica colombiana se viene explotando de manera continua y es utilizada para el consumo y comercio local, representando el 25% de las capturas de piangua (A. tuberculosa + A. similis) (Gil-Agudelo et al., 2011).
A pesar de su importancia, como base de la autonomía alimentaria en las regiones costeras de Colombia y de América, son pocos los trabajos sobre esta especie. Los estudios sobre A. similis han abordado aspectos relacionados con tallas de madurez y épocas reproductivas (Cruz y Palacios, 1983; Cruz-Soto y Jiménez, 1994; Mijail et al., 2002), crecimiento (Musello et al., 2002), densidad (Silva y Bonilla, 2001) y estructura de tallas y proporción sexual (Flores y Licandeo, 2010). En la costa pacífica colombiana, los estudios sobre A. similis cubren algunas observaciones sobre la captura de juveniles (Borrero, 1982), reproducción y abundancia (Herrán, 1983) y densidades (Cantera y Contreras, 1978; Lucero y Cantera, 2008; Lucero et al., 2012). En el presente trabajo se estudió el ciclo reproductivo, tallas y abundancia de A. similis dentro de una visión temporal, como base para futuros planes de manejo en la región, ya que, a pesar de su importancia socioeconómica, existe poca información sobre su estado y aspectos biológicos tanto en Bahía Málaga como en el resto del Pacífico colombiano.
ÁREA DE ESTUDIO
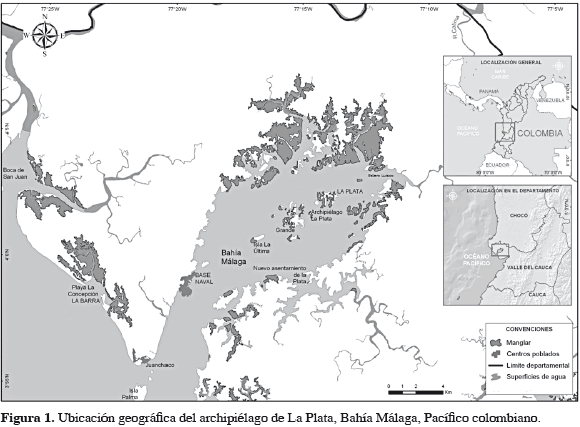
El estero de Luisico, archipiélago de La Plata, está localizado al interior de Bahía Málaga (04°03'50.5"N-77°12'47.8"W) en la costa pacífica colombiana. Presenta un área aproximada de 136 km2 en la parte marino-costera (Cantera, 1991) y posee biotopos tales como playas arenosas, playas rocosas, acantilados terciarios y manglares en forma dispersa en toda su longitud (Figura 1). Hacia la parte interna de Bahía Málaga se desarrollan verdaderos manglares ribereños bordeados por mangle rojo (Rhizophora spp.). Las comunidades aledañas al área objeto de estudio se dedican principalmente a la pesca de camarón y pargo rojo y la extracción de piangua; esta última labor realizada principalmente por mujeres.
MATERIALES Y MÉTODOS
Los muestreos fueron realizados mensualmente entre septiembre de 2009 y agosto de 2010 mediante muestreo aleatorio simple. Las capturas de A. similis se realizaron siguiendo el método tradicional de recolección en el ecosistema de manglar en cuatro parcelas de 50 m2 para determinar la densidad en individuos por metro cuadrado; los especímenes fueron colectados por piangüeras expertas durante marea baja, haciendo un barrido en toda el área seleccionada con tiempo y número de personas definidos (45 minutos, cuatro personas). Adicionalmente, cuatro muestras de sedimento de aproximadamente 300 g cada una fueron recolectadas para análisis de granulometría y se registró la salinidad para cada una de las parcelas con un salinómetro YSI modelo 30. A todos los individuos obtenidos se les midió la longitud total de la concha (distancia desde el borde anterior hasta la parte más externa del borde posterior), altura (desde el umbo hasta el margen ventral) y ancho (distancia entre las partes más prominentes de las dos valvas), con un calibrador digital con una precisión de 0.01 mm. Se estableció el peso total y el peso de la carne con una balanza con precisión de 1 g. La variación de la densidad entre los meses de estudio se analizó aplicando métodos gráficos de distribución.
Las muestras de sedimento obtenidas para cada mes fueron sometidas a un tratamiento de floculación para la separación de partículas menores y tamizado en húmedo. El resto del material fue secado en una estufa para su posterior tamizado en seco. Se emplearon tamices con tamaño de malla de 2000, 1000, 500, 250, 125 y 63 µm. El material retenido en cada tamiz fue pesado en una balanza con precisión de 0.01 g. Los datos obtenidos fueron analizados en el programa Gradistat (Blott y Pye, 2008) obteniendo las medidas de media gráfica, coeficiente de selección, simetría y curtosis. Con el fin de correlacionar el ciclo reproductivo con la salinidad intersticial se aplicó un análisis de correlación por rangos de Spearman dado que los datos no fueron paramétricos.
Análisis del ciclo reproductivo
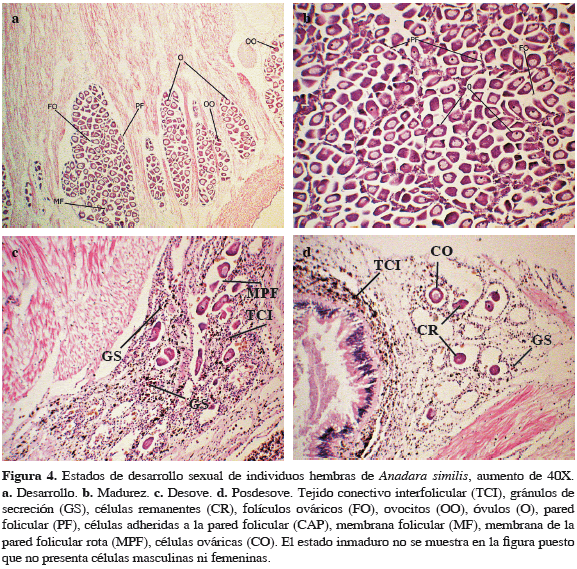
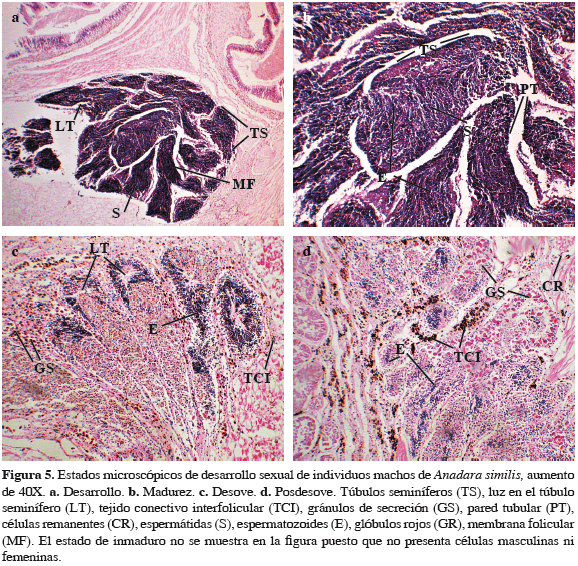
En fresco se realizaron cortes transversales (anterior, medio y posterior) para identificar el color, ubicación y distribución de la glándula reproductora en cada individuo. Cada corte incluyó desde las inmediaciones del músculo aductor anterior hasta la base entre el pie y los músculos del cuerpo. En los casos en que no fue posible observar la gónada o parte de ella con este método, se procedió a realizar cortes longitudinales (superior, medio e inferior) desde la región más próxima al músculo aductor anterior hasta el aductor posterior, con el fin de observar la pequeña gónada en desarrollo. Macroscópicamente se determinaron tres estados de desarrollo sexual (reposo, desarrollo y madurez). El desove no fue considerado mediante observación macroscópica debido a la dificultad de diferenciar los estados de desarrollo indiferenciado con desoves parciales y con desoves totales. La coloración de la gónada se determinó utilizando categorías de colores presentadas en trabajos anteriores para A. tuberculosa (Herrán, 1983; Borda y Cruz, 2004; Lucero et al., 2012), la cual corresponde a crema y blanco para los machos y anaranjado para las hembras.
El volumen ocupado por la gónada se expresó en porcentaje de la gónada respecto al cubrimiento de la cavidad visceral. Se consideraron individuos en categoría cero (0) o estado de reposo cuando no fue posible observar la glándula reproductora después de los diversos cortes, por lo que su sexo no pudo ser definido. Los individuos de categoría uno (1) se consideraron en desarrollo debido a que la gónada fue poco abundante pues están entrando a una fase de madurez. Finalmente la categoría dos (2) o madurez presenta una gónada con gran volumen, cubriendo más del 50% de la cavidad visceral, estado en el que ya son posibles eventos de desove.
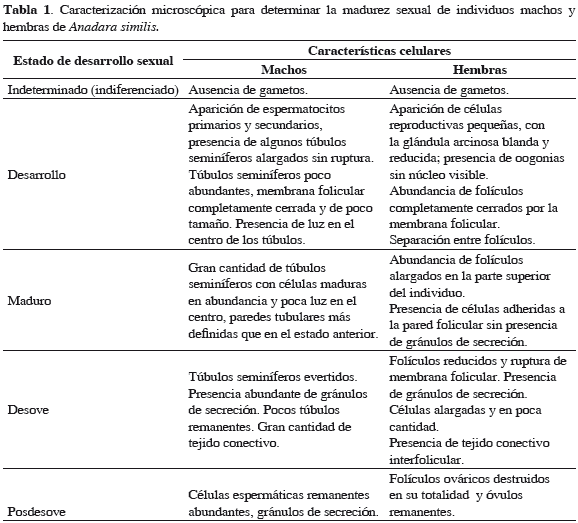
Para analizar la madurez sexual a nivel microscópico se utilizaron las escalas propuestas por Herrán (1983), Cruz y Palacios (1983) y Lucero et al. (2012), adicionando nuevas observaciones (Tabla 1). Los estadios clasificados fueron: indeterminado, desarrollo, madurez, desove y posdesove. Para ello, se emplearon 20 individuos cada mes para el análisis histológico. Se extrajeron las gónadas por disección del tracto reproductivo correspondientes a la parte media del corte longitudinal y del transversal. Los cortes fueron de aproximadamente 2 cm de espesor. Las muestras se deshidrataron en una batería creciente de etanol y se incluyeron en parafina. Se realizaron cortes de 7 µm de grosor y fueron teñidos con hematoxilina-eosina (Herrán, 1983). Finalmente los cortes se deshidrataron con etanol, se aclararon con xileno y el montaje definitivo se hizo con resina sintética.
Se determinó el índice de madurez sexual (IMS) mensual con los datos macroscópicos, mientras que las observaciones microscópicas permitieron describir las características de cada estado de desarrollo sexual. El IMS relaciona el número de individuos maduros con el total de individuos analizados. Se realizó el análisis de los patrones de reclutamiento para tener una estimación indirecta de los meses de mayor actividad reproductiva mediante el programa de computación Fisat, de distribución gratuita, el cual integra el método de Battacharya en la ecuación. El rendimiento de la carne se calculó considerando el peso fresco de la carne con relación al peso total (Cruz y Palacios, 1983).
Análisis de talla y peso
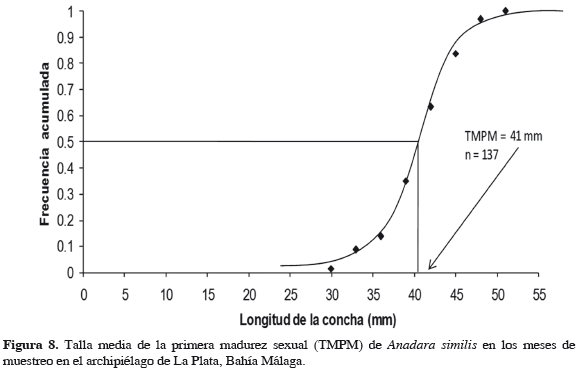
Debido a que se desconoce el ámbito de tallas en el que se encuentran organismos juveniles y adultos de la especie, las longitudes obtenidas fueron clasificadas arbitrariamente en tres grupos: 0-30 mm como tallas pequeñas, 30-45 mm como tallas medianas y mayores de 45 mm como tallas grandes. La talla media de madurez sexual (TMMS) fue determinada mensualmente con un intervalo de confianza del 95%, mientras que la talla media en donde la población ha tenido por lo menos un desove (L50%) fue obtenida aplicando la metodología propuesta por Borda y Cruz (2004), consistente en realizar un gráfico de ojiva suavizada de distribución de frecuencias para variables continuas donde la longitud media se establece en el punto donde la curva corta el 50% de las frecuencias acumuladas. Este análisis se hizo con los datos de longitud de la concha de individuos maduros.
RESULTADOS
Parámetros ambientales
El tipo de sustrato encontrado fue en su mayoría de tipo limo-arcilloso (< 63 µ), característico de las zonas de manglar. La salinidad media en los meses de muestreo fue de 18.32 ± 4.38. Las salinidades más bajas se registraron en mayo (9.36), septiembre (14.37), noviembre (13.42) y diciembre (12.6), mientras que las más altas fueron en enero (20.92), abril (21.27) y junio (24.70). Durante el tiempo de estudio se encontró una relación entre la salinidad y el índice de madurez sexual de r2= 0.65.
Análisis del ciclo reproductivo
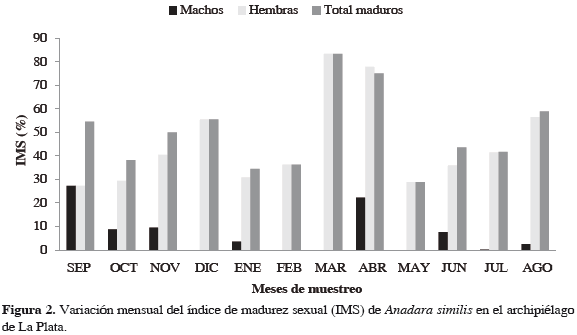
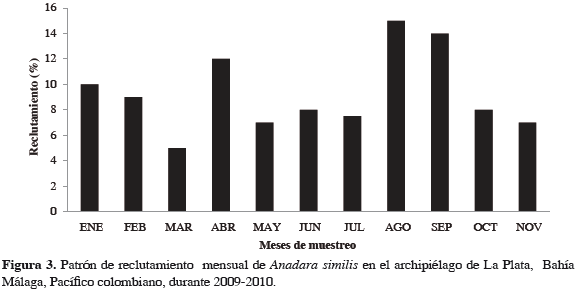
Se analizaron 347 individuos, 198 hembras y 35 machos; a 114 no se les pudo determinar el sexo (indeterminados). Anadara similis presentó picos de mayor actividad reproductiva en septiembre, noviembre, diciembre, marzo, abril y agosto, siendo marzo y abril los de mayor intensidad; los meses restantes presentaron un IMS inferior a 50%. No obstante, siempre se encontraron individuos maduros durante el tiempo de estudio, con un IMS superior a 25%. Las hembras presentaron IMS mayor que los machos, exceptuando septiembre cuando ambos presentaron un IMS similar (27%), siendo este el mayor IMS presentado por los machos (Figura 2). Se observó reclutamiento continuo durante el tiempo de estudio, con mayor incidencia en agosto y septiembre (Figura 3).
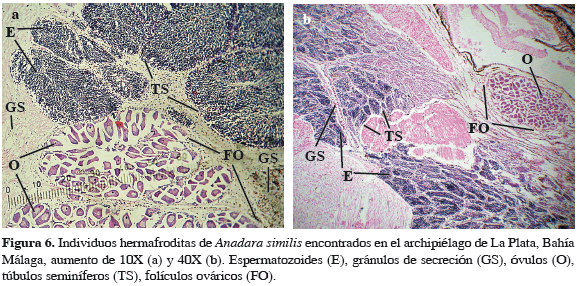
El análisis histológico de individuos machos y hembras de A. similis reveló la presencia de cinco estados de desarrollo gonadal (Tabla 1) para A. tuberculosa en la misma zona. El 83.4% de los organismos evaluados presentaron células sexuales en estado de madurez, mientras que 8.6% no presentaron ninguna definición sexual a nivel micro o macroscópico (Figuras 4 y 5). Se presentaron 15 casos de individuos hermafroditas (4.3%), los cuales presentaron estructuras foliculares ováricas y túbulos seminíferos con capacidad para producir óvulos y espermatozoides de manera sincrónica en sus diferentes estados de reproducción en el mismo individuo, los cuales fueron encontrados en los períodos de noviembre y diciembre de 2009 y agosto de 2010 (Figura 6).
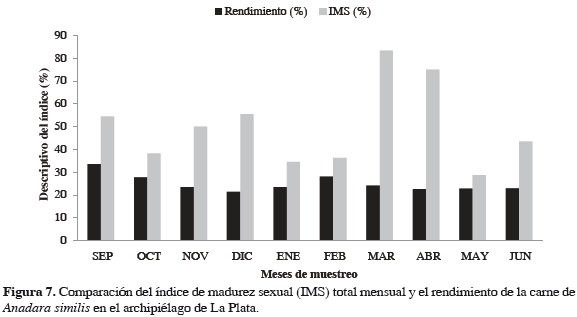
Los individuos machos presentaron un rendimiento medio de carne mayor (26.20%, mínimo: 11.67%, máximo: 38.26%) que las hembras (23.93%, mínimo: 8.98%, máximo: 61.72%). Sin embargo, el rendimiento promedio general de carne para A. similis fue de 24.27%. La relación entre el índice de madurez sexual y el rendimiento muestra una tendencia opuesta, indicando que A. similis aumenta su rendimiento en las épocas de menor actividad reproductiva (Figura 7).
Análisis de talla y peso
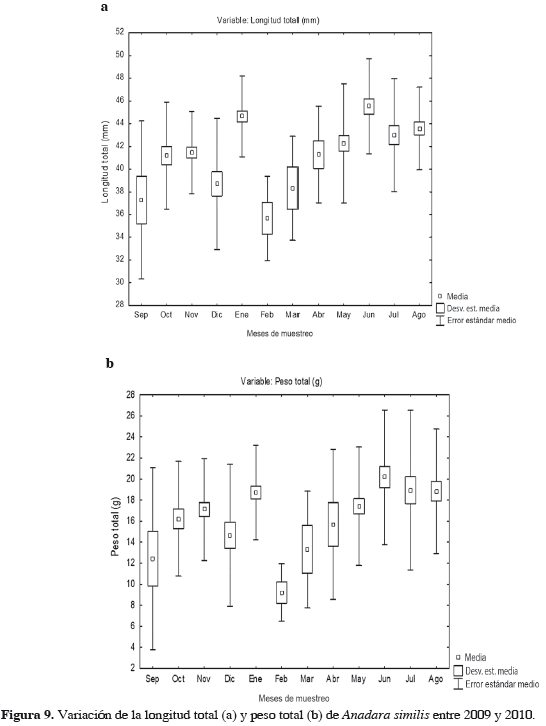
La talla media de captura encontrada fue de 42.30 ± 5.0 mm, con una talla mínima de 22.62 mm y máxima de 54.78 mm. El 1.32% corresponde a individuos con tallas entre 0 y 30 mm, 69.05% entre 30 y 45 mm y 29.63% restante a los individuos mayores a 45 mm. En general, no se presentaron diferencias significativas en la longitud total en los diferentes meses, excepto entre enero y febrero, y entre junio y agosto (H11,3.78 = 68.28968; p < 0.05).
La talla media de madurez encontrada para la especie durante este estudio fue de 41.84 ± 4.50 mm, con un promedio de 42.06 ± 4.45 mm en hembras y 40.52 ± 4.87 mm en machos, encontrando que las hembras son generalmente de mayor talla que los machos (t0.05;197 = 1.645; p < 0.05). Por su parte, la talla mínima de madurez encontrada fue de 28.46 mm en hembras y 31.83 mm en machos mientras las tallas máximas de madurez halladas fueron 50.04 mm para hembras y 48.46 mm para machos. Finalmente, la talla donde el 50% de la población ha tenido mínimo un desove (Lt50%) es de 41 mm (Figura 8).
Los pesos promedio total y de carne fueron 17.39 ± 6.19 g y 4.14 ± 1.58 g, respectivamente. No se encontraron diferencias significativas entre los meses de estudio (H11,378 = 41.75529; p < 0.05, H11,378 = 37.38596; p < 0.05, respectivamente), presentando los menores valores en febrero (9.21 y 2.48 g, respectivamente) y los mayores en junio (20.17 y 4.52 g) (Figura 9).
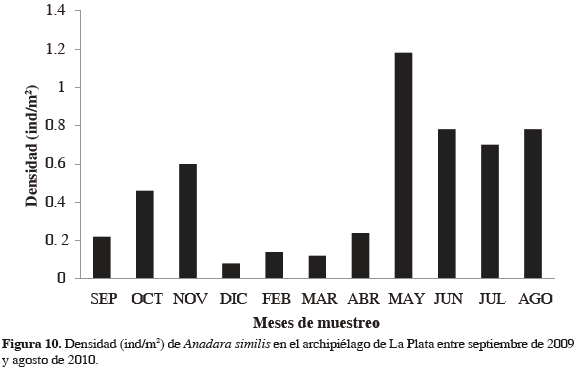
Variación temporal de la densidad
Se encontraron 378 individuos entre septiembre de 2009 y agosto de 2010, representando una densidad promedio de 0.13 ± 0.01 ind/m2. Se presentó una variación entre los meses de muestreo con mayor densidad en mayo y agosto y menor en febrero y marzo (Figura 10). Las hembras presentaron una abundancia mayor que los machos con promedio de 0.073 ind/m2 y 0.014 ind/m2. La proporción sexual de la especie durante el tiempo de estudio fue de 6:1 (hembras-macho).
DISCUSIÓN
Reproducción y hermafroditismo
Anadara similis mostró signos de madurez sexual y desoves simultáneos durante todos los meses del año de estudio, presentando reproducción de tipo continua. Sin embargo, en marzo-abril hay mayor proporción de individuos sexualmente maduros, seguida de un fuerte desove en mayo. Estos meses son importantes para aplicar estrategias de manejo para esta especie en la región, como en el caso de vedas, ya que se estaría protegiendo la población sexualmente madura y la desovante. Herrán (1983), para la bahía de Buenaventura, también encontró actividad reproductiva de forma continua durante todo el año, con picos en marzo como en el presente trabajo, pero también en julio y septiembre; las diferencias entre estos estudios pueden estar relacionadas con los cambios climáticos en la temporalidad del estudio y por condiciones geográficas entre las localidades. La variación en el régimen de pluviosidad a nivel espacio-temporal en el Pacífico colombiano puede ser un indicador de estas variaciones reproductivas de A. similis, ya que la pluviosidad es considerada un factor influyente en los mecanismos reproductivos de las especies de Anadara, así como lo demuestran otros autores para A. tuberculosa (Cruz y Palacios, 1983; Herrán, 1983; Cruz, 1984; Borda y Cruz, 2004, Lucero et al., 2012). Es posible que la finalización del evento oceanográfico El Niño en marzo de 2010 y el inicio de La Niña en mayo (Ideam, 2010) hayan incidido en los picos de madurez encontrados, variando las condiciones ambientales de la región tales como salinidad (valor más bajo de 9.36 en mayo) y temperatura. Resultados similares fueron encontrados por Vega (1994), quien registró que salinidades altas favorecen el proceso de reproducción de A. tuberculosa y A. similis.
La alta proporción de hembras encontrada con respecto a los machos (6:1) contrasta con lo registrado por Cruz (1984) y Silva y Bonilla (2001) para Costa Rica, quienes encontraron una proporción muy cercana a 1:1. Sin embargo, Flores y Licandeo (2010) mencionan también una mayor abundancia de hembras con respecto a los machos de esta especie (2.6:1) en Ecuador, mientras que en Colombia, Herrán (1983) registró una proporción de hembras:machos de 2:1 para la bahía de Buenaventura, lo cual es inferior a lo encontrado en el presente trabajo. La diferencia en la proporción hembras:machos, encontrada en el presente estudio, puede ser una condición de reversión sexual y hermafroditismo para esta especie, así como lo demuestran Mzighani (2005) y Afiati (2007) para otras especies de Anadara. El análisis histológico realizado mostró evidentes casos de hermafroditismo de esta especie (4.3%), siendo este el primer registro de este tipo para A. similis. La mayor proporción encontrada de hembras respecto a los machos en A. similis, la mayor longitud de estas últimas y el mayor volumen de tejido reproductivo femenino que masculino encontrado en hermafroditas, podría sugerir procesos de reversión sexual en esta especie, lo cual debería ser estudiado en detalle.
Mijail et al. (2002) registraron una talla mínima de madurez de 28.00 mm para esta especie en Nicaragua, similar a lo encontrado en el presente trabajo (28.46 mm), lo cual sugiere un inicio temprano de la actividad reproductiva. El alto porcentaje de captura encontrado en este trabajo (60.05%) con tallas entre 30 y 45 mm es similar a lo registrado por Lucero et al. (2012) en la misma zona, encontrando que el 60% de las capturas se ejercieron sobre individuos menores de 40 mm de longitud. Esto evidencia una fuerte captura en la población reproductora, considerándose un indicador de niveles altos de explotación en la zona y vulnerabilidad de la especie. Autores como Stern-Pirlot y Wolff (2006) y Flores y Lincadeo (2010) también indican que la estructura de tallas relativamente más bajas es producto de la presión por pesca, por lo que se hace necesaria la implementación de estrategias de manejo para este recurso. Se evidenció reclutamiento durante todo el año; sin embargo, durante los meses de agosto y septiembre se registraron los mayores procesos para este manglar, tres meses después del mayor pico de madurez sexual en la zona (abrilmayo), coincidiendo con lo indicado por Lucero et al. (2012), quienes encontraron un tiempo de reclutamiento de entre uno y tres meses luego de los eventos de desove.
Rendimiento
El rendimiento de carne promedio encontrado para A. similis fue de 21.30%, similar al 21.22% registrado por Silva y Bonilla (2001). Sin embargo, los machos presentaron un rendimiento de carne menor (18.10%) que las hembras (24.52%). Las variaciones del rendimiento y la madurez sexual encontradas en A. similis, especialmente en noviembre y mayo, sugieren un aumento de carne cuando el animal reduce su actividad sexual, siendo un indicativo de la inversión o gasto de energía en la reproducción antes que en el crecimiento corporal. Squires et al. (1975) encontraron relaciones similares para esta especie en Buenaventura, pero otros autores sugieren que se incrementa el rendimiento de la carne cuando se aproxima la madurez sexual debido al aumento del volumen de la gónada (Cruz y Palacios, 1983). El rendimiento también es un indicador de la calidad del ambiente en que vive este recurso, ya que la producción de carne está relacionada con la precipitación, el aumento de materia orgánica y disposición de nutrientes en las áreas de manglar, como lo indican Cruz y Palacio (1983), Vega (1994) y Silva y Bonilla (2001) en Costa Rica.
Densidad
La densidad encontrada en este estudio no se considera diferente a la registrada por Lucero et al. (2012) de 0.1 ind/m2 en la misma zona y Lucero y Cantera (2008) de 0.05 ind/m2 en Cauca. Sin embargo es menor que la registrada en Costa Rica por Silva y Bonilla (2001) de 0.2 ind/m2. La densidad encontrada de esta especie puede ser un indicador de disminución de la población, así como lo sugieren Silva y Bonilla (2001) para Costa Rica y Lucero et al. (2012) para Colombia. La escasa densidad con tallas de captura y madurez sexual bajas encontradas en este estudio sugieren que esta especie se encuentra en un estado de vulnerabilidad, por lo que se hace necesario iniciar estrategias de manejo sostenible. Adicional a ello, es relavante continuar los estudios en los aspectos reproductivos, pues la condicion de hermafroditismo aquí encontrada debe ser analizada en detalle para determinar si ella y procesos de reversión sexual están determinados por el nivel de explotación, variaciones ambientales, modificación del habitat o es una condicion biológica de la especie, como en otros moluscos.
BIBLIOGRAFÍA
1 Afiati, N. 2007. Hermaphroditism in Anadara granosa (L.) and Anadara antiquata (L.) (Bivalvia: Arcidae) from central Java. J. Coastal Develop., 10: 171-179. [ Links ]
2 Blott, S. J. y K. Pye. 2005. Gradistat: a grain size distribution and statistics package for the analysis of unconsolidated sediments. Earth Surf. Process. Landforms, 26: 1237-1248. [ Links ]
3 Borda, C. A. y R. Cruz. 2004. Pesca artesanal de bivalvos (Anadara tuberculosa y A. similis) y su relación con eventos ambientales. Pacífico colombiano. Rev. Invest. Mar., 25 (3): 197-208. [ Links ]
4 Borrero, F. 1982. Observaciones sobre la recolección de juveniles de "piangua", Anadara spp. y las condiciones oceanográficas en el área de Punta Soldado, bahía de Buenaventura. Tesis Biología, Univ. del Valle, Cali. 110 p. [ Links ]
5 Cantera J. 1991. Etude structurale des mangroves et des peuplements macrobenthiques littoraux de deux bailes du pacifique colombien (Malaga et Buenaventura) rapport avec les conditions du milieu et les perturbations anthropiques. Tesis de Doctorado, Universidad de Aix-Marseille, Marsella, Francia. 439 p. [ Links ]
6 Cantera, J. R. y R. Contreras. 1978. Informe preliminar sobre el potencial malacológico aprovechable en el Pacífico colombiano. Mem. I. Sem. Ocean. Pac. Sudamer., 2: 440-474. [ Links ]
7 Chanley, P. 1966. Larval development of the large blood clam, Noetia ponderosa (Say). Proc. Nat. Shellfish. Ass., 56: 53-58. [ Links ]
8 Cruz, R. A. 1984. Algunas aspectos de la reproducción en Anadara tuberculosa (Pelecypoda: Arcidae) de Punta Morales, Puntarenas, Costa Rica. Rev. Biol. Trop., 32 (1): 45-50. [ Links ]
9 Cruz, R. A. y J. A. Palacios. 1983. Biometría del molusco Anadara tuberculosa (Pelecipoda: Arcidae) en Punta Morales, Puntarenas, Costa Rica. Rev. Biol. Trop., 31: 175-179. [ Links ]
10 Cruz-Soto, R. A. y J. A. Jiménez. 1994. Moluscos asociados a las áreas de manglar de la costa pacífica de América Central. Editorial Fundación UNA, Heredia. 182 p. [ Links ]
11 Flores, L. y R. Licandeo. 2010. Estructura de tallas y proporción sexual de Anadara tuberculosa y Anadara similis en una reserva de manglares al noroeste de Ecuador. Rev. Biol. Mar. Oceanog., 45 (3): 541-546. [ Links ]
12 Gil-Agudelo, D. L., S. Espinosa, M. F. Delgado, W. Gualteros, C. H. Lucero y J. Cantera. 2011. La pesquería tradicional de piangua en el Pacífico colombiano, entre la subsistencia y el comercio. 49-79. En: Díaz, J. M., C. Vieira y G. Melo (Eds.). Diagnóstico de las principales pesquerías del Pacífico. Fundación Marviva-Colombia, Bogotá. 242 p. [ Links ]
13 Herrán, Y. 1983. Observaciones sobre el desarrollo gonadal de la "Piangua" Anadara tuberculosa (Sowerby, l833) y Anadara similis (Adams, 1852) en Punta Soldado, bahía de Buenaventura. Tesis de Biología, Univ. del Valle, Cali. 110 p. [ Links ]
14 Ideam. 2010. Boletín informativo sobre el monitoreo del fenómeno de "El Niño". Boletín 14. 10 p. [ Links ]
15 Lucero, C. H. y J. R. Cantera. 2008. Análisis de la explotación de la piangua Anadara tuberculosa y A. similis en el Consejo Comunitario de Cuerval-Cauca, Pacífico colombiano. Inf. Tec. Ecofondo. CCl-Cuerval. Guapi, Colombia. 28 p. [ Links ]
16 Lucero, C., J. Cantera y R. Neira. 2012. Pesquería y crecimiento de la piangua (Arcoida: Arcidae) Anadara tuberculosa en Bahía de Málaga del Pacífico colombiano, 2005-2007. Rev. Biol. Trop., 60: 203-217. [ Links ]
17 Mijail, P., I. Siria, M. Sotillo y E. Vargas. 2002. Norma técnica para regular la extracción y aprovechamiento sostenible de la concha negra en el Pacífico de Nicaragua. Informe final, Universidad Centroamericana, Managua. 68 p. [ Links ]
18 Mora, E. 1990. Catálogo de bivalvos marinos del Ecuador. Inst. Nal Pesca, Bol. Cient. Técn., 10 (1): 1-136. [ Links ]
19 Musello, C., M. Álvarez y L. Flores. 2002. Crecimiento de Anadara similis (C.B. Adams, 1852) en la Reserva Ecológica de Manglares Cayapas-Mataje, Remacam: Una aproximación basada en tallas. Facultad de Ingeniería Marítima y Ciencias del Mar, Guayaquil. 7 p. [ Links ]
20 Mzighani, S. 2005. Fecundity and population structure of cockles, Anadara antiquata L. 1758 (Bivalvia: Arcidae) from a sandy/muddy beach near Dar es Salaam, Tanzania. Western Indian Ocean J. Mar. Sci., 4 (1): 77-84. [ Links ]
21 Pathansali, D. y M. K. Soong. 1958. Some aspects of cockle (Anadara granosa L.) culture in Malaya. Proc. Indo-Pacific. Fish. Council, 8 (11): 26-31. [ Links ]
22 Silva, A. y R. Bonilla. 2001. Abundancia y morfometría de Anadara tuberculosa y A. similis (Mollusca: Bivalvia) en el manglar de Purruja, Golfo Dulce, Costa Rica. Rev. Biol. Trop., 49 (Supl. 2): 315-320. [ Links ]
23 Squires, H. J., M. Estévez, O. Barona y O. Mora. 1975. Mangrove cockles, Anadara spp. (Mollusca: Bivalvia) of the Pacific Coast of Colombia. The Veliger, 18 (1): 57-68. [ Links ]
24 Stern-Pirlot, A. y M. Wolff. 2006. Population dynamics and fisheries potential of Anadara tuberculosa (Bivalvia: Arcidea) along the Pacific coast of Costa Rica. Rev. Biol. Trop., 54: 87-99. [ Links ]
25 Vega, A. J. 1994. Estructura de población, rendimiento y épocas reproductivas de Anadara spp. (Bivalvia: Arcidae) en la Reserva Forestal Térraba-Sierpe, Puntarenas, Costa Rica, con recomendaciones para su manejo. Tesis de Maestría, Univ. de Costa Rica, San José. 114 p. [ Links ]
FECHA DE RECEPCIÓN: 28/11/2011 FECHA DE ACEPTACIÓN: 28/02/2013
*Contribución No. 1128 del Instituto de Investigaciones Marinas y Costeras (Invemar).