Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.43 no.1 Santa Marta Jan./June 2014
DESCRIPCIÓN DEL HÁBITO ALIMENTARIO DE DOCE ESPECIES DE PECES ASOCIADOS A LA CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA
DESCRIPTION OF THE FEEDING HABITS OF TWELVE SPECIES OF FISHES FROM THE CIÉNAGA GRANDE DE SANTA MARTA, COLOMBIA
Dáninso Gámez Barrera, Eliana Morón Granados y Juan Fuentes Reines
Universidad del Magdalena, Grupo de Investigación en Limnología. A. A. 731, Santa Marta, Colombia. daninso@gmail.com, elianamariamorongranados@gmail.com, juanmanuelfuentesreines@yahoo.com.
RESUMEN
Se evaluaron los cambios de los componentes alimentarios de 12 especies de peces asociados al área suroriental de la Ciénaga Grande de Santa Marta, Colombia; en total se capturaron 2035 peces. En algunas especies se observaron variaciones en el componente alimentario a nivel de tallas, tiempo y espacio, principalmente en Ariopsis sp., Cathorops mapale, Lycengraulis batesii, Astyanax magdalenae y Aequidens pulcher. En cuanto a la similitud de dietas entre especies, se observaron dos grupos principales. El primero se dividió en tres subgrupos: uno compuesto por A. magdalenae y Roeboides dayi, los cuales se caracterizaron por consumir insectos y zooplancton; el segundo compuesto por los peces generalistas Ariopsis sp., L. batesii y A. pulcher; y el tercero por los peces depredadores Caquetaia kraussii y Caquetaia kraussii. El otro grupo está compuesto por peces caracterizados por consumir fitoplancton y en menor proporción detritos y zooplancton (Oreochromis niloticus, Mugil incilis, M. liza y M. curema) o por principalmente detritos (Cyphocharax magdalenae).
PALABRAS CLAVES: Peces, dieta, contenido estomacal, macrófitas, mangles.
ABSTRACT
Changes in food composition of 12 species of fishes from the southeastern part of the Ciénaga Grande de Santa Marta, Colombia were evaluated; a total of 2035 individuals were sampled. Significant changes in food composition with size, time and space were observed, mainly in Ariopsis sp., Cathorops mapale, Lycengraulis batesii, Astyanax magdalenae, and Aequidens pulcher. Regarding diet similarity between species, two main groups were observed. The first one was divided in three subgroups: one characterized by fish foraging on insects and zooplankton is composed by A. magdalenae and Roeboides dayi; the second one is composed by the generalists Ariopsis sp., L. batesii, and A. pulcher, and the third one by fish predators Caquetaia kraussii and Caquetaia kraussii. The other group was characterized by fish feeding on phytoplankton and in a lower proportion on detritus and zooplankton (Oreochromis niloticus, Mugil incilis, M. liza, and M. curema) or on detritus (Cyphocharax magdalenae).
KEYWORDS: Fish, diet, stomach content, macrophytes, mangroves.
INTRODUCCIÓN
Los peces de las lagunas costeras son los principales almacenadores, transformadores y transportadores de energía dentro de ellas y con su entorno (Reid y Wood, 1976; Yáñez-Arancibia y Nugent, 1977; Yáñez-Arancibia, 1986; Yáñez-Arancibia et al., 1988). Estos sistemas se caracterizan por la diversidad de hábitats que presentan, los cuales son usados por los peces para cumplir su ciclo de vida, teniendo para ello adaptaciones morfológicas, fisiológicas y de comportamiento (Yáñez-Arancibia et al., 1994). El escenario de áreas estuarinas ilustra la relación existente entre el predominio de la diversidad como respuesta a la heterogeneidad espacial y las perturbaciones ambientales. Tales relaciones han sido bien documentadas a través de la cuantificación de interacciones entre especies y el efecto de épocas climáticas, la salinidad y la profundidad (Schluter y Ricklefs, 1993; Allen y Baltz, 1997; Christensen et al., 1997).
El conocimiento acerca del uso espacial y temporal del hábitat permite inferir las relaciones ecológicas entre los organismos, las cuales se reflejan en la composición de sus dietas (Sánchez et al., 1996). La adquisición de conocimientos de los hábitos alimentarios de las especies facilita entender la forma en que se desarrollan sus ciclos de vida (Wootton, 1990; Saucedo-Lozano et al., 1999; Bocanegra-Castillo et al., 2000). El análisis de los patrones tróficos proporciona información valiosa para comprender las interacciones y procesos que influyen en los cambios temporales de las comunidades. A pesar de la aparente importancia de la heterogeneidad temporal en la estructura y el funcionamiento de las comunidades de peces, pocos trabajos en los sistemas tropicales de Latinoamérica han incorporado esta variabilidad en sus estudios de la estructura trófica (Raz-Guzmán y Sánchez et al., 1996).
Pocos trabajos de dieta de peces en la Ciénaga Grande de Santa Marta (CGSM) están disponibles en la literatura, una serie de autores como Osorio (1988), Santos-Martínez y Arboleda (1993) y Torres et al. (2004) ya han estudiado la dieta de varias especies (Elops sauruss, Bairdiella ronchus, Mugil curema, M. incilis y M. liza), pero se carece de un estudio más completo. En tal contexto el objetivo de este trabajo fue evaluar la variación del componente alimentario de 12 especies de peces asociados al área suroriental de la Ciénaga Grande de Santa Marta, teniendo en cuenta el ciclo diario y la ubicación o tipo de hábitat (zona litoral y aguas abiertas). Así mismo, se evaluaron las diferencias del componente alimentario entre las especies.
ÁREA DE ESTUDIO
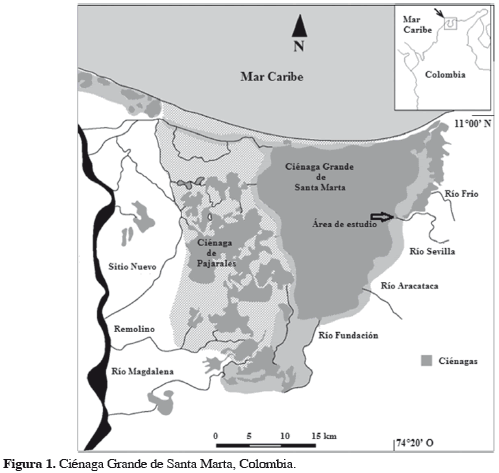
La Ciénaga Grande de Santa Marta (CGSM; Figura 1), es la laguna costera estuarina más grande de Colombia (450 km2), ubicada al norte del país sobre el Caribe, más específicamente en el departamento del Magdalena (10°20'-11°05'N y 74°06'-74°52'W). Está permanentemente comunicada con el mar Caribe a través de la boca de la Barra e indirectamente con el río Magdalena a través de canales naturales y artificiales. Sus aguas poseen una profundidad promedio anual de 1.5 m y una temperatura de 30 °C, en tanto la salinidad varía entre 9 y 33 (Mancera y Botero, 1993), de acuerdo con dos períodos climáticos: uno seco que va desde diciembre a marzo y otro lluvioso, desde abril a noviembre (Blanco et al., 2006). Es un área de elevada población e interés socioeconómico, pues por décadas sus habitantes han dependido en forma directa de la pesca artesanal. El estudio se llevó a cabo en la desembocadura del río Sevilla (10º52'N-64º19'W), ubicada en la parte suroriental, la cual contiene macrófitas predominantes como buchón de agua (Eichhornia crassipes), con una profundidad mínima de 60 cm y una máxima de 3 m.
MATERIALES Y MÉTODOS
Recolección de peces
Los peces se recolectaron mediante un diseño de muestreo que incluyó la variación espacial con dos estaciones cercanas al litoral (una denominada Frente al manglar y la otra Frente a las macrófitas) y una estación ubicada en aguas abiertas. Así mismo se contempló la variación temporal en escala horaria (6:00, 12:00 y 19:00 horas) y período climático (seco y lluvioso). Los muestreos se realizaron en marzo, abril, junio, julio, octubre y noviembre de 2009. Para realizar la captura de los peces se aplicó un esfuerzo estándar de seis lances con dos tipos de atarraya, que difirieron en el tamaño de malla (2 y 3 cm) para intentar reducir el efecto de la selectividad del arte. En cada sitio se realizaron 216 lances en total. Los peces recolectados se identificaron con las claves de Dahl (1971), Cervigón (1991, 1993), Betancur y Acero (2005) y Maldonado et al. (2005), y fueron contados, medidos con un ictiómetro y pesados con una balanza Ohaus de 5 kg de capacidad.
Análisis de las recolectas
Las muestras fueron procesadas aplicando la metodología de Laevastu (1980) y Marrero (1994). Cada pez fue disecado, se extrajo el estomago conservándolo en frascos con formol bufferado al 10%. Todos los frascos se rotularon, indicando la especie, el número de la muestra y la fecha. Luego, en el Laboratorio de Biología de la Universidad del Magdalena, el contenido estomacal de cada pez fue colocado en una placa Petri para separar, identificar y enumerar las presas presentes usando estereoscopio y microscopio. Las presas fueron identificadas hasta el nivel taxonómico permitido por el grado de digestión del alimento y agrupadas en presas, ítems o categorías. Cada grupo taxonómico fue pesado en una balanza eléctrica Ohaus (No. E12140) de 210 g (± 0.1 mg) de capacidad. Los métodos fueron aplicados individualmente en cada contenido estomacal. Para analizar el contenido estomacal de Mugil, Oreochromis y Cyphocharax (por el tipo de alimento que consumen) la muestra que se conservó con formol se agitó y se extrajo una submuestra que se distribuyó en un portaobjeto de 100 mm2, hasta alcanzar una distribución homogénea; por contenido estomacal se analizaron tres submuestras, haciendo tres conteos de cinco campos cada uno, obteniéndose un promedio por espécimen.
El coeficiente de vacuidad (CV) de los estómagos se calculó con la técnica de Windell (1971) (CV = 100 x No. estómagos vacíos/No. total de estómagos analizados). Tres métodos fueron utilizadas para cuantificar el contenido estomacal, expresado en valores promedio: frecuencia de aparición (FA), frecuencia numérica (FN) y gravimetría (G) (Windell, 1971; Windell y Bowen, 1978; Silva y Stuardo, 1985):
FO = 100 x ocurrencia de presas del ítem A/No. total de estómagos con alimento
FN = 100 x No. de presas del ítem A/No. total de presas (se aplicó en Mugil, Oreochromis y Cyphocharax)
G = 100 x peso de las presas del ítem A/peso de todas las presas.
Para establecer la importancia de cada presa en la composición de la dieta se estimó el índice de importancia relativa (IIR) de Yáñez-Arancibia et al. (1976) (IIR = FA x (G o FN)/100); en donde, IIR representa el índice de importancia relativa, FA es el porcentaje de la frecuencia de aparición, G es el porcentaje gravimétrico y FN es el porcentaje de la frecuencia numérica. Esta expresión es porcentual presentando de 0 a 100, donde 0 a 9.9% representa grupos tróficos de importancia relativa baja, de 10 a 40% grupos de importancia relativa secundaria y 40 a 100% grupos de importancia relativa alta (Yáñez et al., 1976).
El grado de utilización de los recursos alimentarios que pueden ser comunes a las especies estudiadas por coexistir en un mismo hábitat se evaluó cuantitativamente con el grado de interacción trófica entre las especies a través de la sobreposición de sus dietas mediante el índice de Morisita (Morisita, 1959). Este método está basado en la construcción de un dendrograma de afinidad entre las especies. La variable usada para construir el dendrograma utilizando el programa Primer 6 fue el IIR sin discriminar los estratos de tiempo y espacio analizados. Cuando el índice de Morisita es igual a 1, existe una superposición total y en consecuencia una competencia interespecífica, mientras que un valor de 0 indica una ausencia total de superposición trófica. Para definir si los grupos alimentarios de cada especie tenían diferencias estadísticas espacio-temporalmente, se aplicó un análisis de varianza (Anova), con diseño a tres factores: área de muestreo con tres niveles (Frente a las macrófitas, Frente al manglar y Aguas abiertas); tiempo de horario con tres niveles (6, 12 y 19 horas) y mes de captura con seis niveles (marzo, abril, junio, julio, octubre y noviembre), a las diferencias estadísticas encontradas se les aplicó la prueba de Tukey.
RESULTADOS
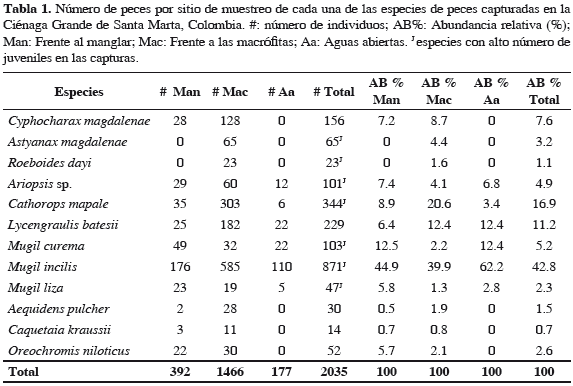
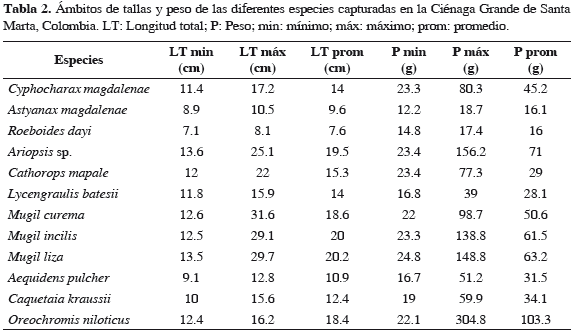
Se capturaron en total 2035 peces, las mayores abundancias en las capturas fueron de las especies Mugil incilis, Cathorops mapale, Lycengraulis batesii y Cyphocharax magdalenae (Tabla 1). Estas cuatro especies agrupan el 78.5% del número total de individuos capturados. La especie M. incilis (lisa) aportó el 42.8% de la abundancia total, mientras que las once especies adicionales representan el 51.2%. En la Tabla 1 también se presentan los peces capturados por sitios y las abundancias relativas de cada especie, siendo Frente a las macrófitas el sitio con el mayor número de capturas (1466). El 79% de los peces capturados fueron juveniles. Los datos de longitud total (LT) y peso (P) se presentan en la Tabla 2.
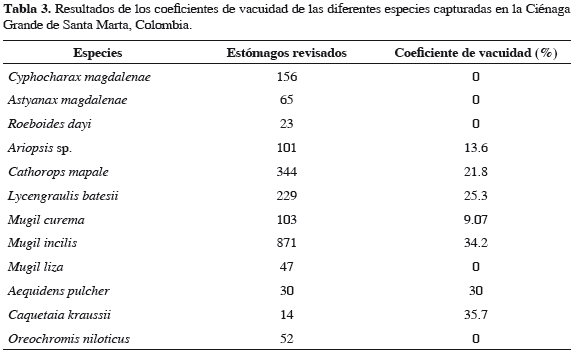
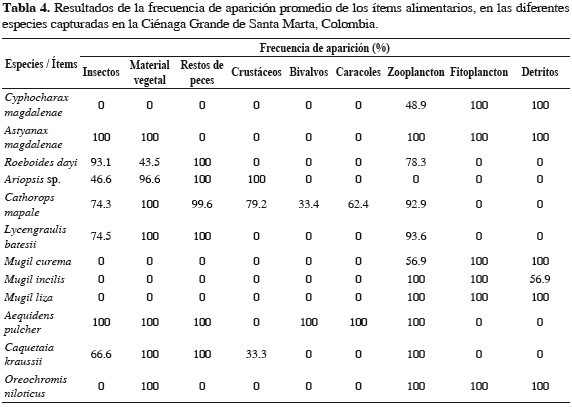
Se identificó un total de nueve grupos alimentarios: insectos (Diptera, Hemiptera y Trichoptera), material vegetal, restos de peces (constituidos por Mugil sp. y Caquetaia kraussii), crustáceos (Callinectes sp. y Macrobrachium sp.), bivalvos, caracoles, fitoplancton (Cyanophyceae, Chlorophyceae y Bacillariophyceae), zooplancton (Rotifera, Cladocera, Copepoda y Ostracoda) y detritos. En las especies C. magdalenae, A. magdalenae, R. dayi, M. liza y O. niloticus se encontró contenido alimentario en 100% de los estómagos, en las otras especies algunos estómagos no contenían alimento (Tabla 3).
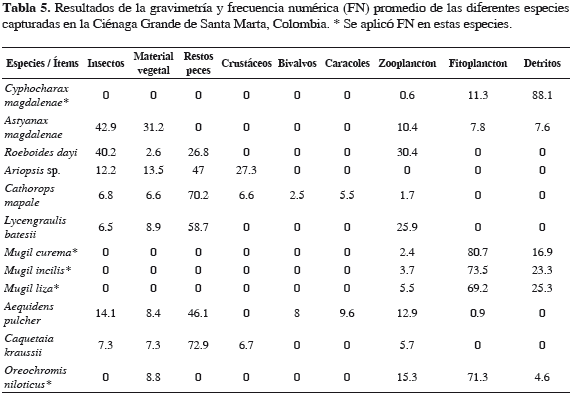
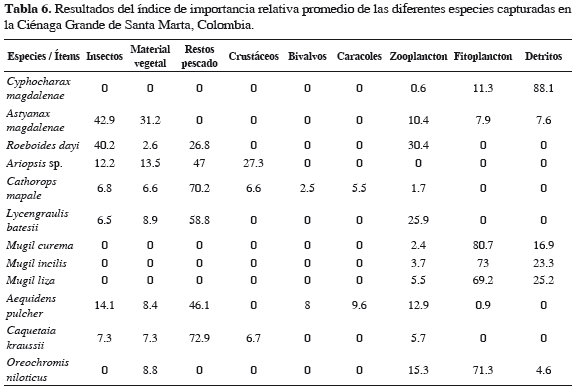
Cyphocharax magdalenae. Dieta compuesta por fitoplancton, zooplancton y detritos; fitoplancton y detritos tuvieron 100% de FA y zooplancton 48.9% (Tabla 4). Detritos presentó el mayor peso (88.1%) en la dieta, fitoplancton 11.3%, y zooplancton 0.6% (Tabla 5). Detritos resultó ser la categoría alimentaria de mayor importancia (IIR 88.1%) (Tabla 6). Durante toda la investigación la dieta alimentaria de la especie no presentó variaciones significativas.
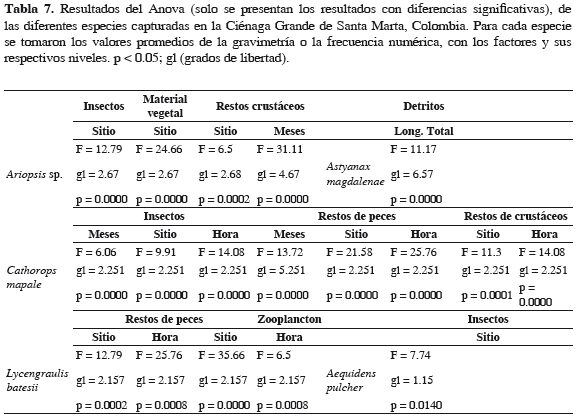
Astyanax magdalenae. Dieta compuesta por insectos, material vegetal, fitoplancton, zooplancton y detritos; este último presentó una FA de 49.2%, el resto de los ítems alimentarios se encontraron 100% en los estómagos (Tabla 4). Insectos presentó el mayor peso (42.9%) (Tabla 5) y resultó ser la categoría alimentaria de mayor importancia (IIR 42.9%) (Tabla 6). Se encontraron diferencias significativas en el consumo de detritos, fue similar hasta los 15 cm (LT) y disminuyó con el incremento de la LT (Tabla 7).
Roeboides dayi. Dieta compuesta por restos de peces, insectos, zooplancton y material vegetal; restos de peces presentó una FA de 100% para escamas, 91.3% para insectos (Chironomidae), 78.3% para zooplancton (rotíferos, copépodos, cladóceros y ostrácodos) y 43.5% para material vegetal (Tabla 4). Insectos presentó el mayor peso (40.2%; Tabla 5) y resultó ser la categoría alimentaria de mayor importancia (IIR 40.2%; Tabla 6). Durante toda la investigación la dieta alimentaria de la especie no presentó variaciones significativas.
Ariopsis sp. Dieta compuesta por restos de peces, crustáceos, material vegetal e insectos; restos de peces y crustáceos tuvieron 100% de aparición, material vegetal (96.6%) e insectos (46.6%) (Tabla 4). Restos de peces presentó el mayor peso (47%) (Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 47%) (Tabla 6). Se encontraron diferencias significativas en el consumo de insectos, el cual fue mayor frente a las macrófitas; el más alto consumo de crustáceos fue en aguas abiertas en abril y el menor consumo en junio; el contenido de material vegetal fue menor en aguas abiertas (Tabla 7).
Cathorops mapale. Dieta compuesta por restos de peces, insectos, caracoles, bivalvos, zooplancton y material vegetal; en 100% de los estómagos se halló material vegetal, restos de peces en 99.6%, zooplancton en 92.9%, restos de crustáceos (cangrejos y camarones) en 79.2%, insectos (dípteros y hemípteros) en 74.3%, caracoles en 62.4% y bivalvos en 33.4% (Tabla 4). Restos de peces presentó el mayor peso (70.2%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 70.2%; Tabla 6). Se encontraron diferencias significativas, las cuales indican mayor consumo de peces frente a las macrófitas, en horas de la noche y mayor en junio y menor en noviembre; el consumo de crustáceos fue superior en la mañana frente a las macrófitas y mangles; el consumo de insectos fue alto en abril y noviembre, en macrófitas y mangle (Tabla 7).
Lycengraulis batesii. Dieta compuesta por restos de peces, insectos, zooplancton y material vegetal; material vegetal y restos de peces se encontraron en 100% de los estómagos, zooplancton en 93.6% (copépodos, rotíferos, ostrácodos y cladóceros) e insectos (dípteros y hemípteros) en 74.3% (Tabla 4). Restos de peces presentó el mayor peso (58.7%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 58.7%) (Tabla 6). Hubo diferencias significativas que indican mayor consumo de peces en aguas abiertas a medio día; en cuanto al consumo de zooplancton fue más alto frente a las macrófitas y mangle (Tabla 7).
Mugil curema. Dieta compuesta por fitoplancton, zooplancton y detritos; fitoplancton y detritos tuvieron una FA de 100% y zooplancton de 57% (Tabla 4). Fitoplancton presentó el mayor número (80.7%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 80.7%; Tabla 6).
Mugil incilis. Dieta compuesta por fitoplancton, zooplancton y detritos; fitoplancton y zooplancton con una FA de 100% y detritos de 56.9% (Tabla 4). Fitoplancton presentó el mayor número (73%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 73%; Tabla 6).
Mugil liza. Dieta compuesta de fitoplancton, zooplancton y detritos, los cuales se encontraron en la totalidad de los estómagos (Tabla 4). Fitoplancton presentó el mayor número (69.2%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 69.2%; Tabla 6).
Aequidens pulcher. Dieta compuesta de insectos, material vegetal, restos de peces, bivalvos, caracoles, fitoplancton y zooplancton, con una frecuencia de 100% (Tabla 4). Restos de peces presentó mayor peso (46.1%; Tabla 5) y resultó ser el grupo trófico de mayor importancia (IIR 46.1%; Tabla 6). Se encontraron diferencias significativas en el consumo de insectos, el cual fue más alto en las macrófitas y menor frente al manglar (Tabla 6).
Caquetaia kraussii. Dieta compuesta por restos de peces, material vegetal, insectos, crustáceos, y zooplancton; material vegetal, restos de peces y zooplancton con una FA de 100%, insectos de 66.7% y cangrejos de 33.3% (Tabla 4). Restos de peces presentó el mayor peso (72.9%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 72.9%; Tabla 6).
Oreochromis niloticus. Dieta compuesta por material vegetal, fitoplancton, detritos y zooplancton con una FA de 100% (Tabla 4). El mayor contenido estomacal en número fue fitoplancton (71.3%; Tabla 5) y resultó ser la categoría trófica de mayor importancia (IIR 71.3%; Tabla 6).
Asociación trófica entre las especies
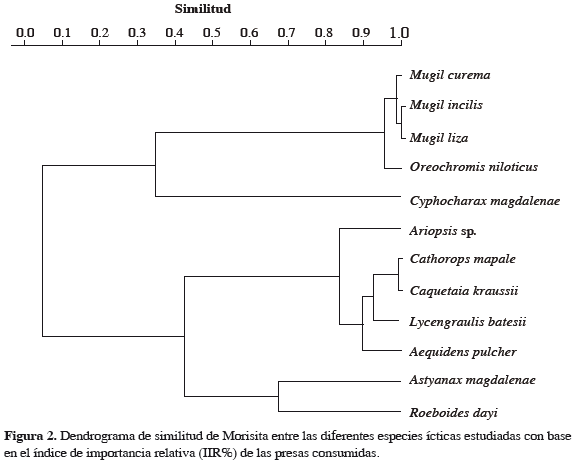
El dendrograma de similitud de Morisita (Figura 2) se usó para el análisis del grado de interacción trófica entre las especies estudiadas, utilizando el índice de importancia relativa (IIR%) de los grupos alimentarios consumidos. En la Figura 2 se forman inicialmente dos grandes grupos, los carnívoros con una similitud de 0.4 y el otro grupo con una similitud de 0.35.
El grupo de los carnívoros se divide en dos subgrupos de acuerdo con la similitud de sus dietas. Un subgrupo está formado por las especies A. magdalenae y R. dayi, las cuales consumen insectos, material vegetal y zooplancton. El otro subgrupo está dividido en dos subgrupos, uno compuesto por las especies Ariopsis sp. L. batesii y A. pulcher, con una similitud cercana a 0.8 que consumen diferentes grupos alimentarios (generalistas) y el otro subgrupo cercano a 0.9 de similitud formado por las especies C. kraussii y Caquetaia kraussii que consumen mayormente restos de peces (Figura 2). El otro gran grupo contiene las especies C. magdalenae, M. curema, M. incilis, M. liza y O. niloticus. En este grupo M. incilis y M. liza tienen una dieta cercana a uno en similitud, M. curema es cercana a 0.97; O. niloticus, tiene una dieta muy similar a las tres especies anteriores, la diferencia está en el consumo de material vegetal. Finalmente, la especie C. magdalenae es similar en un 25% con el resto de este grupo, por el elevado consumo de detritos (Figura 2).
DISCUSIÓN
De las doce especies de peces, Caquetaia kraussii, A. magdalenae, Ariopsis sp., A. pulcher y C. kraussii presentaron un amplio espectro alimentario, lo que refleja la flexibilidad al hacer uso del alimento disonible, siendo esta capacidad de adaptación propia de las especies estuarinas (Caquetaia kraussii y Ariopsis sp.). Las relaciones tróficas de los peces en los estuarios se caracterizan por la flexibilidad de hábitos alimentarios, omnivoría, repartición de recursos entre varias especies y cadenas tróficas basadas en el consumo de detritos y algas (Miller y Dunn, 1980).
Al analizar los contenidos estomacales de las doce especies se encontró que siete (A. magdalenae, R. dayi, Ariopsis sp., L. batesii, A. pulcher, C. kraussii y Caquetaia kraussii) presentaron una dieta carnívora y las restantes (C. magdalenae, M. curema, M. incilis, M. liza y O. niloticus) se caracterizaron por consumir detritos, fitoplancton y zooplancton. Esta distribución se vio reflejada en el dendrograma de similitud de Morisita (Figura 2) realizado sobre el IIR de las presas consumidas por las diferentes especies; este es un análisis importante en los estudios de hábitos alimentarios de peces.
Los carnívoros del presente estudio se pueden dividir en tres grupos: insectívoros, generalistas y piscívoros. Entre los carnívoros insectívoros se encuentra A. magdalenae y R. dayi. En los contenidos estomacales de A. magdalenae se encontraron principalmente insectos y restos vegetales. Galvis et al. (1997) y Maldonado et al. (2005) describen esta especie como omnívora, consumidora de restos de plantas, fitoplancton e invertebrados, mezclados con partículas de limo, pero los insectos no son el ítem principal, además no presentan variaciones en la talla para la alimentación de esta especie. Igualmente R. dayi tiene hábitos alimentarios diurnos, consumidora de insectos principalmente, seguido de zooplancton y restos de peces (escamas), los resultados son similares con los de Galvis et al. (1997). Peterson y Winemiller (1997) registraron que, en aguas corrientes, los adultos de R. dayi consumen una combinación de invertebrados y escamas de peces y que el zooplancton es un componente importante de la dieta sólo en los estadios juveniles; Ortaz et al. (2003) mostraron que la dieta de R. dayi en el embalse La Mariposa estuvo constituida por zooplancton (Cladocera y Copepoda), insectos acuáticos (Diptera y Ephemeroptera), Ostracoda y escamas de peces (escamas cicloideas). Pero difiere con el trabajo de Román-Valencia et al. (2003), quienes registran en la dieta de la especie consumo de lombrices, igualmente observaron diferencias en la dieta alimentaria entre el período seco y de lluvias.
Ariopsis sp., L. batesii y A. pulcher, con una similitud cercana a 0.8, consumen una variedad de grupos alimentarios (generalistas). Ariopsis sp. consumió principalmente peces, seguido en importancia por los crustáceos e insectos. Estos resultados son similares con los registrados por Olaya-Nieto et al. (2012), que identificaron cinco grupos alimentarios: crustáceos, peces, material vegetal, moluscos y otros, siendo crustáceos el grupo más frecuente, abundante y con mayor composición en peso. Galvis (1983), Acero (2002), Chaparro et al. (2002) y Atencio-García et al. (2005) consideran a Ariopsis sp. como carnívora, consumidora de peces principalmente.
Lycengraulis batesii consumió principalmente peces, seguido de zooplancton y en baja proporción insectos, por lo tanto se considera carnívora. En efecto, Whitehead et al. (1988) la describen como consumidora de pequeños peces. Así mismo, Planquette et al. (1996) la presentan como consumidora de crustáceos principalmente y zooplancton. Igualmente A. pulcher consumió peces principalmente, seguidos de insectos y zooplancton. Mills y Vevers (1989), Galvis et al. (1997) y Maldonado et al. (2005) la registran como consumidora de insectos y crustaceos. Rojas et al. (2005) registraron una dieta omnívora tanto para la especie en estudio como para A. coeruleopunctatus debido al consumo de diferentes recursos, como fitoplancton, zooplancton, peces, crustáceos, insectos (Hemiptera, Odonata y Ephemeroptera) y semillas. Los autores mencionados anteriormente no encontraron variaciones en el consumo de los diferentes grupos alimentarios.
Cathorops mapale y C. kraussii resultaron ser especies carnívoras con preferencia piscívora. Cathorops mapale consumió más peces en las macrófitas, con mayor actividad alimentaria en la noche. Estos resultados difieren del trabajo de Gómez-Canchong et al. (2004), que la describen como consumidora de crustáceos, zooplancton y en baja proporción peces, además no informan de variaciones espaciotemporales en la alimentación de la especie. Finalmente, Vega-Cendejas (1990) registró a la congenénerica Cathorops melanopus consumidora de crustáceos, peces, moluscos y material vegetal.
Caquetaia kraussii, de hábitos alimentarios diurnos, presentó una dieta compuesta por peces, insectos, material vegetal, crustáceos y zooplancton. Estos resultados son similares con los encontrados por Galvis et al. (1997), Ortega-Lara et al. (2002) y Atencio-García et al. (2005) que la clasifican como consumidora de peces e invertebrados bentónicos.
En el otro gran grupo (C. magdalenae, M. curema, M. incilis, M. liza y O. niloticus) se encuentran los consumidores de detritos y fitoplancton principalmente. Cyphocharax magdalenae presentó alto consumo de detritos y en menor proporción fitoplancton y zooplancton. Estos resultados son similares con los trabajos de Galvis et al. (1997), Atencio-García et al. (2005) y Cala (2005) quienes describieron a esta especie como consumidora exclusiva de detritos. Sin embargo, los detritos siempre están combinados con lodo, razón por la cual se le puede considerar como iliófaga.
Según Zavala-Camín (1996), los iliófagos se caracterizan dentro de los detritívoros porque ingieren lodo o arena, que por sí solos no representa un tipo de alimento, sino que incluido en estos se encuentran: detrito orgánico, detrito inorgánico, perifiton, detritos de macroflora, detritos planctónicos sedimentados y materia coprogénica. En ese sentido, C. magdalenae se podría caracterizar más específicamente como detrítivora-iliófaga.
Mugil curema, M. incilis y M. liza, se alimentan principalmente de fitoplancton y en forma secundaria de detritos. Mugil curema presentó el más alto consumo de fitoplancton de las tres especies, estos resultados son similares a los de Osorio (1988), pero difieren de Yáñez-Arancibia (1976) que indica que M. curema se alimenta preferentemente de detritos, sedimentos finos inorgánicos (a cuyas partículas vive asociada microfauna y microflora) y algas filamentosas; como alimento variable circunstancial puede aprovechar además, ostrácodos, nemátodos, foraminíferos, microgastrópodos, anélidos, isópodos, fragmentos de vegetales y diatomeas bentónicas. Jacot (1920) señaló que M. curema tiene hábitos alimentarios similares a M. cephalus, y los pequeños juveniles no comen crustáceos como otras especies del género, sino que sus estómagos se encuentran llenos de fango y materia orgánica. Franco y Bashirulla (1992) reportan que esta especie se alimenta preferentemente de diatomeas bentónicas, restos orgánicos, sedimentos finos inorgánicos y dinoflagelados. En consecuencia, su espectro trófico señala que es una especie detritívora vegetal. Gómez-Canchong et al. (2004) indican que M. incilis tiene un alto consumo de detritos, seguido de fitoplancton y muy bajo consumo de zooplancton. Bustos y Pérez (2003) y Cogua et al. (2013) indican que M. incilis consume preferiblemente diatomeas céntricas y pennadas. Mugil liza presentó un alto consumo de fitoplancton y bajo consumo de detritos, siendo estos resultados diferentes de los hallados por Greenfield y Thomerson (1997), que registran a M. liza como consumidora de detritus principalmente y fitoplancton. Finalmente, Osorio (1988) indica que M. liza en la CGSM mostró una dieta detrítica aunque marcadamente influida por la meiofauna asociada al fondo.
Oreochromis niloticus consumió material vegetal (hojas y raíces de macrófitas flotantes), fitoplancton, detritos y zooplancton; estos resultados son similares a otros trabajos que la reconocen generalmente como omnívora, aunque hay fuerte evidencia de que es principalmente herbívora (Petr, 1967; Getachew y Fernando, 1989; Dempster et al., 1995; Talde et al., 2004) y, en ese sentido, Biterlich y Gnaiger (1985) afirman que O. niloticus es el verdadero pez herbívoro, por su sistema digestivo altamente especializado, capaz de producir pH < 1, suficiente para descomponer los tejidos más recalcitrantes. Así mismo, Weliange y Amarasinghe (2003) indican que la especie consume detritos, fitoplancton, plantas y peces. Esta plasticidad trófica es la que le proporciona ese oportunismo dietético que puede ser la base de su éxito colonizador, como fue observado por Njiru et al. (2004) en el lago Victoria.
El grado de interacción, evaluado a través de la sobreposición de las presas comunes, permite cuantificar el grado de utilización de los mismos recursos alimentarios que individuos de una o más especies comparten al coexistir en un mismo hábitat (Saucedo-Lozano et al., 1999). Sin embargo, altos valores de sobreposición de dietas no son evidencia suficiente para concluir que existe competencia por alimento (Pianka, 1976). Pereira et al. (2004), al estudiar los hábitos alimentarios de nueve especies, encontraron que la dieta estuvo altamente influida por los recursos disponibles y que las estrategias de alimentación utilizadas por los generalistas y especialistas pudieron evitar la competencia. Es así, que la competencia interespecífica se minimiza cuando la densidad, abundancia y distribución de la presas es elevada, lo cual favorece la coexistencia de especies de peces en un área determinada (Arenas-Granados y Acero, 1992). No obstante la sobreposición de dietas estimada entre las especies de interés de este estudio se considera que la amplia y alta disponibilidad de presas registrada durante todo el año puede minimizar las interacciones de competencia trófica.
Desde el punto de vista de las relaciones tróficas se sugiere como modelo del flujo de energía en la zona suroriental de la CGSM el siguiente: a la ciénaga ingresan nutrientes provenientes de la cuenca aportante principalmente y del proceso natural realizado por los descomponedores. A su vez estos son asimilados por los mangles, las macrófitas y el fitoplancton. Entre los consumidores primarios se encuentran los insectos en general, el zooplancton y las especies de peces que registraron entre sus ítems alimentarios microalgas como C. magdalenae, M. curema, M. incilis, M. liza y O. niloticus. Depredando sobre el zooplancton y los insectos se encontraron los consumidores secundarios como A. magdalenae, R. dayi, A. pulcher, L. batesii y C. kraussii. En un último nivel se encontraron los depredadores como Ariopsis sp. y Caquetaia kraussii. Los detritos son consumidos por las especies filtradoras especialmente por C. magdalenae, finalmente los organismos descomponedores reconstituyen la materia orgánica al sistema como nutrientes. Las especies utilizaron recursos comunes principalmente en las macrófitas, donde encontraron alta disponibilidad de alimento durante todo el año y al utilizar estrategias similares, estas asociaciones resultaron unidades funcionales de la comunidad.
AGRADECIMIENTOS
Los autores le agradecen a la Universidad del Magdalena por permitir el uso del laboratorio de Biología y la colaboración del personal auxiliar.
BIBLIOGRAFÍA
1 Acero P., A. 2002. Order Siluriformes, Family Ariidae. 831-852. En: Carpenter, K. E. (Ed.). The living marine resources of the Western Central Atlantic. Volume 2: Bony fishes part 1 (Acipenseridae to Grammatidae). FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. FAO, Roma. 1373 p. [ Links ]
2 Allen, R. I. y D. M. Baltz. 1997. Distribution and microhabitat use by flatfishes in a Louisiana estuary. Environ. Biol. Fish., 50: 85-103. [ Links ]
3 Arenas-Granados, P. y A. Acero P. 1992. Organización trófica de las mojarras (Pisces: Gerreidae) de la Ciénaga Grande de Santa Marta (Caribe Colombiano). Rev. Biol. Trop., 40 (3): 287-302. [ Links ]
4 Atencio-García, V. J., E. Kerguelén-Durango, E. Cura Dorado, R. Rosado Carcamo, A. Vallejo y M. Valderrama. 2005. Régimen alimentario de siete especies ícticas en el embalse de la hidroeléctrica Urrá (Córdoba, Colombia). Rev. MVZ-Córdoba, 10 (2): 614-622. [ Links ]
5 Betancur, R. y A. Acero P. 2005. Description of Cathorops mapale, a new species of sea catfish (Siluriformes: Ariidae) from the Colombian Caribbean, based on morphological and mitochondrial evidence. Zootaxa, 1045: 45-60. [ Links ]
6 Biterlich, G. y E. Gnaiger. 1985. Phytoplanktivorous or omnivorous fish? Digestibility of zooplankton by silver carp, Hypophthalmichthys molitrix (Val). Aquaculture, 40: 261-263. [ Links ]
7 Blanco, J. A., E. A. Viloria y J. C. Narváez. 2006. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Est. Coast Shelf Sci., 66: 157-167. [ Links ]
8 Bocanegra-Castillo, N., L. A. Abitia-Cárdenas y F. Galván-Magaña. 2000. Espectro alimentario de la berrugata californiana Meticirrhus undulatus de Laguna Ojo de Liebre, Baja California Sur, México. Cien. Mar., 26 (4): 659-675. [ Links ]
9 Bustos, D. y D. Pérez. 2003. Ecología trófica y algunos aspectos biológicos de las especies pertenecientes a las familias Mugilidae y Centropomidae en la laguna de Navío Quebrado, Guajira, Caribe colombiano. Trabajo de grado, Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá. 122 p. [ Links ]
10 Cala, P. 2005. Diet of Astyanax fasciatus and Cyphocharax magdalenae (Pisces: Characiformes), in the Betania reservoir, upper part of the rio Magdalena system, Colombia. Dahlia-Rev. Asoc. Colomb. Ictiol., 8: 3-7. [ Links ]
11 Cervigón, F. 1991. Los peces marinos de Venezuela. Vol. I, Segunda edición. Fundación Científica Los Roques, Caracas. 425 p. [ Links ]
12 Cervigón, F. 1993. Los peces marinos de Venezuela. Vol. II, Segunda edición. Fundación Científica Los Roques, Caracas. 497 p. [ Links ]
13 Chaparro, N., S. Gaitán y N. Hernández. 2002. Incubación, larvicultura y alevinaje del bagre estuarino. Ariopsis bonillai (Miles, 1945) en cautiverio, Santa Marta Caribe colombiano. Informe técnico. Universidad del Magdalena y Colciencias, Santa Marta. 20 p. [ Links ]
14 Christensen, J. D., M. E. Monaco y T. A. Lowery. 1997. An index to assess the sensitivity of Gulf of Mexico species to changes in estuarine salinity regimes. Gulf. Res. Rep., 9: 219-229. [ Links ]
15 Cogua, P., M. F. Jiménez-Reyes y G. Duque. 2013. Relaciones tróficas de cinco especies de peces de interés comercial en la bahía de Cartagena, Caribe colombiano. Bol. Invest. Mar. Cost., 42 (1): 185-192. [ Links ]
16 Dahl, G. 1971. Los peces del norte de Colombia. Inderena, Bogotá. 391 p. [ Links ]
17 Dempster, P., D. J Baird y M. C. M. Beveridge. 1995. Can fish survive by filter-feeding on microparticles? Energy balance in tilapia grazing on algal suspensions. J. Fish. Biol., 47: 7-17. [ Links ]
18 Franco, L. y K. M. B. Bashirullah. 1992. Alimentación de la lisa (Mugil curema) del golfo de Cariaco, Estado Sucre, Venezuela. Zootecnia Trop., 10 (2): 219-238. [ Links ]
19 Galvis, G., J. Mojica y M. Camargo 1997. Peces del Catatumbo. Asociación Cravo Norte, Bogotá. 188 p. [ Links ]
20 Galvis, O. 1983. Los áridos de la Ciénaga Grande de Santa Marta. Tesis de Maestría, Universidad Nacional de Colombia, Bogotá. 186 p. [ Links ]
21 Getachew, T. y C. H. Fernando. 1989. The food habits of an herbivorous fish (Oreochromis niloticus Linn.) in Lake Awasa, Ethiopia. Hydrobiologia, 174: 195-200. [ Links ]
22 Gómez-Canchong, P., L.M. Manjarrés, L. O. Duarte y J. Altamar. 2004. Atlas pesquero del área norte del mar Caribe de Colombia. Univ. Magdalena, Santa Marta. 230 p. [ Links ]
23 Greenfield, D. W. y J. E. Thomerson. 1997. Fishes of the continental waters of Belize. University Press of Florida, Miami. 311 p. [ Links ]
24 Jacot, A. P. 1920. Age, growth and scale characteristics of the mullets, Mugil cephalus and Mugil curema. Trans. Am. Microsc. Soc., 39 (3): 119-229. [ Links ]
25 Laevastu, T. 1980. Manual de métodos de biología pesquera. Editorial Acribia, Zaragoza. 243 p. [ Links ]
26 Maldonado, J. A., A. Ortega, J. S. Usma, G. Galvis, F. A. Villa, L. Vásquez, S. Prada y C. Ardila. 2005. Peces de los Andes de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá. 346 p. [ Links ]
27 Mancera, J. E. y L. Botero. 1993. Estudio ecológico de la Ciénaga Grande de Santa Marta, delta exterior del río Magdalena. Informe de proyecto tercera etapa, Invemar, Santa Marta. 128 p. [ Links ]
28 Marrero, C. 1994. Métodos para cuantificar contenidos estomacales en peces. Universidad Nacional Experimental de los Llanos Ezequiel Zamora-Unellez, Caracas. 36 p. [ Links ]
29 Miller, J. M. y M. L. Dunn. 1980. Feeding strategies and patterns of movement of juvenile estuarine fihes. 437-448. En: Kennedy, V. S (Ed.) Estuarine perspectives. Academic Press, Nueva York. 533 p. [ Links ]
30 Mills, D. y G. Vevers, 1989. The Tetra encyclopedia of freshwater tropical aquarium fishes. Tetra Press, Nueva Jersey. 208 p. [ Links ]
31 Morisita, M. 1959. Measuring of the dispersion and analysis of distribution patterns. Mem. Fac. Sci., Kyushu Univ., Series E., Biology, 2: 215-235. [ Links ]
32 Njiru, M., J. B. Okeyo-Owuor, M. Muchiri e I. G. Cowx. 2004. Shifts in the food of Nile tilapia, Oreochromis niloticus (L.) in Lake Victoria, Kenya. Afr. J. Ecol., 42: 163-170. [ Links ]
33 Olaya-Nieto, C. W., J. J. Arellano-Padilla y A. L. Martínez-González. 2012. Hábitos alimentarios del barbul de piedra (Ariosis sp.) en el río Sinú, Colombia. Acta Biol. Colomb., 17 (1): 117-127. [ Links ]
34 Ortaz, M., S. Cano, E. González y C. Peñaherrera. 2003. Dieta de Roeboides dayi (Pisces: Characidae) en un embalse neotropical de Venezuela. Acta Biol. Venez., 23 (1): 15-22. [ Links ]
35 Ortega-Lara, A., A. Aguiño y G. C. Sánchez. 2002. Los peces del alto Cauca: Caracterización de la ictiofauna nativa de los principales ríos de la cuenca alta del río Cauca en el departamento del Cauca. Primera Parte. Fundación para la Investigación y el Desarrollo Sostenible (Funindes) y Corporación Autónoma Regional del Cauca (CRC), Popayán, Colombia. 142 p. [ Links ]
36 Osorio, D. 1988. Ecología trófica de Mugil curema, M. incilis y M. liza (Pisces: Mugilidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano. I. Análisis cualitativo y cuantitativo. An. Inst. Invest. Mar. Punta Betín, 18: 113-126. [ Links ]
37 Pereira, C. C. G. F., W. S. Smith y E. L. G. Espíndola. 2004. Hábitos alimenticios de nueve especies de peces del embalse de Três Irmãos, São Paulo, Brasil. Universidad y Ciencia, Núm. Esp., (1): 33-38. [ Links ]
38 Peterson, C. y K. O. Winemiller. 1997. Ontogenetic diet shifts and scale-eating in Roeboides dayi, a Neotropical characid. Env. Biol. Fish., 49: 111-118. [ Links ]
39 Petr, T. 1967. Food preferences of the commercial fishes of the Volta Lake. Technical Report No. 22, Volta Basin Research Project, University of Ghana, Acra, Ghana. 9 p. [ Links ]
40 Pianka, E. R. 1976. Competition and niche theory. 114-141. En: May, R. M. (Ed.). Theorical ecology, principles and applications. WB Saunders, Filadelfia y Toronto. 317 p. [ Links ]
41 Planquette, P., P. Keith y P. Y. Le Bail. 1996. Atlas des poissons d'eau douce de Guyane (tome 1). Collection du Patrimoine Naturel, vol.22. IEGB-Muséum national d'Histoire naturelle, París, INRA, CSP, Min. Env., París. 429 p. [ Links ]
42 Raz-Guzmán, A. y A. J. Sánchez. 1996. Trophic structure related to seagrass habitat complexity. 241-248. En: Kuo, J., R. C. Phillips, D. I. Walker y H. Kirkman (Ed.). Seagrass biology. Proceedings of an International Seagrass Workshop. Rottnest Island, Australia. 371 p. [ Links ]
43 Reid, G. y R. Wood. 1976. Ecology of inland waters and estuaries. Segunda edición, Van Nostrand Company, Nueva York. 485 p. [ Links ]
44 Rojas, J. E., L. A. Soca y G. I. García. 2005. Contenido del tracto digestivo de cuatro especies de peces autóctonos y sus implicaciones como biorreguladores de larvas de mosquitos en Venezuela. Rev. Cubana Med. Trop., 57 (3): 196-200. [ Links ]
45 Román-Valencia, C., A. B. Botero y R. C. Ruiz. 2003. Trophic and reproductive ecology of Roeboides dayi (Teleostei: Characidae) from upper Rio Cauca, Colombia. Boll. Mus. Reg. Sci. Nat. Torino, 20 (2): 487-496. [ Links ]
46 Sánchez, A. J., A. Raz-Guzmán y E. Barba. 1996. Habitat value of seagrasses for decapods in tropical coastal lagoons of the south western Gulf of Mexico: An overview. 233-240. En: Kuo, J. R., C. Phillips, D. I. Walker y H. Kirkman (Eds.) Seagrass biology. Proccedings of an International Workshop. The University of Western Australia. Rottnest Island, Australia. 385 p. [ Links ]
47 Santos-Martínez, A. y S. Arboleda. 1993. Aspectos biológicos y ecológicos del macabí Elops saurus Linnaeus (Pisces: Elopidae) en la Ciénaga Grande de Santa Marta y costa adyacente, Caribe Colombiano. An. Inst. Invest. Mar. Punta Betín, 22: 77-96. [ Links ]
48 Saucedo-Lozano, M., G. González-Sansón y X. Chiappa-Carrara. 1999. Alimentación natural de los juveniles de Lutjanus peru (Nichols y Murphy, 1922) (Lutjanidae: Perciformes) en la costa de Jalisco y Colima, México. Cien. Mar., 25 (3): 381-400. [ Links ]
49 Schluter, D. y R. E. Ricklefs. 1993. Species diversity in ecological communities: historical and geographical perspectives. University of Chicago, Chicago. 19 p. [ Links ]
50 Silva, M. y J. Stuardo. 1985. Alimentación y relaciones tróficas generales entre algunos peces demersales y el bentos de Bahía Coliumo (Provincia de Concepción, Chile). Gayana Zool., 49 (3-4): 77-102. [ Links ]
51 Talde, C. M., A. C. Mamaril y M. L. D. Palomares. 2004. The diet composition of some economically important fishes in the three floodplain lakes in Agusan Marsh wildlife sanctuary in the Philippines. Sri Lanka. J. Aquat. Sci., 9: 45-56. [ Links ]
52 Torres, L., A. Acero P. y A. Santos. 2004. Ecología trófica de la carrura Bairdiella ronchus (Pisces: Sciaenidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano. Rev. Acad. Colomb. Cienc., 28 (109): 529-534. [ Links ]
53 Vega-Cendejas, E. 1990. Interacción trófica entre los bagres Cathorops melanopus (Agassiz 1829) y Arius felis (Linnaeus 1766), en las costas de Celestún, Yucatán, México. An. Inst. Cienc. Mar. Limnol., 17 (2): 271-285. [ Links ]
54 Weliange, W. S. y U. S. Amarasinghe. 2003. Accounting for diel feeding periodicity in quantifying food resource partitioning in fish assemblages in three reservoirs of Sri Lanka. Asian Fish. Sci., 16 (3 y 4): 203-213. [ Links ]
55 Whitehead, P. J. P., G. J. Nelson y T. Wongratana. 1988. FAO Species catalogue. Vol. 7. Clupeoid fishes of the world (Suborder Clupeoidei). An annotated and illustrated catalogue of the herrings, sardines, pilchards, sprats, shads, anchovies and wolf-herrings. Part 2. Engraulididae. FAO Fish. Synop., 125 (7/2): 305-579. [ Links ]
56 Windell, J. T. 1971. Food analysis and rate of digestion. 215-226. En: Ricker, W. E. (Ed). Methods for assessment of fish production in fresh waters. Segunda edición, Blackwell Scientific Publications, Oxford. 313 p. [ Links ]
57 Windell, J. T. y S. H. Bowen. 1978. Methods for study of fish diets based on analysis of stomach contents. 219-226. En: Bagenal, T. (Ed.). Methods for assessment of fish production in fresh waters. Tercera edición, Blackwell Scientific Publications, Oxford. 365 p. [ Links ]
58 Wootton, R. J. 1990. Ecology of teleost fishes. Chapman and Hall, Nueva York. 404 p. [ Links ]
59 Yáñez-Arancibia, A. 1976. Observaciones sobre Mugil curema Valenciennes en áreas naturales de crianza, México. Alimentación, crecimiento, madurez y relaciones ecológicas. An. Inst. Cienc. Mar Limnol. Univ. Nac. Auton. Mex., 3: 92-124. [ Links ]
60 Yáñez-Arancibia, A. 1986. Ecología de la zona costera. Análisis de siete tópicos. AGT, México D. F. 189 p. [ Links ]
61 Yáñez-Arancibia, A. y R. Nugent. 1977. El papel ecológico de los peces en estuarios y lagunas costeras. An. Centro Cien. Mar Limnol. Univ. Nal. Auton. México, 4: 107-117. [ Links ]
62 Yáñez-Arancibia, A., J. Curiel-Gómez y V. Leyton. 1976. Prospección biológica y ecología del bagre marino Galeichthys caerulescens (Günther) en el sistema lagunar costero de Guerrero, México (Pisces: Ariidae). An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 3 (1): 125-180. [ Links ]
63 Yáñez-Arancibia, A., A. L. Lara-Domínguez, J. L. Rojas-Galviz, P. Sánchez-Gil, J.W. Day y C. J. Madden. 1988. Seasonal biomass and diversity of estuarine fishes coupled with tropical habitat heterogenety (southern Gulf of Mexico). J. Fish Biol., 33: 191-200. [ Links ]
64 Yáñez-Arancibia, A., A. L. Lara y D. Pauly. 1994. Coastal lagoons as fish habitats. 363-376. En: Kjerfve, B. (Ed.). Coastal lagoons processes. Elsevier, Ámsterdam. 577 p. [ Links ]
65 Zavala-Camín, L. 1996. Introdução aos estudos sobre alimentação natural em peixes. Eduem. Maringá, Brasil. 129 p. [ Links ]
FECHA DE RECEPCIÓN: 28/01/2013 FECHA DE ACEPTACIÓN: 17/10/2013