Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.43 no.1 Santa Marta Jan./June 2014
POLIQUETOS ERRANTES (POLYCHAETA: ERRANTIA) ESCLEROBIONTES DEL PUERTO DE MAZATLÁN, SINALOA (MÉXICO)
FOULING ERRANT POLYCHAETES (POLYCHAETA: ERRANTIA) FROM THE PORT OF MAZATLAN, SINALOA (MEXICO)
Tulio F. Villalobos-Guerrero1,2 y María Ana Tovar-Hernández2,3
1 El Colegio de la Frontera Sur (Ecosur), Unidad Chetumal, Posgrado en Ciencias en Recursos Naturales y Desarrollo Rural, Av. Centenario Kilómetro 5.5, 77014, Chetumal, Quintana Roo, México. tulio1786@msn.com, tvillalobos@ecosur.edu.mx.
2 Geomare, A. C., Av. Miguel Alemán 616-4B, Col. Lázaro Cárdenas, 82040, Mazatlán, Sinaloa, México.
3 El Colegio de Sinaloa, Gral. Antonio Rosales 435 Pte., Col. Centro, 80000, Culiacán, Sinaloa, México. maria_ana_tovar@yahoo.com.
RESUMEN
El puerto de Mazatlán es el principal puerto de altura y cabotaje del noroeste de la República Mexicana. A lo largo del canal de navegación existen boyas metálicas de señalamiento marítimo, mismas que proveen un sustrato favorable para el establecimiento de diversas comunidades esclerobiontes. Este estudio da a conocer la composición de especies de poliquetos errantes eunicimorfos y filodocimorfos asociados a boyas metálicas durante el ciclo anual 2009. La comunidad está representada por 6 familias, 17 géneros y 22 especies. Nueve especies son nominales, siete son potencialmente nuevas y seis requieren de estudios detallados para esclarecer su identidad. Pterocirrus (Phyllodocidae) constituye un nuevo registro del género para el Pacífico oriental tropical. Se indica el hábitat, distribución y comentarios taxonómicos de las especies registradas y se incluye una lista de las especies de poliquetos esclerobiontes registradas en la ecorregión golfo de California.
PALABRAS CLAVES: Boyas, lista de especies, nuevos registros, poliquetofauna, sureste del golfo de California.
ABSTRACT
Mazatlan is the main sea and coastal port from northwestern Mexico. There are maritime metallic signaling buoys throughout the navigation channel, these provide a favorable substrate for the establishment of diverse fouling communities. This study discloses the composition of errant eunicemorph and phyllodocemorph polychaete species associated to metallic buoys during an annual cycle (2009). The polychaetofauna is represented by 6 families, 17 genera and 22 species. Nine are nominal species, seven are potentially new species and six require of detailed studies to clarify their identity. Pterocirrus (Phyllodocidae) is recorded by the first time in the Tropical Eastern Pacific. The habitat, distribution and taxonomic comments of the recorded species are indicated; furthermore, a fouling polychaete species list in the Gulf of California is included.
KEYWORDS: Buoys, checklist, new records, polychaetofauna, southeastern Gulf of California.
INTRODUCCIÓN
Mazatlán es uno de los puertos más importantes del Pacífico mexicano debido a su intensa actividad comercial, pesquera y turística. En el puerto se ha realizado tráfico de mercancías con más de 70 países y movimientos de cruceros internacionales que lo conectan con otros sitios en el Pacífico mexicano y Estados Unidos; además es el principal proveedor de suministros de la península de Baja California. Está constituido por flotas y cooperativas pesqueras, terminales de transbordadores, dársenas y astilleros; así como por estructuras de protección, atraque y señalamiento marítimo como balizas y boyas (SCT, 2010).
El tráfico marítimo en el canal de navegación del puerto de Mazatlán es guiado a través de boyas metálicas (SCT, 2010). Está bien documentado que dichas estructuras incrementan significativamente la diversidad de la epibiota en los puertos (Connell y Glasby, 1999; Lim et al., 2009). Estas comunidades esclerobiontes -conjunto de organismos asociados a cualquier tipo de sustrato duro, particularmente a los de origen antrópico- son altamente diversas, albergan alrededor de diez phyla distribuidos en aproximadamente 100 taxones (Hewitt et al., 2004; Cohen et al., 2005). Los poliquetos son componentes comunes en estas comunidades, constituyen una proporción significativa de biomasa (Pequegnat y Pequegnat, 1968; Relini et al., 2000; Cohen et al., 2005) y se encuentran entre los principales organismos invasores de dársenas y puertos (Streftaris et al., 2005; Çinar, 2009; Read et al., 2011), especialmente aquellos poliquetos sedentarios como las "flores de mar" (Sabellidae) y los "pinitos de mar" (Serpulidae). Estos últimos grupos residen en diversos sustratos artificiales: cascos de embarcaciones, muelles flotantes, pilotes de muelles, boyas de señalización y cabos (Lewis et al., 2006; Link et al., 2009), como así lo demuestran también los estudios de Tovar-Hernández et al. (2009a, 2009b, 2010) y Tovar-Hernández y Yáñez-Rivera (2012a, 2012b) para Mazatlán.
Contrario a lo que ocurre con los poliquetos sedentarios, los poliquetos errantes esclerobiontes son poco conocidos en términos de biodiversidad y de especies exóticas invasoras. Un estudio taxonómico de este grupo sería relevante para determinar la composición faunística y la presencia de especies exóticas. Por tanto, este trabajo tiene como propósito identificar la poliquetofauna errante esclerobionte asociada a boyas de señalización del puerto de Mazatlán, Sinaloa.
MATERIALES Y MÉTODOS
Se hicieron muestreos mensuales durante 2009 en cinco boyas metálicas de señalización distribuidas a lo largo del canal de navegación del puerto de Mazatlán. Las localizaciones geográficas de las cinco estaciones son las siguientes: Est. 1 (23°12'13.0"N, 106°24'31.4"O), Est. 2 (23°12'10.0"N, 106°24'30.1"O), Est. 3 (23°11'48.7"N, 106°24'31.0"O), Est. 4 (23°11'31.1"N, 106°24'43.9"O) y Est. 5 (23°11'08.9"N, 106°24'55.8"O). Las boyas presentaron un diámetro de 2.2 m, una altura de 1.2 m y una profundidad de 1.5 m. Se recolectó la biota esclerobionte de la superficie de las boyas mediante buceo libre y raspado con espátula. La biota fue separada en grandes grupos taxonómicos. Los poliquetos se fijaron en formol al 10% durante 24 horas; posteriormente, se enjuagaron para preservarlos en etanol al 70%. Para más detalles de la metodología consultar Villalobos-Guerrero y Tovar-Hernández (2013). Se emplearon las claves de identificación a nivel de género y especie de Blake et al. (1994, 1995), Blake y Ruff (2007) y De León-González et al. (2009). Las identificaciones fueron corroboradas con las descripciones originales y/o caracterizaciones recientes.
El material biológico fue depositado en la Colección Científica de Referencia de Poliquetos del Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, con clave de registro MAZ.POL.078.1198. Se utilizaron dos clases de material adicional: aquel depositado provisionalmente en Geomare A. C., procedente de varios sustratos del puerto de Mazatlán [consultar la información de las estaciones en Tovar-Hernández et al. (2009b)] y el material ajeno al golfo de California depositado en la colección de poliquetos del Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Autónoma de México. Se revisaron ambos materiales con la finalidad de realizar comparaciones morfológicas y enriquecer la información biológica de las especies.
Se efectuaron caracterizaciones para las especies, incluyendo coloración en vivo (cuando estuvo disponible), algunos caracteres diagnósticos fueron representados mediante fotografía digital. Se indicó en el hábitat de cada especie la temperatura, salinidad y oxígeno disuelto estimados mediante una sonda multiparamétrica; así mismo, si fuera el caso, se citó el hábitat de la especie tomado de la literatura. La distribución mencionada para las especies se basó en las provincias y ecorregiones marinas del mundo establecidas por Spalding et al. (2007). En variaciones se señalaron algunos caracteres diagnósticos específicos para cada especie considerada, además del número de segmentos y medidas de longitud total (LT), longitud al segmento 10 (L10) y ancho al segmento 10 (A10); en las especies de Nereididae, la longitud y ancho fueron medidos hasta el segmento 15 debido a que en esta región no hay influencia del abultamiento de la faringe. Se realizaron biometrías para determinar la variabilidad morfométrica de algunos caracteres. El tamaño de la muestra se representó con n y la media aritmética con µ. Las siguientes abreviaturas fueron utilizadas en las caracterizaciones de las especies: GSA, gancho subacicular; GECM, gancho encapuchado compuesto multidentado; GESM, gancho encapuchado simple multidentado; número de maxila, M + número romano (e.g. MI, MVI); número de área faríngea, A + número romano (e.g. AII, AVI).
RESULTADOS
En total, 22 especies de poliquetos errantes pertenecientes a 17 géneros y seis familias fueron identificadas en las boyas metálicas de señalización del puerto de Mazatlán. Dorvilleidae y Hesionidae están representadas por un género y una especie. Eunicidae la componen tres géneros y siete especies. Lumbrineridae consta de dos géneros y dos especies. Nereididae por seis géneros y siete especies. Finalmente, Phyllodocidae la constituyen cuatro géneros y cuatro especies. Nueve especies son nominales (41%), siete son potencialmente nuevas (32%) y seis requieren de estudios detallados para esclarecer su identidad (27%).
Pterocirrus Claparède es un género registrado por primera ocasión en el Pacífico oriental tropical. Las especies potencialmente nuevas constituyeron, per se, siete nuevos registros para la ecorregión. Únicamente seis de las especies nominales de poliquetos recolectadas habían sido registradas previamente en el golfo de California: Dorvillea vittata (Grube y Ørsted en Grube), Marphysa angelensis Fauchald, Ceratonereis singularis Treadwell, Perinereis elenacasoae Rioja, P. villalobosi Rioja y Alitta succinea (Leuckart). Las tres primeras son registradas por primera ocasión en Sinaloa y las tres últimas son especies comunes en el estado. En suma, y descartando las especies problemáticas, nueve especies son nuevos registros para la ecorregión y trece lo son para Sinaloa. Alitta succinea es una especie exótica de poliqueto errante en el puerto de Mazatlán.
Subclase Errantia Audouin y Milne-Edwards, 1832
Orden Eunicida Dales, 1962
Familia Dorvilleidae Chamberlin, 1919
Género Dorvillea Parfitt, 1866
Dorvillea vittata (Grube y Ørsted en Grube, 1857)
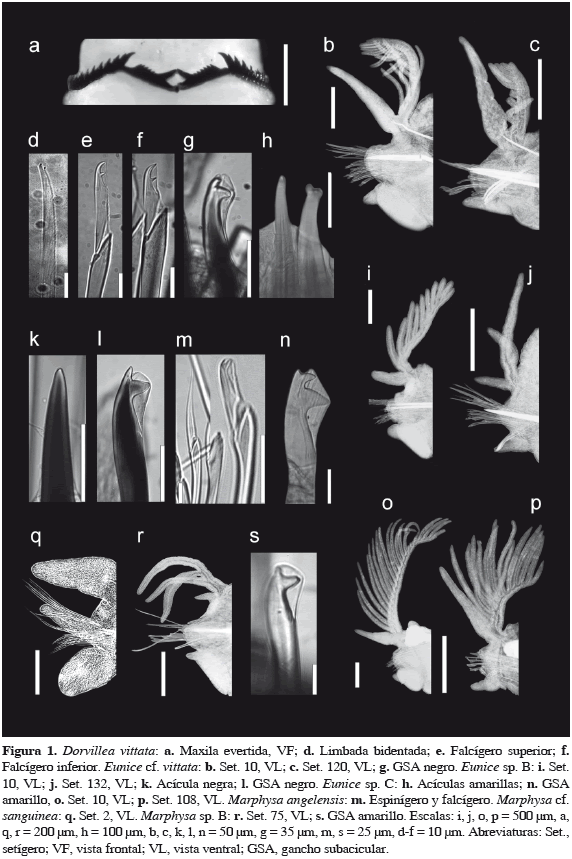
(Figuras 1a, d-f, 2a)
Anisoceras vittataz Grube y Ørsted in Grube, 1857: 61; Wolff y Petersen 1991: lám. 2, fig. 7.
Dorvillea vittata Hartman 1959: 348; Pettibone 1961: 182. Localidad tipo: Puntarenas, Costa Rica.
Material examinado. 24 individuos (17 completos): Est. 1 (17), Est. 2 (5), Est. 3 (2).
Caracterización. Prostomio con palpos biarticulados, antenas moniliformes con nueve artejos, más cortas y delgadas que los palpos; sin papila nucal. Dos pares de portadores maxilares con serraciones. Maxila superior: placas basales con 10-12 dientes (n = 10); 19-23 placas dentales; placa 1 con un diente principal pronunciado, poco recurvado (Figura 1a), un diente lateral y uno medio; placa 6 con un diente principal, uno lateral y tres medios; placa 15 con un diente principal, uno lateral y dos medios; placa 22 con un diente principal, uno lateral y uno medio. Maxila inferior: placas basales con 12-16 dientes (n = 10); 28-29 placas dentales (n = 10); diente principal corto, tamaño similar en toda la hilera; placa 1 con un diente lateral y dos medios; placa 6 y placa 15 con un diente lateral y tres medios; placa 22 con un diente lateral y uno medio. Mandíbulas con 8-10 dientes (n = 10), dos o tres dentículos libres (n = 10). Parápodos con cirro dorsal largo, delgado; distalmente redondeados en anteriores, digitiformes en medios, lanceolados en posteriores. Setas inician en el primer parápodo. Setas supraciculares: limbadas simples y distalmente bidentadas (Figura 1d). Setas subaciculares: falcígeros compuestos bidentados de dos tamaños (Figuras 1e, f). Dos pares de cirros pigidiales, el superior más largo, triarticulado. Coloración in vivo: bandas rojizas-púrpura en todo el cuerpo, más notorias en peristomio y segmentos anteriores (Figura 2a).
Variaciones. LT = 5-21.5 mm (n = 17, µ = 14.2 ± 4.9), A10 = 0.5-1.3 mm (n = 23, µ = 0.9 ± 0.2), setígeros 58-93 (n = 17, µ = 78 ± 9). Articulaciones en las antenas 8-12 (n = 20, µ = 9 ± 1).
Hábitat. Fondos rocosos (Bastida-Zavala, 1993). Esclerobionte en boyas entre temperaturas de 21.5-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.5 mg/L.
Distribución. Nicoya (Grube y Ørsted en Grube, 1857) y golfo de California (Bastida-Zavala, 1993).
Comentarios. Diez especies de Dorvillea son reconocidas en las provincias marinas que rodean a México, pero solo cuatro se distribuyen en el Pacífico mexicano: Dorvillea batia Jumars, D. cerasina (Ehlers), D. moniloceras (Moore) y D. vittata (Grube & Ørsted in Grube) (Carrera-Parra 2009a). Del total en México, D. bacescui Rullier, D. cerasina, D. largidentis Wolf, D. sociabilis (Webster) y D. vittata integran un grupo con falcígeros compuestos, ausencia de papila nucal, cirros dorsales no ensanchados y antenas moniliformes. La presencia de articulaciones en los palpos separa a D. vittata (articulados, Figura 2a) de D. sociabilis (simples). El inicio de las setas y el número de articulaciones en las antenas diferencia a D. vittata (parápodo 1; con 8-12 articulaciones) de D. bacescui (parápodo 2; con cinco articulaciones). Las diferencias entre D. cerasina y D. largidentis con respecto a D. vittata se basan en el arreglo del aparato maxilar y el tipo de setas limbadas.
Grube y Ørsted en Grube (1857) describieron Anisoceras vittataz (= Dorvillea fide Hartman, 1959) con un solo ejemplar procedente del Pacífico costarricense. La descripción es breve pero relevante. Grube y Ørsted señalan antenas con nueve articulaciones, palpos dos veces más anchos que las antenas, crenados, y cirros anales superiores triarticulados. El número de articulaciones en antenas y cirros pigidiales, el tipo de palpos, e incluso la coloración y sus patrones, son idénticos a los ejemplares de Mazatlán. Grube y Ørsted no indicaron la articulación palpal; no obstante, Ørsted ilustró el material con palpos subdistalmente articulados (Wolff y Petersen, 1991: lám. 2, fig. 7).
Familia Eunicidae Berthold, 1827
Género Eunice Cuvier, 1817
Eunice cf. violacea Grube y Ørsted en Grube, 1857
(Figuras 1b, c, g, 2b)
Eunice violacea Grube y Ørsted en Grube, 1857: 55-56; Fauchald 1992: 335; Salazar-Vallejo et al. 2011: 1467-1468. Localidad tipo: Puntarenas, Costa Rica. Eunice aphroditois (non Pallas) Monro 1933: 58-59.
Material examinado. Dos individuos juveniles incompletos: Est. 5 (2).
Caracterización. Prostomio bilobulado. Apéndices prostomiales ahusados, no articulados, en herradura. Antenas media y laterales de tamaño similar, se extienden al segundo setígero. Palpos anteniformes cortos, se extienden al segundo anillo peristomial. Un par de ojos semicirculares. Cirros peristomiales cortos, no alcanzan el margen anterior del peristomio, digitiformes, no articulados. MI = 1 + 1, MII = 5 + 6, MIII = 7 + 0, MIV = 5 + 8, MV = 1 + 1, MVI = - + -; MIII formando parte del arco distal. Branquias pectinadas desde el setígero 5, máximo con 25 filamentos, ligeramente más largas que el cirro dorsal en setígeros anteriores (Figura 1b). Cirro dorsal cirriforme, no articulado, ligeramente hinchado en su base. Cirro ventral con la base hinchada en forma de cojinete transversal con punta digitiforme en setígeros anteriores, no hinchado en posteriores (Figura 1c). Pectinas anodontas en setígeros anteriores, heterodontas en medios y posteriores. Falcígeros compuestos bidentados; dientes de tamaños similares y dirigidos distalmente en setígeros anteriores; el proximal más grande y dirigido lateralmente en posteriores. Acícula negra, punta roma o mucronada; dos acículas en setígeros anteriores, una en posteriores. GSA desde el setígero 21, negro, bidentado, uno a tres por parápodo, diente proximal grande, dirigido lateralmente (Figura 1g). Cirros anales lisos; par superior más largo. Coloración in vivo: cuerpo violeta; setígero 4 y/o 5, ápice de los cirros peristomiales, dorsales y ventrales con una banda blanquecina, los apéndices prostomiales con varias bandas (Figura 2b).
Hábitat. Esclerobionte en boyas en temperaturas de 21.4 °C, salinidad de 34 y oxígeno disuelto de 4.0 mg/L.
Variaciones. L10 = 6-7 mm (n = 2, µ = 6.5 ± 0.7), A10 = 4.1-4.7 mm (n = 2, µ = 4.4 ± 0.4). Setígero de inicio de las branquias 5 (n = 2, µ = 5 ± 0), y de los ganchos subaciculares 19-23 (n = 2, µ = 21 ± 3).
Distribución. Nicoya (Grube y Ørsted en Grube, 1857), Ensenada de Panamá (Monro, 1933) y golfo de California.
Comentarios. Grube y Ørsted en Grube (1857) describieron Eunice violacea con un solo ejemplar procedente del Pacífico costarricense. La descripción incluye algunos caracteres morfológicos y los patrones de pigmentación: tonos violeta (escarlata en alcohol); setígero 3 y ápice de los cirros peristomiales y dorsales amarillentos, apéndices prostomiales con bandas del mismo color. Fauchald (1992) consideró a la especie como indeterminable debido a la descripción breve y a la carencia de material tipo. Monro (1933) revisó material del Pacífico de Panamá y concluyó que E. violacea es sinónimo menor de E. aphroditois. Salazar-Vallejo et al. (2011) notaron que los patrones de pigmentación caracterizados por Crossland en Monro (1933) son idénticos a los que Grube y Ørsted describieron para E. violacea, aunque las bandas amarillas de los cirros dorsales no están presentes en juveniles (amarillo solo ápice del cirro dorsal) (Villalobos-Guerrero, obs. pers.); por tanto, sugieren que el nombre debe ser reestablecido con material topotípico. Eunice cf. violacea presenta los mismos patrones de pigmentación. Es posible que el material aquí registrado pertenezca a E. violacea; no obstante, es indispensable corroborar la especie con material del Pacífico costarricense, mediante atributos morfológicos y moleculares.
Eunice sp. B
(Figuras 1i-l, 2c)
Eunice sp. 2 Ruiz-Cancino et al. 2011: 39-41, figs. 7A-J, 16E.
Material examinado. 18 individuos (cuatro completos): Est. 1 (5), Est. 2 (3), Est. 4 (9), Est. 5 (1).
Caracterización. Prostomio bilobulado. Apéndices prostomiales ahusados, no articulados, en herradura. Antenas media y laterales de tamaño similar, se extienden al primer setígero. Palpos anteniformes cortos, se extienden a la mitad del peristomio. Un par de ojos redondos. Cirros peristomiales cortos, no alcanzan el margen anterior del peristomio, cirriformes, no articulados. MI = 1 + 1, MII = 4-5 + 4-5, MIII = 6-7 + 0, MIV = 4-5 + 8-9, MV = 1 + 1 MVI = -+ -; MIII reducida, formando parte del arco distal. Branquias pectinadas desde el setígero 6, máximo con 10 filamentos, más largas que el cirro dorsal (Figura 1i, j). Cirro dorsal cirriforme, no articulado ni basalmente hinchado. Cirro ventral con la base hinchada en forma de cojinete transversal con punta digitiforme en setígeros anteriores (Figura 1i). Pectinas heterodontas. Falcígeros compuestos bidentados; dientes de tamaños similares y dirigidos distalmente; el proximal más grande en setígeros posteriores. Acícula negra, punta roma ligeramente curva (Figura 1k); dos acículas en setígeros anteriores, una en posteriores. GSA desde el setígero 22, negro, uno por parápodo, bidentado, diente proximal grande, dirigido lateralmente (Figura 1l). Cirros anales lisos; par superior dos veces más largo. Coloración in vivo: cuerpo escarlata, pigmentación simulando una red de malla; setígero 3 y/o 4, ápice de apéndices prostomiales, cirros peristomiales, dorsales, ventrales y base hinchada sin pigmentación característica (Figura 2c).
Hábitat. Esclerobionte en boyas en temperaturas de 21.5-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.1-6.7 mg/L.
Distribución. Pacífico tropical mexicano (Ruiz-Cancino et al., 2011) y golfo de California.
Variaciones. LT = 7-65 mm (n = 4, µ = 37.5 ± 25.1), L10 = 2-8.5 mm (n = 18, µ = 5.1 ± 1.5), A10 = 0.8-4.3 mm (n = 18, µ = 0.9 ± 0.7), setígeros 48-160 (n = 4, µ = 117 ± 50). Setígero de inicio de las branquias 5-8 (n = 18, µ = 6 ± 1), de los ganchos subacicualres 18-28 (n = 18, µ = 22 ± 3).
Comentarios. Las provincias marinas que rodean las costas de México contienen 75 especies de Eunice; de las cuales, 42 presentan distribución exclusiva en las provincias del Atlántico y 22 en las del Pacífico; el resto se distribuyen en ambos litorales, siendo E. antennata (Savigny in Lamarck), E. aphroditois (Pallas) y E. vittata (delle Chiaje) cuestionables en las provincias mexicanas (Carrera-Parra, 2009b). Solo ocho especies de Eunice registradas en las provincias marinas que rodean las costas de México presentan simultáneamente GSA negro y bidentado, apéndices prostomiales y cirro dorsal no articulados, cirros peristomiales lisos, cortos, branquias inician antes del setígero 29 y palpos no divididos: Eunice bucciensis (Treadwell), E. collini Augener, E. denticulata Webster, E. filamentosa Grube & Ørsted in Grube, E. mutilatoides Augener, E. spongicola (Treadwell), E. notata (Treadwell) y E. tovarae Carrera-Parra & Salazar-Vallejo. Eunice sp. B difiere de E. denticulata, E. filamentosa, E. spongicola y E. tovarae por la forma de las acículas: la acícula es aguzada en Eunice sp. B, en el resto la acícula es distalmente expandida. Así mismo, Eunice sp. B puede separarse de E. bucciensis y E. notata por la forma del diente proximal del GSA (grande y dirigido lateralmente en la primera; corto y dirigido distalmente en las dos últimas). Eunice collini y E. mutilatoides difieren de Eunice sp. B por el tipo de branquia y el número de filamentos branquiales; palmadas y con uno o dos filamentos en E. collini y E. mutilatoides, y pectinadas con hasta diez filamentos en los ejemplares de Mazatlán. Además, E. mutilatoides difiere de Eunice sp. B por el arreglo de las antenas y palpos en el prostomio. Eunice mutilatoides presenta apéndices alineados en el prostomio; mientras que en Eunice sp. B están dispuestos en herradura. Es posible que pertenezca a una especie no descrita.
Eunice sp. C
(Figuras 1h, n-p, 2d)
Material examinado. 105 individuos (45 completos): Est. 1 (26), Est. 2 (36), Est. 3 (18), Est.4 (18), Est. 5 (7).
Caracterización. Prostomio bilobulado. Apéndices prostomiales moniliformes, en herradura. Ceratóforos cortos, ceratostilos con articulación subesférica. Antena media se extiende al tercer setígero, con 15 artejos; antenas laterales se extienden al segundo setígero, con 13 artejos; y palpos se extienden al primer setígero, con nueve artejos. Un par de ojos redondos, oscuros. Cirros peristomiales cortos, no alcanzan el margen anterior del peristomio, cirriformes, no articulados. MI = 1 + 1, MII = 4-7 + 5-7, MIII = 5-7, MIV = 5-8 + 6-9, MV = 1 + 1, MIII formando parte del arco distal. Branquias pectinadas desde el setígero 4, máximo con 25 filamentos, más largas que el cirro dorsal (Figuras 1o, p). Cirro dorsal cirriforme, más largo en setígeros posteriores, no articulado ni basalmente hinchado. Cirro ventral con la base hinchada de forma globular con punta digitiforme en setígeros anteriores. Pectinas heterodontas. Falcígeros compuestos bidentados; dientes de tamaños similares y dirigidos distalmente; el proximal más grande en setígeros posteriores. Acículas amarillas, una o dos por parápodo, punta roma o mucronada en setígeros anteriores, distalmente expandida en posteriores (Figura 1h). GSA desde el setígero 24, uno o dos por parápodo, amarillo, tridentado (Figura 1n). Cirros anales lisos; par superior tres veces más largo. Coloración in vivo: cuerpo verde olivo con múltiples máculas blanquecinas; apéndices prostomiales verde olivo; segundo anillo peristomial con una banda blanquecina (Figura 2d).
Hábitat. Esclerobionte en boyas en temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 31-100 mm (n = 27, µ = 61 ± 21.5), L10 = 3.5-11 mm (n = 102, µ = 7 ± 1.5), A10 = 1.5-5 mm (n = 102, µ = 3 ± 0.6), setígeros 74-128 (n = 45, µ = 109 ± 10). Antena media con 11-19 artejos (n = 70, µ = 15 ± 2); antenas laterales con 7-20 artejos (n = 85, µ = 13 ± 2); palpos con 6-12 artejos (n = 70, µ = 9 ± 1). Branquias desde los setígeros 3-5 (n = 102, µ = 4 ± 1), y los ganchos subaciculares desde los setígeros 20-31 (n = 102, µ = 24 ± 2).
Comentarios. Solo dos especies de Eunice registradas en las provincias marinas que rodean las costas de México presentan simultáneamente ganchos subaciculares amarillos y tridentados, apéndices prostomiales con articulaciones subesféricas y cirros peristomiales lisos: Eunice aedificatrix (Monro) y E. chicasi de León-González et al. Recientemente, Salazar-Vallejo et al. (2011) argumentaron la necesidad de retomar las características branquiales como su inicio y el número máximo de filamentos, así como los patrones de pigmentación, la longitud de los apéndices prostomiales y su número de articulaciones, tipo de pectinas, falcígeros y ganchos subaciculares, entre otros caracteres más, para mejorar la distinción entre especies de Eunice.
Eunice sp. C difiere de E. aedificatrix por la longitud de los cirros peristomiales, la forma y longitud del diente proximal de los falcígeros, la acícula, el número de filamentos branquiales y de GSA por parápodo. En E. aedificatrix, los cirros peristomiales son largos, sobrepasan el margen anterior del peristomio, el diente proximal de los falcígeros está dirigido lateralmente, más largo que el distal, carece de acículas mucronadas, presenta hasta 13 filamentos branquiales y un GSA por parápodo (Fauchald, 1992); por el contrario, los cirros peristomiales en Eunice sp. C son cortos, alcanzan la mitad del peristomio, el diente proximal es simétrico y tan largo como el distal, las acículas mucronadas están presentes, tiene 25 filamentos branquiales como máximo y hasta dos GSA por parápodo. Por otra parte, E. chicasi presenta branquias desde el setígero 6 y diez filamentos branquiales como máximo (Ruiz-Cancino et al., 2011); mientras que las branquias en Eunice sp. C inician en los setígeros 3-5 y tienen más de 20 filamentos branquiales. El número de artejos y la extensión de los apéndices prostomiales en E. chicasi es el siguiente (Ruiz-Cancino et al., 2011): antena media con 27 artejos se extiende al setígero 5, antenas laterales con 21 artejos se extienden al setígero 2, palpos con 15 artejos se extienden al setígero 1; mientras que en Eunice sp. C: antena media con 15 artejos se extiende al setígero 3, antenas laterales con 13 artejos, se extienden al setígero 2, palpos con nueve artejos se extienden al setígero 1. Por tal motivo, es posible que Eunice sp. C pertenezca a una especie no descrita.
Género Marphysa De Quatrefages, 1865
Marphysa angelensis Fauchald, 1970
(Figura 1m)
Marphysa angelensis Fauchald, 1970: 57-59, lám. 8A-H. Localidad tipo: Puerto Refugio, isla Ángel de la Guarda, Baja California.
Material examinado. Un individuo completo: Est. 4 (1). LT = 8.5 mm, L10 = 2.2 mm, A10 = 1.1 mm, 74 setígeros.
Caracterización. Prostomio bilobulado. Apéndices prostomiales cortos, fusiformes, en herradura. Palpóforos y ceratóforos cortos. Antena media aislada, se extiende al segundo setígero. Palpos anteniformes dehiscentes. Un par de ojos redondos. MI = 1 + 1, MII = 3 + 6, MIII = 7 + 0, MIV = 4 + 9, MV = 1 + 1; MIII formando parte del arco distal. Branquias palmadas desde el setígero 9, presentes en la mayoría de los parápodos, máximo con dos filamentos, más largas que el cirro dorsal en setígeros anteriores y posteriores. Cirro dorsal cirriforme, sin proceso ventral. Cirro ventral con base hinchada con punta digitiforme en setígeros anteriores. Pectinas anodontas. Espinígeros y falcígeros compuestos en todos los parápodos (Figura 1m); falcígeros más abundantes que los espinígeros en setígeros anteriores. Falcígeros compuestos bidentados; dientes de tamaños similares y dirigidos distalmente; el proximal más grande en setígeros posteriores. Acícula negra, punta roma; dos acículas en setígeros anteriores, una en posteriores. GSA desde el setígero 15, uno por parápodo, negro, bidentado, diente proximal más grande, dirigido lateralmente. Cirros anales lisos; par superior tres veces más largo.
Hábitat. Arena, 20-40 m de profundidad (Fauchald, 1970). Esclerobionte en boyas en temperaturas de 24 °C, salinidad de 34.5 y oxígeno disuelto de 5.9 mg/L.
Distribución. Golfo de California (Fauchald, 1970).
Comentarios. De acuerdo con las agrupaciones de Marphysa establecidas por Fauchald (1970), M. angelensis pertenece al grupo D2 (falcígeros y espinígeros compuestos, branquias presentes en la mayoría de los parápodos). Actualmente, el grupo D2 engloba a once especies: Marphysa angelensis, M. brevitentaculata Treadwell, M. chevalensis Willey, M. dartevellei Monro, M. depressa (Schmarda), M. digitibranchia Hoagland, M. fallax Marion y Bobretzky, M. formosa Steiner y Amaral, M. mixta Fauchald, M. orensanzi Carrera-Parra y Salazar-Vallejo, y M. sebastiana Steiner y Amaral. De ellas, M. angelensis es la única especie del grupo con falcígeros y espinígeros en todos los parápodos. El ejemplar se ajustó a la descripción original de M. angelensis. En este estudio se describe por primera ocasión la fórmula maxilar de la especie. Es necesaria la revisión de material numeroso para determinar los caracteres variables de esta y todas las especies del grupo D2.
Marphysa cf. sanguinea (Montagu, 1815)
(Figura 1q)
Marphysa schmardai Gravier, 1907: 529-530. Localidad tipo: Paita, Perú.
Marphysa californica Moore, 1909: 251-253, lám. 8, fig. 13-20, lám. 9, fig. 19-20. Localidad tipo: San Diego, California, EE. UU.
Marphysa americana Monro, 1933: 68-69, fig. text. 28. Localidad tipo: Pacífico de Panamá.
Material examinado. Nueve individuos, solo dos completos: Est. 1 (3), Est. 2 (2), Est. 5 (4).
Caracterización. Prostomio bilobulado. Apéndices prostomiales cortos, fusiformes, en herradura. Palpóforos y ceratóforos cortos. Antena media aislada, se extiende al segundo setígero; antenas laterales se extienden al primer setígero; palpos se extienden al segundo anillo peristomial. Un par de ojos redondos. MI = 1 + 1, MII = 4-5 + 5-6, MIII = 5-6 + 0, MIV = 4-5 + 7-9, MV = 1 + 1; MIII formando parte del arco distal. Branquias palmadas desde el setígero 11, presentes en la mayoría de los parápodos, máximo con cinco filamentos, más largos que el cirro dorsal. Cirro dorsal cirriforme, sin proceso ventral. Cirro ventral con base hinchada con punta digitiforme en setígeros anteriores. Lóbulo postsetal de setígeros 1-3 alargado, digitiforme, rebasa la longitud del cirro ventral (Figura 1q). Pectinas isodontas, estrechas y amplias. Espinígeros compuestos en todos los parápodos. Acícula negra, punta roma; dos o tres en setígeros anteriores, una en posteriores. GSA desde el setígero 21, uno por parápodo, negro, bidentado, diente proximal más grande, dirigido lateralmente. Cirros anales lisos; par superior cinco veces más largo.
Hábitat. Esclerobionte en boyas entre temperaturas de 21.5-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.1-6.7 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 16-18 mm (n = 2, µ = 17 ± 1.4), L10 = 2.5-5 mm (n = 9, µ = 3.6 ± 0.7), A10 = 1.4-2.3 mm (n = 9, µ = 1.8 ± 0.3), setígeros 96-100 (n = 2, µ = 98 ± 3). Branquias inician en los setígeros 10-13 (n = 9, µ = 11 ± 1), los ganchos subaciculares en los 17-27 (n = 9, µ = 21 ± 3).
Comentarios. Nuestros ejemplares comparten caracteres con el "complejo Marphysa sanguinea (Montagu)": ganchos subaciculares negros, bidentados, espinígeros compuestos y setas pectinadas isodontas. Marphysa sanguinea, considerada cosmopolita anteriormente, ha sido restringida para los mares septentrionales de Europa (Hutchings y Karageorgopoulos, 2003). Existen tres nombres disponibles para este complejo multiespecífico en el Pacífico americano: Marphysa americana Monro, M. californica Moore y M. schmardai Gravier. De acuerdo con Carrera-Parra (2009b), la única diferencia entre estas especies es el número de filamentos branquiales, los cuales son dependientes de la talla de los ejemplares, y por tanto constituyen una sola especie diferente de M. sanguinea.
Marphysa cf. sanguinea difiere de la especie nominal en las proporciones de los lóbulos postsetales anteriores y en el setígero de inicio de las branquias. En M. sanguinea, el lóbulo postsetal de los setígeros anteriores es corto, truncado, y las branquias inician en el setígero 14-27 (Hutchings y Karageorgopoulos, 2003); en cambio, el lóbulo postsetal de los setígeros anteriores de los ejemplares de este estudio es muy alargado y digitiforme, y las branquias inician en el setígero 10-13. Se desconocen los lóbulos postsetales y la variación del setígero branquiado en el "complejo Marphysa sanguinea" del Pacífico americano. Es indispensable revisar el material tipo o topotípico de M. americana, M. californica y M. schmardai para aceptar o rechazar su estatus como especie única y así asignarles un nombre a nuestros ejemplares. Este estudio respalda la posible ausencia de M. sanguinea en el Pacífico americano.
Marphysa sp. B
(Figura 1r, s)
Marphysa sp. Ruiz-Cancino et al. 2011: 46-48, figs. 10A-J, 16H.
Material examinado. Seis individuos incompletos: Est. 1 (3), Est. 3 (2), Est. 4 (1).
Material adicional examinado. Un individuo incompleto: MT-016 (1).
Caracterización. Prostomio bilobulado. Apéndices prostomiales cortos, fusiformes en herradura. Palpóforos y ceratóforos cortos. Antena media aislada, se extiende al tercer setígero; antenas laterales se extienden al segundo setígero; palpos se extienden al primer setígero. Dos ojos redondos. MI = 1 + 1, MII = 3 + 3, MIII = 4, MIV = 4 + 6, MV = 1 + 1, MIII ubicada detrás de MII. Branquias pectinadas desde el setígero 30 al final del fragmento, máximo con tres filamentos, más largos que el cirro dorsal (Figura 1r). Cirro dorsal cirriforme, sin proceso ventral. Cirro ventral con base hinchada con punta digitiforme en setígeros anteriores. Pectinas isodontas estrechas. Falcígeros compuestos en todos los parápodos; dientes de tamaño similar, el proximal ligeramente más grande en setígeros posteriores. Acícula negra, punta roma; dos o tres en setígeros anteriores, una en posteriores. GSA desde el setígero 32, uno por parápodo, amarillo, bidentado, diente proximal más grande, dirigido lateralmente (Figura 1s).
Hábitat. Coral muerto (Ruiz-Cancino et al., 2011) y como esclerobionte en boyas entre temperaturas de 20.3-28.6, salinidades de 32.1-35.2 y oxígeno disuelto de 3.1-6.6 mg/L.
Distribución. Pacífico tropical mexicano (Ruiz-Cancino et al., 2011) y golfo de California.
Variaciones. L10 = 2-4 mm (n = 7, µ = 2.9 ± 0.7), A10 = 0.9-2 mm (n = 7, µ = 1.4 ± 0.4). Branquias inician en los setígeros 16-44 (n = 6, µ = 30 ± 10), los ganchos subaciculares en 22-37 (n = 7, µ = 32 ± 5).
Comentarios. De acuerdo con las agrupaciones de Marphysa establecidas por Fauchald (1970), el grupo C2 contiene especies que presentan solo falcígeros compuestos y branquias en la mayoría de los parápodos. Actualmente, C2 engloba alrededor de 20 especies, de ellas solo 12 son reconocidas debido a que presentan información taxonómica detallada: Marphysa amadae Fauchald, M. angeli Carrera-Parra y Salazar-Vallejo, M. bifurcata Kott, M. borradailei Pillai, M. capensis (Schmarda), M. corallina (Kinberg), M. gayi De Quatrefages, M. mortenseni Monro, M. posteriobranchia Day, M. regalis Verrill, M. stylobranchiata Moore y M. veracruzensis De León-González y Díaz-Castañeda. Marphysa sp. B difiere de dichas especies, excepto M. veracruzensis, por presentar ganchos subaciculares amarillos, bidentados.
Marphysa veracruzensis y Marphysa sp. B son diferenciables por varios caracteres. En la primera, el prostomio es oblongo, las pectinas son heterodontas con 17-18 dientes, carece de cirros ventrales posteriores, la maxila III presenta seis dientes y la maxila IV izquierda entre 5-6 y la derecha entre 7-8 (De León-González y Díaz-Castañeda, 2006); mientras que en Marphysa sp. B, el prostomio es tan largo como ancho, las pectinas son isodontas con 11-15 dientes, los cirros ventrales están presentes en setígeros posteriores, la maxila III tiene cuatro dientes y la maxila IV luce cuatro dientes izquierdos y seis derechos.
Marphysa sp. B no difiere considerablemente de Marphysa sp. (Ruiz-Cancino et al., 2011), excepto en el tipo de branquias y número de filamentos que son caracteres dependientes de la talla. Es indispensable revisar material numeroso de las morfoespecies y determinar su estatus, ya que posiblemente pertenezcan a una misma especie no descrita.
Género Palola Gray en Stair, 1847
Palola sp. A
(Figura 2e)
Palola sp. 1 Ruiz-Cancino et al. 2011: 49-51, figs. 13A-F, 16I.
Material examinado. Tres individuos incompletos: Est. 1 (2), Est. 4 (1).
Material adicional examinado. Un individuo completo: EMU-5117 (1).
Caracterización. Prostomio bilobulado. Apéndices prostomiales digitiformes, en herradura. Palpóforos y ceratóforos cortos. Antena media más larga que las laterales (Figura 2e), se extiende al tercer setígero; antenas laterales al segundo setígero; palpos al segundo anillo peristomial. Un par de ojos subovales. Cirros peristomiales cortos, no alcanzan el margen anterior del peristomio, digitiformes. MI = 1 + 1, MII = 3 + 2, MIII = 1 + 0, MIV = 1 + 1, MV = 1 + 1; MIII ubicada atrás de MII. Mandíbulas dos veces más largas que MI. Branquias desde el setígero 70 al final del cuerpo, monofilamentosas, tamaño similar al cirro dorsal en setígeros anteriores, cinco veces más largas en posteriores. Cirro dorsal digitiforme, liso, mayor que el ventral. Cirro ventral digitiforme en setígeros anteriores y posteriores; base hinchada y punta digitiforme en setígeros medios. Falcígeros compuestos bidentados; dientes con longitud similar y dirigidos distalmente; hoja corta, gruesa. Acícula negra, punta roma, ligeramente curva, una por parápodo. Cirros anales lisos; par superior más largo.
Hábitat. Coral muerto y sobre conchas de bivalvos (Ruiz-Cancino et al., 2011); como esclerobionte en boyas entre temperaturas de 21.5-30.8 °C, salinidades de 32.1-34.8 y oxígeno disuelto de 3.1-6.4 mg/L.
Distribución. Pacífico tropical mexicano y Pacífico centroamericano (Ruiz-Cancino et al., 2011); golfo de California.
Variaciones. LT = 59 mm (n = 1, µ = 59 ± 0), L10 = 2.5-6 mm (n = 4, µ = 4.08 ± 1.7), A10 = 1.3-2.5 mm (n = 4, µ = 2.03 ± 0.53), setígeros 257 (n = 1, µ = 257 ± 0). Branquias desde los setígeros 65-79 (n = 3, µ = 70 ± 8).
Comentarios. Catorce especies de Palola son válidas en el mundo (Schulze, 2006); tres de ellas se distinguen por presentar falcígeros con hoja corta y robusta como en Palola sp. A: Palola valida (Gravier), P. vernalis Treadwell y P. viridis Gray en Stair. Palola sp. A difiere de P. valida y P. viridis, porque ellas presentan maxila IV con dos o cuatro dientes, respectivamente; mientras que en Palola sp. A es una placa con un diente. En P. vernalis las antenas laterales son más largas que la antena media, esto no ocurre en Palola sp. A en donde las antenas laterales son más cortas que la antena media. Es posible que pertenezca a una especie no descrita.
Familia Lumbrineridae Schmarda, 1861
Género Lumbrineris De Blainville, 1828
Lumbrineris sp. A
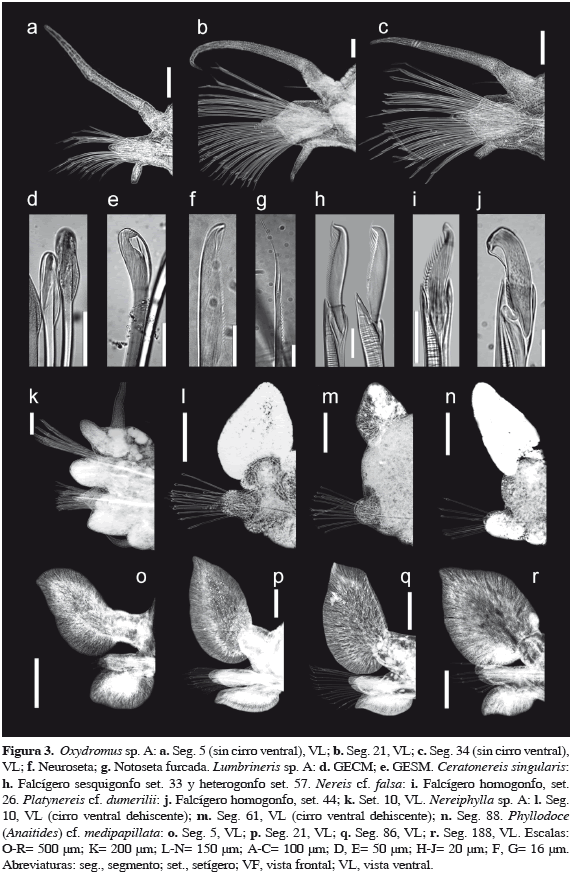
(Figura 3d, e)
Material examinado. 11 individuos (cinco completos): Est. 1 (4), Est. 2 (2), Est. 4 (4), Est. 5 (1).
Caracterización. Prostomio globular. Peristomio con segundo anillo entero ventralmente. Aparato maxilar con cinco pares de maxilas; portadores maxilares con tamaño similar a MI. MI en forma de fórceps, lamela accesoria bien desarrollada. MII = 4 + 5 dientes; más ancha, tan larga como MI. MIII = 4 + 4 dientes, diente distal más largo. MIV = 2 + 2 dientes; diente distal más largo que el proximal. MV libre, muy prominente, lateral a las maxilas III-IV. Parápodos con lóbulo presetal muy corto, redondeado en todos los segmentos; lóbulo postsetal bien desarrollado, digitiforme, alargado, sin cambio gradual. Cirro dorsal corto, redondeado. Seta limbada dorsal desaparece en el setígero 31, la limbada ventral en el 21. Acícula parda oscura a negra, aguzada; hasta tres en setígeros anteriores, una en posteriores. GECM desaparecen en el setígero 21; hoja corta, más de siete dientes (Figura 3d). GESM con hoja corta, hasta con 11 dientes (Figura 3e); dos tamaños, el postacicular dos veces más largo en setígeros posteriores. Cirros cirriformes lisos, de tamaño similar. Coloración in vivo: cuerpo amarillo-pardusco, sin patrón de pigmentación.
Hábitat. Esclerobionte en boyas entre temperaturas de 21.5-31.8 °C, salinidades 32.1-35.2 y oxígeno disuelto de 3.1-6.7 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 12-42 mm (n = 5, µ = 24.6 ± 11.9), L10 = 1.5-3.1 mm (n = 11, µ = 2.5 ± 0.5), A10 = 0.8-1.6 mm (n = 11, µ = 1.3 ± 0.3), setígeros 64-142 (n = 5, µ = 102 ± 33). Seta limbada dorsal desaparece en los setígeros 21-37 (n = 10, µ = 31 ± 5), la ventral en 12-29 (n = 11, µ = 21 ± 4) y el gancho encapuchado compuesto multidentado en 9-28 (n = 11, µ = 21 ± 5).
Comentarios. Cuarenta y dos especies de Lumbrineris son válidas en todo el mundo (Carrera-Parra, 2006). Doce son reconocidas para las provincias que rodean las costas de México; de las cuales, nueve presentan distribución en las provincias marinas del Pacífico mexicano (Carrera-Parra, 2009c). Del total mundial, solo dos presentan MIII tetradentado como en nuestros ejemplares: Lumbrineris albifrons Crossland y L. perkinsi Carrera-Parra. Ambas especies comparten MII pentadentado y acículas amarillas (Carrera-Parra, 2006); mientras que Lumbrineris sp. A, muestra la MII izquierda tetradentada, la derecha pentadentada y acículas negras. Así mismo, Lumbrineris sp. A se diferencia de ambas especies por el setígero de aparición/desaparición de los GECM y de las setas limbadas, incluso por los patrones de pigmentación que son notorios en L. perkinsi pero ausentes en Lumbrineris sp. A. Es posible que pertenezca a una especie no descrita.
Género Scoletoma de Blainville, 1828
Scoletoma cf. tetraura (Schmarda, 1861)
Lumbrineris tetraura (non Notocirrus tetraurus Schmarda) Moore 1911: 291; Hartman 1944: 147-149, lám. 8, figs. 175, 190, 191, lám. 9, figs. 192-195; Fauchald 1970: 109-111, lám. 19, figs. b-e; Hilbig 1995: 309, fig. 11.13.
Material examinado. Un individuo: Est. 5 (1). L10 = 2.0 mm, A10 = 0.9 mm.
Caracterización. Prostomio globular. Peristomio con segundo anillo entero ventralmente. Aparato maxilar con cinco pares de maxilas; portadores maxilares más cortos que la MI. MI en forma de fórceps, lamela accesoria bien desarrollada. MII= 4 + 5 dientes; más ancha, tan larga como MI. MIII= 2 + 2 dientes, diente distal más largo. MIV = 1 + 1 diente aguzado. MV libre, muy prominente, lateral a las maxilas III-IV. Parápodos con lóbulo presetal corto, redondeado; lóbulo postsetal bien desarrollado, digitiforme, alargado, sin cambio gradual. Seta limbada dorsal desaparece en el setígero 23, la limbada ventral en el 20. Acícula amarilla. GESM con dos formas: capuchón largo hasta el setígero 16, con menos de ocho dientes; capuchón corto desde el setígero 17, con más de nueve dientes.
Hábitat. Esclerobionte en boyas en temperaturas de 22 °C, salinidad de 34.1, y oxígeno disuelto de 6.6 mg/L.
Distribución. Ensenada del sur de California (Moore, 1911; Fauchald, 1970; Hilbig, 1995) y golfo de California (Hartman, 1944).
Comentarios. Diecinueve especies de Scoletoma son reconocidas para las provincias marinas que rodean las costas de México; de ellas, 14 presentan distribución en las provincias del Pacífico mexicano. Del total en México, solamente cuatro presentan el par maxilar III bidentado: Scoletoma sarsi (Kinberg), S. tetraura (Schmarda), S. treadwelli (Hartman) y S. zonata (Johnson).
Scoletoma zonata difiere de Scoletoma sp. A por el número de dientes en MII, longitud del capuchón en los ganchos simples y los patrones de coloración. La primera presenta MII simétrica (cuatro dientes por maxila), ganchos simples con capuchón corto en todos los setígeros y una banda parda, gruesa, por parápodo (Johnson, 1901); en cambio, Scoletoma sp. A exhibe MII asimétrica (cuatro y cinco dientes en las maxilas), ganchos simples con capuchón largo en setígeros anteriores y carece de pigmentación. En cambio, S. treadwelli se distingue de Scoletoma sp. A por el número de dientes en MII y por la extensión y dirección del lóbulo postsetal. Scoletoma treadwelli luce MII simétrica (cuatro dientes por maxila), lóbulo postsetal ligeramente alargado y dirigido ventralmente; mientras que en Scoletoma sp. A, la MII es asimétrica (cuatro y cinco dientes en la maxila) y el lóbulo postsetal más alargado y dirigido dorsalmente.
El ejemplar de este estudio se ajusta a las caracterizaciones de S. tetraura para California y Pacífico mexicano (Hartman, 1944; Fauchald, 1970; Hilbig, 1995): lóbulo postsetal más largo que el presetal y dirigido dorsalmente, acículas amarillas, ganchos encapuchados simples, largos, disminuyen gradualmente y aparecen desde el primer setígero, M1 = 1 + 1, MII = 4 + 4, MIII = 2 + 2, MIV = 1 + 1, MV = libre. Scoletoma tetraura fue descrita brevemente para las costas chilenas como Notocirrus tetraurus (Schmarda, 1861); sin embargo, varios autores la han considerado presente en el Pacífico de América del norte y del centro (Carrera-Parra, 2009c). La especie no ha sido redescrita con material tipo y no hay certeza de los caracteres que la definen, a tal grado que S. sarsi, descrita para el golfo de Guayaquil (Ecuador), no puede ser separada de S. tetraura por la escasa información taxonómica existente (Carrera-Parra, 2009c). Es indispensable revisar dicho material para esclarecer el estatus de los ejemplares del Pacífico norteamericano.
Orden Phyllodocida Dales, 1962
Familia Hesionidae Grube, 1850
Género Oxydromus Grube, 1855
Oxydromus sp. A
(Figura 3a-c, f, g)
Material examinado. 49 individuos (21 completos): Est. 1 (30), Est. 2 (4), Est. 3 (7), Est. 4 (3), Est. 5 (5).
Caracterización. Prostomio ovoide, más ancho que largo. Ojos en arreglo trapezoidal; par anterior reniforme, más grande que el posterior redondeado. Tres antenas cirriformes, no ensanchadas basalmente; antena media tres veces más corta que las laterales, ubicada medio-anteriormente en el prostomio. Palpos de tamaño similar a las antenas; palpóforo cilíndrico, palpostilo basalmente ensanchado. Seis pares de cirros anteriores largos, cirriformes, no articulados. Cirros dorsales de los segmentos 1, 2 y 3 se extienden a los segmentos 4, 5 y 6, respectivamente; cirros siguientes subarticulados medio-terminalmente (Figura 3a), lisos en segmentos posteriores (Figura 3b, c). Cirros ventrales de los segmentos 1, 2 y 3 se extienden a los segmentos 5, 6 y 6, respectivamente; cirros siguientes digitiformes, lisos. Lóbulos preaciculares digitiformes, largos; triangulares en segmentos posteriores. Lóbulos neuropodales rectangulares; distalmente redondeados en segmentos anteriores (Figura 3a) y aguzados en posteriores (Figura 3c). Dos noto- y neuroacículas simples por parápodo. Notosetas desde el segmento 6, hasta tres por parápodo, furcadas con dientecillos; diente principal tres veces más grande que el secundario (Figura 3g). Neurosetas compuestas, unidentadas, lámina distalmente expandida y truncada (Figura 3f); hasta 20 en segmentos anteriores, más de 20 en posteriores. Cirros anales cirriformes. Coloración in vivo: Cuerpo anaranjado pálido, cuatro bandas blanquecinas en el dorso.
Hábitat. Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L. Epibionte del mangle rojo Rhizophora mangle (L), entre galerías del serpúlido Ficopomatus miamiensis (Treadwell) (Villalobos-Guerrero, obs. pers.).
Distribución. Golfo de California.
Variaciones. LT = 3-8.6 mm (n = 21, µ = 6.1 ± 1.7), L10 = 0.8-1.65 mm (n = 50, µ = 1.1 ± 0.2), A10 = 0.3-0.85 mm (n = 50, µ = 0.5 ± 0.1), segmentos 28-44 (n = 21, µ = 38 ± 4).
Comentarios. Oxydromus tiene prioridad ante Ophiodromus y por tal motivo fue reestablecido recientemente. Treinta y dos especies de Oxydromus Grube son válidas en el mundo (Villalobos-Guerrero y Harris, 2012). Siete son reconocidas para las provincias que rodean las costas de México (Salazar-Vallejo y Rizzo, 2009); de estas, solo dos se encuentran en las provincias del Pacífico mexicano. Del total en México, solo cinco presentan neurosetas de un solo tipo (compuestas): Oxydromus agilis (Ehlers), O. minutus (Hartmann-Schröder), O. mutilatus (Treadwell), O. pugettensis (Johnson) y O. obscurus (Verrill). Oxydromus sp. A cumple con esta característica, pero es diferente de dichas especies por presentar cirros dorsales articulados y prostomio ovoide (casi tan ancho como largo). Además, otros caracteres como el tipo de setas y el tamaño de las estructuras prostomiales, ayudan a separar Oxydromus sp. A de algunas de esas especies.
Oxydromus pugettensis fue descrita para la sonda de Pugett en el Pacífico estadounidense. Hilbig (1994) caracterizó la especie con material del norte de California. Ha sido registrada ampliamente en diferentes localidades del Pacífico americano templado y tropical (e. g. Gravier, 1909; Rioja, 1941; Hartman, 1961; Kudenov, 1975; Fauchald, 1977; Pleijel, 1998), e incluso, en otras regiones del mundo como Japón (Uchida, 2004) y Rusia (Uschakov, 1955). Además de los caracteres mencionados anteriormente, Oxydromus sp. A puede separarse de O. pugettensis porque la primera presenta hasta tres notosetas por parápodo y lámina accesoria de las neurosetas truncada y expandida distalmente, mientras que O. pugettensis presenta dos notosetas por parápodo y la lámina accesoria de las neurosetas es aguzada (Hilbig, 1994). Los registros de O. pugettensis para el Pacífico mexicano seguramente pertenecen a Oxydromus sp. A. Es posible que se trate de una especie no descrita; sin embargo, es indispensable efectuar la redescripción de la especie con material tipo o topotípico para definir la identidad del material.
Familia Nereididae De Blainville, 1818
Subfamilia Nereidinae De Blainville, 1818
Género Alitta Kinberg, 1865
Alitta succinea (Leuckart, 1847)
Nereis succinea Leuckart, 1847: 154-156, lám. 2, figs. 9, 11. Localidad tipo: Helgoland y Cuxhaven, Alemania.
Neanthes succinea Sato 2013: 35-43, figs. 3D-F, 4B, 15-17 (syn.).
Alitta succinea Bakken y Wilson 2005: 516-517 (partim); Villalobos-Guerrero 2012: 131-165, figs 1-3.
Material examinado. 679 individuos (455 completos): Est. 1 (201), Est. 2 (70), Est. 3 (137), Est. 4 (51), Est. 5 (220).
Material adicional examinado. 46 individuos (30 completos): EMU-451 (1), EMU-457 (2), EMU-4386 (22), EMU-4387 (10), EMU-4388 (2), EMU-4389 (4), EMU-4390 (5).
Caracterización. Para una caracterización detallada con fotografías de los ejemplares consultar Villalobos-Guerrero (2012).
Hábitat. Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L. Para conocer los hábitats de la especie consultar Villalobos-Guerrero (2012).
Distribución. Más de 50 países de los océanos Atlántico, Pacífico e Índico. Para una revisión detallada de la distribución consultar Villalobos-Guerrero (2012).
Variaciones. LT = 7-42 mm (n = 80, µ = 18 ± 7.7), L15 = 2.5-11 mm (n = 142, µ = 5.5 ± 1.5), A15 = 0.5-6 mm (n = 142, µ = 1.5 ± 0.7), segmentos 37-122 (n = 80, µ = 69 ± 15). Dientes mandibulares 7-11 (n = 58, µ = 9 ± 1). Paragnatos: AI = 2-4 (n = 58, µ = 3±1); AII = 8-26 (n = 55, µ = 17 ± 4); AIII = 5-23 (n = 55, µ = 13 ± 4); AIV = 10-32 (n = 57, µ = 19 ± 5); AV = 2-11 (n = 121, µ = 5 ± 2); AVI = 4-13 (n = 120, µ = 8 ± 2); AVII-VIII = 56-128 (n = 73, µ = 84 ± 14) (este estudio).
Comentarios. Alitta succinea es catalogado como un poliqueto introducido de alto impacto en todo el mundo (GISD, 2007) y como especie potencialmente exótica en el golfo de California (Villalobos-Guerrero, 2012). Definir el estatus de la especie para confirmar su amplia distribución ha tomado interés especial en los últimos 30 años. Wilson (1984, 1988) revisó numerosos ejemplares de Neanthes succinea procedentes de diversos países y de la localidad tipo (Helgoland, Alemania); no encontró diferencias notorias entre su material, concluyendo que era la misma especie. Khlebovich (1996) retuvo a N. succinea dentro de Neanthes y restableció Alitta Kinberg, 1865 para tres especies; no obstante, no argumentó porque seguir manteniendo a la especie dentro de Neanthes, ni dio detalle de la restauración del género, solo que se asemeja a Nectoneanthes Imajima. Wilson (1988) indicó que la especie tipo de Nectoneanthes, N. oxypoda (Marenzeller), es sinónimo de N. succinea, ya que Imajima (1972) utilizó caracteres que podrían fungir como modificaciones epitocas, para definir Nectoneanthes. Bakken y Wilson (2005) confirmaron la validez de Alitta mediante un análisis filogenético de la morfología y lo redefinieron incluyendo a A. succinea; así, Nectoneanthes pasó a ser sinónimo de Alitta. Este último género puede reconocerse de los otros por la presencia de un lóbulo presetal notopodal tan largo como la lígula notopodal dorsal y un lóbulo postsetal neuropodal presente a lo largo de todo el cuerpo; en la enmendación, el género fue definido sin notoacículas en los setígeros 1 y 2 (Bakken y Wilson, 2005: 514).
Sato (2013) restableció Nectoneanthes demostrando con material tipo y no tipo que N. oxypoda no es sinónimo de A. succinea por numerosos caracteres presentes en la fase atoca. Conjuntamente, Sato determinó el lectotipo y paralectotipos de A. succinea con tres ejemplares procedentes de Alemania. Con base en este material, evidenció el error que Bakken y Wilson (2005) cometieron al indicar a la especie con notoacículas en los setígeros 1 y 2 (ausentes en el material tipo), considerando que este único carácter es suficiente para transferir a A. succinea al género Neanthes; así, enmendó Neanthes: ... notoacículas de los setígeros 1 y 2 presentes o ausentes". Sin embargo, si nos basamos en los caracteres que definen a Alitta (sensu Bakken y Wilson, 2005: 516), consideramos inválida la transferencia de Alitta succinea a Neanthes, debido a que la presencia/ausencia de notoacículas en los setígeros 1 y 2 no es el carácter principal que define al género Alitta, sino la presencia de un lóbulo presetal notopodal tan largo como la lígula notopodal dorsal. Por esta razón, mantenemos nuestros ejemplares en Alitta.
Género Ceratonereis Kinberg, 1865
Ceratonereis singularis Treadwell, 1929
(Figura 3h)
Ceratonereis singularis Treadwell, 1929: 1-3, figs. 1-8; Perkins 1980: 17-26, figs. 7-10 (partim). Localidad tipo: Isla San José, California.
Material examinado. 81 individuos (14 completos): Est. 1 (13), Est. 2 (12), Est. 3 (21), Est. 4 (10), Est. 5 (25).
Material adicional examinado. Un individuo incompleto: EMU-448 (1).
Caracterización. Prostomio escindido, más ancho que largo. Antenas tan largas como los palpos. Cirro tentacular más posterior se extiende hasta el setígero 13. Mandíbulas con siete dientes. Paragnatos solo en el anillo maxilar, cónicos. AI = 0; AII = 11, en dos o tres hileras diagonales; AIII = 7, en grupo suboval; AIV = 13, en arreglo subcircular. Parápodos con lígulas notopodal dorsal y ventral similares, cuatro veces más cortas que el cirro dorsal en setígeros anteriores; lígula dorsal reducida, más corta que la ventral en posteriores. Cirro dorsal cirriforme; tan largo como la mitad del ancho del segmento en setígeros anteriores, alcanza el ancho del segmento en posteriores. Lígula neuropodal triangular en todos los setígeros. Lóbulo presetal más corto que la lígula notopodal ventral en setígeros anteriores, reducido en posteriores. Lóbulo postsetal prominente en segmentos anteriores, como lóbulo acicular redondeado en segmentos posteriores. Notosetas: espinígeros sesquigonfos y falcígeros sesquigonfos; falcígeros desde el setígero 15-20, unidentados, diente dirigido lateralmente (Figura 3h); espinígeros desde el setígero 3. Neurosetas: fascículo dorsal, falcígeros heterogonfos (Figura 3h) y espinígeros sesquigonfos; 2-3 falcígeros por fascículo; fascículo ventral, espinígeros heterogonfos y falcígeros heterogonfos; 6-9 falcígeros por fascículo. Notoacículas desde el setígero 1 y 2. Coloración in vivo: cuerpo verdoso-pardusco en la región anterior.
Hábitat. Zona intermareal a 7 m de profundidad en lagunas y bahías (De León-González y Solís-Weiss, 2000); entre manglar, algas, esponjas, coral; lodo, arena, rocas, conchilla; en la columna de agua o como esclerobionte (Bastida-Zavala, 1993; De León-González y Solís-Weiss, 2000). Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Ensenada del sur de California (Hernández-Alcántara et al., 2003), golfo de California (Perkins, 1980; De León-González y Solís-Weiss, 2000) y Pacífico tropical mexicano (Salazar-Vallejo et al., 1990).
Variaciones. LT = 9-33 mm (n = 14, µ = 20.8 ± 7.1), L15 = 2-9 mm (n = 61, µ = 4.8 ± 1.2), A15 = 0.3-1.8 mm (n = 61, µ = 1.1 ± 0.3), segmentos 42-75 (n = 14, µ = 65 ± 9). Cirro tentacular más largo se extiende hasta el setígero 9-18 (n = 36, µ = 13 ± 2). Dientes mandibulares 6-8 dientes (n = 27, µ = 7 ± 1). Paragnatos: AI = 0 (n = 52, µ = 0 ± 0); AII = 4-16 (n = 52, µ = 11 ± 2); AIII = 4-10 (n = 52, µ = 7 ± 1) y AIV = 7-19 (n = 52, µ = 13 ± 2).
Comentarios. Cinco especies de Ceratonereis son reconocidas para las provincias marinas que rodean las costas de México; de ellas, cuatro están presentes en las provincias del Pacífico mexicano (De León-González, 2009). Del total en México, solamente tres presentan lígulas notopodales dorsales en todo el cuerpo: Ceratonereies mirabilis, C. singularis y C. tentaculata (Perkins, 1980). Ceratonereis singularis se diferencia de C. mirabilis y C. tentaculata por la dentición distal en los falcígeros (unidentados en la primera, bidentados en el resto).
Ceratonereis singularis fue descrita para la isla San José (golfo de California). Perkins (1980) revisó el holotipo y otros ejemplares del Pacífico oriental y Atlántico occidental. Señaló que son la misma especie, aunque notó algunas diferencias. El material del Pacífico presentó ojos subiguales, cirros dorsales relativamente cortos en segmentos anteriores y lígulas neuropodales que alcanzan el extremo del lóbulo presetal; por el contrario, el material del Atlántico presentó ojos anteriores más grandes, cirros dorsales más largos en segmentos anteriores y lígulas neuropodales que alcanzan la mitad del lóbulo presetal. Los ejemplares de este estudio concuerdan con el material del Pacífico.
Género Nereis Linnaeus, 1758
Nereis cf. falsa De Quatrefages, 1866
(Figuras 2g, 3i)
Nereis falsa (non De Quatrefages) De León-González y Solís-Weiss 2000: 558.
Material examinado. 119 individuos (45 completos): Est. 1 (29), Est. 2 (14), Est. 3 (21), Est. 4 (19), Est. 5 (36).
Caracterización. Prostomio entero anteriormente. Cirro tentacular más posterior se extiende hasta el setígero 4. Mandíbulas con ocho dientes. Paragnatos cónicos, excepto en AVII-VIII como conos y barras-P. AI = 1; AII = 16, dos o tres hileras; AIII = 21, forman un óvalo; AIV = 26, en forma de circulo; AV = 0; AVI = 4, forman una cruz; AVII-VIII = 34, dos bandas con conos y barras-P. Parápodos con lígula notopodal dorsal redondeada en setígeros anteriores, triangular en setígeros medios y posteriores; lígula notopodal ventral redondeada en setígeros anteriores y medios, triangular en posteriores. Cirro dorsal cirriforme ubicado en el margen medio de la lígula dorsal; cortos en setígeros anteriores, más largos en setígeros posteriores. Sin lóbulos notopodales presetal y postsetal. Lígula neuropodal redondeada en setígeros anteriores, subulada en medios y posteriores. Lóbulo postsetal triangular en setígeros anteriores, redondeado en posteriores. Notosetas: falcígeros homogonfos y espinígeros homogonfos; falcígeros desde el setígero 26, apéndice largo, aserrado, con una protuberancia distal y un diente recurvado (Figura 3i). Neurosetas: fascículo dorsal con espinígeros homogonfos y falcígeros heterogonfos; fascículo ventral con espinígeros y falcígeros heterogonfos, falcígeros sin protuberancia, con un diente anquilosado. Notoacículas ausentes en los setígeros 1 y 2. Cirros anales cirriformes, largos.
Hábitat. Lodo arenoso (De León-González y Solís-Weiss, 2000). Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto 3.0-6.7 mg/L.
Distribución. Golfo de California (De León-González y Solís-Weiss, 2000).
Variaciones. LT = 9-36 mm (n = 18, µ = 19.6 ± 7.7), L15 = 2.5-2.8 mm (n = 45, µ = 5.3 ± 1.4), A15 = 0.5-1.8 mm (n = 45, µ = 1.0±0.3), segmentos 52-73 (n = 18, µ = 64 ± 6). Cirro tentacular más largo se extiende hasta el setígero 2-5 (n = 41, µ = 4 ± 1). Dientes mandibulares 7-11 dientes (n = 43, µ = 8 ± 1). Paragnatos: AI = 0-1 (n = 43, µ = 1 ± 0); AII = 10-27 (n = 45, µ = 16 ± 4); AIII = 10-32 (n = 45, µ = 21 ± 5); AIV = 14-44 (n = 45, µ = 25 ± 6); AV = 0 (n = 45, µ = 0 ± 0); AVI = 2-7 (n = 45, µ = 4 ± 1); AVII-VIII = 20-47 (n = 44, µ = 34 ± 7). Falcígero homogonfo desde el setígero 19-36 (n = 43, µ = 26 ± 4).
Comentarios. Veintiocho especies de Nereis son reconocidas para las provincias marinas que rodean las costas de México (De León-González, 2009); de ellas, 24 están presentes en las provincias del Pacífico mexicano. Del total en México, cuatro presentan dos o más hileras de paragnatos en el AVII-VIII, lígula dorsal no expandida en parápodos posteriores y falcígero homogonfo notopodal largo multidentado: Nereis callaona (Grube y Krøyer en Grube), N. costaricaensis Dean, N. falsa De Quatrefages y N. occidentalis Hartman. De ellas, solo N. falsa es la especie más cercana a los ejemplares de este estudio.
Nereis falsa fue descrita para el mar Negro; sin embargo, Fauvel (1941) y Day (1967) sugirieron la presencia en ambas costas de América. De León-González y Solís-Weiss (2000) registraron a N. falsa en el Pacífico mexicano, considerándola una especie de amplia distribución en aguas templadas y tropicales.
Los ejemplares de este estudio denominados aquí como N. cf. falsa, son distintos a N. falsa próxima a la localidad tipo (e. g. Grube, 1840; De Quatrefages, 1866; Claparède, 1868, 1870; Fauvel, 1923) por el número de paragnatos en AI, aserraciones de los falcígeros, extensión del cirro tentacular más largo, y tamaño corporal de los ejemplares. Nereis falsa presenta dos paragnatos en AI (raramente 0 o 3, nunca 1), falcígeros homogonfos con aserraciones cortas, falcígeros heterogonfos con aserraciones de tamaño moderado, cirro tentacular más largo se extiende hasta los segmentos 4-8, y cuerpo con longitudes menores de 60 mm; mientras que en N. cf. falsa, AI presenta un paragnato (raramente 0), falcígeros homogonfos con aserraciones de tamaño moderado, falcígeros heterogonfos con aserraciones largas, cirro tentacular más largo se extiende hasta los segmentos 2-5, y cuerpo con longitudes menores a 35 mm (Figura 2g). Es indispensable la revisión del material tipo o topotípico que delimite su morfología.
Género Perinereis Kinberg, 1865
Perinereis elenacasoae Rioja, 1947
Perinereis elenacasoi Rioja, 1947: 531-531, figs. 8-17. Localidad tipo: Mazatlán, Sinaloa.
Perinereis elenacasoae De León-González y Solís-Weiss 1998: 680-681, figs. 4a-e, 5a-d.
Material examinado. Siete individuos (cuatro completos): Est. 1 (1), Est. 2 (2), Est. 3 (1), Est. 4 (2), Est. 5 (1).
Material adicional examinado. Tres individuos (uno completo): EMU-4469 (1), EMU-5115 (1), EMU-5121 (1).
Caracterización. Prostomio pentagonal. Cirro tentacular más posterior se extienden hasta el setígero 2-3. Mandíbulas con ocho dientes. Paragnatos cónicos, excepto en AVI como barras lisas. AI = 8, en arreglo subtriangular; AII = 16, en arreglo subtriangular; AIII = 17, grupo oval; AIV = 22, en arreglo curvo; AV = 1; AVI = 1, barra lisa; AVII-VIII = 29, en dos o tres bandas. Parápodos anteriores con lígulas y lóbulos distalmente redondeados. Parápodos medios con lígulas y lóbulos cónicos. Parápodos posteriores con lígula notopodal dorsal alargada, lígula notopodal ventral y lóbulo neuropodal postsetal cónicos, lígula neuropodal ventral digitiforme. Notosetas: espinígeros homogonfos. Neurosetas divididas en fascículos dorsal y ventral. Fascículo dorsal: espinígeros homogonfos y falcígeros heterogonfos. Fascículo ventral: falcígeros heterogonfos y espinígeros heterogonfos. Pigidio con cirros anales cortos.
Hábitat. Entre mitílidos (Rioja, 1947); rizoides de algas, sustratos rocosos y coralinos (De León-González y Solís-Weiss, 1998). Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Ensenada del sur de California (De León-González y Solís-Weiss, 1998), golfo de California (Rioja, 1947; De León-González y Solís-Weiss, 1998), Pacífico tropical mexicano (Berkeley y Berkeley, 1960), golfo de México sur y Caribe suroccidental (De León-González y Solís-Weiss, 1998).
Variaciones. LT = 13.5-49 mm (n = 5, µ = 27.5 ± 13.7), L15 = 3.5-11 mm (n = 7, µ = 6.1 ± 2.6), A15 = 0.7-2.5 mm (n = 7, µ = 1.4 ± 0.6), segmentos 57-78 (n = 5, µ = 69 ± 8). Dientes mandibulares 6-9 (n = 3, µ = 8 ± 2). AI = 6-13 (n = 7, µ = 8 ± 3); AII = 13-20 (n = 7, µ = 16 ± 2); AIII = 11-24 (n = 7, µ = 17 ± 4); AIV = 16-28 (n = 7, µ = 22 ± 5); AV = 0-2 (n = 7, µ = 1 ± 1); AVI = 1 (n = 7, µ = 1 ± 0); AVII-VIII = 18-41 (n = 7, µ = 29 ± 8).
Comentarios. Doce especies de Perinereis son reconocidas para las provincias marinas que rodean las costas de México; de ellas, seis están presentes en las provincias del Pacífico mexicano. Del total en México, cinco presentan la lígula dorsal expandida en parápodos posteriores y AVI con una barra transversa: Perinereis anderssoni Kinberg, P. bajacaliforniana De León-González y Solís-Weiss, P. elenacasoae Rioja, P. obfuscata Grube y P. villalobosi Rioja.
Perinereis elenacasoae es diferente de todas, excepto P. bajacalifornica, por la presencia de barras transversas largas en AVI. Esta última especie luce un arreglo y número de paragnatos en AI y AVII-VIII distinto al de P. elenacasoae. En P. bajacaliforniana, AI y AVII-VIII tienen siete paragnatos, arreglados en forma triangular y en una línea, respectivamente; mientras que en P. elenacasoae, AI presenta 6-13 paragnatos en grupo subtriangular y AVII-VIII con 18-41 paragnatos dispuestos en dos o tres líneas.
Perinereis villalobosi Rioja, 1947
(Figura 2h)
Perinereis villalobosi Rioja, 1947: 532-534, figs. 18-22; De León-González y Solís-Weiss 1998: 690-691, fig. 10a-e. Localidad tipo: Mazatlán, Sinaloa.
Material examinado. Cuatro individuos (tres completos): Est. 1 (3), Est. 2 (1).
Caracterización. Prostomio tan largo como ancho. Cirro tentacular más posterior se extiende hasta el setígero 4-5. Mandíbulas con ocho dientes. Paragnatos cónicos, excepto en AVI como barras escudiformes (Figura 2h). AI = 1; AII = 22; AIII = 46, en cinco hileras; AIV = 46, en arreglo curvo; AV = 1; AVI = 1, barra escudiforme; AVII-VIII = 43, en dos hileras. Parápodos anteriores con lígulas y lóbulos distalmente redondeados. Parápodos medios y posteriores con lígula notopodal dorsal extendida y lígula notopodal ventral cónica; lóbulo neuropodal postsetal mamiliforme, lígula neuropodal ventral en forma de cabeza. Notosetas: espinígeros homogonfos. Neurosetas divididas en fascículos dorsal y ventral. Fascículo dorsal: espinígeros homogonfos y falcígeros heterogonfos. Fascículo ventral: falcígeros heterogonfos y espinígeros heterogonfos. Pigidio con cirros anales cortos.
Hábitat. Entre mitílidos y sustratos rocosos (Rioja, 1947; De León-González y Solís-Weiss, 1998). Esclerobionte en boyas entre temperaturas de 22.2-31.5 °C, salinidades de 32.7-34.4 y oxígeno disuelto de 3.4-5.8 mg/L.
Distribución. Ensenada del sur de California (De León-González y Solís-Weiss, 1998) y golfo de California (Rioja, 1947; De León-González y Solís-Weiss, 1998).
Variaciones. LT = 19-63 mm (n = 3, µ = 36 ± 23.6), L15 = 4-10 mm (n = 4, µ = 5.9 ± 2.8), A15 = 0.9-2.5 mm (n = 4, µ = 1.4 ± 0.7), segmentos 90-110 (n = 3, µ = 99 ± 10). Dientes mandibulares 7-9 (n = 2, µ = 8 ± 1). Paragnatos: AI = 1 (n = 4, µ = 1 ± 0); AII = 16-26 (n = 4, µ = 21 ± 4); AIII = 37-57 (n = 4, µ = 46 ± 10); AIV = 39-54 (n = 4, µ = 46 ± 6); AV = 1-2 (n = 4, µ = 1 ± 1); AVI = 1 (n = 4, µ = 1 ± 0); AVII-VIII = 41-45 (n = 4, µ = 43 ± 2).
Comentarios. De las 12 especies de Perinereis registradas en las provincias mexicanas, solamente cinco presentan la lígula dorsal expandida en parápodos posteriores y AVI con una barra transversa: Perinereis anderssoni Kinberg, P. bajacaliforniana de León-González y Solís-Weiss, P. elenacasoae Rioja, P. obfuscata Grube y P. villalobosi Rioja. Perinereis anderssoni, P. obfuscata y P. villalobosi son las únicas con barras transversas cortas en AVI; sin embargo, P. villalobosi es la única con un paragnato en AI (P. anderssoni con cuatro y P. obfuscata con 8-15). Los ejemplares de este estudio coinciden con la caracterización de P. villalobosi disponible para el golfo de California (De León-González y Solís-Weiss, 1998).
Género Platynereis Kinberg, 1865
Platynereis cf. dumerilii (Audouin y Milne-Edwards, 1834)
(Figura 3j, k)
Material examinado. 25 individuos (siete completos): Est. 1 (6), Est. 2 (5), Est. 3 (2), Est. 4 (6), Est. 5 (6).
Material adicional examinado. Dos individuos (uno completo): MT-021 (1), MT-022 (1).
Caracterización. Prostomio subpentagonal. Cirro tentacular más posterior se extiende hasta el setígero 6. Mandíbulas con siete dientes. Paragnatos pectinas; ausentes en las áreas I, II, y V. AIII = 6, forman una o tres hileras; AIV = 6, en arreglo creciente; AVI = 1-2; AVII-VIII = 6, una a dos hileras irregulares, una atrás de otra. Parápodos con lígulas distalmente digitiformes en setígeros 1-4, redondeadas en setígeros 5-9; setígero 10 con lígula notopodal dorsal distalmente digitiforme, lígula notopodal ventral redondeada y lígula neuropodal triangular (Figura 3k). Lígulas distalmente subuladas en el resto de los setígeros, las notopodales dorsales ligeramente expandidas en posteriores. Setígeros 1-9 sin lóbulo notopodal presetal; lóbulo neuropodal postsetal alargado, desaparece en los setígeros 5-9. Lóbulo neuropodal postsetal subulado en el resto de los setígeros. Cirro dorsal cirriforme, ubicado en el margen medio de la lígula dorsal. Notosetas: falcígeros homogonfos y espinígeros homogonfos; falcígeros desde el setígero 10, hasta cuatro por notópodo, apéndice corto con reborde distal, un diente incurvado con lámina, ligamento grueso con forma de S (Figura 3j). Neurosetas: fascículo dorsal con espinígeros homogonfos y falcígeros heterogonfos; espinígeros heterogonfos presentes en setígeros 1-4; fascículo ventral con espinígeros y falcígeros heterogonfos; falcígeros desde el setígero 5. Notoacículas ausentes en los setígeros 1 y 2.
Hábitat. Esclerobionte en boyas entre temperaturas de 20.3-31.8, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 6-28.5 mm (n = 8, µ = 14.9 ± 7.2), L15 = 2-7.5 mm (n = 27, µ = 4.7 ± 1.3), A15 = 0.5-2.3 mm (n = 27, µ = 1.0 ± 0.4), Seg = 41-72 (n = 8, µ = 59 ± 11). Cirro tentacular más largo se extiende hasta el setígero 4-9 (n = 21, µ = 6 ± 2). Dientes mandibulares 6-9 (n = 27, µ = 7 ± 1). Paragnatos: AIII = 0-16 (n = 27, µ = 2 ± 5); AIV = 3-11 (n = 27, µ = 6 ± 2); AVI = 1-2 (n = 27, µ = 1 ± 1); AVI = 1-2 (n = 27, µ = 2 ± 1), AVII-VIII = 3-12 (n = 26, µ = 6 ± 1). Falcígeros homogonfos desde el setígero 7-13 (n = 27, µ = 10 ± 1).
Comentarios. Cinco especies de Platynereis son reconocidas para las provincias marinas que rodean las costas de México; de las cuales, tres están presentes en el Pacífico mexicano (De León-González, 2009). Del total en México, tres presentan falcígeros compuestos y carecen de espinígeros sesquigonfos ribeteados: Platynereis dumerilii (Audouin y Milne-Edwards), P. hutchingsae De León-González et al. y P. mucronata De León-González et al. Platynereis dumerilii es diferente de las otras dos especies por el arreglo de los paragnatos en las áreas III, VI y VII-VIII, así como por la presencia del falcígero homogonfo y del diente incurvado del falcígero heterogonfo (De León-González, 2009).
Platynereis dumerilii fue descrita para el mar Mediterráneo, pero ha sido registrada para varias localidades de los océanos Atlántico, Índico y Pacífico, a profundidades que van desde fondos someros hasta 4000 m; por tanto, ha sido considerada especie de amplia distribución en aguas templadas y tropicales (Salazar-Vallejo y Jiménez-Cueto, 1997).
Los ejemplares de este estudio, P. cf. dumerilii son distintos a P. dumerilii s. s. del mar Mediterráneo (e. g. Audouin y Milne-Edwards, 1834; Grube, 1840; Claparède, 1870; Fauvel, 1923) en el tamaño, forma, número y distribución del falcígero homogonfo, extensión del cirro tentacular más largo, incidencia de protuberancia distal en falcígeros heterogonfos, y número de dientes en las mandíbulas. Platynereis dumerilii presenta un falcígero homogonfo (raramente dos) a partir del setígero 20, generalmente ausentes en setígeros posteriores, apéndice largo, mucronado, no inserto profundamente en el manubrio, diente incurvado nunca alcanza el manubrio, ligamento corto; cirro tentacular más largo se extiende hasta los segmentos 10-18; sin protuberancia distal en el ápice de los falcígeros heterogonfos; y entre 5-20 dientes mandibulares. Mientras que nuestros ejemplares presentan hasta cuatro falcígeros homogonfos a partir de los setígeros 7-13, generalmente presentes en setígeros posteriores, con apéndice corto, no mucronado, inserto profundamente en el manubrio (mitad del apéndice), diente incurvado alcanza el ras del manubrio, ligamento largo en forma de S; cirro tentacular más largo se extiende hasta los segmentos 4-9; protuberancia distal de los falcígeros heterogonfos presente; y entre 6-9 dientes mandibulares.
Hartman (1959, 1965) sinonimizó 20 taxones con diferente distribución bajo el nombre P. dumerilii. No obstante, hasta el momento no existen indicios de que la especie haya sido transportada por actividades antropogénicas para sugerir una amplia distribución (Read, 2007). Es indispensable la revisión del material tipo o topotípico de P. dumerilii que delimite consistentemente su morfología y la reevaluación cuidadosa de las sinonimias.
Género Pseudonereis Kinberg, 1865
Pseudonereis deleoni Villalobos-Guerrero y Tovar-Hernández, 2013
Pseudonereis deleoni Villalobos-Guerrero y Tovar-Hernández, 2013: 776-778, fig. 2, 3. Localidad tipo: Mazatlán, Sinaloa.
Material examinado. Holotipo: EMU-9604 (Mazatlán, Sinaloa, México, en boyas metálicas, Est. 5, 28-X-2009, col. M. A. Tovar y F. Vázquez, 29.4 °C, 33.1, 6.6 mg/L) (LT = 18 mm, L15 = 5 mm, A15 = 1.1 mm, 65 segmentos). Cuatro paratipos: EMU-9607 (Est. 4, 27-IV-2009, col. F. Vázquez y SLR, 20.8 °C, 34, 5.5 mg/L), EMU-9605 (macho epitoco, Est. 4, 29-VII-2009, col. T. F. Villalobos y M. Ramírez, 30.8 °C, 34 ups, 4.4 mg/L), EMU-9606 (Est. 4, 24-VI-2009, col. B. Yáñez y F. Vázquez, 28.5 °C, 34.5, 5.1 mg/L), EMU-9608 (Est. 2, 27-V-2009, col. B. Yáñez y F. Vázquez, 28.6 °C, 35.2, 3.1 mg/L) (LT = 19-46 mm, L15 = 6-10 mm, A15 = 1.2-2.1 mm, 70-87 segmentos).
Diagnosis. Para una descripción detallada con fotografías consultar Villalobos-Guerrero y Tovar-Hernández (2013).
Hábitat. Esclerobionte en boyas (Villalobos-Guerrero y Tovar-Hernández, 2013).
Distribución. Golfo de California y Pacífico tropical mexicano (Villalobos-Guerrero y Tovar-Hernández, 2013).
Comentarios. Villalobos-Guerrero y Tovar-Hernández (2013) describieron recientemente a Pseudonereis deleoni con material esclerobionte del puerto de Mazatlán, Sinaloa. Los autores indicaron que es una especie similar a P. variegata Grube y Krøyer, pero pueden diferenciarse por el número de paragnatos en las áreas II-IV, el setígero inicial del espinígero heterogonfo, la longitud del cirro dorsal en setígeros medio anteriores, la posición del cirro dorsal en la lígula notopodal dorsal, y el número de dientes en las mandíbulas. Asimismo, señalaron que los registros de P. gallapagensis Kinberg y P. variegata para el Pacífico mexicano posiblemente correspondan a P. deleoni, sugiriendo la posible ausencia de ambas especies en la región.
Familia Phyllodocidae Ørsted, 1843
Género Eulalia Savigny, 1822
Eulalia gracilior (Chamberlin, 1919)
Steggoa gracilior Chamberlin, 1919: 5-6.
Eulalia gracilior Pleijel, Aguado y Rouse 2012: 7-9, figs. 5, 6 (syn.). Localidad tipo: Laguna Beach, California.
Material examinado. Dos individuos completos: Est. 3 (1), Est. 4 (1).
Material adicional examinado. Ocho individuos (tres completos): EMU-4480 (1); MT-001 (1), MT-007 (2), MT-008 (1), MT-012 (1), MT-016 (1).
Caracterización. Para una descripción detallada de la especie consultar Pleijel et al. (2012).
Hábitat. Entre filoides del sargazo Macrocystis pyrifera, esclerobionte en pilotes de muelles (Pleijel et al., 2012) y en boyas en temperaturas de 21.9, salinidad de 34.1 y oxígeno disuelto de 4.3-6.4 mg/L (este estudio).
Distribución. Ensenada del sur de California (Pleijel et al., 2012), golfo de California (este estudio) y Pacífico tropical mexicano (Villalobos-Guerrero, obs. pers.).
Variaciones. LT = 8-16 (n = 5, µ = 11.30 ± 3.31), A10 = 0.4-0.9 mm (n = 8, µ = 0.55 ± 0.18), segmentos 69-103 (n = 5, µ = 84 ± 15).
Comentarios. Trece especies de Eulalia Savigny son reconocidas para las provincias marinas que rodean las costas de México: Eulalia bilineata Johnston, E. californiensis (Hartman), E. gracilior (Chamberlin), E. hutchingsonensis (Perkins), E. lapsus Pleijel, E. levicornuta Moore, E. longicornuta Moore, E. mexicana Fauchald, E. myriacycla (Schmarda), E. personata Gravier, E. peruana (Hartmann-Schröder), E. quadrioculata Moore y E. uschakovi Kudenov; todas, salvo E. hutchingsonensis, han sido registradas en el Pacífico mexicano.
Eulalia gracilior es reconocible fácilmente de las especies anteriores por la presencia de tres líneas longitudinales negras o pardo oscuras en el dorso. Méndez (2006) registra a E. gracilior para profundidades mayores a mil metros en el golfo de California; no obstante, estos registros son dudosos ya que todas las especies del género conocidas son de ambientes someros (Pleijel et al., 2012). En este trabajo registramos por primera ocasión la especie para las aguas someras del Pacífico oriental tropical.
Género Pterocirrus Claparède, 1868
Pterocirrus burtoni Pleijel, Aguado y Rouse, 2012
Pterocirrus burtoni Pleijel, Aguado y Rouse, 2012: 12-14, figs. 9, 10. Localidad tipo: La Jolla, California.
Material examinado. 21 individuos (cinco completos): Est. 1 (1), Est. 2 (1), Est. 4 (5), Est. 5 (14).
Caracterización. Para una descripción detallada de la especie consultar Pleijel et al. (2012).
Hábitat. Entre filoides del sargazo Macrocystis pyrifera, esclerobionte en pilotes de muelles (Pleijel et al., 2012) y en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Ensenada del sur de California (Pleijel et al., 2012) y golfo de California.
Variaciones. LT = 7-13 mm (n = 5, µ = 9.80 ± 2.17), A10 = 0.5-1.3 (n = 21, µ = 0.9 ± 0.2), segmentos 50-74 (n = 5, µ = 63 ± 10).
Comentarios. Siete especies de Pterocirrus son válidas en el mundo: Pterocirrus burtoni Pleijel et al., P. foliosus (Treadwell), P. hunteri Benham, P. macroceros (Grube), P. montereyensis (Hartman), P. nidarosiensis Pleijel, P. remus Böggemann y P. slastnikovi Annenkova. En este trabajo se registra por primera ocasión el género para el Pacífico oriental tropical y se extiende su distribución en la ecorregión golfo de California.
Género Nereiphylla de Blainville, 1828
Nereiphylla sp. A
(Figura 3l-n)
Material examinado. Un individuo completo: Est. 3 (1).
Material adicional examinado. Siete individuos (cinco completos): MT-022 (6), MT-024 (1).
Caracterización. Prostomio circular, con escotadura posterior. Sin papila nucal. Dos ojos subcirculares. Dos pares de antenas frontales voluminosas, distalmente aguzadas; par superior tan largo como el prostomio, alcanza el segmento 2, el inferior tan largo como la mitad del prostomio. Fórmula tentacular: (01/0+S1/1)+S1/V). Segmentos 1-2 fusionados dorsalmente; segmento 1 reducido. Cirros tentaculares más largos que anchos y ligeramente aplanados (con forma de espátula), aguzados distalmente; cirróforo corto. Cirros tentaculares dorsales de los segmentos 1 y 3 similares, se extienden al segmento 4 y 7, respectivamente; cirro tentacular del segmento 2 ligeramente más largo, ancho y dorsal que el resto, se extiende al segmento 7; el ventral similar al par de antenas superior, se extiende al segmento 4. Setas desde el segmento 2. Parápodos con lóbulos desde el segmento 3. Neurópodo redondeado. Acículas amarillas. Cirro dorsal cordiforme, oblongo, voluminoso, simétrico en segmentos anteriores (Figura 3l), cordiforme, corto y asimétrico en medios (Figura 3m), y lanceolado, largo y simétrico en posteriores (Figura 3n); cirróforo ancho, proyectándose ligeramente. Cirro ventral suboval, tan largo como el neurópodo en segmentos posteriores. Neurópodo con 10-12 espinígeros. Cirros anales similares a las antenas. Papila pigidial media ausente.
Hábitat. Esclerobionte en pilotes de muelles y boyas en temperaturas de 22.2, salinidad de 34.1, y oxígeno disuelto de 6.4 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 8-15 mm (n = 6, µ = 10.7 ± 2.7), A10 = 0.5-1.0 mm (n = 8, µ = 0.8 ± 0.2), segmentos 76-101 segmentos (n = 6; µ = 89 ± 9).
Comentarios. Doce especies de Nereiphylla son válidas en el mundo (Pleijel, 1991); de ellas, solo dos están presentes en las provincias del Pacífico mexicano. Del total mundial, solo cinco presentan la fórmula tentacular (01/0+S1/1)+S1/V y el cirro tentacular dorsal del segmento 2 corto (extendiéndose hasta el segmento 9): Nereiphylla crassa Imajima, N. fragilis (Webster), N. hera Kato y Mawatari, N. mimica Eibye-Jacobsen y N. paretti de Blainville. Las diferencias entre los ejemplares de este estudio y dichas especies se concentran en la forma del cirro dorsal en segmentos medios. Nereiphylla sp. A es la única especie con cirro dorsal reducido, cordiforme y tan largo como ancho en segmentos medios. Así mismo, N. hera y Nereiphylla sp. A son las únicas con cirros tentaculares espatuliformes distalmente afilados; sin embargo, las proporciones de los cirros dorsales y cirróforos, y la incidencia de la papila pigidial distinguen a ambas especies.
Nereiphylla castanea fue descrita para Eno-shima, Japón, pero ha sido registrada en aguas tropicales y templadas del mundo. En América tropical se ha documentado desde California hasta Panamá (e. g. Moore, 1909; Monro, 1933; Rioja, 1941; Hernández-Alcántara y Solís-Weiss, 1999). Blake y Ruff (2007) señalaron que N. castanea pertenece a un complejo de especies. Imajima (2003) caracterizó a N. castanea con material cercano a la localidad tipo. Nereiphylla sp. A es diferente de N. castanea por la extensión del cirro tentacular, las proporciones del cirro dorsal en segmentos medios y la incidencia de la papila pigidial. Es posible que pertenezca a una especie no descrita.
Género Phyllodoce Savigny in Lamarck, 1818
Subgénero Phyllodoce (Anaitides) Czerniavsky, 1882
Phyllodoce (Anaitides) cf. medipapillata Moore, 1909
(Figuras 2f, 3o-r)
Phyllodoce medipapillata Moore, 1909: 237, lám. 7, figs. 3-4; Mountford 1991: 166, fig. 3D (partim).
Phyllodoce (Anaitides) medipapillata McCammon y Montagne 1979: 362, fig. 5a-c (partim).
Material examinado. 28 individuos (23 completos): Est. 1 (2), Est. 2 (9), Est. 3 (5), Est. 4 (6), Est. 5 (6).
Caracterización. Prostomio circular, con escotadura posterior. Papila nucal pequeña, piriforme. Dos ojos ovalados. Dos pares de antenas frontales cortas, cirriformes. Sección proximal de la faringe con dos grupos de seis hileras por costado, con 11 papilas redondeadas; hilera media dorsal generalmente sin papilas, pero raramente con 1-5 papilas. Sección distal de la faringe con seis hileras longitudinales de lóbulos pequeños; abertura oral con 17 papilas cónicas. Órganos nucales piriformes. Fórmula tentacular: (01/0+01/1)+01/V). Segmentos 1-2 fusionados dorsalmente; segmento 1 reducido. Cirros tentaculares cirriformes; cirróforo corto. Cirros tentaculares dorsales de los segmentos 1 y 3 largos, similares, se extienden al segmento 8; cirro tentacular del segmento 2 más largo, se extiende al segmento 11. Setas desde el segmento 4. Parápodos con lóbulos desde el segmento 4. Neurópodo corto; lóbulo presetal tan largo como el cirro ventral, distalmente dividido en lóbulo inferior y superior. Acículas amarillas. Cirro dorsal foliáceo, grande, redondeado, simétrico; oblongo en segmentos anteriores y medios (Figuras 3o-q), anchos en posteriores (Figura 3r); cirróforo prolongado. Cirro ventral foliáceo, más largo que el neurópodo en segmentos anteriores, tan largo como el neurópodo en medios y posteriores. Neurópodo con 15 o más espinígeros en segmentos medios. Cirros anales largos, clavados. Coloración in vivo: cuerpo verde olivo oscuro (Figura 2f).
Hábitat. Esclerobionte en boyas entre temperaturas de 20.3-31.8 °C, salinidades de 32.1-35.2 y oxígeno disuelto de 3.0-6.7 mg/L.
Distribución. Golfo de California.
Variaciones. LT = 11-94 mm (n = 23, µ = 52.9 ± 23.5), A10 = 0.5-2.8 mm (n = 28, µ = 1.6 ± 0.6), segmentos 80-236 (n = 22, µ = 160 ± 42).
Comentarios. Dieciséis especies de Phyllodoce (Anaitides) son reconocidas para las provincias marinas que rodean las costas de México; de ellas, 14 están presentes en el Pacífico mexicano (este estudio). Del total en México, solo tres presentan la fórmula tentacular: (01/0+01/1)+01/V y 13 hileras de papilas proximales en la faringe (seis por costado y una media): Phyllodoce (A.) cortezi Kudenov, P. (A.) madeirensis Langerhans y P. (A.) medipapillata Moore. El número de papilas medias en la región proximal de la faringe es muy variable y no es un carácter útil para separar entre las especies. Phyllodoce (A.) cortezi es diferente de las otras dos especies por presentar cirros dorsales anteriores subcuadrangulares [foliáceos en P. (A.) madeirensis y P. (A.) medipapillata].
McCammon y Montagne (1979) señalaron que la ausencia de órganos nucales en el prostomio de P. (A.) madeirensis es la diferencia con P. (A.) medipapillata. Mountford (1991) redescribió P. (A.) madeirensis con material procedente de varias regiones del mundo, incluyendo de la localidad tipo, y la consideró cosmopolita; rechazó la ausencia de órganos nucales en la especie y concluyó que la forma y pigmentación de los parápodos son muy similares en ambas especies. Sin embargo, sus esquemas revelan diferencias morfológicas notorias en los parápodos de P. (A.) medipapillata y P. (A.) madeirensis. Es indispensable la re-examinación de material tipo y topotípico de P. (A.) madeirensis, así como la redescripción de la especie sin mezclar ejemplares de diferentes regiones.
La coloración es diagnóstica para separar entre especies cercanas de Phyllodoce (Mountford, 1991). En P. (A.) medipapillata, la coloración post-fijación es pardusca en juveniles y morado-pardo en adultos (Moore, 1909; McCammon y Montagne, 1979; Mountford, 1991); mientras que la coloración in vivo en adultos es parda o pardusca-rosada, los oocitos son azul brillante y le confieren un tono turquesa al cuerpo (Leslie Harris. Natural History Museum of Los Angeles County. California, EUA. 2011. Com. Pers.). Los ejemplares de este estudio son similares a P. (A.) medipapillata (Moore, 1909; McCammon y Montagne, 1979; Mountford, 1991); no obstante, dichos ejemplares son verde olivo o amarillo oscuro, las hembras grávidas presentan la misma coloración y los oocitos son amarillo pálido. Es posible que se trate de una especie no descrita, aunque se mantienen como Phyllodoce (A.) cf. medipapillata hasta que se efectúe una redescripción detallada de la especie que incluya material tipo, en vivo y preservado.
DISCUSIÓN
Este es el primer trabajo en México destinado al conocimiento de la biodiversdad de los poliquetos errantes esclerobiontes. Durante los muestreos realizados en el puerto de Mazatlán, se identificaron 22 especies distribuidas en 17 géneros y seis familias de poliquetos eunicemorfos y filodocemorfos.
El golfo de California es la ecorregión del Pacífico mexicano donde se han efectuado mayores esfuerzos para conocer la riqueza poliquetofaunística (Hernández-Alcántara et al., 2008). En total, existen 720 especies de poliquetos en la ecorregión (Brusca y Hendrickx, 2010); sin embargo, esta contribución adiciona un nuevo registro de género y nueve nuevos registros de especies para la ecorregión.
Por su parte, Sinaloa es uno de los estados del Pacífico mexicano mejor estudiados en términos de composición faunística de poliquetos (Fernández-Álamo, 2002). En total, existen 395 especies de poliquetos en Sinaloa (Hendrickx y Brusca, 2002), no obstante es necesario recopilar y actualizar el número de especies de poliquetos conocidas para el estado, incluyendo una evaluación de su distribución biogeográfica pues muchos de los nombres son cuestionables para la región (Villalobos-Guerrero obs. pers.). En este estudio se adicionan dos nuevos registros de género y trece nuevos registros de especies. La tendencia de registrar especies desconocidas sigue en aumento desde el primer registro hace aproximadamente 90 años (Chamberlin, 1919) hasta la actualidad. En síntesis, Sinaloa presenta aproximadamente la mitad de las especies registradas en el Pacífico mexicano (45%) (Hernández-Alcántara et al., 2008: 1100 especies) y casi tres cuartas partes de la poliquetofauna registrada en el golfo de California (65%) (Brusca y Hendrickx, 2010: 720 especies).
El número alto de especies consideradas como nuevos registros para la ecorregión en este estudio es debido al ambiente artificial que no había sido explorado anteriormente y a la identificación minuciosa. El primer estudio destinado a conocer la diversidad de poliquetos de sustratos artificiales en el golfo de California registró cinco géneros de poliquetos, representados por seis especies de serpúlidos y tres de sabélidos (Tovar-Hernández et al., 2009b); de ellas, cuatro son comunes en la ecorregión, dos constituyeron nuevos registros para México, y el resto se consideraron especies exóticas (Branchiomma bairdi, Ficopomatus miamiensis e Hydroides elegans). Sumando el número de especies de poliquetos esclerobiontes documentados, 35 especies han sido reconocidas en el golfo de California (Tovar-Hernández et al. 2009a, 2009b; Villalobos-Guerrero, 2012; Villalobos-Guerrero y Tovar-Hernández, 2013). Aunque es probable que la poliquetofauna esclerobionte en el puerto de Mazatlán esté representada por al menos 60 especies (Villalobos-Guerrero y Tovar-Hernández, obs. pers.), uno de los números más altos para cualquier comunidad esclerobionte en el mundo (e. g. Farrapeira et al., 2011: 45 especies; Pequegnat y Pequegnat, 1968: 37 especies; Godwin et al., 2004: 25 especies).
AGRADECIMIENTOS
Apreciamos la ayuda de la bibliotecaria Clara Ramírez Jáuregui (Instituto de Ciencias del Mar y Limnología, Universidad Autónoma de México) para adquirir literatura de difícil acceso y las facilidades concebidas por Nuria Méndez (Instituto de Ciencias del Mar y Limnología, Mazatlán, Universidad Autónoma de México) para el procesamiento de la biota. El apoyo de Beatriz Yáñez y Sergio Rendón (Instituto de Ciencias del Mar y Limnología, Mazatlán) fue fundamental durante la recolecta del material biológico. Luis F. Carrera, Sergio I. Salazar (El Colegio de la Frontera Sur, México), Leslie Harris (Los Angeles County Museum, Allan Hancock Foundation), Ángel de León (Universidad Autónoma de Nuevo León, México) y Óscar Díaz (Instituto Oceanográfico de Venezuela, Universidad de Oriente) atendieron amablemente múltiples cuestionamientos y proporcionaron referencias indispensables. Este estudio recibió financiamiento de la Conabio a través del proyecto GN002. La lectura crítica de Luis F. Carrera-Parra y dos evaluadores anónimos dio como resultado una versión del manuscrito muy mejorada.
BIBLIOGRAFÍA
1 Audouin, J. V. y H. Milne-Edwards. 1834. Recherches pour servir a l'histoire naturelle du littoral de la France, ou Recueil de mémoires sur l'anatomie, la physiologie, la classification et les moeurs des animaux de nos côtes; ouvrage accompagné de planches faites d'après nature. 2. Annélides. Crochard, París. 290 p. [ Links ]
2 Bakken, T. y R. S. Wilson. 2005. Phylogeny of nereidids (Polychaeta, Nereididae) with paragnaths. Zool. Scr., 34: 507-547. [ Links ]
3 Bastida-Zavala, J. R. 1993. Taxonomía y composición biogeográfica de los poliquetos (Annelida: Polychaeta) de la bahía de La Paz, BCS, México. Rev. Inv. Cient., 4: 11-39. [ Links ]
4 Berkeley, E. y C. Berkeley. 1960. Notes on some polychaeta from the west coast of Mexico, Panama, and California. Can. J. Zool., 38: 357-362. [ Links ]
5 Blake, J. A. y E. Ruff. 2007. Polychaeta. 128-181. En: Carlton, J. M. (Ed.). The Light and Smith manual: intertidal invertebrates from central California to Oregon. Cuarta edición. University of California Press, Berkeley, EE. UU. 1003 p. [ Links ]
6 Blake, J. A., B. Hilbig y P. H. Scott. 1994. Taxonomic atlas of the benthic fauna of the Santa Maria basin and Western Santa Barbara channel. Vol. 4. The Annelida Part 1. Oligochaeta and Polychaeta: Phyllodocida (Phyllodocidae to Paralacydoniidae). Santa Barbara Mus. Nat. Hist. Cal., Santa Barbara, EE. UU. 369 p. [ Links ]
7 Blake, J. A., B. Hilbig y P. H. Scott. 1995. Taxonomic atlas of the benthic fauna of the Santa Maria basin and Western Santa Barbara channel. Vol. 5. The Annelida Part 2. Polychaeta: Phyllodocida (Syllidae and scale-bearing families, Amphinomida, and Eunicida). Santa Barbara Mus. Nat. Hist. Cal., Santa Barbara, EE. UU. 378 p. [ Links ]
8 Brusca, R. C. y M. E. Hendrickx. 2010. Invertebrate biodiversity and conservation in the Gulf of California. 72-95. En: Brusca, R. C. (Ed.). The Gulf of California: biodiversity and conservation. ASDM Studies in Natural History. Arizona-Sonora Desert Museum Press and University of Arizona Press, Tucson, EE. UU. 354 p. [ Links ]
9 Carrera-Parra, L. F. 2006. Revision of Lumbrineris (Polychaeta: Lumbrineridae). Zootaxa, 1336: 1-54. [ Links ]
10 Carrera-Parra, L. F. 2009a. Dorvilleidae Chamberlin, 1919. 154-163. En: De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
11 Carrera-Parra, L. F. 2009b. Eunicidae Berthold, 1827. 165-181. En: De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
12 Carrera-Parra, L. F. 2009c. Lumbrineridae Schmarda, 1861. 263-275. En: De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
13 Chamberlin, R. V. 1919. The Annelida Polychaeta. Mem. Comp. Zool. Harv., 48: 1-514. [ Links ]
14 Çinar, M. E. 2009. Alien polychaete species (Annelida: Polychaeta) on the southern coast of Turkey (Levantine Sea, eastern Mediterranean), with 13 new records for the Mediterranean Sea. J. Nat. Hist., 43: 2283-2328. [ Links ]
15 Claparède, E. 1868. Les annélides chétopodes du Golfe de Naples. Mém. Soc. Phys. Nat. Genève, 19: 313-584. [ Links ]
16 Claparède, E. 1870. Les annélides chétopodes du Golfe de Naples. Supplément. Mém. Soc. Phys. Hist. Nat. Genève, 20: 365-542. [ Links ]
17 Cohen, A. N., L. H. Harris, B. L. Bingham, J. T. Carlton, J. W. Chapman, C. C. Lambert, G. Lambert, J. C. Ljubenkov, S. N. Murray, L. C. Rao, K. Reardon y E. Schwindt. 2005. Rapid assessment survey for exotic organisms in the southern California bays and harbors, and abundance in port and nonport areas. Biol. Inv., 7: 995-1002. [ Links ]
18 Connell, S. D. and T. M. Glasby. 1999. Do urban structures influence local abundance and diversity of subtidal epibiota? A case study from Sydney Harbour. Mar. Environ. Res., 47: 373-387. [ Links ]
19 Day, J. H. 1967. Polychaeta of Southern Africa. Part 1. Errantia. British Museum (Natural History), Londres. 458 p. [ Links ]
20 De León-González, J. A. 2009. Nereididae Lamarck, 1818. 325-354. En: De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
21 De León-González, J. A. y V. Díaz-Castañeda. 2006. Eunicidae (Annelida: Polychaeta) associated with Phragmathopoma caudata Mørch, 1863 and some coral reefs from Veracruz, Gulf of Mexico. Sci. Mar., 70S3: 91-99. [ Links ]
22 De León-González, J. A. y V. Solís-Weiss. 1998. The genus Perinereis (Polychaeta: Nereididae) from the Mexican littoral waters, including the description of three new species and the redescriptions of P. anderssoni and P. elenacasoae. Proc. Biol. Soc. Wash., 111: 674-693. [ Links ]
23 De León-González, J. A. y V. Solís-Weiss. 2000. A review of the polychaete family Nereididae from western Mexico. Bull. Mar. Sci., 67: 549-570. [ Links ]
24 De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss. 2009. Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
25 De Quatrefages, A. 1866. Histoire naturelle des annelés marins et d'eau douce: annélides et géphyriens. Tome Premier. Collection des Suites a Buffon formant avec les OEuvres de cet auteur un Cours Complet d'Histoire Naturelle. Librairie Encyclopédique de Roret. París. 588 p. [ Links ]
26 Farrapeira, C. M. R., D. O. Tenório y F. D. Amaral. 2011. Vessel biofouling as an inadvertent vector of benthic invertebrates occurring in Brazil. Mar. Poll. Bull., 62: 832-839. [ Links ]
27 Fauchald, K. 1970. Polychaetous annelids of the families Eunicidae, Lumbrineridae, Iphitimidae, Arabellidae, Lysaretidae and Dorvilleidae from western Mexico. Allan Hancock Monogr. Mar. Biol., 5: 1-335. [ Links ]
28 Fauchald, K. 1977. Polychaetes from intertidal areas in Panama, with a review of previous shallow-water records. Smithson. Contr. Zool., 221: 1-81. [ Links ]
29 Fauchald, K. 1992. A review of the genus Eunice (Polychaeta: Eunicidae) based in upon type material. Smithson. Contr. Zool., 523: 1-422. [ Links ]
30 Fauvel, P. 1923. Polychètes errantes. Faune de France. 5. Librairie de la Faculté des Sciences. París. 488 p. [ Links ]
31 Fauvel, P. 1941. Annélides Polychètes de la Mission du Cap Horn (1882-1883). Bull. Mus. Hist. Nat., Paris, Sér. 2, 18: 272-298. [ Links ]
32 Fernández-Álamo, M. A. 2002. Los gusanos anélidos. 179-185. En: Cifuentes-Lemus, J. L. y J. Gaxiola-López (Eds.). Atlas de la biodiversidad de Sinaloa. El Colegio de Sinaloa, Culiacán, México. 442 p. [ Links ]
33 GISD. 2007. Alitta succinea. Base de datos global de especies invasoras (GISD). http://ww.issg.org/database/species/ecology.asp?si=1068$fr=1$sts=$lang=EN. 14/05/2013. [ Links ]
34 Godwin, L. S., L. G. Eldrege y K. Gaut. 2004. The assessment of hull fouling as a mechanism for the introduction and dispersal of marine alien species in the main Hawaiian Islands. Bishop Museum Techn. Rep., 28, 114 p. [ Links ]
35 Gravier, C. 1907. Sur les Annélides Polychètes rapportés par M. le Dr. Rivet, de Payta (Pérou). Bull. Mus. Hist. Nat., Paris, 13: 525-530. [ Links ]
36 Gravier, C. 1909. Annélides polychètes recueillis à Payta (Pérou) par M. le Dr. Rivet, membre de la Mission géodésique de l'Équateur. Arch. Zool. Exp. Gen., 4e série, 10: 617-659. [ Links ]
37 Grube, A. E. 1840. Actinien, Echinodermen und Würmer des Adriatischen- und Mittelmeers, nach eigenen Sammlungen beschrieben. J.H. Bon. Kønigsberg, Rusia. 92 p. [ Links ]
38 Grube, A. E. 1857. Annulata örstediana. Enumeratio Annulatorum, quae in itinere per Indiam occidentalem et Americam centralem annis 1845-1848 suscepto legit cl. A.S. Örsted, adjectis speciebus nonnullis a cl. H. Kröyero in itinere ad Americam meridionalem collectis. (1. Familia Aphroditea-F. Euniceae). Vidensk. Meddr. Dansk. Naturh. Foren. For, 1856: 44-62. [ Links ]
39 Hartman, O. 1944. Polychaetous annelids. Parte 5. Eunicea. Allan Hancock Pac. Exped., 10: 1-238. [ Links ]
40 Hartman, O. 1959. Catalogue of the polychaetous annelids of the world. Part 1. Occ. Pap. Allan Hancock Fdn., 23: 1-353. [ Links ]
41 Hartman, O. 1961. Polychaetous annelids from California. Allan Hancock Pac. Exped., 25: 1-226. [ Links ]
42 Hartman, O. 1965. Catalogue of the polychaetous annelids of the world. Supplement 1960-1965 and index. Occ. Pap. Allan Hancock Found., 23: 1-197. [ Links ]
43 Hendrickx, M. E. y R. C. Brusca. 2002. Biodiversidad de los invertebrados marinos de Sinaloa. 141-163. En: Cifuentes-Lemus, J. L. y J. Gaxiola-López (Eds). Atlas de la biodiversidad de Sinaloa. El Colegio de Sinaloa, Culiacán, Sinaloa, México. 442 p. [ Links ]
44 Hernández-Alcántara, P. y V. Solís-Weiss. 1999. Systematics and distribution of the polychaetes (Annelida: Polychaeta) from the sublittoral zone in the Gulf of California. Oceánides, 14: 25-38. [ Links ]
45 Hernández-Alcántara, P., S. Frontana-Uribe y V. Solís-Weiss. 2003. Commented checklist of the polychaetes (Annelida: Polychaeta) from areas adjacent to islands of the Mexican Pacific and Gulf of California. Bull. Sth. Cal. Acad. Sci., 102: 1-16. [ Links ]
46 Hernández-Alcántara, P., M. A. Tovar-Hernández y V. Solís-Weiss. 2008. Polychaetes (Annelida: Polychaeta) described for the Mexican Pacific: an historical review and an updated checklist. Lat. Am. J. Aquat. Res., 36: 37-61. [ Links ]
47 Hewitt, C. L., M. L. Campbell, R. E. Thresher, R. B. Martin, S. Boyd, B. F. Cohen, D. R. Currie, M. F. Gomon, M. J. Keogh, J. A. Lewis, M. M Lockett, N. Mays, M. A. Macarthur, T. D. O'Hara, G. C. B. Poore, D. J. Ross, M. J. Storey, J. E. Watson y R. S. Wilson. 2004. Introduced and cryptogenic species in Port Phillip Bay, Victory, Australia. Mar. Biol., 144: 183-202. [ Links ]
48 Hilbig, B. 1994. Family Hesionidae Sars, 1862. 235-260. En: Blake, J. A., B. Hilbig y P. H. Scott (Eds.). Taxonomic atlas of the benthic fauna of the Santa Maria basin and Western Santa Barbara channel. 4. The Annelida Part 1. Oligochaeta and Polychaeta: Phyllodocida (Phyllodocidae and Paralacydoniidae). Santa Barbara Mus. Nat. Hist. Cal., Santa Barbara, California, EE. UU. 377 p. [ Links ]
49 Hilbig, B. 1995. Family Lumbrineridae Malmgren, 1867, emended Orensanz, 1990. 279-313. En: Blake, J. A., B. Hilbig y P. H. Scott (Eds.). Taxonomic atlas of the benthic fauna of the Santa Maria basin and Western Santa Barbara channel. 5. The Annelida Part 2. Polychaeta: Phyllodocida (Syllidae and scale-bearing families), Amphinomida, and Eunicida. Santa Barbara Mus. Nat. Hist. Cal., Santa Barbara, California, EE. UU. 378 p. [ Links ]
50 Hutchings, P. A. y P. Karageorgopoulos. 2003. Designation of a neotype of Marphysa sanguinea (Montagu, 1813) and a description of a new species of Marphysa from eastern Australia. Hydrobiologia, 496: 87-94. [ Links ]
51 Imajima, M. 1972. Review of the annelid worms of the family Nereidae of Japan, with descriptions of five new species or subspecies. Bull. Nat. Sci. Mus., Tokyo, 15: 37-153. [ Links ]
52 Imajima, M. 2003. Polychaetous Annelids from Sagami Bay and Sagami Sea collected by the Emperor Showa of Japan and deposited at the Showa Memorial Institute, National Science Museum, Tokyo (II), orders included within the Phyllodocida, Amphinomida, Spintherida and Eunicida. Nat. Sci. Mus. Monogr., Tokyo, 23: 1-221. [ Links ]
53 Johnson, H. P. 1901. The Polychaeta of the Puget Sound region. Proc. Boston Soc. Nat. Hist., 29: 381-437. [ Links ]
54 Khlebovich, V. V. 1996. Fauna of Russia and neighbouring countries. Polychaetous Annelids, Volume III. Polychaetes of the Family Nereididae of the Russian seas and the adjacent waters. Russ. Acad. Sci., Zool. Inst., New Ser., 140. 1-221. [ Links ]
55 Kudenov, J. D. 1975. Errant polychaetes from the Gulf of California, Mexico. J. Nat. Hist., 9: 65-91. [ Links ]
56 Leuckart, R. S. 1847. Verzeichnis der zur Fauna Helgoland's gehorenden wirbellosen Seethiere. 136-168. En: Frey, H. y R. S. Leuckart (Eds.). Beiträge Kenntnis Wirbelloser Thiere Besonderer Berücksichtigung Fauna Norddeutschen Meeres. Friedrich Vieweg und sohn. Braunschweig, Alemania. 168 p. [ Links ]
57 Lewis, J. A., C. Watson y H. A. ten Hove. 2006. Establishment of the Caribbean serpulid tubeworm Hydroides sanctaecrucis Kroyer [in] Mörch, 1863, in northern Australia. Biol. Inv., 8: 665-671. [ Links ]
58 Lim, S. C., N. J. de Voogd y K. S. Tan. 2009. Fouling sponges (Porifera) on navigation buoys from Singapore waters. Raffles Bull. Zool., Suppl. 22: 41-58. [ Links ]
59 Link, H., E. Nishi, K. Tanaka, J. R. Bastida-Zavala, E. Kupriyanova y T. Yamakita. 2009. Hydroides dianthus (Polychaeta: Serpulidae), an alien species introduced into Tokyo Bay, Japan. JMBA2, Biod. Rec., 6430: 1-6. [ Links ]
60 McCammon, J. A. y D. E. Montagne. 1979. Some species of the genus Phyllodoce (Polychaeta) from southern California. Zool. J. Linn. Soc., 66: 353-368. [ Links ]
61 Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Rev. Biol. Trop., 54: 773-785. [ Links ]
62 Monro, C. C. A. 1933. The polychaeta errantia collected by Dr. C. Crossland at Colón, in the Panama region, and the Galapagos Islands during the expedition of the S.Y. St. George. Proc. Zool. Soc. Lond., 1933: 1-96. [ Links ]
63 Moore, J. P. 1909. Polychaetous annelids from Monterey Bay and San Diego, California. Proc. Acad. Nat. Sci. Phil., 61: 235-295. [ Links ]
64 Moore, J. P. 1911. The polychaetous annelids dredged by the USS "Albatross" off the coasts of southern California in 1904, 3. Euphrosynidae to Goniadidae. Proc. Acad. Nat. Sci. Phil., 63: 234-318. [ Links ]
65 Mountford, N. K. 1991. Redescription of Phyllodoce erythrophylla (Schmarda, 1861) and P. madeirensis Langerhans, 1880 (Polychaeta: Phyllodocidae), with comments on some related taxa. Ophelia, Suppl., 5: 157-168. [ Links ]
66 Pequegnat, W. E. y L. H. Pequegnat. 1968. Ecological aspects of marine fouling in the Northeastern Gulf of Mexico. Texas AandM Univ., College Station, EE. UU. 80 p. [ Links ]
67 Perkins, T. H. 1980. Review of the species previously referred to Ceratonereis mirabilis, and descriptions of new species of Ceratonereis, Nephtys, and Goniada (Polychaeta). Proc. Biol. Soc. Wash., 93: 1-49. [ Links ]
68 Pettibone, M. 1961. New species of polychacte worms from the Atlantic Ocean, with a revision of the Dorvilleidae. Proc. Biol. Soc. Wash., 74: 167-186. [ Links ]
69 Pleijel, F. 1991. Phylogeny and classification of the Phyllodocidae (Polychaeta). Zool. Scr., 20: 225-261. [ Links ]
70 Pleijel, F. 1998. Phylogeny and classification of Hesionidae (Polychaeta). Zool. Scr., 27:89-163. [ Links ]
71 Pleijel, F., M. T. Aguado y G. W. Rouse. 2012. New and lesser known species of Chrysopetalidae, Phyllodocidae and Syllidae from south California (Phyllodocida, Aciculata, Annelida). Zootaxa, 3506: 1-25. [ Links ]
72 Read, G. B. 2007. Taxonomy of sympatric New Zealand species of Platynereis, with description of three new species additional to P. australis (Schmarda) (Annelida: Polychaeta: Nereididae). Zootaxa, 1558: 1-28. [ Links ]
73 Read, G. B., G. Inglis, P. Stratford y S. T. Ahyong. 2011. Arrival of the alien fanworm Sabella spallanzanii (Gmelin, 1791) (Polychaeta: Sabellidae) in two New Zealand harbours. Aquatic Inv., 6: 273-279. [ Links ]
74 Relini, G., M. Relini y M. Montanari. 2000. An offshore buoy as a small artificial island and a fish aggregating device (FAD) in the Mediterranean. Hydrobiologia, 440: 65-80. [ Links ]
75 Rioja, E. 1941. Estudios anelidológicos. III. Datos para el conocimiento de la fauna de poliquetos de las costas del Pacífico de México. An. Inst. Biol. Univ. Nal. Auton. Méx., 12: 669-746. [ Links ]
76 Rioja, E. 1947. Estudios anelidológicos. XIX. Observaciones sobre algunos nereidos de las costas de México. An. Inst. Biol. Univ. Nal. Auton. Méx., 18: 527-535. [ Links ]
77 Ruiz-Cancino, G., L. F. Carrera-Parra y J. R. Bastida-Zavala. 2011. Eunícidos (Polychaeta: Eunicidae) del Pacífico sur de México. Ciencia y Mar, 14: 27-60. [ Links ]
78 Salazar-Vallejo, S. I. y M. S. Jiménez-Cueto. 1997. Neréidos (Polychaeta) del Caribe mexicano con una clave para las especies del Gran Caribe. Rev. Biol. Trop., 44: 361-377. [ Links ]
79 Salazar-Vallejo, S. I. y A. E. Rizzo. 2009. Hesionidae Grube, 1850 y hesionoideos. 227-243. En: De León-González, J. A., J. R. Bastida-Zavala, L. F. Carrera-Parra, M. E. García-Garza, A. Peña-Rivera, S. I. Salazar-Vallejo y V. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, Monterrey, México. 737 p. [ Links ]
80 Salazar-Vallejo, S. I., J. A. de León-González y C. Chávez-Comparán. 1990. Poliquetos (Annelida: Polychaeta) de la bahía de Manzanillo, con una clave ilustrada para las especies de Colima, México. Rev. Biol. Trop., 38: 211-229. [ Links ]
81 Salazar-Vallejo, S. I., L. F. Carrera-Parra y J. A. de León-González. 2011. Giant eunicid polychaetes (Annelida) in shallow tropical and temperate seas. Rev. Biol. Trop. (Int. J. Trop. Biol.), 59: 1463-1474. [ Links ]
82 Sato, M. 2013. Resurrection of the genus Nectoneanthes Imajima, 1972 (Nereididae: Polychaeta), with redescription of Nectoneanthes oxypoda (Marenzeller, 1879) and description of a new species, comparing them to Neanthes succinea (Leuckart, 1847). J. Nat. Hist., 47: 1-50. [ Links ]
83 Schmarda, L. K. 1861. Neue wirbellose Thiere beobachtet und gesammelt auf einer Reise un die Erdr 1853 bis 1857. Erster Band (zweite halfte) Turbellarian, Rotatorien un Anneliden. 1-164. Wilhelm Engelmann. Leipzig. 164 p. [ Links ]
84 Schulze, A. 2006. Phylogeny and genetic diversity of palolo worms (Palola, Eunicidae) from the Tropical North Pacific and the Caribbean. Biol. Bull., 210: 25-37. [ Links ]
85 SCT. 2010. Secretaría de Comunicaciones y Transportes. Administración Portuaria Integral de Mazatlán. http://www.apimazatlan.com.mx. 14/08/2012. [ Links ]
86 Spalding, M. K., H. E. Fox, G. R. Allen, N. Davidson, Z. A. Ferdaña, M. Finlayson, B. S. Halpern, M. A. Jorge, A. Lombana, S. A. Lourie, K. D. Martin, E. Mcmanus, J. Molnar, C. A. Recchia y J. Robertson. 2007. Marine ecoregions of the world: a bioregionalization of coast and shelf areas. BioScience, 57: 573-583. [ Links ]
87 Streftaris, N., E. Zenetos y E. Papathanassiou. 2005. Globalization in marine ecosystems: the story of nonindigenous marine species across European seas. Oceanogr. Mar. Biol. Annual Rev., 43: 419-453. [ Links ]
88 Tovar-Hernández, M. A. y B. Yáñez-Rivera. 2012a. Capítulo IX. Ficha técnica y análisis de riesgo de Branchiomma bairdi (McIntosh, 1885) (Polychaeta: Sabellidae). 167-190. En: Low-Pfeng, A. M. y E. M. Peters-Recagno (Eds.). Invertebrados marinos exóticos en el Pacífico mexicano. Geomare, A.C., INE-Semarnat, México D. F. 235 p. [ Links ]
89 Tovar-Hernández, M. A. y B. Yáñez-Rivera. 2012b. Capítulo X. Ficha técnica y análisis de riesgo de Ficopomatus miamiensis (Treadwell, 1934) (Polychaeta: Serpulidae). 193-212. En: Low-Pfeng, A. M. y E. M. Peters-Recagno (Eds.). Invertebrados marinos exóticos en el Pacífico mexicano. Geomare, A.C., INE-Semarnat, México D. F. 235 p. [ Links ]
90 Tovar-Hernández, M. A., N. Méndez y J. Salgado-Barragán. 2009a. Branchiomma bairdi: a Caribbean hermaphrodite fan worm in the south-eastern Gulf of California (Polychaeta: Sabellidae). Mar. Biod. Rec., 2: e43. [ Links ]
91 Tovar-Hernández, M. A., N. Méndez y T. F. Villalobos-Guerrero. 2009b. Fouling tubicolous polychaetes worms from the south-eastern Gulf of California: Sabellidae and Serpulidae. Syst. Biod., 7: 1-18. [ Links ]
92 Tovar-Hernández, M. A., E. Suárez-Morales y B. Yáñez-Rivera. 2010. The parasitic copepod Haplostomides hawaiiensis (Cyclopoida) from the invasive ascidian Polyclinum constellatum in the southern Gulf of California. Bull. Mar. Sci., 86: 637-648. [ Links ]
93 Treadwell, A. L. 1929. New species of polychaetous annelids in the collections of the American Museum of Natural History from Porto Rico, Florida, Lower California, and British Somaliland. Am. Mus. Novit., 392: 1-13. [ Links ]
94 Uchida, H. 2004. Hesionidae (Annelida, Polychaeta) from Japan. Kuroshio Biosph., 1: 27-92. [ Links ]
95 Uschakov, P. V. 1955. Polychaetes worms of the far eastern seas of the URSSS. Taxonomic guides to the fauna of the URSSS. Zool. Inst. Acad. Sci., 56, 446 p. [ Links ]
96 Villalobos-Guerrero, T. F. 2012. Capítulo VIII. Ficha técnica y análisis de riesgo de Alitta succinea (Leuckart in Frey and Leuckart, 1847) (Polychaeta: Nereididae). 131-165. En: Low-Pfeng, A. M. y E. M. Peters-Recagno (Eds.). Invertebrados marinos exóticos en el Pacífico mexicano. Geomare, A.C., INE-Semarnat, México D. F. 235 p. [ Links ]
97 Villalobos-Guerrero, T. F. y L. H. Harris. 2012. Oxydromus Grube, 1855 reinstated over Ophiodromus Sars, 1862 (Polychaeta, Hesionidae). ZooKeys, 241: 21-31. [ Links ]
98 Villalobos-Guerrero, T. F. y M. A. Tovar-Hernández. 2013. Una especie nueva de Pseudonereis (Polychaeta: Nereididae) de Mazatlán (Golfo de California), incluyendo una clave para las especies del mundo. Rev. Mex. Biod., 84 (3): 774-781. [ Links ]
99 Wilson, R. S. 1984. Neanthes (Polychaeta: Nereididae) from Victoria with descriptions of two new species. Proc. Roy. Soc. Victoria, 96: 209-226. [ Links ]
100 Wilson, R. S. 1988. Synonymy of the genus Nectoneanthes Imajima, 1972, with Neanthes Kinberg, 1866 (Polychaeta: Nereididae). Proc. Biol. Soc. Wash., 101: 4-10. [ Links ]
101 Wolff, T. y M. E. Petersen. 1991. A brief biography of A. S. Oersted, with notes on his travels in the West Indies and Central America and illustrations of collected polychaetes. Ophelia, Suppl. 5: 669-685. [ Links ]
FECHA DE RECEPCIÓN: 28/02/2013 FECHA DE ACEPTACIÓN: 22/10/2013