Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.43 no.1 Santa Marta Jan./June 2014
DISTRIBUCIÓN Y DENSIDAD DE ICTIOPLANCTON EN EL ESTUARIO DE BAHÍA MÁLAGA, PACÍFICO COLOMBIANO (SEPTIEMBRE DE 2009-FEBRERO DE 2010)*
DISTRIBUTION AND DENSITY OF ICHTHYOPLANKTON IN THE BAHÍA MÁLAGA ESTUARY, PACIFIC COAST OF COLOMBIA (SEPTEMBER 2009-FEBRUARY 2010)
Diana Medina-Contreras1, Jaime Cantera1, Eugenia Escarria2 y Luz M. Mejía-Ladino2
1 Universidad del Valle, Departamento de Biología, Grupo de Investigación en Ecología de Estuarios y Manglares. A. A. 25360, Cali, Colombia. pilarmedina8@hotmail.com, jaime.cantera@correounivalle.edu.co.
2 Instituto de Investigaciones Marinas y Costeras (Invemar), sede Pacífico. A. A. 6713 No. 36. Palmira, Colombia. euesgo79@yahoo.com, mardeluz2@gmail.com.
RESUMEN
Este estudio presenta la densidad, la composición taxonómica y la distribución espacial y temporal del ictioplancton en el estuario de Bahía Málaga, Pacífico colombiano, así como la relación entre estos parámetros biológicos y algunas variables físicoquímicas. Se recolectaron muestras en 12 estaciones a lo largo del canal principal de navegación, las cuales fueron tomadas en cuatro áreas seleccionadas siguiendo el diseño muestreal propuesto por Barletta-Bergan. Se realizaron arrastres superficiales con una red cónica-cilíndrica (ojo de malla: 500 µm; diámetro de boca: 0.6 m; largo: 3.5 m). La salinidad y la temperatura fueron medidas antes de cada arrastre. Un total de 69019 ind/1000 m3 de larvas, representadas en 23 familias, 36 géneros y 40 especies, fueron recolectadas en muestreos mensuales entre septiembre de 2009 y febrero de 2010. Carangidae (39.0%) fue la familia más abundante, seguida de Sciaenidae (27.1%) y Engraulidae (20.1%). Las familias más frecuentes fueron Sciaenidae (26.6%), seguida de Carangidae (22.8%) y Engraulidae (14.7%), las cuales son importantes en los ensamblajes de larvas de peces de estuarios tropicales. El 80% de la densidad fue aportada por seis especies, de las cuales Seriola morfotipo 1 (Carangidae) y Cetengraulis mysticetus (Engraulidae) fueron las más abundantes y dominantes. No se encontró correlación entre la densidad de larvas y la salinidad (Spearman, R = 0.23) o la temperatura (Spearman, R = 0.51). El análisis de las variaciones espaciales y temporales de la densidad de larvas señala diferencias significativas entre los meses muestreados (Anova, p = 0.0029; p < 0.05) pero no entre las áreas (Anova p = 0.078), sugiriendo que Bahía Málaga ofrece condiciones adecuadas para la presencia larval.
PALABRAS CLAVES: Ictioplancton, estuario, taxonomía, Bahía Málaga, Pacífico colombiano.
ABSTRACT
The density, taxonomic composition, and spatial and temporal distribution of the estuarine ichthyoplankton of Bahía Málaga (Pacific coast of Colombia) are described, as well as the relationship between biological parameters and some physicochemical variables. Samples were collected at 12 stations along the principal navigation canal; these samples were taken in four areas following the design of Barletta-Bergan. Surface sweeps were carried out with a conical-cylindrical net (mesh size 500 µm, mouth diameter 0.6 m, length 3.5 m). Salinity and temperature were measured before each sweep. A total of 69019 larvae/1000 m3, representing 23 families, 36 genera and 40 species were collected during monthly sampling from September, 2009 to February, 2010. Carangidae (39.0%) was the most abundant family, followed by Sciaenidae (27.1%) and Engraulidae (20.1%). The most frequent families were Sciaenidae (26.6%), followed by Carangidae (22.8%) and Engraulidae (14.7%) which are important families in larval fish assemblages in tropical estuaries. Eighty percent of total density was provided by six species, of which Seriola morphotype 1 (Carangidae) and Cetengraulis mysticetus (Engraulidae) were the most abundant and dominant. No correlation was found between density and salinity (Spearman, R = 0.23) or temperature (Spearman, R = 0.51). Analysis of spatial and temporal variations of larval density shows significant differences among the months sampled (Anova, p = 0.0029; p < 0.05), but not among areas (Anova, p = 0.078), suggesting that Bahía Málaga offers adequate conditions for the presence of fish larvae.
KEYWORDS: Ichthyoplankton, estuary, taxonomy, Bahía Málaga, Colombian Pacific coast.
INTRODUCCIÓN
Los estuarios son ecosistemas conocidos por mantener una alta diversidad de organismos en diversos estados vulnerables de vida, tales como hembras ovadas, juveniles y larvas, entre otros. Esos sistemas costeros han sido reconocidos como "sala-cunas" por la disponibilidad adecuada de áreas para refugio, alimentación y altos niveles de productividad primaria y secundaria debido a las concentraciones elevadas de nutrientes, lo cual genera condiciones favorables para el asentamiento de larvas y juveniles de diferentes organismos marinos, siendo los peces uno de los grupos más diversos y abundantes. De acuerdo con algunos autores, los estuarios ayudan a mantener buena parte de la diversidad y productividad del océano, aunque a veces los gradientes de variación de las condiciones fisicoquímicas (p. ej. salinidad, temperatura, oxígeno disuelto y turbidez) limitan el uso del estuario (Macnae, 1974; Blaber y Blaber, 1980; Mephan y Petr, 1987; Bulger et al., 1993; Gibson, 1994; Pauly, 1994; Barletta et al., 1998, 2003; Able et al., 1999; Beck et al., 2001; Barletta-Bergan et al., 2002).
Además de los factores fisicoquímicos, las mareas y corrientes son determinantes para la distribución de los peces en el estuario, especialmente en etapas planctónicas, ya que las larvas al permanecer suspendidas en la columna de agua están en mayor grado sujetas a los movimientos de los ciclos mareales. El conocimiento de la distribución y variación, tanto temporal como espacial, del ictioplancton es primordial, ya que más del 80% de los peces litorales utilizan el estuario en alguna de sus etapas de desarrollo y sólo el 10% de los individuos desovados van a ser posteriormente reclutados en sus poblaciones (Yáñez-Arancibia y Nugent, 1977; Castellanos-Galindo et al., 2010). Por esta razón, este tipo de estudios permite identificar áreas potenciales de desove de las poblaciones de peces y establecer posibles relaciones entre ellas, constituyéndose un insumo importante para la gestión de diferentes actividades de conservación de zonas de pesca o la formulación de planes de manejo de especies de interés pesquero o ecológico, entre otras (Yáñez-Arancibia y Nugent, 1977; Beltrán-León y Ríos, 2000; Dominici-Arosemena et al., 2000; Escarria et al., 2006).
Con respecto a la relación entre larvas y adultos de peces, algunos trabajos sugieren que en sistemas estuarinos la composición de adultos puede ser diferente a la de larvas, ya que los ciclos anuales de maduración de cada especie influyen de manera determinante en el comportamiento de sus estadios. La gran mayoría entran al sistema como larvas, desde ambientes marinos adyacentes; otros peces son desovados dentro del estuario hasta completar su ciclo de vida y lo abandonan siendo juveniles. Por lo tanto, la composición del ictioplancton de un estuario es fluctuante a lo largo del tiempo, existiendo poca relación con la composición de adultos cuando se trata de especies no residentes, lo cual ha sido confirmado por diferentes autores (Yáñez-Arancibia y Nugent, 1977; Potter et al., 1990; Bulger et al., 1993; Whitfield, 1999).
A pesar de la reconocida importancia de los estuarios en los ciclos de vida de los peces y de la abundancia de esos ecosistemas en el Pacífico, en Colombia existen algunos estudios relacionados con las larvas estuarinas de peces marinos y generalmente son poco referenciados, especialmente para Bahía Málaga. Las investigaciones que se han desarrollado en el Pacífico colombiano en larvas marinas son las de Echeverri y Bergamín (1982) en Buenaventura (Valle del Cauca) y Saretzki (1997) en la ensenada de Utría (Chocó). Así mismo, Beltrán-León y Ríos (2000) y Beltrán-León (2002) han realizado trabajos desde el punto de vista taxonómico en larvas marinas de peces que incluyen descripciones de especies (sus muestreos en Bahía Málaga se hicieron en Isla Palma). En cuanto a estudios en ecología de larvas de peces, Hernández-Rivas (2002) realizó una caracterización en las costas del Valle del Cauca y Nariño; y Escarria et al. (2006) describieron la composición larval a lo largo del Pacífico colombiano. El presente trabajo determinó los patrones de densidad y distribución (espacial y temporal) del ictioplancton en el estuario de Bahía Málaga, Pacífico colombiano, describiendo la composición taxonómica de los estadios larvales de peces, evaluando la variación de la densidad de acuerdo con la salinidad y temperatura, entre septiembre de 2009 y febrero de 2010 y, finalmente, valorando la importancia de la bahía como sala-cuna.
ÁREA DE ESTUDIO
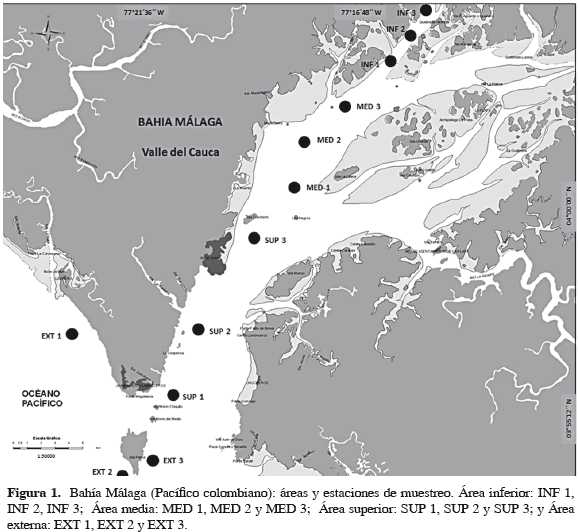
El estuario de Bahía Málaga está localizado a 3°56'-4°05'N y 77°19'-77°21'O, en la región central del Pacífico colombiano, a una distancia aproximada de 36 km del puerto de Buenaventura. Se caracteriza como una de las principales áreas biogeográficas del Pacífico por su alta biodiversidad y heterogeneidad de hábitats (Invemar et al., 2006). Su origen es de tipo tectónico, resultado de un híbrido entre una costa terciaria de acantilados y sustratos duros y condiciones estuarinas con sustratos blandos provenientes de la cuenca aluvial de los ríos Agujeros y La Sierpe, así como de algunos caños ciegos en la parte interna del estuario. Tiene un área aproximada de 136 km2 y alcanza hasta 40 m de profundidad en algunos lugares, especialmente en el sector medio y superior del estuario. Presenta mareas semidiurnas, con un promedio de 4.1 m (Cantera, 1991; Invemar et al., 2006).
Bahía Málaga presenta varias áreas geomorfológicamente diferenciadas: la externa, exhibe un litoral caracterizado por paredes rocosas de acantilado; la superior, presenta sustratos arenosos poco profundos que forman bajos; la media, un estrechamiento de la bahía, tiene la presencia de varias islas rocosas (también conocidas como riscales) rodeadas por planos lodosos; y la interna, caracterizada por la presencia de planos lodosos y bosques de manglar densos. A través de su entrada (3.4 km de ancho) la bahía intercambia con el mar un volumen aproximado de 2000 m3/s. Así mismo, posee dos grandes canales de navegación: el principal presenta en su parte media sustrato rocoso de octocorales y profundidades cercanas a 15 m, así como depresiones submarinas de 40 m; y el canal adyacente presenta fondos fangosos con profundidades de 5 m. Estos dos canales divergen en la región media de la bahía, pero se unen en la parte interna, ocasionando un aumento en la velocidad de las corrientes (aproximadamente de 2.5 m/s). La salinidad superficial del agua está influenciada por la marea y oscila entre 15 y 24 (en promedio), con marea bajando; y entre 20 y 28 (en promedio), con marea subiendo. Las salinidades más bajas (0-10) se registran en la parte interna del estuario dentro de los esteros Luisico, Estancia, El Morro y Valencia (Cantera, 1991), así como en las desembocaduras de La Sierpe y Los Agujeros. Las salinidades altas (20-30) se presentan en la entrada de la bahía en algunos meses del año.
MATERIALES Y MÉTODOS
Con el fin de tener una mayor cobertura y distribución a lo largo de Bahía Málaga, se escogió el canal principal del estuario por presentar mayor profundidad, mayor cobertura y sustrato de tipo rocoso. Mensualmente se tomaron muestras a lo largo de este canal, distribuidas a priori en cuatro áreas: externa, superior, media e inferior; en cada una de ellas se escogieron tres estaciones separadas entre sí con el fin de lograr una mayor cobertura dentro del canal (Tabla 1, Figura 1), realizando una grilla de muestreo similar a la descrita por Barletta-Bergan et al. (2002), con el fin de comparar ambos estuarios. Los muestreos se realizaron entre septiembre de 2009 y febrero de 2010, y en cada estación se hicieron arrastres horizontales superficiales de 10 minutos empleando una red cónica de 60 cm de diámetro, 3 m de longitud y 500 µm de ojo de malla, provista de un flujómetro digital para determinar el volumen de agua filtrado, siguiendo la metodología propuesta por Barletta-Bergan et al. (2002).
En cada uno de los arrastres se midieron las variables salinidad y temperatura empleando una sonda multiparamétrica. Las muestras de larvas y huevos se fijaron con formalina al 5% para su posterior traslado al laboratorio y la identificación de las larvas se realizó con ayuda de los trabajos de Moser et al. (1987) y Beltrán-León y Ríos (2000).
Los huevos colectados se fijaron, preservaron y depositaron en el Museo de Historia Natural Marina de Colombia pero no se identificaron en el presente estudio.
La variación espacial y temporal de la densidad de larvas se evaluó mediante un análisis de varianza de una vía (Anova) para cada factor independientemente y un análisis de varianza factorial (Anova) para evaluar la interacción entre el factor mes y área. Cuando se evidenciaron diferencias estadísticas se aplicó una prueba de comparación múltiple de Tukey. Para identificar la contribución de cada especie en el ensamblaje se empleó un análisis de porcentaje de similaridad (Simper). Así mismo, con el fin de determinar las correlaciones existentes entre la densidad de larvas y las variables físicoquímicas se usó el coeficiente de correlación de Spearman. Las diferencias significativas para esas variables entre cada una de las áreas del estuario se validaron con una prueba de Kruskal-Wallis. Por último, se calculó la diversidad usando el índice de Shannon-Wiener (H') en cada una de las áreas (p < 0.05).
RESULTADOS
Se obtuvo una densidad de larvas de 69019 ind/1000 m3, pertenecientes a 40 especies, 36 géneros y 23 familias. La familia más representativa en cuanto a su densidad fue Carangidae (Seriola morfotipo 1, Oligoplites saurus, Caranx caballus y Gnathanodon speciosous) con un total de 26914 ind/1000 m3, seguida de Sciaenidae (Bairdiella morfotipo 1, Larimus morfotipo 1, Umbrina morfotipo 1, Menticirrhus morfotipo 1, Stellifer morfotipo 1 y Sciaenidae morfotipo 1) con 19004 ind/1000 m3 y Engraulidae (Cetengraulis mysticetus, Anchovia macrolepidota y tres morfotipos diferenciados del género Anchoa) con 13882 ind/1000 m3. Esas familias fueron las más representativas en número de individuos al aportar 86.6% de la densidad.
Por otro lado, las familias Serranidae (tres morfotipos diferenciados del género Paralabrax), Eleotridae (Eleotris picta, E. armiger y Dormitator latifrons), Pomacentridae (Stegastes morfotipo 1, Chromis morfotipo 1 y un morfotipo no definido de la familia) y Achiridae (Achirus mazatlanus, A. klunzingeri, Achirus morfotipo 1) aunque no fueron tan abundantes y sólo representaron 6.2% de la densidad, cobran un valor importante dentro del ensamblaje, ya que aportaron 30% de la riqueza total, con tres especies cada una. Según el índice de diversidad de Shannon-Wiener, el área externa fue la más diversa (H' = 3.4 bits/ind) seguida por el área superior (H' = 2.9 bits/ ind), representadas por 31 y 29 especies, respectivamente. Igualmente la mayor equidad (Pielou) fue encontrada en el área externa (J' = 0.6).
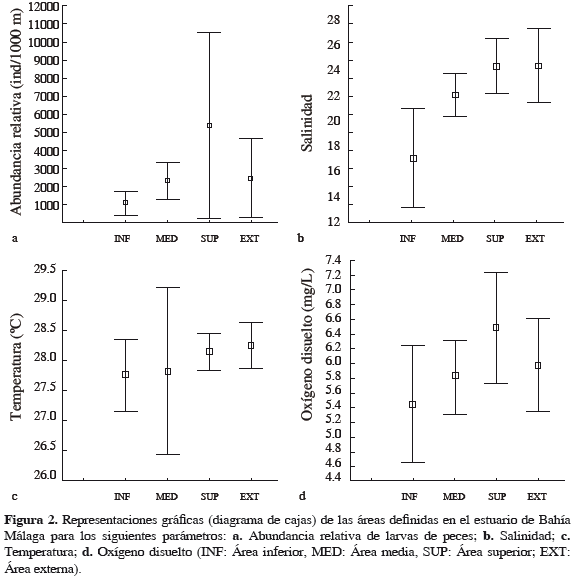
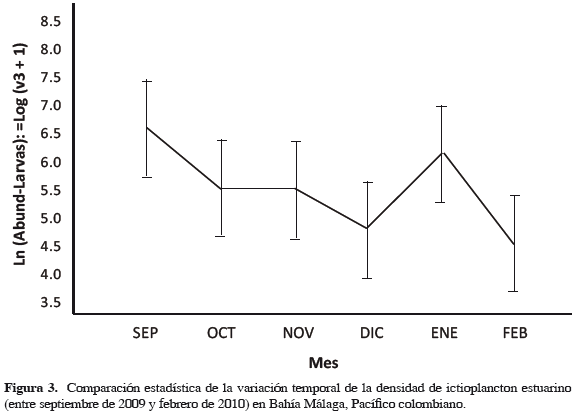
El análisis de varianza no mostró diferencias significativas de la densidad de larvas entre las áreas del estuario (Anova p = 0.078) (Figura 2) pero sí se presentaron diferencias significativas entre los meses de muestreo (Anova p = 0.0029; p < 0.05) (Figuras 3 y 4), siendo septiembre el mes de mayor densidad en comparación con diciembre y febrero, que mostraron menores densidades (Tukey: diciembre, p = 0.04; p < 0.05; febrero, p = 0.01; p < 0.05). Por otra parte, no se encontró interacción entre los factores área y mes (Anova factorial p = 0.1). El análisis Simper señala que seis especies son significativamente importantes dentro del ensamblaje (Seriola morfotipo 1, Cetengraulis mysticetus, Stellifer morfotipo 1, Achirus mazatlanus, Coryphopterus morfotipo 1 e Hypsoblennius morfotipo 1).
La salinidad del agua superficial en Bahía Málaga osciló entre 11.8 y 30.3, con un promedio de 23.4. Los análisis estadísticos señalan diferencias significativas entre las áreas del estuario para esa variable (Kruskal-Wallis, p = 0.015), pero no se registró correlación positiva y significativa de la densidad de larvas con la salinidad (Spearman, R = 0.23). La temperatura osciló entre 25.0 y 31.0, promedio 28.4 °C, y no se registró una correlación positiva y significativa de la densidad de larvas con esa variable (Spearman, R = 0.51); así mismo, el análisis estadístico no muestra diferencias significativas de esa variable entre las áreas (Kruskal-Wallis, p = 0.74). En cuanto a la precipitación, durante los meses de trabajo fue mayor en septiembre (714 mm) y octubre (914 mm) de 2009, seguidos de dos meses de transición, noviembre (575 mm) y diciembre (550 mm) de 2009 y dos de lluvias bajas, enero (265 mm) y febrero (323 mm) de 2010 (Ideam, 2010).
DISCUSIÓN
Una de las características típicas de los ensamblajes de larvas de peces en estuarios tropicales es la dominancia de pocas especies, las cuales generalmente aparecen acompañadas por un significativo número de especies en bajas abundancias que frecuentan el estuario de manera ocasional (Whitfield, 1989; 1999; Morais y Morais, 1994; Barletta-Bergan et al., 2002; Barletta y Barletta-Bergan, 2009). En Bahía Málaga se observa esta condición, ya que 80% de la densidad fue aportada por seis especies: Seriola morfotipo 1, Cetengraulis mysticetus, Stellifer morfotipo 1, Achirus mazatlanus, Coryphopterus morfotipo 1 e Hypsoblennius morfotipo 1.
Las familias Engraulidae, Sciaenidae y Gobiidae, a las cuales pertenecen tres de las seis especies dominantes del presente estudio, también han sido registradas como las más importantes en otros trabajos realizados en estuarios (Morais y Morais, 1994; Whitfield, 1999; Barletta-Bergan et al., 2002). La primera está generalmente asociada a las áreas internas de los sistemas estuarinos, ya que depende en gran medida de las condiciones de turbidez de los mismos y según Barletta-Bergan et al. (2002) es allí donde especies de esa familia desarrollan todo su ciclo de vida. La familia Carangidae, por su parte, agrupó 40% de los individuos y está representada por cuatro especies: Seriola morfotipo 1, Oligoplites saurus, Caranx caballus y Gnathanodon speciosous; sin embargo, es considerada como una familia de menor importancia en los ensamblajes de larvas de otros estuarios (Neira y Potter, 1992; Barletta-Bergan et al.,2002) y, pese a que presenta una importancia comercial en las pesquerías regionales (Escarria et al., 2006), es posible que en el Pacífico colombiano generalmente use los estuarios en su etapa larval.
Como se afirma en la literatura, la representación de especies de agua dulce y estuarinas es por lo general significativa y se han registrado ejemplares de las familias Ariidae, Pimelodidae, Loricariidae, Eleotridae y Curimatidae (Whitfield, 1999; Jaureguizar et al., 2002; Barletta y Barletta-Bergan, 2009). Sin embargo, en el presente estudio las especies relacionadas con agua dulce en el ensamblaje se limitaron a dos individuos de Pseudophallus morfotipo 1 (familia Syngnathidae) y algunos individuos de la familia Eleotridae, explicado en parte por el origen geomorfológico de la bahía (Cantera, 1991), el tipo de muestreo dirigido que se realizó y el arte de pesca empleado. Por otra parte, la distribución de las larvas de Coryphopterus morfotipo 1 e Hypsoblennius morfotipo 1 indica que son especies residentes del estuario, ya que en el presente estudio se colectaron en todas las áreas, sin embargo, los estadios adultos de esas especies sólo se encontraron en las estaciones externas (Medina-Contreras et al., 2011), infiriendo que las larvas permanecen suspendidas a lo largo de toda la bahía hasta que son reclutadas en sus ecosistemas asociados ya siendo adultas, indicando también que el estuario es un medio adecuado para suplir las necesidades durante su etapa larval.
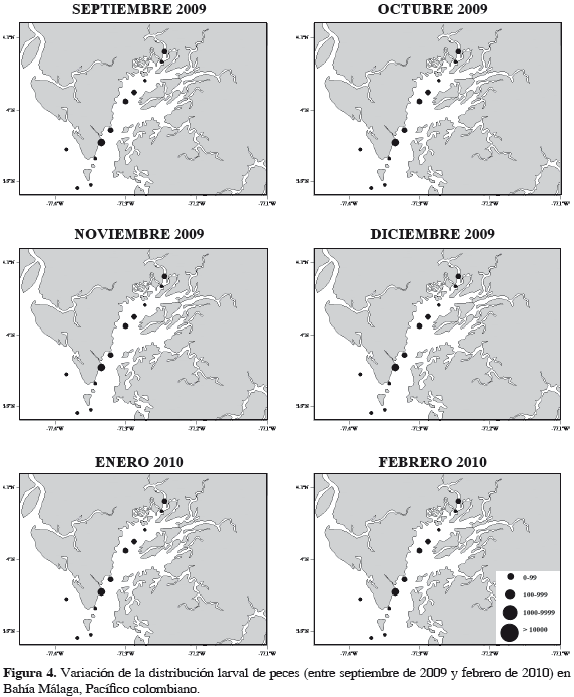
La distribución de las densidades de larvas de peces es homogénea a lo largo del canal principal de Bahía Málaga, sugiriendo que el estuario ofrece condiciones favorables para la presencia larval en cada una de las áreas estudiadas. Esa distribución es diferente comparada con la encontrada en otros estuarios, ya que algunos autores señalan que las mayores abundancias se encuentran en las partes externas del sistema, debido a que un alto número de individuos son arrastrados hacia el océano por las corrientes de mareas (Neira y Potter, 1992; Ramos et al., 2005). Por otro lado, otros autores señalan que las áreas internas favorecen la agregación larval por brindar condiciones de refugio y alimentación, relacionadas con una mayor turbidez, grandes raíces de manglar y alta sedimentación debida a la descarga de agua de los esteros (Barletta-Bergan et al., 2002; Barletta y Barletta-Bergan, 2009).
De acuerdo con los resultados obtenidos en el presente estudio, este estuario presenta un ensamblaje de larvas de peces con una composición taxonómica integrada principalmente por la baja presencia de especies de agua dulce y la dominancia de una familia (Carangidae) que no ha sido registrada como importante en ese tipo de ensamblajes. Finalmente la presencia permanente de larvas de peces en densidades similares en todas las áreas de Bahía Málaga, permiten inferir que en general este estuario es un área importante como sala-cuna, lo cual no sólo se le atribuye a la presencia de manglares en la parte interna (Barletta-Bergan et al., 2002, Barletta y Barletta-Bergan, 2009), sino que también puede estar asociado a otros ecosistemas importantes, tales como arrecifes rocosos, así como a condiciones físicoquímicas particulares.
AGRADECIMIENTOS
El presente trabajo se desarrolló en el marco del proyecto "El papel de la salinidad en las asociaciones de larvas de organismos marinos de Bahía Málaga (Pacífico colombiano): valoración de la importancia de esa área como sala-cuna y su comparación con otros estuarios en hábitats tropicales" (Código: 2105-452-21395-Contrato No. 664-2008) y fue concluido dentro del componente de biodiversidad del proyecto "Vulnerabilidad de los ecosistemas marinos y costeros de Bahía Málaga (Pacífico colombiano): amenazas naturales y antrópicas" (Código 1106-521-28786-Contrato 315-2011), los cuales fueron cofinanciados y ejecutados por el Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andreis" y la Universidad del Valle, y apoyados financieramente por Colciencias. Los autores agradecen especialmente a las comunidades locales de La Plata, Juanchaco y Ladrilleros, así como al grupo de apoyo local en las salidas de campo. Así como a Alejandra Ocampo por la elaboración de las representaciones cartográficas mensuales de las variables fisicoquímicas medidas.
BIBLIOGRAFÍA
1 Able, K., J. Manderson y A. Studholme. 1999. Habitat quality for shallow water fishes in an urban estuary: the effects of man-made structures on growth. Mar. Ecol. Prog. Ser., 187: 227-235. [ Links ]
2 Barletta, M. y A. Barletta-Bergan. 2009. Endogenous activity rhythms of larval fish assemblages in a mangrove fringed estuary in North Brazil. Open Fish Sci. J., 2: 15-24. [ Links ]
3 Barletta, M., A. Barletta-Bergan y U. Saint-Paul. 1998. Description on the fishery structure in the mangrove dominated region of Braganga (State of Pará-North Brazil). Ekotropica, 4: 41-53. [ Links ]
4 Barletta, M., A. Barletta-Bergan, U. Saint-Paul y G. Hubold. 2003. Seasonal changes in density, biomass and diversity of estuarine fishes in tidal mangrove creeks of the lower Caeté Estuary (northern Brasilian coast, east Amazon). Mar. Ecol.Prog. Ser., 256: 217-228. [ Links ]
5 Barletta-Bergan, A., M. Barletta y U. Saint-Paul. 2002. Structure and seasonal dynamics of larval fish in the Caeté River in north Brazil. Est. Coast. Shelf Sci., 154: 193-206. [ Links ]
6 Beck, M., K. Heck, K. Able, D. Childers, D. Eggleston, B. Gillanders, B. Halpern, C. Hays, K. Hostino, T. Minello, R. Orth, P. Sheridanand y M. Weinstein. 2001. The role of near shore ecosystems as fish and shellfish nurseries. Bioscience, 51: 633-641. [ Links ]
7 Beltrán-León, B. 2002. Monitoreo de huevos y larvas de peces Clupeiformes de la costa del Valle del Cauca (Pacífico colombiano) durante 1993. Bol. Cient. INPA, 7: 121-140. [ Links ]
8 Beltrán-León, B. y R. Ríos. 2000. Estadios tempranos de peces del Pacífico colombiano. Instituto Nacional de Pesca y Acuicultura, Buenaventura, Colombia. 727 p. [ Links ]
9 Blaber, S. y T. Blaber. 1980. Factors affecting the distribution of juvenile estuarine and inshore fish. J. Fish. Biol., 17: 143-162. [ Links ]
10 Bulger, A., B. Hayden, M. Monaco, D. Nelson y G. McCormick-Ray. 1993. Biologically-based estuarine salinity zones derived from a multivariate analysis. Estuaries, 16 (2): 311-322. [ Links ]
11 Cantera, J. 1991. Etude structurale des mangroves et des peuplements macro-benthiques littoraux de deux bailes du pacifique colombien (Malaga et Buenaventura) rapport avec les conditions du milieu et les perturbations anthropiques. Tesis de doctorado, Univ. Aix_Marsella, Marsella, Francia. 371 p. [ Links ]
12 Castellanos-Galindo, G., U. Krumme y J. Willis. 2010. Tidal influences on fish distributions in tropical eastern Pacific rocky shores (Colombia). Mar. Ecol. Progress Ser., 416: 241-254. [ Links ]
13 Dominici-Arosemena, A., B. Brugnoli-Olivera, S. Solano-Ulate y A. Ramírez-Coghi. 2000. Ictioplancton de la zona portuaria de El Limón, Costa Rica. Rev. Biol. Trop., 48 (2-3): 439-442. [ Links ]
14 Echeverri, C. y H. Bergamín. 1982. Estudio preliminar de la taxonomía y distribución de larvas de peces en la bahía de Buenaventura. Tesis Biología, Univ. Valle, Cali. 99 p. [ Links ]
15 Escarria, E., B. Beltrán-León y A. Giraldo. 2006. Ictioplancton superficial de la cuenca del océano Pacífico colombiano (septiembre 2003). Inv. Mar., 34 (2): 169-173. [ Links ]
16 Gibson, R. 1994. Impact of habitat quality and quantity on the recruitment of juvenile flatfishes. Neth. J. Sea Res., 32: 191-206. [ Links ]
17 Hernández-Rivas, J. 2002. Composición, distribución y abundancia de las larvas de peces en la costa del Valle del Cauca, Cauca y Nariño, Pacífico colombiano durante 1995. Univ. Valle, Buenaventura, Colombia. 70 p. [ Links ]
18 Ideam. 2010. Precipitaciones promedio mensuales totales. http://institucional.ideam.gov.co/jsp/loader.jsf?lServicio=Usuarios$lTipo=usuarios$lFuncion=login.TXT. 23/03/2011. [ Links ]
19 Invemar, Univalle e Inciva. 2006. Biomálaga: Valoración de la biodiversidad marina y costera de Bahía Málaga (Valle del Cauca) como uno de los instrumentos necesarios para que sea considerada un área protegida. Informe final, Invemar, Univ. Valle e Inciva, Cali. 813 p. [ Links ]
20 Jaureguizar, A., R. Bremec, H. Miazan y C. Lasta. 2002. Fish assemblage and environmental patterns in the Río de La Plata estuary. Est. Coast. Shelf Sci., 56: 921-933. [ Links ]
21 Macnae, W. 1974. Mangrove forest and fisheries. FAO/UNDP. Indian Oc. Fish., 74: 34-35. [ Links ]
22 Medina-Contreras, D., L. Mejía-Ladino y G. Castellanos-Galindo. 2011. Peces. 56-73. En: Cantera-Kintz, J. R. 2011. Estadios de vida vulnerable de organismos marinos de Bahía Málaga: Guía para su identificación. Univ. Valle. Cali. 144 p. [ Links ]
23 Mephan, R. y T. Petr. 1987. Papers contributed to the workshop on strategies for the management of fisheries and aquaculture in mangrove ecosystems. Fish. Rep. (FAO), 370 (Suppl.), 248 p. [ Links ]
24 Morais, T. y T. Morais. 1994. The abundance and diversity of larval and juvenile fish in a tropical estuary. Est. Coast. Shelf Sci., 17: 216-225. [ Links ]
25 Moser, H., P. Smith y L. Eber. 1987. Larval fish assemblages in the California Current region, 1954-1960, a period dynamic environmental change. Calif. Coop. Ocea. Fish. Inv., 28: 97-127. [ Links ]
26 Neira, F. y I. Potter. 1992. Movement of larval fishes through the entrance channel of a seasonally open estuary in Western Australia. Est. Coast. Shelf Sci., 35: 213-224. [ Links ]
27 Pauly, D. 1994. Fish recruitment studies: getting unstuck. Fish. Sci., 10: 78-86. [ Links ]
28 Potter, I., L. Beckley, A. Whitfieldand y R. Lenanton. 1990. Comparisons between the roles played by estuaries in the life cycles of fishes in temperate Western Australia and Southern Africa. Envir. Biol. Fish., 28: 143-178. [ Links ]
29 Ramos, S., R. Cowen, P. Re y A. Bordalo. 2005. Temporal and spatial distributions of larval fish assemblages in the Lima estuary (Portugal). Est. Coast. Shelf Sci., 66: 303-314. [ Links ]
30 Saretzki, C. 1997. Dinámica estructural de la comunidad ictioplanctónica en la ensenada de Utría, Chocó, Pacífico colombiano. Tesis Biología, Pontificia Univ. Javeriana, Bogotá. 67 p. [ Links ]
31 Yáñez-Arancibia, A. y R. Nugent. 1977. El papel ecológico de los peces en estuarios y lagunas costeras. Cent. Cienc. Mar. Limn. Univ. Nal. Aut. Méx., 4 (1): 107-113. [ Links ]
32 Whitfield, A. 1989. Fish larval composition abundance and seasonality in a southern-African estuarine lake. South Afr. J. Zool., 24: 217-224. [ Links ]
33 Whitfield, A. 1999. Ichthyofaunal assemblages in estuaries: a South African case study. Rev. Fish Biol. Fish., 9: 151-186. [ Links ]
FECHA DE RECEPCIÓN: 01/06/2011 FECHA DE ACEPTACIÓN: 11/12/2013
*Contribución No. 1141 del Instituto de Investigaciones Marinas y Costeras (Invemar).