Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.43 no.1 Santa Marta Jan./June 2014
RELACIONES FILOGEOGRÁFICAS DE ALGUNAS COLONIAS DE ALIMENTACIÓN Y ANIDACIÓN DE LA TORTUGA CAREY (ERETMOCHELYS IMBRICATA) EN EL PACÍFICO Y CARIBE COLOMBIANOS*
PHYLOGEOGRAPHIC RELATIONS OF SOME FEEDING AND NESTING OF HAWKSBILL TURTLE ROOKERIES (ERETMOCHELYS IMBRICATA) IN THE CARIBBEAN AND PACIFIC OF COLOMBIA
Natalia Trujillo-Arias1,2, Diego F. Amorocho3,4, Diana López-Álvarez5 y Luz M. Mejía-Ladino6
1 Universidad del Quindío, Armenia, Colombia. Carrera 15, Calle 12 Norte, Armenia, Quindío, Colombia. natitrujillo@gmail.com.
2 Dirección actual: Museo Argentino de Ciencias Naturales, Avenida Ángel Gallardo 470, Buenos Aires, Argentina.
3 Centro de Investigación para el Manejo Ambiental y el Desarrollo (Cimad), Cali, Colombia.
4 World Wildlife Fund Inc (WWF), Carrera 35 No. 4A-25 Cali, Colombia. dfamorocho@wwf.org.co.
5 Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Parque Científico Agronatura Km 18 vía Cali-Palmira, Palmira, Colombia. dianalopez430@gmail.com.
6 Instituto de Investigaciones Marinas y Costeras (Invemar). Parque Científico Agronatura Km 18 vía Cali-Palmira, Palmira, Colombia. mardeluz@hotmail.com.
RESUMEN
La tortuga marina Eretmochelys imbricata habita en aguas tropicales de todos los océanos. La especie está considerada en peligro crítico de extinción por la IUCN y sus poblaciones se encuentran afectadas por el tráfico internacional de los escudos de su caparazón. La presente investigación es pionera en Colombia y en el océano Pacífico oriental tropical, ya que por medio de la amplificación de secuencias de la región control del ADNmt se caracterizaron genéticamente las poblaciones de la especie localizadas en: 1) Parque Nacional Natural Gorgona, 2) Corales del Rosario y San Bernardo y 3) Cabo de la Vela (La Guajira). Se encontraron dos haplotipos nuevos para el Pacífico oriental, aunque los índices de diversidad fueron bajos (h: 0.2857 ± 0.1964; π: 0.0009 ± 0.0008). Para la población de Corales del Rosario y San Bernardo se encontraron cinco haplotipos e índices de diversidad altos (h: 0.9333 ± 0.1217; π: 0.0089 ± 0.0056). Finalmente, la población del Cabo de la Vela presentó índices de diversidad relativamente altos (h: 0.6429 ± 0.0539; π: 0.0076 ± 0.0041). Los análisis de distancia genética no revelaron diferenciación significativa entre las colonias del Caribe colombiano (Φst = 0.002, p > 0.05; Fst = 0.083, p > 0.05); sin embargo, sí se encontró diferenciación entre la colonia anidante del Cabo de la Vela y ocho colonias anidantes en el mar Caribe, lo cual es un patrón característico de la estructura genética a escala global de las tortugas marinas. Por medio de los análisis filogeográficos se observó una profunda división entre el océano Atlántico y la región Pacífico-Índica. Para el filogrupo del Atlántico no se observó una agrupación clara entre los haplotipos, mientras que para el filogrupo del Pacífico-Índico se observó una posible distribución de aislamiento por distancia. El tiempo de divergencia registrado en este estudio entre los linajes del Atlántico y Pacífico-Índico sugiere una separación que pudo haber ocurrido entre el Plioceno y el Pleistoceno (7 Ma), posiblemente influenciada por el levantamiento del istmo de Panamá.
PALABRAS CLAVES: Tortugas marinas, Eretmochelys imbricata, región control ADN mitocondrial, diversidad genética, análisis filogenético.
ABSTRACT
The sea turtle Eretmochelys imbricata inhabits tropical waters of all oceans. IUCN considers this species to be critically endangered and its populations are affected by illegal international shell traffic. We present a pioneer research for Colombia and the Tropical Eastern Pacific, since populations located in 1) Parque Nacional Natural Gorgona, 2) Corales del Rosario y San Bernardo, and 3) Cabo de la Vela (Guajira) were genetically characterized using mtDNA control region sequences. Two new haplotypes for the Eastern Pacific were found, although with low diversity indexes (h: 0.2857 ± 0.1964; π: 0.0009 ± 0.0008). Five haplotypes were found for Corales del Rosario and San Bernardo's populations, with high diversity indexes (h: 0.9333 ± 0.1217; π: 0.0089 ± 0.0056). Finally, Cabo de la Vela population presented relatively high diversity indexes (h: 0.6429 ± 0.0539; π: 0.0076 ± 0.0041). The genetic distance analysis revealed no significant differentiation between the Colombian Caribbean rookeries (Φst = 0.002, p > 0.05; Fst = 0.083, p > 0.05). However, significant differences were found between Cabo de la Vela nesting rookery and eight nesting rookeries along the Caribbean Sea, which is a genetic pattern characteristic of sea turtles on a global scale. Our phylogeographic analysis revealed a deep split between the Atlantic and the Pacific-Indian Ocean. For Atlantic phylogroup no clear clustering between haplotypes was perceived, while in the Pacific-Indian phylogroup a possible distribution of isolation by distance was observed. The divergence time reported in this study between the Atlantic and Pacific-Indian lineages suggests a separation that may have occurred between the Pliocene and Pleistocene (7 Ma), possibly influenced by the rise of the Panama Isthmus.
KEYWORDS: Marine turtles, Eretmochelys imbricata, mitochondrial DNA control region, genetic diversity, phylogenetic analysis.
INTRODUCCIÓN
La tortuga carey (Eretmochelys imbricata) está distribuida en todos los océanos tropicales y subtropicales (Roberts et al., 2004) con una dieta particularmente típica que incluye varias especies de esponjas y cnidarios marinos (León y Björndal, 2002). Esta especie ha sido fuertemente explotada por siglos debido al tráfico ilegal de los escudos de su caparazón (Mortimer et al., 2007); se cree que más de 10000 tortugas por año han sido capturadas en décadas recientes en la región del gran Caribe (Canin, 1989), lo que ha ocasionado que muchas poblaciones anidantes estén gravemente reducidas o extintas como resultado de esa explotación (Bowen et al., 2007). Consecuentemente, la carey se encuentra categorizada como especie en peligro crítico de extinción por la Unión Internacional para la Conservación de la Naturaleza (IUCN por sus siglas en inglés) (Mortimer y Donnelly, 2008) y en el apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres, conocida como Cites (Traffic, 2002).
En el océano Atlántico la tortuga carey ha presentado una disminución drástica de sus poblaciones; sin embargo, en comparación con otras regiones presenta una distribución y abundancia relativamente buena, registrándose poblaciones anidantes y de forrajeo en la mayoría de países del mar Caribe. En cambio, en el océano Pacífico esta especie está particularmente amenazada aproximándose a la extinción regional (Mortimer y Donnelly, 2008), especialmente en el océano Pacífico oriental (OPO) donde alguna vez fueron consideradas comunes desde México hasta Ecuador (Cliffton et al., 1982), siendo actualmente la tortuga marina más escasa de la región (Cornelius, 1982). En 2007 la carey fue declarada funcionalmente erradicada en el OPO, basados en los escasos registros de presencia de la especie y distribución de los arrecifes de coral en la región (Mortimer y Donnelly, 2008; Gaos et al., 2012). Sin embargo, según un estudio reciente, se ha considerado a Ecuador, México, Nicaragua y El Salvador como países prioritarios para la conservación de esta especie en la región, siendo este último, el país de mayor prioridad, ya que presenta la colonia de anidación más grande para la carey en el Pacífico Oriental (Gaos et al., 2010).
A pesar de que se han identificado recientemente algunas poblaciones de carey en el OPO (Gaos et al., 2010), hasta el momento no se han realizado estudios genéticos en esas poblaciones. Los estudios se han realizado principalmente en el océano Atlántico (Bass et al., 1996; Bowen et al., 1996, 2004, 2006, 2007; Bass, 1999; Garduño-Andrade, 2000; Troeng et al., 2005; Lara-Ruiz et al., 2006; Mortimer et al., 2007; Vélez-Zuazo et al., 2008; Blumenthal et al., 2009; Browne et al., 2010; Monzón-Argüello et al., 2010, 2011; Leroux et al., 2012), mientras que las poblaciones del Pacífico-Índico han recibido una mínima atención (Okayama et al., 1999; Nishizawa et al., 2009, 2010; Tabib et al., 2011; Nezhad et al., 2012).
En Colombia los estudios en tortugas marinas se han desarrollado especialmente en la costa Caribe, enfocándose en la conservación de playas de anidación. Aún así, el conocimiento sobre el estado de conservación de esas especies, su dinámica poblacional, historia de vida y amenazas es mínimo, sin mencionar la carencia de estudios en áreas de alimentación que resultan más difíciles y costosos (Rincón-Díaz y Rodríguez-Zárate, 2004). Los trabajos que se han realizado para la carey en playas de anidación del Caribe colombiano han sido ejecutados en los Parques Nacionales Naturales (PNN) Tayrona, Corales del Rosario y San Bernardo, y en el Cabo de la Vela, Isla Fuerte e isla Tortuguilla (McCormick, 1997,1998; Rincón et al., 2001; Arcos et al., 2002; Ceballos-Fonseca, 2004); mientras que para la costa pacífica se han registrado pocos avistamientos de la especie. Según el trabajo realizado por Gaos et al. (2010), para el Pacífico colombiano se han registrado 25 individuos desde 1982 hasta 2009, siendo el PNN Gorgona, la región del Pacífico colombiano con mayor registro de individuos, principalmente en actividades relacionadas con la alimentación.
De acuerdo con el dramático estado de la tortuga carey no solo en Colombia sino también a nivel mundial, es necesario realizar estudios que brinden información y comprensión de aspectos claves sobre su biología, como el grado de aislamiento entre colonias anidantes, vías de migración, el origen (colonia reproductora) de las poblaciones forrajeras y la estructura y diversidad de sus poblaciones (Bowen et al., 2007). Recientemente se han empleado técnicas moleculares que permiten analizar los polimorfismos de ADN y los patrones de diversidad genética de poblaciones naturales, los cuales representan su genealogía y el impacto relativo de eventos históricos, geográficos y demográficos (Avise, 2000; Nordborg e Innan, 2002). En particular los polimorfismos del ADN mitocondrial (ADNmt) han sido usados en el estudio de linajes maternos y estructura poblacional (Bowen et al., 1992), los cuales están íntimamente ligados con las características de historia de vida y procesos poblacionales históricos, útiles para construir planes de conservación (Reece et al., 2005).
El presente estudio es la primera investigación en Colombia dirigida a determinar el estado poblacional de los individuos de tortuga carey presentes en la colonia de alimentación más importante del Pacífico colombiano ubicada en el PNN Gorgona, y dos colonias del Caribe, una de anidación en el Cabo de la Vela, La Guajira, y una de alimentación en Corales del Rosario y San Bernardo. El objetivo es determinar por medio del análisis de la región control del ADNmt, la diversidad y estructura genética de estas colonias y sus relaciones con las demás poblaciones presentes en los océanos Atlántico, Pacífico e Índico.
ÁREA DE ESTUDIO
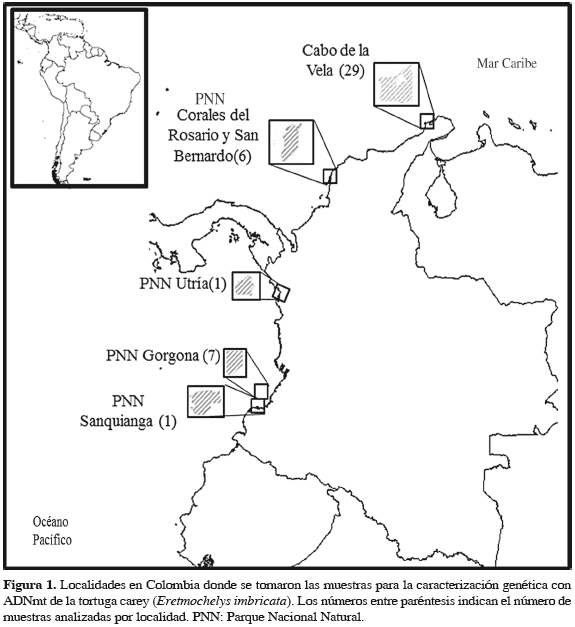
Se analizaron siete muestras de individuos juveniles capturados en el PNN Gorgona (2°55'45"-3°00'55" N y 78°09'00"-78°14'30"O), ubicado al sur occidente del Pacífico colombiano, y separado 56 km del continente. Isla Gorgona pertenece políticamente al municipio de Guapi (Cauca) y fue declarada área protegida mediante la Resolución Ejecutiva No. 141 de julio de 1984. Los sectores de muestreo fueron los arrecifes coralinos de La Azufrada y Playa Blanca, localizados en el lado oriental de la isla. También se incluyeron dos muestras adicionales, la primera, corresponde a un individuo capturado en el PNN Utría (Chocó); y la segunda, de otro capturado en el PNN Sanquianga (Nariño) (Figura 1).
Por otro lado, se incluyeron muestras de tejido provenientes del Caribe colombiano que hacen parte de la Colección de Tejidos del Instituto Alexander von Humboldt, las cuales corresponden a seis juveniles capturados en mar abierto del archipiélago Corales del Rosario y San Bernardo (Bolívar) y a 30 hembras anidantes del Cabo de la Vela (La Guajira) (Figura 1). Dichas recolectas fueron realizadas bajo el Contrato de Acceso a los Recursos Genéticos No. 4 del 28 de marzo de 2007, expedido por el Ministerio del Ambiente, Vivienda y Desarrollo Territorial de Colombia.
MATERIALES Y MÉTODOS
Extracción de ADN, amplificación de PCR y determinación de haplotipos El ADN genómico fue aislado empleando el protocolo de FitzSimmons et al. (1997) para las muestras de tejido sanguíneo y el kit de extracción Tissue DNeasy (Promega) para las muestras de tejido muscular. Un fragmento de 740 pb de la región control del ADN mitocondrial fue amplificado usando los cebadores LTEi9 (GGGAATAATCAAAAGAGAAGG-3') y H950 (GTCTCGGATTTAGGGGTTT-3') (Abreu-Grobois et al., 2006). La región amplificada en este estudio abarca un segmento de 380 pb y uno de 480 pb previamente utilizados en estudios genéticos en poblaciones de tortugas carey (Bass et al., 1996; Bowen et al., 1996; Bass, 1999; Díaz-Fernández et al., 1999; Nishizawa et al., 2010).
La amplificación de la región control de ADNmt se llevó acabo por medio de la técnica de reacción en cadena de la polimerasa (PCR) usando una mezcla de PCR de 25 μL, la cual contenía 50 ng/μL de ADN total, 1 U de Taq polimerasa, 0.5 μM de cada cebador (IDT), 0.2 mM de dNTP's, 2.8 mM de MgCl2 y Buffer 1X (KCl 500 mM y 200 mM Tris-HCl pH 8.4). La desnaturalización, hibridación y extensión se realizaron a 94 °C por 20 segundos, a 52 °C por 30 segundos y a 72 °C por 90 segundos, respectivamente, durante un total de 30 ciclos; la primera desnaturalización y la última extensión fueron realizadas por cinco minutos. Los productos de PCR fueron purificados con el método de polietilenglicol al 20% (PEG 8000 y NaCl), para ser secuenciados por electroforesis capilar multicolor en un equipo (ABI 310-3100) usando los mismos cebadores empleados durante el proceso de PCR. Por último, las secuencias fueron editadas y ensambladas usando el programa Sequencher 6.1 (Gene Code Corporation).
Análisis de los datos
Diversidad y estructura genética
Para examinar la distribución de los polimorfismos dentro de las secuencias obtenidas se empleó el programa DnaSp (Librado y Rozas, 2009). Se determinó la diversidad haplotípica (h) y nucleotídica (π) para cada una de las colonias analizadas; a su vez se cuantificó la diferenciación genética entre ellas por medio de un análisis de comparación de parejas de Fst (basada en la frecuencia convencional) (Raymond y Rousset, 1995) y Φst (Excoffier et al., 1992) usando 10000 permutaciones. Ese mismo análisis fue realizado para determinar la conectividad entre la colonia anidante del Cabo de la Vela con respecto a las demás colonias anidantes registradas en el Atlántico que cuentan con información de haplotipos de 740 pb (Vélez-Zuazo et al., 2008; Browne et al., 2010 y Leroux et al., 2012). Por último, se realizó un análisis jerárquico de varianza (Amova) para determinar cómo se distribuye la variación genética entre los grupos de haplotipos registrados para el Pacífico y Caribe colombianos. Todos estos análisis fueron realizados por medio de Arlequin V.3.11 (Excoffier et al., 2005).
Análisis filogenético y tiempo de divergencia
Para establecer las relaciones filogenéticas entre los haplotipos de este estudio y los registrados en Genbank para los océanos Atlántico, Pacífico e Índico, se construyó una red median-joining por medio del programa Network V 4.6 (Bandelt et al., 1999). La información de la frecuencia de cada haplotipo fue obtenida de los trabajos realizados por Vélez-Zuazo et al. (2008), Browne et al. (2010), Nishizawa et al. (2010), Tabib et al. (2011) y Leroux et al. (2012). Los loops ambiguos formados en la red resultante se resolvieron usando varios criterios derivados de la teoría de coalescencia: 1) Criterio de frecuencia: los haplotipos son más probables a estar conectados a haplotipos con alta frecuencia que con aquellos con frecuencia baja; 2) Criterio topológico: los haplotipos son más probables a estar conectados con haplotipos centrales, que con haplotipos de los extremos; y 3) Criterio geográfico: los haplotipos son más probables a estar conectados a haplotipos de su misma población o región que a aquellos que están en poblaciones distantes (Pfenninger y Posada, 2002). Los filogrupos de la red fueron identificados cuando un grupo de haplotipos fue conectado por un solo haplotipo con mínimas diferencias.
A su vez se realizó un análisis filogenético para corroborar la existencia de grupos monofileticos de haplotipos y estimar el tiempo de separación entre las carey de la región Pacífico-Índico [se emplearon los haplotipos registrados en estudio para el Pacífico colombiano y los de Nishizawa et al. (2010) y Tabib et al. (2011)] y las del océano Atlántico [se emplearon los haplotipos registrados en este estudio para el Caribe colombiano y los registrados por Vélez-Zuazo et al. (2008), Browne et al. (2010) y Leroux et al. (2012)]. Para esto se realizaron dos análisis probabilísticos: 1) Inferencia bayesiana por medio del programa MrBayes 3.1 (Ronquist y Huelsenbeck, 2003); cuatro cadenas de Markov fueron corridas (una fría y tres calientes, utilizando el default del programa) por 5x106 generaciones con muestreo cada 1000 generaciones. Las probabilidades posteriores fueron obtenidas para el árbol consenso por regla de mayoría. 2) Máxima verosimilitud realizada empleando el programa PhyML v 3.1 (Guindon y Gascuel, 2003a), el soporte de los nodos fue evaluado mediante Bootstrap no paramétrico usando 500 réplicas (Felsenstein, 1895). En ambos métodos el modelo de evolución de secuencia empleado fue (TrN + G) determinado por ModelTest 0.1.1 (Guindon y Gascuel, 2003b; Posada, 2008). Las especies empleadas como grupo externo fueron Caretta caretta (Genbank Acc. Nos. EU179436.1 y EU179445.1), Lepidochelys olivacea (Genbank Acc. No. U40661.1) y Lepidochelys kempii (Genbank Acc. No. U40657.1).
Por último, para determinar los tiempos de divergencia del antecesor común más reciente se utilizó el programa Beast V 1.6.1 (Drummond y Rambaut, 2007). Dos puntos de calibración fueron empleados: 1) entre los géneros Caretta y Lepidochelys, 16 millones de años (Ma) (con un intervalo de confianza del 95% de 12 -20 Ma); y 2) entre Lepidochelys olivacea y L. kempii, 5 Ma (con un intervalo de confianza de 95% de 4-6 Ma) (Naro-Maciel et al., 2008). Las condiciones empleadas para el análisis fueron: modelo de evolución molecular GTR usando Gamma + sitios invariantes con cuatro categorías Gamma, junto con la asunción de un reloj molecular relajado Lognormal con una tasa de sustitución por millón de años de 0.018 (Monzón-Arguello et al., 2011). Para todos los prior se emplearon los valores predeterminados por el programa, excepto para la categoría Tree Prior para la cual se usó el modelo Yule Process. Este modelo fue seleccionado considerando: 1) el ajuste y convergencia de los datos empleando dicho modelo; 2) el alto grado de divergencia genética encontrado entre los linajes de los océanos Pacífico-Índico y Atlántico registrado en los análisis anteriores; 3) las sugerencias de otros autores de considerar dos especies dentro del género Eretmochelys basadas en diferencias de coloración y forma del caparazón [E. imbricata para el océano Atlántico y E. squamata para el Pacífico (Meylan, 1999)]; y 4) considerando que los intervalos de confianza obtenidos para los tiempos de divergencia obtenidos bajo un modelo de coalescencia fueron demasiado grandes (ver Anexo 1).
RESULTADOS
Diversidad y estructura genética
El análisis de las 45 secuencias analizadas reveló 34 sitios polimórficos en un segmento de 740 pb. Ese polimorfismo incluyó 28 transiciones, 17 entre pirimidinas (T-C; C-T), 11 entre purinas (G-A; A-G) y 6 transversiones (4 entre C-A; 1 entre C-G y 1 entre T-G), las cuales definieron 10 haplotipos: seis previamente registrados en el GenBank (Ei-A01, Ei-A02, Ei-A03, Ei-A09, Ei-A11 y Ei-A45), uno registrado en la base de datos del Bitmar en México (Ei-A63) (Alberto Abreu-Grobois, Universidad Nacional Autónoma de México. Mazatlán, México. 2008. Com. Pers.) y 3 haplotipos reportados por primera vez para el Pacífico Oriental (Ei-PCol1, Ei-PCol2 y Ei-PCol3) (Tabla 1).
En la colonia de alimentación presente en los arrecifes coralinos del PNN Gorgona se encontraron dos haplotipos nuevos (Tabla 2) hasta el momento únicos para la cuenca del Pacífico Oriental Tropical; no obstante, dos secuencias similares de 500 pb [EiJ5 y EiJ8 (número de acceso GenBank, AB485800.1 y AB485803.1, respectivamente)] fueron registrados en una colonia de alimentación ubicada en las islas Yaeyama, Japón (Nishisawa et al., 2010), las cuales son idénticas hasta los 500 pb a los haplotipos Ei-P(Col1) y Ei-P(Col2), respectivamente. La diversidad haplotípica para la colonia del PNN Gorgona fue de 0.2857 ± 0.1964 y la diversidad nucleotídica fue de 0.0009 ± 0.0008 (Tabla 2). Para las dos muestras secuenciadas del PNN Utría y Sanquianga se encontró el haplotipo Ei-P(Col3) (Tabla 2), el cual representa un registro nuevo para el Pacífico oriental tropical, sin embargo, también ha sido registrado en el golfo Pérsico como haplotipo Iran-3 (número de acceso GenBank GU997696) (Tabib et al., 2011).
Para el área de alimentación del PNN Corales del Rosario y San Bernardo se registraron cinco haplotipos de seis individuos analizados. La diversidad haplotípica para esa colonia de alimentación fue alta (h: 0.9333 ± 0.1217) comparada con otros índices encontrados en este estudio (Tabla 2). Por último, para el área de anidación del Cabo de la Vela se identificaron en total cinco haplotipos, siendo el Ei-A11 el más frecuente, seguido del haplotipo Ei-A01. Los haplotipos Ei-A03 y Ei-A63 fueron registrados en esa colonia con una baja frecuencia (Tabla 2).
Las comparaciones de parejas entre la colonia del Pacífico y las colonias del Caribe colombiano indicaron diferenciación genética significativa, y ausencia de diferenciación genética significativa entre la colonia anidante del Cabo de la Vela y la de alimentación de Corales del Rosario y San Bernardo (Φst = 0.002, p > 0.05; Fst = 0.083, p > 0.05) (Tabla 3). El Amova obtenido soporta la diferenciación genética encontrada entre el Pacífico y Caribe colombiano, con un 83.65% de la variación causada por diferencias entre esas dos regiones (p < 0.01), mientras que el 14.91% de la variación es causada por diferencias dentro de cada región; sin embargo, este último porcentaje no fue significativo (p > 0.05).
Por otro lado, todas las comparaciones de distancia genética realizadas entre la colonia reproductiva del Cabo de la Vela y ocho colonias de anidación en el mar Caribe para las cuales se tiene información de haplotipos de 740 pb, presentaron diferenciación genética significativa (Tabla 4). Las colonias que presentan mayor diferenciación genética con respecto a la colonia del Cabo de la Vela fueron Guadalupe y Barbados-Leeward, mientras que las que presentaron valores menores fueron Costa Rica y Nicaragua.
Análisis filogenético y tiempo de divergencia
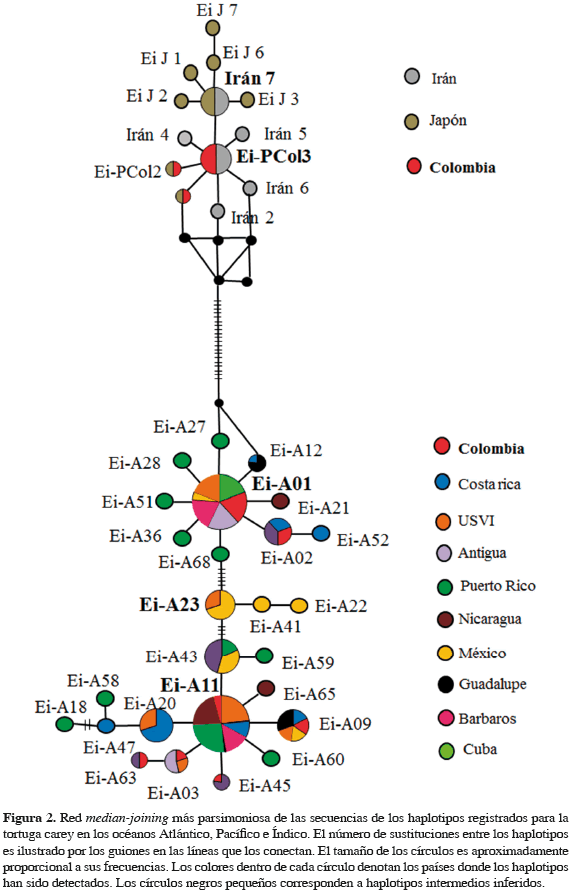
La red median-joining más parsimoniosa mostró dos filogrupos ampliamente divergentes separados por 19 sustituciones (Figura 2). El primero conformado por todos los haplotipos registrados para los océanos Pacífico e Índico, presentando dos clados, uno establecido alrededor del haplotipo Ei-P(Col3), el cual ha sido registrado en este estudio para el Pacífico colombiano además del golfo Pérsico [haplotipo Iran-3 (Tabib et al., 2011)]; esta agrupación exhibe forma de estrella incluyendo los haplotipos registrados para el PNN Gorgona y el golfo Pérsico, todos diferenciados por una sustitución. El segundo clado está formado alrededor del haplotipo Iran7 el cual fue registrado para el golfo Pérsico, no obstante, ese haplotipo también es idéntico a una de las secuencias registradas como haplotipo EiJ4 en las islas Yaeyama, Japón (500 pb). Este clado también agrupa cuatro haplotipos diferenciados por una sola sustitución, los cuales han sido registrados para Japón.
El segundo filogrupo está conformado por los haplotipos registrados para el océano Atlántico, el cual muestra dos clados divergentes separados por seis sustituciones. El primero tiene como haplotipo central a Ei-A01, uno de los más abundantes en el mar Caribe; este clado exhibe una forma de estrella e incluye ocho haplotipos cercanamente relacionados diferenciados por una sustitución, a excepción del Ei-A52, el cual está unido a Ei-A02. El segundo clado se distribuye alrededor de los haplotipos Ei-A11 y Ei-A23; el primero es también uno de los haplotipos más abundantes en el mar Caribe, y es central dentro de la red, el cual se encuentra unido a siete haplotipos diferenciados por una sustitución y cinco haplotipos con una mayor diferenciación (dos sustituciones).
En este mismo clado, se encuentra el haplotipo Ei-A23, principalmente observado en México y unido a los haplotipos Ei-41 y Ei-A22 registrados también para dicho país pero en menor frecuencia. Por último, los distintos métodos de reconstrucción filogenética utilizados (máxima verosimilitud e inferencia bayesiana) generaron topologías altamente concordantes revelando una profunda división entre los linajes de los océanos Pacífico-Índico y el Atlántico, con fuertes soporte en dichas agrupaciones. El análisis de divergencia entre los linajes del océano Atlántico y Pacífico-Índico reveló un tiempo de separación de 7.2 Ma para dichas regiones (un intervalo de confianza del 95%, límite superior e inferior de: 2.2 a 9 Ma) (Figura 3).
DISCUSIÓN
Diversidad y estructura genética
La diversidad observada en este estudio para la colonia de alimentación del PNN Gorgona es baja comparada con los índices de diversidad registrados para otras colonias de alimentación del océano Pacífico-Índico (golfo Pérsico, h: 0.69; e islas Yaeyama, h: 0.78); sin embargo, es similar a la diversidad haplotípica registrada para la tortuga verde (Chelonia mydas) en el PNN Gorgona (h: 0.30, Amorocho et al., 2012). No obstante, los valores de diversidad nucleotídica registrados para ambas especies en la misma zona difieren (tortuga carey, π: 0.0009; tortuga verde, π: 0.011); en parte, debido a las diferencias biológicas y ecológicas entre ambas especies; por ejemplo, comportamiento solitario (E. imbricata) y gregario (C. mydas) (Sanches y Bellini, 1999), tipo de dieta (Naro-Maciel et al., 2008), áreas de distribución, fluctuaciones demográficas y de proporción de sexos. Todas las anteriores, pueden generar diferencias en el tamaño efectivo de sus poblaciones, y por ende distintos valores de diversidad; así como también, el pequeño tamaño muestral incluido de la colonia de carey en el PNN Gorgona. Sin embargo, a pesar de lo anterior, la diversidad registrada en este estudio para la colonia del PNN Gorgona es un reflejo del crítico estado de la especie en el Pacífico colombiano.
Es posible, como se mencionó anteriormente, que la baja diversidad registrada para la carey en esta región de Colombia esté relacionada principalmente con el pequeño tamaño muestral analizado en este estudio. Sin embargo, existen otros aspectos que pueden estar determinándola, entre ellos, la erradicación que ha sufrido esta especie en los hábitats más accesibles de la región (Gaos et al., 2010) y, al mismo tiempo, a la fuerte explotación que soportó hasta mediados del siglo veinte por la caza indiscriminada de los escudos de su caparazón, lo que conllevó a una disminución de las poblaciones de carey en el Pacífico oriental, hasta el punto de ser considera la especie más escasa de la región e incluso extinta regionalmente (Cliffton et al., 1982) hasta 2008, cuando se comprobó su presencia en el OPO (Gaos et al., 2010).
Así mismo, otro factor que puede determinar la baja diversidad es que, según Bowen y Karl (2007), el Pacífico oriental se considera la región del océano más recientemente colonizada por la carey. Todos estos aspectos en conjunto pueden estar implicando una disminución de sus poblaciones, tanto por efecto antropogénico como por procesos de colonización, lo cual posiblemente generó reducción en el número de individuos y, por ende, disminución de la diversidad genética principalmente por efecto de deriva génica o por causa de un efecto fundador. Lo anterior ha sido registrado para otros organismos, entre ellos Dermochelys coriacea (Molfetti et al., 2013), Podocnemis lewyana (Restrepo et al., 2008) y Tursiops aduncus (Natoli et al., 2008). No obstante, para probar las hipótesis de deriva génica y/o efecto fundador es necesario aumentar el número de individuos muestreados de tortuga carey en el OPO.
Por otro lado, debido a los pocos estudios que se han realizado en el OPO sobre la tortuga carey, a la fecha no es posible determinar los linajes contribuyentes a la colonia de alimentación presente en el PNN Gorgona; si bien los haplotipos EiJ5 y EiJ8 presentan secuencias idénticas a Ei-P(Col1) y Ei-P(Col2), respectivamente, dichos haplotipos presentan una longitud de 520 pb, dejando por fuera aproximadamente tres sitios polimórficos [posiciones 554, 576 y 577 (Tabla 1)] que han sido registrados para la región control del ADNmt de las carey. Por otra parte, es importante resaltar el hallazgo del haplotipo Ei-P(Col3) encontrado en los individuos de PNN Utría y Sanquianga, el cual también ha sido registrado para el golfo Pérsico; esto más que considerarse evidencia de posible flujo génico entre ambas colonias, es probablemente debido a que el haplotipo Ei-P(Col3), según la teoría de coalescencia, puede ser considerado uno de los más ancestrales de los océanos Pacífico e Índico, ya que dicho haplotipo dentro de la red median-joining presenta una ubicación central en el filogrupo del Pacífico-Índico, y del cual derivan la mayoría de los haplotipos registrados para el Pacífico colombiano y el golfo Pérsico (Figura 2).
Por lo anterior, aún no es posible determinar el origen de los individuos registrados para el Pacífico colombiano ya que todos los haplotipos registrados para dicha región son considerados "huérfanos", pues no se conoce el origen de las poblaciones. Es posible que muchos de esos individuos provengan de grupos de anidación vecinos como El Salvador, Ecuador y otros países, pero hasta el momento esa información no está disponible. Por lo tanto, la población de carey del Pacífico colombiano debe ser considerada una unidad de manejo independiente, y no se recomienda realizar eventos de recolonización.
Los valores de diversidad genética encontrados en las colonias analizadas para la región del Caribe colombiano fueron relativamente altos comparados con los índices de diversidad registrados para Cuba (h: 0.213; π: 0.016), Guadalupe (h: 0.131; π: 0.003) y México (h: 0.363; π: 0.001), y similares a los de algunas poblaciones como Antigua (h: 0.5511; π: 0.0044), Puerto Rico (h: 0.600; π: 0.0098), Nicaragua (h: 0.612; π: 0.018) y República Dominicana (h: 0.669; π: 0.0100) (Leroux et al., 2012). Sin embargo, al comparar las dos localidades del Caribe colombiano, se observa que la colonia del Cabo de la Vela presenta índices de diversidad más bajos a los encontrados en Corales del Rosario y San Bernardo, debido posiblemente a la dominancia de los haplotipos Ei-A11 y Ei-A01, los cuales están presentes en 43 y 40% de los individuos analizados. Dichos haplotipos son considerados los más abundantes en el mar Caribe, ya que se encuentran registrados para la mayoría de las colonias de carey en la región (Antigua, Barbados, Brasil, Costa Rica, Guadalupe, Nicaragua, Puerto Rico e islas Vírgenes, entre otras). Sin embargo, a pesar de que en la colonia del Cabo de la Vela dominan esos dos haplotipos, al realizar el análisis de diferenciación genética entre ella y las demás colonias del mar Caribe (Tabla 4) se observa diferenciación estadísticamente significativa con todas las colonias anidantes analizadas, esto debido al comportamiento filopátrico y fidelidad al sitio de anidación de las hembras de tortugas marinas, lo cual las lleva a presentar una fuerte estructura genética entre colonias anidantes a escala global (Bass et al., 1996; Bowen y Karl, 2007). No obstante, colonias próximas pueden estar interconectadas, esto se observa entre la del Cabo de la Vela y la de Corales del Rosario y San Bernardo, ya que se encontró ausencia de diferenciación genética significativa entre ambas (Φst = 0.002, p > 0.05; Fst = 0.083, p > 0.05) (Tabla 3), indicando que la colonia del Cabo está contribuyendo a la de alimentación de Corales del Rosario y San Bernardo.
Por otro lado, en la colonia de anidación del Caribe colombiano se registró el haplotipo Ei-A63, el cual hasta el momento sólo había sido registrado en tres individuos presentes en una colonia de alimentación en Nicaragua (Robin ReLoux. Southwest Fisheries Science Center. La Jolla, Estados Unidos. 2009. Com. Pers.); por lo cual el hallazgo de ese haplotipo en una hembra anidante del Cabo de la Vela es una posible evidencia de que la colonia anidante del Caribe colombiano es fuente potencial de individuos para dicho país. Por último, la colonia que se alimenta en el PNN Corales del Rosario y San Bernardo presentó índices de diversidad altos, los cuales son característicos de los sitios de alimentación de las tortugas marinas en donde se congregan individuos de diferentes colonias de anidación. Es importante recalcar que en esa colonia se registraron dos haplotipos poco frecuentes en el mar Caribe (Ei-A02 y Ei-A45), particularmente Ei-A02, registrado únicamente para Nicaragua y Costa Rica.
Análisis filogenético y tiempo de divergencia
Por medio de la red de haplotipos se observó una profunda división entre los individuos de los océanos Atlántico y Pacífico-Índico. En particular para el filogrupo del Atlántico no se observó una agrupación clara entre los haplotipos, esto mismo fue registrado por Monzón-Arguello et al. (2011) y Leroux et al. (2012). En general, la agrupación de los haplotipos en esta región no se ajusta a un patrón claro de distribución, ya que todos los países tienen haplotipos distribuidos en diferentes clados. Por su parte el filogrupo del Pacífico-Índico presenta un patrón filogeográfico diferente al Atlántico, ya que se observa cierto grado de aislamiento geográfico entre sus haplotipos, si bien en la red median-joining se observa que algunos haplotipos como Iran7, Ei-PCol1 y Ei-PCol2 son idénticos a algunos de Japón. Como se mencionó anteriormente esta similitud no puede ser determinada con claridad hasta el momento, pues la longitud de dichas secuencias deja por fuera varios sitios polimórficos. Considerando lo anterior, se puede observar que la mayoría de haplotipos son exclusivos de cada país, ya que de un total de doce, cuatro son endémicos del golfo Pérsico, cinco de Japón y dos del Pacífico colombiano. Y solo un haplotipo es compartido entre Irán y el Pacífico colombiano (Ei-PCol3).
Esta estructuración ha sido registrada incluso a menor escala; un trabajo realizado por Mostafavi et al. (2011) empleando microsatélites registra que dos islas del golfo Pérsico que no están a más de 350 km de distancia presentan una fuerte diferenciación genética. También el trabajo realizado por Reece et al. (2005) registra que la tortuga carey presenta patrones característicos de flujo génico restringido por aislamiento por distancia a causa de su alta fidelidad al sitio de anidamiento y natal homing. Es posible que este patrón sea más marcado entre los océanos Pacífico e Índico, pues la distancia que hay entre estas dos regiones es de más de 10000 km (i.e. entre Irán y Japón la distancia es de aproximadamente 5000 km).
Por otro lado, los resultados presentes en esta investigación soportan el origen monofilético de los linajes de ADNmt para las carey del Atlántico y del Pacífico-Índico, indicando un tiempo de divergencia entre dichos linajes similar al registrado para el género Chelonia (tiempo de divergencia entre la tortuga verde del Atlántico e Índico-Pacífico: 7 Ma con un un intervalo de confianza del 95%: 1.92 y 13.37 Ma) y género Lepidochelys (tiempo de divergencia entre L. kempii distribuida en el océano Atlántico y L. olivácea del océano Pacífico: 5 Ma con un intervalo de confianza del 95%: 4 y 6 Ma) (Naro-Maciel et al., 2008). Esos tiempos de divergencia indican una profunda división ocurrida entre el Plioceno y el Pleistoceno, períodos caracterizados por grandes cambios climáticos y eventos geológicos, entre ellos el levantamiento del istmo de Panamá, el cual es considerado como una de las dos barreras primarias que separa la fauna marina tropical del Atlántico y el Pacífico e influye fuertemente los patrones de especiación y biodiversidad (Bowen y Karl, 2007). Recientemente, O'Dea et al. (2007) publicaron información acerca de registros fósiles en el istmo de Panamá que les permitió determinar que la formación de esa barrera empezó hace aproximadamente 10 Ma y que la mayoría de los cambios biológicos y ambientales que ocurrieron dentro del mundo marino en respuesta al levantamiento del istmo ya habían terminado hace 3.5 Ma. Por lo tanto, el tiempo de divergencia registrado en este estudio concuerda con la información geológica que se tiene hasta el momento de la formación del istmo de Panamá, indicando que si bien el cierre total se dio hace 3.5 Ma, su proceso de levantamiento tuvo efecto en la fauna marina mucho antes de dicho cierre.
Por último, los análisis filogenéticos y el tiempo de divergencia registrado en este estudio para la tortuga carey, revelan una profunda e importante divergencia entre los linajes de los océanos Pacífico-Índico y Atlántico, indicando que posiblemente dichos linajes deben ser considerados como especies plenas, considerando además de los resultados acá expuestos, las diferencias en tamaño y coloración (Meylan, 1999), así como dieta y uso de hábitat (Gaos et al., 2010) en cada región (Pacífico-Índico y Atlántico). Sin embargo, es importante para este tipo de conclusión realizar estudios más detallados, empleando tanto el análisis de más marcadores mitocondriales (i.e. citocromo oxidasa I y citocromo b, entre otros), como nucleares, que permitirían tener una apreciación más completa de la historia de dichos linajes.
Implicaciones para la conservación
La carey actualmente es considerada una de las especies de tortugas marinas con mayor riesgo de extinción a nivel mundial, ya que sus poblaciones han presentado disminuciones drásticas en toda su distribución. En la actualidad, las playas de anidación que históricamente recibían cientos o miles de tortugas cada año, ahora reciben un poco más de una docena de hembras anidantes (Spotila, 2004; Bowen et al., 2007). Varios son los factores que han contribuido a la disminución sus poblaciones, entre ellos está la caza ilegal por los escudos de su caparazón, caza furtiva de huevos, destrucción de hábitat, desarrollo costero y captura incidental en pesquerías (Mast et al., 2004). Sumado a lo anterior, una de las tantas amenazas que presenta esta especie en nuestro país es el desconocimiento total de sus poblaciones, lo cual impide el establecimiento de estrategias de conservación eficaces.
Por lo anterior, esta investigación es de gran importancia para la conservación de las carey en Colombia pues brinda información valiosa para el establecimiento de estrategias de conservación por parte de las autoridades colombianas, ya que por medio de la identificación de haplotipos de ADNmt, los índices de diversidad, estructura y relaciones genealógicas se pudo determinar que: 1) La colonia de alimentación presente en el PNN Gorgona es de gran importancia para la toda la región del OPO ya que presenta haplotipos nunca antes registrados para el Pacífico oriental, lo cual evidencia la necesidad de conservar esa colonia. Sin embargo la existencia de esos haplotipos huérfanos subrayan la necesidad de muestreo adicional en el PNN Gorgona, así como también, la necesidad de expandir los análisis genéticos a otras colonias de anidación y alimentación a lo largo de las costas del Pacífico, lo cual brindaría bases sólidas para implementar estrategias de conservación en la región (i.e. el corredor marino del Pacífico oriental tropical, el cual es una iniciativa dirigida por los gobiernos de Ecuador, Colombia, Panamá y Costa Rica para asegurar la integridad ecológica de áreas marinas protegidas). 2) La evidencia de haplotipos compartidos entre las colonias del Caribe colombiano y el resto del Caribe, demuestran el papel esencial que tienen los planes de conservación entre los diferentes países de la región para asegurar la protección de todos los estadios de vida de las carey, con el fin de minimizar los riesgos de mortalidad en la región y asegurar la protección a largo plazo de la especie.
AGRADECIMIENTOS
Los autores quieren expresar sus más sinceros agradecimientos al Instituto de Investigaciones Marinas y Costeras (Invemar), al Centro de Investigación para el Manejo Ambiental y Desarrollo (Cimad) y al Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, por el apoyo financiero, técnico y logístico prestado a lo largo de ésta investigación. Al Dr. Alberto Abreu-Grobois por su ayuda en la identificación de algunos haplotipos. Al Dr. Gustavo Sebastián Cabanne por sus sugerencias en el análisis de los datos.
BIBLIOGRAFÍA
1 Abreu-Grobois, F., J. Horrocks, A. Formia, R. LeRoux, X. Vélez-Zuazo, P. Dutton, L. Soares, P. Meylan y D. Browne. 2006. New mDNA Dloop primers which work for a variety of marine turtle species may increase the resolution capacity of mixed stock analysis. 178-179. En: Frick, M., A. Panagopoulou, A. Rees y K. Williams (Eds.). 26th Annual Symposium on Sea Turtle Biology and Conservation. Archelon, Creta. 376 p. [ Links ]
2 Amorocho, D. F, F. A. Abreu-Grobois, P. H. Dutton y R. D. Reina. 2012. Multiple distant origins for green sea turtles aggregating off Gorgona Island in the Colombian Eastern Pacific. PLoS ONE, 7: 1-12. [ Links ]
3 Arcos, M., A. Barrero, G. Guarín y P. Quintero. 2002. Establecimiento y comparaciones de características estructurales de puntos focales de anidación de tortugas marinas ya establecidos en el sector de Arrecifes Parque Nacional Natural. Seminario de investigación, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 54 p. [ Links ]
4 Avise, J. C. 2000. Phylogeography: the history and formation of species. Harvard University Press, Cambridge. 447 p. [ Links ]
5 Bandelt, H. J., P. Forster y A. Röhl. 1999. Median-joining networks for inferring intraspecific phylogenies. Mol. Biol. Evol., 16 (1): 37-48. [ Links ]
6 Bass, A. 1999. Genetic analysis to elucidate the natural history and behavior of hawksbill turtles (Eretmochelys imbricata) in the wider Caribbean: a review and re-analysis. Chelonian Cons. Biol., 2: 195-199. [ Links ]
7 Bass, A., D. Good, K. Bjorndal, J. Richardson, Z. Hillis, J. Horrocks y B. Bowen. 1996. Testing models of female reproductive migratory behavior and population structure in the Caribbean hawksbill turtle, Eretmochelys imbricata, with mDNA sequences. Mol. Ecol., 5: 321-328. [ Links ]
8 Blumenthal, J., F. Abreu-Grobois, T. Austin, A. Broderick, M. Bruford, M. Coyne, G. Ebanks-Petrie, A. Formia, P. Meylan, A. Meylan y B. Godley. 2009. Turtle groups or turtle soup: dispersal patterns of hawksbill turtles in the Caribbean. Mol. Ecol., 18: 4841-4853. [ Links ]
9 Bowen, B. y S. Karl. 2007. Population genetics and phylogeography of sea turtles. Mol. Ecol., 16: 4886-4907. [ Links ]
10 Bowen, B. W, A. B. Meylan, J. P. Ross, C. J. Limpus, G. H. Balazs y J. C. Avise. 1992. Global population structure and natural history of the green turtle (Chelonia mydas) in terms of matriarchal phylogeny. Evolution, 46: 865-881. [ Links ]
11 Bowen, B., A. Bass, A. García-Rodríguez, C. Diez, R. Van Dam, A. Bolten, K. Björndal, M. Miyamoto y R. Ferl. 1996. Origin of hawksbill turtles in a Caribbean feeding area as indicated by genetic markers. Ecol. Appl., 6: 566-572. [ Links ]
12 Bowen, B., A. Bass, S. Chow, M. Bostrom, K. Bjorndal, A. Bolten, T. Okuyama, B. Bolker, S. Epperly, E. Lacasella, D. Shaver, M. Dodd, S. Hopkinsmurphy, J. Musick, M. Swingle, K. Baransky, W. Teas, W. Witzell y P. Dutton. 2004. Natal homing in juvenile loggerhead turtles (Caretta caretta). Mol. Ecol., 13: 3797-3808. [ Links ]
14 Bowen, B., W. Grant y Z. Hillis-Starr. 2006. Mixed-stock analysis reveals the migrations of juvenile hawksbill turtles (Eretmochelys imbricata) in the Caribbean Sea. Mol. Ecol., 16: 49-60. [ Links ]
15 Bowen, B., W. Grant, Z. Hillis-Starr, D. Shaver, K. Björndal, A. Bolten y A. Bass. 2007. Mixed-stock analysis reveals the migrations of juvenile hawksbill turtles (Eretmochelys imbricata) in the Caribbean Sea. Mol. Ecol., 16: 49-60. [ Links ]
16 Browne, D. C., J. A. Horrocks y F. A. Abreu-Grobois. 2010. Population subdivision in hawksbill turtles nesting on Barbados, West Indies, determined from mitochondrial DNA control region sequences. Conservation Genetics, 11: 1541-1546. [ Links ]
17 Canin, J. 1989. International trade in sea turtle products. 27-29. En: Eckert, S. A., K. L. Eckert, y T. H. Richardson (Eds.). Proc. Ninth Annual Workshop on Sea Turtle Conservation and Biology, NOAA Tech. Mem. NMFS-SEFC-232, Jekyll Island. Estados Unidos. 251 p. [ Links ]
18 Ceballos-Fonseca, C. 2004. Distribución de playas de anidación y áreas de alimentación de tortugas marinas y sus amenazas en el Caribe colombiano. Bol. Invest. Mar. Cost., 33: 79-99. [ Links ]
19 Cliffton, K., D. O. Cornejo y R. S. Felger. 1982. Sea turtles of the Pacific coast of Mexico. 199-209. En: Bjorndal, K. A. (Ed.). Biology and conservation of sea turtles. Smithsonian Institution Press, Washington. 423 p. [ Links ]
20 Cornelius, S. E. 1982. Status of sea turtles along the Pacific coast of Middle America. 211-220. En: Bjorndal, K. A. (Ed.). Biology and conservation of sea turtles. Smithsonian Institution Press, Washington. 423 p. [ Links ]
21 Díaz-Fernández, R., T. Okayama, T. Uchiyama, E. Carrillo, G. Espinosa, R. Marquez, C. Diez y H. Koike. 1999. Genetic sourcing for the hawksbill turtle, Eretmochelys imbricata, in the northern Caribbean region. Chelonian Cons. Biol., 2: 296-300. [ Links ]
22 Drummond, A. J. y A. Rambaut. 2007. Beast: Bayesian evolutionary analysis by sampling trees. BMC Evol. Biol., 7: 214. [ Links ]
23 Excoffier, L, P. E. Smouse y J. M. Quattro. 1992. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics, 131: 479-491. [ Links ]
24 Excoffier, L., G. Laval y S. Schneider. 2005. Arlequin: A software for population genetics data analysis. Genetic and Biometry Laboratory, University of Geneva, Ginebra. 141 p. [ Links ]
25 Felsenstein, J. 1985. PHYLIP. The Phylogeny Inference Package, versión 3.5. American Naturalist, 125: 1-15. [ Links ]
26 FitzSimmons, N., A. Goldizen, J. Norman, C. Moritz, J. Miller y C. Limpus. 1997. Philopatry of male marine turtles inferred from mitochondrial markers. Proc. Nat. Acad. Sci., 94: 8912-8917. [ Links ]
27 Gaos, A., F. Abreu-Grobois, J. Alfaro-Shigueto, D. Amorocho, R. Arauz, A. Baquero, R. Briseño, D. Chacón, C. Dueñas, C. Hasbun, M. Liles, G. Mariona, C. Muccio, J. Muñoz, W. Nichols, M. Peña, J. Seminoff, M. Vásquez, J. Urteaga, B. Wallace, I. Yañez y P. Zárate. 2010. Signs of hope in the eastern Pacific: international collaboration reveals encouraging status for the severely depleted population of hawksbill turtles Eretmochelys imbricata. Oryx, 44: 595-601. [ Links ]
28 Gaos, A., R. Lewison, B. Wallace, I. Yañez, M. Liles, N. Wallace, A. Baquero, C. Hasbun, M. Vásquez, J. Urteaga y F. Seminoff. 2012. Spatial ecology of critically endangered hawksbill turtles Eretmochelys imbricata: implications for management and conservation. Mar. Ecol. Progr. Ser., 450: 181-194. [ Links ]
29 Garduño-Andrade, M. 2000. Fecundidad de la tortuga de carey Eretmochelys imbricata en Las Coloradas, Yucatán, México. Cienc. Pesq., 14: 67-70. [ Links ]
30 Guindon, S. y O. Gascuel. 2003a. A simple, fast, and accurate algorithm to estimate large phylogenies by maximum likelihood. Syst. Biol., 52 (5): 696-704. [ Links ]
31 Guindon, S. y O. Gascuel. 2003b. PhyML: A simple, fast and accurate algorithm to estimate large phylogenies by maximum likelihood. System. Biol., 5: 696-704. [ Links ]
32 Lara-Ruiz, P., G. López, F. Santos y L. Soares. 2006. Extensive hybridization in hawksbill turtles (Eretmochelys imbricata) nesting in Brazil revealed by mDNA analyses. Cons. Gen., 7: 773-781. [ Links ]
33 León, Y. y K. Björndal. 2002. Selective feeding in the hawksbill turtle, an important predator in coral reef ecosystems. Mar. Ecol. Prog. Ser., 245: 249-258. [ Links ]
34 Leroux, R. A, H. P. Dutton, F. A. Abreu-Grobois, C. J. Lagueux, C. L. Campbell, E. Delcroix, J. Chevalier, J. A. Horrocks, Z. Hillis-Starr, S. Troëng, E. Harrison y S. Stapleton. 2012. Re-examination of population structure and phylogeography of hawksbill turtles in the wider Caribbean using longer mtDNA sequences. J. Heredity, 103 (6): 806-820. [ Links ]
35 Librado, P. y J. Rozas. 2009. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 25: 1451-1452. [ Links ]
36 Mast, R. B., B. J. Hutchnson y N. J. Pi Lcher. 2004. IUCN SSC Marine Turtle Specialist Group news first quarter 2004. Marine Turtle Newsletter, 104: 21-22. [ Links ]
37 McCormick, C. C. 1997. Porque ellas también tienen derecho a seguir dejando huella. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina, Fase II. Coralina, San Andrés, Colombia. 67 p. [ Links ]
38 McCormick, C. C. 1998. Diagnóstico actual de las tortugas marinas del archipiélago de San Andrés, Providencia y Santa Catalina. Coralina, San Andrés, Colombia. 41 p. [ Links ]
39 Meylan, A. 1999. Status of the hawksbill turtle (Eretmochelys imbricata) in the Caribbean region. Chelonian Cons. Biol., 2: 177-184. [ Links ]
40 Molfetti, E., S. Torres Vilaca, J. Y. Georges, V. Plot y E. Delcroix. 2013. Recent demographic history and present fine-scale structure in the Northwest Atlantic leatherback (Dermochelys coriacea) turtle population. PLoS ONE, 8: 1-11. [ Links ]
41 Monzón-Argüello, C., C. Rico, A. Marco, P. López y L. López-Jurado. 2010. Genetic characterization of eastern Atlantic hawksbill turtles at a foraging group indicates major undiscovered nesting populations in the region. J. Exp. Mar. Biol. Ecol., 387: 9-14. [ Links ]
42 Monzón-Argüello, C., N. Loureiro, C. Delgado, A. Marco, J. López, M. Gómez y F. Abreu-Grobois. 2011. Príncipe island hawksbills: Genetic isolation of an eastern Atlantic stock. J. Exp. Mar. Biol. Ecol., 407: 345-354. [ Links ]
43 Mortimer, J. A. y M. Donnelly. 2008. Eretmochelys imbricata. IUCN red list of threatened species v. 2010.1. See http://www.iucnredlist.org. 01/04/2014. [ Links ]
44 Mortimer, J., M. Donnelly, A. Meylan y P. Meylan. 2007. Critically endangered hawksbill turtles: Molecular genetics and the broad view of recovery. Mol. Ecol., 16: 3516-3517. [ Links ]
45 Mostafavi, G., S. Shahnavaz, M. Noroozi, M. R. Fatemi, M. H. Shahhosseiny y A. Mahvari. 2011. Population genetic of Eretmochelys imbricata in two Islands in the northern part of the Persian Gulf using microsatellite markers. J. Mar. Sci. Eng., 1: 69-73. [ Links ]
46 Naro-Maciel, E., M. Le, N. N. FitzSimmons y G. Amato. 2008. Evolutionary relationships of marine turtles: a molecular phylogeny based on nuclear and mitochondrial genes. Mol. Phyl. Evol., 2: 659-662. [ Links ]
47 Natoli, A., E. M. Victor, A. Peddemors y E. Hoelzel. 2008. Population structure of bottlenose dolphins (Tursiops aduncus) impacted by bycatch along the east coast of South Africa. Cons. Gen., 9: 627-636. [ Links ]
48 Nezhad, S. R., E. Modheji y H. Zolgharnein. 2012. Polimorphism analysis of mitochondrial DNA control region of hawksbill turtles (Eretmochelys imbricata) in the Persian Gulf. J. Fish. Aq. Sci., 7: 339-345. [ Links ]
49 Nishizawa, H., J. Okuyama, O. Abe, M. Kobayashi, K. Yoseda y N. Arai. 2009. Genetic diversity of the green turtle nesting populations in Yaeyama Archipelago, Japan. Proc 4th International Symposium on Seastar2000 and Asian Bio-logging Science, 27: 15-17. [ Links ]
50 Nishizawa, H., J. Okuyama, M. Kobayashi, O. Abe y N. Arai. 2010. Comparative phylogeny and historical perspectives on population genetics of the Pacific Hawksbill (Eretmochelys imbricata) and green turtles (Chelonia mydas), inferred from feeding populations in the Yaeyama Islands, Japan. Zool. Sci., 27: 14-18. [ Links ]
51 Nordborg, M. y H. Innan. 2002. Molecular population genetics. Curr. Opin. Plant. Biol., 5: 69-73. [ Links ]
52 O'Dea, A., J. Jackson, H. Fortunato, J. Smith, L. D'Croz, K. Johnson y J. Todd. 2007. Environmental change preceded Caribbean extinction by 2 million years. Proc. Nat. Acad. Sci., 104 (13): 5501-5006. [ Links ]
53 Okayama, T., R. Díaz-Fernández, M. Baba, O. Halim, N. Azeno y H. Koike. 1999. Genetic diversity of the hawksbill turtle in the Indo-Pacific and Caribbean Regions. Chelonian Cons. Biol., 2: 362-367. [ Links ]
54 Pfenninger, M. y D. Posada. 2002. Phylogeographic history of the land snail Candidula unifasciata (Helicellinae, Stylommatophora): fragmentation, corridor migration, and secondary contact. Evolution, 56 (9): 1776-1788. [ Links ]
55 Posada, D. 2008. jModelTest: phylogenetic model averaging. Mol. Biol. Evol., 25 (7): 1253-1256. [ Links ]
56 Raymond, M. y F. Rousset. 1995. An exact test for population differentiation. Evolution, 49: 1280-1283. [ Links ]
57 Reece, J. S., T. A. Castoe y C. L. Parkinson. 2005. Historical perspectives on population genetics and conservation of three marine turtle species. Cons. Gen., 6: 235-251. [ Links ]
58 Restrepo, A, C. B. Brian y V. P. Páez. 2008. Genetic variability in the Magdalena river turtle, Podocnemis lewyana (Duméril, 1852), in the Mompos depression, Colombia. Actual. Biol., 89: 151-159. [ Links ]
60 Rincón-Díaz, M. P. y C. J. Rodríguez-Zárate. 2004. Characterization of nesting and feeding areas of sea turtles in San Bernardo Archipelago, Colombian Caribbean. Bulletin of Marine and Coastal Research, 33: 137-158. [ Links ]
61 Rincón, M. P., D. F. Rivera, C. J. Rodríguez y J. P. Tello. 2001. Establecimiento y caracterización estructural de puntos focales de anidación en el sector de Arrecifes, Parque Nacional Natural Tayrona, Caribe colombiano. Seminario de investigación, Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 67 p. [ Links ]
62 Roberts, M., T. Schwartz y S. Karl. 2004. Global population genetic structure and male-mediated gene flow in the green sea turtle (Chelonia mydas): analysis of microsatellite loci. Genetics, 166: 1857-1870. [ Links ]
63 Ronquist, F. y J. P. Huelsenbeck. 2003. Mrbayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics, 19:1572-1574. [ Links ]
64 Sanches, T. M. y C. Bellini. 1999. Juveniles Eretmochelys imbricata and Chelonia mydas in the Archipelago of Fernando de Noronha, Brazil. Chelonian Cons. Biol., 3: 308-311. [ Links ]
65 Spotila, J. R. 2004. Sea turtles: a complete guide to their biology, behavior, and conservation. The Johns Hopkins University Press and Oakwood Arts, Baltimore, EE. UU. 240 p. [ Links ]
66 Tabib, M., H. Zolgharnein, M. Mohammadi, M. Salari-Aliabadi, A. Qasemi, S. Roshani, H. Rajabi-Maham y F. Frootan. 2011. mDNA variation of the critically endangered hawksbill turtle (Eretmochelys imbricata) nesting on Iranian islands of the Persian Gulf. Gen. Mol. Res., 3: 1499-1503. [ Links ]
67 Traffic. 2002. Revisión de Cites sobre la explotación, comercio y manejo de tortugas marinas en las Antillas menores, Centro América, Colombia y Venezuela. Informe interino de un estudio comisionado por Traffic Internacional a nombre de Cites, Santiago de Chile. 17 p. [ Links ]
68 Troeng, S., P. Dutton y D. Evans. 2005. Migration of hawksbill turtles Eretmochelys imbricata from Tortuguero, Costa Rica. Ecography, 28: 394-402. [ Links ]
69 Vélez-Zuazo, X., W. Ramos, R. Van Dam, C. Diez, A. Abreu-Grobois y B. Witherington. 2008. Dispersal, recruitment and migratory behavior in a hawksbill sea turtle aggregation. Mol. Ecol., 17: 839-853. [ Links ]
FECHA DE RECEPCIÓN: 22/06/2012 FECHA DE ACEPTACIÓN: 16/03/2014
*Contribución No. 1143 del Instituto de Investigaciones Marinas y Costeras (Invemar).