Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.44 no.1 Santa Marta Jan./June 2015
ANÁLISIS HISTÓRICO DE LA INCIDENCIA DE CIGUATERA EN LAS ISLAS DEL CARIBE DURANTE 31 AÑOS: 1980 - 2010
HISTORICAL ANALYSIS OF CIGUATERA INCIDENCE IN THE CARIBBEAN ISLANDS DURING 31 YEARS: 1980 - 2010
Juan Sebastián Celis1 y José Ernesto Mancera Pineda1,2,3
1 Universidad Nacional de Colombia, sede Caribe. Grupo Modelación de Ecosistemas Costeros. San Andrés, Colombia. jscelisme@unal.edu.co.
2 Universidad Nacional de Colombia, Sede Bogotá. Facultad de Ciencias. Departamento de Biología, Bogotá, Colombia. Grupo Modelación de Ecosistemas Costeros. jemancerap@unal.edu.co.
3 Comisión Oceanográfica Intergubernamental. Grupo de trabajo IOC ANCA-Iocaribe, Algas Nocivas del Caribe.
RESUMEN
La ciguatera es una enfermedad causada por el consumo de peces que han acumulado ciguatoxinas liposolubles, producidas por dinoflagelados de los géneros Gambierdiscus, Ostreopsis, Coolia y Prorocentrum. El verdadero alcance de la enfermedad y su impacto en el turismo y la salud pública es poco conocida. Por tal motivo, se analizó la incidencia de ciguatera en los estados insulares del Caribe (EIC) y en la isla de San Andrés (SAI), en busca de tendencias espaciales y temporales. A través de los informes epidemiológicos obtenidos del Centro Epidemiológico del Caribe (CAREC) y de la Secretaría de Salud Departamental de SAI, se calculó la incidencia per cápita de ciguatera en el período comprendido entre 1980 - 2010 para los EIC y 2007 - 2011 para SAI. Los datos fueron analizados mediante pruebas t, tasas de incidencia y análisis de ranking. Los resultados muestran que en el período 1980-2010 hubo 10710 casos registrados de 18 países del CAREC, con una incidencia anual promedio del 42/100 000. Asimismo, hubo un aumento entre los períodos 1980-1990 y 2000- 2010, con un promedio anual calculado a partir de los casos registrados de 34.2 y 45.2 / 100 000, respectivamente. La isla de Montserrat presentó la mayor incidencia en la región, 350/100 000 mientras que SAI presentó una incidencia de 25/100 000 habitantes, ocupando el octavo lugar en comparación con las islas analizadas. La proporción de las tasas para los países CAREC (incidencia anual promedio de 2000 a 2010 / incidencia media anual de 1980 a 1990) fue de 1.36, por lo que hubo un aumento del 32% en la incidencia anual promedio entre los países y casi el 300% entre los dos períodos de tiempo. El nivel de incidencia registrada de ciguatera en el Caribe ha aumentado en los últimos 31 años, principalmente el Caribe Oriental. Islas como Bahamas, Antigua y Barbuda contribuyen en gran medida al aumento registrado. Teniendo en cuenta que el modelo de desarrollo de gran parte de la región se basa en la industria del turismo y el pescado es una fuente de proteínas importante para las comunidades del Caribe, se puede concluir que la ciguatera es un problema creciente que se espera que aumente de forma paralela a los cambios ambientales.
PALABRAS CLAVES: Ciguatera, Caribe, Salud pública, San Andrés, Resiliencia.
ABSTRACT
Ciguatera fish poisoning is a seafood-borne illness caused by the consumption of fish that have accumulated lipid-soluble ciguatoxins, produced by dinoflagellates of the genera Gambierdiscus, Ostreopsis, Coolia and Prorocentrum. The true extent of the disease and its impact on tourism and public health on the Caribbean islands is poorly understood. For this reason, we analyze the incidence of ciguatera in the Caribbean states (CS) and San Andrés Island (SAI), seeking spatial and temporal trends. Through epidemiological reports obtained from the Caribbean Epidemiology Centre (CAREC) and the Departmental Health Secretariat of SAI, the per capita incidence of ciguatera has been calculated for the periods 1980 to 2010 and 2007 to 2011, respectively. Subsequently the data were analyzed using t tests, incidence rate ratio and rank correlation. The data show that, over the period 1980-2010, there were 10 710 cases reported from 18 CAREC countries, with an average annual incidence of 42/100 000. There was an increase between the periods 1980-1990 and 2000-2010 with annual averages calculated from reported cases of 34.2 and 45.2 / 100 000 respectively. The island of Montserrat presented the highest incidence in the region, 350 / 100 000 while SAI showed an incidence of 25/100 000 inhabitants, occupying the eighth position among the analyzed islands. The rate ratio (average annual incidence 2000-2010 / average annual incidence 1980-1990) was 1.36, so there was a 32% increase in the average annual incidence among CAREC countries and almost 300% between the two time periods. The ciguatera incidence level in the Caribbean has increased over the last 31 years, mainly in the Eastern Caribbean. The Bahamas, Antigua and Barbuda contribute greatly to the reported increase. Considering that the development model of much of the region is based on the tourism industry and that fish is a major protein source for Caribbean communities, it can be concluded that ciguatera is a growing problem which is expected to increase in parallel with environmental change.
KEYWORDS: Ciguatera, Caribbean, Public health, San Andrés Island, Resilience.
INTRODUCCIÓN
La ciguatera es una enfermedad trasmitida principalmente por el consumo de pescado contaminado con toxinas de origen natural (Bagnis et al., 1980), que afecta cada año entre 25 000 (Lewis y Stelin, 1992) y 500 000 (Stinn et al., 1998) personas en el mundo. El principal organismo que la causa es el dinoflagelado Gambierdiscus toxicus (Adachi y Fukuyo, 1979), que vive sobre macroalgas colonizadoras de arrecifes de coral (Lehane y Lewis, 2000). Las toxinas entran en la red trófica cuando peces herbívoros consumen G. toxicus mientras forrajean sobre las macroalgas (Yasumoto et al., 1977; Bagnis et al., 1980; Bagnis, 1981). Las toxinas se acumulan en los tejidos de los peces (Legrande et al., 1992) y se bioacumulan en las especies depredadoras de los niveles más altos de la red trófica, con el ser humano como consumidor final. Más de 300 especies de peces han sido registradas como vectores de ciguatera, siendo las especies de las familias Sphyraenidae (barracuda), Muraenidae (morena), Scombridae (sierra) y Lutjanidae (pargo), todas ellas carnívoras, las fuentes más comunes de toxinas (Lehane y Lewis, 2000).
La mayoría de los estudios sobre ciguatera se han enfocado en los aspectos clínicos y epidemiológicos (Chateau-Degat et al., 2005), menor esfuerzo se ha hecho en elucidar las interacciones entre toxinas, sustratos algales y la ecología del fenómeno. Según Goater et al. (2011), la incidencia de ciguatera probablemente refleja la dificultad de los arrecifes de coral para aclimatarse al efecto acumulativo de la variación de las condiciones ambientales. Existen numerosas hipótesis para explicar la temporalidad de la producción de toxinas (Chinain et al., 1999; Chateau- Degat et al., 2005), por ejemplo, temperatura superficial del océano (Chinain et al., 1999; Hales et al., 1999; Chateau-Degat et al., 2005), crecimiento poblacional de G. toxicus (Yasumoto et al., 1980; Bagnis, 1981; Bomber et al., 1988; Cook et al., 2004; Chateau-Degat et al., 2007), eventos de blanqueamiento de coral (Chinain et al., 1999), daño al arrecife de coral producido por el desarrollo de infraestrucura (Bagnis et al., 1980; Anderson et al., 1983; Ruff, 1989; Hearnden et al., 2003), luz solar, niveles de nutrientes, corrientes oceánicas, vientos (Bomber et al., 1988) y eventos de lluvia (Anderson et al., 1983). Se ha sugerido que los brotes ocurren solo donde las condiciones ambientales favorecen el crecimiento de cepas de G. toxicus genéticamente tóxicas (Bagnis et al., 1980). La ocurrencia de la ciguatera es más evidente en las regiones donde la temperatura superficial del mar es alta, ya que temperaturas de ≥29 °C permiten un crecimiento máximo de las poblaciones de Gambierdiscus (Tester et al., 2010).
En el Caribe se han registrado casos de ciguatera desde el siglo XVIII (Halstead, 1967). Patrones de uso de recursos por parte de los grupos Arawak y Caribe que habitaban el Caribe oriental podrían indicar que ellos también enfrentaron problemas con esta enfermedad (Price, 1966). Al igual que otros tipos de intoxicación marina, la ciguatera es subvalorada en gran parte del Caribe, lo que hace altamente pertinente su estudio en la región, más aún si se considera que menos del 0.1% de los intoxicados acude a los servicios de salud (Tosteson, 1995). Las señales y síntomas varían ampliamente e incluyen más de 150 posibles síntomas, lo cual dificulta la estandarización de su diagnóstico (Fauci et al., 2008).
En cuanto a los registros de intoxicación por ciguatera en la isla de San Andrés (SAI), se registraron dos brotes en 1997, los cuales afectaron a 16 turistas y 9 residentes (Arencibia et al., 2009). En SAI se determinó la presencia de dinoflagelados tóxicos epifitos en las praderas de pastos marinos de los sectores norte y oriente de la isla en aguas costeras, encontrando siete especies toxinogénicas de dinoflagelados pertenecientes a los géneros Prorocentrum y Ostreopsis, con densidades celulares bajas comparadas con estudios en otros sitios del Caribe, con ámbitos entre 0 y 836 cel/peso seco. Las especies encontradas son conocidas por producir toxinas que causan diarrea y ciguatera, intoxicaciones que ya han sido documentadas en la isla. Los autores de ese estudio consideran que la nitrificación junto con el poco recambio de agua, puede favorecer el desarrollo de los dinoflagelados tóxicos más que el de otros microorganismos (Rodríguez et al., 2010).
Según la FAO, en las pasadas dos décadas las intoxicaciones marinas parecen haberse incrementado en frecuencia, intensidad y distribución geográfica (Hallegraeff et al., 2003), constituyendo una amenaza a la seguridad alimentaria y nutricional, tanto en mares tropicales como fríos. Para el Pacífico sur se ha registrado un aumento de 60% de incidencia de ciguatera en los últimos 30 años (Skinner et al., 2011) y se considera que podría incrementarse aún más, debido principalmente a cambios en los patrones climáticos globales, degradación del ambiente costero marino y el aumento de la explotación de los recursos marino-costeros (Stinn et al., 1998; Tester et al., 2010). En consecuencia, la preocupación sobre el impacto de las intoxicaciones alimentarias también está en aumento tanto por su impacto en la salud pública como en el turismo. En la actualidad, más de 116 millones de personas viven en las costas del Caribe y más de 25 millones de turistas visitan al año esta región, la mayoría de los cuales pasan la mayor parte de su tiempo en áreas costeras, es así que el ingreso del turismo por sí solo aporta más de $25 mil millones de dólares al año a la región (Burke y Maidens, 2005).
La presente investigación se llevó a cabo con el fin de establecer si, al igual que en el Pacífico, la incidencia de ciguatera ha aumentado en el Caribe en las últimas tres décadas. Los datos de SAI se incluyen con el fin de comparar con las demás islas del Caribe, así como para determinar el aumento de incidencia en la isla. En segunda instancia se buscaron patrones o tendencias en la incidencia de ciguatera en la región Caribe, estableciendo su distribución, frecuencia y relación con fenómenos como el blanqueamiento de coral y con los factores demográficos de las islas del Caribe.
ÁREA DE ESTUDIO
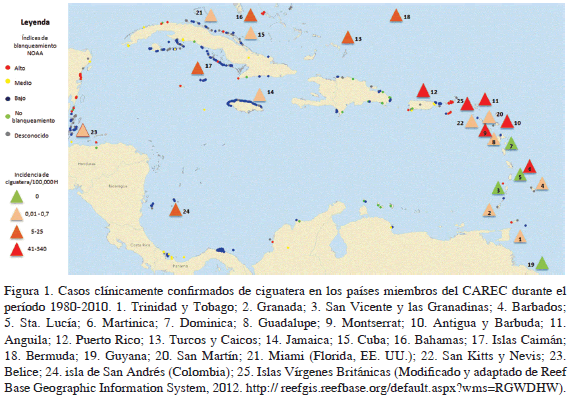
Con el fin de abarcar el mayor número localidades del Gran Caribe, el presente trabajo consideró los datos epidemiológicos y los registros de Trinidad y Tobago, Granada, San Vicente y las Granadinas, Barbados, Santa Lucía, Martinica, Dominica, Guadalupe, Montserrat, Antigua y Barbuda, Anguila, Puerto Rico, Turcas y Caicos, Jamaica, Cuba, Bahamas, Islas Caimán, Bermuda, Guyana, San Martín, Miami (Florida, EE.UU.), San Kitts y Nevis, Belice, isla de San Andrés (Colombia) e islas Vírgenes Británicas (Figura 1).
MATERIALES Y MÉTODOS
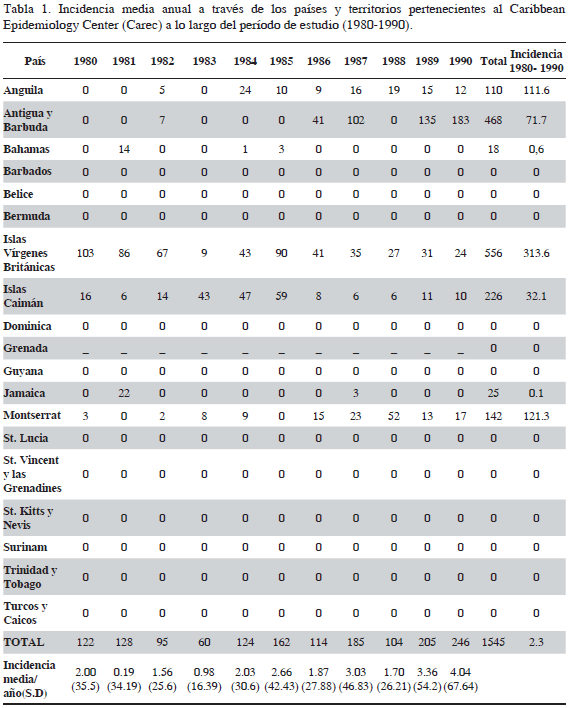
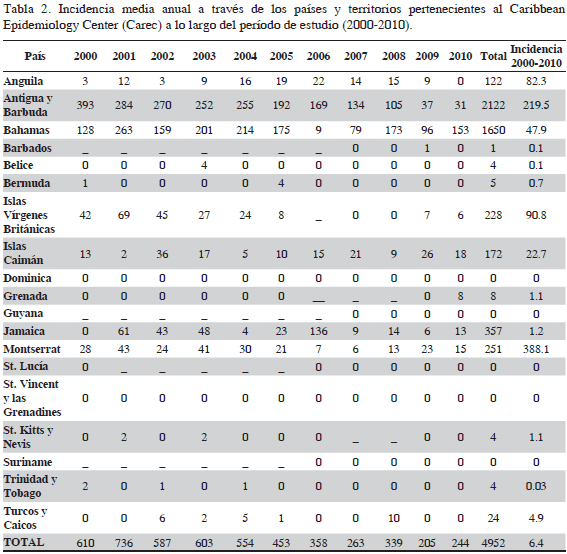
La metodología del presente estudio se basó en el trabajo de Skinner et al. (2011), quienes evaluaron la intoxicación por ciguatera en las islas del Pacífico durante el período 1998-2008, tomando como variable de análisis la incidencia por cada 100 000 habitantes. El Centro de Epidemiología del Caribe (Caribbean Epidemiology Centre - CAREC), a través de su portal web, publica anualmente los registros epidemiológicos regionales, que son alimentados periódicamente por cada uno de los países miembro. Para ciguatera, el CAREC posee datos de los últimos 31 años. Esta información fue recopilada y tabulada para su análisis (Tablas 1 y 2). La incidencia de ciguatera de otros territorios y países no miembros del CAREC fue obtenida a través de la revisión bibliográfica, logrando alcanzar un total de 27 países y territorios del Gran Caribe. Asimismo, se realizó un análisis de ámbitos de incidencia de ciguatera en dos períodos de tiempo 1980-1990 y 2000-2010. Los datos correspondientes a San Andrés, Providencia y Santa Catalina fueron suministrados por la Secretaría de Salud Departamental para el período 2007-2011 y se contrastan con los registrados para el Caribe. Se debe mencionar que la incidencia es una medida ampliamente usada en epidemiología, que para el alcance y objetivos de este estudio permite evidenciar el comportamiento de la ciguatera en el Caribe. Se debe aclarar que dentro de los registros del CAREC no se encuentran análisis epidemiológicos basados en la incidencia temporal, solo se limitan a dar a conocer los datos epidemiológicos de cada país miembro. Esta base de datos fue la que se usó para los cálculos y análisis que se presentan en este artículo.
De acuerdo con la Biblioteca Nacional de Salud de Estados Unidos (NIH), la incidencia mide el número de casos nuevos de una enfermedad, un síntoma, muerte o lesión que se presenta durante un período de tiempo específico, como un año. La incidencia muestra la probabilidad de que una persona en esa población resulte afectada por la enfermedad. Como la incidencia pondera los casos de ciguatera de acuerdo con el número de años registrados, es válida la inserción de los datos de SAI para el análisis de incidencia, en comparación con los demás territorios e islas considerados. Para evidenciar tendencias entre el blanqueamiento de coral y la incidencia de la ciguatera en la región, se recurrió al sistema de información geográfica de la base de datos de Reef Base, donde se obtuvo un mapa que muestra las áreas que presentan índices bajo, medio y alto de blanqueamiento de coral. Sobre este mapa se ubicaron las incidencias de ciguatera calculadas. Se emplearon los registros de presión pesquera sobre los arrecifes de coral así como el suministro de pescado y comida de mar (kg/cápita/año) de la FAO para relacionarlos con incidencia en el Caribe.
Análisis estadísticos
A partir de la base de datos de registro de ciguatera suministrada por el CAREC, se procedió al cálculo de la incidencia por cada 100 000 habitantes por año para el período comprendido entre 1980-2010 para los países del CAREC y 2007-2011 para SAI. Los cálculos se realizaron por país y por año registrado (Tablas 1 y 2). Estos datos se tomaron como base para el análisis de la incidencia de ciguatera. De la misma manera que Skinner et al. (2011) los emplearon para determinar el posible aumento de la incidencia para el Pacífico, en este trabajo se buscó determinar si la incidencia de intoxicación per cápita ha incrementado significativamente en la región, como se plantea en la hipótesis de este trabajo. Se decidió tomar los primeros 10 años y los últimos 10 años de los datos recopilados para determinar si existen diferencias entre estos períodos. Se realizaron comparaciones entre los dos periodos de tiempo, el primero comprendido entre 1980 y 1990 y el segundo entre 2000 y 2010 tomando las incidencias calculadas (Tablas 1 y 2). También se estimó el incremento en la incidencia de ciguatera en los dos intervalos de tiempo analizados a través de los países miembros del CAREC comparando la incidencia anual media dentro de cada país en cada período de tiempo (Tablas 1 y 2) usando una prueba t pareada, controlando para los valores no registrados o faltantes de ciguatera. Previo al análisis estadístico, con el fin de cumplir los supuestos de normalidad de los datos e igualdad de varianzas, los valores de incidencia total e incidencia media fueron normalizados usando transformación logarítmica Ln (X+1). También se presenta la proporción de las tasas de incidencia (1980-1990 / 2000-2010) controlando los valores no registrados o faltantes.
RESULTADOS
Tendencias: 1980-2010
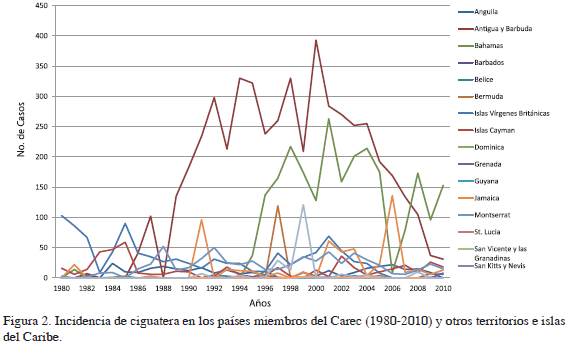
A partir de los datos recopilados por el CAREC, se han presentado 10 710 casos clínicamente confirmados de ciguatera en los países miembros, durante el período 1980-2010 (Tablas 1 y 2). De acuerdo con los datos tabulados para dicho período, la mayoría de los casos fueron registrados por Antigua y Barbuda (49%), Bahamas (22%), islas Vírgenes Británicas (10%), Montserrat (6%), Islas Caimán (4%) y Jamaica (4%). Se puede evidenciar una tendencia al aumento de casos registrados por los países miembros del CAREC, con un máximo de 736 casos en 2001. En 1986, registraron 41 casos; y de 1987 en adelante (con la excepción de 1988, cuando no se registraron casos) un promedio anual de 184 (ámbito 142 a 267 casos). Sin embargo, para el CAREC se debe notar que casos adicionales anecdóticos fueron también registrados durante este período. Los demás países y territorios miembros del CAREC presentaron registros clínicamente comprobados por debajo de 50 a lo largo de los 31 años de estudio (Figura 2). El aporte de casos de ciguatera de estos países al global de la región es bajo. Asimismo, de acuerdo con el registro del CAREC, durante el periodo 1980-2005, se presentaron cuatro grandes brotes de ciguatera, el primero en septiembre de 1982, por la tripulación de un buque en Barbados; el segundo en Antigua y Barbuda entre septiembre y octubre de 1987; el tercero en San Vicente y las Granadinas durante los meses de noviembre y diciembre de 1985 y el último en 2001 en las Bahamas con 20 casos (Figura 2). En ninguno de los registros del CAREC se informa la especie de pescado consumida.
Registro de casos e incidencia temporal de la ciguatera en el Caribe (1980-2010)
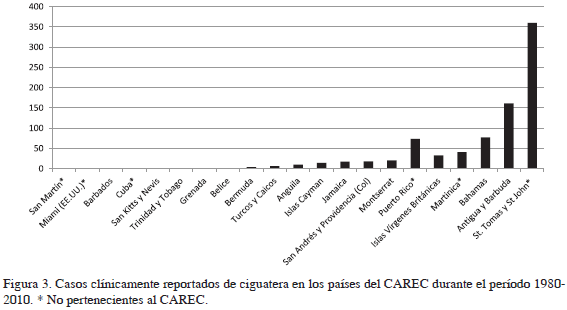
Los casos registrados por los países y territorios pertenecientes al CAREC para el período comprendido entre 1980 y 2010 mostraron altos niveles de variabilidad interanual, tanto dentro como entre las islas y territorios del Caribe pertenecientes al CAREC. La mayoría de los países registraron un número de casos clínicamente comprobados por debajo de 50 por año (Figura 3). Cuatro países no registraron casos de ciguatera: San Vicente y las Granadinas, Dominica, Guyana y Santa Lucía. Por otro lado, Anguila, Bermuda, Turcas y Caicos, Jamaica, islas Vírgenes Británicas, Bahamas, Antigua y Barbuda fueron los países con mayor registro, destacándose el alto número de casos registrados por Bahamas, Antigua y Barbuda, con picos por encima de 150, a partir de 1989. Se observa una disminución de los casos registrados por ambos países, para Antigua y Barbuda desde 2000 y para Bahamas desde 2004, considerando que en 2006 solo se registraron nueve casos (Tablas 1 y 2).
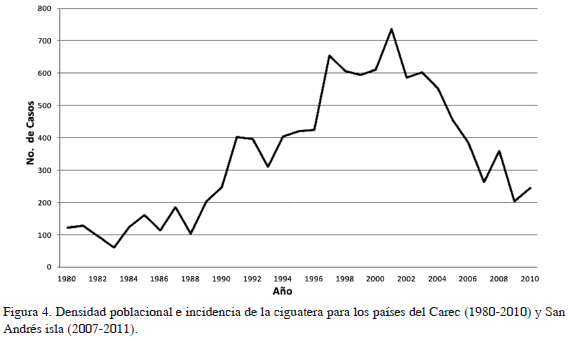
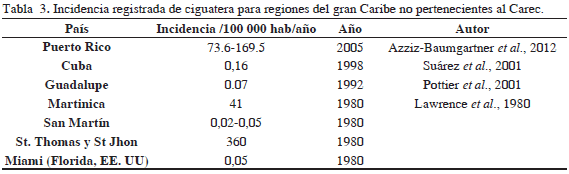
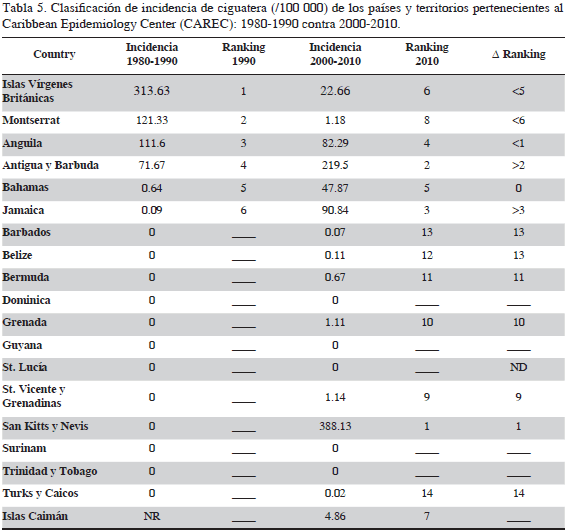
En cuanto al comportamiento de la incidencia calculada para los 31 años del período de estudio (1980-2010) se observa una incidencia comparativa baja, menor a 200/100 000 habitantes por año entre 1980 y 1988. A partir de 1989 se evidencia una tendencia de aumento, que se mantiene hasta 2001, cuando se alcanza el pico máximo de incidencia de 736 /100 000 habitantes por año (Figura 4). Posteriormente se observa una disminución en los últimos años del estudio, con lo que la línea tuvo una forma de campana de Gauss. Respecto a la incidencia por países, se destacan, en su orden Montserrat, Antigua y Barbuda, islas Vírgenes Británicas y Anguila como los países con mayor incidencia de ciguatera en el Caribe, con valores que varían entre 71 y 348 personas por cada 100 000 habitantes. La literatura registra una amplia variedad de incidencia para países del Caribe no pertenecientes al CAREC, que varía entre 360 /100 000 habitantes por año en St. Thomas y St. John (islas Vírgenes Estadounidenses) y 0.16 para Cuba (Tabla 3). Se destacan también las altas incidencias registradas por Puerto Rico y Martinica, mientras Guadalupe, Miami (Florida) y San Martín presentan bajas incidencias per cápita.
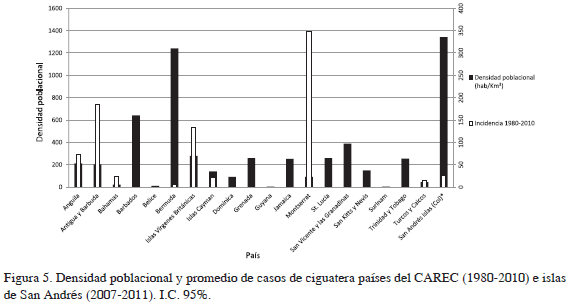
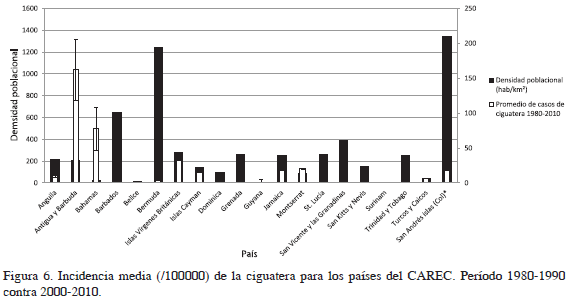
No se encontró relación entre la densidad poblacional y la incidencia de ciguatera registrada en los países miembros del CAREC y SAI. Las islas con las mayores incidencias per cápita (Montserrat, Antigua y Barbuda y las islas Vírgenes Británicas presentan densidades poblacionales bajas por debajo de 300 hab/km2, mientras las de mayores densidades poblacionales, como SAI, Bermuda y Barbados, muestran incidencias menores (Figura 5). Las demás islas presentan densidades poblacionales e incidencias per cápita bajas.
En cuanto a la relación entre densidad poblacional y promedio de casos registrados por los países del CAREC y SAI, se observa que Antigua y Barbuda, las Bahamas e islas Vírgenes Británicas presentaron los promedios más altos de casos registrados de ciguatera para el período 1980-2010, aunque sus densidades poblacionales son bajas (Figura 6). Los casos promedio para las demás islas muestran valores promedio bajos similares, menores a 25 durante el periodo 1980-2010 para los países del CAREC y 2007-2011 para SAI. Como se puede observar, al igual que la incidencia per cápita, la densidad poblacional parece no tener relación con los casos promedio registrados de ciguatera en los países del CAREC.
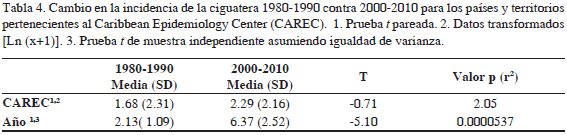
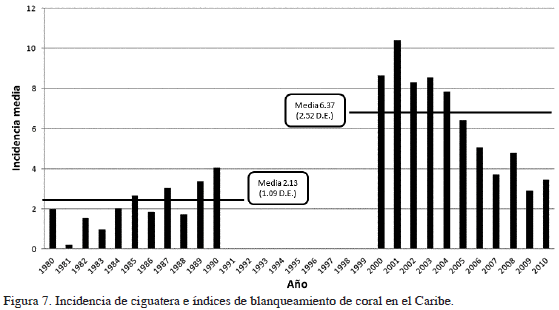
Los análisis estadísticos del cambio de incidencia entre los dos períodos de tiempo considerados mostraron resultados variables. Según la prueba t pareada no existe diferencia estadística significativa entre los países miembros del CAREC para el período de estudio (1980-1990 vs 2000-2010) (P = 2.1) (valores de incidencia última columna tabla 1 y 2). Por otra parte, existe una diferencia estadística significativamente alta entre los dos periodos de tiempo (valores última fila Tablas 1 y 2) cuando se compara la diferencia de la incidencia media a través de los años (P= 0.0000537) usando la prueba t pareada independiente. La proporción de la tasa de incidencia dentro de los países CAREC (incidencia media anual 2000-2010 / incidencia media anual 1980-1990) fue de 1.36 (Tabla 4). Dentro del periodo de 31 años antes del estudio, se observa un claro aumento en la incidencia de ciguatera en general, aunque los resultados muestran variabilidad de la incidencia entre los dos periodos de tiempo (Figura 7). Antigua y Barbuda, Granada, Jamaica, San Kitts y Nevis, San Vicente y las Granadinas y Turcas y Caicos mostraron un incremento en la incidencia (Tabla 5). Otros países y territorios, como Dominica, Barbados, Belice, Bermuda, Guyana, Montserrat e islas Vírgenes Británicas muestran una disminución en la incidencia. Del período 1980-1990 solo seis países notificaron casos comprobados de ciguatera, a diferencia de los observado para el período 2000-2010, cuando se observa un aumento de ocho países que registraron ciguatera, con ejemplos de aumentos considerables, como el observado para Bahamas, Jamaica y Antigua y Barbuda, esta última nación con el número más alto de casos de ciguatera entre los países CAREC.
Distribución geográfica de la ciguatera en el Caribe
El área del Caribe con la mayor incidencia se concentra en la franja oriental, en los territorios correspondientes a Martinica, Anguila, islas Vírgenes Británicas, Puerto Rico, Antigua y Barbuda y Montserrat. Los países que no presentaron casos de ciguatera a lo largo del período analizado se encuentran en el Caribe suroriental (Guyana, San Vicente y las Granadinas, Santa Lucía y Dominica), cerca de la zona de mayor incidencia. El resto de territorios presentan una distribución de incidencia variable, con Bahamas, Bermuda y Turcas y Caicos ubicados en el Caribe nororiental, con un ámbito de incidencia entre 5 y 25. SAI e Islas Caimán, que entran en este ámbito, se encuentran en el Caribe Occidental. El ámbito de incidencia entre 0.01 y 0.7 presenta un ámbito geográfico más amplio, con Belice en el Caribe occidental, Miami (Florida, EE.UU), Cuba y Jamaica en el Caribe noroccidental, y Trinidad y Tobago, Barbados, San Martín, Guadalupe, San Kitts y Nevis y Granada distribuidos en el Caribe sur y nororiental (Figura 1). En cuanto a la relación entre incidencia de ciguatera y fenómenos de blanqueamiento de coral, no se observa una tendencia que permita plantear una hipótesis de correlación entre estas dos variables. Se presenta una de alta incidencia de ciguatera en sitios de índice de blanqueamiento de coral alto como Puerto Rico, islas Vírgenes Británicas y Anguila. Áreas del Caribe con índices de blanqueamiento de coral medio y bajo muestran, por lo general, bajas incidencias de ciguatera.
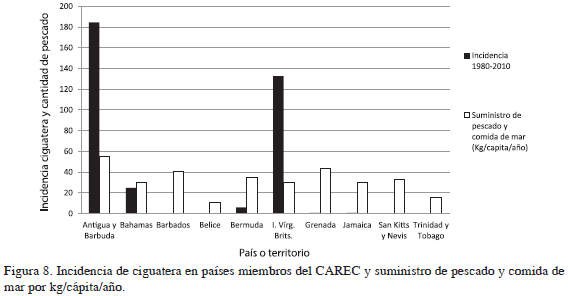
De igual manera, el comportamiento de la incidencia en relación con el suministro de pescado en países del CAREC no muestra tendencias que permitan plantear hipótesis de correlación. Los países del CAREC analizados presentan una cantidad de suministro de pescado y comida de mar similar, mientras sus incidencias varían de manera mucho más evidente (Figura 8). Mientras el suministro de pescado per cápita tuvo valores entre 54.6 y 10.5 kg/cápita/año, la incidencia varió entre 184.4 y 0.014 (/100 000 hab).
DISCUSIÓN
La ciguatera representa una amenaza en las áreas tropicales y subtropicales de ocurrencia. Es así como para los países y territorios insulares del Pacífico (PICT) la incidencia total por cada 100 000 habitantes ha incrementado en un 60 % entre los períodos 1973-1983 y 1998-2008, donde se registra una media de 104 casos contra una de 167.3 casos respectivamente (Skinner et al., 2011). Estos datos muestran que el Pacífico es el área con la mayor incidencia de ciguatera del mundo, con un ejemplo notable, la isla de Rarotonga, con 1058 casos por 10 000 habitantes al año (Rongo y Van Woesik, 2011). Aunque la incidencia per cápita en el Caribe no alcance los niveles del Pacífico, el presente estudio registra un aumento de incidencia mayor al calculado para el Pacífico. Para los períodos 1980-1990 y 2000-2010, se presenta una media anual calculada de casos registrados de 34.2 y 45.2 /100 000 a través de los países y de 2.13 y 6.37 /100 000 a través de los años. La alta tasa de ciguatera en la región entre 1996 y 2006 (Tester et al., 2010) fue registrada para las Antillas Menores, donde además de presentar las mayores temperaturas del mar, se presenta la menor variación de las mismas. Al igual que en otras partes del mundo, la ciguatera en el Caribe constituye una amenaza por sus efectos negativos en la sociedad, más en la caribeña, que por un lado presenta una alta dependencia del turismo y por otro lado, muchos de sus habitantes ven en los recursos marinos una fuente casi exclusiva de proteína en la dieta (Price, 1966; Burke y Maidens, 2005).
Los resultados obtenidos en el presente estudio muestran similitudes con los registrados para el Pacífico y el Caribe (Tester et al., 2010; Skinner et al., 2011) en dos aspectos: el primero, la gran variabilidad de incidencia que se presenta en las islas, similar al Pacifico, donde se evidencia una alta variabilidad inter anual dentro y entre los países. El Caribe, de acuerdo con los resultados de este estudio, también presenta una alta variabilidad dentro de los países del CAREC. El segundo aspecto en común es que, a pesar de la alta variabilidad en la incidencia, tanto en el Pacífico cómo en el Caribe se comprueba un aumento significativo en la incidencia en las últimas tres décadas. De los estados del Caribe pertenecientes al CAREC, se pueden señalar dos que se constituyen como ejemplos del grado de cambio potencial y variabilidad de incidencia de la ciguatera: Antigua y Barbuda, donde se pasó de 71 a 219 entre los dos períodos de tiempo, e islas Vírgenes Británicas, donde disminuyó de 313 a 22 durante el mismo tiempo. El análisis de ámbitos y el resultado de no significancia estadística de la prueba t para la diferencia de incidencia entre los países del CAREC, confirman la existencia de una gran variabilidad espacial y temporal, la cual puede indicar fallas en el diagnóstico, así como variabilidad en la manifestación del problema.
De acuerdo con la proporción de tasas de incidencia, ha habido un incremento de 299% en la incidencia anual de ciguatera entre los dos períodos de tiempo considerados y un aumento de 36% entre los países del CAREC (Tabla 4, Figura 7). Este aumento de la incidencia es mayor al registrado por Skinner et al. (2011) para el Pacífico, en donde el aumento de la incidencia llega a 60% entre los períodos 1973-1983 contra 1998-2008. El incremento de incidencia registrado en este estudio debe considerar que la oblicuidad de los datos (prueba de Grubbs) detectó dos estados considerados como outliers: Antigua y Barbuda y Montserrat, que contribuyen en gran medida al total de la región, además estos dos estados cuentan con poblaciones menores en comparación con el total de la región. Por lo tanto, el incremento regional registrado debe considerar el aporte de los outliers.
La incidencias de ciguatera en el Caribe puede obedecer al aumento de la temperatura superficial del mar ligada al cambio climático, registrada por Tester et al. (2010). La autoecología de Gambierdiscus predice que muchas de las especies responderán favorablemente al cambio climático global (Tester, 1994). Debido a la asociación de Gambierdiscus con macroalgas en arrecifes de coral, es importante notar la relación entre altas temperaturas del agua y la proliferación de macroalgas, sustrato preferido por Gambierdicus (Cruz-Rivera y Villareal, 2006). Ensayos realizados por Tester et al. (2010) registran que la temperatura óptima para cinco especies del género Gambierdiscus es igual o mayor a 29°C, además registran que el número de días que presentaron estas temperaturas superficiales en el mar Caribe casi se han duplicado en las últimas tres décadas (44 a 86 días). Este aumento notable de la temperatura puede explicar la creciente incidencia de ciguatera para el período contemplado en el presente estudio, como también se sugiere para las islas del Caribe oriental, en especial Montserrat, Antigua y Barbuda e islas Vírgenes Británicas, que presentaron las mayores temperaturas del mar acompañadas de las mayores incidencias de ciguatera para el Caribe (Tester et al., 2010). Se debe considerar que a través del tiempo se han adherido más países al CAREC y que los métodos de obtención de información epidemiológica han mejorado. Pero a su vez, esta alta variabilidad temporal de la incidencia hace que sea difícil predecir a escala Gran Caribe, sin negar la necesidad de una acción regional. Autores como Friedman et al. (2008) han estimado que solamente alrededor de 5 a 10 % de los casos son en efecto registrados. Si en este caso acudimos a una estimación conservadora, que considera que apenas 20% de la incidencia es registrada (Lewis, 1986), entonces el verdadero promedio de casos de ciguatera para la región Caribe podría llegar a 53 550. Esta estimación puede parecer alta, pero es 10 veces menor si se compara con la estimación de 500 000 habitantes que sufren de ciguatera en los PICT (Skinner et al., 2011).
La densidad poblacional no parece ser un factor a considerar al momento de plantear posibles causas del aumento de la incidencia y del número de casos promedio de ciguatera en el Caribe. Podría pensarse que densidades poblacionales altas aumentan la vulnerabilidad, como se ve en las Islas Caimán (Tester et al., 2010), donde atribuyen el aumento de incidencia a dos factores: el primero al aumento de la población, ya que se duplicó en los últimos 20 años aumentando la demanda de pescado. El segundo considera que el aumento de las tasas de incidencia obedece a un aumento en el registro de casos, generado por un aumento en la conciencia del público en los últimos años. En este estudio no se evidencia tal tendencia. Este hecho hace que las proyecciones y acciones de gestión del riesgo se enfoquen a otras variables de tipo biológico-ecológico, pesquero, sanitario y normativo.
A la fecha, la literatura concerniente a ciguatera ha estado relacionada principalmente con registros de casos, estudios epidemiológicos y toxicología (Fleming et al., 2001). Este tipo de estudios ha ignorado sistemáticamente los determinantes culturales, ecológicos y políticos de los patrones de la enfermedad (McMichael et al., 2003). La revisión de literatura llevada a cabo para este trabajo encontró falencias en aspectos sociales de la ciguatera, como también lo evidencia Morrison et al. (2008) en su estudio sobre la resiliencia socio-ecológica de la comunidad frente a la ciguatera en Cuba. Los hábitos de consumo de pescado en el Caribe y los factores de demanda afectados por estos hábitos (factores económicos y cultural/tradicional), son muy complejos y varían notablemente de un lugar a otro en el Caribe, lo que hace que la estandarización a partir de los tipos de pescado consumido sea difícil (Adams, 1980) Igualmente, la elección del pescado por el consumidor está influenciada por factores no económicos tales como textura y color de la masa. Infortunadamente, las complejidades señaladas en los mercados pesqueros del Caribe son poco conocidas, representando serios obstáculos a la realización del potencial amplio de los mercados de peces en la región, que pueden resultar en un colapso en los planes de mercadeo (Adams, 1980). Cuando ocurren eventos tóxicos en las islas del Caribe u otras áreas como Florida, islas del Pacífico y Australia, donde la economía de las poblaciones costeras se sustenta básicamente en el comercio de pescado y el turismo, los impactos son muy fuertes, debido a la publicidad que alarma a toda la sociedad y al turismo. Las pérdidas económicas en Puerto Rico entre 1997 y 1998 se estimaron entre 8 y 10 millones de dólares, mostrando el impacto económico que puede llegar a causar la ciguatera (Arencibia et al., 2009). Si bien, a diferencia del Pacifico, los peces herbívoros del área del Caribe hasta ahora no han sido registrados como tóxicos (Pottier et al., 2002), potencialmente pueden ser portadores de las toxinas a diferentes niveles de toxicidad (Angibaud et al., 2008).
Según Olsen et al. (1984), el desarrollo de las pesquerías en el Caribe oriental presenta dos grandes obstáculos: el primero, la sobrexplotación que es más evidente en islas de menor tamaño, las cuales deben enfocarse en la optimización de la utilización y distribución del recurso; y segundo, la intoxicación por consumo de pescado contaminado, que limita los intentos de establecer proyectos de pesquerías en áreas donde la ciguatera es endémica. Asimismo, resaltan que los problemas originados por la ciguatera pueden variar desde la pérdida de productividad de los trabajadores intoxicados hasta la ausencia de recurso para explotar y problemas de salud pública por bajos consumo de proteína en la dieta. Los impactos de la ciguatera en el Caribe oriental también pueden ser sentidos en la industria del turismo. La diversidad y novedad de los peces locales frecuentemente atrae a los turistas. Sin embargo, muchos hoteles rehúsan preparar pescado local para evitar riesgos de intoxicaciones, ya que las víctimas pueden demandar por daños o hacer mala publicidad, afectando negativamente el flujo de visitantes (Carner, 2000). En cuanto a preferencias de consumo de pescado en la región del Caribe, Adams y Higman (1979) resaltaron que el éxito de los sitios de venta de pescado en la región depende, en gran medida, del buen conocimiento local de las preferencias y prejuicios hacia los productos de origen marino. Los hábitos de tipo ambiental, económico, histórico/ cultural y sicológico son complejos y varían dependiendo del lugar.
La distribución espacial de la incidencia de ciguatera en el Caribe, puede ser un indicador de tendencias o de agrupamientos geográficos de zonas de riesgo. La intoxicación por consumo de pescado en el Caribe oriental está registrada desde mediados del siglo pasado con el trabajo de Brody (1971) para el grupo de islas ubicadas a sotavento e islas Vírgenes. Puerto Rico, La Española y St. Croix que presentan una tasa de incidencia mucho menor que la registrada en islas ubicadas a barlovento, como aquellas entre Trinidad y Martinica. El registro epidemiológico de intoxicaciones producidas por ciguatoxinas apenas fue iniciado en 1971 en islas Vírgenes. El problema parece más severo en el área del norte de Montserrat e islas Vírgenes Británicas, incluyendo la porción suroeste del banco de Saba y la placa sur de islas Vírgenes.
El mapa de incidencia elaborado a partir de los datos del CAREC de los registrados para otros países y territorios del Caribe confirma la variabilidad espacial en los países y territorios, mostrando que el Caribe oriental presenta la mayor incidencia dentro de toda la región (Figura 1). Esta tendencia ha sido registrada en trabajos previos (Halstead, 1970; Bagnis, 1978; Olsen et al., 1984; Tester et al., 2010) donde se apoyan afirmaciones sobre la alta prevalencia en las islas ubicadas al norte de Martinica. Olsen et al. (1984) delimitaron tres centros primarios de toxinas, el primero ubicado en el área de Redonda, entre Antigua y Montserrat, el segundo entre el borde oriental del banco de Saba y a lo largo del borde suroriental del banco de Anguila. El tercer centro de toxicidad se encuentra en la plataforma sur de islas Vírgenes Británicas, correspondiendo a lo hallado en este trabajo. Una preocupación ambiental clave en el Caribe es el cambio de fase de los arrecifes de coral hacia un ecosistema dominado por macroalgas (Hughes et al., 1987), que son el sustrato de las microalgas tóxicas (Lehane y Lewis, 2000). La preocupación sobre la expansión de la dominancia algal fue notada en Cuba donde la cobertura algal varió entre 30-60 % alrededor de la isla, inclusive en áreas no contaminadas (Hughes, 1994). En Jamaica, Hughes (1994) encontró que la cobertura algal prolongada en el ámbito de 75-100% debía ser considerada como evidencia de un cambio de fase coral-alga. En toda la región se han observado reducciones en la cobertura de coral vivo y un aumento en el recubrimiento por algas (Burke y Maidens, 2005).
Estudios de líneas de tiempo efectuados en el Caribe, como el de Geister (2008), han mostrado que los arrecifes de coral pueden presentar ciclos de degradación y recuperación, donde la cobertura algal está ligada a las condiciones del coral. De esta manera, se esperaría un comportamiento de incidencia que gráficamente se vería como una campana, cómo se registra en este estudio, donde los últimos años evidencian una caída de la incidencia, aunque persistentemente mayores a los registrados en las décadas pasadas. Existe evidencia considerable de que la ciguatera varia estacionalmente (Bomber et al., 1988; Chinain et al., 1999; Tester et al., 2009), aunque no todos los estudios reflejan esto (de Fouw et al., 2001). Algunos sugieren que las prácticas culturales hacen que no se reflejen los patrones estacionales, especialmente en días de fiesta locales, cuando las comidas incluyen pescado de gran tamaño proveniente del arrecife (Tester et al., 2010).
El aumento de cobertura algal no solo es ocasionada exclusivamente por fenómenos de blanqueamiento, es así como se ha registrado la importancia del erizo negro (Diadema antillarum) como herbívoro que controla los efectos de la abundancia algal (De Fouw et al., 2001), como se registró en el Caribe durante la década de los años 80 del siglo pasado, cuando se incrementó la cobertura de algas bentónicas de un 31% a cerca del 50% después de una mortandad de D. antillarum (Carpenter, 1981). Así mismo, la recuperación de las poblaciones de D. antillarum en arrecifes de coral del Caribe, ha reducido la cobertura de algas a cerca de los niveles históricos en sitios someros y también ha aumentado el reclutamiento de coral (Carpenter y Edmunds, 2006). Si se considera que la segunda barrera de arrecife de coral más extensa del mundo está localizada en Belice y que además de esta existen formaciones coralinas importantes en la región como las barrera localizadas en la islas de San Andrés, Providencia y Santa Catalina, sumado a la alteración de la cobertura de coral ya mencionada y al aumento de la temperatura superficial del agua (Tester et al., 2010) hacen que la región Caribe esté expuesto a un aumento de ciguatera en el futuro. Y más alarmante aún, la región puede presentar dificultades en cuanto a la capacidad de afrontar un aumento de estos eventos en sus sistemas de salud pública o en sus modelos de desarrollo basados en el turismo, como se ha registrado para el Pacífico sur (Goater et al., 2011).
Es importante resaltar el esfuerzo y compromiso que ha tenido el CAREC para hacer el seguimiento epidemiológico no solo de ciguatera, sino de las problemáticas de salud regional en general. Partiendo de estos insumos, se pueden plantear escenarios, propuestas de mitigación y acciones unificadas que puedan llevar a soluciones a una enfermedad que puede ser considerada como una importante causa tanto de malestar agudo como crónico (Skinner et al., 2011). En el Caribe se puede tomar como una oportunidad de trabajo y planificación exitosos, más si se considera que son pocas las acciones de mitigación o normatividad que han tomado las islas y territorios en relación con las intoxicaciones alimentarias de origen marino, principalmente por la insuficiencia de recursos para iniciar un sistema de monitoreo organizado. Al igual que lo registrado por Skinner et al. (2011) para los PICT, es posible que el aumento de incidencia haya obedecido a un incremento tanto en la colaboración como en la investigación y en el interés alrededor de la ciguatera en comparación al periodo inicial del estudio de los países y territorios del CAREC en los últimos años, generando un sesgo en los datos. Sin embargo, los registres de literatura apoyan la tesis de un aumento en la incidencia y ocurrencia de ciguatera en las áreas tropicales y subtropicales del mundo, que se espera sigan incrementando a nivel espacial y temporal. Es necesario reforzar, por un lado, el seguimiento a nivel biológico-epidemiológico de la enfermedad y que las autoridades de salud colaboren de manera estricta con los registros de casos en los países CAREC. De esta manera se tendrá a futuro una mayor confiabilidad y continuidad temporal a largo plazo de la epidemiologia de la enfermedad, que permitiría confirmar la hipótesis del comportamiento cíclico de la ocurrencia de ciguatera en el Caribe, planteada en este trabajo.
CONCLUSIONES
Las intoxicaciones alimentarias como la ciguatera son un ejemplo de cómo una problemática ambiental puede tener un efecto considerable en términos de salud pública y desarrollo, todo enmarcado en un contexto de cambio climático que puede aumentar la vulnerabilidad y por lo tanto el riesgo sobre las comunidades costeras como el Caribe. Al igual que en otras zonas endémicas de ciguatera como el Pacífico sur, en algunos sitios del Caribe en general, y en SAI en particular, no se han tomado medidas para el manejo de la intoxicación. Los resultados de este estudio permitieron estimar que alrededor de 53550 personas pudieron haber contraído la enfermedad en los últimos 31 años, aunque menor a lo registrado para los PICT, no deja de reflejar la magnitud del problema en la región. Si se considera que la población conjunta de los PICT alcanza un poco por encima de tres millones y medio de personas y la estimación de casos es de 500 000 (Skinner et al., 2011) se puede ver que 14% de su población sufre de problemas de ciguatera. Para los CAREC, la población alcanza 7 063 148 y la estimación de casos llega a 53 550, con lo que 0.7% de su población contrae ciguatera. Sin embargo, se ha demostrado un aumento de la incidencia en las últimas décadas en el Caribe que es mayor al registrado para el Pacífico. Comparativamente, SAI presenta una incidencia considerable, ocupando el octavo lugar entre las islas y territorios analizados. El aumento de incidencia en general probablemente obedece, entre otros, al aumento de la temperatura de las aguas, en especial en el Caribe oriental, como lo propusieron Tester et al. (2010) cuyo estudio registró que los sitios donde se detectaron las mayores incidencias se encuentran en áreas donde las temperaturas promedio anual fueron ≥ 25 °C. Inclusive durante febrero, el mes más frío del año, se registraron temperaturas por encima de 25 °C en las Antillas Mayores.
Aunque la región presenta una incidencia comparativa menor a la registrada para el Pacífico, el aumento de incidencia registrado es una señal de alerta que requiere un mayor entendimiento y reconocimiento a través de la investigación multidisciplinar que permita llenar los vacíos de información aún existentes. Aunque en este estudio no se encontró relación estadísticamente significativa entre incidencia de ciguatera registrada y eventos de blanqueamiento de coral, estos están relacionados con aumento de temperatura del agua favoreciendo el cambio de fase coral-alga y permitiendo el aumento de sustrato para las microalgas tóxicas.
AGRADECIMIENTOS
Los autores desean agradecer a la sede Caribe de la Universidad Nacional de Colombia y al Programa de Maestría en Estudios del Caribe. Así mismo al Centro de Investigaciones Pesqueras (CIP) de La Habana, Cuba, por la orientación y corrección del trabajo, en especial a los Doctores Gustavo Arencibia Carballo y Gilma Delgado Miranda. Al profesor Arturo Sierra Beltrán, del Centro de Investigaciones Biológicas del Noroeste, Baja California Sur (CIBNOR) de México, por su colaboración y datos suministrados. Al Caribbean Epidemiology Center (CAREC) por los datos de ocurrencia de ciguatera de los últimos 31 años. A las profesoras Brigitte Gavio y Johannie James de la Universidad Nacional de Colombia por su evaluación crítica. Este trabajo fue financiado por la Universidad Nacional de Colombia, a través de los proyectos Códigos Hermes 9732 y 126 239. Así mismo, formó parte del proyecto titulado "Evaluación del efecto de las intoxicaciones alimentarias de origen marino sobre el turismo y la salud pública en San Andrés Isla, Colombia".
BIBLIOGRAFÍA
1 Adachi, R. y Y. Fukuyo. 1979. The thecal structure of marine toxic dinoflagellate Gambierdicus toxicus gen. et sp. nov. collected in ciguatera endemic area. Bull. Jap. Soc. Sci. Fish., 45: 67-71. [ Links ]
2 Adams, J.E. 1980. The fisheries and fish markets of St. Vincent Island, Eastern Caribbean. Singapore J.Trop. Geo., 6: 1-12. [ Links ]
3 Adams, J.E. y J.B. Higman. 1979. Fish preferences and prejudices in a small Caribbean Island: a study of fish consumption patterns in St. Vincent based on a household survey. 15-34. En Higman, J.B. (Ed.). Proc. 32nd An. Gulf Carib. Fish. Inst., Miami, EE. UU. 123 p. [ Links ]
4 Anderson, B.S., J.K. Sims, N.H. Wiebenga, y M. Sugi. 1983. The epidemiology of ciguatera fish poisoning in Hawaii, 1975-1981. Hawaii Med. J., 42: 326-334. [ Links ]
5 Angibaud, G., J.M. Leveque, D. Laurent, y C. Gaultier. 2008. Neurological features after consumption of a variety of neo-Caledonian shellfish. Rev Neurol., 156(1): 65-66. [ Links ]
6 Arencibia, G., J.E. Mancera y G. Delgado. 2009. La ciguatera: Un riesgo potencial para la salud humana: Preguntas frecuentes. Universidad Nacional Colombia, San Andrés. Colombia. 64 p. [ Links ]
7 Azziz-Baumgartner, E., G. Luber, L. Conklin. T. Tosteson, H. Granade, R. Dickey y L. Backer. 2012. Assessing the incidence of ciguatera fish poisoning with two surveys conducted in Culebra, Puerto Rico, during 2005 and 2006. Environ. Health. Perspect., 120: 526-529. [ Links ]
8 Bagnis, R. 1978. Report of the Mission to the Antilles and Easter Island August 15 September 25, 1978. Institute of Medical Research, Papeete, Tahití. 58 p. [ Links ]
9 Bagnis, R. 1981. The ciguatera type ichtyosarcotoxism: a complicated phenomena of marine and human biology. Oceanologica Acta., 4(3): 375-387. [ Links ]
10 Bagnis, R., S. Chanteau, E. Chungue, J.M. Hurtel, T. Yasumoto y A. Inoue. 1980. Origins of ciguatera fish poisoning: a new dinoflagellate, Gambierdiscus toxicus Adachi and Fukuyo, definitely involved as a causal agent. Toxicon, 8(2): 199-208. [ Links ]
11 Bomber, J.W., R. Guillara y W.G. Nelson. 1988. Roles of temperature, salinity, and light in seasonality, growth and toxicity of ciguatera causing Gambierdiscus toxicus Adachi et Fukuyo (Dinophceae). J. Exp. Mar. Biol. Ecol., 15(1): 53-65. [ Links ]
12 Brody, R. 1971. Ciguatera study Caribbean Research Institute. College of the Virgin Islands St. Thomas US. Virgin Islands. 24th An. Gulf Carib. Fish. Inst., Miami. EE.UU. 39 p. [ Links ]
13 Burke, L., y J. Maidens. 2005. Reefs at risk in the Caribbean. World Res. Inst.. Washington. D.C. 80 p. [ Links ]
14 Carner, F. 2000. Vulnerabilidad del sector turismo. Material de trabajo. "Desarrollo de metodologías para actualizar el manual de CEPAL para estimar los efectos socioeconómicas de desastres naturales y actividades de entrenamiento para construir las capacidades de países para reducir la vulnerabilidad a los desastres naturales" ITA/99130. Ministerio de Relaciones Exteriores de Italia y Cepal, Naciones Unidas. Santiago de Chile. 54 p. [ Links ]
15 Carpenter, R. 1981. Grazing by Diadema antillarum Phillippi and its effects on the benthic algal community. J. Mar. Res., 39: 747-765. [ Links ]
16 Carpenter, R. C y P. Edmunds. 2006. Local and regional scale recovery of Diadema promotes recruitment of scleractinian corals. Ecol. Let., 9: 271-280. [ Links ]
17 Chateau-Degat, M., M. Chinain, N. Cerf, S. Gingras, B. Hubert y E. Dewailly. 2005. Seawater temperature, Gambierdiscus spp. variability and incidence of ciguatera poisoning in French Polynesia. Harmful Algae., 4(6): 1053-1062. [ Links ]
18 Chateau-Degat, M.L., A. Beuter, G. Vauterin, N.L. Nguyen, M. Chinain, T. Darius, A. Legrand, R. Chansin y E. Dewailly. 2007. Neurologic signs of ciguatera disease: evidence of their persistence. Am. J. Trop. Med. Hyg., 77(6): 1170-1175. [ Links ]
19 Chinain, M., M. Ain, X. Deparis, S. Pauillac y A. Legrand. 1999. Seasonal abundance and toxicity of the dinoflagellate Gambierdiscus spp (Dinophyceae), the causative agent of ciguatera in Tahiti, French Polynesia. Mar. Biol., 135(2): 259-267. [ Links ]
20 Cook, A., A. Jardine y P. Weinstein. 2004. Using human disease outbreaks as a guide to multilevel ecosystem interventions. Environ. Health Perspect., 112: 1143-1146. [ Links ]
21 Cruz-Rivera, E. y T.A. Villareal. 2006. Macroalgal palatability and the flux of ciguatera toxins through marine food webs. Harmful Algae., 5(5): 497-525. [ Links ]
22 De Fouw, J.C., H.P. Vanegmond y G.J.A. Speijers. 2001. Ciguatera fish poisoning: a review. National Institute of Public Health and the Environment. Bilthoven, Holanda. 66 p. [ Links ]
23 Fauci, A., E. Braunwald, D.L. Kasper, S.L. Hauser, D.L. Longo, J.L. Jameson y J. Loscalzo. 2008. Harrison's principles of internal medicine. Edición 17. Harvard Medical School. Boston. 345 p. [ Links ]
24 Fleming, L.E., D.G. Baden, J.A. Bean, R. Weisman y D.G. Blythe. 2001. Seafood toxin disease: issues in epidemiology and community outreach. En: B. Reguera, J. Blanco, M.L. Fernández y (T. Wyatt, Eds)., Harmful Algae, Junta de Galicia y Comisión Oceanográfica Internacional de la UNESCO. 248 p. [ Links ]
25 Friedman, M., E. Lora, L.E. Fleming, M. Fernández, P. Bienfang, K. Schrank,. R. Dickey, M.Y. Bottein, L. Backer, R. Ayyar, R. Weisman., S. Watkins, R. Granade y A. Reich. 2008. Ciguatera fish poisoning: treatment, prevention and management. Review. Mar. Drugs., 6: 456-479. [ Links ]
26 Geister, J. 2008. Keynote address: time-traveling in a Caribbean coral reef (San Andres island, western Caribbean, Colombia). The 15th Symposium on the Geology of the Bahamas and other Carbonate Regions. San Salvador, Bahamas. 11 p. [ Links ]
27 Goater, S., B. Derne y P. Weinstein. 2011. Critical issues in the development of health information systems in supporting environmental health: a case study of ciguatera. Environ. Health Persp., 119(5): 585-590. [ Links ]
28 Hales, S., P. Weinstein y A. Woodward. 1999. Ciguatera (fish poisoning), El Niño, and Pacific sea surface temperatures. Ecosyst. Health., 5(1): 20-25. [ Links ]
29 Hallegraeff, G., D.M. Anderson, A.D. Cembella y H.O. Enevoldsen. 2003. Manual on harmful marine microalgae. Unesco Publishing. París. 793 p. [ Links ]
30 Halstead, B.W. 1967. Poisonous and venomous marine animals of the world. U.S. Government Printing Office. Washington D.C. 132 p. [ Links ]
31 Halstead, B.W. 1970. Results of a field survey on fish poisoning in the Virgin and Leeward Islands during 7-18 January 1970. FAO Dep. Fish., Roma. 16 p. [ Links ]
32 Hearnden, M., C. Skelly, R. Eylesy y P. Weinstei. 2003. The regionality of campylobacteriosis seasonality in New Zealand. Int. J. Environ. Health Res., 13(4): 337-348. [ Links ]
33 Hughes, T. 1994. Catastrophes, phase shifts, and large-scale degradation of a Caribbean coral reef. Science, 265: 1547-1551. [ Links ]
34 Hughes, T., D. Reed y M. Boyle. 1987. Herbivory on coral reefs: community structure following mass mortalities of sea-urchins. J. Exp. Mar. Biol. Ecol., 113: 39-59. [ Links ]
35 Lawrence, D., M. Enríquez, R. Lumish y A. Maceo. 1980. Ciguatera fish poisoning in Miami. J. Am. Med. Assoc., 244: 254-258. [ Links ]
36 Legrande, A., M. Fukui, P. Cruchet y T. Yasumoto. 1992. Progress on chemical knowledge of ciguatoxins. Bull. Soc. Pathol. Exot., 85(5): 467-469. [ Links ]
37 Lehane, L. y R.J. Lewis. 2000. Ciguatera: recent advances but the risk remains. Int. J. Food Microbiol., 61: 91-125. [ Links ]
38 Lewis, N. 1986. Epidemiology and impact of ciguatera in the Pacific - a review. Mar. Fish. Rev., 48: 6 - 13. [ Links ]
39 Lewis, R. y M. Stelin. 1992. Multiple ciguatoxins in the flesh of fish. Toxicon, 30(8): 915-919. [ Links ]
40 McMichael, A., C. Butler y C. Folke. 2003. New visions for addressing sustainability. Science, 302: 1919-1920. [ Links ]
41 Morrison, K., P. Aguiar, A. Prieto, D. Castro, T. Waltner y J. Fitzgibbon. 2008. Ciguatera fish poisoning in La Habana, Cuba: A study of local social-ecological resilience. EcoHealth, 5: 346-359. [ Links ]
42 Olsen, D., W. Nellis, S. Richard y S. Wood. 1984. Ciguatera in the Eastern Caribbean. Mar. Fish. Rev., 46: 1-4. [ Links ]
43 Pottier, I., J.P. Vernoux, A. Jones y R.J. Lewis. 2002. Analysis of toxin profiles in three different fish species causing ciguatera fish poisoning in Guadeloupe, French West Indies. Food Addit. Contam., 19: 1034-1042. [ Links ]
44 Price, R. 1966. Caribbean fishing and fishermen: An historical sketch. Am. Anthropol., 68 (6): 1363-1383. [ Links ]
45 Rodríguez, A., J.E. Mancera y B. Gavio. 2010. Survey of benthic dinoflagellates associated to beds of Thalassia testudinum in San Andrés Island, sea flower biosphere reserve, Caribbean Colombia. Acta Biol. Colomb., 15(2): 231-248. [ Links ]
46 Rongo, T. y R. Van Woesik. 2011. Ciguatera poisoning in Rarotonga, southern Cook Islands. Harmful Algae., 10: 345-355. [ Links ]
47 Ruff, T. 1989. Ciguatera in the Pacific: a link with military activities. Lancet, 1(8631): 201-205. [ Links ]
48 Skinner, M., T. Brewer, R. Johnstone, L. Fleming y R. Lewis. 2011. Ciguatera fish poisoning in the Pacific Islands (1998 to 2008). PLos Negl. Trop. Dis., 5(12): 1-7. [ Links ]
49 Stinn, J.F., D.P. De Sylva, L.E. Fleming y E. Hack. 1998. Geographical Information Systems (GIS) and ciguatera fish poisoning in the tropical western Atlantic region. 223-233. En: Williams R.C., Howie M.M, Lee C.V, Henriques W.D. (Eds.) Proc. 1998 Geogr. Inform. Syst. Public Health, Third National Conference, San Diego, EE.UU. 662 p. [ Links ]
50 Suárez, M., M. Arteaga, J. Méndez, J. Cortés y R. Blanco. 2001. Epidemiología de la ciguatera en 16 años de estudio en la provincia de Ciego de Ávila. Rev. Cubana Hig. Epidemiol., 39: 3-5. [ Links ]
51 Tester, P.A. 1994. Harmful marine phytoplankton and shellfish toxicity potential consequences of climate change: 69-76. En: Wilson, M.E., R. Levins y A. Spielman, A. (Eds.). Disease in evolution: global changes and emergence of infectious diseases. The New York Academy of Sciences, Nueva York. 503 p. [ Links ]
52 Tester, P.A., R.L. Feldman, A.W. Nau, M.A. Faust y R.W. Litaker. 2009. Ciguatera fish poisoning in the Caribbean. Smith. Contrib. Mar. Sci., 38: 301-311. [ Links ]
53 Tester, P., R.L. Feldman, A.W. Nau, S.R. Kibler y R.W. Litaker. 2010. Ciguatera fish poisoning and seasurface temperatures in the Caribbean Sea and the West Indies. Toxicon, 56: 698-710. [ Links ]
54 Tosteson, T.R. 1995. The diversity and origins of toxins in ciguatera fish poisoning. P R Health Sci. J., 14(2): 117-129. [ Links ]
55 Yasumoto, T., I. Nakajima, R. Bagnis y R. Adachi. 1977. Finding of a dinoflagellate as a likely culprit of ciguatera. Bull. Jap. Soc. Sci. Fish., 43(8): 1021-1026. [ Links ]
56 Yasumoto, T., A. Inoue, T. Ochi, K. Fujimoto, Y. Oshima y Y. Fukuyo. 1980. Environmental studies on a toxic dinoflagellate responsible for ciguatera. Bull. Jap. Soc. Sci. Fish., 46(11): 1397-1404. [ Links ]
FECHA DE RECEPCIÓN: 12/08/2013 FECHA DE ACEPTACIÓN: 25/02/2014