Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.44 no.1 Santa Marta Jan./June 2015
ESTADO ACTUAL DE LA POBLACIÓN ADULTA DEL CANGREJO SEMITERRESTRE CARDISOMA GUANHUMI (LATREILLE) EN LA ISLA DE SAN ANDRÉS, CARIBE COLOMBIANO
PRESENT STATUS OF THE ADULT POPULATION OF THE SEMITERRESTRIAL CRAB CARDISOMA GUANHUMI (LATREILLE) IN SAN ANDRÉS, COLOMBIAN CARIBBEAN
Annelis Hernández-Maldonado1 y Néstor Hernando Campos Campos2
1 Universidad Veracruzana, Facultad de Ciencias Biológicas y Agropecuarias, Campus Tuxpan, Veracruz, México. E-mail: silena1087@hotmail.com.
2 CECIMAR, Universidad Nacional de Colombia sede Caribe, El Rodadero, Santa Marta, Colombia, E-mail: nhcamposc@unal.edu.co.
RESUMEN
San Andrés es la isla mayor del archipiélago de San Andrés, Providencia y Santa Catalina, ubicado en el Caribe colombiano. En ella están presentes los ecosistemas característicos de la regiones costeras tropicales, que le proporcionan hábitat al cangrejo semiterrestre Cardisoma guanhumi. Este estudio se realizó durante los meses de marzo y abril de 2012, teniendo como objetivo principal la evaluación preliminar de las poblaciones presentes en la isla. Se colectaron manualmente 101 individuos adultos y se registraron las determinaciones morfométricas (longitud y ancho del caparazón y peso) y sexo. Los machos mostraron un mayor tamaño en términos de peso y ancho del caparazón, así como en número de individuos, pues la proporción de sexos (machos: hembras) fue 3:1. Cardisoma guanhumi no tiene depredadores importantes en la isla, ya que no se le considera especie económicamente valiosa en el área, permitiéndole alcanzar mayores dimensiones en comparación con otras a lo largo de su distribución geográfica. Esto ha dado pie a que San Andrés pueda ser considerada como refugio natural para la especie, ya que en otras regiones de Colombia está categorizada como vulnerable.
PALABRAS CLAVES: San Andrés, Cardisoma guanhumi, Morfometría, Cangrejo semiterrestre, Caribe colombiano.
ABSTRACT
San Andrés, the largest island in the Colombian Caribbean, Archipelago of San Andrés, Providence and Santa Catalina, include characteristic tropical coastal ecosystems, which provide habitat for the semiterrestrial crab Cardisoma guanhumi. Between March and April 2012 a study was conducted aiming to make a preliminary evaluation of the crab population on the island. 101 adults crabs were collected manually and their main morphometric measurements were taken (carapace length and width and weight), as well as sex information. Males were more numerous (male: female sex ratio 3:1) and grew larger in terms of body weight and carapace. The species does not have any significant predators on the island and they are not considered by the islanders an economically important resource in this area; this may allow crabs to reach larger sizes compared to other localities along their geographical distribution. This is why the island of San Andres should be considered as a natural refuge for the species, since in other Colombian regions it is considered a vulnerable species.
KEYWORDS: San Andrés, Cardisoma guanhumi, Morphometry, Semiterrestrial crab, Colombian Caribbean.
INTRODUCCIÓN
La isla de San Andrés, con un área total de 27 km2 (Santos-Martínez et al., 2009) y como parte del archipiélago de San Andrés, Providencia y Santa Catalina, fue declarada como Reserva de Biosfera Seaflower en noviembre de 2000 por el Programa Hombre y la Biosfera, de la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura, Unesco (Baine et al., 2007). En la isla se encuentran asentadas poblaciones de varias especies de cangrejos terrestres, entre estos Cardisoma guanhumi (Latreille), el cual presenta un ámbito de distribución amplio que va desde el sureste de Florida hasta Brasil (Powers, 1977; Burggren y McMahon, 1988) y es conocido comúnmente como cangrejo blanco, mulato, juey, pollo de tierra o cangrejo paisano (Rejane y Oshiro, 2002; Barrios, 2008). El cangrejo cava una madriguera que desciende hasta el nivel freático en donde permanecen la mayor parte del tiempo; durante la estación seca sella la entrada de su madriguera con barro, dando lugar al proceso de muda, el cual disminuye con la edad (Hill, 2001); durante la temporada de lluvias y principalmente al anochecer son más activos (Rodríguez-Fourquet y Sabat, 2009). A lo largo de su ciclo de vida su coloración varía; individuos juveniles presentan color marrón oscuro, en etapa de transición es de color púrpura oscuro y naranja, mientras que los adultos tienen un color azul lavanda; en el caso de las hembras cambian a color blanco o amarillo apagado en el momento de la ovulación (Taissoun, 1974; Tavares, 2003). Su ciclo reproductivo depende de los patrones climáticos y las fases lunares, presentando migraciones masivas anuales durante la luna llena de los meses de mayor precipitación, al comienzo de la época de lluvias (Hill, 2001). El periodo de desove se extiende desde junio o principios de julio a diciembre, aunque existen pequeñas variaciones de acuerdo con la región y cambios en las temporadas de lluvias (Gifford, 1962; Hill, 2001). Cardisoma guanhumi tiene una función clave en la cadena alimentaria, son depredados por otros animales como aves y mamíferos (Gifford, 1962), participa en el reciclaje de nutrientes al ingerir hojas, semillas y material en descomposición, además de ser una fuente importante de proteínas e ingresos para las comunidades (Taissoun, 1974; Capistrán y Utrera, 2006; Takahashi, 2008). Una de las poblaciones más explotadas en el Caribe ha sido la de Puerto Rico, en donde es un foco importante en la pesquería artesanal, se explota también en Cuba, Brasil, México y Venezuela (Carmona-Suárez, 2011) y en el Caribe continental de Colombia, en donde ha sido aprovechada ampliamente, registrándose valores máximos de captura en Semana Santa, lo que ha conducido a que sea categorizada como especie vulnerable (VU) en el libro de especies amenazadas de Colombia (Santodomingo-Aguilar y Rueda, 2002; Rojas y Sierra-Correa, 2010). Específicamente para la isla de San Andrés las capturas son muy esporádicas; comercializándose solo en algunos restaurantes y utilizándolo como carnada para la pesca, ya que se tiene la creencia de ser un cangrejo "sucio" por sus hábitos alimentarios y los hábitats en los que se encuentra (Hernández-Maldonado, 2012).
Cardisoma guanhumi ha sido el centro de estudio de diversos trabajos, como Burggren y McMahon (1988) y Gifford (1962), que han sido la base para conocer sobre su distribución, relaciones, hábitat, hábitos alimentarios, reproducción y patrones de coloración; otros se han enfocado en la estimación de la densidad poblacional, métodos de captura, conocimiento etnoecológico y filogeográfico, desde Powers (1977) hasta Firmo et al. (2012). El objetivo de este trabajo fue evaluar preliminarmente las poblaciones de Cardisoma guanhumi presentes en la isla de San Andrés, Colombia, mediante la caracterización de las variables morfométricas principales de los individuos adultos, ya que no existe un estudio precedente para la especie en la región.
ÁREA DE ESTUDIO
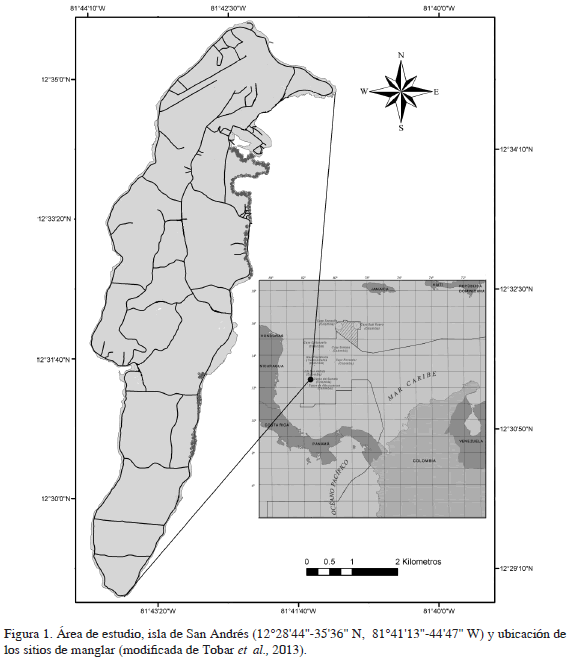
San Andrés es la isla mayor del archipiélago de San Andrés, Providencia y Santa Catalina, localizada a 800 km de la costa continental colombiana (Figura 1). Su clima es seco tropical y su temperatura media anual es de 27.4°C ± 1°C (Campos et al., 2005). El departamento tiene una extensión de línea de costa de 72 km aproximadamente y un área terrestre de 44 km2 (52.5 km2, incluyendo los cayos) (Posada et al., 2009), sus ecosistemas son representativos de regiones tropicales, encontrando arrecifes de coral, praderas de pastos marinos, manglares y bosques secos que albergan puntos de alto endemismo (Santos-Martínez et al., 2009).
MATERIALES Y MÉTODOS
Fase de Campo
Se recolectaron individuos al azar, durante los meses de marzo y abril de 2012, considerando sólo los que se encontraban fuera de sus madrigueras, para evitar un muestreo invasivo. Cada individuo fue medido en la región dorsal del caparazón: longitud (CTL) y ancho (CTW) en mm, con un vernier digital marca AutoTEC de 0.02 mm de precisión, pesado con un dinamómetro plástico de 1000 g de capacidad (TW) y sexado. En el caso de las hembras, se registró adicionalmente ovadas y no ovadas. A cada individuo se le asignó un número que fue plasmado en la región cardiaca con un marcador permanente, para evitar la sobreestimación contando al individuo varias veces, posteriormente se procedió a su liberación. Los individuos fueron recolectados en las zonas de manglar, en sus inmediaciones y en los sitios en donde los isleños mencionaban haber detectado ejemplares de C. guanhumi.
Análisis Estadístico
Todas las pruebas estadísticas se realizaron con el programa Statgraphics Plus, Versión 5.1 con α = 0.05, 1 gl. Los datos tomados de los individuos capturados (longitud y ancho del caparazón y peso) fueron previamente sometidos a una prueba de normalidad; los datos se evaluaron con estadística descriptiva, realizándose una prueba t-Student para la variable CTW para machos y hembras. Las variables CTL, CTW y TW se sometieron a un análisis de regresión de tipo lineal para machos y hembras, al igual para las medidas longitud: ancho y peso: ancho:
CTL= a + b * CTW
TW = a + b * CTW
Una prueba de χ2 se realizó para determinar la relación de sexos en la localidad de estudio, en esta prueba se contrasta la frecuencia observada, respecto a la esperada 1:1 para la relación machos: hembras y se evalúa mediante la fórmula:
χ2= Σ (Oî - Eî )2 / Eî
Se estableció una frecuencia de sexos por intervalo de talla con base en la ecuación propuesta por Creasey et al. (2000) (donde el valor de cero indica igual número de machos que de hembras, valores positivos indican mayor número de machos que de hembras y valores negativos indican mayor número de hembras que de machos), estableciendo así la dominancia de machos respecto a hembras en cada intervalo, cero corresponde a la relación 1:1, determinándose bajo la siguiente fórmula:
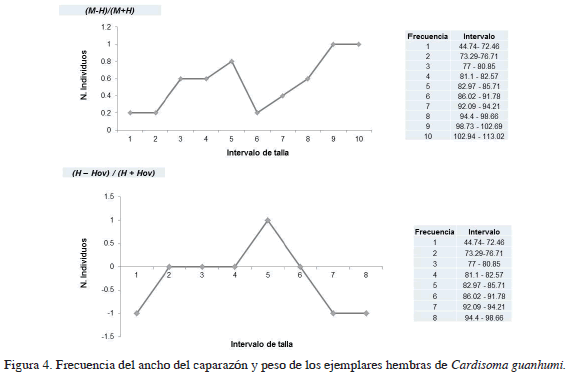
S0 = (M - H) / (M+ H)
Dónde: M= Número de machos en la muestra y H= Número de hembras en la muestra.
Aplicándose de igual forma para obtener la proporción de hembras ovadas respecto a las no ovadas (el valor de cero indica igual número de hembras no ovadas que de ovadas, valores positivos indican mayor número de hembras no ovadas y valores negativos indican mayor número de ovadas):
S0 = (H - Hov) / (H + Hov)
Dónde: H = número de hembras no ovadas (incluyendo juveniles y adultas) y Hov = número de hembras ovadas.
RESULTADOS
Estructura de la población
Se recolectó un total de 101 individuos durante los dos meses de estudio, determinándose 79 individuos machos (78.2%) y 22 hembras (21.9%), de las cuales 15 estaban ovadas (14.85%). La proporción de sexos de las poblaciones de C. guanhumi en la temporada de estudio, a diferencia del esperado 1:1, mostró una relación 3:1 en la que los machos tuvieron mayor representatividad.
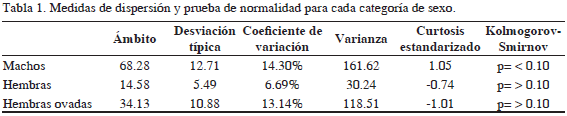
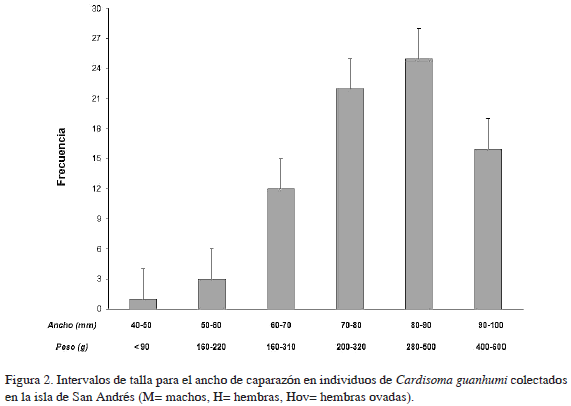
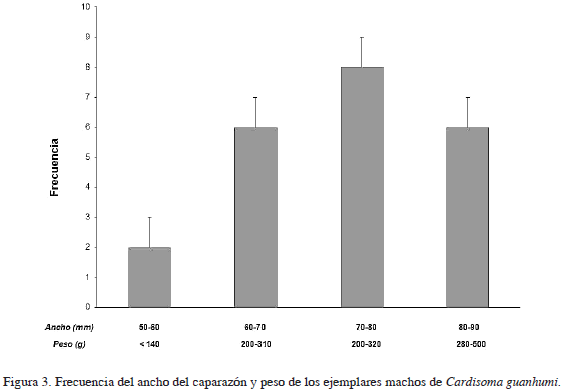
De las observaciones realizadas durante la temporada de estudio, se determinó que el ancho promedio del caparazón para los individuos fue de 87.51 mm, manteniéndose alrededor de 82.00 ± 9.36 mm en hembras (incluyendo no ovadas y ovadas), incrementándose esta talla en machos (88.87 ± 12.71 mm). Las medidas de dispersión muestran que los datos se alejan de la distribución normal; sin embargo, el valor estandarizado de curtosis está dentro del ámbito esperado para los datos de una distribución normal (Tabla 1). La prueba t-Student muestra claramente que los machos alcanzan tallas más grandes (t = 2.544, p = 0.007). El valor promedio de la longitud del caparazón (CTL) en machos fue de 73.85 ± 10.36 y 68.67 ± 7.23 para hembras; con un peso total (TW) de 347.21 ± 114.06 g en machos y 270 ± 80.65 en hembras (Figuras 2 y 3).
Solo se recolectaron individuos adultos de ambos sexos (Tabla 2), ya que todas las capturas fueron manuales (sin la utilización de trampas) y los individuos capturados estaban fuera de sus madrigueras. Aunque durante los recorridos se observó la presencia de individuos juveniles y transicionales, de acuerdo con la coloración de los caparazones.
Frecuencia de sexos por intervalo de talla
Para todos los intervalos de talla establecidos para machos y hembras, los machos son notablemente más abundantes que las hembras. Por otro lado, la relación 1:1 para hembras: hembras ovadas se cumple en la mitad de los intervalos de talla, en tres de los intervalos remanentes hay una tendencia al incremento de hembras ovadas y en sólo un intervalo (82.97-85.71 mm) las hembras no ovadas son predominantes (Figura 4).
Relaciones morfométricas
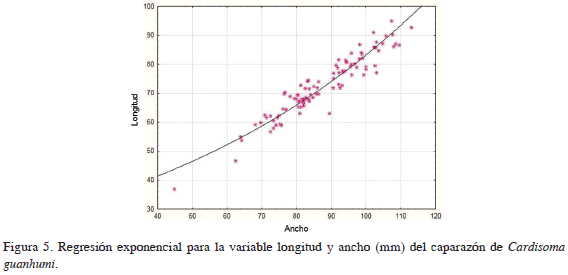
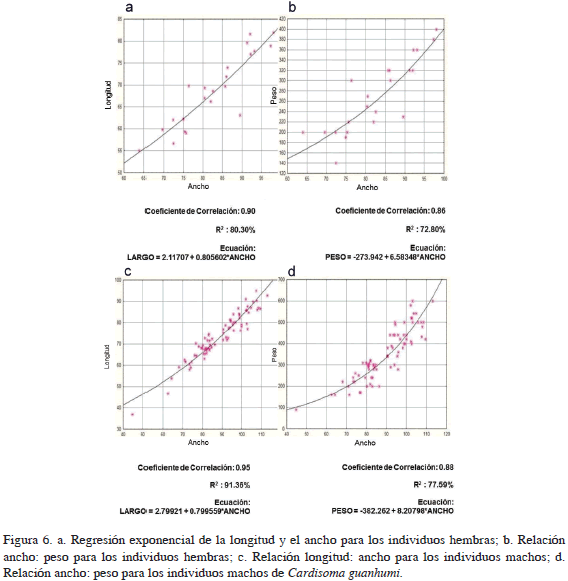
Los contrastes en las categorías de sexos se realizaron con base en una sola variable (CTW), ya que el análisis de correlación de tipo lineal entre longitud y ancho del caparazón muestra una relación significativa (coeficiente de correlación: 0.95, R2 = 90.33%) (Figura 5). Se observa que en los contrastes de las categorías de sexos para hembras: hembras ovadas el coeficiente de correlación es de 0.95 (R2 = 88.41%), para hembras ovadas: machos coeficiente de correlación: 0.85 (R2 = 71.05%), para hembras: machos coeficiente de correlación: 0.85 (R2 = 67.28%), indicando la existencia de una correlación en los tres contrastes. El análisis de regresión lineal para las medidas longitud: ancho y peso, ancho determinó que tanto para machos como para hembras existe relación estadísticamente significativa con un nivel de confianza del 99%. Se observa para ambos sexos la presencia de un crecimiento alométrico positivo (Figura 6).
DISCUSIÓN
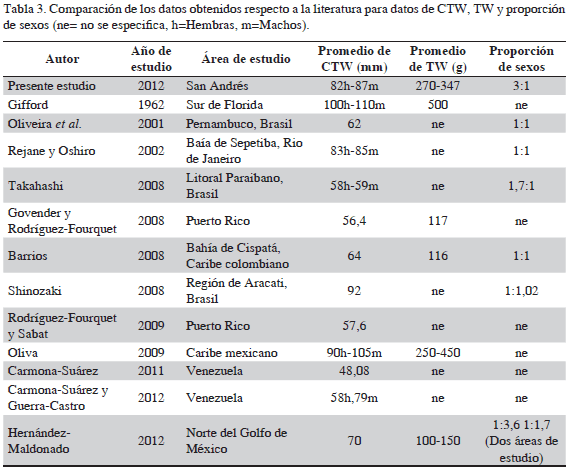
El presente estudio aporta información relevante para al conocimiento de la población de C. guanhumi presente en la isla San Andrés. En esta región del Caribe colombiano no es una especie económicamente importante; sin embargo, el impacto ecológico que tiene en los ecosistemas donde habita es fundamental, pues la excavación de sus madrigueras permite la aireación del suelo y el fraccionamiento de hojas y desechos, facilitando la rápida circulación de nutrientes. Diversos trabajos se han enfocado en el estudio de C. guanhumi en áreas diferentes del conocimiento, se ha observado que su exoesqueleto puede proporcionar una rica fuente de información biológica, estableciendo así qué determinaciones morfométricas como el ancho total de caparazón puede ser utilizada como una herramienta práctica en el monitoreo ambiental (Duarte et al., 2008); en este trabajo el promedio de CTW muestra que, en general, los individuos son de gran tamaño, en comparación con la mayoría de la información que se tiene de otras áreas geográficas (Tabla 3).
Se observa que las poblaciones de C. guanhumi, así como el tamaño del exoesqueleto de los individuos, pueden variar de acuerdo con su distribución geográfica, disponibilidad de alimento, refugio o intensidad de captura (Burggren y McMahon, 1988; Carmona-Suárez, 2011). Durante el trabajo de campo se observó que los factores antes mencionados no tienen una influencia negativa en la población de cangrejo azul en la isla, basado esto en que los individuos colectados presentaron pesos elevados, con promedios cercanos a los publicados por Gifford (1962) y Posada (2009) (Tabla 3).
La diferencia en la proporción de sexos en diferentes poblaciones ha estado mínimamente alejada de las proporciones esperadas (1:1), en la mayor parte de la literatura la proporción de sexos fue 1:1. Por otro lado, Shinozaki (2008) y Takahashi (2008) registraron proporciones diferentes para hembras y machos. En este trabajo se observa una proporción que dista mucho de la segregación esperada, siendo mucho mayor el número de machos con una relación 3:1, probablemente debido a la época de estudio (Tabla 3), ya que al ser temporada de prereproducción las hembras pasan la mayor parte del tiempo en sus madrigueras alimentándose, ganando peso y guardando así reservas energéticas para la fase migratoria. Por el contrario, los machos, al contar con sólo una quela funcional y una hipertrofiada, se ven en la necesidad de salir constantemente de sus madrigueras para conseguir alimento (Duarte et al., 2008). La temporada de estudio también muestra un empalme con el periodo de mayor actividad del macho (Taissoun, 1974).
El tamaño del caparazón de C. guanhumi, así como el de sus congéneres, se da en respuesta a la función y frecuencia de la muda; por esta razón, la relación entre la longitud y el ancho del caparazón es constante durante toda su vida. En este trabajo, el análisis de regresión lineal entre estas dos variables arrojó correlación significativa, observándose también en las publicaciones de Shinozaki (2008), Carmona-Suárez y Guerra-Castro (2012) y en el norte del Golfo de México (Hernández-Maldonado, 2012). Se observa también una relación positiva entre el ancho del caparazón y el peso, este comportamiento es generalizado en Gecarcinidae; sin embargo, los machos son de mayor tamaño y peso que las hembras, atribuido a que el ritmo de crecimiento en hembras es menor por la mayor cantidad de energía invertida en el proceso reproductivo (Turner et al., 2011) o, como en muchas especies de cangrejos, las hembras detienen el crecimiento después del primer desove. Las observaciones realizadas en este estudio muestran que los individuos de C. guanhumi en la isla logran alcanzar grandes dimensiones debido a su escasa depredación, ello puede dar paso a un aprovechamiento sustentable y/o a que San Andrés pueda ser considerada como refugio natural para la especie.
CONCLUSIONES
En San Andrés los individuos de Cardisoma guanhumi muestran un crecimiento positivo, a mayor ancho de caparazón mayor peso, con pesos máximos de 600 g, indicando que el hecho de no contar con fuertes depredadores le da a la especie la oportunidad de alcanzar mayores tallas y muy probablemente ser más longevos en comparación con otras áreas a lo largo de su distribución geográfica donde es considerada económicamente importante y su depredación desemboca en individuos más pequeños.
Se hace necesario contar con datos a través del tiempo y no solo en una temporada, así como la recolecta de individuos en sus diferentes etapas de desarrollo. Sin duda, este trabajo podrá ser introductorio a nuevas investigaciones de la especie en esta zona.
AGRADECIMIENTOS
Agradecimientos a la sede Caribe de la Universidad Nacional de Colombia por el apoyo brindado a uno de los autores (AH) para la realización de la pasantía. A cada uno de los investigadores de la sede que de una u otra manera colaboraron con la recolecta de información. Contribución No. 413 del Instituto de Estudios en Ciencias del Mar, CECIMAR, Sede Caribe, Universidad Nacional de Colombia.
BIBLIOGRAFÍA
1 Baine, M., M. Howard, S. Kerrc, G. Edgard y V. Torale. 2007. Coastal and marine resource management in the Galapagos Islands and the Archipelago of San Andrés: Issues, problems and opportunities. Ocean Coastal Manag., 50: 148-173. [ Links ]
2 Barrios, L. 2008. Aspectos biológicos y ecológicos del cangrejo azul (Cardisoma guanhumi, Latreille, 1825) en la Bahía de Cispatá, Caribe colombiano. Tesis Universidad Jorge Tadeo Lozano. Bogotá. 138 p. [ Links ]
3 Burggren, W. y R. McMahon. 1988. Biology of the land crabs. Cambridge University Press, Cambridge, 477 p. [ Links ]
4 Campos C., N.H., G. Navas, A. Bermúdez T. y N. Cruz C. 2005. Los crustáceos decápodos de la franja superior del talud continental (300-500 m) del mar Caribe colombiano. Universidad Nacional de Colombia, Instituto de Ciencias Naturales, Bogotá. 272 p. [ Links ]
5 Capistrán, B. y L. Utrera 2006. Los cangrejos semiterrestres. Entornos Veracruzanos: La Costa de la Mancha: 461-476. Instituto de Ecología, A.C., Xalapa, Ver. México. 539 p. [ Links ]
6 Carmona-Suárez, C. 2011. Present status of Cardisoma guanhumi Latreille, 1828 (Crustacea: Brachyura: Gecarcinidae) populations in Venezuela. Interciencia, 36(12): 908-913. [ Links ]
7 Carmona-Suárez, C. y E. Guerra-Castro. 2012. Comparison of three quick methods to estimate crab size in the land crabs Cardisoma guanhumi and Ucides cordatus (Crustacea: Brachyura: Gecarcinidae and Ucididae). Rev. Biol. Trop. 60(Suppl. 1): 139-149. [ Links ]
8 Creasey, S., A. Rogers, P. Tyler, J. Gage y D. Jollivet. 2000. Genetic and morphometric comparisons of squat lobster, Munidopsis scobina (Decapoda: Anomura: Galatheidae) population with notes on the phylogeny of the genus Munidopsis. Deep Sea Res. 47(2): 87-118. [ Links ]
9 Duarte, M., A. Francisco y F. Wagner. 2008. Interpopulational morphological analyses and fluctuating asymmetry in the brackish crab Cardisoma guanhumi (Latreille) (Decapoda, Gecarcinidae), on the Brazilian northeast coastline. Pan-Amer. J. Aq. Sci., 3(3): 294-303. [ Links ]
10 Firmo, A., M. Tognella, S. Silva, R. Barboza y R. Alves. 2012. Capture and commercialization of blue land crabs ("guaiamum") Cardisoma guanhumi (Latreille,1825) along the coast of Bahia State, Brazil: an ethnoecological approach. J. Ethnobiol. Ethnomed., 8: 12 p. [ Links ]
11 Gifford, C. 1962. Some observations on the general biology of the land crab, Cardisoma guanhumi (Latreille) in south Florida. Biol. Bull., 123: 207-223. [ Links ]
12 Govender, Y. y C. Rodríguez-Fourquet. 2008. Techniques for rapid assessment of population density and body size of the land crab Cardisoma guanhumi (Latreille, 1825) in Puerto Rico. Trop. Est., 1: 9-15. [ Links ]
13 Hernández-Maldonado, A. 2012. Aspectos biológicos y poblacionales de Cardisoma guanhumi (Latreille, 1825), en la Laguna de Tampamachoco y Majahual en Tuxpan, Veracruz. Tesis Universidad Veracruzana, Facultad de Ciencias Biológicas y Agropecuarias. Tuxpan, México. 87 p. [ Links ]
14 Hill, K. 2001. "Cardisoma guanhumi" Disponible en: <http://www.sms.si.edu/IRLSpec/Cardis_guanhu.htm>. 20/10/2007. [ Links ]
15 Oliva, J. 2009. El cangrejo terrestre Cardisoma guanhumi ¿un recurso pesquero? ECOfronteras. 25: 15-17. [ Links ]
16 Oliveira, B., S. Ferrão y S. de Botelho. 2001. Aspectos populacionais do guaiamum, Cardisoma guanhumi Latreille, 1825, do estuário do Rio Una (Pernambuco - Brasil). Bol. Técn. Cient. CEPENE, Tamandaré, 9(1): 123-146. [ Links ]
17 Posada, B., M. Rozo, J. Bolaños y A. Zamora. 2009. 1 Marco geográfico. 19-26 p. Informe del Estado de los Ambientes y Recursos Marinos y Costeros en Colombia: 2008. Serie de Publicaciones Periódicas Invemar No. 8. Santa Marta, 244 p. [ Links ]
18 Powers, W. 1977. Crabs (Brachyura) of the Gulf of Mexico. University of Texas Marine Science Institute, Port Aransas, EE.UU. 190 p. [ Links ]
19 Rejane, S. e Y. Oshiro. 2002. Aspectos da reprodução do caranguejo guaiamum, Cardisoma guanhumi Latreille (Crustacea, Decapoda, Gecarcinidae) da Baía de Sepetiba, Rio de Janeiro, Brasil. Rev. Bras. Zool., 19(Supl. 1): 71-78. [ Links ]
20 Rodríguez, E., G. Ardila y J. Páramo. 2012. Relaciones morfométricas de crustáceos de profundidad de importancia comercial en el mar Caribe Colombiano. Morfometría crustáceos de profundidad. Bol. Cient. Cent. Mus. Hist. Nat., 16(2): 236-245. [ Links ]
21 Rodríguez-Fourquet, C. y A. Sabat. 2009. Effect of harvesting, vegetation structure and composition on the abundance and demography of the land crab Cardisoma guanhumi in Puerto Rico. Wetlands Ecol. Manag., 17: 627-640. [ Links ]
22 Rojas, X. y P. Sierra-Correa. 2010. Plan integral de manejo del Distrito de Manejo Integrado (DMI) bahía de Cispatá - La Balsa-Tinajones y sectores aledaños del delta estuarino del río Sinú, departamento de Córdoba. Serie de Publicaciones Especiales No. 18 Invemar. Santa Marta. 141 p. [ Links ]
23 Santodomingo-Aguilar, N. y M. Rueda. 2002. Diversidad de especies marinas en Colombia: 217-236. En: Informe del estado de los ambientes marinos y costeros en Colombia. Serie Publicaciones Periódicas 8 de INVEMAR. Santa Marta. 208-225. [ Links ]
24 Santos-Martínez, A., S. Hinojosa y O. Sierra. 2009. Proceso y avance hacia la sostenibilidad ambiental: la Reserva de la Biosfera Seaflower, en el Caribe Colombiano. Cuad. Carib., 13: 7-23. [ Links ]
25 Shinozaki, A. 2008. Biologia reprodutiva do guaiamum, Cardisoma guanhumi Latreille, 1828 (Decapoda: Gecarcinidae) na região de Aracati/Ce. Tesis Universidade Federal Rural de Pernambuco. Recife, Brasil. 91 p. [ Links ]
26 Taissoun, E.N. 1974. El cangrejo de tierra Cardisoma guanhumi (Latreille) en Venezuela: distribución, ecología biología y evaluación poblacional. Bol. Centro Invest. Biol., Univ. Zulia, 10: 8-50 p. [ Links ]
27 Takahashi, M. 2008. Conhecimentos locais e a cadeia produtiva do goiamum (Cardisoma guanhumi, Latreille, 1825) no litoral paraibano. Tesis Universidade Federal da Paraíba / Universidade Estadual da Paraíba. João Pessoa, Brasil. 76 p. [ Links ]
28 Tavares, M. 2003. True crabs. En: Fischer, W. (Ed.). FAO species identification sheets for fishery purposes: Western Central Atlantic (Fishing Area 31). FAO, Roma. 327-352 p. [ Links ]
29 Tobar-Vargas, A., B. Gavio y J.L. Fernández. 2013. New records of plants for San Andres and Old Providence islands (International Biosphere Reserve Seaflower), Caribbean Colombia. Check List, 9(6): 1361-1366. [ Links ]
30 Turner, L., J.P. Hallas y S. Morris. 2011. Population structure of the Christmas Island blue crab, Discoplax hirtipes (Decapoda: Brachyura: Gecarcinidae) on Christmas Island, Indian Ocean. J. Crust. Biol., 31(3): 450-457. [ Links ]
FECHA DE RECEPCIÓN: 12/08/2013 FECHA DE ACEPTACIÓN: 22/04/2015