Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.44 no.1 Santa Marta Jan./June 2015
BIODIVERSIDAD MARINA EN BAJO NUEVO, BAJO ALICIA Y BANCO SERRANILLA, RESERVA DE BIOSFERA SEAFLOWER
MARINE BIODIVERSITY IN REMOTE AREAS IN THE COLOMBIAN CARIBBEAN: NEW SHOAL, ALICE SHOAL AND SERRANILLA BANK
Johanna Vega-Sequeda, Christian M. Díaz-Sánchez, Kelly Gómez-Campo, Tomás López-Londoño, Martha Díaz-Ruiz y Diana Isabel Gómez-López
Instituto de Investigaciones Marinas y Costeras (INVEMAR). Calle 25 No. 2-55, Playa Salguero, Santa Marta, Colombia. johavega@gmail.com, christian.diaz@invemar.org.co, kellygomezcampo@gmail.com, tolopez@gmail.com, mardiazr@gmail.com, diana.gomez@invemar.org.co.
RESUMEN
En 2011 se evaluaron los ecosistemas marinos someros (0-30 m de profundidad) en los complejos arrecifales oceánicos del extremo norte del Caribe colombiano: bajo Nuevo, bajo Alicia (Área de Régimen Común entre Colombia y Jamaica) y banco Serranilla, en la Reserva de Biosfera Seaflower. Mediante análisis visuales de imágenes satelitales se definieron a priori estaciones de muestreo en las que se realizaron evaluaciones ecológicas rápidas para registrar la composición y abundancia relativa de las especies y grupos más representativos de la biota marina existente en cada banco oceánico (corales duros, esponjas, octocorales, macroinvertebrados, peces, macroalgas y pastos marinos). Se registraron 341 especies en banco Serranilla, 242 en bajo Nuevo y 122 en bajo Alicia, siendo los peces el grupo más representativo con un total de 135 especies registradas. Se encontraron siete especies exclusivas en bajo Alicia, 42 en bajo Nuevo y 128 en banco Serranilla. En las tres áreas se registraron 18 especies con alguna categoría de amenaza a nivel mundial y nacional; tres de ellas, Gorgonia ventalina, Ginglymostoma cirratum y Balistes vetula, se encontraron en importantes proporciones en todos los bajos. Los resultados indican que estas áreas remotas poseen una importante riqueza de especies y variedad de ambientes marinos que resaltan su importancia como posibles reservorios de la biodiversidad en el Caribe colombiano.
PALABRAS CLAVES: Ecosistemas marinos someros, Inventarios biológicos, Especies amenazadas, Cayos del norte, Caribe colombiano.
ABSTRACT
In 2011, shallow marine ecosystems were evaluated (0-30 m depth) in the oceanic reef complexes in the northern Colombian Caribbean, including New Shoal, Alice Shoal (Colombia-Jamaica Joint Regime Area) and Serranilla Bank, in the Seaflower Biosphere Reserve. Sampling stations were defined a priori through visual analysis of satellite images. Ecological Rapid Assessments were conducted to record the composition and relative abundance of the most representative species and groups existing in each oceanic shoal (hard corals, macroalgae, sponges, octocorals, macroinvertebrates, seagrass beds, and fishes). The greatest number of species was registered in Serranilla Bank (341), followed by New Shoal (242) and Alice Shoal (122). Fishes were the most representative group with 135 species. Seven exclusive species were found in Alice Shoal, 42 in New Shoal and 128 in Serranilla Bank. 18 species were registered with endangered categories at a global and national level, three of which (Gorgonia ventalina, Ginglymostoma cirratum and Balistes vetula) were found in important proportions. Species richness and the diversity of marine ecosystems found in this study highlight the importance of these remote areas as reserves of biodiversity in the Colombian Caribbean.
KEYWORDS: Shallow marine ecosystems, Biological inventories, Threatened species, Northern Cays, Colombian Caribbean.
INTRODUCCIÓN
El mar Caribe es una cuenca semicerrada del océano Atlántico occidental, rodeado por las costas de sur y centro América, la península de Yucatán y la cadena de las Antillas. Hace parte de la Provincia del Atlántico Noroccidental Tropical, la cual incluye nueve ecorregiones (Spalding et al., 2007). De acuerdo con los últimos estimativos de la biodiversidad marina en el Caribe, se han registrado 12046 especies (Miloslavich et al., 2010). En el Caribe colombiano se han registrado cerca de 4945 especies de flora y fauna marina, aproximadamente 41% de las conocidas para todo el Caribe (Gracia et al., 2011), aunque se espera, con la realización de futuras investigaciones, que aumente el número de especies registradas para la mayoría de los grupos taxonómicos. En el archipiélago de San Andrés, Providencia y Santa Catalina se conoce la existencia de ecosistemas diversos y de importante riqueza de especies, representada principalmente por los grupos de peces, corales y octocorales (Sánchez et al., 1997, 2005; Mejía y Garzón-Ferreira, 2000; Linton y Fisher, 2004; Navas-Camacho et al., 2010a, 2010b; Rodríguez-Ramírez et al., 2010), esponjas (Zea, 2001), pastos marinos (Díaz et al., 2003) y macroalgas (Díaz- Pulido y Díaz, 1997; Gavio y Wynne, 2013). Sin embargo, debido a la lejanía de centros urbanos, los complejos arrecifales oceánicos bajo Nuevo, bajo Alicia y banco Serranilla han sido menos estudiados (Díaz et al., 1996, 2000; Geister y Díaz, 1996, 2007; Dimar-CIOH, 2009; Abril-Howard et al., 2010; Bent et al., 2012; Bruckner, 2012).
En la actualidad, los espacios oceánicos despiertan especial interés por el potencial de sus recursos marinos y del subsuelo, siendo una alternativa de explotación; sin embargo, es poco lo que se conoce del estado de las poblaciones naturales, su valor ecológico, socioeconómico y político. Estos intereses por la búsqueda de recursos convierten a los espacios marinos en áreas vulnerables. Por tal motivo es importante consolidar el conocimiento para cubrir vacíos de información especialmente en áreas remotas y poder diseñar e implementar lineamientos de manejo responsables que incluyan la conservación del ambiente y los actores locales y regionales (gobierno, industria, población humana, entre otros).
En este estudio se presentan los resultados de los inventarios biológicos de fondos someros realizados durante la expedición científica del Instituto de Investigaciones Marinas y Costeras ‘José Benito Vives de Andreis' (Invemar) durante 2011. Las áreas estudiadas incluyen los complejos arrecifales oceánicos bajo Nuevo, bajo Alicia y banco Serranilla entre 0 y 30 m de profundidad. Se describe la composición y abundancia relativa de las especies en los diferentes grupos de organismos más representativos (corales, macroalgas, esponjas, octocorales, macroinvertebrados, pastos marinos y peces) y la presencia de especies bajo alguna categoría de amenaza y que son prioritarias para la conservación (MAVDT, 2010; IUCN, 2012). Esta información hace parte del documento Invemar y ANH (2012) en el que adicionalmente se realizó una caracterización general de los ecosistemas marinos someros y profundos en el área de estudio.
ÁREA DE ESTUDIO
Bajo Nuevo, bajo Alicia y banco Serranilla se encuentran en el mar Caribe, al norte del archipiélago de San Andrés, Providencia y Santa Catalina, donde limitan con Nicaragua, Honduras y Jamaica. Desde el 2000, el Archipiélago fue declarado como Reserva de Biósfera Seaflower y una porción de 65018 km2 como Área Marina Protegida (AMP) en 2005. Las áreas del norte de la Reserva se incluyen entre las que han sido objeto de la mayor explotación pesquera e influenciadas por las decisiones políticas y por el diferendo limítrofe que persiste con Nicaragua (INAP, 2011). Estos complejos oceánicos de aguas someras están conformados por plataformas carbonatadas, barreras arrecifales con aspecto de semiatolones y lagunas arrecifales con diversas geomorfologías (Geister y Díaz, 2007; DIMAR-CIOH, 2009).
Bajo Nuevo
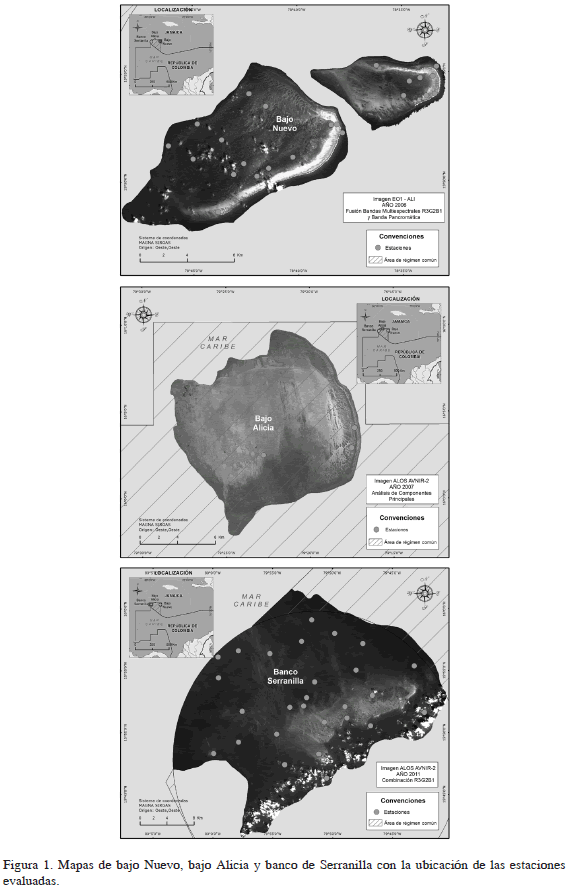
Se encuentra entre los puntos geográficos 15°48'-54' N y 78°32'-47' W. Es un área con una formación arrecifal tipo atolón localizada al sureste de bajo Alicia y aproximadamente a 120 km al este del banco Serranilla (DIMAR-CIOH, 2009). Presenta una barrera periférica en los flancos este y sur, segmentada por un canal de aproximadamente 1.4 km de ancho (Abril- Howard et al., 2010) que también divide el bajo en dos elevaciones principales para un área total de aproximadamente 100 km2 (Figura 1).
Bajo Alicia
Está localizado entre banco Serranillla y bajo Nuevo, entre los puntos geográficos 16°03'-05' N y 79°17'-28' W y corresponde al "Área de Régimen Común (ARC)" entre Colombia y Jamaica de acuerdo al "Tratado binacional de delimitación marítima Sanín-Robertson de 1993", que estableció que esta área sea administrada en conjunto por ambos países, así como su soberanía. El Bajo presenta una forma circular, con un área aproximada de 200 km2 (Abril-Howard et al., 2010). Es un atolón totalmente sumergido (Figura 1), el cual no evidencia claramente una barrera arrecifal periférica, sin embargo, en el extremo oriental se encuentra una estructura similar a una barrera poco desarrollada con una profundidad cercana a 12 m.
Banco Serranilla
Se encuentra localizado entre los puntos geográficos 15°47'-52' N y 79°45'-80°03' W. El banco tiene forma casi circular ocupando un área aproximada de 1100 km2 y está clasificado geomorfológicamente como un semiatolón con una barrera arrecifal periférica discontinua ubicada al costado sureste. La barrera contiene una serie de cayos y elevaciones que pueden emerger parcialmente durante las mareas bajas, siendo Serranilla el más grande de los cayos (Geister y Díaz, 2007; Figura 1). Esta isla posee una vegetación dispersa entre la que se encuentran la palma de coco (Cocos nucifera), uva de mar (Coccoloba uvifera) y lavenda (Tournefortia gnaphalodes), además es una zona de anidación de las tortugas caguama (Careta careta), verde (Chelonia mydas) y carey (Eretmochelys imbricata). Asimismo, hace presencia jurisdiccional una instalación militar de la Infantería de Marina de la Armada Nacional de Colombia.
MATERIALES Y MÉTODOS
Diseño de muestreo
Se interpretaron a partir de análisis visuales una serie de imágenes satelitales previamente procesadas con el fin de obtener una aproximación general a los tipos de fondo encontrados en las zonas someras (< 30 m) del área de estudio. Las diferencias observadas en los valores digitales de los pixeles de las imágenes de satélite permitieron asumir la presencia de diferentes tipos de fondo en las áreas de muestreo. Con el fin de facilitar la organización del trabajo en campo, se sectorizaron las tres áreas de acuerdo con su extensión y se georreferenciaron una serie de posibles estaciones de muestreo procurando abarcar la mayor cantidad de tipos de fondo. De esta forma, banco Serranilla, el área más extensa, contó con 12 sectores, seguida de bajo Nuevo con cinco y bajo Alicia con cuatro (Figura 1).
Se realizaron evaluaciones rápidas Fast Surveys en parcelas de 400 m2 (20 x 20 m) aproximadamente, donde se estimaron las coberturas (%) de los principales componentes del sustrato, se realizaron inventarios de grupos taxonómicos (corales, algas, esponjas, moluscos, crustáceos y peces) y se les dio una categoría de abundancia (1: escaso, 2: común, 3: abundante), se colectaron organismos que no se pudieron identificar en campo para su posterior análisis en laboratorio y se realizaron registros fotográficos. Todos los individuos se identificaron hasta el nivel taxonómico más bajo posible. Los datos registrados en campo se complementaron con los registros fotográficos de organismos y se verificó la información con material bibliográfico de otros estudios.
La expedición se realizó en agosto de 2011; en total se evaluaron 53 estaciones, entre 0 y 30 m de profundidad, distribuidas así: 23 en bajo Nuevo, 3 en bajo Alicia y 27 en banco Serranilla. En cada estación se anotó información básica (coordenadas geográficas, profundidad, observaciones generales, unidad ecológica y geomorfológica).
Análisis de información
Se estimó la riqueza específica (S = número de especies) y frecuencia de observación de los organismos de cada área evaluada. Se tuvo en cuenta las especies de peces e invertebrados de importancia comercial teniendo en cuenta los criterios de Cervigón et al. (1993), Garzón-Ferreria et al. (2002), Coralina-Invemar (2012), lista ASFIS (FAO, 2014) y Jackson et al. (2014). Adicionalmente, con el fin de identificar especies prioritarias para la conservación en el área de estudio, se seleccionaron aquellos organismos que por tener un riesgo potencial de desaparición en próximos años, son reconocidos como "especies amenazadas" a nivel mundial y nacional o con base en las categorías y lineamientos empleados por la IUCN (International Union for Conservation of Nature and Natural Resources; IUCN, 2012), los libros rojos de especies amenazadas de Colombia y la normativa legal vigente (Ardila et al., 2002; Castaño-Mora, 2002; Mejía y Acero, 2002; MAVDT, 2010).
RESULTADOS Y DISCUSIÓN
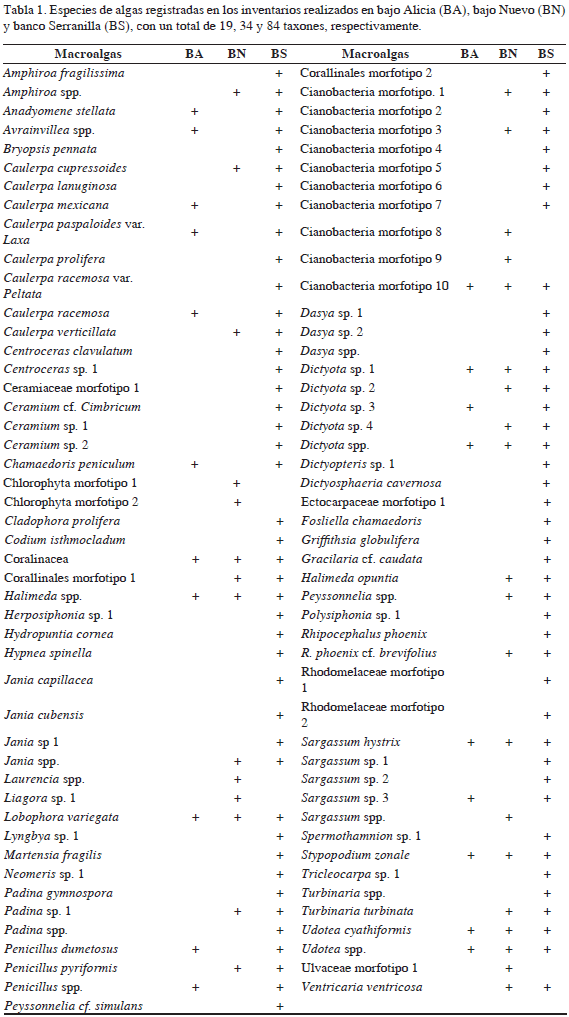
A nivel general, las macroalgas fueron el grupo dominante del sustrato en cada una de las tres áreas. Las algas pardas (Heterokontophyta, 16 especies), representadas por los géneros Dictyota, Turbinaria, Lobophora, Stypopodium y Sargassum fueron las más frecuentes, así como las algas verdes (Chlorophyta, 22 especies), que incluyeron géneros conspicuos como Caulerpa, Penicillus, Rhipocephalus y Udotea (Tabla 1). También se identificaron algas rojas (Rhodophyta, 23 especies) y una interesante riqueza de cianobacterias, entre las cuales se identificaron algunas morfoespecies.
Respecto a la representatividad de la riqueza de algas, fueron identificados 83 taxones en los tres complejos arrecifales. Este valor fue bajo en relación con los 202 taxones mencionados por Díaz-Pulido y Díaz-Ruiz (2003) para el archipiélago de San Andrés y Providencia. Sin embargo, esta diversidad podría ser mayor de acuerdo con lo expuesto por Gavio y Wynne (2013), quienes registraron 161 taxones, de los cuales 65 fueron nuevos para el archipiélago.
La abundancia de estos organismos fotosintéticos puede deberse a que existen condiciones ambientales favorables para su proliferación (e.g. disponibilidad de luz, corrientes, una posible reducción en su pastoreo, sustrato estable y apropiado, entre otros). Esto, sumado a otros factores de amplia distribución como sobrepesca, sedimentación, cambio climático, puede contribuir al desarrollo algal en la competencia con otros organismos bentónicos (Carpenter, 1986; Hollock et al., 1993; McCook, 1999). No obstante, la dominancia algal favorece en cierta medida a la riqueza de especies, ya que algunas praderas de algas pueden servir como hábitats de cría de peces de arrecife e invertebrados (Díaz-Pulido et al., 2007).
Por su parte, los corales duros no fueron tan abundantes como en otras áreas arrecifales oceánicas del Caribe colombiano (Díaz et al., 1996, 2000). Se registraron 39 especies de corales duros distribuidas en 13 familias y 3 órdenes (Scleractinia, Milleporida y Stylasterida), valor que es cercano al documentado por Bruckner (2012) para el área de estudio (38 especies, 11 familias) pero menor al registrado por Díaz et al. (2000) para el archipiélago de San Andrés y Providencia (49 especies, 14 familias). A nivel general, las especies más abundantes fueron: Agaricia agaricites, Pseudodiploria strigosa, Orbicella annularis, O. faveolata, Millepora alcicornis, Porites astreoides, P. porites y Siderastrea siderea (Tabla 2).
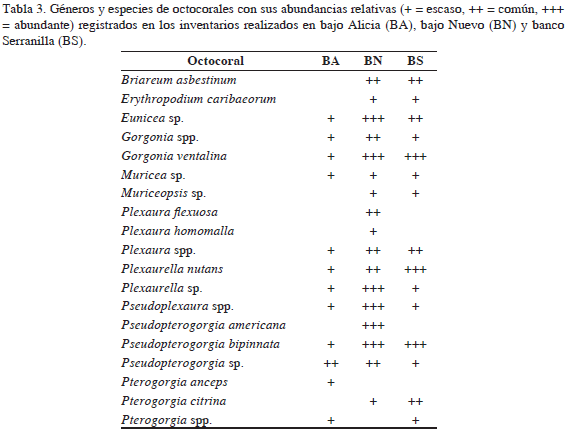
Fueron identificados en total 19 taxones de octocorales. Sin embargo, la riqueza de este grupo de organismos es potencialmente mayor considerando que la similitud morfológica de algunas especies dificulta su diferenciación en campo (Sánchez et al., 2005). Entre las especies más abundantes se destacaron Eunicea sp., Gorgonia ventalina, Plexaurella nutans, Pseudoterogorgia americana y P. bipinnata (Tabla 3). El mayor número de especies se registró en bajo Nuevo (17), seguido de banco Serranilla (15) y bajo Alicia (12) (Figura 2; Tabla 3). Las importantes abundancias relativas registradas en los tres complejos oceánicos para los octocorales pueden estar asociadas con la presencia de numerosas terrazas calcáreas. Otras condiciones comunes en estos bajos oceánicos, como la fuerte energía del oleaje y la posibilidad de encontrar fondos duros con diferentes gradientes de profundidad, favorecen el asentamiento y crecimiento de poblaciones de octocorales (Birkeland, 1974; Muzik, 1982; Yoshioka y Yoshioka, 1989; Sánchez et al., 1998).
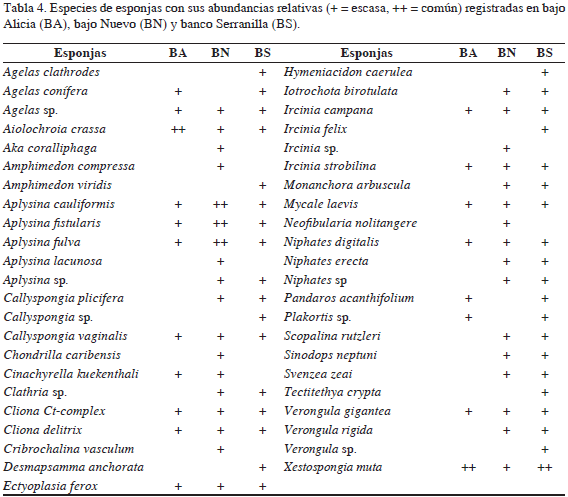
Se identificaron 45 especies de esponjas, de las cuales 37 se registraron en banco Serranilla, 34 en bajo Nuevo y 19 en bajo Alicia. Se destacaron por su abundancia Xestospongia muta, Aplysina cauliformis, A. fulva, Aiolochroia crassa, Agelas spp., Cliona Ct-complex (C. caribbaea, C. tenuis, C. aprica, C. varians), C. delitrix, Ircinia strobilina y Verongula gigantea (Tabla 4). Zea (2001) encontró 61 especies de esponjas en Serrana, Alburquerque y Roncador, dentro del archipiélago de San Andrés y Providencia, lo que indica que en el área de estudio la riqueza de especies es importante y merece un análisis taxonómico más detallado para completar los inventarios de esponjas para la reserva Seaflower. Actualmente, se considera que en algunos arrecifes del Caribe las esponjas pueden estar dominando las comunidades de la macrofauna sésil, principalmente en términos de biomasa. Asimismo, la composición de las comunidades puede reflejar las relaciones biogeográficas con otras áreas de la región (Pawlink et al., 2013). Se destacó la abundancia de la esponja barril X. muta en los tres complejos arrecifales y la presencia de la especie incrustante-excavadora C. delitrix con individuos que frecuentemente se encontraron colonizando colonias de corales, principalmente de las especies Siderastrea spp., Montastraea cavernosa y Orbicella spp. se ha demostrado que esta especie de esponja excavadora es un fuerte competidor por espacio en arrecifes de la Reserva Seaflower, encontrando que algunas especies/morfologías de corales son más vulnerables a ser colonizadas (Chaves-Fonnegra y Zea, 2011). Se presume que la actividad selectiva de la esponja sobre ciertas especies de corales puede modificar la estructura y composición coralina a largo plazo en los arrecifes de la Reserva Seaflower.
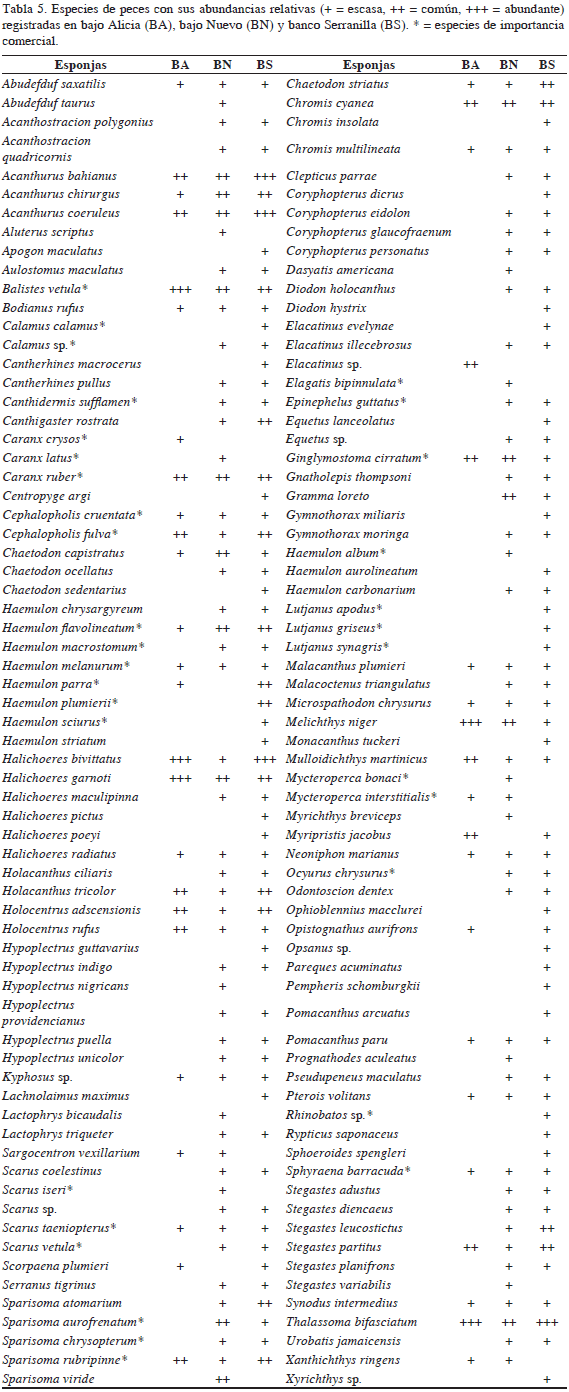
Los peces arrecifales fue el grupo más abundante y rico en especies. Asimismo, constituyen uno de los componentes bióticos más importantes de los sistemas arrecifales, modifican la estructura del sustrato bentónico y se convierten en el principal conducto del flujo de materia y energía (Wainwright y Bellwood, 2002). Se registraron 136 especies pertenecientes a 39 familias de las clases Actinopterygii y Chondrichthyes. Este valor es inferior al mencionado por Bruckner (2012) de 165 especies para el área de estudio. Las especies más abundantes fueron: Acanthurus bahianus, A. coeruleus, Balistes vetula, Chromis cyanea, Ginglymostoma cirratum, Halichoeres bivittatus, H. garnoti, Melichthys niger y Thalassoma bifasciatum (Tabla 5). Los peces de importancia comercial fueron en su mayoría escasos; sólo se registró una alta abundancia del tiburón (G. cirratum) y se registraron algunas especies de chernas (principalmente Cephalopholis fulva) y jureles (principalmente Caranx ruber) con una abundancia intermedia, mientras que los pargos (Lutjanus spp.), el pargo pluma (Lachnolaimus maximus) y las barracudas (Sphyraena barracuda) obtuvieron bajas abundancias. Es probable que la escasez de recursos pesqueros de importancia comercial sea un indicador de sobreexplotación y falta de regulación en las actividades de pesca extractiva, teniendo en cuenta que la baja abundancia de estas especies es una característica de áreas con elevada intensidad pesquera (Chiappone et al., 2000). El pez león Pterois volitans, especie invasora con reconocidos efectos en el Gran Caribe, se registró en bajas proporciones. También se registró el coral Tubastrea coccinea, dentro de las especies invasoras (Tablas 2 y 5).
Respecto a otros organismos, se registraron un total de 53 especies, de los cuales 3 corresponden a anémonas, 2 a zoantideos, 10 a artrópodos, 19 a equinodermos, 18 a moluscos y una tortuga (Tabla 6). Se encontraron especies de importancia comercial como la langosta espinosa (Panulirus argus), el caracol pala (Eustrombus gigas), la tortuga carey (Eretmochelys imbricata) y los pepinos de mar (Holothuria mexicana e Isostichopus badionotus).
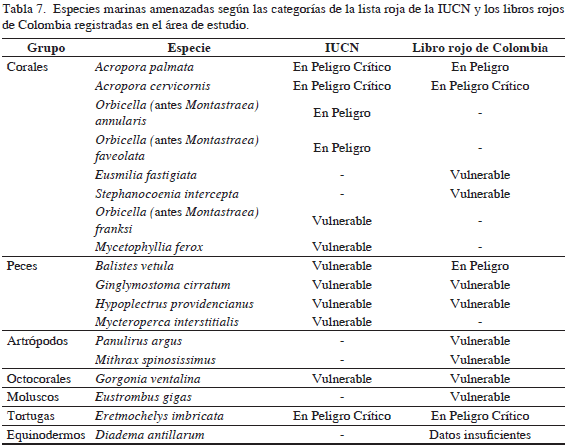
Por otro lado, se registró la presencia de 18 especies que se encuentran bajo algún grado de amenaza (Tabla 7) según las categorías de la IUCN (2012) y los Libros Rojos de Especies Amenazadas en Colombia (Ardila et al., 2002; Castaño-Mora, 2002; Mejía y Acero, 2002) debido a las notables reducciones en sus poblaciones en las últimas décadas por factores como la sobreexplotación de recursos y mortalidades masivas asociadas a enfermedades (Lessios et al., 1984; Brown, 1997; Díaz et al., 2000; Steiner y Williams, 2006; Burke et al., 2011). Se destacaron por su frecuencia de observación el octocoral G. ventalina, el pez B. vetula, el tiburón G. cirratum y el coral O. faveolata (Figura 3). Se observaron parches de los corales Acropora palmata y A. cervicornis, especies catalogadas "En peligro crítico" debido a su drástica reducción en las últimas décadas, que excede 80% en el Gran Caribe como consecuencia de la enfermedad de banda blanca (Garzón-Ferreira y Díaz, 2003; Sutherland et al., 2004; IUCN, 2012). La abundancia de colonias del coral A. palmata en algunas zonas arrecifales puede indicar que estos bajos han funcionado como reservorio y/o puede ser señal de un proceso de recuperación de la especie. En respuesta a su estado crítico, estas dos especies de coral han despertado la atención internacional, reconociendo que su estudio, monitoreo y conservación son una prioridad esencial.
Bajo Nuevo
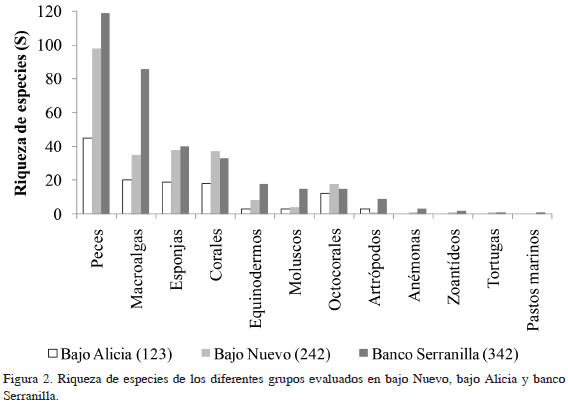
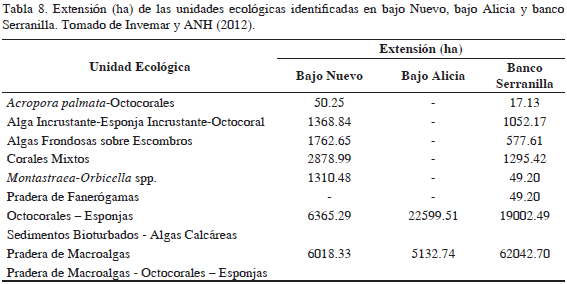
Los principales componentes del sustrato son las algas (37.8%), la arena (27.6%), los octocorales (13.5%), los corales duros (12.1%) y las esponjas (6.7%), igualmente, se identificaron nueve unidades ecológicas según Invemar y ANH (2012) (Tabla 8). Presentó una riqueza de 242 especies, donde los peces (98 especies), corales (37 especies) y esponjas (34 especies) fueron los principales representantes.
En esta área se encuentran formaciones coralinas significativas que posiblemente dan lugar a refugios y asociaciones de organismos.
Se registraron 41 especies exclusivas en esta área, entre las que se encuentran los corales Dendrogyra cylindricus, Favia fragum y T. coccinea, la esponja Aka coraliphaga, el equinodermo Ophionereis reticulata, los peces Abudefduf taurus, Elagatis bipinnulata, Hypoplectrus indigo, Mycteroperca bonaci y 34 taxones de macroalgas, entre los que se encuentran los géneros de Chlorophyta Laurencia, Liagora, y la familia Ulvaceae. Se registraron 37 especies de corales, siendo abundantes: A. agaricites, M. alcicornis, O. annularis, O. faveolata y P. strigosa (Tabla 3). Teniendo en cuenta la cobertura coralina encontrada en bajo Nuevo (12%), con respecto a bajo Alicia (3%) y banco Serranilla (5%), es evidente que hay un mayor desarrollo coralino en esta área. Se registraron 37 especies de esponjas, siendo Aplysina cauliformis, A. fistularis y A. fulva las más abundantes (Tabla 4).
En cuanto a los peces se registraron 98 especies, encontrándose a C. ruber, Haemulon aurolineatum y Sparisoma viride entre las más abundantes (Tabla 5). Aunque el tiburón nodriza G. cirratum fue común en las tres áreas, se destacó por su elevada abundancia en bajo Nuevo, también registrada por Bent et al. (2012) y Bruckner (2012). Este hecho es de gran relevancia ecológica debido a que los cambios que han ocurrido en los ecosistemas marinos han incluido la extracción intensa de estos depredadores, vulnerables sobre todo a la pesca local (Compagno, 2001).
Respecto a otros organismos, se registraron 16 especies, entre las que se encuentran P. argus, Diadema antillarum y E. imbricata (Tabla 6). En cuanto a las especies amenazadas, este bajo registró la mayor frecuencia de especies (16), entre las que se encuentran G. ventalina, G. cirratum y O. annularis (Figura 3), lo cual puede estar asociado a la heterogeneidad del fondo, a la mayor cobertura coralina y a la cantidad de unidades ecológicas (INVEMAR y ANH, 2012).
Bajo Alicia
Los principales componentes vivos en el fondo fueron las algas (40.1%), los octocorales (10.4%), las esponjas (8.1%) y los corales duros (3.1%); asimismo, se registraron tres unidades ecológicas según Invemar y ANH (2012) (Tabla 8). En este bajo se registraron 122 especies, característica que coincide con la menor cantidad de ambientes encontrados a una profundidad menor a 30 m, siendo los peces el grupo con mayor riqueza (45 especies; Figura 2).
Por otro lado, en bajo Alicia se observaron seis especies exclusivas, entre las que se destacan el cangrejo Mithrax spinosissimus y el octocoral Pterogorgia anceps. Se registraron 19 taxones de macroalgas marinas entre las que se encuentran los géneros Avrainvillea, Dictyota y Penicillus (Tabla 1). Se registraron 18 especies de corales todos con bajas abundancias, entre los observados están Agaricia tenuifolia, O. faveolata y P. porites (Tabla 2). Se registraron 19 especies de esponjas siendo Aiolochroia crassa y X. muta las más abundantes (Tabla 4). Se registraron 45 especies de peces, destacando la alta abundancia de B. vetula y M. niger (Tabla 5), lo que contrasta con la escasez de estos peces en otras áreas del Caribe colombiano (Navas Camacho y Rodríguez- Ramírez, 2008). Respecto a otros organismos asociados al sustrato, se identificaron nueve especies, entre los que se encuentran los invertebrados comerciales E. gigas, P. argus e I. badionotus (Tabla 6). En cuanto a las 10 especies amenazadas identificadas, su frecuencia de observación fue relativamente baja, observándose individuos de las especies B. vetula, G. cirratum y M. spinosissimus (Figura 3).
Serranilla Se identificaron nueve unidades ecológicas según Invemar y ANH (2012), en las que los principales componentes vivos del sustrato en términos de cobertura fueron las algas (43.8%), los octocorales (11.8%), las esponjas (8.1%) y los corales duros (5.0%; Tabla 8). Se registró una riqueza de 341 especies, a la cual contribuyeron en mayor medida los peces (117 especies) y las macroalgas (84 especies), incluyendo cianobacterias.
En el banco Serranilla se registraron 128 especies exclusivas, entre las que se destacan el coral Solenastrea bournoni, los equinodermos Astichopus multifidus, Clypeaster rosaceus, Meoma ventricosa, el molusco Strombus gallus, los peces Centropyge argi, Chaetodon sedentarius, Opsanus sp., Rhinobatos sp. y Xyrichtys sp., el pasto marino Syringodium filiforme y 50 especies de macroalgas (Tablas 1-6).
Se registró un total de 84 taxones de algas marinas, entre las que se encuentran Amphiroa fragilissima, cianobacterias, Halimeda spp. y Turbinaria spp. (Tabla 1). Se registraron 33 especies de corales duros, siendo A. agaricites, M. alcicornis y S. siderea las más abundantes (Tabla 2). Se registraron 37 especies de esponjas, entre las que se encuentran Amphimedon viridis, Callyspongia sp y Tectitethya cripta (Tabla 4). Se registraron 117 especies de peces, siendo las más abundantes Acanthurus spp., Halichoeres bivittatus y Thalassoma bifasciatum (Tabla 5).
Respecto a otros organismos, se registraron 49 especies (Tabla 6), donde también se agrupó la mayor parte de especies de importancia comercial: langosta espinosa (P. argus), caracol pala (E. gigas), tortuga carey (E. imbricata) y pepinos de mar (H. mexicana, I. badionotus). En cuanto a las organismos amenazados, esta área registró el mayor número de especies (16), siendo más frecuente la observación de B. vetula, D. antillarum, P. argus y Stephanocoenia intersepta (Figura 3).
La ubicación remota de bajo Nuevo, bajo Alicia y banco Serranilla, pero principalmente la presencia de diferentes ambientes o unidades ecológicas, posiblemente han permitido que el área de estudio posea una gran riqueza de especies marinas, que indica que estas áreas son reservorios importantes de biodiversidad del país. Además, la observación de especies clave para la conservación, evidencia que en el área se concentran poblaciones que merecen especial atención para fortalecer las estrategias de manejo de zonas marino costeras y aplicar medidas de protección de las especies de importancia pesquera.
CONCLUSIONES
Se encontraron importantes valores de riqueza en las áreas estudiadas, asociadas principalmente a formaciones coralinas y a la extensión de ciertas unidades ecológicas. El mayor valor de riqueza de especies se registró en banco Serranilla, especialmente para la biota de peces y macroalgas. Bajo Nuevo presentó una alta riqueza siendo los peces, los corales y las esponjas los grupos más conspicuos, debido posiblemente a la mayor cobertura de coral y extensión de las unidades de corales mixtos y Montastraea-Orbicella spp., que brindan una mayor disponibilidad de hábitats para las especies.
A partir de los inventarios biológicos realizados, se evidenció una notable relación entre paisajes en términos de la diversidad de ambientes o unidades ecológicas y la riqueza de especies que puede ser encontrada en el área de estudio. Tal relación resalta la importancia de estas áreas como reservorios de biodiversidad en medio de ambientes oceánicos de aguas someras que han sido pocas veces caracterizados biológicamente.
AGRADECIMIENTOS
Estas actividades se desarrollaron en el marco del convenio 016-2010 entre Invemar, la Agencia Nacional de Hidrocarburos (ANH) y el Ministerio de Relaciones Exteriores y Comercio Exterior de Jamaica. Los autores agradecen especialmente al Ministerio de Relaciones Exteriores de Colombia, Gobernación de San Andrés, Providencia y Santa Catalina, Alcaldía de Providencia, DIMAR, a las directivas de Invemar, particularmente a los coordinadores del proyecto Francisco Arias Isaza, David Alonso Carvajal y Milena Benavides y a la ANH por todo su apoyo en la gestión y realización de este proyecto. Igualmente por su colaboración en la parte cartográfica al grupo del Laboratorio de Sistemas de Información (LabSIS) del Invemar y por las labores de campo a toda la tripulación de la embarcación Captain "S" y a Nathalia Prada (Fundación Omacha). Contribución de Invemar No. CTRB-1144.
BIBLIOGRAFÍA
1 Abril-Howard, A., C. Sánchez-García, H. Bent, N. Bolaños y E. Jay. 2010. Estimación de la cobertura coralina del banco Serranilla, bajo Alicia y bajo Nuevo. Primera aproximación al conocimiento del ecosistema. 249-253. En: Invemar y Acimar (Eds.). Libro de resúmenes extendidos XIV Seminario Nacional de Ciencias y Tecnologías del Mar (Senalmar). Serie de Publicaciones Especiales del Invemar. No 21, Santa Marta. 578 p. [ Links ]
2 Alcolado, P. 1999. Comunidades de esponjas de los arrecifes del archipiélago Sabana-Camagüey, Cuba. Bol. Inv. Mar. Cost., 28: 95-124. [ Links ]
3 Appeltans, W., P. Bouchet, G. A. Boxshall, K. Fauchald, D. P. Gordon, B. W. Hoeksema, G. C. Poore, R. Van Soest, S. Stöhr, T. C. Walter y M. J. Costello (Eds.). 2011. World register of marine species. http://www.marinespecies.org. 18/02/12. [ Links ]
4 Ardila, N., G. Navas y J. Reyes (Eds.). 2002. Libro rojo de invertebrados marinos de Colombia. La serie de libros rojos de especies amenazadas de Colombia, Invemar y Ministerio de Medio Ambiente, Bogotá. 179 p. [ Links ]
5 Bent, H., A. Abril-Howard, N. Bolaños y E. Taylor. 2012. Abundancia de peces en los complejos arrecifales de Serranilla, Bajo Alicia y Bajo Nuevo, Reserva de Biósfera Seaflower de Colombia. Rev. Mar. Cost., 4: 33-49. [ Links ]
6 Birkeland, C. 1974. The effect of wave action on the population dynamics of Gorgonia ventalina Linnaeus. Stud Trop Oceanogr., 12: 115-126. [ Links ]
7 Brown, B.E. 1997. Disturbances to reefs in recent times. 354-379. En: Birkeland, C. (Ed). Life and death of corals reefs. Chapman and Hall, Nueva York. 536 p. [ Links ]
8 Bruckner, A. 2012. Global reef expedition: San Andrés Archipelago, Colombia. Field Report. April 9-24, 2012. Khaled bin Sultan Living Oceans Foundation, Landover, EE.UU. 52 p. [ Links ]
9 Buddemeier, R., J. Kleypas y R. Aronson. 2004. Coral reefs and global climate change: Potential contributions of climate change to stresses on coral reef ecosystems. Pew Center on Global Climate Change, Arlington, EE.UU. 44 p. [ Links ]
10 Burke, L., K. Reytar, M. Spalding y A. Perry. 2011. Reefs at risk: revisited. World Resources Institute. Washington. 114 p. [ Links ]
11 Carpenter, R. 1986. Partitioning herbivory and its effects on coral reefs algal communities. Ecol. Monogr., 56(4): 345-363. [ Links ]
12 Case, J.E., T.L. Holcombe y R. G. Martin. 1984. Map of geologic provinces in the Caribbean region. 1-30. En: Bonini, W.E., R.B. Hargraves y R. Shangan (Eds.). The Caribbean South America plate boundary and regional tectonics. Mem. Geol. Soc. Am., 162: 421 p. [ Links ]
13 Castaño-Mora, O.V. 2002. Libro rojo de reptiles de Colombia. Libros rojos de especies amenazadas de Colombia. Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio del Medio Ambiente y Conservación Internacional-Colombia, Bogotá. 160 p. [ Links ]
14 Cervigón, F., R. Cipriani, W. Fischer, L. Garibaldi, M. Hendrickx, A.J. Lemus, R. Márquez, J.M. Poutiers, G. Robaina y B. Rodríguez. 1993. FAO species identification sheets for fishery purposes. Field guide to the commercial marine and brackish-water resources of the northern coast of South America. FAO. Roma. 513 p. + anexos. [ Links ]
15 Chaves-Fonnegra, A. y S. Zea. 2011. Coral colonization by the encrusting excavating Caribbean sponge Cliona delitrix. Mar. Ecol., 32: 162-173. [ Links ]
16 Chiappone, M., R. Sluka y K. Sullivan-Sealey. 2000. Groupers (Pisces: Serranidae) in fished and protected areas of the Florida Keys, Bahamas and northern Caribbean. Mar. Ecol. Prog. Ser., 198: 261-272. [ Links ]
17 Compagno, L.J.V. 2001. Sharks of the world: An annotated and illustrated catalogue of shark species known to date; bullhead, mackerel and carpet sharks (Heterodontiformes, Lamniformes and Orectolobiformes). FAO Spec. Cat. Fish. Purp., Roma, 2(1): 1-269. [ Links ]
18 Coralina e Invemar (Eds.). 2012. Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. Instituto de Investigaciones Marinas y Costeras (Invemar) y Corporación para el Desarrollo Sostenible del Archipiélago de San Andrés, Providencia y Santa Catalina (Coralina), Serie de Publicaciones Especiales del Invemar No. 28, Santa Marta. 179 p. [ Links ]
19 Díaz, J.M., G. Díaz-Pulido, J. Garzón-Ferreira, J. Geister, J. Sánchez y S. Zea. 1996. Atlas de los arrecifes coralinos del Caribe colombiano: I. Complejos arrecifales oceánicos. Serie de Publicaciones Especiales del Invemar No. 2, Santa Marta. 83 p. [ Links ]
20 Díaz, J.M., L. Barrios, M. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Serie de Publicaciones Especiales del Invemar No. 5, Santa Marta. 175 p. [ Links ]
21 Díaz, J.M., L.M. Barrios y D.I. Gómez-López. 2003. Las praderas de pastos marinos en Colombia: estructura y distribución de un ecosistema estratégico. Serie de Publicaciones Especiales del Invemar No. 10, Santa Marta. 160 p. [ Links ]
22 Diaz-Pulido, G. y J.M. Díaz. 1997. Algal assemblages in lagoonal reefs of Caribbean oceanic atolls. Proc. 8th Int. Coral Reef Symp. Panama, 1: 827-832. [ Links ]
23 Díaz-Pulido, G. y M. Díaz-Ruiz. 2003. Diversity of benthic marine algae of the Colombian Atlantic. Biota Col., 4(2): 203-246. [ Links ]
24 Diaz-Pulido, G., L.J. McCook, A.W. Larkum, H.K. Lotze, J.A. Raven, B. Schaffelke, J. Smith y R.S. Steneck. 2007. Vulnerability of macroalgae of the Great Barrier Reef to climate change. 151-192. En: Johnson, J.E. y P.A. Marshall (Eds.). Climate change and the Great Barrier Reef. Townsville, Australia. 818 p. [ Links ]
25 Dimar-CIOH. 2009. Geografía submarina del Caribe colombiano. Serie de publicaciones especiales CIOH Volumen 4. Cartagena. 150 p. [ Links ]
26 FAO. 2014. FAO FishFinder. - Web Site. FAO FishFinder. FI Institutional Websites. En: FAO Fisheries and Aquaculture Department. Roma. http://www.fao.org/fishery/fishfinder/en. 22/12/14. [ Links ]
27 Froese, R. y D. Pauly (Eds.). 2012. FishBase.World Wide Web electronic publication. www.fishbase.org. 14/02/2012. [ Links ]
28 Garzón-Ferreira, J. y J.M. Díaz. 2003. The Caribbean coral reefs of Colombia. 275-301. En: Cortés, J. (Ed.). Latin American coral reefs. Elsevier Science. Ámsterdam. 508 p. [ Links ]
29 Garzón-Ferreira, J., M. Reyes-Nivia y A. Rodríguez-Ramírez. 2002. Manual de métodos del SIMAC: Sistema Nacional de Monitoreo de Arrecifes Coralinos en Colombia. Invemar. Santa Marta. 102 p. [ Links ]
30 Gavio, B y J. Wynne. 2013. Biodiversity of the marine macroflora in the international Biosphere Reserve Seaflower, Caribbean, Colombia. p. 97. En: Campos, N., P. Dueñas y J. Garay (Eds.). Libro de memorias del XV Seminario Nacional en Ciencias y Tecnologías del Mar (Senalmar). Invemar, Santa Marta. 299 p. [ Links ]
31 Geister, J. y J.M. Díaz. 1996. A field guide to the atolls and reefs of San Andrés y Providencia (Colombia). 8th Int. Coral Reef Symp. Panamá, 41 p. [ Links ]
32 Geister, J. y J.M. Díaz. 2007. Ambientes arrecifales y geología de un archipiélago oceánico: San Andrés, Providencia y Santa Catalina (mar Caribe, Colombia) con guía de campo. Ingeominas, Bogotá. 114 p. [ Links ]
33 Gracia, A., J. Medellín-Mora, M. Garrido-Linares, E. Arteaga-Sogamoso y A. Merchán-Cepeda. 2011. Estado del conocimiento de la diversidad de especies. 195-250. En: Invemar. Informe del estado de los ambientes marinos y costeros en Colombia: Año 2010. Serie de Publicaciones Periódicas del Invemar No. 8, Santa Marta. 322 p. [ Links ]
34 Guiry, M.D. y G.M. Guiry. 2012. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org. 20/02/2012. [ Links ]
35 Hollock, P., F.E. Müller-Karger y J.C. Halas. 1993. Coral reef decline. Nat. Geogr. Res. Explor., 9(3): 358-378. [ Links ]
36 INAP. 2011. Resultados del Proyecto Piloto de Adaptación Nacional al Cambio Climático - INAP (TF 056350). Informe Final. The World Bank, GEF, Instituto Nacional de Salud, IDEAM, Conservación Internacional Colombia, Invemar y Coralina. 121 p. [ Links ]
37 Invemar y ANH. 2012. Línea base ambiental en el Área de Régimen Común Jamaica-Colombia como aporte al aprovechamiento sostenible de los recursos marinos compartidos: Comunidades biológicas de fondos poco profundos. Informe técnico final, Invemar, Santa Marta. 111 p. [ Links ]
38 Jackson, J.B.C., M.K. Donovan., K.L. Cramer y V.V. Lam (Eds.). 2014. Status and trends of Caribbean coral reefs: 1970-2012. Global Coral Reef Monitoring Network, IUCN, Gland. Suiza. 304 p. [ Links ]
39 Lessios, H.A., D.R. Robertson y J.D. Cubit. 1984. Spread of Diadema mass mortality through the Caribbean. Science, 226(4672): 335-337. [ Links ]
40 Linton, D. y T. Fisher. 2004. Caricomp: Caribbean Coastal Marine Productivity Program: 1993-2003. Caricomp, Kingston. 91 p. [ Links ]
41 MAVDT. 2010. Resolución 383 del 23 de febrero de 2010. "Por la cual se declaran las especies silvestres que se encuentran amenazadas en el territorio nacional y se toman otras determinaciones". Ministerio de Ambiente, Vivienda y Desarrollo Territorial. Bogotá. 29 p. [ Links ]
42 McCook, L. 1999. Macroalgae, nutrients and phase shifts on coral reefs: Scientific issues and management consequences for the Great Barrier Reef. Coral Reefs, 18(4): 357-367. [ Links ]
43 McCook, L., J. Jompa y G. Díaz-Pulido. 2001. Competition between corals and algae on coral reefs: A review of evidence and mechanisms. Coral Reefs, 19: 400-417. [ Links ]
44 Mejía, L.S. y A. Acero P. (Eds.) 2002. Libro rojo de peces marinos de Colombia. La serie libros rojos de especies amenazadas de Colombia, Invemar, Instituto de Ciencias Naturales-Universidad Nacional de Colombia y Ministerio de Medio Ambiente, Bogotá. 174 p. [ Links ]
45 Mejía, L.S. y J. Garzón-Ferreira. 2000. Estructura de comunidades de peces arrecifales en cuatro atolones del archipiélago de San Andrés y Providencia (Caribe sur occidental). Rev. Biol. Trop., 48(4): 883-896. [ Links ]
46 Miloslavich, P., J.M. Díaz, E. Klein, J.J. Alvarado y C. Díaz. 2010. Marine biodiversity in the Caribbean: Regional estimates and distribution patterns. PloS ONE, 5(8): e11916. doi:10.1371/journal.pone.0011916. [ Links ]
47 Muzik, K. 1982. Octocorallia (Cnidaria) from Carrie Bow Cay, Belize. 309-316. En: Rutzler, K. e I.G. MacIntyre (Eds.). The Atlantic barrier reef system at Carrie Bow Cay, Belize I. Structure and communities. Smithson. Contrib. Mar. Sci., Vol. 12, Washington. 539 p. [ Links ]
48 Navas-Camacho, R. y A. Rodríguez-Ramírez. 2008. Estado de los arrecifes coralinos. 53-73. En: Invemar (Ed.). Informe del estado de los ambientes marinos y costeros en Colombia: Año 2007. Serie de Publicaciones Periódicas del Invemar No. 8, Santa Marta. 380 p. [ Links ]
49 Navas-Camacho, R., K. Gómez-Campo, J. Vega-Sequeda y T. López-Londoño. 2009. Estado de los arrecifes coralinos en Colombia. 59-88. En: Invemar (Ed.). Informe del estado de los ambientes y recursos marinos y costeros en Colombia: Año 2008. Serie de Publicaciones Periódicas del Invemar No. 8, Santa Marta. 243 p. [ Links ]
50 Navas-Camacho, R., K. Gómez-Campo, J. Vega-Sequeda, T. López-Londoño, D. Duque, A. Abril y N. Bolaños. 2010a. Estado de los arrecifes coralinos en Colombia. 75-100. En: Invemar. Informe del estado de los ambientes y recursos marinos y costeros en Colombia: Año 2009. Serie de Publicaciones Periódicas del Invemar No. 8, Santa Marta. 320 p. [ Links ]
51 Navas-Camacho, R., D.L. Gil-Agudelo, A. Rodríguez-Ramírez, M.C. Reyes-Nivia y J. Garzón-Ferreira. 2010b. Coral diseases and bleaching on Colombian Caribbean coral reefs. Rev. Biol. Trop., 58(suppl. 1): 95-106. [ Links ]
52 Prada, M. 2012. Comunidades de peces. 106-113 En: Coralina e Invemar (Eds.). Atlas de la Reserva de Biósfera Seaflower. Archipiélago de San Andrés, Providencia y Santa Catalina. Invemar y Coralina, Serie de Publicaciones Especiales del Invemar No. 28, Santa Marta. 179 p. [ Links ]
53 Rivera-Monroy, V.H., R.R. Twilley, D. Bone, D.L. Childers, R.C. Coronado-Molina, I.C. Feller, J. Herrera-Silveira, R. Jaffe, E. Mancera, E. Rejmankova, J.E. Salisbury y E. Weil. 2004. A conceptual framework to develop long-term ecological research and management objectives in the wider Caribbean region. Bioscience, 54: 843-856. [ Links ]
54 Rodríguez-Ramírez, A., M.C. Reyes-Nivia, S. Zea, R. Navas-Camacho, J. Garzón-Ferreira, S. Bejarano, P. Herrón y C. Orozco. 2010. Recent dynamics and condition of coral reef in the Colombian Caribbean. Rev. Biol. Trop., 58(Suppl. 1): 107-131. [ Links ]
55 Rosenberg, G. 2009. Malacolog 4.1.1: A database of western Atlantic marine Mollusca. Database (version 4.1.1). http://www.malacolog.org/. 20/02/2012. [ Links ]
56 Sánchez, J.A. y H. Wirshing. 2005. A field key to the identification of tropical western Atlantic zooxanthellate octocorals (Octocorallia: Cnidaria). Car. J. Sci., 41(3): 508-522. [ Links ]
57 Sánchez, J.A., J. M. Díaz y S. Zea. 1997. Gorgonian communities in two contrasting environments on oceanic atolls of the southwestern Caribbean. Bull. Mar. Sci., 61(2): 453-465. [ Links ]
58 Sánchez, J.A., S. Zea y J.M. Díaz. 1998. Patterns of octocoral and black coral distribution in the Oceanic Barrier Reef-complex of Providencia Island, Southwestern Caribbean. Car. J. Sci., 34(3-4): 250-264. [ Links ]
59 Sánchez, J.A., V. Pizarro, A. Acosta-Sánchez, P. Castillo, P. Herrón, J. C. Martínez, P. Montoya y C. Orozco. 2005. Evaluating coral reef benthic communities in remote Caribbean atolls (Quitasueño, Serrana, and Roncador banks) to recommend marine-protected areas for the Seaflower Biosphere Reserve. Atoll. Res. Bull., 531: 1-65. [ Links ]
60 Spalding, M., H.E. Fox, G.R. Allen, N. Davidson, Z.A. Ferdaña, M. Finlayson, B.S. Halpern, M.A. Jorge, A. Lombana, S.A. Lourie, K.D. Martin, E. McManus, J. Molnar, C.A. Recchia y J. Robertson. 2007. Marine ecoregions of the world: a bioregionalization of coastal and shelf areas. BioScience, 57(7): 573-583. [ Links ]
61 Steiner, S.C. y S.M. Williams. 2006. The density and size distribution of Diadema antillarum in Dominica (Lesser Antilles): 2001-2004. Mar. Biol., 149: 1071-1078. [ Links ]
62 Sutherland, K., J. Porter y C. Torres. 2004. Diseases and immunity in Caribbean and Indo-Pacific zooxanthellate corals. Mar. Ecol. Prog. Ser., 266: 273-302. [ Links ]
63 Wainwright, P.C. y D.R. Bellwood. 2002. Ecomorphology of feeding in coral reef fishes. 33-55. En: Sale, P.F. (Ed.). Coral reef fish: dynamics and diversity in a complex ecosystem. Academic Press, Elsevier Science, San Diego, EE.UU. 549 p. [ Links ]
64 Wilkinson, C.R. 1987. Interocean differences in size and nutrition of coral reef sponge populations. Science, 236: 1654-1657. [ Links ]
65 Yoshioka, P. y B. Yoshioka. 1989. Effects of wave energy, topographic relief and sediment transport on the distribution of shallow-water gorgonians of Puerto Rico. Coral Reefs, 8(3): 145-152. [ Links ]
66 Zea, S. 1993. Recruitment of demosponges (Porifera, Demospongiae) in rocky and coral reef habitats of Santa Marta, Colombian Caribbean. Mar. Ecol., 14(1): 1-21. [ Links ]
67 Zea, S. 2001. Patterns of sponge (Porifera, Demospongiae) distribution in remote, oceanic reef complexes of the southwestern Caribbean. Rev. Acad. Colomb. Cienc., 25(97): 581-595. [ Links ]
68 Zea, S., T. P. Henkel y J. R. Pawlik. 2009. The Sponge Guide: a picture guide to Caribbean sponges. www.spongeguide.org. 18/02/2012. [ Links ]
FECHA DE RECEPCIÓN: 20/11/2013 FECHA DE ACEPTACIÓN: 27/04/2015