Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.45 no.1 Santa Marta Jan./June 2016
NOTA:
DISTRIBUCIÓN, FRECUENCIA Y ABUNDANCIA DEL FITOPLACTON POTENCIALMENTE TOXÍGENO EN LA CUENCA PACÍFICA COLOMBIANA
DISTRIBUTION, ABUNDANCE AND FREQUENCY OF POTENTIAL TOXIGENIC PHYTOPLANKTON OF THE COLOMBIAN PACIFIC BASIN
Edgar Arteaga Sogamoso y Laura Victoria Perdomo Trujillo
Instituto de Investigaciones Marinas y Costeras (Invemar), Calle 25 No. 2-55, Playa Salguero, Santa Marta, Colombia. edarso@hotmail.com, lvperdomo@unal.edu.co
RESUMEN
Con el fin de contribuir al conocimiento del fitoplancton potencialmente toxígeno de la cuenca pacífica colombiana, se describe su distribución, frecuencia y abundancia en muestras tomadas en once cruceros, entre 2004 y 2011. Estos cruceros fueron realizados en el marco del Estudio Regional del Fenómeno de El Niño en el Pacífico Sudeste (ERFEN), programa multinacional de la Comisión Permanente del Pacífico Sur (CPPS). En los resultados se destacan por su amplia distribución, permanencia y abundancia los géneros Pseudo-nitzschia, Dinophysis, Gonyaulax y Alexandrium, los cuales han sido registrados como causantes de intoxicaciones amnésicas (Pseudo-nitzschia), diarreicas (Dinophysis y Gonyaulax) y paralizantes (Alexandrium). A pesar de que algunos de ellos fueron abundantes en el plancton, durante los muestreos no fueron evidentes cambios en la coloración del agua, ni se tuvo registros de que hubieran causado efectos nocivos durante el periodo de estudio.
PALABRAS CLAVES: Fitoplancton nocivo, Pacífico colombiano.
ABSTRACT
In order to contribute to the knowledge of potentially toxigenic phytoplankton, the frequency, distribution and abundance of these organisms in samples from eleven cruises conducted in the Colombian Pacific basin from 2004 to 2011 is described. The research cruises were conducted under the Regional Study of the "El Niño" phenomenon in the Southeast Pacific (ERFEN), a multinational program of the Permanent Commission for the South Pacific (CPPS). Genera Pseudo-nitzschia, Dinophysis, Gonyaulax, and Alexandrium are remarkable in the results because of their wide distribution, persistence and abundance. These species have been reported to cause amnesic intoxications (Pseudonitzschia), diarrhea (Dinophysis and Gonyaulax), and paralytic poisoning (Alexandrium). Although some of these species were abundant in the plankton, there were not obvious changes in water coloration or reports of adverse effects during the study period.
KEY WORDS: Harmful marine phytoplankton, Colombian Pacific.
Las algas microscópicas planctónicas son importantes en los ecosistemas ya que como productores primarios, son la base de la cadena trófica. En ocasiones, cuando las condiciones ambientales son propicias, proliferan generando floraciones (concentraciones por encima de un millón de células por litro), que en algunos casos pueden ser beneficiosas para las pesquerías y acuicultura, y también ayudar a mitigar el efecto invernadero del CO2; pero en determinadas situaciones, pueden llegar a causar impactos ambientales negativos, produciendo pérdidas económicas en los mismos sectores y en el turismo, incluso, efectos no deseados sobre la salud humana (Hallegraeff, 2004; Reguera et al., 2011). Estas últimas se han denominado como floraciones algales nocivas (FAN), el cual es un término adoptado por la Comisión Oceanográfica Intergubernamental (COI) de la Unesco y aceptado internacionalmente para denominar cualquier proliferación de microalgas (independientemente de su concentración), percibida como negativa, por su impacto en la salud pública, la acuicultura, el medio ambiente y las actividades recreativas (Reguera et al., 2011).
Con base en los daños que ocasionan, Reguera et al. (2011) clasifican las FAN en: 1) Floraciones algales de elevada biomasa, no tóxicas, que pueden causar daños de tipo fisicoquímico (por ejemplo, anoxia, hiperoxigenación, descenso del pH, excreción de altas concentraciones de amonio). 2) Floraciones productoras de toxinas que se transfieren a través de la cadena trófica (incluyendo a los seres humanos). 3) Floraciones algales ictiotóxicas (por excreción de substancias mucilaginosas por las microalgas, que provoca un aumento de viscosidad del agua, atascos en la branquias y dificultad en el intercambio de gases; por la presencia de espinas y otros apéndices de las microalgas que erosionan las agallas de los peces aumentando su susceptibilidad a las infecciones bacterianas y víricas. 4) Floraciones de microalgas productoras de toxinas que se transfieren a través del aerosol marino y causan irritaciones. 5) Floraciones de cianobacterias (CHAB, por sus siglas en inglés).
Las floraciones de algas, pueden ocurrir de forma natural, en áreas de surgencia, frentes costeros y estuarios, donde una combinación de condiciones de enriquecimiento de nutrientes y factores físicos, pueden producir altas concentraciones de microalgas. Sin embargo, las floraciones también pueden ocurrir como resultado de actividades antropogénicas, principalmente eutroficación de áreas costeras y estuarios con alto contenido de nitrógeno y fósforo, lo cual puede permitir un incremento de microalgas locales. Otras fuentes importantes de nutrientes son los dragados, debido a que la remoción de sedimentos re-suspende la materia orgánica y acelera la degradación de la misma ocasionando la liberación de nutrientes (Reguera, 2002).
No todas las floraciones algales nocivas producen cambios de coloración en el agua y en algunos casos se presentan eventos tóxicos sin cambios de color. Por esta razón son fundamentales los análisis químicos para determinar la toxicidad de una floración, ya que incluso el simple cambio en el color del agua o la presencia de especies registradas como tóxicas, no determinan los efectos tóxicos sobre peces e invertebrados ni sobre los humanos (Reguera et al., 2011). De las más de 5000 especies de fitoplancton, sólo unas 300 son capaces de presentar altas concentraciones celulares generando discoloraciones en la superficie del agua (llamadas mareas rojas) y solo, aproximadamente 80 tienen la capacidad de producir toxinas potentes (Hallegraeff, 2004). Desafortunadamente, no se ha encontrado una clara relación entre la concentración de algas y su potencial efecto nocivo, ya que algunas especies pueden contaminar con toxinas a moluscos, incluso a muy bajas concentraciones celulares, mientras otras requieren de altas densidades para generar efectos dañinos apreciables (Hallegraeff, 2004).
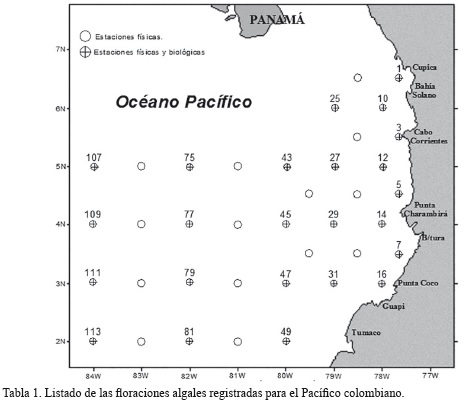
En el Pacífico colombiano son pocos los eventos conocidos sobre floraciones algales. Autores como Maldonado (1978), García-Hansen et al. (2004) y Ramírez y Giraldo (2006) han registrado floraciones algales ocasionadas por diferentes especies y relacionadas con cambios en las condiciones ambientales habituales debidas a surgencias o veranos prolongados. De estos registros, solo la floración ocurrida en el año 1976 se asoció con la muerte de peces y otras especies, principalmente bentónicas (Tabla 1).
En las costas colombianas del Pacífico nunca se han registrado casos de intoxicación en humanos y mucho menos de decesos; sin embargo cabe la posibilidad de que puedan presentarse, ya que eventos tóxicos han sido registrados en las costas de algunos países de Centroamérica y Sudamérica como Ecuador, Perú y Chile. Además, algunas especies que se registran en otras latitudes como potencialmente nocivas o tóxicas, han sido encontradas en estudios de la composición del plancton del Pacífico colombiano (Castillo y Vizcaíno, 1993; Medina, 1997; Tejada et al., 2003; Ramírez et al., 2006).
El conocimiento del fitoplancton en el Pacífico colombiano es aún escaso por lo cual es necesario concentrar esfuerzos en su estudio, dada su gran importancia a nivel ecosistémico y a su respuesta inmediata a cambios en las características fisicoquímicas en la columna de agua, generados por factores climáticos, influencia antrópica (contaminación) y procesos oceánicos (surgencias). Cambios bruscos en el ambiente pueden provocar una floración nociva con consecuencias negativas en la acuicultura, agricultura, pesca e influir directamente sobre las comunidades naturales y humanas.
Con el fin de contribuir al conocimiento del fitoplancton de la cuenca del Pacífico colombiano (CPC) que pueda ser causante de eventos toxígenos, en el presente trabajo se describe a nivel de género y de especie, la presencia y distribución que se observó entre 2004 al 2011, en muestreos realizados en 11 cruceros a bordo de los buques oceanográficos, adscritos a la Armada Nacional Colombiana, en el marco del ERFEN. El estudio abarcó toda la CPC comprendida entre los meridianos 77°45' WO a los 84°00'O y los paralelos 1°30'N a 5°00N, incluyendo el área triangular frente al departamento del Chocó, comprendida entre las coordenadas 5°00'N, 79°52'O; 6°30'N, 77°45'O y 5°N, 77°45'O; plano sobre el cual se siguió una grilla conformada por 45 estaciones de muestreo (Figura 1).
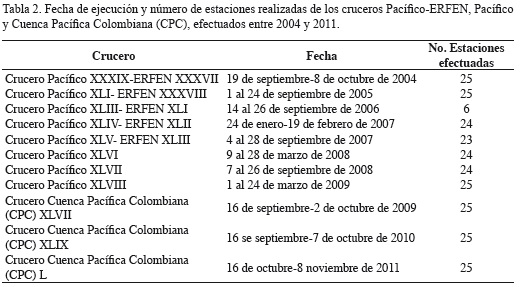
Los muestreos de fitoplancton se realizaron entre 2004 y 2011, en 11 cruceros a bordo de los buques oceanográficos adscritos a la Armada de la República de Colombia y la Dirección General Marítima (Dimar), ARC-Malpelo y ARC-Providencia. Los nombres de los cruceros, fechas y número de estaciones efectuadas por crucero se exponen en la Tabla 2.
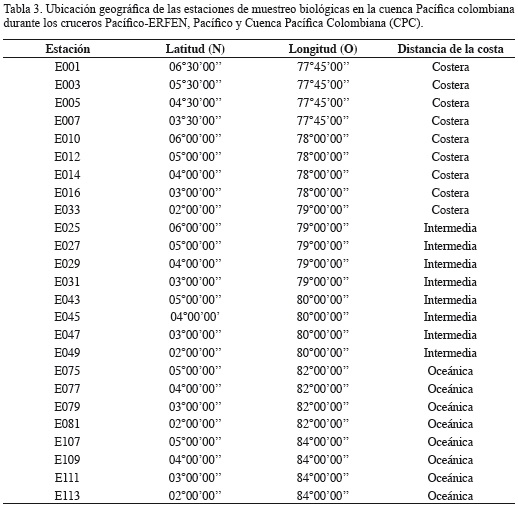
De las 45 estaciones preestablecidas en la grilla, 25 se destinaron para la toma muestras biológicas (Figura 1), entre ellas las de fitoplancton. La ubicación geográfica de estas estaciones se presenta en la Tabla 3. Para este trabajo se tuvo en cuenta la profundidad de muestreo (0 y 50 m) y la distancia de las estaciones respecto a la línea de costa, establecidas de acuerdo con Ramírez y Giraldo (2006), así: zona costera (estaciones: E001, E003, E005, E007, E010, E012, E014, E016 y E033), ubicadas a menos de 56 km de la costa; intermedias las que se encontraron entre 56 y 167 km de la costa (estaciones: E025, E027, E029, E031, E043, E045, E047 y E049); y oceánicas a las ubicadas a más de 167 km de la costa (estaciones: E075, E077, E079, E081, E107, E109, E111 y E113) (Tabla 2, Figura 1).
El análisis cualitativo y cuantitativo de los grupos de interés se realizó a partir de muestras de agua tomadas a nivel superficial y a 50 m de profundidad con botellas Niskin (5 L). Las muestras, cuyo volumen obtenido varió entre 250 y 500 ml, fueron fijadas con formalina hasta concentración final de 5%. La determinación de la abundancia celular, en número de individuos * L-1, se realizó mediante la técnica de Utermöhl (Sournia, 1978; Villafañe y Reid, 1995) empleando microscopio invertido provisto de reglilla Whipple, examinando alícuotas de 50 mL depositadas en cámaras de sedimentación por tiempo no menor de 72 h. Para la identificación de organismos se emplearon las guías de Cupp (1943), Taylor (1976), Pesantes (1983), Balech (1988), Round et al. (1990), Tomas (1996) y Soler et al. (2003).
En la Tabla 4 se muestran los géneros y las especies hallados en la cuenca pacífica colombiana, que han sido registrados en otras áreas del mundo como causantes de eventos nocivos por toxicidad. Según la Tabla 4, los taxa potencialmente toxígenos hallados en la CPC fueron:
Alexandrium. Varias especies pertenecientes a este género han sido agentes causantes de envenenamiento paralizante por moluscos (PSP = Paralitic Shellfish Poison) (Balech, 2002; Taylor et al., 2004 ). En el área estuvieron presentes en 5 de los 11 cruceros analizados, siendo el máximo valor de densidad encontrado de 586 individuos *L-1, en septiembre y octubre de 2010 (Tabla 4). Este valor fue el único que estuvo por encima del límite regulatorio que impondría suspensiones de las actividades relacionadas con la extracción y pesca de moluscos en países como Dinamarca (500 individuos * L-1) (Andersen, 1996).
Dinophysys. Es un género que ha sido registrado con varias especies causantes de intoxicación diarreica por moluscos (DSP = Diarrhetic Shellfish Poison) (Balech, 2002; Taylor et al., 2004; Reguera et al., 2012). Se detectó en 10 de los 11 cruceros analizados, el máximo valor de su abundancia se registró en marzo de 2008, con 113 individuos * L-1 (Tabla 4), superando también el limite regulatorio (100 individuos * L-1) en el que se establecerían e impondrían alertas y restricciones en las actividades acuícolas y pesqueras de bivalvos marinos en los Países Bajos, Irlanda y Escocia (Andersen, 1996).
Dinophysis caudata. Productora de toxinas diarreicas (DSP) (Balech, 2002; Taylor et al., 2004), se observó en marzo de 2008 y marzo de 2009, con una abundancia máxima en 2009 de 74 individuos * L-1 (Tabla 4).
Dinophysis rotundata. Productora de toxinas diarreicas (DSP) (Balech, 2002; Taylor et al., 2004), fue detectada en septiembre de 2007 con una densidad de 34 individuos * L-1 (Tabla 4). Este valor no alcanzó el límite de densidad para esta especie que impone restricciones para las actividades acuícolas en países como Dinamarca (103 individuos * L-1) (Andersen, 1996).
Gonyaulax. Contiene especies sindicadas de la producción de yesotoxinas, asociadas aunque con reservas con eventos diarreicos (Rhodes et al., 2006; Riccardi et al., 2009). En el Pacífico colombiano se encontró en nueve de los 11 cruceros realizados, alcanzando densidades hasta de 221 individuos * L-1 (Tabla 4).
Pseudo-nitzaschia. Este género contiene varias especies causantes de envenenamiento amnésico por moluscos (ASP = Amnesic Shellfish Poison) (Ferrario et al., 2002; Hasle y Frixell, 2004). En la CPC su presencia fue permanente, al detectarse en todos los cruceros y en más del 50% de las estaciones de todos éstos, en varios de los cruceros alcanzó valores que sobrepasaron los límites que imponen restricciones en la extracción y cultivo de moluscos en los Países Bajos (104 individuos * L-1; Andersen, 1996) (Tabla 4).
Aunque en ocasiones las densidades de varios de los grupos toxígenos hallados en la CPC superaron los límites que impondrían medidas prevención y control que van desde la generación de alertas, el análisis de toxinas e inclusive las suspensión en las actividades de extracción y cultivo de moluscos en los países antes mencionados (Andersen, 1996), estas no estuvieron acompañadas con cambios en la coloración del agua ni tampoco estuvieron relacionadas con eventos tóxicos en el área de estudio. Lo anterior puede ser debido a que la mayoría de estas densidades se presentaron principalmente en estaciones ubicadas en las zonas intermedias y oceánicas (Figura 1, Tabla 4), por lo que sus efectos nocivos, si los hubiera, serían menos evidentes y de poco alcance sobre las poblaciones humanas costeras. Además, es difícil que se traduzcan en eventos de intoxicación inmediatos, pues dependen de la participación de los organismos vectores, como moluscos filtradores o peces fitófagos, por ejemplo, que consumen el fitoplancton tóxico, acumulan las toxinas y las transfieren a los depredadores. Por otro lado, el grado de toxicidad también depende de la especie de microalga involucrada ya que algunas producen toxinas tan potentes que pueden resultar nocivas aunque no alcancen concentraciones celulares elevadas o causen cambios en la coloración del agua (Reguera, 2002). Respecto a los límites de concentración celular expuestos por Andersen (1996), es bueno mencionar que para una misma especie o género, ésta varía entre países, por lo que se escogieron como referencia para el presente estudio, los valores más bajos. Finalmente, es necesario mencionar que este estudio no contempló otros organismos con potencialidad nociva como los grupos Haptophyta, Raphidophyta y dinoflagelados no tecados. Para observar estos grupos, se requiere contar con organismos vivos, lo que no fue posible, dadas las sustancias que se emplearon para la fijación y preservación de las muestras.
AGRADECIMIENTOS
Los autores agradecen a la Dirección General Marítima (DIMAR), al Centro de Investigaciones Oceanográficas e Hidrográficas del Pacífico (CCCP), a la Armada de la República de Colombia, al Instituto de Investigaciones Marinas y Costeras (Invemar) y las tripulaciones de los buques oceanográficos ARC-Malpelo y ARC-Providencia, por el apoyo logístico y financiero brindado para el desarrollo del presente estudio. Contribución No. 429 Instituto de Estudio en Ciencias del mar (Cecimar).
BIBLIOGRAFÍA
Andersen, P. 1996. Design and implementation of some harmful algal monitoring systems. IOC Technical Series Vol. 44. IOC-Unesco, París. 102 p. [ Links ]
Arteaga, E., E. Rodríguez-Rubio y A. Galeano. 2008. Distribución, abundancia y composición del fitoplancton y condiciones ambientales en la cuenca pacífica colombiana, durante enero-febrero de 2007. Bol. Cient. CCCP., (15): 105-122. [ Links ]
Balech, E. 1988. Los dinoflagelados del Atlántico sudoccidental. Publ. Espec. Inst. Esp. Oceanogr. No. 1, Madrid. 310 p. [ Links ]
Balech, E. 2002. Dinoflagelados tecados tóxicos del Cono Sur Americano. 123-144. En: Sar, E.A., M.E. Ferrairo y B. Reguera (Eds.). Floraciones algales nocivas en el Cono Sur Americano. Instituto Español de Oceanografía, Madrid. 311 p. [ Links ]
Castillo, F.A. y Z. Vizcaino. 1993. Observación del fitoplancton del Pacífico durante 1991-1992 en condiciones El Niño. Bull. Inst. Fr. Études Andines, 22(1): 179-190. [ Links ]
Cupp, E. 1943. Marine plankton diatoms of the west coast of North America.Bull. Scripps Inst. Oceanogr., 5(1): 1-138. [ Links ]
Ferrario, M.E., E.A. Sar y S.E. Sala. 2002. Diatomeas potencialmente toxígenas del Cono Sur Americano: 167-194. En: Sar, E.A., M.E. Ferrario y B. Reguera (Eds.). Floraciones algales nocivas en el Cono Sur Americano. Instituto Español de Oceanografía, Madrid. 311 p. [ Links ]
García-Hansen, I., R. Cortés-Altamirano y A.P. Sierra-Beltrán. 2004. La marea roja causada por dinoflagelado Alexandrium tamarense en la costa Pacífica colombiana. 2001. Rev. Biol. Trop., 52(1): 59-68. [ Links ]
Hallegraeff, G.M. 2004. Harmful algal blooms: a global overview: 25-49. En: Hallegraeff, G.M., D.M. Anderson y A.D. Cembella (Eds.). Manual of harmful marine microalgae. IOC UNESCO, París. 793 p. [ Links ]
Hasle, G.R. y G.A. Fryxell. 2004. Taxonomy of diatoms: 465-509: En: Hallegraef, G.M., D.M. Anderson y A.D. Cembella (Eds.). Manual of harmful marine microalgae. IOC Unesco, París. 793 p. [ Links ]
Maldonado, J. 1978. Observaciones realizadas sobre el fenómeno de marea roja presentado en aguas del Pacífico colombiano en los meses de julio a septiembre de 1976. Rev. Divulg. Pesq., 12:1-8. [ Links ]
Medina, L. 1997. Composición y comportamiento del fitoplancton en el área de Pacífico colombiano, años 1995-1997. Bol. Cient. CCCP, (6): 95-108. [ Links ]
Pesantes, F. 1983. Dinoflagelados del fitoplancton del golfo de Guayaquil. Acta Oceanogr. Pacíf. (Inocar), Guayaquil. 98 p. [ Links ]
Ramírez, D.G. y A. Giraldo. 2006. Estructura comunitaria del fitoplancton de la cuenca pacífica colombiana durante la campaña oceanográfica Pacífico XXXIX-ERFEN VII. Bol. Cient. CCCP, 13: 65-84. [ Links ]
Ramírez, D.G., A. Giraldo y J. Tovar. 2006. Producción primaria, biomasa y composición taxonómica del fitoplancton costero y oceánico en el Pacífico colombiano (septiembre-octubre 2004). Invest. Mar., Valparaíso, 34(2): 211-216. [ Links ]
Reguera, B. 2002. Establecimiento de un programa de seguimiento de microalgas tóxicas: 21-52. En: Sar, E.A., M.E. Ferrairo y B. Reguera (Eds.). Floraciones algales nocivas en el Cono Sur Americano. Instituto Español de Oceanografía, Madrid, España. 311 p. [ Links ]
Reguera, B., R. Alonso, A. Moreira y S. Méndez. 2011. Guía para el diseño y puesta en marcha de un plan de seguimiento de microalgas productoras de toxinas. COI de Unesco y OIE manuales y guías de la COI, París. 70 p. [ Links ]
Reguera, B., L. Velo-Suarez, R. Raine y P.M. Gil. 2012. Harmful Dinophysis species: A review. Harmful Algae, 14: 87-106. [ Links ]
Rhodes, L., P. McNabb, M. De Salas, L. Briggs, V. Beuzenberg y M. Gladstone. 2006. Yessotoxin production in Gonyaulax spinifera. Harmful Algae, 5: 148-155. [ Links ]
Riccardi, M., F. Guerrini, F. Roncarati, A. Milandri, M. Cangini, S. Pigozzi, E. Riccardi, A. Ceredi, P. Ciminiello, C. Dell'Aversano, E. Fattorusso, M. Forino, L. Tartaglione y R. Pistocchi. 2009. Gonyaulax spinifera from the Adriatic Sea: Toxin production and phylogenetic analysis. Harmful Algae, 8: 279-290. [ Links ]
Round, F.E., R.M. Crawford y D.G. Mann. 1990. The diatoms. Biology and morphology of the genera. Cambridge University Press, Cambridge. 747 p. [ Links ]
Soler, A., M.I. Pérez y E. Aguilar. 2003. Diatomeas de las costas del Pacífico en Panamá: estudio florístico. Universidad de Panamá, Ciudad de Panamá. 384 p. [ Links ]
Sournia, A. 1978. Phytoplankton manual. Unesco, París. 337 p. [ Links ]
Taylor, F.J. R., Y. Fukuyo, J. Larsen y G.M. Hallegraeff. 2004. Taxonomy of harmful dinoflagellates: 389-432. En: Hallegraef, G.M., D.M. Anderson y A.D. Cembella (Eds.). Manual of harmful marine microalgae. IOC de Unesco, París. 793 p. [ Links ]
Taylor, T. 1976. Dinoflagellates from the International Indian Ocean expedition. A report on material collected by the R.V. "Anton Brunn". Institute of Oceanography and Department of Botany, Vancouver. 227 p. [ Links ]
Tejada, C., L. García, I. Málikov y N. Villegas. 2003. Compilación oceanográfica de la cuenca pacífica colombiana. Centro Control Contaminación del Pacífico Colombiano. Serie Publicaciones Especiales Vol. 1, Editorial Dimar, San Andrés de Tumaco, Colombia. 124 p. [ Links ]
Tomas, C.R. (Ed.). 1996. Identifying marine diatoms and dinoflagellates. Academic Press, San Diego. 598 p. [ Links ]
Villafañe, V.E. y F.M. Reid. 1995. Métodos de microscopía para la cuantificación del fitoplancton: 169-185. En: Alveal, K., M. Ferrario, E. de Oliveira y E. Sar (Eds.). Manual de métodos ficológicos. Universidad de Concepción, Concepción. 850 p. [ Links ]
RECIBIDO: 17/01/2015 ACEPTADO: 11/12/2015