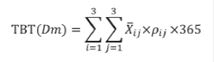INTRODUCCIÓN
Los arrecifes coralinos son considerados como uno de los ecosistemas más biodiversos del mundo (Hoegh-Guldber et al., 2007). Dentro de las especies que albergan estos ecosistemas, se encuentran organismos causantes de bioerosión. De acuerdo con Neumann (1966), la bioerosión es la destrucción y remoción de material consolidado o sustrato lítico por la acción directa de organismos. Los organismos causantes de bioerosión han sido divididos en microperforadores, macroperforadores y raspadores (Tribollet y Golubic, 2011). Dentro de los raspadores se encuentran principalmente peces [e.g. Labridae (subfamilia Scarinae), Balistidae y Tetraodontidae] y erizos regulares (e.g. Diadematidae y Cidaridae) (Downing y ElZahr, 1987; Londoño-Cruz et al., 2003; Hernández-Ballesteros et al., 2013).
Los equinoideos o erizos regulares son un grupo de la fauna bentónica que juega un papel ecológico importante en la estructura comunitaria (Herrera-Escalante et al, 2005; Barberá et al, 2011). Estos organismos son generalmente herbívoros y se alimentan tanto de micro como de macroalgas (Lawrence, 1975), las cuales desprenden del sustrato utilizando su pico corneo (linterna de Aristóteles). Mediante este ramoneo, como es conocida esta forma de alimentación, los erizos remueven (i.e. bioerosionan) pequeñas fracciones del material sobre el cual crecen las algas que, en el caso de los arrecifes coralinos, es carbonato de calcio. Cuando las densidades poblaciones de equinoideos son bajas, los efectos sobre la comunidad arrecifal, en particular sobre los corales, pueden ser positivos, pues liberan espacio para el asentamiento coralino (Sammarco, 1982: Morrison, 1988; Sánchez-Jeréz et al., 2001; Dumont et al, 2013), pero cuando son altas, las tasas de bioerosión pueden ser excesivas con un concomitante deterioro y debilitamiento arrecifal (Glynn et al, 1979; Bak, 1990; Glynn Leyte-Morales, 1997). En adición, se ha documentado que existen una serie de factores, tanto bióticos (e.g. depredación, territorialidad, densidad poblacional y tamaño de los individuos), como abióticos (e.g. hora del día, zona del arrecife y profundidad), que afectan la tasa de bioerosión por equinoideos (Glynn, 1988; Eakin, 1992; Bak, 1994; Nodarse, 2001; Toro-Farmer et al. 2002; Herrera-Escalante et al., 2005).
Dentro de los equinoideos, algunas de las especies pertenecientes al género Diadema se destacan por su capacidad bioerosionadora (e.g. D. antillarum Philippi en el Caribe y Atlántico y D. savignyi (Audouin) y D. setosum (Leske) en el Indo-Pacífico - Bak, 1990, 1994; Carreiro-Silva y McClanahan, 2001; Dumont et al., 2013). En el Pacífico Oriental Tropical, D. mexicanum A. Agassiz es una de las especies más conspicuas (Lawrence, 2007) y su efecto bioerosivo ha sido estudiado en regiones como las Galápagos (Ecuador), Panamá, Costa Rica y México (Glynn, 1988; Guzmán y Cortes, 1992; Herrera-Escalante et al, 2005; Alvarado et al, 2012). En Colombia, los arrecifes de la isla Gorgona han sido objeto de diversos estudios (Zapata, 2001; Zapata y Vargas-Ángel, 2003; Zapata et al., 2010); sin embargo, han sido pocos los realizados sobre equinoideos y en particular sobre D. mexicanum. En adición, los pocos trabajos realizados sobre equinoideos se han centrado más en la taxonomía y en la distribución espacial (Vargas-Ángel, 2003; Neira y Cantera, 2005), que en el papel como bioerosionadores. Los únicos registros que se tienen de bioerosión por equinoideos en el Pacífico colombiano son el de Toro-Farmer et al. (2002) en arrecifes coralinos (Playa Blanca, isla Gorgona) y el de Lozano et al. (2011) en ecosistemas rocosos (isla Palma, bahía Málaga). Por lo anterior, el presente trabajo tuvo como objetivo determinar la tasa de bioerosión por D. mexicanum en el arrecife de La Azufrada (isla Gorgona) y evaluar si dicha tasa fue afectada por el tamaño de los individuos, la zona arrecifal y la profundidad.
ÁREA DE ESTUDIO
La isla Gorgona, la cual hace parte del Parque Nacional Natural Gorgona (una de las cinco áreas protegidas dentro del Pacífico colombiano), está ubicada a 30 km del continente (Guapi, Cauca) (3°00'55" N, 78°14'30" W) y constituye el territorio insular más extenso (13.2 km2) sobre la plataforma continental del Pacífico colombiano (Figura 1). Gorgona está influenciada por la Zona de Convergencia Intertropical, lo que determina su clima biestacional y el patrón anual de precipitación unimodal (Zapata et al, 2010). El ciclo mareal en la isla es semidiurno, con una amplitud de aproximadamente 4 m (Prahl et al, 1979). Uno de los principales arrecifes coralinos en la isla es La Azufrada, el cual es relativamente pequeño (aproximadamente 0.094 km2) y poco desarrollado. Los principales constructores del andamio arrecifal son corales ramificados del género Pocillopora (e.g. P. damicornis (Linnaeus) y P. capitata Verril), seguido de algunas colonias de corales masivos (e.g. Porites spp. y Pavona spp.). El arrecife presenta un patrón de zonación poco definido con tres zonas características: Trasarrecife (TR), Planicie (PL) y Frente (FR), desde costa hacia mar afuera: la primera zona posee una cobertura de coral menor a 50%, con parches de coral y arena, y su profundidad es ± 1 m en marea baja; en la segunda la cobertura de coral vivo está entre 80 y 90%, y es la zona más somera (± 0.5 m) en marea baja; en la tercera la cobertura coralina disminuye drásticamente al aumentar la profundidad (± 3.0 m). Para más información sobre los arrecifes coralinos de la isla ver Zapata (2001).
MATERIALES Y MÉTODOS
Densidad, talla y profundidad
Los muestreos poblacionales fueron realizados en noviembre de 2014 y abril y julio de 2015, siguiendo el método propuesto por Toro-Farmer et al. (2002). Se utilizaron 320 cuadrantes de 1 m2 distribuidos de manera aleatoria en cada zona arrecifal, TR (n=100), PL (n=115) y FR (n=105). Para determinar el tamaño corporal se midió el ancho de la testa de todos los individuos dentro de los cuadrantes, con un calibrador digital subacuático (Zebra Tech), el cual, a su vez, registraba la profundidad a la cual se hizo la medición. Todos los individuos muestreados fueron clasificados en tres clases de tamaño: Pequeños (< 15 mm): P, Medianos (>15mm - < 20mm): M, y Grandes (> 20mm): G, según lo propuesto por Herrera-Escalante et al. (2005). Para determinar el contenido de carbonato de calcio (CaCO3) intestinal se recolectó de manera sistemática el último individuo de cada diez contados (dentro del cuadrante) hasta completar 30 por zona arrecifal. Posteriormente, los erizos recolectados fueron fijados (inyección con formalina al 10%), debidamente rotulados y transportados en recipientes plásticos (5 L) con formalina al 10% hasta los laboratorios de Biología Marina de la Universidad del Valle en Cali.
Tasa de bioerosión
La cantidad de carbonato de calcio (CaCO3) intestinal de los 90 erizos recolectados fue calculada haciendo algunas modificaciones del protocolo propuesto por Carreiro-Silva y McClanahan (2001): El sistema digestivo fue extraído, secado en un horno a 60°C por 48 h y pesado en una balanza analítica (precisión 0.0001 g). Posteriormente, fue calcinado en una mufla a 550°C por 3 h, para eliminar el material orgánico y conservar solamente la porción inorgánica. La diferencia de peso antes y después de la incineración fue usada para calcular la materia orgánica. Finalmente, la fracción inorgánica fue tratada con ácido clorhídrico HCL a 5% y lavada con agua destilada en papel filtro, para ser secada al horno a 60 °C por 12 h. La diferencia de peso seco antes y después de la digestión fue usada para calcular la cantidad de CaCO3 intestinal de cada individuo. Para calcular la tasa de bioerosión se asumió un tiempo de recambio intestinal de 24 h (Glynn et al, 1979; Bak, 1990; Herrera-Escalante et al, 2005).
La tasa de bioerosión fue calculada teniendo en cuenta: 1) el promedio de carbonato de calcio presente en individuos de una talla dada (P, M. G) expresada en kilogramos y 2) densidad promedio de individuos de esa talla en cada zona arrecifal (TR, PL, FR). La sumatoria de las tasas parciales, a través de las zonas arrecifales o a través de las clases de tamaño, permitió calcular la tasa de bioerosión total para el arrecife corrigiendo por la densidad etaria (ver ecuación 1).
Donde:
TBT(Dm) = Tasa de bioerosión total por D. mexicanum en el arrecife La Azufrada
i = Clase de tamaño
j = Zona arrecifal
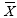 i j= Promedio de carbonato de calcio (en kg) para un tamaño dado en una zona arrecifal dada
i j= Promedio de carbonato de calcio (en kg) para un tamaño dado en una zona arrecifal dada
pij= Densidad de D. mexicanum de un tamaño dado en una zona arrecifal dada.
Análisis de los datos
Se calculó la densidad poblacional para todo el arrecife y para cada zona. En adición, se determinó el tipo de distribución espacial (i.e. agregada, uniforme, aleatoria) de la población usando el índice de dispersión (I = Varianza/ Media), el cual se evaluó a través de la prueba Chi-cuadrado (X 2) (Elliot, 1977). La densidad de los erizos fue evaluada entre zonas arrecifales a través de un modelo lineal generalizado siguiendo una distribución binomial negativa, debido a la sobredispersión de los datos (z=3.71; p«0.001). Como los datos de talla no cumplieron los supuestos de normalidad (Anderson-Darling, A=6.52; p<0.0001) y homogeneidad de varianzas (Levene, F=20.81; p<0.000), se realizó una prueba de aleatorización (10000 iteraciones), con la cual se generó una distribución de referencia (Edgington y Onghena, 2007), para evaluar el efecto de las zonas arrecifales sobre la talla de los erizos. Cuando se encontraron diferencias significativas, se realizaron pruebas de comparación múltiple. Por otro lado, la tasa de bioerosión (transformada con logaritmo natural) se evaluó utilizando ANOVA factorial, con tallas (tres niveles) y zona arrecifal (tres niveles) como factores explicativos. Dado que una de las combinaciones de los factores (P-TR) no tenía repeticiones, no se incluyó en el modelo la interacción entre factores. Cuando se hallaron diferencias significativas, se utilizó la prueba de comparación múltiple de Tukey. Finalmente, se realizaron dos regresiones lineales para determinar la dependencia del contenido de CaCO3 intestinal; la primera con la talla de los individuos y la segunda con la profundidad de recolecta del individuo. El dato de profundidad de recolecta fue estandarizado con relación al Chart Datum, utilizando el programa de licencia libre WXTide32, versión 4.7 (Free Software Foundation Inc. 2007). Todos los análisis fueron realizados con el programa de licencia libre R (R Core Team, 2014), versión 3.1.0, con un valor de significancia de α=0.05 y siguiendo los supuestos estadísticos (Zar, 1999).
RESULTADOS
Densidad, talla y profundidad
Se contaron 2650 individuos de D. mexicanum, lo que arrojó una densidad arrecifal promedio de 8.28 ± 11.65 ind/m2. Las densidades poblacionales entre las zonas difirieron significativamente, siendo FR la zona con mayor densidad promedio (13.0 ± 11.53 ind/m2), seguida por PL (6.73 ± 8.46 ind/m2) y TR (5.11 ± 13.38 ind/m2) (Fig. 2A). Aunque la densidad fue más baja en TR, fue en esta zona donde se contó el mayor número de individuos (n = 77) en un cuadrante. Por otra parte, el índice de dispersión (I) mostró que D. mexicanum se distribuyó de manera agregada.
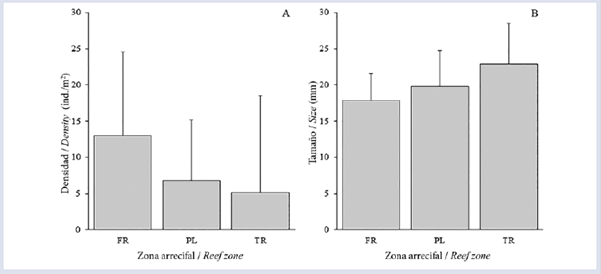
Figura 2 Promedio (±DE) de la densidad (A) y tamaño (B) del erizo Diadema mexicanum en cada zona arrecifal (FR= Frente, PL= Planicie, TR= Trasarrecife) del arrecife La Azufrada, isla Gorgona, Pacífico colombiano.
En relación con la talla, se midieron un total de 860 individuos, de los cuales 45.7% correspondieron a individuos de tamaño M, 40.6% a G y 13.7% a P. La talla promedio de los equinoideos fue de 19.62 ± 5.02 mm, con un máximo de 41.5 mm y un mínimo de 9.0 mm. Se encontraron diferencias significativas en las tallas entre todas las zonas, siendo TR la zona con la mayor talla promedio (22.86 ± 5.62 mm), seguida por PL (19.80 ± 4.98 mm) y FR (17.86 ± 3.75 mm) (Fig. 2B). Las tallas mostraron un patrón inverso a lo encontrado en la densidad; es decir, la zona con mayor densidad (FR) presentó los individuos más pequeños y viceversa (Fig. 2B). Finalmente, la profundidad media a la cual se hicieron las mediciones de los equinoideos aumentó gradualmente desde la costa hacia mar afuera, así: TR - 1.49 m, PL - 1.83 m y FR - 3.62 m.
Tasa de bioerosión
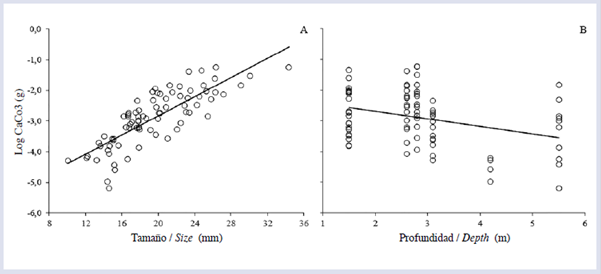
En los cálculos de la tasa de bioerosión se utilizaron 81 de los 90 datos disponibles, debido a posibles errores en el proceso de calcinado y digestión de la muestra. El tamaño de los equinoideos afectó significativamente la tasa de bioerosión en términos generales, los individuos de tamaño G removieron mayores volúmenes que los M y los P (Fig. 3A). También se observó un efecto significativo de la zona arrecifal sobre la tasa de bioerosión; en este caso, solo se encontraron diferencias marginales entre FR y TR. La mayor tasa se presentó en FR, seguido por PL y TR (Fig. 3B). Por otro lado, se observó que el tamaño de los equinoideos (Fig. 4A) y la profundidad (Fig. 4B) afectaron significativamente el contenido de CaCO3 intestinal. Finalmente, la tasa promedio anual de bioerosión por D. mexicanum para el arrecife La Azufrada, considerando las abundancias relativas de cada clase de tamaño en cada zona arrecifal, fue de (Tabla 1).
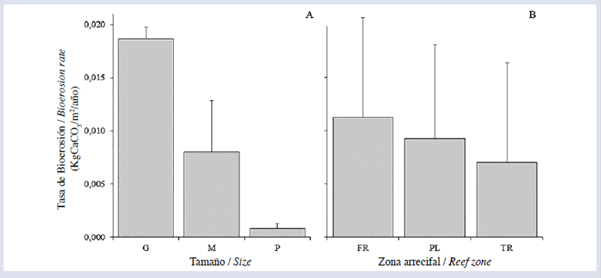
Figura 3 Tasa promedio de bioerosión (KgCaCO3/m2/año ± DE) por Diadema mexicanum discriminada por clase de tamaño (A) y zona arrecifal (B), en el arrecife La Azufrada, isla Gorgona, Pacífico colombiano.
DISCUSIÓN
Conocer la densidad poblacional de los equinoideos en ecosistemas marinos como los arrecifes coralinos es importante, no solo porque afecta de forma directa la tasa de bioerosión sobre estos (i.e. a mayores densidades, mayores tasas de bioerosión), sino también porque ellos ayudan a modular las abundancias relativas y la composición de especies de algas y corales (Herrera-Escalante et al., 2005). Las densidades poblacionales de D. mexicanum fueron relativamente altas si se comparan con otras zonas del Pacífico Oriental Tropical (Tabla 1); solo se han encontrado valores más altos en localidades (e.g. Isla Uva, Panamá) afectadas por eventos anómalos (e.g. fenómeno de El Niño) (Eakin, 1992). En dichas ocasiones, las altas densidades de equinoideos son la respuesta final a una serie de cambios ocasionados por el aumento en la temperatura del agua: incremento en la mortalidad del coral, rápido crecimiento de algas sobre el esqueleto coralino y finalmente un incremento en la abundancia de los equinoideos que se alimentan de estas (Glynn, 1988; Toro-Farmer et al., 2002).
Durante el periodo de estudio se observaron grandes parches de coral muerto como resultado, quizás, de eventos anómalos de temperatura registrados para la región (NOAA, 2016). Además, se registraron mareas bajas extremas durante el mismo periodo (IDEAM, 2015). Es probable que este tipo de eventos desencadenaran el proceso antes mencionado, con el concomitante incremento en las densidades de los equinoideos. En adición, se ha documentado que las densidades de equinoideos están relacionadas con la complejidad del sustrato y la talla de los mismos (Londoño et al., 2003; Lee, 2006); es decir, la relación entre el número y tamaño de refugios condiciona tanto la abundancia como el tamaño de los equinoideos que pueden colonizar un lugar determinado (Lozano-Cortés et al., 2011). Los equinoideos de FR son más pequeños, pero más abundantes que los de TR; esto puede ser un indicativo de la complejidad estructural de estas dos zonas; aunque esta característica no fue medida, observaciones en campo sugieren que los refugios en el TR son más grandes, pero menos abundantes que en FR, lo que permitiría la presencia de animales con tallas promedio más grandes, pero en menores abundancias, como se observó en este estudio. Además, se ha mostrado que existe una relación inversamente proporcional entre la cobertura coralina y la abundancia de los equinoideos (Glynn et al., 1979; Bak, 1990), lo que podría explicar la alta abundancia de D. mexicanum en FR comparado con PL, la cual presenta una mayor cobertura coralina (Zapata, 2001). A pesar de lo anterior, lo más probable es que no sea un solo factor (e.g. cobertura coralina o tamaño de refugios) el que module tanto la estructura de tallas como la densidad poblacional de una especie en particular en las diferentes zonas de un ecosistema complejo, como un arrecife coralino, sino la interacción de varios factores (bióticos y abióticos) que se combinan para determinar las características individuales y poblacionales, de los organismos que se encuentran en una subdivisión particular (e.g. TR, PL, FR) del ecosistema.
Por otra parte, se ha sugerido la existencia de tres factores principales y significativos, a la hora de evaluar el efecto erosivo de los equinoideos en los arrecifes coralinos: la especie, la talla de los individuos y la densidad (Bak, 1994). Los resultados de este trabajo muestran evidencia del efecto que tiene la talla de los equinoideos sobre la cantidad de material removido desde el arrecife por individuos por unidad de área y tiempo (i.e. la tasa de bioerosión). Este resultado es congruente con lo registrado por otros autores en diferentes especies de equinoideos, Echinometra mathaei (McClanahan y Muthiga, 1989), Centrostephanus coronatus (Toro-Farmer et al., 2002), Diadema mexicanum (Herrera-Escalante et al., 2005; Alvarado et al., 2012) y D. setosum (Dumont et al., 2013) o el grupo en general (Bak, 1990; Carreiro-Silva y McClanahan, 2001). Resultados como el anterior no son sorprendentes, pero vale la pena resaltar, como se mencionó anteriormente, que la talla es solo un factor de la ecuación y, por lo tanto, evaluar su efecto combinado con los otros factores (e.g. zona arrecifal) es un reto interesante. En este sentido, el impacto ocasionado por equinoideos de una talla determinada, puede verse modulado por la densidad de los mismos, en cada zona o en el arrecife en general. Es plausible suponer que individuos con tallas pequeñas, pero en altas densidades (e.g. lo ocurrido en FR), pueden tener un impacto similar al de individuos grandes, pero con bajas densidades (e.g. lo ocurrido en TR), dando como resultado una tasa de bioerosión similar entre las diferentes zonas del arrecife.
Como se puede ver, para poder tener una idea clara sobre el verdadero efecto bioerosivo de los equinoideos, no basta solo con obtener promedios, sino que es necesario considerar tanto la talla como la densidad específica. Aunque las densidades en La Azufrada son altas, las tallas medias son relativamente pequeñas, por lo cual los valores de remoción de carbonato de calcio se encuentran dentro de lo registrado tanto para el Pacífico colombiano (Lozano-Cortés, et al., 2011), como para el Pacífico Oriental Tropical (México - Herrera-Escalante et al., 2005; Costa Rica -Alvarado et al, 2012).
Una característica importante en la determinación de las tasas de bioerosión, por cualquier tipo de organismo, es el tiempo de recambio intestinal. Algunos autores (Glynn et al., 1979; Bak, 1990; Toro-Farmar et al, 2002), han utilizado intervalos de 24 h en sus cálculos; sin embargo, otros han mostrado que este puede ser mayor (1.18 días para Diadema setosum - Carreiro-Silva y McClanahan, 2001) o menor (0.5 días para Echinometra vanbrunti - Lozano-Cortés et al., 2011). Dado lo anterior, es importante que en futuros estudios se hagan estimaciones específicas del tiempo de recambio para la especie en particular, pues dependiendo de este valor, los cálculos podrían variar ampliamente.
Por otro lado, se considera que la profundidad, en términos biológicos, no influye de manera significativa sobre las tasas medias de bioerosión, debido principalmente a que las amplitudes de profundidad tratadas en este estudio son pequeñas (entre 1 y 7 m aproximadamente). Además, otros autores han considerado este factor como secundario en arrecifes cercanos (Londoño-Cruz et al., 2003), debido a que no se observa un marcado gradiente de profundidad y el cambio mareal en la zona es relativamente amplio (±4 m), lo que conlleva a una variación amplia a pequeña escala que podría afectar la zonación de los organismos productores de erosión. Aunque esta "inestabilidad" podría ocasionar un efecto insignificante sobre los equinoideos, es necesario realizar estudios detallados para poner a prueba este tipo de hipótesis. En este sentido, cabe mencionar que algunos trabajos han encontrado un efecto significativo de la profundidad sobre la bioerosión (Glynn y Leyte-Morales, 1997; Griffin et al, 2003; Herrera-Escalante et al, 2005), pero la amplitud en el ámbito de profundidad fue mayor en dichos estudios (entre 1 y 13 m).
Finalmente, algunos estudios han mostrado que la tasa de producción de carbonato de calcio por corales pocillopóridos en La Azufrada puede llegar a ser hasta tres órdenes de magnitud superior (5.56 KgCaCO3/m2/año -Palacios et al., 2014) a los valores de bioerosión registrados para D. mexicanum (0.083 KgCaCO3/m2/año) en este estudio. Dado lo anterior, se puede considerar que el efecto bioerosivo de este equinoideo no tiene un efecto importante sobre la estabilidad del arrecife. Sin embargo, es necesario resaltar que tanto los cálculos de Palacios et al. (2014) como los registrados en este trabajo, constituyen solo dos componentes del balance entre acrecimiento y bioerosión. Para tener una idea más clara es necesario incluir, en el proceso de acrecimiento, el aporte de otras especies de coral (e.g. especies masivas) y de algas coralinas, y es necesario considerar en el proceso de bioerosión los aportes generados por otros organismos, tanto perforadores (e.g. esponjas, gusanos, crustáceos, bivalvos) como abrasionadores (e.g. peces y otros equinoideos).











 text in
text in