INTRODUCCIÓN
Las especies invasoras son aquellas que se establecen fuera de su área nativa de distribución (Molnar et al., 2008), y son reconocidas por causar efectos negativos en los ecosistemas invadidos (Crooks, 2002). El pez león (Pterois volitans) (Linnaeus, 1758), originario del Indo Pacífico logró invadir el Atlántico occidental tropical y subtropical, constituyendo una de las invasiones de peces marinos más rápida de la historia (Morris et al., 2009). En Cuba se conoce su presencia por primera vez en la costa sur oriental en 2007 por Chevalier et al. (2008) y en 2009 se encontraba distribuido por toda la isla (Chevalier et al., 2014). Esta especie puede constituir una seria amenaza para las poblaciones de los organismos de las cuales se alimenta, impactando de forma drástica las tramas tróficas de los arrecifes al consumir las especies nativas de peces e invertebrados (Albins y Hixon, 2008; Morris y Akins, 2009; Alexander y Haynes, 2011; Cabrera, 2011; Valdez-Moreno et al., 2012; Morris, 2013; Cabrera-Guerra, 2014). Además, puede representar una grave amenaza para los peces nativos de nivel trófico similar en la competencia por los recursos, el alimento y el espacio (Morris, 2013; Morris y Green, 2013), ya que presenta características y hábitos conductuales nuevos para el ecosistema invadido; los cuales le pueden conferir cierto grado de eficiencia depredadora (Albins y Hixon, 2011; Albins y Lyons, 2012). Algunos estudios realizados con estos fines (Whitfield et al., 2007; Albins y Hixon, 2008; Morris y Akins, 2009; Green y Côte, 2010; Cure et al., 2012; Green et al.,2012; Albins, 2013; Benkwitt, 2014) dan indicios de que el pez león podría superar a algunos depredadores autóctonos en la competencia por los recursos alimentarios en los hábitats que ha invadido, así como disminuir la abundancia de las especies nativas de peces e invertebrados que constituyen sus presas (Albins, 2013). Teniendo en cuenta el impacto que puede causar el pez león a las especies nativas de nivel trófico similar, la presente investigación se propuso caracterizar la composición y estructura de la dieta del pez león y la de peces nativos de nivel trófico similar, evaluar la relación del aumento de la talla del pez león con la composición de la dieta, así como determinar el nivel de superposición entre la dieta del pez león y la de los peces nativos de nivel trófico similar.
ÁREA DE ESTUDIO
El estudio fue realizado desde marzo de 2012 hasta febrero de 2016 en tres localidades de Cuba (Figura 1): Guanahacabibes, Pinar del Río (21°46'35.6"-55'77.9"N y 84°32'93.8"-27'91.8"W), La Habana (23°06'98.5''N y 82°26'20.3''W) y Cayo Las Brujas, Villa Clara (22°32'54.8''-38'12.3''Ny 79°10'17.3"-15'46.6"W). Se trabajó en arrecifes de coral (Guanahacabibes y La Habana) y pastos marinos (Cayo Las Brujas). La presente investigación fue realizada en estas tres localidades para determinar si la superposición de la dieta del pez león con la de los peces nativos varía según el tipo arrecifes y según el biotopo marino.
Guanahacabibes
El Parque Nacional Guanahacabibes es un área marina protegida, está ubicado en la provincia Pinar de Río y posee una extensión de 15 950 ha (Cobián y Chevalier, 2009). En esta zona, los arrecifes son de tipo franjeantes o costeros y su perfil característico generalmente es el de una terraza única que culmina en un escarpe profundo de estructura variada. Los arrecifes del área han sido considerados entre los de mayor belleza y mejor estado de conservación de Cuba (Alcolado et al., 2003; Gotera, 2005; González-Ferrer et al., 2007).
La Habana
La localidad de La Habana se ubica en un sector frente al litoral occidental de la provincia La Habana. El crecimiento de corales, gorgonias y esponjas se limita fundamentalmente a la zona del veril (Guardia y González-Sansón, 2000) y no existen crestas ni arrecifes de parche (cabezos). En su lugar, toda la franja costera hasta unos 7 m de profundidades una explanada rocosa con muy pocos refugios (Aguilar y González-Sansón, 2007). No existen grandes porciones de fondos blandos y los que hay son inestables, por lo que prácticamente no existen pastos marinos (Aguilar y González-Sansón, 2007).
Caibarién
La localidad de Cayo Las Brujas se encuentra ubicada en la provincia Villa Clara. Presenta un gran número de cayos de mangle e islotes que se asientan sobre una plataforma común y están separados entre sí por canales y canalizos, que permiten el acceso del mar a la costa de Cuba (Martínez-Daranas, 2007). En esta localidad predominan los pastos marinos, particularmente la fanerógama Thalassia testudinum. Además, bordeando los cayos se encuentra una densa línea de mangle rojo (Rhizophora mangle).
MATERIALES Y MÉTODOS
Recolectas
En las localidades de Guanahacabibes y La Habana se colectaron individuos pertenecientes a las familias Lutjanidae, Serranidae, Haemulidae y Holocentridae; mientras que en Cayo Las Brujas se capturaron solo Lutjanidae y Haemulidae debido a la baja abundancia de especies de Serranidae y Holocentridae con tallas similares a las del pez león. Los peces capturados de la familia Serranidae correspondían a las especies Cephalopholis cruentata y C. fulva, los pertenecientes a Holocentridae correspondían a las especies Holocentrus adscensionis y H. rufus, en el caso de Haemulidae correspondían a Haemulon sciurus y H. flavolineatum, mientras que en La Habana los correspondientes a la familia Lutjanidae pertenecían a Lutjanus synagris y en Guanahacabibes y Cayo Las Brujas pertenecían a L. griseus y L. apodus. Todos los peces nativos cumplían la condición de ser los depredadores carnívoros más abundantes en cada localidad, además de presentar talla similar a la del pez león. Los ejemplares fueron capturados entre 8:00 y 10:00 h mediante la utilización de redes de mano (jamos) y arpones hawaianos. Las capturas fueron realizadas tres veces al año.
Procesamiento en el laboratorio
Los peces león y los peces nativos fueron analizados en un corto período de tiempo a partir de su colecta, en el caso que no fuera posible fueron congelados para su posterior identificación. Los ejemplares se sacrificaron mediante un corte de la columna vertebral en la región cervical empleando tijeras. En el caso del pez león se removieron las espinas dorsales, pélvicas y anales para evitar posibles accidentes. A todos los individuos colectados se les midió el largo total (centímetros) con una regla de 0.1 mm de precisión y se determinó el peso (gramos) con una balanza analítica de 0.5 g de precisión.
Las entidades halladas en los estómagos se identificaron hasta el taxón más bajo posible. Los peces se identificaron según Böhlke y Chaplin (1968), Guitart (1974), Guitart (1975) y Claro (2001). Los crustáceos se identificaron según los trabajos de Gómez (1980), Martínez-Iglesias y Gómez (1986) y Ortiz et al. (2010). Para el análisis volumétrico se emplearon vasos y probetas graduadas de 1 ml y 0.2 ml de precisión respectivamente.
Análisis de datos
Se graficó una curva de Entidades acumuladas vs. Estómagos analizados (unidades de muestreo), estos últimos se combinaron y ordenaron aleatoriamente. El análisis de las entidades halladas en los estómagos de cada una de las especies se realizó mediante el cálculo del porcentaje del número (%N), frecuencia (%F) y volumen (%V). A partir de estos resultados se calculó el índice de importancia relativa (IRI) (Pinkas et al., 1971), según la formula IRI= (%N+%V) x %F, también se evaluó el porcentaje de IRI como %IRI= 100 x IRIi/Eni=IRIi (Hyslop, 1980).
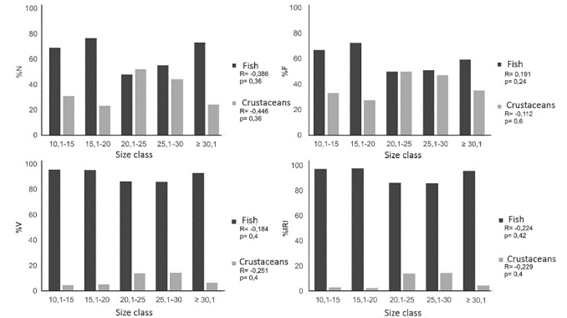
En La Habana se realizó un análisis de la dieta según la talla del pez león, se utilizó solo esta localidad debido a que fue la única donde se capturaron peces león de todas las amplitudes de tallas. Los ejemplares de peces león en dicha localidad fueron agrupados en cinco (5) clases de largo total: 10-15 cm; 15.1-20 cm; 20.1-25 cm; 25.1-30 cm y más de 30 cm. Fue determinado el consumo de peces y crustáceos según la talla del pez león mediante las variables %N, %F, %V y %IRI. Este procedimiento se realizó para determinar si había variaciones en la composición de la dieta del pez león con el crecimiento. En el caso que existan cambios en el espectro alimentario al pasar de una a otra etapa de desarrollo, se determinará el nivel de superposición trófica entre cada clase de tallas del pez león y las familias de peces nativos.
Para comparar los valores medios del %N, %F, %V y %IRI de las entidades alimentarias halladas en el estómago de los peces león y las familias de peces nativos se empleó el método de Montecarlo (Metropolis y Ulam, 1949). Se utilizaron 10000 remuestreos aleatorios con reemplazamiento de los datos originales. Para determinar si existía correlación entre el consumo de peces y crustáceos (%N, %F, %V y %IRI) con las tallas del pez león se aplicó una prueba de Mantel (Mantel, 1967). Los datos se convirtieron a matrices de distancia Euclidiana, se realizaron 999 permutaciones y se compararon ambas matrices. Esta comparación se basó en calcular el estadístico Z y probar su significación contra una distribución nula obtenida por permutaciones de la segunda matriz. Con la finalidad de analizar la superposición trófica entre el pez león y los peces nativos, se calcularon los intervalos confianza del índice Morisita-Horn (Horn, 1956). Se empleó en método de Montecarlo utilizando 10000 remuestreos aleatorios con reemplazamiento de los datos originales y se calcularon los límites de confianza por Boostrap. Para el procesamiento de los datos y las pruebas estadísticas fueron utilizados los programas Microsoft Excel, Pop Tools versión 3.23, Primer versión 6.0, R versión 3.2.2 y Mapinfo versión 10.5.
RESULTADOS
Composición de la dieta
Fueron capturados 899 peces león y 377 peces nativos de nivel trófico similar de los cuales, 74 correspondieron a la familia Serranidae, 146 a Haemulidae, 71 a Holocentridae y 86 a Lutjanidae.
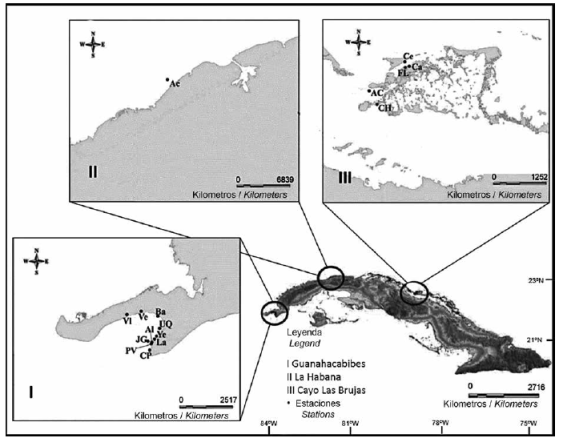
Figura 1 Ubicación de las localidades y estaciones de captura de peces león (Pterois volitans) y peces nativos de nivel trófico similar. I: Guanahacabibes (Pinar del Río), II: La Habana, III: Cayo Las Brujas(Villa Clara). Acopio Cobo: AC, Acuario: Ac, Almirante: Al, Bajada: Ba, Canal del Hielo: CH, Carey: Ca, Cerco: Ce, Cuevas de Pedro: CP, Delfinario: De, Farallón de Lali: FL, Jardín de las Gorgonias: JG, Laberinto: La, Patio de Vanesa: PV, Uvero Quemado: UQ, Veral: Vl, Verraco: Ve, Yemayá: Ye.
La tendencia asintótica observada en la curva de entidades acumuladas vs estómagos analizados permitió considerar apropiado el tamaño de la muestra (Figura 2).
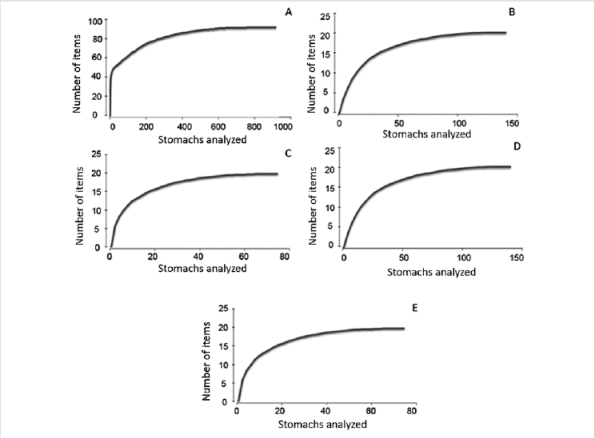
Figura 2 Curva de acumulación de entidades. A: Pez león, B: Lutjanidae, C: Serranidae, D: Haemulidae, E: Holocentridae.
En el contenido estomacal del pez león fueron identificadas 81 entidades alimentarias, agrupadas en 10 órdenes y 30 familias (Tablas 1, 2, 3, 4, 5). Las familias Pomacentridae (%IRI=1.41), Gobiidae (%IRI=0.82), Scaridae (%IRI= 0.33) y Labridae (%IRI=0.22) fueron las más importantes. En el contenido estomacal de los peces nativos se identificaron 44 entidades, agrupadas en 11 órdenes y 21 familias.
Tabla 1 Lista de entidades halladas en el contenido estomacal de los peces león (Pterois volitans) en las tres localidades estudiadas: Guanahacabibes, La Habana y Cayo Las Brujas Número: N, Frecuencia: F, Volumen: V, Índice de Importancia Relativa: IRI.
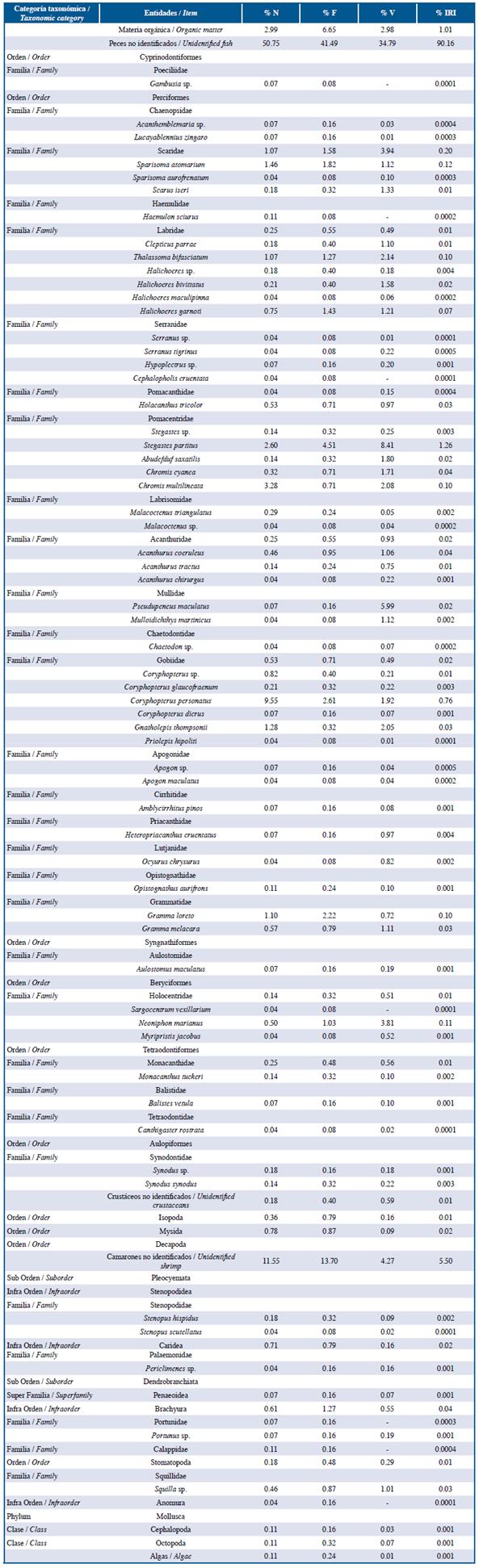
Tabla 2 Lista de entidades halladas en el contenido estomacal de la familia Haemulidae en las tres localidades estudiadas: Guanahacabibes, La Habana y Cayo Las Brujas Número: N, Frecuencia: F, Volumen: V, Índice de Importancia Relativa: IRI.
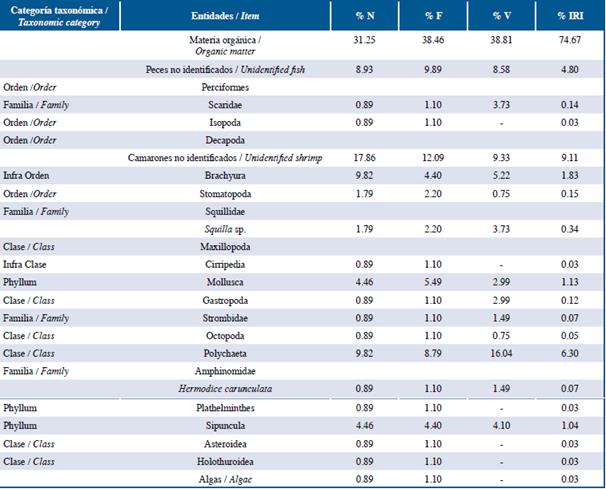
Tabla 3 Lista de entidades halladas en el contenido estomacal de la familia Serranidae en las tres localidades estudiadas: Guanahacabibes, La Habana y Cayo Las Brujas Número: N, Frecuencia: F, Volumen: V, Índice de Importancia Relativa: IRI.
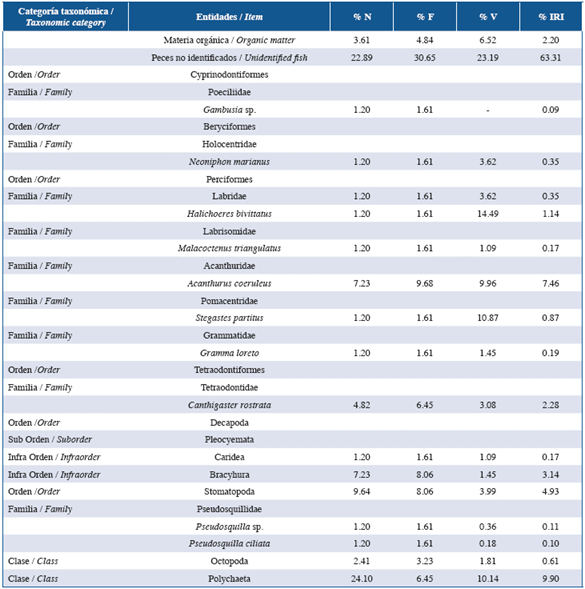
Tabla 4 Lista de entidades halladas en el contenido estomacal de la familia Holocentridae en las tres localidades estudiadas: Guanahacabibes, La Habana y Cayo Las Brujas Número: N, Frecuencia: F, Volumen: V Índice de Importancia Relativa: IRI.
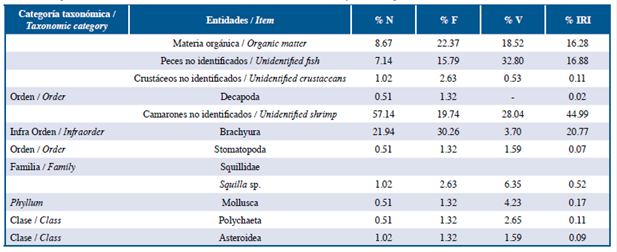
Tabla 5 Lista de entidades halladas en el contenido estomacal de la familia Lutjanidae en las tres localidades estudiadas: Guanahacabibes,mLa Habana y Cayo Las Brujas Número: N, Frecuencia: F, Volumen: V, Índice de Importancia Relativa: IRI.
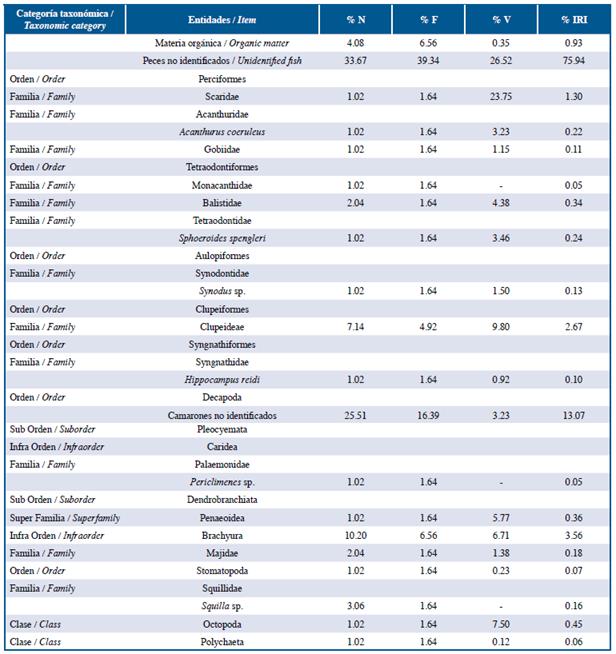
Los peces león y las especies de las familias Lutjanidae y Serranidae se alimentaron principalmente de peces y crustáceos en ese orden de abundancia de acuerdo a %IRI. Las especies pertenecientes a la familia Holocentridae se alimentaron principalmente de crustáceos, mientras Haemulidae de pequeños invertebrados bentónicos. En la familia Lutjanidae se cuantificaron nueve familias de peces como parte de su dieta, de ellas, Acanthuridae (%IRI=9,49), Clupeidae (%IRI=2,67) y Scaridae (%IRI=1,30) fueron las mejor representadas. La familia Serranidae presentó ocho familias de peces en su dieta, de las cuales Acanthuridae (%IRI=7,45) y Labridae (%IRI=1,48) fueron las más importantes. En el caso de la familia Holocentridae los camarones (Infraorden Stenopodidea y Caridea y la superfamilia Penaeoidea, %IRI=44,99) y el infraorden Brachyura (%IRI=20,77) fueron las entidades más importantes. A pesar de que los peces constituyen el segundo grupo mejor representado, no se logró identificar alguna familia de estos (%IRI=16,88). La dieta de la familia Haemulidae estuvo compuesta por crustáceos (camarones y brachyuros), poliquetos, moluscos, platelmintos, sipuncúlidos, holoturoideos y asteroideos; la proporción de cada componente varió de acuerdo a cada localidad.
Análisis de la dieta según la talla del pez león en La Habana
Se comprobó que no existe correlación significativa entre el aumento de la talla del pez león y el consumo de peces y crustáceos para ninguno de los métodos utilizados en la localidad de La Habana (Figura 1). De manera que la dieta de los juveniles es similar a la de los adultos en cuanto a la proporción de peces y crustáceos consumida.
Índice de superposición trófica
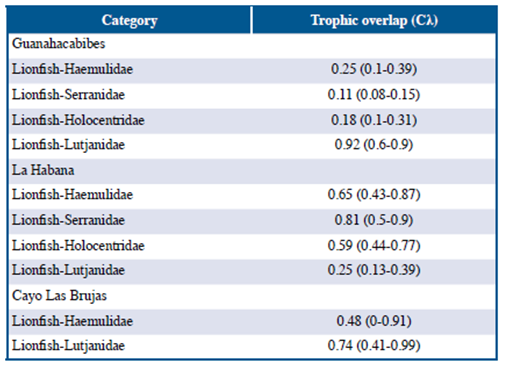
Los valores promedio del Índice de Morisita-Horn en Guanahacabibes indicaron una superposición baja entre las dietas del pez león y las familias Haemulidae, Serranidae y Holocentridae, mientras que, dicho índice para Lutjanidae fue elevado. En la localidad de La Habana Serranidae presentó una superposición alta de su dieta con respecto a la del pez león, Haemulidae y Holocentridae presentaron una superposición media, mientras que Lutjanidae una superposición baja. En la localidad de Cayo Las Brujas, al comparar las dietas de Haemulidae y Lutjanidae con respecto a la del pez león se observó una superposición media y alta respectivamente (Tabla 6).
DISCUSIÓN
La tendencia asintótica observada en las curvas acumuladas muestra que el número de estómagos fue suficiente para caracterizar la dieta del pez león y de las familias de peces nativos. El número de entidades alimentarias halladas en el contenido estomacal del pez león y de las familias Lutjanidae, Serranidae, Haemulidae y Holocentridae confirma que estos peces son depredadores activos generalistas (Sierra et al., 2001; Morris et al., 2009). La composición de la dieta del pez león en las tres localidades es semejante a lo obtenido en otras regiones del Caribe (Albin y Hixon, 2008; Cabrera, 2011; McCleery, 2011). Los peces y crustáceos fueron los grupos principales en su dieta, aunque los primeros fueron los más abundantes, lo cual coincide con los resultados obtenidos en el Atlántico, Bahamas, Cuba, el Caribe, Sureste de Estados Unidos y México (Albins y Hixon, 2008; Morris y Akins, 2009; Cabrera, 2011; McCleery, 2011; Muñoz et al., 2011; Green et al., 2012; Côté et al., 2013; Chevalier et al., 2014; Cabrera-Guerra, 2014; Dahl y Patterson, 2014; Cobián et al., 2016). Las familias de peces que presentaron mayor %IRI en la dieta del pez león coinciden en su mayoría con las registradas por otros autores en Cuba y el Caribe (Morris y Akins, 2009; McCleery, 2011; Cabrera-Guerra, 2014; Chevalier et al., 2014; Cobián-Rojas et al., 2016) por lo que concluimos que la composición de su dieta es semejante en toda la región del Caribe (Morris y Akins, 2009; Cabrera, 2011; McCleery, 2011; Cabrera-Guerra, 2014).
Se conoce que el pez león es una especie de poca movilidad que prefiere las oquedades rocosas (Morris y Akins, 2009), por lo que su alimentación está condicionada a su conducta. Lo anterior explica que entre las familias mejor representadas en su dieta se encuentren Gobiidae, Scaridae y Labridae las cuales viven asociadas al fondo y se encuentran entre las más abundantes en los arrecifes de Cuba (Sierra et al., 2001; Chevalier y Cárdenas, 2005, 2006; Cobián y Chevalier, 2009, Cobián et al. 2011), convirtiéndolas en presas asequibles al pez león. En el caso de Pomacentridae, los representantes del género Chromis se encuentran por lo general en la columna de agua por lo que se requiere mayor movilidad para capturarlos, sobre todo a los adultos, motivo por el cual no se encuentra entre las más abundantes en la dieta del pez león, a pesar de encontrarse entre las más abundantes en los arrecifes estudiados. Sin embargo, el género Stegastes tiene hábitos bentónicos y constituyó una de las entidades más importantes en la dieta de este pez invasor en Guanahacabibes y La Habana. Lo que reafirma que no solo la abundancia tiene un papel importante sino también los hábitos de las presas (Green et al., 2011).
La composición de la dieta de cada familia de peces nativos en cada localidad fue similar. La familia Lutjanidae y Serranidae son depredadores carnívoros, consumen gran cantidad de peces y una gran variedad de organismos bentónicos, fundamentalmente crustáceos (Sierra et al., 2001; Claro y Robertson, 2010). Ambas presentan hábitos alimentarios relacionados con el fondo (Sierra et al., 2001), esto explica que Labridae y Scaridae respectivamente sean las más importantes en las dietas de estas familias, ya que viven asociadas al fondo convirtiéndose en presas asequibles para estos depredadores. Por otro lado, Haemulidae y Holocentridae son depredadores carnívoros, aunque raramente consumen peces y se alimentan generalmente de pequeños organismos bentónicos (Sierra et al., 2001; Claro y Robertson, 2010).
En la localidad de Guanahacabibes, a pesar que los peces constituyeron la entidad más importante en la dieta de la familia Serranidae, no fue posible identificar las entidades alimentarias a niveles genérico y específico, mientras que en Cayo Las Brujas para Lutjanidae solo se pudo identificar un género y dos especies de peces. La imposibilidad de identificar las entidades alimentarias, en ambos casos, se debe al estado de degradación de las entidades que presentaban en el estómago, ya que las capturas se realizaron con demasiado tiempo de diferencia con respecto al horario de alimentación. Por otro lado, en Guanahacabibes la familia Clupeidae pudo haber sido sobrestimada por el método volumétrico ya que se hallaron algunos ejemplares de gran tamaño en los estómagos de los pargos (Lutjanidae). En esta localidad cerca de los arrecifes muestreados se han observado grandes cardúmenes de sardinas (Clupeidae), lo que demuestra que esta familia es abundante en dicha localidad, pudiéndose observar diversidad de depredadores alimentándose de ellas.
El hecho de que la familia Haemulidae presentara el espectro trófico más amplio, se debe a la amplia variedad de invertebrados encontrados en su dieta. Las entidades alimentarias que se hallaron formando parte de su espectro trófico presentaron un elevado grado de degradación, esto puede deberse a que esta familia muele el alimento con sus dientes faríngeos en forma de placas, por lo que este se encuentra en sus intestinos en fragmentos o formando una masa heterogénea. Esto dificulta notablemente la identificación de las presas y la cuantificación de cada una por su peso o volumen (Sierra et al., 1994).
A pesar de que Cephalopholis cruentata y Haemulon sciurus fueron consideradas en esta investigación como depredadores de nivel trófico similar al del pez león, fueron encontrados juveniles formando parte del contenido estomacal del pez león. De manera que, además de una posible afectación en la competencia por los recursos alimentarios, el pez león podría provocar afectaciones en los representantes de estas familias mediante depredación directa.
En el análisis de la dieta según la talla del pez león, no existió correlación entre el consumo de peces y crustáceos con el aumento de la talla. Estos resultados coinciden con los registrados en Cuba por Cabrera-Guerra (2014). Sin embargo, no corresponden con los resultados registrados en Bahamas (Morris y Akins, 2009), en el Caribe (McCleery, 2011) y en Cuba (García, 2015). Estos autores plantean que hay un aumento proporcional del consumo de peces según crece el pez león, por lo que la ingesta de crustáceos deja de ser relevante en la dieta. A pesar de que la mayoría de los autores plantean que al aumentar la talla del pez león aumenta el consumo de peces y disminuye el de crustáceos, otros autores como Chevalier et al. (2014) capturaron ejemplares de gran tamaño en praderas de Thalassia y manglares donde los camarones del infraorden Penaeidae alcanzan grandes tallas. En los estómagos analizados en esas estaciones se observó que estos camarones eran muy comunes en su dieta y los resultados según las variables número, frecuencia y volumen eran muy similares entre ellos. El hecho de que no exista diferencia en la dieta del pez león con el crecimiento, indica que las magnitudes de superposición entre las dietas del león y los peces nativos no van a depender de las tallas de esta especie invasora, al menos en la localidad de La Habana. De manera que, la existencia de una competencia a nivel trófico no va a estar influenciada por la talla del pez león, ya que en La Habana los juveniles de pez león tienen dieta similar a la de los adultos.
El Índice de Morisita-Horn entre la dieta del pez león y los peces nativos varió según la localidad, el biotopo marino (arrecife y pastos marinos) y las características propias de cada familia. En Guanacahabibes la superposición entre las dietas del pez león y las familias Haemulidae, Holocentridae y Serranidae fueron bajas. En el caso de Haemulidae y Holocentridae se debe a que estas familias se alimentan principalmente de pequeños invertebrados bentónicos, mientras que el pez león se alimenta esencialmente de peces. A pesar de que Serranidae se alimenta de gran cantidad de peces, la imposibilidad de clasificar las entidades alimentarias hasta taxones bajos pudo ser la causa principal de la baja superposición trófica.
En la localidad de La Habana Serranidae mostró una superposición alta de su dieta con respecto a la del pez león, esto se debe a que ambos se alimentaron principalmente de peces en esta investigación. Las familias Haemulidae y Holocentridae mostraron una superposición media debido a que los taxa de peces y crustáceos presentes en la dieta de estas familias coinciden con los presentes en la dieta del pez león. Por otro lado, la superposición entre la dieta del pez león y Lutjanidae fue baja. La mayoría de las especies capturadas en esta localidad pertenecen a la especie Lutjanus synagris, la cual presentó un elevado número de crustáceos en su dieta, esto coincide con lo obtenido por Sierra et al. (2001). De manera que, el elevado número de crustáceos presentes en el espectro alimentario de L. synagris determina el bajo nivel de superposición entre la dieta de esta familia y el pez león. Además, en La Habana existe un gran deterioro de hábitats y un elevado nivel de contaminación, debido a la antropización existente en dicha localidad (Guardia y González-Sansón, 2000; Alcolado-Prieto et al., 2012), por lo que la diversidad de especies ícticas tanto presas como competidores y la disponibilidad de ellas en el medio natural es menor con respecto a otras localidades (Betancourt y González-Sansón, 2007; Cobián y Chevalier, 2009).
En la localidad de Cayo Las Brujas, el índice de superposición entre la familia Haemulidae y el pez león fue medio, aunque esta familia se alimenta principalmente de pequeños invertebrados las capturas en esta localidad fueron realizadas en pastos marinos donde la abundancia y diversidad de especies disponibles es diferente que en los arrecifes. Por otro lado, en dicha localidad y en Guanahacabibes la superposición de la dieta del pez león con Lutjanidae fue alta. Esto se debe a que la mayoría de los individuos capturados pertenecen a las especies Lutjanus apodus y Lutjanus griseus, las cuales son se alimentaron fundamentalmente de peces en dicha localidad, al igual que el pez león.
CONCLUSIONES
El pez león y las familias Lutjanidae y Serranidae se alimentaron principalmente de peces mientras que Haemulidae y Holocentridae consumieron fundamentalmente pequeños invertebrados bentónicos.
Las variaciones en la talla del pez león no tienen influencia en la composición de su dieta en la localidad de La Habana.
El nivel de superposición entre la dieta del pez león y los peces nativos varía según la localidad, la zona ecológica, la disponibilidad y abundancia de las presas en el medio natural y según las características propias de cada familia.
La disponibilidad de alimento no constituye un factor limitante para el pez león y los peces nativos, por lo que no hay evidencia de que exista competencia trófica entre estos grupos.











 text in
text in