Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.47 no.1 Santa Marta ene./jun. 2018
https://doi.org/10.25268/bimc.invemar.2018.47.1.738
Artículos de Investigación
Dinámica de la estructura y composición de macroinvertebrados y su relación con las variables ambientales en la bahía de Buenaventura
1 Estudiante de Maestría en Ingeniería Ambiental, Universidad Nacional de Colombia sede Palmira. Grupo de Investigación ECONACUA, Palmira, Valle del Cauca, Colombia. degamboag@unaledu.co.
2 Profesor titular, Departamento de Ingeniería, Universidad Nacional de Colombia sede Palmira. Grupo de Investigación ECONACUA, Palmira, Valle del Cauca, Colombia. gduquen@unal.educo.
3 Docente-Investigador Facultad de Ciencias Básicas, Universidad Santiago de Cali. Grupo de Investigación ECONACUA, Palmira, Valle del Cauca, Colombia. rosa.cogua00@usc.edu.co.
La bahía de Buenaventura se caracteriza por una gran dinámica espacio-temporal de las variables ambientales. Existe información descriptiva sobre la distribución de macroinvertebrados en la bahía y su hábitat, sin embargo es necesario documentar sobre su dinámica en relación a las variables ambientales. El objetivo del presente trabajo fue determinar la variación espaciotemporal en la estructura y composición de macroinvertebrados y relacionarla con las variables ambientales. Se realizaron cuatro muestreos (abril-junio-septiembre-noviembre) a lo largo del año 2015, en cuatro estaciones (Estuario Río-Estuario Interno-Estuario Externo-Estuario Marino). En cada estación se colectaron tres muestras de sedimento, variables fisicoquímicas del agua y macroinvertebrados. Se encontraron en total 532 individuos distribuidos en 17 especies y 9 familias. La abundancia varió desde 0.7±1.2 a 29.7±7.4 individuos por arrastre y la riqueza varió de 0.3±1.2 a 4.7±1.2 especies por arrastre. El análisis de regresión múltiple sugiere una influencia de las variables salinidad y porcentaje de arcillas sobre la estructura y composición de macroinvertebrados en la bahía. La abundancia y riqueza de macroinvertebrados fue mayor cuando en el estuario predominaron las condiciones de mayor salinidad.
PALABRAS CLAVE: Biodiversidad; Invertebrados Epibentónicos; Estuario Tropical; Sedimentos
Buenaventura bay is characterized by a great dynamic of environmental variables. There is descriptive information concerning the distribution of macroinvertebrates in the bay and its habitat, however it is necessary to document on its dynamics in relation to environmental variables. The objective of the present work was to determine the espatio-temporal variation in the structure and composition of macroinvertebrates and their relationship with the environmental variables. Four sampling (April-June-September November) were carried out throughout 2015, in four stations (Estuary River-Internal Estuary-External Estuary-Marine Estuary). At each station three samples of sediments, physicochemical variables of the water and macroinvertebrates were collected. A total of 532 individuals were found in 17 species and 9 families. The abundance varied from 0.7±1.2 to 29.7±7.4 individuals per trawl and the richness varied from 0.3±1.2 to 4.7±1.2 species per trawl. The multiple regression analysis suggests an influence of the variables salinity and percentage of clays on the structure and composition of macroinvertebrates in the bay. The abundance and richness of macroinvertebrates was higher when the salinity conditions prevailed in the estuary.
KEYWORDS: Biodiversity; Epibenthonic Invertebrates; Tropical Estuary; Sediments
INTRODUCCIÓN
Los estuarios son ecosistemas costeros que ofrecen servicios de gran importancia para el desarrollo socioeconómico global. Los servicios van generalmente desde el turismo y recreación, hasta la protección de la costa, el control de la erosión, el reciclaje de nutrientes, la purificación del agua, la captura de carbono y la producción de comida y materia prima (Dauvin, 2007). Sin embargo, la zona costera es el grupo de ecosistemas marinos que presenta mayor cantidad de impactos por actividades humanas (Halpern et al, 2008).
Los efectos de las actividades humanas sobre los ecosistemas estuarinos se han venido evaluando según la diversidad del macrobentos, debido a que estas comunidades son sensibles a las presiones antropogénicas o estresores naturales (Dauvin, 2007). En adición, los macroinvertebrados bentónicos no sólo son importantes para evaluar la calidad de los estuarios y hacer planes de manejo y conservación, sino que a nivel mundial, la pesca de 3.4 millones de toneladas de langostinos y camarones, representa 10 billones de dólares, y cerca del 16% de las exportaciones mundiales de pescadería (FAO, 2009).
Las presiones sobre las comunidades de macrobentos a causa de las redes de arrastre camaroneras se pueden resumir en: alteración de la estructura física, suspensión del sedimento, cambios químicos y cambios en la comunidad bentónica por la captura incidental (Dauvin, 2007; FAO, 2009). Además, la cercanía a la costa hace del fondo estuarino uno de los principales receptores de contaminación antropogénica (Bayen, 2012). No obstante, las diferentes adaptaciones del macrobentos de los estuarios hace compleja la determinación de cuándo un cambio en la comunidad se debe a un estresor antrópico o cuándo se debe a la variabilidad ambiental del ecosistema (FAO, 2009; Lambert et al, 2011), debido a que la distribución y abundancia de los organismos bentónicos está influenciada por variables ambientales como la salinidad, pH, profundidad, temperatura, textura del sedimento y materia orgánica, entre otras (Carvalho y Santos, 2013; Furlan et al., 2013; Martins et al, 2014).
En el estuario de la bahía de Buenaventura la pesca artesanal ocupa un rol socioeconómico importante (Carvajal et al., 2011). Este ecosistema estuarino es alimentado por las desembocaduras de los ríos Dagua y Anchicayá, que aportan gran cantidad de sedimento que se acumula con el tiempo, en su mayoría rico en materia orgánica (Lucero-Rincón et al., 2008). El tipo de fondo que predomina en la bahía son los fondos blandos (Neira y Cantera, 2005).
Este estudio hace énfasis en los macroinvertebrados que habitan los fondos blandos, sin embargo, en los hábitats de litoral rocoso, fondos blandos, arenas y manglares del Pacífico del Valle del Cauca se han registrado 226 especies de crustáceos pertenecientes a 56 familias y cinco órdenes (Sessilia, Stomatopoda, Amphipoda, Isópoda, Decápoda) (Lazarus y Cantera, 2007). En cuanto a equinodermos, para la bahía de Buenaventura, se han registrado 9, de las 66 especies del Pacífico del Valle del Cauca, distribuidas en 7 familias y 4 ordenes (Paxillosa, Ophiurida, Cidariida, Scutellina). La poca representatividad de este grupo en la bahía se debe principalmente a que prefieren fondos duros (Neira y Cantera, 2005).
Este estudio busca contribuir a las investigaciones realizadas en la bahía de Buenaventura sobre la influencia de las variables ambientales en la dinámica de los macroinvertebrados (Lucero et al., 2006; Hernández, 2015), teniendo en cuenta que estos organismos son de importancia socioeconómica, además, la comprensión de la dinámica de las comunidades en función de la variación ambiental permitirá predecir el efecto sobre el macrobentos bajo presiones de origen antrópico y natural.
MATERIALES Y MÉTODOS
Área de estudio
El presente estudio se desarrolló en la bahía de Buenaventura, ésta se encuentra entre las latitudes 3°44' N y 3°56' N, y las longitudes 77°01' W y 77°20'. Su ancho va desde 3.4 km en la entrada hasta 5.5 km en la parte interna. Mide aproximadamente 30 km de largo, su forma es angosta y alargada (Figura 1). Su profundidad promedio es de 5 m, sin variabilidad apreciable, sólo el canal para navegación de barcazas que pasa por el centro de la bahía (Otero, 2005). La marea es semidiurna con un ámbito promedio de 3.7 m y presenta una temperatura del agua que oscila entre 25.7 °C y 29.8 °C (Cantera et al., 1992; Otero, 2005). La máxima precipitación en el año 2015 se presentó en el mes de noviembre, y la menor en junio (datos proporcionados por el IDEAM, 2015. Promedio de las estaciones Bajo Calima, Malaguita y Aeropuerto de Buenaventura).
En este estuario existen dos zonas, la bahía interior y la exterior. Se trabajó en la bahía exterior, que se caracteriza por agua bien mezclada que genera una homogeneidad vertical donde hay una diferencia entre la salinidad del fondo y superficie menor a 2 UPS, tanto en marea baja como en alta (Otero, 2005).
Fase de campo
Se realizaron cuatro muestreos en cada época climática, en el año 2015 (abril-noviembre), en cuatro estaciones distribuidas en la bahía de Buenaventura según un gradiente de salinidad. La estación ER (Estuario Rio) ubicada en 77°6'33.1'' W y 3°50'51.5''N, se caracterizó por ser interna e influenciada por la descarga del río Dagua, la estación EI (Estuario Interno) ubicada en 77°7'24.9'' W y 3°52'4.4''N, se caracterizó por ser interna y conformada por litoral rocoso. Mientras la estación EE (Estuario Externo) ubicada en 77°9'35.9''W y 3°50'58.7''N, se caracterizó por ser externa y conformada por litoral rocoso y por último, la estación EM (Estuario Marino) ubicada en 77°8'58.4'' W y 3°48'56.5''N, se caracterizó por ser externa e influenciada por la descarga del río Anchicayá. Las estaciones estuvieron separadas en promedio 4 km la una de la otra (Figura 1).
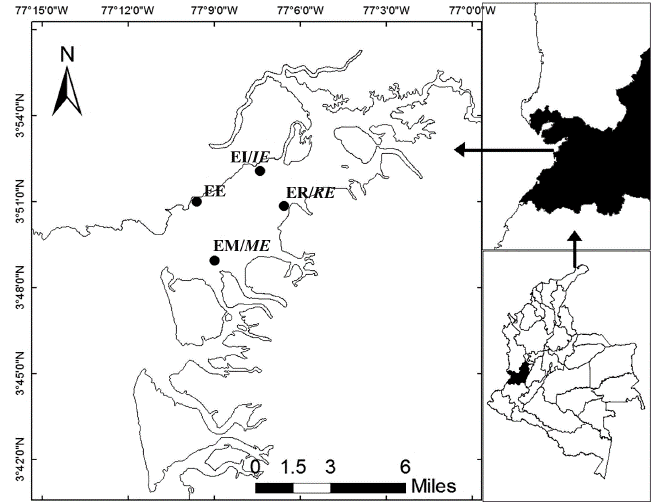
Figura 1: Área de estudio. Bahía de Buenaventura. (ER: Estuario Río; EI: Estuario Interno; EE: Estuario Externo; EM: Estuario Marino. Fuente:Elaboración propia adaptado del SIGOT.
Por cada estación y época se tomaron muestras de agua para variables fisicoquímicas, de sedimentos para granulometría y de macroinvertebrados para estructura y abundancia. Cada muestra tuvo tres réplicas para un total de 48 muestras. Para determinar la composición del sedimento se colectaron muestras de 5 cm de profundidad del sustrato mediante un corazonador de PVC de 4.5 cm de diámetro y 20 cm de largo. En las muestras de agua superficial se determinaron las variables fisicoquímicas: temperatura (C°), salinidad, pH y oxígeno disuelto (OD mg l-1), con un multímetro portátil marca Thermo Scientific. Adicionalmente, se midió la transparencia con un disco Secchi, la profundidad con un profundímetro flotante marca Depth Sounder y las coordenadas geográficas con un GPS (GARMIN).
Las muestras de macroinvertebrados epibentónicos, consistieron en la colecta en lancha con red de arrastre de ojo de malla 2.5 cm y con un ancho de trabajo de 8 metros, mediante arrastres independientes de 10 minutos, cada unidad experimental tuvo tres réplicas para un total de 48 arrastres. Los organismos y sedimentos fueron almacenados en bolsas plásticas, refrigerados y posteriormente llevados al laboratorio para ser almacenados a una temperatura de -20 °C.
Fase de Laboratorio
Sedimentos
A cada muestra del corazonador y a sus réplicas, se extrajeron los 5 cm superficiales, se usaron 5 g para contenido de materia orgánica mediante ignición (Danovaro, 2010) y 30-40 g para granulometría, mediante un tratamiento mecánico con tamices para partículas mayores a 50 hasta 1000 /<m. Se usó la escala Wentworth (Bengtsson y Picado, 2008; Danovaro, 2010).
Macroinvertebrados
En cada réplica, los macroinvertebrados fueron contados e identificados, como también se les midió el peso, talla y se les determinó sexo y estado reproductivo. Se clasificaron taxonómicamente a nivel de especie apoyándose de las claves taxonómicas FAO (Fischer et al., 1995), bases de datos de internet (WoRMS: World Register of Marine Species) y revisión de literatura (Lemaitre y Álvarez-León, 1992; Pineda y Madrid, 1993; Baltazar, 1997; Neira y Cantera, 2005; Lazarus y Cantera, 2007; Cardoso y Hochberg, 2013).
Tratamiento de datos
Las variables fisicoquímicas del agua fueron: Sal (salinidad), pH, OD (concentración de oxígeno mgL-1), Tr (transparencia). Las variables de la composición del sedimento fueron: %MO (porcentaje de materia orgánica), %G (porcentaje de gravas y arenas muy gruesas), %AG (porcentaje de arenas gruesas), %AM (porcentaje de arenas medias), %AF (porcentaje de arenas finas), %L (porcentaje de limos) y %A (porcentaje de arcillas).
Se determinó la abundancia (N), riqueza (S) y diversidad de Shannon (H') del ensamblaje de macroinvertebrados. A las variables ambientales, a la composición y estructura de macroinvertebrados, se les revisó la normalidad, se examinaron las gráficas de residuales para confirmar la normalidad y homogeneidad de varianza, y en los casos necesarios se realizó la transformación correspondiente para mejorar normalidad (Green, 1979).
Se redujo la cantidad de variables ambientales mediante un análisis de componentes principales (PCA) basado en una matriz de correlaciones. El PCA se realizó usando el procedimiento Princomp en SAS 9.4 (SAS, 2012). Este procedimiento se realizó para pasar de 13 variables ambientales a 10 variables no correlacionadas que explicaron el 82.35% de la varianza del experimento.
Se examinaron las diferencias significativas (p<0.05) por estación de muestreo y época climática entre la estructura y composición de macroinvertebrados, mediante un Análisis Multivariado de Varianza (MANOVA), de dos vías, con estación y época climática como factores principales (usando el Modelo Lineal General y las medias de diferencias de cuadrados, SAS 9.4 (SAS, 2012). Se efectuó el ANOVA y se examinó el Error Tipo III para mejorar la interpretación de las diferencias significativas entre macroinvertebrados. Por último, se inspeccionó la prueba de Tukey para identificar la estación o época climática en la cual la variable en cuestión presentó diferencias significativas.
Se desarrolló un análisis de regresión múltiple univariada para determinar las variables ambientales que estuvieron relacionadas con la composición y estructura de los macroinvertebrados. La colinealidad entre las variables independientes fue evaluada examinando los factores de inflación de varianza (VIF; Allison, 1991). Las variables se consideraron independientes si los valores VIF fueron cercanos a 1, y colineales cuando el valor fue mayor a 10. Las variables incluidas en la regresión múltiple fueron seleccionadas ingresando cada variable. Un valor de p<0.05 fue escogido como valor de entrada y salida para identificar el conjunto de variables que fueron importantes en la descripción de la variable dependiente. El mayor valor de F fue usado en cada paso para identificar la variable que más contribuyó al valor de R2. Las variables subsecuentes fueron escogidas de la misma manera; sin embargo, después de cada nueva adición, todas las variables fueron examinadas para asegurarse que cumplieran el criterio del modelo (p<0.05). Si la variable no fue lo suficientemente significativa, se eliminó del modelo.
RESULTADOS
En la bahía de Buenaventura, las variables ambientales como salinidad, pH, oxígeno disuelto, transparencia, y la composición del sedimento, variaron temporalmente (MANOVA, F=25.4, p<0.0001) a través de las estaciones (MANOVA, F=7.1, p<0.0001) y también se presentó una influencia de la época sobre las variables ambientales en las estaciones (MANOVA, F=16.4, p<0.0001). La salinidad fue mayor en junio en ER, pero en esta estación también se presentó la menor salinidad en noviembre (ANOVA, p<0.0001). El pH fue mayor en abril en EM, pero en noviembre presentó el menor valor en la misma estación (ANOVA, p<0.0001). El oxígeno disuelto fue mayor en septiembre en la estación EE, y menor en noviembre en la estación ER (ANOVA, p<0.0001). La transparencia fue mayor en junio en EI, y menor en noviembre en EM (ANOVA, p<0.0001) (Tabla 1).
Tabla 1: Promedios de las variables ambientales por Época y Estación, estimados por mínimos cuadrados (±desvest). Las letras leídas verticalmente indican diferencias significativas (Tukey), en orden descendente, para cada variable ambiental con una interacción significativa de dos vías (p≤0.05). Cada media fue calculada de tres muestras para un total de 48 muestras. ER=Estuario Rio. EI=Estuario Interno. EE=Estuario Externo. EM=Estuario Marino. Sal=Salinidad, OD=Oxígeno disuelto, TR=Transparencia, %MO=Porcentaje de materia orgánica, %G=Porcentaje de grava y arena muy gruesa, %AG=Porcentaje de arena gruesa, %AM=Porcentaje de arena media, %AF=Porcentaje de arena fina y %A=Porcentaje de arcilla.
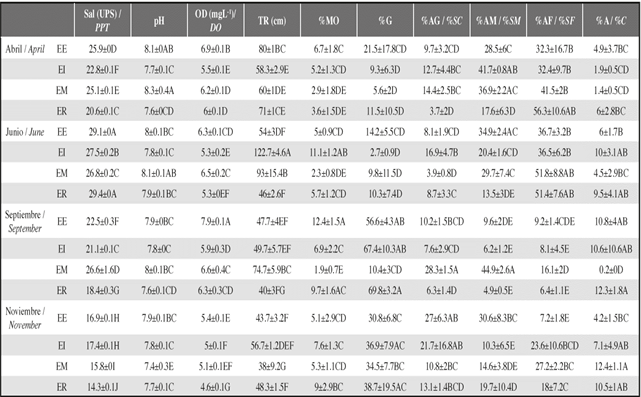
Respecto a los sedimentos, el porcentaje de materia orgánica fue mayor en septiembre en la estación EE, y menor en la estación EM durante los meses de septiembre y junio (ANOVA, p<0.0001). La fracción del sedimento grueso fue mayor en septiembre en ER, y menor en junio en EI (ANOVA, p<0.0001). El porcentaje de arena fue mayor en junio en la estación EM, y menor en septiembre en EI (ANOVA, p<0.0001). Por último, el porcentaje de arcilla fue mayor en noviembre en EM, y menor en la misma estación pero en el mes de septiembre (ANOVA, p<0.0001) (Tabla 1).
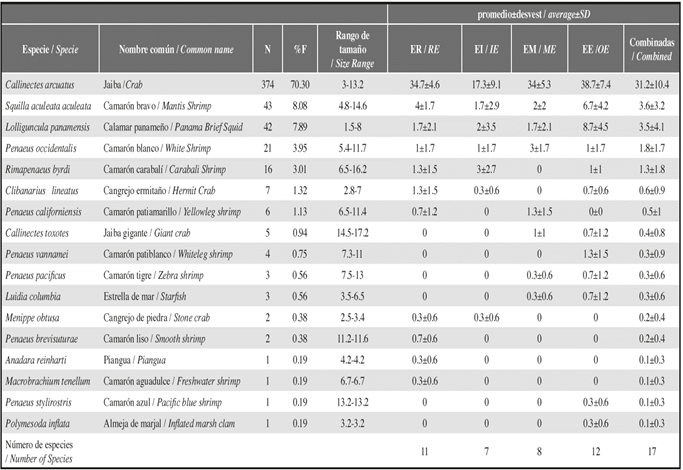
En la bahía de Buenaventura se realizaron 48 arrastres desde abril a noviembre, en cuatro estaciones, y se registraron en total 532 individuos distribuidos en 17 especies y 9 familias. La abundancia varió desde 0.7+1.2 a 29.7±7.4 individuos por arrastre, la riqueza varió de 0.3+1.2 a 4.7+1.2 especies por arrastre y la máxima diversidad de Shannon fue 1.6+0.3 Por clase predominaron los crustáceos (91%), seguidos de los moluscos (8%) y por último los equinodermos (1%).
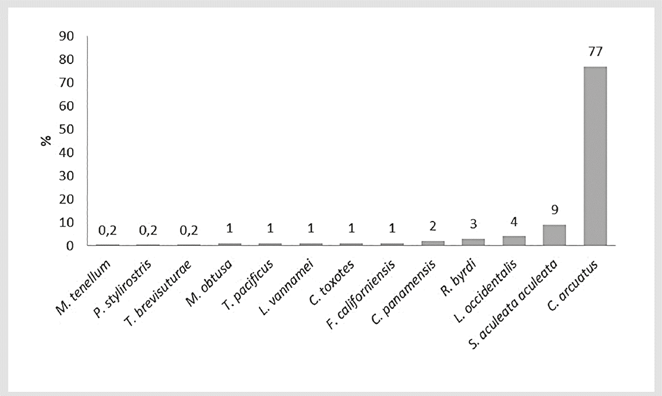
En el grupo de los crustáceos, la familia más abundante fue Portunidae (n=383; 78%), seguida de Penaeidae (n=53; 11%) y Squillidae (n=43; 9%). Las especies más abundantes fueron Callinectes arcuatus, Squilla aculeata aculeata y Litopenaeus occidentalis (Figura 2).
En el grupo de los moluscos, la familia más abundante fue Loliginidae (n=42; 96%), mientras las familias Arcidae y Corbicuidae tuvieron baja representatividad (n=1; 2%). De la familia Arcidae, se encontró la piangua, Anadara reinharti y de Corbiculidae, se halló la especie Polymesoda inflata. En el grupo de equinodermos, sólo se capturó la especie Luidia columbia (n=3), de la familia Luidiidae.
La abundancia total de macroinvertebrados fue mayor en la estación Estuario Externo (38.39%), seguida de Estuario Río (28.12%), Estuario Marino (23.72%) y Estuario Interno (9.78%). Por época, el pico de abundancia se presentó en junio (39.36%), seguido de abril (26.89%), noviembre (20.78%) y septiembre (12.96%) (Figura 3). Cuatro de las 17 especies de macroinvertebrados fueron encontradas en las 4 estaciones (Tabla 2) y las especies más abundantes se encontraron en la zona externa de la bahía (EM y EE). Del resto de especies, seis fueron exclusivas de la zona externa de la bahía (EM y EE) y cuatro estuvieron en la zona interna de la bahía (ER y EI).
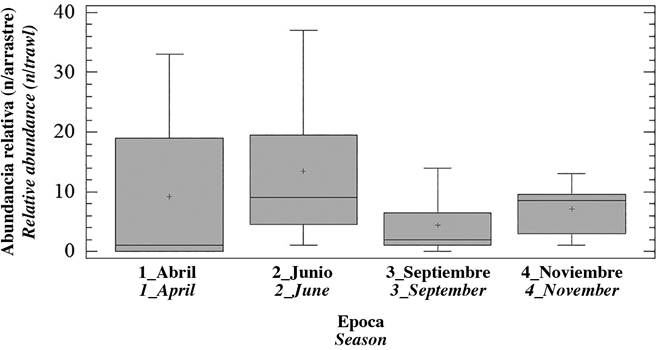
Figura 3 Gráfico de cajas y bigotes de la distribución de las abundancias relativas de los macroinvertebrados a través de las épocas de muestreo.
Tabla 2: Escalafón de abundancia de macroinvertebrados, frecuencia relativa (%F) en las estaciones de muestreo, ámbito del tamaño (mm, longitud total para camarones, estrellas de mar y cangrejos ermitaño y largo del caparazón para cangrejos) y promedio de abundancia relativa (ind/arrastre, promedio de 48 muestras) de macroinvertebrados colectados en las estaciones ER, EI, EE y EM.
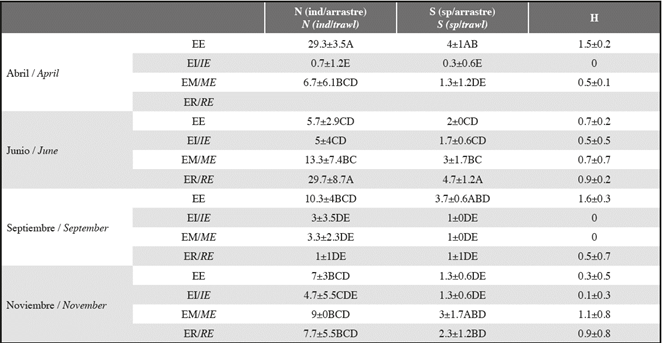
La estructura y composición de macroinvertebrados no variaron por época (MANOVA, F=2.1, p=0.06) ni por estación (MANOVA, F=1.7, p=0.14). Sin embargo, la época presentó una influencia significativa sobre la variación de la abundancia y riqueza de los macroinvertebrados a través de las estaciones (MANOVA, F= 3.9, p<0.0001). Se determinó que tanto las mayores abundancia y riqueza fueron en junio en la estación ER, mientras que las menores abundancia y riqueza, se presentaron en abril en EI (Tabla 3), ANOVA, p<0.0001, para ambos). No se presentó una interacción entre la época y estación con la diversidad de Shannon.
Tabla 3: Promedios de las abundancias relativas del ensamblaje de macroinvertebrados, iqueza de especies y diversidad de Shannon por Época y Estación, estimado por mínimos cuadrados (±desvest). Las letras leídas verticalmente indican diferencias significativas (Tukey) para cada descriptor de la comunidad con una interacción significativa de dos vías (p≤0.05). Cada media fue calculada de tres muestras para un total de 48 muestras. ER=Estuario Rio. EI=Estuario Interno. EE=Estuario Externo. EM=Estuario Marino.
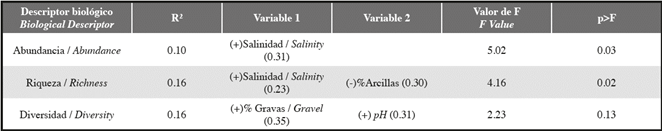
En el análisis de regresión múltiple univariada se encontró que la abundancia fue mayor entre mayor la salinidad del agua, mientras la riqueza fue mayor cuando la salinidad fue alta y el porcentaje de arcillas fue bajo. Se usaron 13 variables ambientales para predecir la abundancia relativa, la riqueza y la diversidad de Shannon (Tabla 4). Dos de los tres modelos fueron significativos (p<0.05). Aunque el mejor modelo explicó 16% de la variación en los descriptores biológicos. Se incluyeron en el modelo las variables que no fueron colineales, y las más notables tuvieron correlaciones significativas. La correlación de Pearson de la salinidad fue significativa para el modelo de abundancia (p=0.03). De acuerdo a las correlaciones de Pearson, salinidad explicó 31% de la varianza de la abundancia de macroinvertebrados, y 23% de la varianza en la riqueza de macroinvertebrados.
Tabla 4: Análisis de regresión múltiple de los descriptores del ensamblaje de macroinvertebrados en relación a las variables ambientales. Las variables se reportaron en el orden que ingresaron al modelo, es decir, la variable 1 tuvo mayor valor de F (p<0.05). El tipo de relaciones entre las variables biológicas y ambientales se representaron por signos y las correlaciones de Pearson se representaron en paréntesis. El nivel de significancia para retener las variables en cada modelo fue p<0.05, excepto para las variables en cursiva (0.15<p<0.05). Las correlaciones de Pearson significativas se indicaron en negrilla.
DISCUSIÓN
En estudio se consideró que las condiciones ambientales fueron marinas cuando el conjunto de variables salinidad, pH, oxígeno disuelto y transparencia presentaron valores altos y cuando en el sedimento predominaron las arenas medias y finas. Las condiciones ambientales de menor salinidad fueron opuestas a las descritas anteriormente. Esta clasificación se sustenta en varios estudios que describen las características fisicoquímicas del agua y sedimentos de la bahía (Cantera y Blanco, 2001; Lucero et al., 2006). Acorde con estos estudios, se determinó que el porcentaje de gravas y arena muy gruesa fue alto en el sedimento cuando la salinidad, el pH y la transparencia fueron bajos, lo que indicó influencia del agua dulce por las descargas de los ríos Dagua y Anchicayá. Las gravas y arenas muy gruesas fueron los materiales que predominaron en los sedimentos de estaciones aguas arriba de la desembocadura del río Dagua (Lucero et al., 2006). Mientras la baja transparencia posiblemente se debió a que las condiciones hidrodinámicas no permitieron el asentamiento de los limos y arcillas. En general, las épocas de mayor precipitación en el estuario y las estaciones donde se ubicaron las zonas de drenaje de los ríos, afectaron la salinidad, el pH, el oxígeno disuelto y la fracción del sedimento generando cambios y variabilidad en las ofertas fisicoquímicas de los microhábitats del estuario.
En este estudio el grupo taxonómico que tuvo mayor representatividad en el ensamblaje de macroinvertebrados fueron los crustáceos, siendo la jaiba, C. arcuatus, la especie dominante en el estuario de la bahía de Buenaventura. Lo anterior concuerda con inventarios de macroinvertebrados (Norse y Estevez, 1977; Neira y Cantera, 2005; Lazarus y Cantera, 2007) y estudios sobre las poblaciones de interés económico en la zona (Pineda y Madrid, 1993; Baltazar, 1997). Las jaibas son organismos eurihalinos, es decir, cuentan con la adaptación fisiológica de soportar un amplio rango de salinidad (Norse y Estevez, 1977; Hernández y Arreola-Lizárraga, 2007), de ahí a que se distribuyan sobre el estuario sin limitaciones por salinidad.
El segundo crustáceo más abundante fue el camarón bravo. La abundancia de S. aculeata no tuvo un patrón claro, debido a que esta especie es residente de las zonas fangosas y fangoarenosas de la bahía (Murillo, 1988), además, se ha registrado que las hembras se entierran bajo del sedimento (Wortham, 2009) lo que pudo interrumpir su captura en el muestreo. En general, el camarón bravo se colectó en todas las épocas de forma abundante, mientras los camarones blanco (P. occidentalis) y carabalí (R. byrdi) también estuvieron en todas las épocas pero de manera poco abundante. El resto de especies estuvieron ausentes en una o más épocas
En el grupo de los moluscos, se colectaron los bivalvos Polymesoda, Anadara y los cefalópodos del género Loligunculla. Respecto al calamar dedal de Panamá, Loligunculla panamensis, sólo se encontraron individuos en la época de abril en la estación EE; en el golfo de California se ha registrado que la especie se desplaza según las ofertas de alimento (Arizmendi-Rodríguez et al, 2012); se han realizado estudios sobre sus hábitos alimentarios en la costa pacífica colombiana (Barragán, 1977), registrando que los peces y crustáceos son la principal fuente de alimento. Los resultados del presente trabajo respecto a la mayor abundancia de L. panamensis en abril en EE sugieren que durante esta época se presentó allí una oferta ambiental que favoreció la presencia abundante de la especie.
En cuanto al grupo de los equinodermos, se encontraron sólo tres individuos de la estrella Luidia columbia, de la familia Luiididae, que es una de las siete familias de equinodermos que habitan fondos blandos en el pacífico (Neira y Cantera, 2005). La baja representatividad concuerda con lo registrado por otros estudios en la zona donde se evidenció la escasa presencia de estas familias en fondos blandos debido a la preferencia de fondos duros como arrecifes rocoso y coralino, y litoral rocoso (Neira y Cantera, 2005). En relación al grupo de poliquetos, que son predominantes en la macrofauna de fondos blandos (Valencia et al, 2014), no se colectaron en esta investigación debido a que no presentaron el tamaño suficiente para ser capturados por las redes de arrastre de ancho de ojo de malla de 2.54 cm (una pulgada).
La abundancia relativa de macroinvertebrados fue mayor en junio y menor en septiembre, y estuvo asociada de manera positiva a la salinidad del agua. En junio se presentó el pico de abundancia de la jaiba C. arcuatus. Se ha registrado que en las épocas de mayor salinidad se presenta el pico de reclutamiento de jaibas del género Callinectes en el Caribe (Valencia y Campos, 1996). Respecto a la especie Penaeus occidentalis, durante junio se presentó la mayor salinidad que coincidió con la presencia de algunos juveniles (n=5). Se ha registrado que el principal pulso de la migración de los juveniles desde las zonas de guardería hacia las zonas de camarones adultos ocurre entre mayo y junio (Pineda, 1992). En síntesis durante junio el estuario presentó altas salinidades que favorecieron la presencia y abundancia de los macroinvertebrados.
La riqueza de especies fue mayor en junio y menor en septiembre, y estuvo débilmente influenciada por la salinidad y el porcentaje de arcillas. El modelo de regresión evidenció que hubo mayor riqueza de especies entre mayor salinidad del agua y menor porcentaje de arcillas en el sedimento. Se ha registrado que en los meses de mayor precipitación en la bahía (septiembre-noviembre) se incrementa la entrada de arcillas por erosión y escorrentía (Cantera y Blanco, 2001). En general, los resultados del estudio sugieren que en junio predominaron las condiciones de mayor salinidad en el estuario, en consecuencia se mantuvo rezagada la entrada de agua dulce y se favoreció la entrada de especies marinas, lo que aumentó el número de especies en el estuario.
En este estudio se encontraron tendencias espaciales en la riqueza de macroinvertebrados, siendo mayor en la zona externa de la bahía, caracterizada por condiciones marinas (EE y EM). Este gradiente también se registró en otros estudios en el Pacífico pues a mayor distancia de la desembocadura de los ríos, se empezaron a encontrar especies como cangrejos ermitaños (género Clibanarius) y estrellas de mar (género Luidia) (Norse y Estevez, 1977). En esta zona se encontraron seis especies exclusivas respecto a cuatro de la bahía interna. En la boca de la bahía, correspondiente a las estaciones marinas, se han registrado macroinvertebrados de amplio desplazamiento (Portunidae, Penaeidae, Palaemonidae, Calappidae y Loligunculla) (Cantera y Blanco, 2001), además, se encuentra el plano lodoso donde desemboca el río Anchicayá, en la estación EM. Esta interacción y oferta de microhábitats favorece la riqueza de macroinvertebrados por ser un ecotono entre el mar abierto y el estuario, donde hay presencia de especies marinas, especies del estuario y especies de la desembocadura del río Anchicayá.
CONCLUSIONES
En la bahía de Buenaventura la abundancia relativa de macroinvertebrados epibentónicos fue mayor en salinidades altas, la riqueza de especies fue mayor en aguas de mayor salinidad y en sedimentos con bajo contenido de arcilla, mientras la diversidad de Shannon fue mayor en sedimentos con alto contenido de gravas y aguas de alto pH. Tanto la riqueza como la abundancia de macroinvertebrados fueron mayores en junio y en las estaciones externas, debido a que en esta época y en estas estaciones predominaron las condiciones de mayor salinidad del estuario caracterizadas por sedimentos con poca materia orgánica y el tamaño de grano con tendencias hacia las arenas medias y finas.
AGRADECIMIENTOS
Los autores agradecen a la facultad de Ingeniería y Administración de la Universidad Nacional de Colombia (sede Palmira) y a la Universidad Santiago de Cali por el apoyo económico para la realización de este estudio. De igual manera, al grupo de Ecología y Contaminación Acuática study. (ECONACUA), por todo el apoyo logístico y el apoyo en la salidas de campo. De forma muy especial agradecemos a los coordinadores de los laboratorios de la Universidad Nacional de Colombia sede Palmira. University of Colombia, Palmira.
REFERENCIAS
Allison, P.D. 1991. Logistic regression using the SAS system: theory and application. SAS Institute INC., Cary, North Carolina. [ Links ]
Arizmendi-Rodríguez, D.I., C.A. Salinas-Zavala, C. Quiñonez-Velazquez y A. Mejia-Rebollo. 2012. Abundancia y distribución del calamar dedal, Lolligunculapanamensis (Teuthida: Loliginidae), en el golfo de California. Cienc. Mar., 38(1A): 31-45. [ Links ]
Baltazar, M. 1997. Estudio del contenido estomacal de cuatro especies de langostinos en la costa pacífica colombiana: Penaeus vannamei Boone (1931), Penaeus occidentalis Streets (1871), Penaeus stylirostris Stimpson (1871), Penaeus californiensis Holmes 1890 (Crustacea: Penaeidae). Tesis Pregrado Biología, Universidad del Valle, Cali. 106 p. [ Links ]
Barragán, V.J. 1977. Estudio de la nutrición del calamar del Pacífico colombiano, Lolliguncula panamensis Berry (Cephalopoda: Myopsida). Div. Pesq., 10:1-7 [ Links ]
Bayen, S. 2012. Occurrence, bioavailability and toxic effects of trace metals and organic contaminants in mangrove ecosystems: a review. Environment International, 48: 84-101. [ Links ]
Bengtsson, G. and F. Picado. 2008. Mercury sorption to sediments: Dependence on grain size, dissolved organic carbon, and suspended bacteria. Chemosphere, 73(4): 526-531. [ Links ]
Cantera, J.R., R. Neira y J. Tovar. 1992. Efectos de la polución doméstica sobre la macrofauna bentónica de sustratos blandos en la costa pacífica colombiana. Revista de Ciencias, 7: 21-39. [ Links ]
Cantera, J.R . and J.F. Blanco. 2001. The estuary ecosystem of Buenaventura bay, Colombia. In Coastal Marine Ecosystems of Latin America. Springer Berlin Heidelberg, 265-280 p. [ Links ]
Cardoso, F. y F.G. Hochberg. 2013. Revisión del género Lolliguncula Steenstrup, 1881 (Cephalopoda: Loliginidae) frente a la costa del Pacífico de América del Sur. Rev. Per. Biol., 20(2): 129-136. [ Links ]
Carvajal, A., A. Ruiz, N. López, G. Calle, J. Pachón, N. Gutiérrez y J. Gutiérrez. 2011. Resultados y Análisis Municipal: Buenaventura. Cali, Colombia. http://www.valledelcauca.gov.co/salud/descargar.php?id=6710 01/03/2017. [ Links ]
Carvalho, A.N. and P.T. Santos. 2013. Factors affecting the distribution of epibenthic biodiversity in the Cávado estuary (NW Portugal). Revista da Gestão Costeira Integrada, 13(1): 101-111. [ Links ]
Danovaro, R. 2010. Methods for the study of deep-sea sediments, their functioning and biodiversity. CRC Press. [ Links ]
Dauvin, J.C. 2007. Paradox of estuarine quality: benthic indicators and indices, consensus or debate for the future. Mar. Pollut. Bull., 55(1): 271-281. [ Links ]
FAO. 2009. The state of fisheries and aquaculture. 2008. Food and Agriculture Organization of the United Nations, Rome. 196 p. [ Links ]
Fischer, W., F. Krupp, W. Schneider, C. Sommer y K.E. Carpenter. 1995. Guía FAO para la identificación de especies para los fines de la pesca: Pacífico centro-oriental. Volúmenes 1-3. FAO [ Links ]
Furlan, M., A.L. Castilho, L.C. Fernandes-Goes, V. Fransozo, G. Bertini y R.C. Costa. 2013. Effect of environmental factors on the abundance of decapod crustaceans from soft bottoms off southeastern Brazil. An Acad. Bras. Cienc., 85(4): 1345-1356. [ Links ]
Green, R.H. 1979. Sampling design and statistical methods for environmental biologists. John Wiley and Sons, New York. 24-43. [ Links ]
Halpern, B.S., S. Walbridge, K.A. Selkoe, C.V. Kappel, F. Micheli, C. D'Agrosa and R. Fujita. 2008. A global map of human impact on marine ecosystems. Science, 319(5865): 948-952. [ Links ]
Hernández, J.G. 2015. Asociaciones de poliquetos de fondos blandos en la bahía de Buenaventura, Pacífico colombiano. RIAA, 6(2): 75-84. [ Links ]
Hernández, L. y J.A. Arreola-Lizárraga. 2007. Estructura de tallas y crecimiento de los cangrejos Callinectes arcuatus y C. bellicosus (Decapoda: Portunidae) en la laguna costera Las Guásimas, México. Rev. Biol. Trop., 55(1): 225-233. [ Links ]
Lambert, G.I., S. Jennings, M.J. Kaiser, H. Hinz and J.G. Hiddink. 2011. Quantification and prediction of the impact of fishing on epifaunal communities. Mar. Ecol. Prog. Ser., 430: 71-86. [ Links ]
Lazarus, J.F. y J.R. Cantera. 2007. Crustáceos (Crustacea: Sessilia, Stomatopoda, Isopoda, Amphipoda, Decapoda) de Bahía Málaga, Valle del Cauca (Pacífico colombiano). Biota Colombiana, 8(2): 221-190. [ Links ]
Lemaitre, R. y R. Álvarez-León. 1992. Crustáceos decápodos del Pacífico colombiano: lista de especies y consideraciones zoogeográficas. Bol. Invest. Mar. Cost., 21(1): 33-76. [ Links ]
Lucero-Rincón, C.H., G. Bolívar, R. Neira y E.J. Peña. 2008. Utilización de la macrofauna bentónica como indicadora de calidad ambiental en la desembocadura del río Anchicayá, Pacífico colombiano. Ingeniería de Recursos Naturales y del Ambiente No. 7: 94-101. [ Links ]
Lucero, C.H., J.R. Cantera and I.C. Romero. 2006. Variability of macrobenthic assemblages under abnormal climatic conditions in a small scale tropical estuary. Estuar. Coast. Shelf. Sci., 68(1): 17-26. [ Links ]
Martins, B.A., R.T. Pereira, V. Fransozo , G.M. Teixeira, M. Furlan and A. Fransozo. 2014. Environmental factors modulating the abundance and distribution of Callinectes danae (Decapoda: Portunidae) from two areas of the southeastern coast of Brazil. Biologia, 69(10): 1356-1364. [ Links ]
Murillo, C. 1988. Estomatópodos de la costa pacífica de Colombia e isla Gorgona (Crustacea: Stomatopoda: Squillidae: Gonodactylidae y Pseudosquillidae). An. Inst. Invest. Mar. Punta de Betín, 18: 95-112 p. [ Links ]
Neira, R. y J.R. Cantera . 2005. Composición taxonómica y distribución de las asociaciones de equinodermos en los ecosistemas litorales del Pacífico colombiano. Rev. Biol. Trop., 53(3): 195-206. [ Links ]
Norse, E.A. and M. Estevez. 1977. Studies on portunid crabs from the eastern Pacific. I. Zonation along environmental stress gradients from the coast of Colombia. Mar. Biol., 40(4): 365-373. [ Links ]
Otero, L. 2005. Aplicación de un modelo hidrodinámico bidimensional para describir las corrientes y la propagación de la onda de marea en la bahía de Buenaventura. Bol. Cient. CCCP, 12: 9-21 [ Links ]
Pineda, M. y N. Madrid. 1993. Evaluación de la biología y dinámica poblacional de la jaiba Callinectes arcuatus Ordway en el Pacífico colombiano. Tesis Pregrado Biología. Universidad del Valle. Facultad de Ciencias. 118 p. [ Links ]
Pineda, F. 1992. Biología y dinámica poblacional del camarón de aguas someras Penaeus occidentalis Streets, durante el año 1991, en la costa Pacífica colombiana. En: Memorias del VIII Seminario Nacional de Ciencias del Mar, Santa Marta, Colombia , 782-796 p. SAS, Institute. 2012. [ Links ]
SAS 9.4 for Windows. SAS Institute Inc., Cary, NC, USA. [ Links ]
Sigotn.igac.gov.co/sigotn/pagina.aspx, consultado en 2007. [ Links ]
Valencia, M.J. y N.H. Campos. 1996. Aspectos de la dinámica poblacional de jaibas Callinectes sapidus y C. bocourti de la Ciénaga Grande de Santa Marta, Caribe colombiano (Crustacea: Decapoda: Portunidae). Rev. Acad. Colomb. Cienc., 20(76): 121-129. [ Links ]
Valencia, B., L. Herrera, and A. Giraldo. 2014. Community structure and vertical distribution of the soft bottom macrofauna on Isla Gorgona, Colombian Pacific. Rev. Biol. Trop . 62: 169-188. [ Links ]
Wortham, J.L. 2009. Abundance and distribution of two species of Squilla (Crustacea: Stomatopoda: Squillidae) in the northern Gulf of Mexico. Gulf and Carib. Res. 21(1): 1-12. [ Links ]
Recibido: 24 de Mayo de 2017; Aprobado: 29 de Agosto de 2017











 texto en
texto en