Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.47 no.1 Santa Marta ene./jun. 2018
https://doi.org/10.25268/bimc.invemar.2018.47.1.741
Artículos de Investigación
Variación espacial y temporal de larvas de peces en una bahía hipersalina del Caribe colombiano
1 Universidad del Valle, Facultad de Ciencias Naturales y Exactas, Departamento de Biología, Calle 13 # 100-00, Cali, Colombia. juan.j.gallego@correounivalle.edu.co, alan.giraldo@correounivalle.edu.co. oceanografia@correounivalle.edu.co
Los patrones de distribución espacial y la diversidad de los organismos son resultado de la evolución, la biogeografía y la interacción entro los factores abióticos y bióticos locales que operan a diferentes escalas temporales y espaciales. En este trabajo se especifica la dinámica espacial y temporal del ensamblaje de estadios larvales de peces en bahía Portete y se evalúa la relación entre la variación espacial y temporal de la abundancia y las condiciones oceanográficas locales. El registro de información oceanógrafica y biológica se obtuvo a partir de dos campañas de muestreos realizadas en julio (época seca) y noviembre (época lluviosa) de 2015 para incorporar condiciones climáticas contrastantes de esta localidad. Durante cada campaña de muestreo se siguió una malla de 21 estaciones, distribuidas de manera sistemática en la bahía. Se capturaron 2763 larvas de peces, pertenecientes a 66 especies y 37 familias. La estructura y composición del ensamblaje de larvas, fue significativamente diferente entre los períodos de estudio, así como la riqueza y diversidad de especies, siendo mayor en noviembre (época lluviosa) en comparación con julio (época seca). En términos generales, la abundancia y riqueza de larvas de peces en bahía Portete parecen estar relacionadas con la disponibilidad de alimento (biomasa de zooplancton) y las condiciones de temperatura y salinidad local, siendo probablemente influenciada su variación espacial por el patrón de circulación local.
PALABRAS CLAVE: Bahía Portete; Diversidad; Ensamblaje; Guajira; Ictioplancton
Spatial distribution patterns and the diversity of organisms are the result of evolution, biogeography and the interaction between the local abiotic and biotic factors that operate at different temporal and spatial scales. This paper describes the spatial and temporal dynamics of the assembly of larval stages of fish in Bahía Portete and evaluates the relationship between spatial and temporal variation in abundance and local oceanographic conditions. Oceanographic and biological information was obtained from two sampling campaigns in July (dry season) and November (rainy season) 2015 to incorporate these contrasting climatic conditions. During each sampling campaign a mesh of 21 stations was performed, distributed in a systematic way in the Bay. 2763 larvae of fish, belonging to 37 families and 66 species were captured. The structure and composition of the assembly of larvae was significantly different between the periods of study, as well as the richness and diversity of species, being higher in November (rain season) in comparison with July (dry season). In general terms, the abundance and richness of fish larvae in Bahía Portete seem to be related to the availability of food (zooplankton biomass) and local conditions of temperature and salinity, being it's variation probably influenced by the local circulation pattern.
KEY WORDS: Portete Bay; Diversity; Assembly; Guajira; Ichthyoplankton
INTRODUCCIÓN
Los patrones de distribución espacial y la diversidad de los organismos son el resultado de la evolución, la biogeografía y la interacción entre los factores abióticos y bióticos locales que operan a diferentes escalas temporales y espaciales (Berasategui, 2003). El zooplancton es uno de los factores bióticos de mayor importancia para entender la estructuración de las redes tróficas pelágicas y se puede considerar en un nivel intermedio ya que transfiere la energía de la producción primaria a niveles superiores (González, 1988). Por tanto, la comunidad zooplanctónica se convierte en uno de los factores que representa y determina la productividad de una región, ya que define las rutas de transferencia energética y por ende estaría estrechamente asociado con los niveles de producción secundaria en una localidad (Franke et al., 2005).
La primera fase de desarrollo de los organismos marinos es de gran interés dentro de las investigaciones en oceanografía biológica debido al reabastecimiento de las poblaciones, la conectividad o intercambio de individuos entre las mismas (Cowen et al., 2000, 2006; Lefevre y Bellwood, 2015). Dentro del zooplancton, las larvas y huevos de peces (ictioplancton) han sido de interés permanente para los investigadores. En términos generales, el ictioplancton se constituye en un elemento primordial para comprender la biología, ecología y patrones de distribución de las especies de peces en su estado adulto, además de ser un elemento esencial en los procesos de flujo de energía y estabilidad de los ecosistemas acuáticos (Köster et al., 2001; Frederiksen et al., 2006; Montagnes et al., 2010; Zhou et al., 2011). Sin embargo, a pesar de su importancia existen vacíos en el conocimiento de su taxonomía y ecología en algunas regiones del mundo, como en la zona costera tropical, debido a su complejidad taxonómica (Leis y Thrnski, 1989; Leis, 1991; Neira et al, 1998).
En los ambientes marinos costeros, las variaciones de las condiciones ambientales en diferentes escalas de tiempo pueden modular la distribución y abundancia de larvas de peces (Kingsford, 2001). Durante un ciclo anual, que incorpora diferentes condiciones hidrográficas, la distribución, abundancia y composición de los ensamblajes de peces responderá en esa misma escala, generando variaciones en su composición y abundancia (Leis y McCormick, 2002).
Aunque la magnitud de las fluctuaciones estacionales depende de la distancia del ecuador; variaciones de tipo intra-anual en los patrones climáticos pueden tener un fuerte efecto en las comunidades biológicas presentes en los ambientes marinos tropicales (Longhurst y Pauly, 1987; Alongi, 1990). En términos generales, las variaciones temporales y espaciales de los factores físicos generalmente son las que más contribuyen a las respuestas biológicas de las comunidades marinas. Por ejemplo, fluctuaciones en la circulación, la estabilidad de la columna de agua, la turbidez, la salinidad, el oxígeno, o la temperatura pueden llegar a ser determinantes para la viabilidad de una especie en particular (Blaxter, 1991; Lamber et al., 2003; Perry et al., 2010; Villamizar et al., 2011).
En general, el ictioplancton y las variaciones espacio-temporales que exhibe generan gran curiosidad en el mundo científico por ser un grupo de interés comercial. El primer registro sobre ictioplancton en el Caribe colombiano se remonta a la década de los años 70 del siglo pasado, con el trabajo de Mercado (1970), quien describió la taxonomía de las larvas del sábalo (Megalops atlanticus), especie de importancia comercial, y Ávila de Tabarés (1978), quien realizó la descripción taxonómica del ictioplancton asociado a la Ciénaga Grande de Santa Marta entre enero 1970 y mayo 1972. Posteriormente, el programa INPAVecep (1994-1999) evaluó los recursos pesqueros presentes en la plataforma externa y el talud superior a lo largo del Caribe colombiano hasta la isóbata de 200 m, generando la mayor cantidad de información científica del ictioplancton de la región (Manjarrés et al., 1994, 1997; 1998a, 1998b, 1998c; INPA, 1999; Vergara y Arteaga, 1999; Vergara et al., 1999).
Aunque se han realizado otros estudios sobre ictioplancton en el Caribe colombiano, como los de Escobar y Manjarrés (1987), Rodríguez (1996), Vergara (1997) y Medellín et al. (2013), la información disponible sobre esta fase de desarrollo de la fauna íctica en ambientes costeros de la zona norte del Caribe colombiano es escasa y más aún hacia el sector de la Alta Guajira. En este sector, la bahía de Portete se considera un ambiente hipersalino de alta importancia ecológica (Fajardo, 1979; Cabrera y Donoso, 1993; Gutiérrez-Moreno et al., 2008), en la que han sido registradas 224 especies de peces adultos pertenecientes a 70 familias (Garzón-Ferreira, 1989). Esta localidad, fue declarada como Parque Nacional Natural (PNN) en diciembre de 2014 (MADS, 2014), teniendo como uno de sus objetivos de conservación "contribuir a la generación de servicios ecosistémicos que brindan los ecosistemas marítimos y costeros y sus especies asociadas, favoreciendo la productividad pesquera de la alta Guajira a través de la protección de los espacios de incubación y crianza de juveniles de especies hidrobiológicas".
Considerando la importancia biológica, ecológica y económica relacionada con el conocimiento de la composición taxonómica, abundancia y variación espacio-temporal de los estadios iniciales de desarrollo de los peces, el propósito de este trabajo de investigación fue describir la composición y cuantificar la abundancia del ensamblaje ictioplanctónico en bahía Portete y establecer su relación con las condiciones locales de temperatura, salinidad, clorofila-a, oxígeno disuelto, transparencia y campo instantáneo de circulación superficial. Se tuvieron en consideración los dos periodos climáticos contrastantes que fueron descritos para esta localidad por Guzmán-Alvis et al. (2006), el periodo de vientos o periodo seco entre junio-agosto y el periodo de precipitación entre los meses de septiembre y noviembre.
MATERIALES Y MÉTODOS
Área de estudio
Bahía Portete se encuentra al norte del departamento de La Guajira, Caribe continental colombiano, y está ubicada entre el cabo de la Vela y Punta Gallinas, a 12°07' N-72° 02' W (Figura 1). Cubre una superficie aproximada de 125 km2, con 13 km de diámetro y se comunica con el mar abierto a través de una boca de 2 km de ancho. En términos generales, es una bahía somera, con un ámbito de profundidad entre 3 y 9 m, en donde se encuentran formaciones coralinas sobre los costados sur y occidental, y praderas de pastos marinos y bosques de manglar bordeando el litoral sureste (Garzón, 1989; Solano, 1994; Gutiérrez-Moreno et al., 2008).
Colecta y análisis de muestras
Se recolectaron 84 muestras de zooplancton durante dos campañas de muestreo oceanográfico, la primera realizada en julio de 2015, período de mayor influencia de los vientos y menor precipitación promedio en la zona, y la segunda en noviembre de 2015, período inmediatamente posterior al momento de máxima precipitación en la zona (Guzmán-Alvis et al., 2006). La malla de muestreo estuvo conformada por 21 estaciones, distribuidas de manera sistemática en la bahía, con el propósito de cubrir todos los hábitats submareales y litorales descritos para esta localidad (Fig. 1).
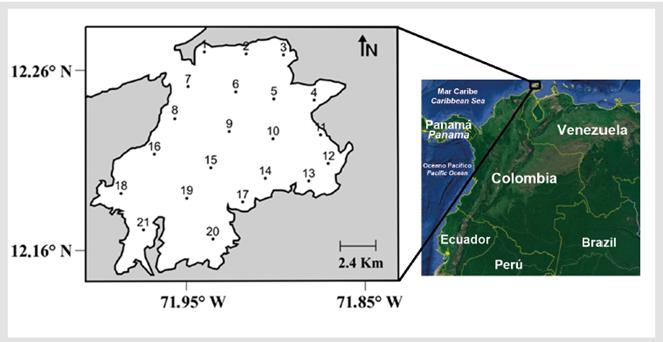
Figura 1 Bahía Portete en la Alta Guajira, Caribe norte colombiano, indicando la ubicación de las 21 estaciones de muestreo durante dos campañas oceanográficas en julio y noviembre de 2015. Imagen Landsat/ Copernicus - Google Earth Pro®. Fecha: 31 marzo 2012, Altura: 20 km, imagen centrada a 12° 12' 56" N -71° 54' 40" O.
En cada estación se efectuaron registros verticales de temperatura y salinidad con un CTD Sea-Bird 19 y se determinó la transparencia del agua con un disco Secchi. Adicionalmente se tomaron muestras discretas de agua a una profundidad de 1 m utilizando una botella Niskin, registrándose la temperatura, pH y oxígeno disuelto a través de una sonda multiparamétrica YSI 85® y la concentración de clorofila-a in-vivo y la turbidez con un fluorómetro portátil AquaFlour® previamente calibrado.
En cada estación se realizó pesca de zooplancton utilizando una red bongo de 30 cm de boca, equipada con mallas de 300 y 500 fim, mediante arrastres superficiales (1 a 10 m) diurnos, circulares, con una duración de 10 min. Se utilizó un flujómetro Hydrobios® adosado a cada boca de la red para cuantificar el volumen de agua filtrada y estandarizar la abundancia por unidad de volumen. Las muestras de zooplancton fueron fijadas en una solución de formalina-agua de mar a una concentración final de 4%, y transportadas al laboratorio de Ecología Animal de la Universidad del Valle (UV) (Cali, Colombia). Posteriormente en el laboratorio, se revisó la totalidad de cada una de las muestras y se separaron, contaron e identificaron hasta el menor nivel taxonómico posible todas las larvas de peces, siguiendo las guías de Beltrán y Herrera (2000) y Richards (2005). Todo el material identificado fue depositado en la colección de referencia de Biología Marina de UV (UNIVALLE: CIR-UV: 0150001 y 0150533).
Para cuantificar la biomasa de zooplancton se utilizó la mitad de la muestra recolectada con la malla de 300 fim concentrada sobre filtros de celulosa previamente pesados. Las muestras se secaron a 60°C por 24 horas y se pesaron en una balanza analítica con precisión de 0.0001 g, determinando la biomasa seca por diferencia de pesos.
Análisis de datos
Se estableció la representatividad del esfuerzo de muestreo a partir de la construcción de curvas de rarefacción para cada período de estudio y se definió la riqueza esperada a partir de los estimadores Chao 2 y Jackknife de segundo orden. Se describió la diversidad y riqueza de los ensambles de larvas de peces utilizando los índices de atributos comunitarios Shannon y Margalef, y se realizó una comparación entre periodos por remuestreo con 1000 repeticiones utilizando la técnica de Bootstrap. Además, se utilizó el método de interpolación "krigging" con el programa computacional Surfer11® para representar la variación espacial de la abundancia de larvas de peces, las condiciones oceanográficas y el campo de circulación superficial instantáneo en el área de estudio para ambos períodos.
La estructura del ensamblaje se describió con base en el índice de similitud de Bray Curtis, definido a partir de la matriz de abundancia de las especies con una frecuencia de aparición igual o superior a 5%. Se realizó una transformación utilizando la función log (x+1) para disminuir el efecto de las especies dominantes en abundancia. Se utilizó el algoritmo de agrupación promedio para construir un dendrograma de similitud, y se utilizó la rutina del perfil de similitud (SIMPROF) para establecer la significación de las agrupaciones. Finalmente, se estableció la contribución de las especies dentro de las agrupaciones generadas en el análisis de similitud mediante la rutina de Porcentajes de Similitud (SIMPER) también en el programa PRIMER v6.0®.
Por último, se evaluó el grado de relación entre la estructura establecida del ensamblaje de larvas de peces y las condiciones oceanográficas del área de estudio utilizando un análisis de correspondencia canónica (ACC) desarrollado con el software estadístico de libre acceso Past v3.0. Esta prueba de asociación multivariada maximiza el grado de correlación entre la abundancia de larvas peces y los parámetros físico-químicos.
RESULTADOS
Composición y estructura del ensamblaje de larvas de peces
Se capturaron 2763 larvas de peces, pertenecientes a 66 especies y 37 familias (Tabla 1). La representatividad del muestreo estuvo entre 91 y 96%. En todas las estaciones de muestreo se recolectaron larvas de peces, durante ambos periodos. La riqueza y diversidad de especies variaron significativamente entre los períodos de estudio, siendo mayor en noviembre que en julio, (riqueza, d: julio = 5.43- noviembre = 9.15, p = 0.001; diversidad, H': julio = 2.64 nats/ind - noviembre = 3.17 nats/ind, p=0.001). Sin embargo, la abundancia de larvas (ind/1000m3) fue significativamente mayor en julio que en noviembre (Mann-Whitney p < 0.005, Figura 2).
Tabla 1 Lista taxonómica del ictioplancton en bahía Portete durante julio y noviembre de 2015. Se indican la abundancia relativa (Ar.) y la frecuencia de captura (FrC.) durante los dos períodos de muestreo y el total en el área de estudio. Se utilizó la información de FishBase® para establecer el hábitat, uso e interés comercial (Frose et al., 2017).
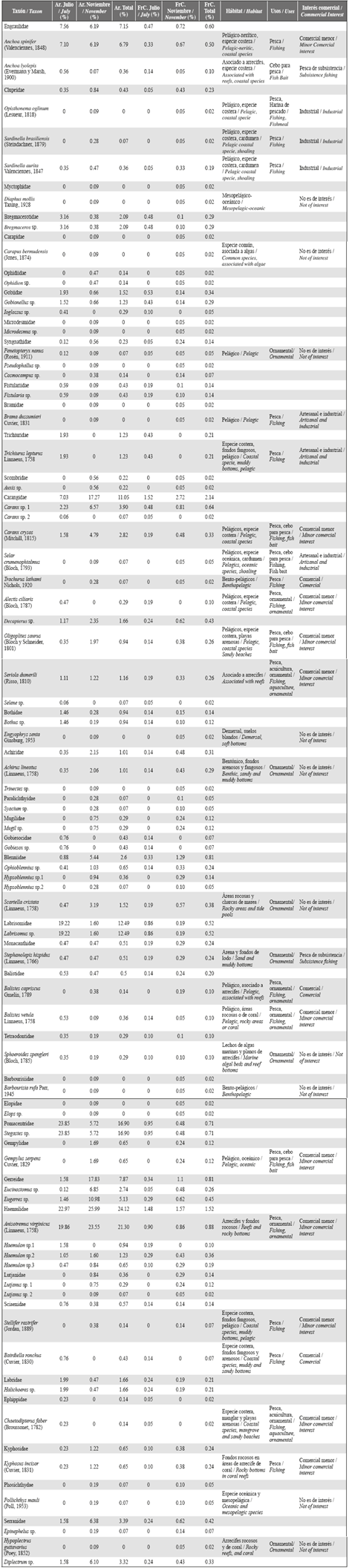
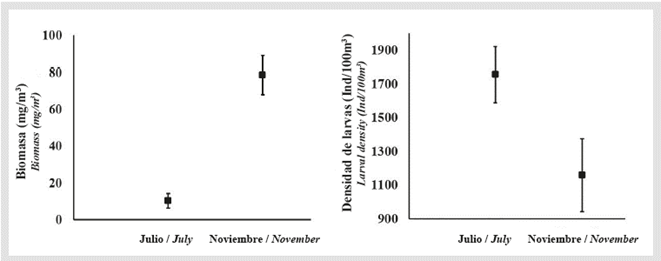
Figura 2 Biomasa de zooplancton y densidad de larvas de peces en la columna de agua sobre el área de estudio en julio y noviembre.
Durante julio las familias con mayor frecuencia de captura fueron Haemulidae, Carangidae y Pomacentridae, mientras que durante noviembre fueron Carangidae, Haemulidae y Blenniidae. En este mismo sentido, las especies con mayor frecuencia de captura durante julio fueron Anisotremus virginicus, Stegastes sp. y Labrisomus sp.; mientras que durante noviembre fueron Anchoa spinifer, Caranx sp.l y A. virginicus.
Considerando ambos períodos de muestreo, las familias más abundantes en bahía Portete fueron Haemulidae (24.3%), Pomacentridae (16.9%) y Labrisomidae (12.5%), siendo las especies más abundantes A. virginicus (2l.3%) y Stegastes sp. (16.9%) (Tabla 1). De las 66 especies identificadas, 38% correspondió a especies de interés para las actividades pesqueras, destacando por su abundancia A. virginicus (21.3%) (Figura 3).
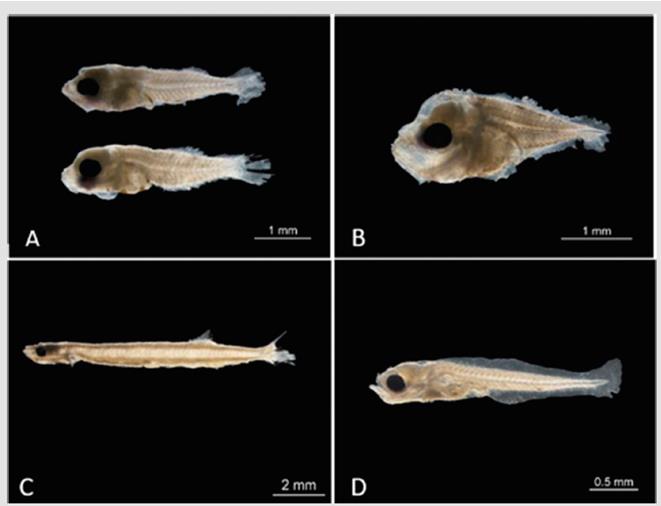
Figura 3 Larvas de peces de especies comerciales más abundantes. A) Anisotremus virginicus, B) Caranx sp. 1, C) Sardinella aurita y D) Trichiurus lepturus.
La familia más diversa fue Carangidae, con un total de 10 especies identificadas, seguida por Haemulidae y Blenniidae con 4 especies cada una. Además, es importante destacar que el mayor número de especies se registró en el mes de noviembre con 57, mientras que durante julio sólo se registraron 37.
Con base en el análisis de similitud entre estaciones y períodos se establecieron cinco grupos significativos (SIMPROF, p < 0.05), con porcentajes de disimilitud entre grupos superiores a 70% (Figura 4). El grupo que incluyó más estaciones (grupo e) estuvo conformado por 18 estaciones de julio, distribuidas en toda el área de estudio con excepción del área suroriental y 9 estaciones de noviembre, ubicadas al sur de la bahía, en donde se encuentran bosques de manglar, bajos de arena y arrecifes rocosos (Figura 4). Este grupo se conformó debido al aporte de Stegastes sp.1, A. virginicus y Labrisomus sp.1 (SIMPER, 57.6% de la similitud).
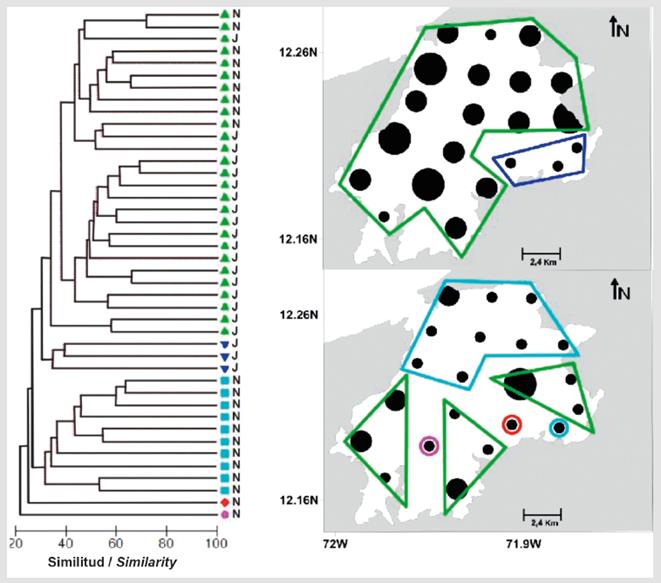
Figura 4 Dendrograma de similitud para el ensamblaje de larvas de peces en bahía Portete y variación espacial de la densidad (ind/100m3) en el área de estudio considerando las dos temporadas de estudio. Se representan las agrupaciones significativas (test Simprof, p<0.05) con líneas negras en el dendrograma y se identifica su ubicación espacial con polígonos de colores correspondientes a cada uno de las cinco agrupaciones identificadas.
Tres estaciones de julio, ubicadas en un sitio con pastos marinos conformaron el grupo c (Figura 4), debido al aporte de Eugerres sp., Caranx sp.1, Eucinostomus sp. y Diplectrum sp. (SIMPER, 76.5% de la similitud). Las estaciones de noviembre ubicadas en las zonas central y norte del área de estudio, en donde predominan bajos rocosos y de arena, conformaron el grupo d (Figura 4), debido al aporte de Eugerres sp., A. virginicus y Stegastes sp. 1 (SIMPER, 38.5% de la similitud).
Por último, los grupos a y b estuvieron compuestos por una sola estación de noviembre cada uno. La número 19 para el primer grupo, cuya mayor abundancia fue de Decapterus sp. y la estación 14 (Figura 4), en la que dominó Caranx crysos. Ambas especies pertenecen a la familia Carangidae que se caracteriza por presentar desove pelágico.
Condiciones ambientales
La transparencia en julio varió entre 0.7 y 3.0 m de profundidad, mientras que para noviembre se encontró entre 0.8 y 3.3 m de profundidad (Tabla 2), siendo menor la transparencia durante los dos períodos de estudio en las estaciones 13 y 14 de la malla de muestreo. La temperatura, salinidad, clorofila-a y pH superficial del mar fueron significativamente menores durante julio (Mann-Whitney, p < 0.001, Tabla 2, Figura 5, Figura 6), mientras que el oxígeno disuelto superficial fue significativamente menor durante noviembre (Mann-Whitney p < 0.001, Tabla 2, Figura 6). Para la clorofila-a no se encontraron diferencias significativas entre julio y noviembre (Mann-Whitney p > 0.005, Figura 5).
Tabla 2 Parámetros físico-químicos registrados en bahía Portete durante julio y noviembre de 2015. n: número de estaciones donde se registraron los parámetros físico-químicos, μ: promedio, D.s.: desviación estándar, Min: valor mínimo registrado y Max: valor máximo registrado
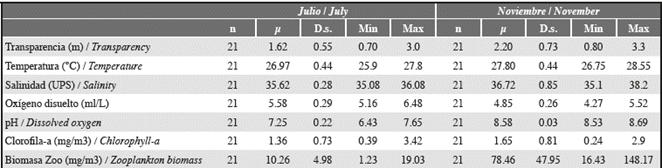
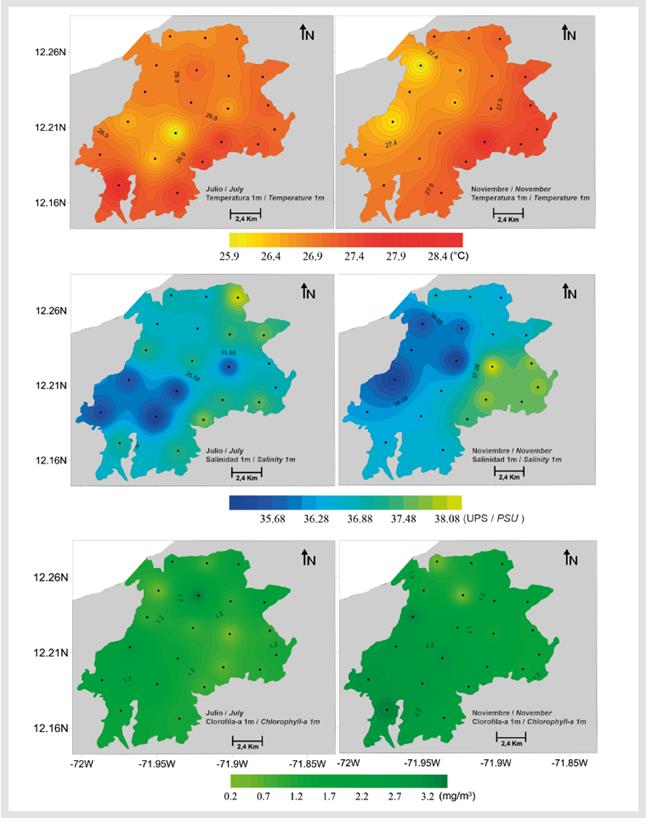
Figura 5 Variabilidad espacial de la temperatura, salinidad y clorofila-a superficial (1 m) en el área de estudio..
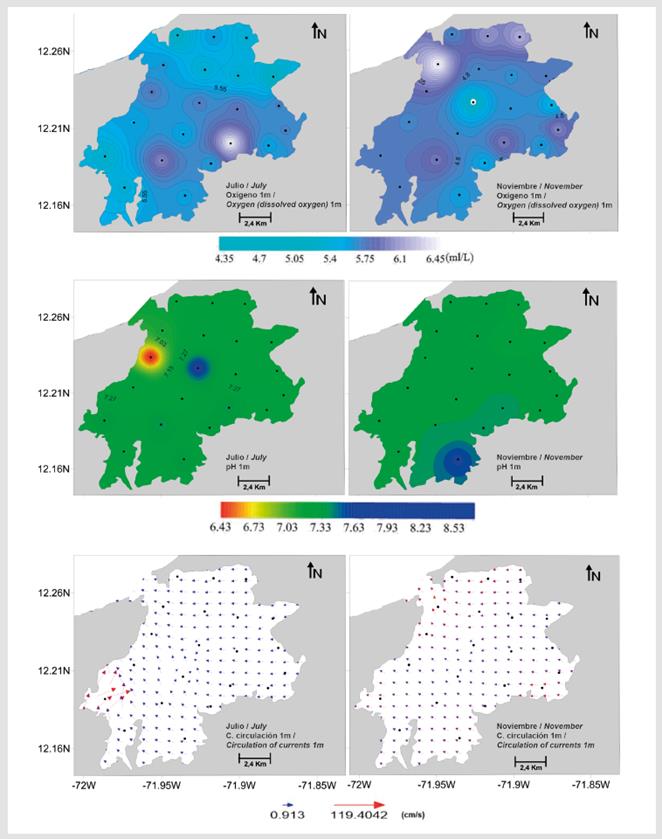
Figura 6 Variabilidad espacial del oxígeno disuelto, pH y el campo de circulación superficial (1 m) instantáneo en el área de estudio.
La velocidad superficial del agua en bahía Portete durante julio estuvo entre 0.1 y 1.1 m/s, con dirección predominante hacia el noroeste (Figura 6). Aunque el patrón general de circulación al interior de Portete se mantuvo durante noviembre definiéndose un eje central de circulación superficial, con dirección hacia la entrada (Figura 6), la velocidad fue significativamente menor, con registros entre 0.05 a 0.3 m/s (Mann-Whitney p < 0.001, Tabla 2). En cuanto a la biomasa zooplanctónica se establecieron diferencias significativas entre los períodos de estudio (Mann-Whitney p < 0.001) siendo un orden de magnitud mayor durante noviembre (julio: 1.2 a 19.0 mg/ m3, noviembre: 16.4 a 148.2 mg/m3) (Tabla 2) (Figura 2).
Relación entre larvas de peces y variables ambientales
Los dos primeros ejes de ordenación del análisis de correspondencia canónica (ACC) explicaron 73.24% de la varianza total del ensamblaje de larvas de peces en bahía Pórtete. La concentración de oxígeno estuvo inversamente relacionada con la temperatura, salinidad, pH, clorofila-a y biomasa zooplanctónica tanto en el eje 1 como en el 2, mientras que la biomasa zooplanctónica estuvo inversamente relacionada con la temperatura, salinidad, pH y clorofila-a en el eje 2 (Figura 7). Además, la abundancia total de larvas de peces estuvo directamente relacionada con la clorofila-a (r = 0.87; p = -0.035) e inversamente relacionada con la biomasa zooplanctónica (r = -0.31; p = 0.046).
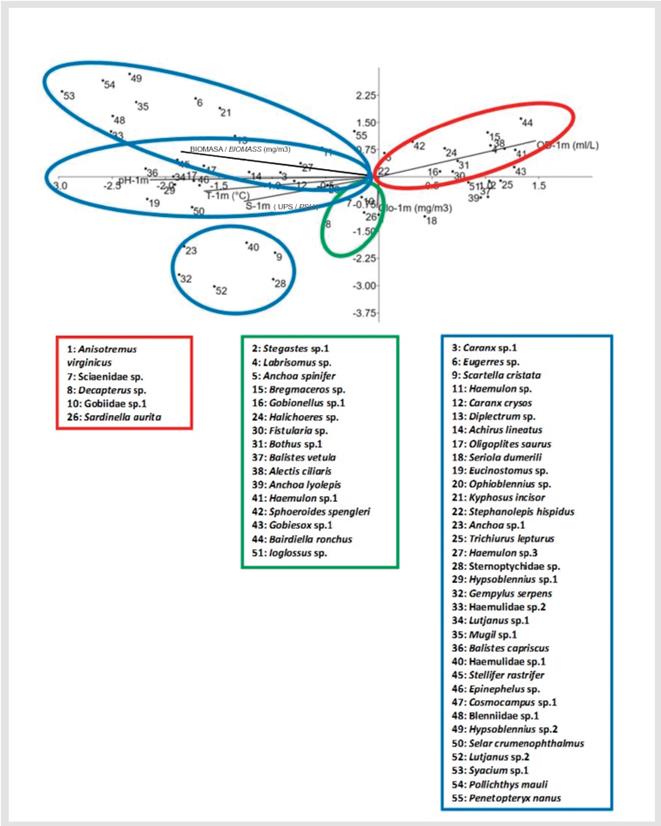
Figura 7 Análisis de correspondencia canónica utilizando la abundancia de las especies encontradas con frecuencia > 5%. Los dos primeros ejes canónicos explican 73.24% de la varianza total.
Labrisomus sp., Anchoa spinifer, Bregmaceros sp., Gobionellus sp., Halichoeres sp., Fistularia sp., Bothus sp.1, Alectis ciliaris, Haemulon sp.1, Sphoeroides spengleri, Gobiesox sp., Bairdiella ronchus, Ioglossus sp., Stegastes sp., Balistes vetula y Anchoa lyolepis estuvieron directamente correlacionadas con la concentración de oxígeno disuelto, mientras que Anisotremus virginicus, Sciaenidae sp., Decapterus sp., Gobiidae sp.1 y Sardinella aurita estuvieron directamente correlacionados con la concentración de clorofila-a. Por último, la mayoría de especies identificadas en los dos periodos de estudio estuvieron directamente correlacionadas con la temperatura, salinidad, pH y biomasa, algunas como por ejemplo Scartella cristata, Caranx crysos, Oligoplites saurus, Haemulon sp.1 y Stellifer rastrifer (Figura 7).
DISCUSIÓN
De acuerdo con Garzón-Ferreira (1989), las familias de peces más diversas en bahía Portete son Haemulidae (12), Sciaenidae (12) y Carangidae (11), siendo las especies con mayor frecuencia de captura Eucinostomus gula, Archosargus rhomboidalis y Diapterus rhombeus. A partir del análisis taxonómico realizado al ictiopancton en la presente investigación, las familias con mayor riqueza de especies fueron Carangidae (10), seguida por Haemulidae (4), siendo las especies con mayor frecuencia de captura Anisotremus virginicus, Caranx sp. 1 y Anchoa spinifer. Aunque los resultados obtenidos en cuanto a las familias más diversas son similares, las especies de peces adultos con mayor frecuencia de captura fueron diferentes a las especies de larvas de peces con mayor frecuencia de captura en Portete.
Es necesario tener en cuenta que el trabajo de Garzón-Ferreira (1989) se realizó con base en el análisis de la captura de peces adultos mediante el uso de un chinchorro de playa y redes agalleras, complementado con censo visual y uso de icticida. Aunque esta es la referencia bibliográfica más completa a la fecha sobre la fauna de peces de bahía Portete, a los especímenes capturados no se les analizó el estado de desarrollo de las gónadas, por lo que su captura no necesariamente signifique que estén utilizando esta localidad para procesos reproductivos, razón por la cual no es viable establecer una relación directa entre los resultados obtenidos por Garzón-Ferreira (1989) y los de la presente investigación.
Al comparar los resultados de estructura y composición del ensamblaje de larvas de peces establecido para bahía Portete en el presente estudio con trabajos similares desarrollados en otros ecosistemas marinos y estuarios someros del mar Caribe y Golfo de México, se encontró que en todos esos estudios las densidades larvales tienden a ser relativamente bajas, predominan larvas pequeñas y se establece una baja riqueza de especies en comparación con el ictioplancton e ictiofauna registrada para los ambientes costeros adyacentes (Houde y Lovdal, 1984; Ditty, 1986; Powell et al, 1989; Vásquez-Yeomans y Richards, 1999).
Estudios previos en la zona costera norte del Caribe colombiano registraron que las familias de larvas de peces más abundantes son Gobiidae, Carangidae, Sciaenidae y Synodontidae, siendo las especies con mayor porcentaje de aparición Eucinostomus sp., Lutjanus synagris y Upeneus parvus (Manjarrés et al., 2005a, 2005b). Esos autores realizaron el trabajo de identificación considerando las larvas capturadas con un ojo de malla de 500 ^m. A diferencia de esos trabajos previos, la descripción de la composición de larvas de peces presentes en bahía Portete se realizó a partir del análisis de las capturas realizadas con malla de 300 y 500 /<m, lo que incrementa de manera sustancial la probabilidad de captura de larvas de un mayor número de familias, estando dominado el ictioplancton de esta localidad por cinco familias de peces (Haemulidae, Carangidae, Engraulidae, Labrisomidae y Pomacentridae) que juntas representaron 72.12 % del total de las larvas de peces identificadas.
Las larvas de A. virginicus, Stegastes sp., Caranx sp. 1 y Labrisomus sp. fueron las dominantes en el área de estudio. Esos peces están ampliamente distribuidos en el mar Caribe y han sido registrados previamente en el Caribe colombiano (Manjarrés et al, 2005a, 2005b). En bahía Portete esas especies fueron encontradas en ambos períodos de estudio, lo que sugiere que su presencia como estadio larval no es estacional. Los haemúlidos son peces tropicales y subtropicales que se localizan en cardúmenes en aguas costeras someras, en áreas de arrecife y pastos marinos (Nelson, 1994). Poco se conoce sobre la temporada reproductiva de esta familia y en particular de A. virginicus, por lo que los resultados obtenidos en la presente investigación se convierten en un punto de partida para profundizar en la comprensión de los períodos reproductivos de esta especie, la cual es de interés comercial para la región (Correa y Manjarrés, 2004; Viloria-Maestre et al, 2016).
A lo largo de las últimas décadas ha sido descrito que los ensamblajes de larvas de peces marinos presentan una alta dinámica espacial y temporal, en donde las variaciones en la composición y abundancia se presentan tanto horizontal como verticalmente en escalas temporales que van desde horas hasta diferencias marcadas por las estaciones anuales (Leis, 1991). En términos generales, esta variabilidad temporal modula el efecto simultáneo de múltiples factores hidrográficos y ambientales que pueden llegar a determinar la supervivencia de las larvas (Robertson, 1991; Leis y McCormick, 2002; Lo et al, 2010; Sánchez et al, 2017). Por lo tanto, en el ambiente pelágico la variación temporal de las condiciones ambientales estaría modulando la distribución, abundancia y, en general, la estructura de los ensamblajes de larvas de peces (Franco et al, 2002; Funes, 2002; Aceves et al, 2003, 2008; Hsieh et al, 2016).
De acuerdo con los resultados obtenidos, los atributos comunitarios de los ensamblajes de larvas de peces en el área de estudio fueron diferentes entre los períodos de estudio, siendo mayor la riqueza y la diversidad durante noviembre en comparación con julio. En la región de la alta Guajira, ha sido descrita una variabilidad climática anual típica consistente en un periodo seco en julio y agosto, caracterizado por fuertes vientos, y una temporada de lluvias intensas de septiembre a noviembre, caracterizada por una menor intensidad del viento (Andrade, 1993; Guzmán-Alvis et al, 2006). Durante el período seco (fuertes vientos) se intensifica un proceso de surgencia costera al frente de bahía Portete, cuyo núcleo se localiza a 100 km de la línea de costa, y que trae como consecuencia un incremento en la productividad primaria en el sistema pelágico costero (Andrade y Barton, 2005; Rueda-Roa y Muller-Karger, 2013), promoviendo condiciones de disponibilidad de alimento adecuadas para que las larvas de peces incrementen su probabilidad de supervivencia (Castonguay et al., 2008; Ottersen et al, 2010; Coelho-Souza et al, 2012).
El patrón de circulación es quizás uno de los factores físicos que más influencia tiene en la distribución espacial de la abundancia de las larvas de peces (Reiss et al., 2000; Feng et al., 2010), dando origen a procesos advectivos o de retención que tienden a incrementar o disminuir la abundancia de las larvas de peces en una localidad (Sánchez-Velasco et al, 2006; Olivar et al., 2010). En bahía Portete, la dirección predominante de la circulación superficial fue hacia el occidente y en dirección hacia la boca de la bahía en ambos períodos de estudio. Esta condición probablemente estaría favoreciendo la movilización superficial interna de larvas de peces en toda la bahía desde el sector oriental de la bahía, en donde se encuentran las zonas de manglar y formaciones coralinas y rocosas submareales. Aunque no se realizaron registros de circulación a agua o cerca del fondo en la boca de la bahía, la tendencia de circulación superficial en dirección hacia la boca de la bahía sugiere que esta localidad estaría aportando larvas de peces para la zona costera aledaña durante todo el año, proceso fundamental para el mantenimiento de los recursos pesqueros de una región (Pineda et al, 2007, Planes et al, 2009, Harrison et al, 2012).
Teniendo en cuenta que las larvas de peces se alimentan principalmente de organismos planctónicos, su supervivencia y crecimiento dependerá en gran medida de la disponibilidad del alimento (Somaraskis et al, 2002). Generalmente, la densidad de larvas de peces se encuentra estrechamente relacionada con la biomasa de zooplancton, coincidiendo con un incremento en la disponibilidad local del alimento (Kaunda-Arara et al, 2009; Sponaugle et al, 2009). Esto coincide con los resultados obtenidos en este estudio, en el cual la mayoría de especies de larvas encontradas en la bahía están directamente correlacionadas con la biomasa del zooplancton.
En términos generales, las fluctuaciones estacionales de la producción larval están fuertemente asociadas a los eventos reproductivos de las especies, los cuales parecen estar sincronizados con los requerimientos de las larvas para incrementar el éxito en el reclutamiento, definiendo el patrón espacial de distribución (Johannes, 1978; Robertson, 1991; Pineda et al, 2010; China y Holzman, 2012). En los sistemas heterogéneos existe una alta diversidad de especies de peces con diferentes requerimientos y patrones de desove, donde algunas especies presentan uno o dos picos de reproducción durante un año y otras se reproducen durante todo el año (Pittman et al., 2004). Con base en esto, en bahía Portete la variabilidad temporal encontrada del ensamblaje puede reflejar los diferentes patrones reproductivos que presentan las especies que como adultos habitan en este sistema. De esta manera, es posible que especies como A. virginicus, que tiene frecuencia de ocurrencia en Portete mayor a 60%, se reproduzca varias veces al año. Por el contrario, aquellos estadios larvales que solo fueron registrados en uno de los períodos de muestreo podrían corresponder a especies con un solo periodo reproductivo anual o que fueron transportadas accidentalmente al área de estudio por procesos advectivos locales (Gray, 1993).
CONCLUSIONES
En bahía Portete, el ensamblaje de larvas de peces estuvo representado por cinco familias abundantes, Haemulidae, Pomacentridae, Labrisomidae, Carangidae y Engraulidae. Además, de las 66 especies identificadas 38% fueron de interés comercial en el Caribe. Es importante destacar que el registro de Anisotremus virginicus en altas abundancias durante los dos períodos de estudio, proporciona un valor de importancia adicional a Portete ya que es una especie de interés para las pesquerías del Caribe colombiano.
Los ensamblajes de larvas de peces en bahía Portete fueron significativamente diferentes entre los períodos de estudio, no solamente en cuanto a la abundancia de las larvas de peces sino también en su riqueza. Esta variación podría ser el resultado del efecto de varios factores, entre los que se destacan el patrón de circulación superficial del agua, la disponibilidad de alimento y los eventos reproductivos de las especies presentes en el área; además, de que la heterogeneidad de hábitats, tales como lo son los pastos marinos, arrecifes rocosos, áreas de manglar y fondos lodosos pueden estar favoreciendo una alta riqueza de especies en esta localidad.
Los resultados de este trabajo incrementan el conocimiento disponible sobre el ensamblaje de larvas de peces presente en el PNN Bahía Portete-Kaurele y fortalecerán la información requerida por los administradores de esta área protegida para incorporar acciones de manejo y conservación. Sin embargo, considerando el alcance temporal abordado no es posible establecer tendencias de variación, lo cual limita la capacidad predictiva del esfuerzo de investigación en relación a las zonas de desove o épocas reproductivas.
AGRADECIMIENTOS
A Marisol Rivera, Isabel Cristina Calle, Andrés Cuellar y Mauricio Jerez por el apoyo durante las campañas de muestreo oceanográfico. A María Claudia Díaz Granados, coordinadora del programa marino de Conservación Internacional Colombia (CIC), por su apoyo incondicional en la gestión administrativa y logística requerida para el desarrollo de esta investigación. Las fotografías de los especímenes fueron realizadas por Juan Felipe Ortega y el primer autor en el laboratorio de imágenes del Departamento de Biología de UV. Este trabajo fue financiado parcialmente por la UV, el programa marino de CIC y Cerrejón Puerto Bolívar en el marco del Convenio Acuerdos de Pesca 2015. La recolección de zooplancton en el PNN Portete-Kaurele estuvo amparada por el permiso individual de recolección de especímenes de especies silvestres de la diversidad biológica con fines de investigación científica no comercial -PIDB DTCA No. 024 15, Resolución 183 de 24 de noviembre de 2015 del Ministerio de Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia.
REFERENCIAS
Aceves, G., S.P Jiménez, A. Hinojosa, R. Funes, R.J. Saldierna, D. Lluch, PE. Smith and W. Watson. 2003. Fish larvae from the Gulf of California. Sci. Mar., 67(1): 1-11. [ Links ]
Aceves, G., R. Saldierna, A. Hinojosa , S.P.A. Jiménez, M.E. Hernández and R. Morales. 2008. Vertical structure of larval fish assemblages during diel cycles in summer and winter in the southern part of Bahía de La Paz, Mexico Estuar. Coast. Shelf. Sci., 76: 889-901. [ Links ]
Alongi, D. 1990. The ecology of tropical soft-bottom benthic ecosystems. Oceanography. Mar. Biol. Ann. Rev., 28:381-496. [ Links ]
Andrade, C.A. 1993. Análisis de la velocidad del viento sobre el mar Caribe. Bol. Cient. CIOH, 13: 33-44. [ Links ]
Andrade, C.A. and D. Barton. 2005. The Guajira upwelling system. Cont. Shelf Res., 25: 1003-1022. [ Links ]
Ávila de Tabarés, G. 1978. Ictioplancton de la Ciénaga Grande de Santa Marta; enero 1970-mayo 1972. Inderena-Div. Pesq., 12(1). [ Links ]
Beltrán B.S. y R. Herrera. 2000. Estadios tempranos de peces del Pacífico colombiano. Ministerio de Agricultura y Desarrollo Rural (INPA), Buenaventura, Colombia. 727 p. [ Links ]
Berasategui, A. 2003. An historical review of the planktonic copepods diversity of the Río de la Plata and the Argentine-Uruguay common fishing zone. Inf. Técn. Proyecto FREPLATA. 22 p. [ Links ]
Blaxter, J.H. 1991. The effect of temperature on larval fishes. Neth. J. Zool., 42(2):336-357. [ Links ]
Cabrera, E. y M.C. Donoso. 1993. Estudio de las características oceanográficas del Caribe colombiano, Región III zona I PDCTM. Bol. Cient. CIOH , 13:19-32. [ Links ]
Castonguay, M., S. Plourde, D. Robert, J.A. Runge and L. Fortier. 2008. Copepod production drives recruitment in a marine fish. Can. J. Fish. Aquat. Sci., 65(8), 1528-1531. [ Links ]
China, V. and R. Holzman. 2014. Hydrodynamic starvation in first-feeding larval fishes. Proc. Natl. Acad. Sci. U.S.A., 111(22): 8083-8088. [ Links ]
Coelho-Souza, S.A., M.S. López, J.R.D. Guimarães, R. Coutinho and R.N. Candella. 2012. Biophysical interactions in the Cabo Frio upwelling system, Southeastern Brazil. Braz. J. Oceanogr., 60(3): 353-365. [ Links ]
Correa, F. y L. Manjarrés. 2004. Recursos de peces demersales explotados por las pesquerías artesanales marítimas de La Guajira, Caribe colombiano: 77-92. En: Manjarrés, L. (Ed.). Pesquerías dermales del área norte del mar Caribe de Colombia y parámetros biológicos pesqueros y poblacionales del recurso pargo. Universidad del Magdalena, Santa Marta. [ Links ]
Cowen, R.K., K.M. Lwiza, S. Sponaugle, C.B. Paris and D.B. Olson. 2000. Connectivity of marine populations: open or closed? Science, 287: 857-859. [ Links ]
Cowen, R.K ., C.B. Paris and A. Srinivasan. 2006. Scaling of connectivity in marine populations. Science, 311: 522-527. [ Links ]
Ditty, J.G. 1986. Ichthyoplankton in neritic waters of the northern Gulf of Mexico off Louisiana: composition, relative abundance, and seasonality. Fish. Bull., 84: 935-946. [ Links ]
Escobar, A. y G. Manjarrés. 1987. Consideraciones generales sobre el ictioplancton de la región de La Guajira, Colombia. Rev. Ing. Pesq., 7(1-2): 8-29. [ Links ]
Fajardo, G.E. 1979. Surgencia costera en las proximidades de la península colombiana de la Guajira. Bol. Cient. CIOH , 2:7-19. [ Links ]
Feng, M., D. Slawinski, L.E. Beckley and J.K. Keesing. 2010. Retention and dispersal of shelf waters influenced by interactions of ocean boundary current and coastal geography. Mar. Freshwater. Res., 61(11): 1259-1267. [ Links ]
Franco, C., E. Godínez and M. Suárez. 2002. Larval fish assemblages in waters off the central Pacific coast México. J. Plankton. Res., 24(8): 775-784. [ Links ]
Franke, K., B. Petrie, J. Choi and W. Leggett. 2005. Tropic cascades in a formerly Cod-dominated ecosystem. Science, 308(5728): 1621-1623. [ Links ]
Frederiksen, M., M. Edwards, A.J. Richardson, N.C. Halliday and S. Wanless. 2006. From plankton to top predators: bottom-up control of a marine food web across four trophic levels. J. Anim. Ecol., 75(6): 1259-1268. [ Links ]
Froese, R. and D. Pauly. (Eds.). 2017. FishBase. World Wide Web electronic publication. www.fishbase.org, version 10/2017. [ Links ]
Funes, R., C. Flores, A. Esquivel, M.A. Fernández and A. Gracia. 2002. Larval fish community structure along the west coast of Baja California during and after the El Niño event (1983). Bull. Mar. Sci., 70(1): 41-54. [ Links ]
Garzón-Ferreira, J. 1989. Contribución al conocimiento de la ictiofauna de la bahía Portete, Departamento de La Guajira, Colombia. Inderena-Trianea, 3:149-172. [ Links ]
González, A. 1988. Plancton de las aguas continentales. Secretaría General, Organización de los Estados Americanos, Programa Regional de Desarrollo Científico y Tecnológico, Washington, D.C. 130 p. [ Links ]
Gray, C.A. 1993. Horizontal and vertical trends in the distribution of larval fishes in coastal waters off central New South Wales Australia. Mar. Biol., 116: 649-666. [ Links ]
Gutiérrez-Moreno, C., D. Alonso y C. Segura-Quintero. 2008. Diseño de un área marina protegida para bahía Portete - La Guajira, Caribe colombiano. Bol. Invest. Mar. Cost., 37(2): 189-212. [ Links ]
Guzmán-Alvis, A.I., P. Lattig and J.A. Ruiz. 2006. Spatial and temporal characterization of soft bottom polychaetes in a shallow tropical bay (Colombian Caribbean). Bol. Invest. Mar. Cost ., 35(1): 19-36. [ Links ]
Harrison, H.B., D.H. Williamson, R.D. Evans, G.R. Almany, S.R. Thorrold, G.R. Russ and M.L. Bemmen. 2012. Larval export from marine reserves and the recruitment benefit for fish and fisheries. Curr. Biol., 22(11), 1023-1028. [ Links ]
Houde, E.D. and J.D.A. Lovdal. 1984. Seasonality of occurrence foods and food preferences of ichthyoplankton in Biscayne Bay, Florida. Estuar. Coast. Shelf Sci, 18: 403-419. [ Links ]
Hsieh, H.Y., W.T. Lo, H.H Chen and P.J. Meng. 2016. Larval fish assemblages and hydrographic characteristics in the coastal waters of southwestern Taiwan during non-and post-typhoon summers. Zool. Stud., 55(18). [ Links ]
INPA. 1999. Boletín estadístico pesquero 1997-1998. Instituto Nacional de Pesca y Acuicultura, Bogotá, 118 p. [ Links ]
Johannes, R.E. 1978. Traditional marine conservation measures in Oceania and their demise. Ann. Rev. Ecol. Syst., 9:349-364. [ Links ]
Kaunda-Arara, B., J.M. Mwaluma, G.A. Locham, V. Oresland and M.K. Osore. 2009. Temporal variability in fish larval supply to Malindi Marine Park, coastal Kenya. Aquat. Conserv. Mar. Freshw. Ecosyst., 19(S1): S10-S18. [ Links ]
Kingsford, M.J. 2001. Diel patterns of abundance of presettlement reef fishes and pelagic larvae on a coral reef. Mar. Biol., 138:853-867. [ Links ]
Köster, F.W., H. Hinrichsen, M.A. St. John, D. Schnack, B.R. MacKenzi, J. Tomkiewicz and M. Plikshs. 2001. Developing Baltic cod recruitment models. II. Incorporation of environmental variability and species interaction. Can. J. Fish. Aq. Sci., 58(8): 1534-1556. [ Links ]
Lambert, Y., N.A. Yaragina, G. Kraus, G. Marteinsdottir and P.J. Wright. 2003. Using environmental and biological indices as proxies for egg and larval production of marine fish. J. Northw. Atl. Fish. Sci, 33(115): 159 p. [ Links ]
Lefevre, C.D. and D.R. Bellwood. 2015. Disturbance and recolonisation by small reef fishes: the role of local movement versus recruitment. Mar. Ecol. Prog. Ser., 537:205-215. [ Links ]
Leis, J.M. 1991. The pelagic stage of reef fishes: the larval biology of coral reef fishes: 183-230. In: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. University of Hawaii. Honolulu. [ Links ]
Leis, J.M. and M.I. McCormick. 2002. The biology, behaviour and ecology of the pelagic, larval stage of coral-reef fishes, p 171-199. In Sale, P.F. (Ed.). Coral reef fishes: New insights into their ecology. Academic Press, San Diego. [ Links ]
Leis, J.M. and T. Trnski. 1989. The larvae of Indo-Pacific shore fishes. University of Hawaii. 371 p. [ Links ]
Lo, W.T., H.Y. Hsieh, L.J. Wu, H.B. Jian, D.C. Liu and W.C. Su. 2010. Comparison of larval fish assemblages between during and after northeasterly monsoon in the waters around Taiwan, western North Pacific. J Plankton Res., 32(7): 1079-1095. [ Links ]
Longhurst, A.R. and D. Pauly. 1987. Ecology of tropical oceans. Academic Press, San Diego . 407 p. [ Links ]
Manjarrés, L., J. Torres, A. Vergara, G. Rodríguez, J. Viaña y J. Correa. 1994. Crucero de evaluación de recursos demersales en el Caribe colombiano VECEP/DEMER/9401. Informe final, INPA, Santa Marta. 52 p. [ Links ]
Manjarrés, L ., J. Torres , G. Rodríguez , A. Vergara , E. Arteaga, J. Viaña , J. Arévalo, R. Galvis, J. Rodríguez, F. Amaya, D. García, J. y G. León. 1997. Crucero de evaluación de peces pelágicos pequeños en el Caribe colombiano. Informe final, INPA, Santa Marta, 34 p. [ Links ]
Manjarrés, L ., J. Torres , G. Rodríguez , A. Vergara , E. Arteaga , J. Viaña , J. Arévalo , R. Galvis , J. Rodríguez , F. Amaya , D. García , J. Páramo y G. León . 1998a. Crucero de evaluación de peces pelágicos pequeños en el Caribe colombiano. Informe final, Instituto Nacional de Pesca y Acuicultura (INPA), Santa Marta, 47 p. [ Links ]
Manjarrés, L ., J. Torres , G. Rodríguez , A. Vergara , E. Arteaga , J. Viaña , J. Arévalo , R. Galvis , J. Rodríguez , F. Amaya , D. García , J. Páramo y G. León . 1998b. Campaña de evaluación de peces pelágicos pequeños en el Caribe colombiano. Informe final, INPA, Santa Marta, 57 p. [ Links ]
Manjarrés, L ., J. Torres , G. Rodríguez , A. Vergara , E. Arteaga , J. Viaña , J. Arévalo , R. Galvis , J. Rodríguez , F. Amaya , D. García, J. y G. León . 1998c. Campaña de evaluación de peces pelágicos pequeños en el Caribe colombiano. Informe final, INPA, Santa Marta, 58 p. [ Links ]
Manjarrés, L ., A. Vergara , J. Torres , G. Rodríguez , E. Arteaga , J. Viaña , J. Arévalo y R. Galvis. 2005a. Evaluación de peces demersales e ictioplancton en el mar Caribe de Colombia, incluyendo condiciones oceanográficas. Parte I: Crucero INPA- ECEP/UE/DEMER/9507. Santa Marta, 51 p. [ Links ]
Manjarrés, L ., G. Rodriguez, J. Torres , A. Vergara , E. Arteaga , J. Arévalo , R. Galvis , D. Rodríguez y J. Viaña . 2005b. Evaluación de peces demersales e ictioplancton en el mar Caribe de Colombia, incluyendo condiciones oceanográficas. Parte II: Crucero INPA-VECEP/UE/DEMER/9507. Santa Marta, 87 p. [ Links ]
Medellín-Mora, J., A. Polanco y G. Navas. 2013. Inventario de larvas de peces registradas para el Caribe colombiano. Bol. Invest. Mar. Cost ., 42(2):233-253. [ Links ]
Mercado, J. 1970. Notas sobre los estados larvales del sábalo, Megalops atlanticus, con comentarios sobre su importancia comercial y deportiva. Trabajo de grado. Universidad Jorge Tadeo Lozano, Cartagena. 32 p. [ Links ]
Ministerio de Ambiente y Desarrollo Sostenible (MADS). 2014. Resolución 2096 de 19 de diciembre de 2014. Por medio de la cual se declara, reserva, delimita y alindera el Parque Nacional Natural Bahía Portete - Kaurele. Ministerios de Ambiente y Desarrollo Sostenible. 30 p. [ Links ]
Montagnes, D.J., J.F. Dower and G.M. Figueiredo. 2010. The protozooplankton-ichthyoplankton trophic link: an overlooked aspect of aquatic food webs. J. Eukaryot. Microbiol., 57(3): 223-228. [ Links ]
Neira, F.J., A.G. Miskiewicz and T. Trnski . 1998. Larvae of temperate Australian fishes. Laboratory guide for larval fish identification. University of Western Australia, Perth. 474 p. [ Links ]
Nelson, J. S. 1994. Fishes of the world. Third ed. John Wiley y Sons, Inc., New York. 600 p. [ Links ]
Olivar, M.P., M. Emelianov, F. Villate, I. Uriarte, F. Maynou, I. Álvarez and E. Morote. 2010. The role of oceanographic conditions and plankton availability in larval fish assemblages off the Catalan coast (NW Mediterranean). Fish. Oceanogr., 19(3): 209-229. [ Links ]
Ottersen, G., S. Kim, G. Huse, J.J. Polovina and N.C. Stenseth. 2010. Major pathways by which climate may force marine fish populations. J. Mar. Syst., 79(3): 343-360. [ Links ]
Perry, R.I., P. Cury, K. Brander, S. Jennings, C. Möllmann and B. Planque. 2010. Sensitivity of marine systems to climate and fishing: concepts, issues and management responses. J. Marine. Syst., 79(3):427-435. [ Links ]
Pineda, J., J.A. Hare and S.U. Sponaugle. 2007. Larval transport and dispersal in the coastal ocean and consequences for population connectivity. Oceanography. 20(3), 22-39. [ Links ]
Pineda, J ., F. Porri, V. Starczak and J. Blythe. 2010. Causes of decoupling between larval supply and settlement and consequences for understanding recruitment and population connectivity. J. Exp. Mar. Biol. Ecol., 392(1), 9-21. [ Links ]
Pittman, S.C., A. McAlpine and K. Pittman. 2004. Linking fish and prawns to their environment: a hierarchical landscape approach. Mar. Ecol. Prog Ser., 283:233 - 254. [ Links ]
Planes, S., G.P. Jones and S.R. Thorrold. 2009. Larval dispersal connects fish populations in a network of marine protected areas. Proc. Natl. Acad. Sci. U.S.A ., 106(14), 5693-5697. [ Links ]
Powell, A.B., D.E. Hoss, W.F. Hettler, D.S. Peters and S. Wagner. 1989. Abundance and distribution of ichthyoplankton in Florida Bay and adjacent waters. Bull. Mar. Sci ., 44: 35-48. [ Links ]
Reiss, C., C. Panteleev, C. Taggart, J. Sheng and B. De Young. 2000. Observations on larval fish transport and retention on the Scotian shelf in relation to geostrophic circulation. Fish. Oceanogr., 9:195-213. [ Links ]
Richards, W. 2005. Early stages of Atlantic fishes: an identification guide for the Western Central North Atlantic. Vol. 1. Taylor y Francis Group, CRC Press, Boca Ratón, USA. 2640 p. [ Links ]
Robertson, R. 1991. The role of adult biology in the timing of spawning of tropical reef fishes. Page 754. In: Sale, P (Ed.). The ecology of fishes on coral reefs. Academic Press, San Diego . [ Links ]
Rodríguez, J. 1996. Abundancia y distribución de larvas de peces demersales en el área suroccidental del Caribe colombiano. Tesis Universidad Jorge Tadeo Lozano, Santa Marta, 110 p. [ Links ]
Rueda-Roa, D.T. and F.E. Muller-Karger. 2013. The southern Caribbean upwelling system: sea surface temperature, wind forcing and chlorophyll concentration patterns. Deep Sea Research Part I: Oceanogr. Res. Pap., 78: 102-114. [ Links ]
Sánchez-Velasco, L., E. Beier, C. Ávalos-García and M.F. Lavín. 2006. Larval fish assemblages and geostrophic circulation in Bahía de La Paz and the surrounding southwestern region of the Gulf of California. J. Plankton. Res ., 28:1081-1098. [ Links ]
Sánchez-Velasco, L ., E. Beier , V.M. Godínez, E.D. Barton , E. Santamaría-del-Ángel, S.P.A. Jiménez-Rosemberg and S.G. Marinone. 2017. Hydrographic and fish larvae distribution during the "Godzilla El Niño 2015-2016" in the northern end of the shallow oxygen minimum zone of the Eastern Tropical Pacific Ocean. J. Geophys. Res-Oceans, 122(3): 2156-2170. [ Links ]
Solano, O. 1994. Corales, formaciones arrecifales y blanqueamiento de 1987 en bahía Portete (Guajira, Colombia). An. Inst. Mar. Punta Betín, 23: 149-163. [ Links ]
Somarakis, S., P. Drakopoulos and V. Filippou. 2002. Distribution and abundance of larval fish in the northern Aegean Sea-eastern Mediterranean-in relation to early summer oceanographic conditions. J. Plankton. Res ., 24(4): 339-358. [ Links ]
Sponaugle, S., J.K. Llopiz, L.N. Havel and T.L. Rankin. 2009. Spatial variation in larval growth and gut fullness in a coral reef fish. Mar. Ecol. Prog. Ser., 383: 239-249. [ Links ]
Vásquez-Yeomans, L. and W.J. Richards. 1999. Variación estacional del ictioplancton de la Bahía de la Ascensión, Reserva de la Biosfera de Sian Ka'an (1990-1994). Rev. Biol. Trop., 47: 201-212. [ Links ]
Vergara, A. 1997. Distribución, abundancia y diversidad de larvas de peces demersales comerciales en la zona nerítica frente al departamento de La Guajira, Caribe colombiano. Tesis M.Sc., Universidad Nacional de Colombia, Santa Marta. 171 p. [ Links ]
Vergara, A. and E. Arteaga . 1999. Abundancia y distribución de larvas de peces de las familias Carangidae, Clupeidae y Engraulidae en el nororiente del litoral Caribe colombiano. INPA Bol. Cient. Supl., 6: 83-95. [ Links ]
Vergara, A ., E. Arteaga and J. Rodríguez. 1999. Composición abundancia y distribución del ictioplancton del Caribe colombiano. INPA Bol. Cient. Supl., 6: 77-83. [ Links ]
Villamizar, N., B. Blanco-Vives, H. Migaud, A. Davie, S. Carboni and F.J. Sánchez-Vázquez. 2011. Effects of light during early larval development of some aquacultured teleosts: a review. Aquaculture, 315(1):86-94. [ Links ]
Viloria-Maestre E., M. Santos-Acevedo, S. Chávez and J.A. Romero. 2016. Pesquería artesanal del margen costero entre Los Cocos (Magdalena) y Punta Gallinas (La Guajira), Caribe colombiano. Serie de Publicaciones Generales del INVEMAR 92, Santa Marta, 60 p. [ Links ]
Zhou, M., Y. Lin, S. Yang, W. Cao and L. Zheng. 2011. Composition and ecological distribution of ichthyoplankton in eastern Beibu Gulf. Acta Oceanol. Sin, 30(1): 94-105. [ Links ]
Recibido: 13 de Julio de 2017; Aprobado: 27 de Febrero de 2018











 texto en
texto en 


