INTRODUCCIÓN
En las zonas costeras la abundancia del fitoplancton está controlada por los cambios naturales y las modificaciones que experimenta el ambiente marino por causas antrópicas (Martínez-López et al., 2001). Esto se debe a que las aguas neríticas están expuestas a la contaminación generada por residuos sólidos y líquidos, provenientes de las actividades comerciales, domésticas, industriales, portuarias, marítimas y turísticas (Pinzón-Bedoya et al., 2007). En este sentido, la actividad humana altera los cambios espaciales y temporales que presenta el fitoplancton debido a factores y procesos naturales que ocurren a escalas temporales que varían de femtosegundos a milenios (Reynolds, 1990; Gallegos y Neale, 2015). Además, en los trópicos, la dinámica del fitoplancton es controlada principalmente por el suministro de nutrientes a las capas superficiales (Lewis, 1992; Lewandoska et al., 2014). Estos ambientes marinos son considerados tradicionalmente como oligotróficos con muy baja variabilidad estacional (Burford et al., 1995). Sin embargo, en las desembocaduras de los ríos (Cloern et al., 2014; Davis et al., 2014) o donde se produce el fenómeno de surgencia costera (Philips y Badylak, 1996) la entrada de nutrientes es alta y las aguas pueden catalogarse como mesotróficas o eutróficas. También puede existir alta variabilidad estacional.
Esta situación se presenta en el golfo de Cariaco (estado Sucre, Venezuela) donde la biomasa y abundancia del fitoplancton pueden aumentar en la época de calma (lluvias) cuando la escorrentía, la descarga de los ríos y el aumento del flujo de las aguas subterráneas juegan un papel importante en la incorporación de nutrientes (Novoa et al., 1998) y durante la época de surgencia costera cuando los vientos alisios propician el ascenso de aguas subsuperficiales ricas en nutrientes (Ferraz-Reyes, 1983; Alvera-Azcárate et al., 2009, 2011). El golfo es un cuerpo de agua influenciado por los vientos alisios del noreste durante la primera parte del año y por la Zona de Convergencia Intertropical (ZCIT) durante la segunda mitad del año (Quintero et al., 2004; López-Monroy y Troccoli-Ghinaglia, 2014). Considerando su alta productividad, se plantea evaluar la variación espacio-temporal en composición, abundancia y diversidad del fitoplancton en el golfo de Cariaco.
MATERIALES Y MÉTODOS
El golfo de Cariaco está ubicado en la región nororiental de Venezuela, entre 10° 36' 00" - 10° 26' 20" N y 64° 13' 40'' - 63° 38' 20" O (Caraballo, 1982a).
Sus características generales han sido descritas en Caraballo (1982a, 1982b). Los muestreos se realizaron mensualmente en la superficie y a 10 m con una botella Niskin (5 L) en siete estaciones (georreferenciadas con un GPS marca Garmin), desde febrero de 2014 hasta enero de 2015 (Figura 1, Tabla 1). Se midió in situ la transparencia del agua con un disco de Secchi (m) y la salinidad (UPS) y temperatura (ºC) con una sonda multiparamétrica (Jenway 970 DO2 Meter). La medición de clorofila a (clor. a) y feopigmentos se realizó según el método de Lorenzen, descrito y mejorado por Parsons et al. (1984). Mientras que la determinación de abundancia microalgal se realizó según el método de sedimentación de Utermöhl descrito por Edler y Elbrächter (2010). La identificación del fitoplancton se hizo según los trabajos de Cupp (1943), Tomas (1997), Berard-Thierrault et al. (1999) y Rivera-Tenenbaum (2006). Las figuras de abundancia fitoplanctónica son presentadas en escala logarítmica (Log10) para una mejor visualización. Los cocolitofóridos Emiliania huxleyi y Gephyrocapsa oceanica se denominaron Emiliania-Gephyrocapsa porque la microscopía óptica no permite la diferenciación de sus cocolitos.
Tabla 1 Ubicación geográfica de las estaciones de muestreo.
| Estaciones de muestreo Sampling stations | Coordenadas geográficas Geographical coordinates |
|---|---|
| Desembocadura del río Manzanares / Manzanares river mouth | 10° 28' 108" N - 64° 11' 954" O |
| Turpialito | 10° 26' 768" N - 64° 02' 065" O |
| Estación 22 / Station 22 | 10° 28' 300" N - 63° 58' 000" O |
| San Antonio | 10° 26' 666" N - 63° 47' 614" O |
| Guacarapo | 10° 29' 525" N - 63° 44' 629" O |
| Ensenada Grande del Obispo | 10° 34' 339" N - 64° 03' 134" O |
| Manicuare | 10° 32' 017" N - 64° 11' 717" O |
Por otro lado, la diversidad de las especies se calculó con el índice de Shannon (Krebbs, 1999). Los datos de velocidad del viento (promedio del día de muestreo y los tres días anteriores) fueron suministrados por la estación meteorológica del aeropuerto Antonio José de Sucre, Cumaná, estado Sucre.
Las épocas oceanográficas fueron establecidas modificando las propuestas por Rivas-Rojas et al. (2007). Las muestras correspondientes a la época surgencia (febrero-mayo) presentaron temperatura ≤ 24 °C, concentraciones de nitrito + nitrato entre 1 y 7.5 µmol L-1 aproximadamente y de fosfato entre 0.5 y 1.2 µmol L-1. Las muestras de la época de transición (junio- agosto) se caracterizaron por valores de temperatura en el intervalo 24 < X ≤ 26 °C, concentraciones de nitrito + nitrato desde 0.5 hasta 4 µmol L-1 aproximadamente y de fosfato de nd a 0.8 µmol L-1. Por último, en la época de calma (septiembre -enero) la temperatura fue ≥ 26 °C, las concentraciones de nitrito + nitrato variaron entre 0.5 - 1 µmol L-1 aproximadamente y las de fosfato de 0.3 a 1 µmol L-1. La época de transición corresponde al periodo en el cual ocurre la surgencia secundaria descrito por Rueda-Roa et al. (2018).
Las diferencias temporales y espaciales de las variables se escrutaron con el análisis de varianza no paramétrico propuesto por Kruskall-Wallis (Boyer et al., 1997) debido a que la distribución de los datos no cumplió con los supuestos de normalidad y homocedasticidad. Las relaciones entre las variables se determinaron con un Análisis de Componentes Principales (ACP) a partir de una matriz de correlación múltiple (Johnson y Wichern, 1992). La relación entre el fitoplancton y resto de las variables para cada época se interpretó con un Análisis de Correspondencia Canónica (ACC; Ter Braak y Verdonschot, 1995). Para establecer diferencias en la estructura de la comunidad del fitoplancton con respecto a las épocas se aplicó un Análisis Escalamiento Multidimensional no paramétrico (nMDS, siglas en inglés; Clarke y Warwick, 2001).
RESULTADOS
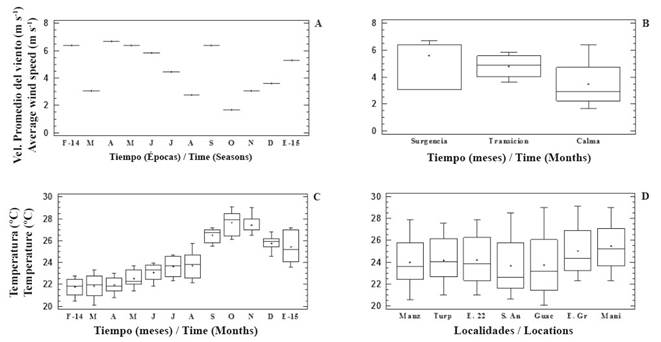
En la Tabla 2 se muestran los estadísticos básicos de las variables medidas en el Golfo de Cariaco desde febrero de 2014 hasta enero de 2015. La velocidad promedio del viento más baja (1.67 m s-1) se detectó en octubre (época de calma) y la más alta (6.67 m s-1) en abril (época de surgencia), ambas en 2014. Se observaron diferencias significativas de esta variable con respecto a los meses y las épocas (KW= 90 y 27.85; p < 0.05; respectivamente. Figura 2Ay B). La temperatura del agua exhibió un comportamiento similar a la velocidad promedio del viento, mostrando diferencias con respecto a los meses y las épocas (KW= 136.41 y 127.66; p < 0.05; respectivamente. Figura 2 C); además, varió significativamente con respecto a la profundidad y las localidades (KW= 8.14 y 13.03; p < 0.05; respectivamente. Figura 2 D; localidades). El valor más bajo de temperatura (20.1 ºC) se midió a 10 m en Guacarapo (marzo de 2014; época de surgencia) y el más alto (29.1 ºC) se midió en la superficie en Ensenada Grande del Obispo (noviembre de 2014; época de calma). El resto de las variables no presentó diferencias significativas con respecto a la profundidad y la localidad (Tabla 3).
Tabla 2 Estadísticos básicos de las variables físicas, químicas y biológicas medidas en el golfo de Cariaco desde febrero de 2014 hasta enero de 2015. N: tamaño de la muestra; S: desviación estándar; H´: diversidad de Shannon-Wiener. La velocidad promedio del viento representa el promedio del día de muestreo y los tres días anteriores.
| Variables | N | Promedio Average | S | Mín | Máx |
|---|---|---|---|---|---|
| Velocidad promedio del viento (m s-1) Average wind speed | 12 | 5.851 | 1.718 | 3.34 | 9.17 |
| Transparencia (m) Transparency | 81 | 7.226 | 3.494 | 1.50 | 19.50 |
| Salinidad (UPS) Salinity | 165 | 36.316 | 2.698 | 11.00 | 38.86 |
| Temperatura del agua (°C) Water temperature | 166 | 24.300 | 2.285 | 20.06 | 29.10 |
| Conc. O disuelto (mg L-1) 2 Dissolved O Conc. (mg L-1) 2 | 116 | 4.342 | 2.357 | 0.85 | 12.83 |
| Conc. clor. a (mg m-3) Chlor. a conc. (mg m-3) | 158 | 2.934 | 3.020 | nd | 17.52 |
| Feopigmentos (mg m-3) Feopigments (mg m-3) | 156 | 0.789 | 0.705 | nd | 4.64 |
| Abund. total (org mL-1) Total abund. (org mL-1) | 166 | 242 | 272 | 24 | 1847 |
| H´(bits ind-1) H´(bits ind-1) | 166 | 2.116 | 0.764 | 0.38 | 3.74 |
| Equidad Equity | 166 | 0.615 | 0.175 | 0.13 | 0.99 |
Tabla 3 Variables que no mostraron diferencias espaciales significativas (p > 0.05).
| Variable Variable | Factor Factor | Valor del análisis (KW) Analysis value (KW) |
|---|---|---|
| Concentración de clorofila a | Profundidad / Depth | 0.66 |
| Chlorophyll a concentration | Localidades / Locations | 11.63 |
| Abundancia fitoplanctónica | Profundidad / Depth | 0.64 |
| Phytoplankton abundance | Localidades / Locations | 4.49 |
| Diversidad | Profundidad / Depth | 0.40 |
| Diversity | Localidades / Locations | 0.11 |
Con relación a la concentración de clorofila a, el valor más bajo se halló (nd) en Turpialito (superficie) y Manicuare (10 m) en diciembre y en la desembocadura del río Manzanares (superficie), en San Antonio (10 m) y Ensenada Grande (superficie) en enero de 2015; mientras que el más alto (17.52 mg m-3) se obtuvo en San Antonio (10 m) en marzo (época de surgencia). Este valor máximo coincidió con una floración de Guinardia striata. Esta variable presentó diferencias significativas con respecto a los meses y las épocas (KW= 68.78 y 46.35; p < 0.05; respectivamente. Figuras 3 A y B), pero no varió con respecto a la profundidad ni localidades.
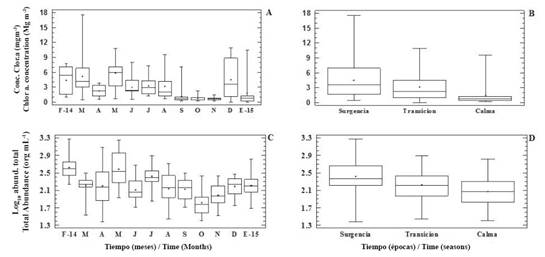
Figura 3 Distribución temporal de la concentración de clor. a (mg m-3; A y B) y la abundancia total (org mL-1; C y D) en el golfo de Cariaco, febrero 2014 - enero 2015.
La abundancia fitoplanctónica mostró un comportamiento similar a la concentración de clorofila, variando significativamente con respecto a los meses y épocas (KW= 59.23 y 26.46; p < 0.05; respectivamente. Figuras 3 C y D), pero no con respecto a las localidades ni profundidades. El intervalo de valores de abundancia fue 0.2 - 1.8 x 103 org mL-1. El valor más bajo se detectó a 10 m en San Antonio (abril de 2014) y el más alto en la superficie de la desembocadura del río Manzanares (febrero de 2014), ambos valores durante la época de surgencia.
La abundancia relativa de los grupos funcionales presentó el siguiente orden de importancia: diatomeas > nanoflagelados > cocolitofóridos > dinoflagelados > cianobacterias > “otros” (Figura 4 A). Las diatomeas (42% de los individuos) y los nanoflagelados (35% de los individuos) dominaron alternadamente. Los nanoflagelados dominaron la comunidad desde febrero hasta abril de 2014 y fueron sustituidos por las diatomeas entre mayo y julio del mismo año. Seguidamente los nanoflagelados volvieron a dominar desde agosto hasta noviembre y de nuevo fueron sustituidos por las diatomeas al final del estudio. Los cocolitofóridos representaron una importante fracción del total de organismos y ocuparon el segundo lugar en cuanto a abundancia en marzo, junio y septiembre de 2014 (32% a 24%) y en enero de 2015 (30%). Por otro lado, las cianobacterias y “otros” presentaron la menor abundancia y no mostraban una clara tendencia, por lo que se combinaron en el grupo denominado “Otros”.
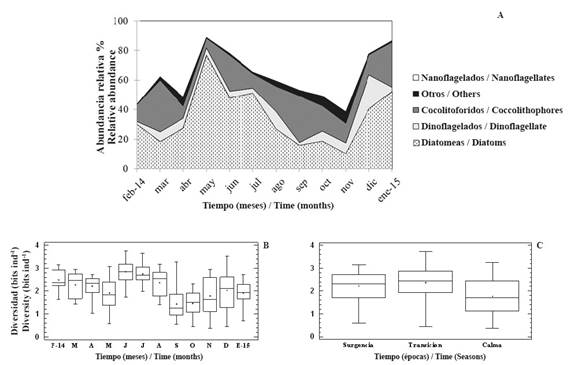
Figura 4 Distribución temporal de la abundancia relativa (%, A) y de la diversidad (bits ind-1; B y C) del fitoplancton en el golfo de Cariaco, febrero 2014 - enero 2015.
Se identificaron 249 especies, de las cuales 120 fueron diatomeas, 90 dinoflagelados, 13 cocolitofóridos, 6 cianobacterias y 20 “otros”. De los taxones identificados, 23 formaron parte de las especies residentes (Tabla 4).
Tabla. 4 Lista de especies residentes (presentes en más de 20% de las muestras) en el golfo de Cariaco, febrero 2014 - enero 2015. F.A: frecuencia de aparición. Ab: abundancia.
| Especies residents Resident species | F.A (%) OF (%) | Ab. (org ml-1) Ab. (org ml-1) |
|---|---|---|
| Diatomeas / Diatoms | ||
| Cylindrotheca closterium Ehrenberg | 47 | 279 |
| Chaetoceros sp. | 27 | 446 |
| Guinardia striata (Stolterfoth) Hasle | 25 | 4351 |
| Leptocylindrus danicus Cleve | 23 | 1483 |
| Navicula sp. | 30 | 107 |
| Nitzschia longissima (Brébisson) Ralfs | 53 | 348 |
| Pleurosigma sp. | 27 | 54 |
| Pseudo-nitzschia lineola (Cleve) Hasle | 25 | 494 |
| Pseudo-nitzschia pungens (Grunow ex Cleve) Hasle | 30 | 616 |
| Rhizosolenia imbricata Brightwell | 24 | 126 |
| Thalassionema nitzschioides (Grunow) Mereschkowsky | 45 | 1079 |
| Thalassiosira sp. | 54 | 550 |
| Dinoflagelados / Dinoflagellates | ||
| Ceratium gibberum Gourret | 22 | 45 |
| Dinophysis acuminata Claparède y Lachmann | 22 | 53 |
| Dinophysis caudata Saville-Kent | 22 | 26 |
| Gymnodinium sp. | 28 | 174 |
| Prorocentrum gracile Schütt | 28 | 41 |
| Prorocentrum micans Ehrenberg | 33 | 79 |
| Scrippsiella trochoidea (Ehrenberg) Kretschmann | 37 | 491 |
| Scrippsiella sp. | 34 | 270 |
| Tripos furca (Ehrenberg) Gómez | 28 | 105 |
| Cocolitofóridos / Coccolithophores | ||
| Calciosolenia murrayi Gran | 38 | 1156 |
| Emiliania-Gephyrocapsa | 72 | 4310 |
Las especies que dominaron la comunidad fueron: las diatomeas Cylindrotheca closterium, Nitzschia longissima, Thalassionema nitzschioides y Thalassiosira sp.; los dinoflagelados Prorocentrum micans y Scrippsiella trochoidea; y los cocolitofóridos Calciosolenia murrayi y Emiliania-Gephyrocapsa.
Por otro lado, la diversidad fluctuó entre 0.38 bits ind-1 (en la superficie de Turpialito en noviembre de 2014, época de calma) y 3.74 bits ind-1 (en la superficie de Manicuare en junio de 2014, época de transición). Esta variable presentó diferencias significativas con respecto a los meses y las épocas (KW= 54.38 y 40.45; p < 0.05; Figura 4B y C, respectivamente), pero no varió con respecto a las localidades ni las profundidades.
La varianza acumulada de valores de las variables en los primeros tres componentes del ACP durante la época de surgencia fue 72% del total (Tabla 5). En el primer componente se demostró la existencia de una correlación positiva entre la velocidad promedio del viento, la temperatura, la abundancia de diatomeas, la abundancia de cocolitofóridos y la abundancia total; estas variables se correlacionaron de manera negativa con la concentración de clor. a (Fig. 5 A). Así mismo, el ACC de esa época evidenció que la velocidad promedio del viento fue una de las variables que tuvo mayor incidencia sobre la estructura comunitaria (Fig. 5 B); le siguen, en orden de importancia, la temperatura y la concentración de clor. a. A estas variables se asoció la presencia de las diatomeas G. striata y Th. nitzschiodes y el dinoflagelado Tripos furca.
Tabla 5 Porcentajes de varianza total explicada por los tres primeros componentes del Análisis de Componentes Principales (ACP) aplicados a las variables medidas en el golfo de Cariaco, febrero 2014 - enero 2015.
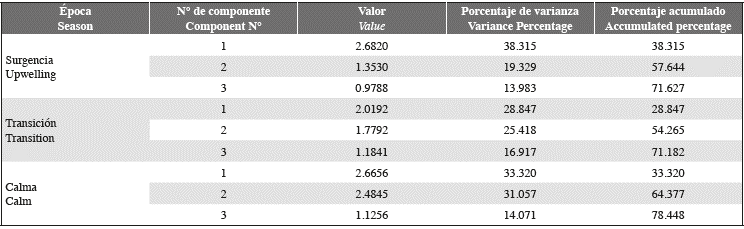

Figura 5 Proyección ortogonal de algunas variables estudiadas definida por los primeros dos componentes del ACP (A) y entre estas variables y los organismos más abundantes y frecuentes del ACC (B) para la época de surgencia.
En cambio, durante la época de transición (junio- agosto de 2014), se determinó que la varianza acumulada de valores de las variables en los primeros tres componentes del ACP fue 71% del total (Tabla 5). En el primer componente, se presentó una correlación positiva entre la concentración de clor. a, la abundancia de diatomeas, cocolitofóridos y total (Figura 6 A). Mientras que en el segundo componente se observó una correlación positiva entre la velocidad promedio del viento y la diversidad. Estas variables se correlacionaron de manera negativa con la temperatura. En la época de transición, la concentración de clor. a y la temperatura se asociaron positivamente a la abundancia del cocolitóforido C. murrayii y los dinoflagelados P. gracile y T. fusus en el componente 1 (Figura 6 B). La velocidad promedio del viento se asoció de forma negativa con la variable y las especies mencionadas anteriormente.
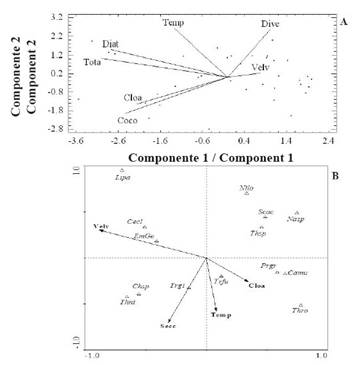
Figura 6 Proyección ortogonal de algunas variables estudiadas definida por los primeros dos componentes del ACP (A) y entre estas variables y los organismos más abundantes y frecuentes del ACC (B) para la época de transición.
Finalmente, se determinó que la varianza acumulada de valores de las variables en los primeros tres componentes del ACP durante la época de calma (septiembre de 2014-enero de 2015) fue 78% del total (Tabla 5). En esta época se identificó una correlación positiva entre temperatura, concentración de clorofila a, abundancia de dinoflagelados y diversidad. Estas variables se correlacionaron de forma negativa con la abundancia de diatomeas, cocolitofóridos, nanoflagelados y total (Figura 7 A). Así mismo, el ACC evidenció que la diversidad fue la variable que más identificó a la estructura comunitaria, seguida de la temperatura y la velocidad promedio del viento (Figura 7 B). Las diatomeas C. closterium, P. lineola, Thalassiosira sp. y los dinoflagelados P. micans y S. trochoidea se asociaron fuertemente con la diversidad en el primer componente. Por otra parte, la presencia del cocolitofórido Emiliania-Gephyrocapsa y el dinoflagelado P. gracile se asociaron con mayor fuerza con la temperatura y la transparencia.
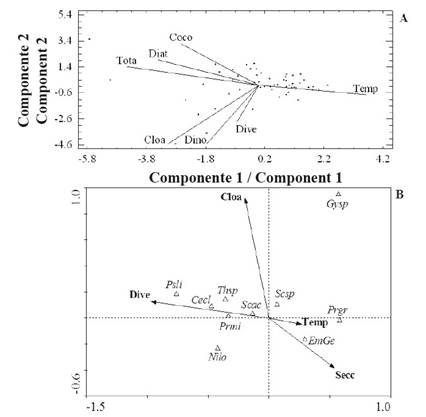
Figura 7 Proyección ortogonal de algunas variables estudiadas definida por los primeros dos componentes del ACP (A) y entre estas variables y los organismos más abundantes y frecuentes del ACC (B) para la época de calma.
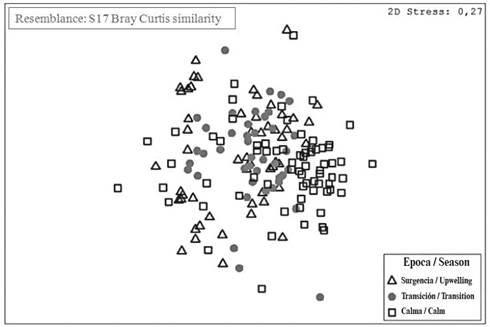
A pesar de que el MDS-ANOSIM detectó diferencias significativas entre las épocas (R = 0.216; p < 0.05), no se observó una clara separación entre ellas (Tabla 6; Figura 8). Este resultado obedeció al hecho de que los resultados de la época de transición forman un subconjunto de las épocas de surgencia y la calma.
Tabla 6 Resumen del Análisis de Similaridad (ANOSIM) aplicado a los datos multivariados, empleando como factor las épocas en el golfo de Cariaco, entre febrero 2014 y enero 2015.
| Grupos Groups | Estadístico R Statistic R | Nivel de significancia Significance level | Permutaciones Permutations | Numero >= observado Observed number ≥ |
|---|---|---|---|---|
| Surgencia - Transición Upwelling - Transition | 0.109 | < 0.05 | 999 | 0 |
| Surgencia - Calma Upwelling - Calm | 0.282 | < 0.05 | 999 | 0 |
| Transición - Calma Transition - Calm | 0.217 | < 0.05 | 999 | 0 |
DISCUSIÓN
A pesar de que los registros de los datos hidrográficos y del fitoplancton en la época de transición formaron un subconjunto de las mediciones realizadas en las épocas de surgencia y calma, la distribución de los datos evidenció la existencia de estacionalidad. Esto quedó comprobado por: las diferencias entre la relación de las variables expresadas por el ACP, lo que ocasionó cambios en la estructura comunitaria; y la diferencia entre épocas mostrada por el ACC, el cual demostró diferencias en la relación entre las variables y las especies dominantes en cada época.
Durante la época de surgencia se presentó la mayor celeridad del viento, menor temperatura y mayor abundancia fitoplanctónica. Estas características han sido señaladas por autores como Alvera-Azcárate et al. (2009, 2011), Jury (2017) y Rueda-Roa et al. (2018) como típicas de los primeros meses del año cuando los vientos alisios actúan con mayor intensidad y se produce la surgencia costera.
La concentración de los pigmentos y los valores de abundancia fitoplanctónica medidos en este estudio se encuentran dentro del intervalo informado para el área como típicos de esta época (0.01 - 43.06 mg clor. a. m-3 y 0.02 - 2.32 x 103 org mL-1; Ferraz-Reyes, 1983 y Rivas-Rojas et al., 2007; La Barbera-Sánchez et al., 1999 y Pirela-Ochoa et al., 2008). Sin embargo, la composición fitoplanctónica no coincide con lo registrado por Ferraz-Reyes (1976), Gómez-Carvajal et al. (2000), Rivas-Rojas et al. (2007) y Pirela-Ochoa et al. (2008), quienes mencionan que las diatomeas dominaron de forma exclusiva la comunidad durante la época de surgencia. Además, estos autores establecieron que los cocolitofóridos eran miembros ocasionales de la comunidad. Sin embargo, en este estudio se determinó que los cocolitofóridos C. murrayi y el complejo Emiliania-Gephyrocapsa formaron parte de los organismos dominantes.
El cambio en la conformación del grupo dominante durante la época de surgencia de diatomeas a diatomeas/ cocolitofóridos concuerda con lo indicado por Taylor et al. (2012) para la estación de serie de tiempo CARIACO, ubicada a unos 50 km al este del golfo de Cariaco. Los autores establecieron que en esta época durante el período 1996 - 2004 las diatomeas superaron en número al resto de los grupos, mientras que a partir de 2004, las diatomeas y los cocolitofóridos fueron codominantes y exhibieron números similares.
Astor et al. (2013) cuantificaron una fluctuación del pH de 8.113 a 8.014 en CARIACO durante el período 1996 - 2008. A pesar de que los autores informaron que el pH tendió a disminuir durante ese período, se considera que el cambio de pH (0.099 unidades) es muy reducido para explicar la dominancia compartida entre diatomeas y cocolitofóridos durante la época de surgencia. En este sentido, Beaufort et al. (2011) señalaron que la respuesta de los cocolitofóridos ante el aumento de la presión parcial de CO2 en aguas de surgencia chilenas es contradictoria. La reducción de hasta 0.4 unidades de pH resultó en la sustitución de especímenes de Emiliania huxleyi ligeramente calcificados por otros altamente calcificados. Además, Alvites Gutiérrez (2016) indicó que en aguas peruanas el grado de calcificación y distribución de cocolitofóridos está relacionado con la intensidad del afloramiento costero y la distribución de las masas de agua que modifican factores claves como la temperatura, pH, oxígeno y nutrientes. Según la autora, la abundancia de los cocolitofóridos se incrementó hacia las estaciones intermedias y oceánicas donde el pH alcanzó valores más alcalinos, la columna de agua presentó una mayor estratificación y aguas más cálidas y se incrementaron los valores de N/P.
Ante lo anteriormente expuesto, se concuerda con Taylor et al. (2012) y se atribuye el cambio de la estructura comunitaria del fitoplancton durante la época de surgencia al calentamiento de las aguas superficiales y al debilitamiento de la intensidad de esta. Estas condiciones resultan en una disminución del suministro de nutrientes a la capa eufótica impactando negativamente el crecimiento de las diatomeas. La presencia de aguas turbulentas con un contenido menor de nutrientes favorecería el aumento de la abundancia de los cocolitofóridos a expensas de las anteriores. Para demostrar esto es necesario realizar una investigación que comprare las concentraciones actuales de nutrientes con las realizadas en las décadas de los años 70 y 80 del siglo pasado.
Además, se ha sugerido que el drenaje continental durante la época de lluvias tiene un impacto significativo sobre la entrada del sílice necesario para el crecimiento de las diatomeas durante la época de surgencia (Elguezabal Méndez, M. A. Universidad de Oriente. Cumaná, Venezuela. 2003. Com. Pers.). Por lo cual es necesario investigar la relación existente entre la precipitación y la presencia de las diatomeas. La región nororiental de Venezuela es semiárida y el drenaje terrestre podría representar un aporte de sílice significativo al sistema. Tal información podría evidenciar otro impacto del calentamiento global en la región.
Aun cuando los dinoflagelados contribuyeron en menor grado a la composición fitoplanctónica del golfo durante la época de surgencia, P. micans y S. trochoidea formaron parte de las especies más abundantes al final de dicho periodo. Al respecto, Ferraz-Reyes et al. (1987) señalaron que varias especies de dinoflagelados pueden ser abundantes en el golfo de Cariaco durante la época de surgencia.
La correlación positiva observada entre la velocidad promedio del viento, la temperatura, la abundancia de diatomeas, de cocolitofóridos y la abundancia total no sólo constató que ambos grupos de microalgas fueron los que más contribuyeron numéricamente sino también que ambos fueron favorecidos por la presencia de aguas subsuperficiales de menor temperatura y turbulentas, como lo mencionaron Rivas- Rojas et al. (2007). Por otro lado, la asociación negativa de estas variables con respecto a la clor. a, sugiere que el aumento en la concentración de clorofila fue la respuesta al ingreso de una mayor cantidad de nutrientes causado principalmente por la surgencia (Shang et al., 2004; Goschen et al., 2015).
El hecho de que la velocidad del viento fuera una de las variables más influyente sobre la comunidad fitoplanctónica se debió al efecto de profundización de la capa mezcla. Esto controla la entrada de nutrientes a la columna de agua y la permanencia del fitoplancton en la capa iluminada, entre otros aspectos (Raymont, 2014; Zhang et al., 2016). La asociación detectada entre la diatomea G. striata y la concentración de clor. a sugiere que esta diatomea, cuya abundancia total durante esta época alcanzó un valor alto, fue la que aportó la mayor cantidad de la clor. a.
En la época de transición, la velocidad promedio del viento disminuyó progresivamente y la temperatura aumentó. Este comportamiento ha sido descrito por diversos investigadores (Gómez-Carvajal et al., 2000; Quintero et al., 2004; Rueda-Roa et al., 2018) quienes, a pesar de no señalar la existencia de un periodo de transición, sí afirman que esta tendencia es típica durante la segunda mitad del año en el nororiente del país. Los valores de clor. a medidos en este periodo están dentro del intervalo (nd -17.34 mg clor. a. m-3, Rivas-Rojas et al., 2007; Soto et al., 2015) registrado para esta época, mostrando el mismo patrón que las variables antes descritas.
También, la abundancia fitoplanctónica está dentro del intervalo (0.05 - 3.27 x 103 org.mL-1) descrito para la época por Rivas-Rojas et al. (2007) y Calvo-Trujillo et al. (2015). La comunidad estuvo integrada principalmente por diatomeas, nanoflagelados y cocolitofóridos. Esta composición es similar a la descrita para la época anterior, lo que sugiere que aun durante el periodo de transición, la intensidad del viento fue suficiente para mantener a las diatomeas en la columna de agua. Esto es corroborado por la inclusión de diatomeas como N. longissima y Th. nitzschiodes dentro de las especies dominantes. Gómez-Carvajal et al. (2000), Rivas-Rojas et al. (2007) y Pirela-Ochoa et al. (2008) establecieron que estas diatomeas formaron parte del grupo funcional dominante a lo largo del año en playa San Luís y en la isla de Cubagua. Esta diferencia en el rol de N. longissima y Th. nitzschiodes podría indicar un cambio en las condiciones ambientales imperantes en el nororiente de Venezuela en la última década. Tal cambio sólo podría ser confirmado con la fijación de una estación de series de tiempo en el golfo.
La diversidad, no sólo presentó los máximos valores del estudio durante esta época sino que además estos valores fueron superiores al establecido por Margalef (1972) para aguas neríticas y a los intervalos informados en el archipiélago Los Roques y playa San Luis (Sánchez-Suárez, 1994 y Rivas- Rojas et al., 2007, respectivamente). La disminución en la velocidad del viento permite la coexistencia de especies que proliferan en aguas turbulentas con especies que proliferan en aguas estratificadas y por eso la diversidad fue mayor. Esto fue corroborado por el ACP aplicado a la época en cuestión.
Por otro lado, el ACC demostró que aun cuando la velocidad promedio del viento no influyó directamente sobre la comunidad, la turbulencia que esta generó fue suficiente para mantener una columna de agua bien mezclada. Asimismo, el hecho de que los dinoflagelados P. gracile y T. furca se asociaran fuertemente a la concentración de clor. a, sugiere que la capacidad locomotora de estas especies permitió una mayor permanencia en la zona iluminada para su crecimiento (Balech, 1977; Harrison et al., 2015).
Finalmente, durante la época de calma las variables ambientales exhibieron un comportamiento típico para el nororiente venezolano (Rueda-Roa et al. 2018). La época se caracteriza por el debilitamiento de los vientos Alisios y el paso de la ZCIT sobre la región, los cuales controlan los patrones de lluvia en el norte del país (Quintero et al., 2004).
La concentración de clorofila (nd - 12.39 mg clor. a m-3; Pirela-Ochoa et al., 2008 y Salazar-Gómez et al., 2011, respectivamente), abundancia (0.05 - 2.37 x 103 org mL-1; Rivas-Rojas et al., 2007 y La Barbera-Sánchez et al., 1999; respectivamente) y diversidad (0.29 - 3.8 bits ind-1, Sánchez-Suárez 1994 y Rodríguez-Centeno et al., 2010; respectivamente) son típicos para la época. Así mismo, se observó desde el inicio y hasta mediados de esta época la dominancia de los nanoflagelados. Esta dominancia se atribuye a: sus diversas formas de nutrición tal como lo han señalado Rivas-Rojas et al. (2007) y más recientemente Calvo-Trujillo et al. (2015); además, los flagelos le confieren cierta locomoción en la columna de agua estable lo que permite migrar y así obtener una mayor cantidad de nutrientes (Tomas, 1997).
Entre diciembre 2014 y enero 2015 se produjo un cambio en la composición comunitaria. Numéricamente, las diatomeas dominaron la comunidad nuevamente lo cual fue causado por el incremento en la intensidad del viento y la turbulencia tal como ocurrió en la época de surgencia. Sin embargo, la concentración de nutrientes disponibles debió ser baja lo que explica la correlación positiva entre la temperatura y la abundancia de dinoflagelados, un evento común para la época de calma. Además, la asociación entre la concentración de clor. a y los dinoflagelados sugiere que estos aportaron la mayor fracción del pigmento en este periodo. Por otro lado, el hecho de que estas variables se asociaran de manera opuesta a la abundancia de diatomeas, cocolitofóridos y el total de organismos, confirma la presencia de aguas pobres en nutrientes con una baja abundancia y biomasa fitoplanctónica. En la región, este evento ha sido informado por Ferraz-Reyes et al. (1987).
Los resultados indicaron que los procesos oceanográficos y atmosféricos a los cuales está sujeto el golfo de Cariaco permiten la separación del estudio en tres épocas diferentes: surgencia, transición (surgencia y calma) y calma. Cada época presenta características fisicoquímicas y biológicas (fitoplancton en general) propias que resultan de la variación en la intensidad de estos procesos. Es posible que incluso pueda diferenciarse una cuarta época, transición entre calma y surgencia, pero esto requiere de un estudio más prolongado.
CONCLUSIONES
Los cambios temporales de las variables hidrográficas corresponden a lo que se considera como típico para el golfo de Cariaco y fueron ocasionados por la acción de los vientos Alisios durante la primera parte del año y el aporte de agua dulce y nutrientes durante la época de lluvias en la segunda mitad del año. Aun cuando las especies dominantes identificadas en el presente trabajo concuerdan con lo establecido en investigaciones anteriores en el golfo de Cariaco, se ha detectado un cambio en la dominancia durante la época de surgencia. Los cocolitofóridos C. murrayi y Emiliania-Gephyrocapsa no sólo estuvieron presentes en todos los muestreos sino que también llegaron a dominar la comunidad fitoplanctónica durante la época de surgencia.











 texto en
texto en