INTRODUCCIÓN
El zooplancton está conformado por especies animales de prácticamente todos los taxones de organismos que habitan en el ecosistema pelágico marino (Kiørboe, 2008). Estos pueden ejercer un control efectivo en el patrón de abundancia del fitoplancton y a la vez constituir una parte importante del alimento de diversos organismos del plancton, necton y aves marinas. Por lo tanto, el zooplancton representa un componente de biomasa y diversidad biológica fundamental en la trofodinámica del ecosistema pelágico, transfiriendo gran parte de la energía fijada por los productores primarios hacia los niveles tróficos superiores (D’Alelio et al., 2016; Heneghan et al., 2016); desempeñando un papel importante en el funcionamiento de los ciclos biogeoquímicos (RaphaëlN’doua et al., 2009; Jose et al., 2015). La comunidad zooplanctónica puede ser afectada por los pulsos en el régimen hidrográfico, considerando que la carga de nutrientes afecta en primera instancia al fitoplancton, para luego ejercer patrones de respuesta al zooplancton (Liess et al., 2016) y a las densidades de peces (Selleslagh y Amara, 2008), debido a que gran parte de los organismos zooplanctónicos tienen ciclos de vida relativamente cortos (Litchman et al., 2013). En consecuencia, comprender los cambios en la estructura de la comunidad zooplanctónica en función de la variabilidad ambiental a diferentes escalas de tiempo y espacio, es fundamental para la descripción del funcionamiento y productividad biológica del ecosistema pelágico marino; por lo tanto, pueden ser utilizados como una herramienta en el monitoreo de sistemas acuáticos (Smitha et al., 2013; Bork et al., 2015).
La zona costera oriental de Venezuela es una región importante debido a la diversidad biológica y pesquera (Márquez y Jiménez, 2002; Márquez-Rojas et al., 2006a; Allen et al., 2007), y también por su uso turístico, al incluir las playas más concurridas de la región. También es un área de influencia de la surgencia costera (Okuda, 1975; Alvera-Azcárate et al., 2009; Rueda-Roa y Muller-Karger, 2013). Los estudios sobre la composición específica, la abundancia y distribución espacio-temporal del zooplancton allí presente están disponibles para diversos entornos de su costa nororiental, como la bahía de Mochima (Márquez et al., 2007, 2008; Marcano et al., 2010), la cuenca de Cariaco (Márquez et al., 2009) y golfo de Cariaco (Legaré, 1961; Zoppi 1961; Marín et al., 2004; Márquez et al., 2006b; 2011), siendo escasa la información disponible para el eje costero Arapito-Santa Fé. Este último está influenciado por las condiciones hidrográficas, especialmente una surgencia costera intermitente (Menge y Menge, 2013).
En este escenario, se planteó determinar la composición, abundancia, biomasa y distribución espacial del zooplancton en la zona costera Arapito-Santa Fé, estado Sucre, durante diciembre 2008.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio fue la región marino-costera comprendida entre Playa Arapito y el centro poblado de Santa Fe (10º24´ N, y 64º40´ O; Figura 1), localizada en el estado Sucre, Venezuela (SE Caribe). Es una localidad de aproximadamente 12 km de largo, con playas de arenas y una línea de costa muy escarpada, con una plataforma continental muy corta, la cual se prolonga mar adentro hasta 40 a 80 m de profundidad. El área al igual que la región noreste de Venezuela, está afectada por el fenómeno de surgencia costera estacional (Okuda, 1975; Alvera- Azcárate et al., 2009; Scranton et al., 2014), la cual está estrechamente relacionada con el régimen de los vientos alisios, distinguiéndose tres períodos climáticos de distinta magnitud de la surgencia durante el año. Un período entre diciembre y abril con intensidad fuerte de los vientos (época de surgencia), acompañado de temperatura y oxígeno bajos y concentración alta de nutrientes; el segundo entre mayo y julio (época de transición), con intensidad moderada, con agua subtropical; finalmente, entre agosto y noviembre, se presenta la menor intensidad de los vientos (época de relajación), con temperatura y oxígeno altos y concentración baja de nutrientes (Lorenzoni et al., 2013).
Fase de Campo
El muestreo se realizó durante la campaña del B/O GUAIQUERI II durante 6 y 7 de diciembre de 2008. Las estaciones se localizaron entre las zonas costeras de la entrada del golfo de Santa Fe y las islas Arapo, con gradientes batimétricos fuertes y establecidos en áreas protegidas como zonas de régimen de protección especial (ABRAE), como parte del Parque Nacional Mochima. Se recolectaron muestras en 20 estaciones, separadas en estaciones costeras sobre la plataforma continental (estaciones: 3, 5, 9, 12, 14, 20, 23, 26, 28, 31) y estaciones alejadas de la costa, mar abierto (superior a 1 Km, estaciones: 34, 36, 37, 38, 39, 40, 41, 44, 46, 49) (Figura 1).
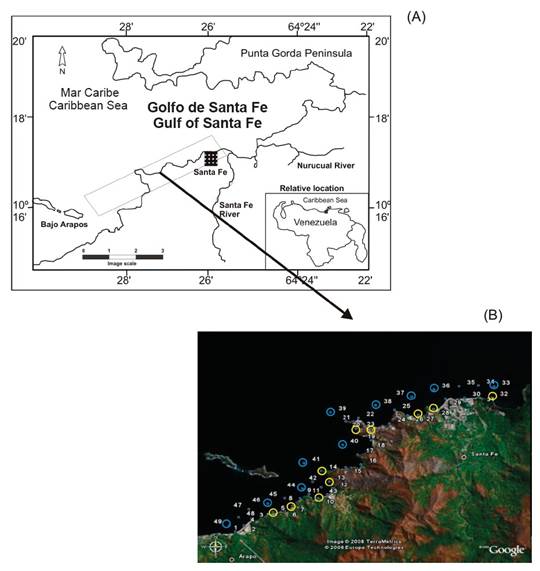
Figura 1 (A) Ubicación geográfica de la zona de estudio. (B) Localización de las estaciones de muestreo en la zona costera Arapito-Santa Fe, estado Sucre, Venezuela. Los círculos amarillos representan las estaciones costeras y los círculos azules las estaciones alejadas de la costa.
Se utilizó una red de Bongo de malla de 500 y 300 µm de poro, con 56 cm de diámetro de boca, provista de un flujómetro marca Rigosha. Con esta, en las estaciones costeras, se hicieron calados diurnos oblicuos desde el fondo a la superficie, y en las estaciones de mar abierto, desde 50 m hasta la superficie, durante 15 min, a una velocidad de calado de 3.9 km/h. Las muestras se fijaron en formalina tamponada al 5% y se trasladaron al laboratorio de zooplancton del Instituto Oceanográfico de Venezuela. La determinación de abundancia se efectuó extrapolando el volumen analizado a la muestra original, y con los datos del flujómetro se calculó el volumen filtrado, que sirvió de base para la estimación de la abundancia mesozooplanctónica por metro cúbico de agua filtrada. Por otra parte, para establecer la abundancia microalgal se tomaron muestras con botellas Niskin a 1 m de profundidad, en cada estación, y se vertieron en botellas plásticas (250 ml) y se fijaron con formalina al 4% neutralizada con hexametilentetramina.
Análisis físico químico del agua
La recolección de las muestras de agua se llevó a cabo con una roseta con CTD (SBE-19) utilizando botellas Niskin de 5L caladas a 5 m de profundidad. Las muestras (500 ml) se mantuvieron congeladas (-20 °C) hasta su procesamiento y análisis en el Laboratorio de Elementos Nutritivos del Departamento de Oceanografía del Instituto Oceanográfico de Venezuela.
El oxígeno disuelto se determinó según el método de Winkler descrito por Strickland y Parsons (1972). Para el registro vertical de temperatura y salinidad se utilizó el CTD (SBE-19). Las concentraciones de fosfatos y nitratos se establecieron de acuerdo con las recomendaciones de Gordon et al. (1993). Los resultados para estos elementos fueron expresados en μmol L-1.
Las determinaciones de clorofila a (chl a) en la superficie se realizaron empleando el método espectrofotométrico descrito por Lorenzen modificado por Strickland y Parsons (1972). Para ello se recolectaron muestras en botellas de polietileno oscuras (2 L).
Análisis del fitoplancton y zooplancton
La cuantificación de microalgas se realizó según el método de sedimentación de Utermöhl (1958), empleando columnas de 50 ml, posteriormente se les agregaron gotas de lugol para facilitar la sedimentación de las células, así como para apreciar mejor sus estructuras. Las microalgas fueron identificadas utilizando los trabajos de Cupp (1943), Thomas (1997), Berard-Therriault et al. (1999) y Rivera- Tenembaum (2006). En los conteos no se incluyeron dinoflagelados heterótrofos (ej. Protoperidinium).
Para el zooplancton, cada muestra de la malla de 300 µm se homogenizó y dividió en dos porciones iguales por medio de un separador Folsom; una porción fue destinada al estudio de la estructura de la comunidad y la otra para el análisis de la biomasa por medio del método gravimétrico (biomasa húmeda, Postel et al., 2000), sin separar en este proceso a los organismos gelatinosos; los datos se expresaron en mg m-3. Para la determinación taxonómica, de las muestras concentradas (500 ml) se obtuvieron submuestras de 2.5 ml con una pipeta Stempel, y se procedió al conteo e identificación utilizando los trabajos de Tregouboff y Rose (1957), Zoppi (1971), Campos- Hernández y Suárez-Morales (1994), Boltovskoy (1999), así como la base de datos de Razouls et al. (2005-2017). Para algunos grupos se resaltaron las especies más importantes.
Análisis de los datos
Luego de comprobar que no se cumplieron los supuestos del análisis paramétrico mediante la prueba de normalidad de Kolmogorov-Smirnov y homocedasticidad de Bartlet (Sheskin, 2004), se comparó la abundancia de fitoplancton, biomasa y abundancia zooplanctónica total entre las estaciones costeras y las alejadas de la costa utilizando la prueba no paramétrica de Mann-Whitney (Test Wilcoxon). Se utilizó un nivel de significación de alfa=0.05. Para estas pruebas se utilizó el software estadístico Statgraphics plus 5.1.
Para establecer si existían diferencias significativas en la estructura comunitaria entre los principales grupos del zooplancton, se utilizó el análisis de similitud (ANOSIM) y el escalamiento multidimensional no métrico (MDS); este último se utilizó para visualizar la ordenación en los grupos del zooplancton en dos dimensiones con respecto a la ubicación de las estaciones probando las diferencias entre los grupos de la comunidad del zooplancton de acuerdo con la ubicación de las estaciones. Los datos de abundancia para los análisis fueron transformados previamente a raíz cuarta, para crear una matriz de similitud de Bray-Curtis. La identificación de los aportes de los principales grupos taxonómicos que más contribuyen a la similitud y la disimilitud entre la ubicación de las estaciones se realizó con la prueba de porcentaje de similitud (SIMPER); para esto se utilizó el programa Primer 6 & Permanova (Clarke y Gorley, 2006).
Para establecer la relación entre las variables ambientales (temperatura, salinidad, oxígeno disuelto, nitrato, nitrito y fosfato) y la abundancia fitoplanctónica y los grupos del zooplancton de cada zona, se realizó el análisis de redundancia (RDA) luego de demostrar que la distancia del gradiente en el primer componente tenía valores menores a 3 (Muylaert et al., 2009). Los gráficos de superficie fueron realizados con el programa Surfer versión 8.0 para representar las isolíneas de las variables físicos- químicas utilizadas.
RESULTADOS
Variables ambientales
La temperatura superficial del agua varió desde 26.60 ºC en la estación 24 hasta 28.60 ºC en la estación 21, con una media de 27.70 ± 0.43 ºC (Figura 2A). El valor mínimo de salinidad de las aguas superficiales en el área de estudio fue de 29.40 en la estación 31 y el máximo de 36.90 en la estación 13, con una media general de 36.24 ± 1.60 (Figura 2B). El oxígeno disuelto varío entre 3.89 (estación 3) y 4.93 ml L-1 (estación 8), con una media de 4.44 ± 0.22 ml L-1 (Figura 2C).
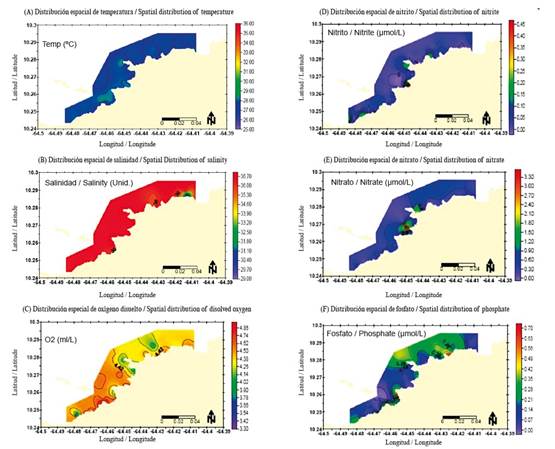
Figura 2 Distribución espacial de: A temperatura (ºC), B salinidad, C oxígeno disuelto (ml L), D nitrito, E nitrato y F fosfato (µmol L), de las aguas superficiales de la zona costera Arapito - Santa Fé, estado Sucre, Venezuela, durante diciembre 2008.
El nitrito fluctuó entre no detectable (ND) y 0.48 μmol L-1, con una media general de 0.06 ± 0.08 μmol L-1; los valores más altos se registraron en las estaciones 16 y 20, cerca de la costa entre Arapito y Playa Colorada, específicamente en el Sector de Santa Cruz y Punta Colorada (Figura 2D). Los valores de nitrato fluctuaron entre 0.01 μmol L-1 en la estación 16 y 3.62 μmol L-1 en la estación 17, con una media de 0.47 ± 0.55 μmol L-1. En casi toda la región estudiada el nitrato registró valores inferiores a 1 μmol L-1 con la excepción de las zonas pobladas de Santa Cruz y al este de Punta Colorada donde se presentaron valores superiores a 1.50 μmol L-1 (Figura 2E). Las concentraciones de fosfatos fluctuaron entre ND y 0.77 μmol L-1, con una media de 0.20 ± 0.17 μmol L-1; los máximos valores se registraron al este de Playa Colorada y frente a la empresa Camaronera Aguamarina de la Costa (estaciones 9 y 13; Figura 2F).
Variables bióticas
Las concentraciones de Chl a en el área fueron no detectables. Se encontró gran abundancia de formas flageladas (75 - 93% del total de individuos <10 µm) que no pudieron ser identificadas; el resto de la comunidad estuvo formada por clorófitas, diatomeas, dinoflagelados, euglenófitas, primnesiófitas y silicoflagelados. Además, las muestras contenían ciliados, tintínidos, cladóceros y copépodos de diferentes estadios. El intervalo de abundancia fue de 47 a 1177 cél ml-1. Se estableció que la abundancia del fitoplancton no varió de manera significativa con respecto a la ubicación de las estaciones (Test W = 3.65; p > 0.05).
La biomasa zooplanctónica expresada como biomasa húmeda varió entre 0.14 y 0.71 mg m-3, los valores más bajos (< 0.20 mg m-3) se obtuvieron en las estaciones ubicadas hacia el oeste (estaciones 4 y 49), lejos de los centros poblados; los valores más altos se obtuvieron en las estaciones situadas hacia el este, 34 (0.71 mg m-3) y 36 (0.64 mg m-3) frente a la población de Santa Fe. No se hallaron diferencias significativas con respecto a la ubicación de las estaciones (Test W= 0.67; p > 0.05).
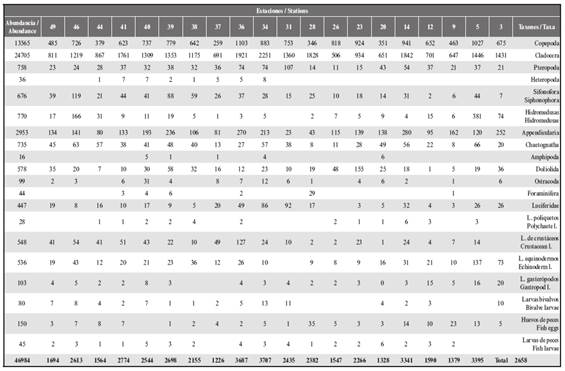
La abundancia zooplanctónica varió entre 1226 y 3708 ind. m-3 (Tabla 1). Las estaciones 5, 14, 34 y 36 presentaron los valores más altos (3341 - 3708 ind. m-3), separadas por las estaciones 23, 28, 31, 39, 40 y 41 donde se registraron valores intermedios (2266 - 2774 ind. m-3)
Tabla 1 Abundancia del zooplancton superficial (ind. m-3) de la zona costera Arapito - Santa Fe, estado Sucre, Venezuela, durante diciembre 2008 (L. = larvas).
(Figura 3A; Tabla 1). Las estaciones 20 y 37 presentaron las abundancias más bajas con menos de 1400 ind. m-3 (Figura3A). Se comprobó que la abundancia zooplanctónica no varió de manera significativa con respecto a la ubicación de las estaciones (Test W= 0.75; p > 0.05; Figura 3B).
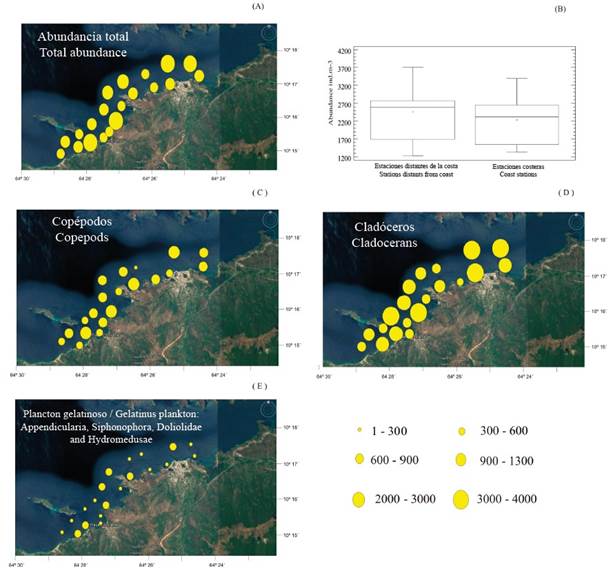
Figura 3 Distribución espacial y por ubicación de las estaciones de la abundancia (ind. m-3). zooplanctónica total (A y B) y distribución espacial de los principales grupos zooplanctónicos (ind. m-3), copépodos ( C), cladóceros (D) y plancton gelatinoso (E ) de la zona costera Arapito - Santa Fe, estado Sucre, Venezuela, durante diciembre 2008.
Se identificaron 20 grupos taxonómicos (Tabla 1). Las mayores abundancias para los copépodos (costeras: 346 a 1027 ind m-3; alejadas de la costa: 259 a 1103 ind m-3) y los cladóceros (costeras: 506 a 1842 ind m-3; alejadas de la costa: 691 a 2251 ind m-3) se registraron en las estaciones alejadas de la costa; sin embargo, para ambos grupos no se detectaron diferencias significativas de la abundancia entre la ubicación de las estaciones (Test W= 0.98 y Test W= 0.75; p > 0.05, respectivamente; Figura. 3C, D).
De igual manera, ocurrió con el zooplancton gelatinoso y los sifonóforos, no mostraron un patrón de distribución marcado, mientras que para las hidromedusas se halló lo contrario (costera: 503 ind m-3; alejadas de la costa: 267 ind m-3; Figuras 3E, 4A). Sin embargo, para este último grupo tampoco se hallaron diferencias significativas entre las abundancias y la ubicación de las estaciones (Test W= 0.40; p > 0.05; Figura 4A).
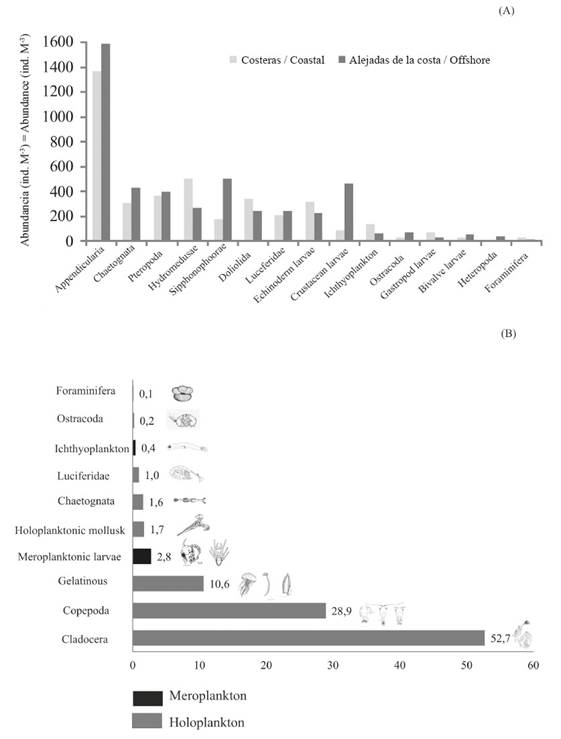
Figura 4 (A) Abundancia (ind.m-3) de los grupos zooplanctónicos considerando las estaciones costeras y las alejadas de la costa. No se considera a los cladóceros y copépodos y (B) abundancia relativa de los principales grupos del zooplancton capturados en la zona costera Arapito - Santa Fe, estado Sucre, Venezuela. Las barras grises representan al holoplancton y las negras el meroplancton.
De la abundancia total de los grupos taxonómicos analizados tanto en las estaciones costeras como alejadas de lacosta, loscladócerosrepresentaron 52.7% delaabundancia relativa. Los copépodos fueron el segundo componente con mayor abundancia relativa (28.9%), seguido del plancton gelatinoso (hidromedusas, apendicularias, sifonóforos y ctenóforos) con 10.6%. Estos tres grupos representantes del holoplancton obtuvieron una abundancia relativa de 92.9% (Figura 4B). El aporte de los grupos meroplanctónicos en el área de estudio fue mínimo. De estos grupos la mayor abundancia correspondió a las larvas de crustáceos (1.17%), seguido de las larvas de equinodermos (1.14%) y el resto a larvas de moluscos y poliquetos (Figura 4B).
Dentro de los grupos zooplanctónicos contabilizados más importantes en el eje costero Arapito- Santa Fe destaca la presencia de solamente tres especies de cladóceros: Penilia avirostris, Pseudevadne tergestina y Evadne spinifera y 43 de copépodos, dentro de estos Acartia tonsa, Temora turbinata y Paracalanus quasimodo fueron los más abundantes. Entre los apendicularios, Oikopleura (Coecaria) longicauda y Oikopleura (Vexillaria) dioica sobresalieron.
El ANOSIM mostró diferencias significativas (p<0.05; R global 0.27) en la abundancia zooplanctónica entre las estaciones cercanas y alejadas de la costa. El análisis SIMPER indicó que la disimilitud de la estructura comunitaria entre la ubicación de las estaciones fue baja, con un porcentaje de 17.4% (Tabla 2). La mayor diferencia en las estaciones costeras fue la ausencia de heterópodos, mientras que en las estaciones alejadas de la costa, la contribución estuvo repartida principalmente entre larvas de crustáceos, larvas de bivalvos, ostrácodos y sifonóforos. La ordenación MDS de la abundancia zooplanctónica con respecto a la ubicación de las estaciones, no evidenció una separación significativa entre las dos zonas en que se dividió el estudio; no obstante, se pudo notar mayor similitud en las estaciones alejadas de la costa (Figura 5).
Tabla 2 Porcentaje de contribución de los principales grupos del zooplancton que marcaron la disimilitud entre la ubicación de las estaciones estudiadas en el análisis SIMPER. P. Diss: promedio de disimilaridad. Porcentaje de disimilaridad: 17.4%.
| Grupos / Groups | Abundancia Est. Costeras / Abundance Coastal Stations | Abundancia Est. Alejadas / Abundance Offshore Stations | P. Diss | Porcentaje Contribución Acumulado / Percentage Contribution Accumulated | ||
|---|---|---|---|---|---|---|
| Heterópodos / Heteropods | 0.00 | 1.11 | 1.85 | 8.08 | 8.08 | |
| L. crustáceos / Crustacean larvae | 1.45 | 2.52 | 1.55 | 7.96 | 16.04 | |
| L. bivalvos / Bivalve larvae | 0.75 | 1.41 | 1.44 | 6.40 | 29.30 | |
| Ostrácodos / Ostracoda | 0.93 | 1.30 | 1.20 | 5.85 | 35.14 | |
| Sifonóforos / Sophonophora | 1.93 | 2.59 | 1.46 | 5.13 | 51.16 | |
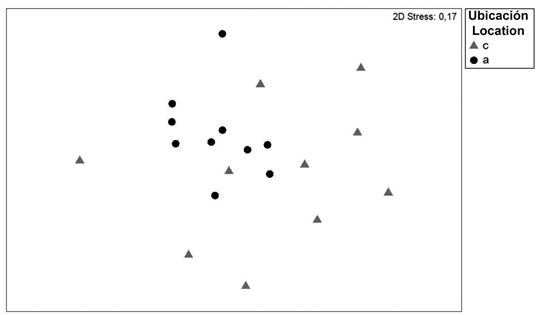
Figura 5 Ordenación MDS de las estaciones de la zona costera Arapito - Santa Fe, estado Sucre, Venezuela, durante diciembre 2008. Estaciones costeras (triángulo gris) y Estaciones alejadas de la costa (círculo negro).
El análisis de redundancia arrojó una correlación especies-ambiente de 0.52 y entre los componentes 1 y 2 fue de 0.58. En el componente 1 el nitrito estuvo correlacionado de manera inversa con el fitoplancton, sifonóforos, larvas de crustáceos y cladóceros. En el componente 2 el fosfato estuvo correlacionado de manera inversa con la temperatura y salinidad y asociados a este, estuvieron los quetognatos, hidromedusas, copépodos y doliólidos (Figura 6).
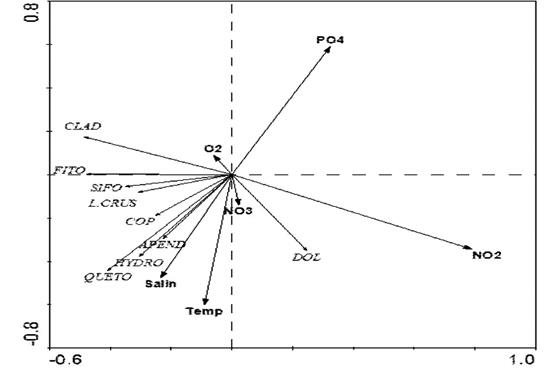
Figura 6 Análisis de redundancia (RDA) entre las variables ambientales y el fitoplancton y los grupos zooplanctónicos del eje costero Arapito - Santa Fe, estado Sucre, Venezuela. PO4: fosfato, NO2: nitrito, NO3: nitrato, O2: oxígeno disuelto, Salin: salinidad, Temp: temperatura del agua, Clad: cladóceros, Fito: fitoplancton, Sifo: sifonóforos, L. crus: larvas de crustáceos, Cop: copépodos, Apen: apendicularios, Hydro: hidromedusas, Queto: quetognatos, Dol: doliólidos.
DISCUSIÓN
Las condiciones oceanográficas de la zona costera Arapito - Santa Fé, al igual que toda la región nororiental de Venezuela, se ven afectadas por el fenómeno de surgencia estacional (Okuda, 1975; Alvera-Azcárate et al., 2009; Scranton et al., 2014). Por lo tanto, es de esperarse que la temperatura y la salinidad no presentaran variaciones espaciales marcadas durante el muestreo, indicando una zona de estabilidad termohalina (Rueda-Roa y Muller- Karger, 2013); en consecuencia, las diferencias en los valores de temperatura y salinidad corresponden más bien a diferencias temporales como reflejo de la intensidad de la surgencia costera en esta área, tal y como ha sido señalado por diversos autores (Okuda, 1975; Allen et al., 2007; Martínez, 2009).
Al comparar los valores de temperatura, salinidad y oxígeno disuelto registrados en el presente estudio, con otros trabajos del área (Okuda, 1975; Allen et al., 2007), para la misma época se detectaron diferencias, ya que las temperaturas registradas por ellos son más bajas (< 27ºC) y la salinidad y el oxígeno disuelto más altos. Estas diferencias pudieran ser explicadas por cambios estacionales de la intensidad de las surgencia referidos por Taylor et al. (2012), lo que indica que en el mes de muestreo del presente trabajo todavía no se presentaba evidencia de una elevada intensidad de la surgencia, pudiendo haber un retardo en la misma, para este año en particular.
Al considerar los nutrientes durante el estudio, los valores fueron relativamente altos en relación con los detectados por Okuda y Benítez (1974) y Okuda (1975), debido a las precipitaciones en la zona y el aporte fluvial, los cuales superaron la media anual para esta región del país (López-Monroy y Troccoli-Ghinaglia, 2014). Por otra parte, las concentraciones elevadas de nutrientes en la región marino costera Arapito - Santa Fe hacen suponer que existen aportes antrópicos directos, así como descargas continentales debido al aumento de las escorrentías y caudales de los ríos que enriquecen las aguas superficiales de las regiones marino costeras (Okuda, 1975; Martínez, 2009). Además, no se registraron diferencias espaciales, indicando que la alteración local de las concentraciones de fosfato y nitrato, a través de las reacciones bioquímicas en esta zona de estudio, es relativamente pequeña. En ese sentido, Okuda (1975) indicó que estas altas concentraciones de nutrientes se mantienen en la mayor parte de la columna de agua durante un período prolongado del año. Esta ventaja natural es aprovechada por el primer eslabón de la cadena trófica, reflejándose en una productividad primaria elevada, trayendo como consecuencia un aumento en la abundancia zooplanctónica que conlleva a una buena producción pesquera evidenciada en la región (Rueda-Roa et al., 2017).
Al igual que las variables físico-químicas, la biomasa fitoplanctónica muestra una marcada variación estacional en la región nor-oriental de Venezuela, relacionada con los eventos de surgencia que ocurren entre diciembre y julio (Okuda, 1975; Alvera-Azcárate et al., 2009; Scranton et al., 2014). El hecho de que la concentración de clorofila a no fuera detectable en todas las estaciones puede explicarse porque no se determinó que porcentaje de los nanoflagelados cuantificados contenía clorofila. Según Moustaka-Gouni et al. (2016), los nanoflagelados agrupan células con diferentes tipos de nutrición (fotosintetizadores, heterótrofos y mixótrofos), por lo que pueden proliferar en aguas con concentraciones de nutrientes variables. Además, las muestras contenían organismos zooplanctónicos que normalmente no aparecen en muestras de volumen reducido como las que se usan para evaluar el fitoplancton. Esto sugiere que los herbívoros consumieron las células de mayor tamaño (diatomeas y dinoflagelados) con un mayor contenido del pigmento. Por estas razones, los resultados difieren de lo informado por Estrella-López (2007), quien utilizó volúmenes de muestra ≤1000 ml y registró que el intervalo de biomasa para el Golfo de Santa Fe en el periodo julio - diciembre de 1999 fue de 0.14 a < 1 mg Chl a m-3.
En general, la composición del zooplancton en el eje costero Arapito - Santa Fé refleja dominancia de cladóceros y copépodos, quedando en tercer lugar el plancton gelatinoso. Los cladóceros destacaron dentro del zooplancton marino, básicamente por su abundancia, sobresaliendo Penilia avirostris sobre Pseudoevadne tergestina; llegaron ambas a conformar 52% del total de la abundancia zooplanctónica.
Los cladóceros constituyen un grupo en el que dominan las formas de aguas continentales, pero los representantes marinos llegan a constituir una importante fracción de la comunidad zooplanctónica y de la producción de materia orgánica (Marazzo y Valentin, 2004). Penilia avirostris se considera una forma típica de aguas cálidas y de ambientes costeros eurihalinos (Marazzo y Valentin, 2000); es, además, la única especie de cladóceros marinos que se alimenta por filtración (Atienza et al., 2008). Penilia tergestina se encuentra principalmente en la superficie de mares costeros y embalses (Marazzo y Valentin, 2004), es carnívora y cuando abunda es alimento de peces y otros depredadores zooplanctónicos (Fofonoff, 1994); puede alcanzar grandes abundancias debido a que los huevos partenogenéticos se desarrollan hasta embriones antes de ser liberados al medio (paedogenesis) (Marazzo y Valentin, 2000).
La dominancia de los cladóceros en la comunidad zooplanctónica en el eje costero Arapito - Santa Fé pudo deberse a los procesos físicos antes mencionados, ya que ambas especies son conocidas como típicas de aguas cálidas. Penilia avirostris, la más abundante, se encuentra óptimamente en agua con temperatura alrededor de 25°C (Onbé, 1999), aunque puede encontrarse en aguas hasta de 18°C, como sucede en zonas costeras y bahías de México (Hernández-Trujillo et al., 2010). Penilia tergestina se considera indicadora de masas costeras de aguas cálidas y el intervalo térmico en el que se distribuye óptimamente es de 22 a 25°C (Marazzo y Valentin, 2001). Las condiciones térmicas del agua en el lugar y época de estudio estuvieron dentro de ese intervalo, de las que han sido reconocidas como óptimas para ambas especies, por lo que las grandes concentraciones obtenidas podrían explicarse por las condiciones ambientales imperantes en el área al momento del estudio.
Por su parte, Márquez et al. (2008), durante un estudio de dos años en la parte interna de la bahía de Mochima, registraron a los cladóceros como el grupo más abundante en el zooplancton; Zoppi (1961) establece que los cladóceros en muchas áreas pueden competir con los copépodos en abundancia numérica, dominando, particularmente, en las estaciones cercanas a las costas y durante los meses de calma. Lo antes expuesto no coincide con los resultados obtenidos, ya que no se encontraron diferencias espaciales en cuanto a la abundancia; posiblemente estas diferencias fueron generadas por una alta variabilidad que implican los largos periodos de estos estudios.
Se encontró una elevada abundancia de los copépodos Acartia tonsa, Temora turbinata y Paracalanus quasimodo. La presencia de estas especies coincide con los antecedentes sobre copépodos dominantes en la zona nor- oriental del país (Legaré, 1961; Zoppi, 1961; Marín et al., 2004; Márquez et al., 2007, 2008, 2011), así como del mar Caribe y Caribe suroriental (Michael y Foyo, 1976) y sur del Golfo de México (Álvarez-Cadena et al., 2007; Ruíz-Pineda et al., 2016). Por su parte, A. tonsa ha sido registrada como una especie que presenta amplio ámbito de tolerancia de salinidad y temperatura (Martínez-Barragán et al., 2009), además es un eficiente consumidor de fitoplancton y sus poblaciones se pueden incrementar rápidamente en la presencia de alimento abundante (Teixeira et al., 2010). Por lo tanto, la abundancia elevada de los filtradores, P. avirostris y A. tonsa, podría explicar las bajas concentraciones de clorofila a.
De los resultados obtenidos se puede concluir que la abundancia zooplanctónica del eje costero Arapito - Santa Fe durante el período de estudio es alta en comparación con los valores obtenidos en otras regiones del nor-oriente del país para la época, entre los que se puede mencionar a Márquez et al. (2011) para el golfo de Cariaco (entre 38 - 413 ind.m-3 en diciembre de 2003). De igual manera, ocurrió con los trabajos de Márquez et al. (2007, 2008) para la bahía de Mochima, quienes registraron valores más elevados (1210 ind.m-3) a las magnitudes que están en el límite inferior de este trabajo, durante la misma época. Estas diferencias están relacionadas con la estacionalidad de la surgencia costera e intensidad del viento. Esta afirmación también ha sido señalada por Rueda-Roa y Muller-Karger (2013), los cuales han basado sus conclusiones en las fluctuaciones en los parámetros bióticos y abióticos, durante varios años de estudio en el nororiente de Venezuela. De las evidencias anteriores, surge la necesidad del establecimiento de series de tiempo de larga duración.
Por supuesto, cada especie tiene un nicho propio y causaunainfluencia diferencial enlatotalidaddelacomunidad planctónica. Sin embargo, la premisa fundamental es que las especies numéricamente dominantes (o en biomasa) ejercen mayor influencia en la transferencia de energía a niveles tróficos superiores y constituyen relevantes nodos de biomasa en la trama trófica del ecosistema epipelágico (Mendoza- Portillo, 2013), tal y como ocurrió con los cladóceros y copépodos en el eje costero Arapito - Santa Fé. Esto también quedó corroborado con la abundancia relativa mayor de los grupos holoplanctónicos. No obstante, la baja abundancia de larvas de crustáceos, así como de meroplancton en general, indica posiblemente, ausencia de actividad reproductiva, ya que, en otros estudios en la región, la mayor abundancia de crustáceos no corresponde con el mes del presente trabajo (Márquez et al., 2006a). Sin embargo, el alto porcentaje de holoplancton sugiere que el área de estudio puede considerarse como de crecimiento y alimentación.
Se puede señalar también, considerando los hábitos alimentarios de los grupos de zooplancton identificados, que la trama alimentaria del mesozooplancton en la zona de estudio estuvo constituida básicamente por herbívoros, especialmente cladóceros y copépodos, organismos que tienden a permanecer en la parte superior de la columna de agua (Calbet et al., 1999), seguidos de los apendicularios y sifonóforos, organismos filtradores que incluyen en su dieta diferentes organismos (cocolitofóridos, diatomeas, radiolarios y foraminíferos) y por último, por las medusas, quetognatos y luciféridos, organismos carnívoros u omnívoros que probablemente cumplan un papel regulador en la comunidad (Hopkins et al., 1993).
La ausencia de diferencias significativas en la abundancia del fitoplancton y en la disimilitud del zooplancton entre las estaciones costeras y las alejadas de la costa evidencia que las condiciones oceanográficas en el eje costero Arapito- Santa Fe durante la realización del estudio, resultaron en una distribución relativamente homogénea de los organismos, con un porcentaje de disimilitud muy bajo (17,4%), debido principalmente a la ausencia de los heterópodos en las estaciones costeras, mientras que los ostrácodos, sifonóforos, larvas de crustáceos y bivalvos, fueron más abundantes en las estaciones alejadas de la costa. Estas diferencias espaciales en la composición fueron evidenciadas a través de la prueba ANOSIM, hallándose las mayores abundancias de cladóceros, copépodos, apendicularios y quetognatos en las estaciones externas y con una mayor similitud de sus magnitudes entre estas, tal y como quedó demostrado con el MDS.
Sin embargo, los ubicuos cladóceros y copépodos abundan tanto en la costa como en las estaciones alejadas de la costa y es en ésta última donde dominan y caracterizan la comunidad; de igual manera, ocurrió con los quetognatos y pterópodos. Estos resultados no concuerdan con lo expresado por Zoppi (1961), quien indicó que en regiones costeras y en aguas de poca profundidad, la biomasa y abundancia del zooplancton es mayor, debido a que los nutrientes terrígenos elevan la producción primaria en áreas cercanas a la costa. Sin embargo, dada la concentración relativamente elevada de nutrientes en las estaciones costeras, principalmente del nitrito (procesos de óxido-reducción), debido a las descargas de aguas servidas y de ríos, podrían haber influido en la menor abundancia observada en las estaciones costeras, tal y como se evidenció con el análisis de redundancia (RDA).
Atendiendo a las consideraciones antes señaladas, hay que destacar que el eje costero Arapito - Santa Fe es un cuerpo receptor de la descarga de drenajes de aguas residuales urbanas, agrícolas y provenientes de la acuicultura, vertidas al sistema sin tratamiento previo. Esta constante adición de nutrientes ha originado cambios importantes en la calidad del agua y en la dinámica del sistema, lo cual seguramente origina cambios en los niveles y ciclos de producción de los organismos, así como en la composición de las poblaciones en los sitios impactados. Esto coincide con las observaciones de Calvo-Trujillo et al. (2015) y Soto et al. (2015) en zonas costeras de Venezuela, donde mencionan una situación similar, de abundante aporte de nutrientes con suficiente luz, con valores bajos de clorofila a y fitoplancton, indicando un patrón de circulación fuerte y bajo tiempo de residencia.
Los resultados presentados en este estudio coincidieron con los informados por Ferraz-Reyes (1993), quien indicó que los procesos climáticos (alta nubosidad y pluviosidad y baja velocidad del viento) y oceanográficos (calentamiento y estratificación, aguas continentales cargadas de material en suspensión y baja salinidad superficial) característicos de la época de relajación, resultaron en valores bajos de Clorofila a y abundancia fitoplanctónica, con una predominancia de los nanoflagelados. Sin embargo, si se hubieran recolectado muestras a mayor profundidad podría demostrarse el ascenso de la isotermas ≤ a 24ºC, lo cual indicaría el inicio del periodo de surgencia. La predominancia de los nanoflagelados en lugar de las diatomeas se explicaría porque las aguas surgidas aún no han sustituido las aguas cálidas pobres en nutrientes típicas de la época de relajación. Por lo tanto, se presume que el aumento significativo de la abundancia zooplanctónica fue producto del crecimiento de formas autótrofas y heterótrofas (nanoflagelados) promovida por los aportes de nutrientes de las aguas continentales. Sería recomendable realizar este tipo de estudio durante la época de surgencia en desarrollo, para determinar los cambios estructurales que se producen en la comunidad fitoplanctónica y zooplanctónica en respuesta a los cambios estacionales.
La biomasa y abundancia zooplanctónica son indicadores gruesos de la productividad secundaria y su variabilidad depende de la respuesta de los grupos que la integran ante las fluctuaciones del ambiente (Mann y Lazier, 1991). Por lo tanto, la biomasa, abundancia y composición del zooplancton obtenida en este trabajo, permite tener una línea base para comparar con estudios posteriores donde se realice un seguimiento del cambio de estas variables; en virtud de que estos cambios pueden convertirse en impactos negativos que influirán en la productividad biológica, y por lo tanto, en el aprovechamiento de los servicios ambientales que provee la zona por su importancia pesquera y de uso turístico.
CONCLUSIÓN
La abundancia y riqueza de holoplancton encontrado permite considerar al área de estudio como una zona de crecimiento y alimentación, corroborado con las concentraciones bajas de clorofila a, indicando posiblemente una alta tasa de pastoreo, por la alta abundancia de especies filtradoras. La poca disimilitud del zooplancton con respecto a las estaciones evidencia una distribución relativamente homogénea de los organismos.











 text in
text in 



