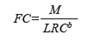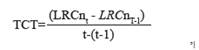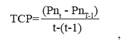INTRODUCCIÓN
Las tortugas carey (Eretmochelys imbricata) están clasificadas como especies en peligro crítico por la Unión Internacional para la Conservación de la Naturaleza (UICN). Las revisiones de las tendencias en las playas de anidación de la región del Caribe en las décadas anteriores han mostrado el pequeño tamaño de la población (>100 hembras anidantes por país) y las tendencias generales de reducción en la actividad de anidación (Meylan, 1999). Las estimaciones basadas en los controles cruzados de información sobre el comercio de productos del caparazón de tortuga y la actividad reproductiva en las playas de anidación muestran que las poblaciones del Caribe continúan disminuyendo (McClenachan et al., 2006; Wyneken et al., 2013). Múltiples factores antropogénicos (por ejemplo, la iluminación) también continúan impactando el éxito reproductivo de las tortugas (Harewood y Horrocks, 2008). La desaparición de las tortugas carey en varios ecosistemas ha provocado cambios profundos en la estructura y biodiversidad de los arrecifes de coral (McClenachan et al., 2006).
La cría en cautiverio es una estrategia experimental de conservación que tiene como objetivo promover el reclutamiento de las poblaciones de tortugas marinas manteniéndolas durante los primeros meses o años, hasta que alcancen un tamaño que les permita enfrentarse con éxito a las fuentes de mortalidad natural (Mortimer, 1995; Ross, 1999; Burke, 2015). En cautiverio, las tortugas tienen acceso a una mayor cantidad de alimento y de más alta calidad nutricional; además, gastan menos energía en enfrentarse a los depredadores, las olas o los cambios de temperatura. Esto conduce a tasas de crecimiento más rápidas y quizás a una edad más temprana de madurez sexual (Bjorndal et al., 2013b). Cuando las tortugas criadas en cautiverio son liberadas en el medio marino, a pesar de haber estado en contacto constante con seres humanos durante meses o años, muestran el comportamiento típico de las tortugas salvajes (Nagelkerken et al., 2003; Monterrosa y Salazar, 2005). Las tortugas carey criadas en cautiverio pueden presentar comportamientos de migración o descanso que difieren de los de las tortugas silvestres, aunque estas habilidades podrían mejorar con algún enriquecimiento ambiental durante el período de cautiverio. (Okuyama et al., 2010). Estudios recientes de monitoreo por telemetría han demostrado que una vez liberadas, las tortugas carey pueden migrar hacia zonas de alimentación típica, utilizando las rutas naturales (Pabón- Aldana et al., 2012). Además de promover la supervivencia de las tortugas en las etapas tempranas de la vida, el levante puede servir como mecanismo de sensibilización de las personas, especialmente entre los jóvenes, alrededor de los problemas ambientales y la importancia de la conservación de la biodiversidad. En el levante, la alimentación de los animales constituye uno de los principales costos (Pelegrín y Fraga, 2002). Idealmente, la dieta imitará a la presa natural y aportará los elementos nutricionales necesarios para un desarrollo corporal adecuado; por ejemplo, una dieta debe asegurar un funcionamiento fisiológico, una buena salud y las tasas de crecimiento suficientes para proporcionar una ventaja ambiental (Espinosa y Labarta, 1987). Para las tortugas carey una especie oportunista con preferencia por los corales y las esponjas (León y Bjorndal, 2002)- desarrollar una dieta completa representa un gran desafío. Como el levante requiere una gran inversión financiera, los elementos de la dieta de una especie en cautiverio deben tener costos aceptables y estar disponibles localmente.
Las granjas y centros de investigación que albergan tortugas marinas (E. imbricata, Lepidochelys olivacea, Caretta caretta, y Chelonia mydas) han alimentado a las tortugas con dietas a base de músculo de pescado (Gutiérrez y Cabrera, 1996; Mann et al., 2000a), pescado fresco, verduras (Kanghae et al., 2014), plantas rastreras de playa, macroalgas (Mann et al., 2000b), o calamar (Moein et al., 2003). En los criaderos de Nagoya (Japan), las hembras de C. caretta son alimentadas tres veces por semana con carne de pescado, camarones, calamares, col china y macroalgas, en una cantidad equivalente a 0.5% de su masa corporal (Kakizoe et al., 2013). La dieta de dichas crías también incluye alimentos artificiales producidos por la aglomeración mecánica y compactación de mezclas (Tacon, 1989) diseñadas específicamente para las tortugas marinas u otros reptiles (Endres et al., 2012; Kanghae et al., 2014). El uso de dietas artificiales permite la selección de requisitos nutricionales específicos para las tortugas y la promoción de tasas de crecimiento rápidas con una condición corporal saludable. Los fabricantes de piensos comerciales mezclan varias fuentes de proteínas para crear dietas con un espectro equilibrado de aminoácidos y porciones de proteína con alto valor nutricional (Kellems y Church, 2002). Además, el uso de alimentos procesados facilita el mantenimiento de la calidad del agua en los sistemas de estanques con filtración y recirculación, lo que lleva a costos logísticos reducidos.
Varios estudios han intentado establecer las condiciones óptimas para la formulación de dietas artificiale (Kanghae et al., 2014). Con juveniles de C. mydas, Wood y Wood (1981) hallaron que la digestibilidad de la dieta aumenta con la concentración de proteínas y sugirieron que los alimentos deben contener un mínimo de 40% de proteína, al menos hasta alcanzar las 14 semanas de edad. De forma similar, Harfush et al. (2000) recomiendan que las dietas para L. olivacea contengan mezclas de carne de pescado, cabezas de camarón y carne enriquecida (dextrina). Por su parte, para C. caretta, Monterrosa y Salazar (2005) compararon dietas formuladas con diferentes concentraciones de proteína, y obtuvieron los valores más altos de tasas de crecimiento utilizando niveles de proteína superiores a 40%. Se obtuvieron resultados similares en pruebas para E. imbricata donde la harina de calamar, en comparación con otras fuentes de proteína, mostró los mejores efectos sobre las tasas de crecimiento y desarrollo (Pelegrín et al., 2006).
Otros estudios se han centrado en probar los efectos del enriquecimiento de las dietas artificiales. Pelegrín y Fraga (2002) descubrieron que alternar el consumo de proteína fresca con pellets de alimento, mejora el desarrollo corporal de los individuos; la inclusión de material vegetal (por ejemplo, Sargassum sp.) entre comidas también muestra beneficios relacionados con el aumento del apetito y los hábitos oportunistas de las tortugas (Mann et al., 2000a). De manera similar, Joya y Molina (2006) concluyeron que una dieta basada en proteínas de origen animal presenta mayor palatabilidad que si se basara en proteínas vegetales (p. ej., soya), a pesar de tener una composición nutricional similar. La mejora de la palatabilidad facilita el consumo de los pellets por parte de las tortugas y también influye en su asimilación.
Estudios recientes con tortugas marinas juveniles en cautiverio han usado dietas comerciales (por ejemplo, Turtle Chow), diseñadas específicamente para las tortugas (ver Endres et al., 2012). En algunos casos, las dietas artificiale han sido complementadas con suplementos dietéticos, carne de camarón, gelatinas o preparaciones caseras en las que las verduras (espinacas y lechuga), el hígado (cocido) y/o el aceite de pescado se mezclan con las vitaminas A, D, E y los complejos B (Mann et al., 2000a). Las dietas comerciales para tortugas tienen costos elevados y su disponibilidad es limitada para los países en desarrollo debido al costo de importación desde los países productores, pero hay otros alimentos procesados disponibles. Aunque estas dietas artificiales no están formuladas específicamente para tortugas marinas, pueden cumplir con los requisitos establecidos para el mantenimiento de estas especies.
Se evalúan en este estudio los efectos producidos en las tasas de crecimiento al utilizar dos dietas de alimentación comercial, originalmente diseñadas para otras especies como el camarón. (Litopenaeus vannamei) y la tilapia (Oreochromis sp.), como dieta exclusiva en la cría en cautiverio de las crías de E. imbricata entre el sexto y décimo mes de vida. También se analizaron los efectos de las dietas sobre los factores de condición de los individuos. El objetivo fue determinar si estas dietas comerciales son una opción adecuada para promover un crecimiento saludable y reducir los costos de mantenimiento de las tortugas carey en cautiverio.
MATERIALES Y MÉTODOS
Animales y Sistemas de Mantenimiento
Durante los últimos años, los nidos de tortugas marinas en el Parque Nacional Natural Tayrona (Caribe colombiano) han sido monitoreados y protegidos por voluntarios o guardaparques con el apoyo académico del Acuario Mundo Marino de la Universidad Jorge Tadeo Lozano (Santa Marta, Colombia). Cuando existe un riesgo inminente de pérdida de nidos debido a inundaciones u otras causas, los nidos se trasladan a un criadero artificial hasta la eclosión, utilizando procedimientos estándar (Wood y Wood, 1979; Mortimer, 1999). Luego, las crías se mantienen en cautiverio por períodos de aproximadamente un año, lo que permite tener tiempo para estudiar las condiciones adecuadas para el manejo de tortugas marinas en cautiverio y el desarrollo de programas de concienciación ambiental para la comunidad local.
Durante la temporada de anidación de 2006, un nido de tortugas carey procedente de la playa principal del sector Arrecifes (11º 20’ 15" N - 73º 58' 44" O) se reubicó en el criadero 45 días después de la oviposición. Los neonatos de tortuga (n = 92, éxito de eclosión 85.7%, incubación 62 días) se mantuvieron en estanques de 500 l al aire libre con una densidad de 30-31 individuos por estanque con cambios diarios (siempre que fue posible) de agua y se expusieron a 12 h luz/12 h oscuridad, de acuerdo con el ciclo circadiano local. Además, se usó un tanque de fibra cubierto con una capacidad de 8.94 m3 (8940 l), un área de 8.13 m2 y que disponía de un mecanismo de filtración físico-químico-biológico para el mantenimiento de la calidad del agua; subdividido en dos o tres secciones mediante barreras móviles de red de plástico.
Las tortugas se mantuvieron en agua a una temperatura aproximada de 25 °C, salinidad de 39.2-39.7 y un pH promedio de 8.05 ± 0.33, condiciones adecuadas para el mantenimiento de especies acuáticas en un sistema cerrado de una zona tropical (Adey y Loveland, 2007). El agua se obtuvo en la bahía de Gaira (Santa Marta, Colombia), la cual presenta un patrón de circulación en superficie que permite el recambio constante de las aguas dentro de la bahía (Franco-Herrera, 2005). El sistema (tanque, superficies y estructuras accesorias) se desinfectó periódicamente con hipoclorito de sodio comercial y abundante agua fresca.
Comenzando al sexto día después de la eclosión se alimentó a las tortugas dos veces al día ad libitum con músculo de pescado de especies regionales como: Opisthonema oglinum, Mugil incilis, Scomberomorus brasiliensis, Ocyurus chrysurus y Sicydium sp. y, ocasionalmente, camarones (Litopenaeus vannamei), calamares (Loligo sp.) y cangrejos (Callinectes sp.). Estas condiciones se mantuvieron hasta el quinto mes de edad (172 días después de la eclosión), cuando la nidada (n = 92) se dividió en dos grupos, con 46 individuos por grupo, para evaluar los efectos de los dos tipos de alimentos comerciales.
Al comienzo del experimento, los individuos tenían un tamaño medio de 12.5 ± 0.1 cm de longitud recta del caparazón (LRC) y una masa corporal de 305.14 ± 54.68 g. No se registró la temperatura de incubación de la incubación que hubiera permitido estimar la proporción de sexos de las tortugas en el estudio; el sexo de los individuos no se consideró bajo el supuesto de que no hay diferencias morfométricas entre las tortugas marinas juveniles masculinas y femeninas (Kilic y Candan, 2014).
Morfometría
Para estimar el crecimiento de los especímenes durante el experimento, se midió la longitud recta del caparazón (LRC; Bolten, 1999) cada 10-16 días con una precisión de 0.1 cm, mientras que el peso de cada espécimen se registró usando una balanza semianalítica digital (precisión de 0.01 g y capacidad máxima de 4000 g). Anteriormente, en el quinto mes de edad, se fijó un número de dos dígitos (00, 01, 02... 92) en la segunda placa costal de cada individuo con fines de identificación. Los números fueron grabados sobre las capas superficiales de la placa usando un mini taladro eléctrico de percusión vibratoria (110 V) con una fresa de carburo (Discover - China).
Dietas experimentales
Para este estudio se utilizaron dos dietas comerciales con composición y concentración similar de vitaminas (Tabla 1), introduciendo estos pellets en la dieta de las tortugas a los cinco meses de edad (d 172 post-eclosión). El alimento A es una dieta ampliamente utilizada en la crianza de tilapia juvenil (Oreochromis sp.) en alta densidad. Consistía en partículas esféricas de color marrón claro (2.3 mm de diámetro) que flotaban en la superficie del agua y permanecían intactas durante aproximadamente dos horas. El alimento B es utilizado en el engorde de camaron. Consistía en granos cilíndricos gruesos, de color marrón oscuro (4.5 mm de longitud y 1.5 mm de diámetro); una vez en el agua, esos granos caían directamente al fondo, donde permanecían intactos durante largos períodos. El alimento A y el alimento B difirieron en la presencia de algunos aminoácidos esenciales y sales (Tabla 1), pero especialmente con respecto a la fuente de proteína. El alimento A se fabrica a partir de harina de pescado, mientras que el alimento B consiste en harina de calamar. Además, el alimento A incluía harina de trigo como aglutinante, mientras que el alimento B incluía harina de arroz.
Tabla 1 Composición, nutrientes y características de los pellets comerciales evaluados en este estudio como una dieta completa para las crías de tortuga carey. Los ingredientes que los diferencian en su composición se destacan en gris.
| Elemento / Item | Alimento A / Food A | Alimento B / Food B |
|---|---|---|
| Ceniza máxima (%) / Maximum ash (%) | 10 | 10 |
| Fibra máxima (%) / Maximum Fiber (%) | 6 | 4 |
| Bajo en grasa (%) / Low fat (%) | 4 | 6 |
| Humedad máxima (%) / Maximum Humidity (%) | 12 | 12 |
| Bajo en proteínas (%) / Low protein (%) | 38 | 35 |
| Aceite de soya y/o aceite de maíz / Soybean oil and/or corn oil | X | |
| Aceite de pescado / Fish oil | X | X |
| Aceite de calamar / Squid oil | X | |
| Ácido ascórbico (antimicrobiano) / Ascorbic acid (antimicrobial) | X | X |
| Ácido fólico / Folic acid | X | X |
| Arroz / Rice | X | X |
| Biotina / Biotin | X | |
| Antioxidantes BHT (2,6-di-tert-butil) -4-metifenol) oretoxiquina (6-etoxi-, 1,2-dihidro-2, 2,4-trimetil-quinolina) / BHT (2,6-di- tert-butyl) -4-metifenol) orethoxyquin (6-Etoxy-, 1,2-dihydro-2, , 2,4-trimethyl-quinoline)antioxidants | X | X |
| Carbonato de calcio / Calcium carbonate | X | |
| Cloruro de colina / Choline chloride | X | X |
| Cloruro de sodio / Sodium chloride | X | |
| Colesterol / Cholesterol | X | |
| Fosfato bicálcico desfluorado / Calcium phosphate bi de fluorinated | X | |
| Fosfato monosódico / Monosodium phosphate | X | |
| Harina de calamar / Squid meal | X | |
| Harina de pescado / Fish meal | X | |
| Harina de carne / Meat meal | X | |
| Lecitina / Lecitin | X | |
| Lisina / Lisina | X | X |
| Trigo/maíz molido/sorgo / Wheat/ground corn/sorghum | X | X |
| Metionina / Methionine | X | X |
| Niacina / Niacin | X | X |
| Sulfato u óxido de zinc / Zinc sulfate or oxide | X | X |
| Sulfato u óxido de manganeso / Manganese sulfate or oxide | X | X |
| Sulfato u óxido ferroso / Ferrous sulfate or oxide | X | X |
| Pantotenato de calcio / Calcium Pantothenate | X | X |
| Piridoxina / Piridoxin | X | X |
| Riboflavina / Riboflavin | X | X |
| Sulfato de cobre / Copper sulfate | X | X |
| Sulfato de magnesio / Magnesium sulfate | X | |
| Tiamina / Thiamine | X | X |
| Harina de soya / Soy bean meal | X | X |
| Pastel de algodón / Cotton cake | X | |
| Treonina / Threonine | X | |
| Vitaminas A, B12, E, / Vitamin A, B12, E, | X | X |
| Vitamina C / Vitamin C | X | |
| Vitamina D / Vitamin D | X | |
| Vitamina D3 / Vitamin D3 | X | |
| Vitamina K / Vitamin K | X | |
| Yodato de calcio y/o dihidroioduro de etilendiamina (EDDI) / Calcium iodate and/or EDDI | X | X |
| Costo (CO pesos/kg en febrero de 2007) / Cost (CO pesos/kg in February 2007) | $ 1997.5 | $ 2300.0 |
Para introducir los pellets en la dieta, la porción de músculo de pescado ofrecida a todo el grupo experimental de especímenes se redujo gradualmente desde aproximadamente 3 kg día-1 a 0 kg día-1, durante cinco días, aumentando al mismo tiempo la porción de alimento experimental. Después de 105 días más (es decir, 110 días en total), las tortugas fueron alimentadas con pellets dos veces al día, por la mañana y por la tarde.
La atención veterinaria de las enfermedades dermatológicas y sistémicas, sin relación alguna con el ensayo, llevó a la separación de varios individuos del experimento, los cuales sufrieron infecciones bacterianas y micóticas dérmicas causadas por agresiones que ocasionaron lesiones traumáticas (Bailey, 2008). Este tipo de infecciones aparentemente son comunes en tortugas marinas en cautiverio, favorecidas por el hacinamiento de los sistemas cerrados, en los que aumentan los incidentes de mordeduras y las condiciones de baja calidad del agua (Sison et al., 1990; Bailey, 2008; Chuen-Im et al., 2010). En este caso, esas lesiones se trataron diariamente con la aplicación tópica de antibióticos o soluciones antisépticas (p. ej., rifampicina, povidona, tintura de yodo en dilución 1:2, oxitetraciclina) y "baños de sol", lo que resultó en una regeneración progresiva de las heridas. En otros casos, estas enfermedades causaron estomatitis con una infección bacteriana secundaria, lo que llevó a la aplicación intravenosa de antibióticos de amplio espectro (p. ej., enrofloxacina 5 mg/ kg im cada 48 horas). Luego, los individuos que recibieron los antibióticos intravenosos fueron retirados del experimento debido a los efectos potenciales del tratamiento veterinario sobre el peso individual de las tortugas. Por lo tanto, las estimaciones presentadas aquí se basan en las mediciones realizadas con las 33 tortugas divididas en dos grupos: alimento A (n = 13) y alimento B (n = 20). Se presentan estimaciones para el resto de las tortugas alimentadas con proteína fresca, aquí llamado grupo pescado (n = 43), que no se compararon directamente con los grupos experimentales después de haber recibido tratamientos veterinarios que incluían antibióticos y medicamentos antiinflamatorios que podrían influir en su condición corporal.
El día 287 se cambiaron todas las tortugas a una dieta de músculo de pescado, algunos suplementos dietéticos, calamares y camarones. Además, antes de ser liberadas en el océano desde el sitio de anidación, 11 meses después de la eclosión, las tortugas fueron alimentadas con algas, camarones y cangrejos como alimento vivo.
Factor de condición
Con base en cada medición, se calculó el factor de condición (FC) individual de la siguiente manera:
Donde M es la masa individual, LRC es la longitud recta del caparazón y b es el coeficiente de regresión para la regresión entre la altura y la masa (b = 2.6043, Labrada- Martagón et al., 2010).
Tasas de crecimiento
Para este estudio, se definió el crecimiento como la diferencia en tamaño (LRC) o masa para cada individuo durante un intervalo de tiempo específico. Con base en Bjorndal et al. (2013a) y Casale et al. (2009), la Tasa de Crecimiento en Tamaño (TCT) se estima como
Donde n se refiere a un individuo específico, LRCnt es el tamaño de ese individuo (n) en un momento dado (t), y LRCnt-1 es el tamaño del mismo individuo en una medición previa realizada t días antes. Hubo un período de 10 a 16 días entre cada medición de la LRC. Usando un enfoque similar al de Pelegrín et al. (2003a) y Sampson et al. (2015), se estimó la tasa de crecimiento en peso (TCP) como el aumento de la masa del individuo a lo largo del tiempo, de acuerdo con la siguiente ecuación:
Donde Pnt-1 es el peso (gramos) del individuo en un momento dado (t), y Pnt-1 es el peso del mismo individuo en el momento de la medición anterior (t-1). Luego, el efecto de la dieta en la TCP y TCT de la tortuga se estimó mediante un ANOVA de medidas repetidas (alimento: A y B; Edad (días)), mientras que la normalidad se comprobó mediante el análisis de Shapiro-Wilk, utilizando el software STATISTICA 8.0 de Stat. Soft. Inc.
RESULTADOS
Aceptación y consumo.
Una vez que los alimentos experimentales fueron introducidos en la dieta, la respuesta de comportamiento varió entre los individuos. Para el grupo de alimento A, cuando las partículas se colocaron por primera vez en la superficie del agua, los postneonatos no mostraron una respuesta inmediata. Se acercaron de forma progresiva (minutos) y comieron algunos pellets. A medida que disminuía el tamaño de las porciones de músculo de pescado, aumentaba su interés por los pellets y la ingestión de los mismos. Para el alimento B, los granos inmediatamente llamaron la atención de los especímenes cuando cayeron por la columna de agua al fondo del estanque. En respuesta, desde la primera vez que se les dio este concentrado, las tortugas se movieron hasta el punto en que cayeron los granos, los mantuvieron en la boca varias veces y finalmente los mordieron y tragaron. En este caso, el tamaño de grano facilitó el escape de los trocitos de la alimentación a través de los bordes de la mandíbula.
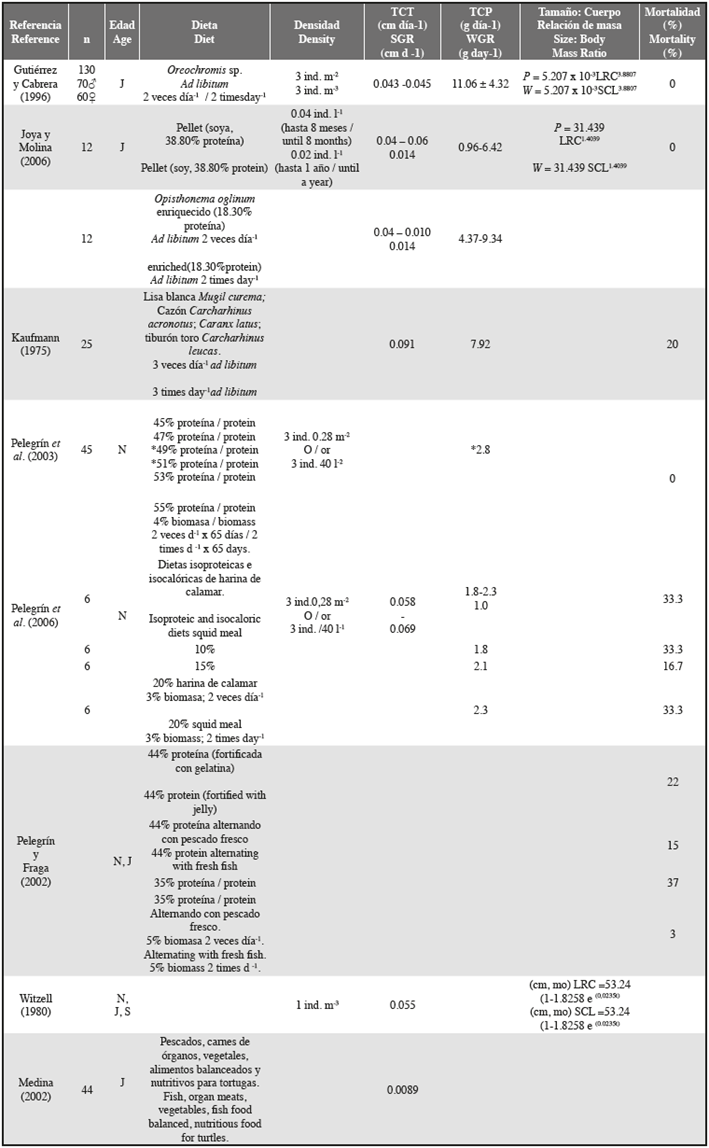
Cinco días después de que comenzara el ensayo, cuando se suspendió por completo el suministro de músculo de pescado y aumentó la oferta de alimentos experimentales, en general los individuos mostraron inapetencia. Luego, mostraron un aumento de la avidez, especialmente por el Alimento A. Estos granos, que flotaban en la superficie del agua, parecían llamar su atención y reducir el estrés generado por el cambio de dieta. Cuarenta y cinco días después del inicio del estudio, el consumo de grano aumentó desde 30 g (aprox. 0.7 g ind-1día-1) a más de 120 g por grupo. Posteriormente, el suministro de alimentos se duplicó, aunque la cantidad de alimentos consumidos no parecía cambiar. Esta medida se implementó para reducir la ansiedad y el estrés de los individuos que llegaron a atacarse entre ellos mismos. Este comportamiento es común en las crías de tortugas carey post-eclosión, probablemente debido a limitaciones de espacio en el tanque (obs. pers.), aunque las condiciones de densidad para este ensayo (6.4 - 11.2 ind. m-2), fueron cercanas o inferiores a las utilizadas en estudios similares con tortugas marinas en cautiverio (Tabla 2).
Reducción en los tamaños de la muestra.
Durante los experimentos, 16 (17.4%) crías murieron. Además, 43 se infectaron con enfermedades, fueron tratadas y se recuperaron por completo. Todas éstas fueron eliminadas de los análisis experimentales. De la muestra inicial de 46 por ensayo solo se consideran 13 (28.3%) individuos del grupo A y 20 (43.5%) del grupo B, para las estimaciones aquí presentadas.
Asimilación de los alimentos
Condición corporal y tasas de crecimiento
Para este estudio, el factor de condición presentó valores entre 8.56 y 10.43 x10-4. Para esta variable, el grupo alimentado con el Alimento B tuvo el rango de oscilación más alto, entre 9.55 x 10-4 (d 233) y 8.56 x 10-4 (d 286).
Tasas de crecimiento en peso y tamaño
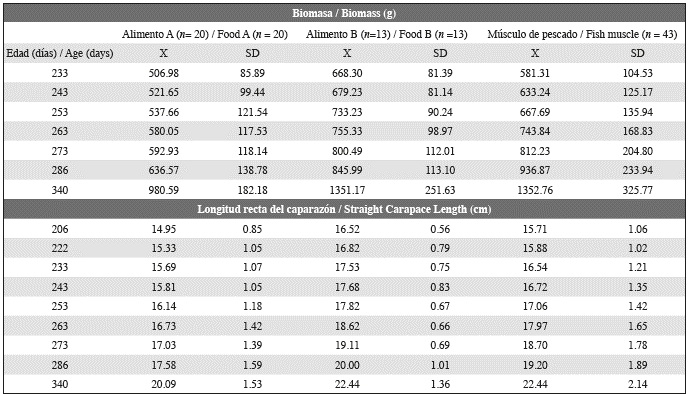
La tasa de crecimiento en tamaño (TCT) presentó valores entre 0.01 y 0.21 cm. día-1, con distribución normal (Shapiro-Wilk P = 0.96, P = <0.001), con un promedio de 0.03 ± 0.04 cm día-1. Los valores de TCT no mostraron una tendencia constante, sino que aumentaron o disminuyeron con cada medición (Figura 1).
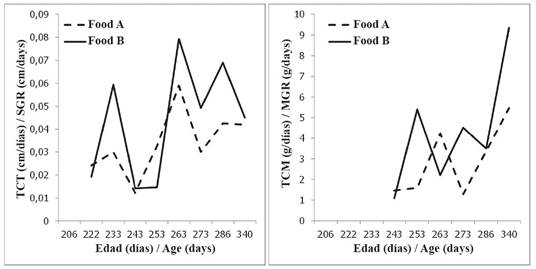
Figura 1 Tasas de crecimiento promedio en tamaño (TCT) y masa corporal (TCM) para los dos grupos experimentales (Alimento A, n: 30 individuos; Alimento B, n: 13 individuos) de juveniles de tortuga carey alimentados con dietas comerciales.
Además, la TCT disminuyó para todos los individuos entre la segunda y la última medición, como lo evidencia una tendencia general de desaceleración del crecimiento cuando los juveniles se acercaron a los 11 meses de edad (Figura 2). Una prueba ANOVA de medidas repetidas evidenció (Tabla 3) diferencias significativas relacionadas tanto con la dieta experimental como con la fecha (edad) de la medición. Sin embargo, sólo en el caso de las dietas experimentales apareció una clara diferencia entre los grupos experimentales, con los individuos alimentados con Alimento B mostrando una TCT más alta
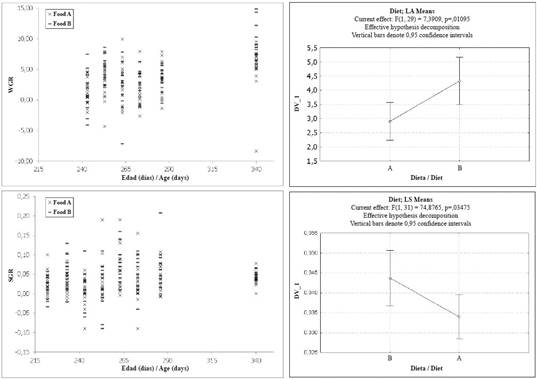
Figura 2 Tasas de crecimiento en tamaño (TCT) y peso (TCP) para dos grupos experimentales (Alimento A, n: 30 individuos; Alimento B, n: 13 individuos) de juveniles de tortuga carey alimentados con dietas comerciales.
Tabla 3 Análisis de varianza de medidas repetidas para los valores de la TCT y TCP para dos grupos experimentales de tortugas carey alimentadas con dos dietas diferentes (A y B); las mediciones se realizaron en seis momentos diferentes (edad) durante casi los tres meses que duró el experimento.
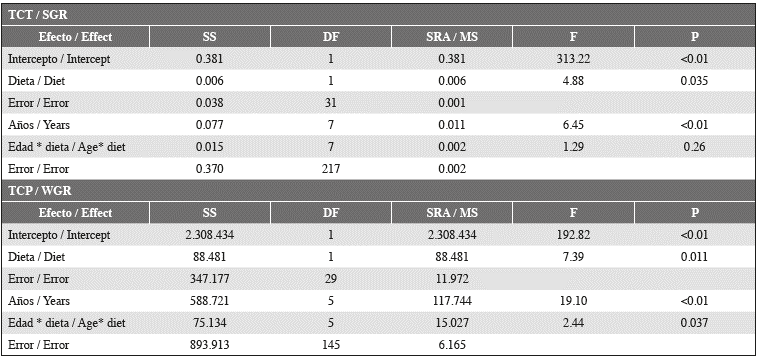
Las tasas de crecimiento en peso para los grupos experimentales presentaron valores entre 8.37 y 14.90 g día-1, con distribución normal (Shapiro-Wilk P = 0.987, P = 0.086) con un valor promedio de 3.4 ± 3.4 g día-1. Los valores medios mostraron diferencias significativas entre los grupos (prueba t, valor t = 2.42, P = 0.016, df = 193), siendo más altos en el grupo alimentado con el Alimento B (4.13 ± 3.079 g día-1) que con el Alimento A (2.92 ± 3.079 g día-1). Un ANOVA de medidas repetidas (Tabla 3) evidenció que tanto la dieta como la edad (es decir, la fecha en que se tomó la medición) de los individuos tuvieron un efecto en los valores de la TCP, aunque el efecto relacionado con la dieta fue menor. Los valores de la TCP no mostraron una tendencia general, excepto por un aumento general desde el momento en que finalizó el experimento y en el grupo completo de las tortugas que se alimentaron con proteína fresca.
Análisis de varianza de la masa corporal individual
Se comparó el peso individual, considerando como factores explicativos el período de experimentación y las diferentes dietas probadas. Esto nos permitió establecer diferencias significativas entre los individuos (ANOVA, df = 5, P <0.001) condicionadas por la dieta y el tiempo de medición (inicial vs. final). El modelo de ANOVA propuesto explicó 87% de la variación (R2). La estimación de los componentes de la varianza muestra que 83% de la varianza se debe a la edad (día) en que se midieron los individuos en lugar de a los grupos experimentales.
Mientras tanto, un análisis de contrastes de las diferencias de peso entre individuos mostró que la masa de los especímenes alimentados con el Alimento A difería significativamente de los que se alimentaban de músculo de pescado y Alimento B. Desde este punto de vista, el aumento de peso observado en este estudio también se vio influenciado por diferencias en el desarrollo debido a los individuos. Al final del período de cautiverio, los individuos presentaron un tamaño promedio (LRCmax) y un peso de 21.8 ± 2.1 cm y 1255.61 ± 323.72 g, respectivamente (Tabla 4).
DISCUSIÓN
Las tortugas carey tienen un pico estrecho y cerrado que proporciona fácil acceso a las grietas; son consideradas como una especie oportunista que se alimenta de la epibiota de esponjas y corales (Witzell, 1983). Aunque tienen una fuerte preferencia por los invertebrados (León y Bjorndal, 2002; Carrión et al., 2013), varios estudios basados en el análisis del contenido del estómago muestran abundancia de macroalgas (Bell, 2013). Debido a esto, las tortugas carey se describen hoy en día principalmente como especie consumidora de macroalgas, y segundo, como una omnívora. Desde este punto de vista, replicar una dieta óptima para las crías post-eclosión y los ejemplares juveniles en cautiverio representa un desafío. En estas etapas, las tortugas marinas se caracterizan por altos requerimientos de proteínas y carbohidratos (Pelegrín et al., 2003a; Bell, 2013).
A pesar de estas restricciones, los valores del tamaño corporal (16.3-26.8 cm LRC) y la masa corporal (648.29- 2221.95 g) obtenidos al final de este estudio son similares a los obtenidos en estudios previos para el mantenimiento de las crías de tortuga carey. Por ejemplo, Joya y Molina (2006) registraron valores de LRC entre 22.5 y 24.9 cm y una masa entre 943.44 g y 1318.08 g para los individuos de once meses. Los resultados de este trabajo para la LRC y masa sobrepasan tales rangos. Esto puede estar relacionado con el mayor número de individuos utilizados en este estudio, los cuales procedían del mismo nido. Ambos elementos podrían aumentar la heterogeneidad del tamaño y la masa de los especímenes.
Gutiérrez y Cabrera (1996) registraron una masa corporal promedio de 1521 ± 280 g y 1534 ± 253 g y un LRC de 23.60 ± 1.88 cm y 20.20 ± 1.57cm para dos grupos de 130 juveniles de tortuga carey (Tabla 2) a los 11 meses de edad. Los valores de la LRC son similares a los obtenidos en este estudio, pero la masa es >250 g más alta. Gutiérrez y Cabrera (1996) usaron una dieta de músculo de pescado (Oreochromis sp.) durante todo el proceso de la cría en cautiverio.
El uso de dietas basadas solo en alimentos artificiales como en este estudio, condujo a un menor desarrollo corporal (peso) y también tuvo un efecto en las tasas de crecimiento en tamaño. El ámbito de TCT (0.01 y 0.21 cm día-1) fue inferior al obtenido por Gutiérrez y Cabrera (1996) o Joya y Molina (2006). Nuestros resultados son consistentes con las observaciones realizadas por Joya y Molina (2006), quienes concluyeron que un pellet hecho de proteína animal puede promover diferencias en las tasas de crecimiento y la condición corporal de los individuos. Los valores de la TCP registrados en nuestro estudio están por debajo de los de otros estudios donde los individuos fueron alimentados con proteína fresca y suplementos formulados (consulte la Tabla 2). Además de valores en tasas de crecimiento más bajos obtenidas por las dietas experimentales que se probaron en este estudio, se observaron valores significativamente más altos tanto para la TCT como para la TCP obtenidas para los individuos alimentados con pellets basados en harina de calamar (alimento B). Este hallazgo concuerda con las estimaciones de Pelegrín et al. (2006), quienes encontraron que las dietas basadas en esta fuente de proteína promovían valores más altos de TCP.
Además, se encontró que los valores máximos de la TCP (11.35 g día-1) corresponden a aquellos individuos alimentados con proteína fresca. Este hallazgo concuerda con los resultados registrados por Gutiérrez y Cabrera (1996), quienes evidenciaron que la alimentación con proteína fresca incrementa el desarrollo corporal (masa) de las tortugas cautivas. Cuando los individuos son alimentados con proteína fresca después de un largo período de consumir alimentos artificiales, responden aumentando excesivamente su consumo, lo que promueve tasas de crecimiento más altas y rápidas.
De otro lado, la cantidad de alimento A y alimento B consumida por las tortugas se vio influenciada por la visibilidad en la columna de agua, lo que dependía de la frecuencia de mantenimiento de los tanques. Cuando la visibilidad dentro del tanque se reducía al mínimo, después de dos o tres días de no cambiar el agua a consecuencia de las limitaciones logísticas o de mantenimiento del sistema de reservorio, las tortugas no comieron y mostraron mayor estrés y agresividad.
El nivel de consumo de alimentos también está influenciado por el acceso de cada individuo a los alimentos; esto a su vez depende de cuánto compita con otros o de los riesgos a que ha de enfrentarse para adquirirlo. En el caso de las tortugas marinas, el tamaño individual influy aparentemente en el crecimiento de los individuos y tiene un efecto indirecto en la edad a la que alcanzan la madurez reproductiva (Bjorndal et al., 2013a). Los individuos más pequeños de un grupo crecen a un ritmo más lento, no sólo porque están genéticamente predispuestos a hacerlo, sino también porque su condición corporal limita su capacidad para acceder a los alimentos. Bjorndal et al. (2013a) describieron esta situación comparando la tasa de crecimiento y la talla de madurez sexual en ejemplares de C. mydas en cautiverio en las islas Caimán. Esto podría explicar por qué las diferencias de masa corporal obtenidas en los grupos experimentales de este estudio fueron mejor explicadas por los especímenes que por la dieta proporcionada. Desde este punto de vista, se requieren nuevos enfoques que evalúen la asimilación individual, pero también que consideren la competencia entre los individuos por los alimentos y los costos de energía asociados con el proceso de alimentación.
Shaw et al. (1989) llamaron la atención sobre la necesidad de tener precaución en el uso exclusivo de alimentos comerciales para el mantenimiento de las tortugas marinas. Argumentaron que el uso de productos derivados de la soya como fuente de proteínas en muchas de estas formulaciones plantea riesgos para la salud de los reptiles debido a las altas concentraciones de fitoestrógenos, genisteína y diadzeína. Estos compuestos presentan una acumulación progresiva, y la actividad en el torrente sanguíneo, lo que puede causar trastornos hepáticos, depresión de la glándula pituitaria o alteraciones en el desarrollo sexual. Joya y Molina (2006) registraron una menor eficiencia al utilizar un pellet basado en un compuesto derivado de esta oleaginosa; sus resultados mostraron una menor palatabilidad de los alimentos y dificultades de digestibilidad para algunos de sus componentes. Se debe tener en cuenta aquí que, aunque los alimentos probados en este ensayo tenían ingredientes derivados de la soya, ésta no es la base de su composición. Desde este punto de vista, se presume que la soya no representaba un riesgo para la salud de las tortugas; además, no existen evidencias que relacionen los resultados obtenidos con la presencia de harina de soya en la composición de los alimentos probados en este estudio. Sin embargo, hay estudios que evidencian un efecto positivo del uso de la soya para el mantenimiento de los reptiles. Zhou et al. (2016) registraron que la sustitución del 30% de la comida fresca por un concentrado de proteína de soya es factible, siempre que en todo momento se le añade la enzima fosfatasa (fitasa).
La selección de un alimento debe considerar la posible palatabilidad de la dieta para las especies de interés, que depende no solo de su composición sino también de la asimilación de nutrientes por parte de los individuos, tanto de forma individual como en combinación con otros alimentos (Espinosa y Labarta, 1987). Para los alimentos artificiale utilizados para las tortugas marinas, no hay estimaciones con respecto a los factores que podrían influir en la palatabilidad de los alimentos artificiales, lo que hace que la palatabilidad deba considerarse en estudios futuros. Con base en estos resultados, los programas de conservación que puedan considerar el mantenimiento en cautiverio de juveniles o crías post-eclosión de tortugas marinas, deben evaluar la respuesta de los animales a los alimentos artificiales en las etapas tempranas, e incluir en su dieta elementos de alta preferencia para estas especies, como camarón o músculo de pescado.
Las dietas basadas exclusivamente en alimentos procesados deben considerar la composición de dichas mezclas (concentraciones de proteína superiores a 40%) y los costos logísticos y económicos asociados. En términos económicos, en marzo de 2007, el Alimento A costaba COP $ 1997.5 (US $ 0.79) por kilogramo, mientras que el Alimento B costaba COP $ 2300 (US $ 0.91) por kilogramo. Mantener un consumo semanal de 250 g/individuo para un grupo de 100 tortugas de seis meses costaría menos de COP $ 500/semana (US $ 0.2/ semana). Se necesitarían aproximadamente 18 kg de músculo de pescado para alimentar a 100 tortugas de seis meses durante una semana, lo que costaría aproximadamente COP $ 25000/ semana (US $ 9.94/semana), mucho más que el costo de los pellets. Además, la palatabilidad de los alimentos y la avidez por los mismos de las especies de interés deben evaluarse en el momento en que se ofrece el alimento a los individuos. Según nuestros resultados, los alimentos artificiales que probamos no son adecuados para utilizarse como dietas exclusivas para las crías de E. imbricata. Sin embargo, la presencia de aminoácidos y vitaminas en estos compuestos, y su bajo costo, pueden hacerlos viables como un elemento complementario para las tortugas, especialmente si los alimentos incluyen más de 40% de proteína animal y harina de calamar en su composición. Por lo tanto, existe la necesidad de ejecutar nuevos estudios que midan los efectos de las dietas compuestas de diferentes mezclas de comidas frescas y artificiales, o aplicadas a diferentes edades, sobre el crecimiento y la fisiología de las tortugas marinas en cautiverio.











 texto en
texto en