INTRODUCCIÓN
El estrecho de Gerlache es parte de la región costera occidental de la Península Antártica, en donde los vientos y tormentas tienen poca influencia y la entrada de agua dulce debido al deshielo incrementa la estabilidad de la superficie de la columna de agua, lo que lleva a una mayor productividad (Smith Jr et al., 1987; Holm-Hansen y Mitchell, 1991; Lancelot et al., 1993; Smith et al., 1996; Isla et al., 2002; Varela et al., 2002; Ducklow et al., 2012). Esta localidad ha sido considerada por varios autores como área principal de forrajeo para numerosos grupos taxonómicos y, por lo tanto, ha sido de interés permanente para la investigación en la Antártica (Hopkins et al., 1985; Brinton, 1991; Huntley y Brinton 1991; Huntley et al., 1991; Whitehouse y Veit, 1994; Zhou et al., 1994; Fraser y Trivelpiece, 1996; Ross et al., 1996; Cabal et al., 2002; Silva et al, 2001).
Considerando la clasificación de biomas marinos de la Antártica, desarrollada por Treguer y Jacques (1992), el estrecho de Gerlache forma parte del ecosistema de la plataforma continental, que se caracteriza por tener altos niveles de biomasa de fitoplancton durante primavera y verano (Smith Jr y Nelson, 1986; Holm-Hansen y Mitchell, 1991; Varela et al, 2002; Ballerini et al, 2014). Además del krill, uno de los grupos taxonómicos que aprovecha la disponibilidad de fitoplancton en esta región son los copépodos, con un impacto de alimentación de hasta 65% de la producción primaria local diaria y un redireccionamiento mediante materia fecal de más de 22% del flujo total de carbono en el área (Gleiber et al., 2012). Estas características hacen de los copépodos un grupo taxonómico clave en la dinámica del ecosistema pelágico de esta región (Gleiber et al., 2016).
La zona occidental de la Península Antártica, sector en donde se encuentra el estrecho de Gerlache, es uno de los lugares en donde se ha registrado la mayor tasa cambio térmico en el planeta originado por el calentamiento global (Vaughan et al., 2003). Esta variación térmica ha provocado un cambio significativo en la estructura de todos los niveles taxonómicos de la trama trófica pelágica (Montes-Hugo et al., 2008; Stammerjohn et al., 2008). En particular, los análisis de series de tiempo de la composición del zooplancton indican que la abundancia de copépodos en esta región ha estado aumentando significativamente durante las últimas dos décadas (Ross et al., 2008, 2014; Steinberg et al., 2015), cambio que puede llegar a tener un efecto significativo en la eficiencia de la bomba biológica (Steinberg et al., 2012). Incluso, se ha presentado evidencia que la zona occidental de la península Antártica, ha pasado de ser un sistema dominado por la herbivoría de los eufaúsidos a un sistema dominado por la herbivoría del microzooplancton (Sailley et al., 2013). En este nuevo escenario, los copépodos actuarían como vínculo directo entre los dos sistemas descritos, debido a su estrategia de alimentación flexible que les permite alimentarse de diatomeas o de micro-zooplancton (Gleiber et al. 2016).
El conocimiento sobre las comunidades de copépodos epipelágicos en el estrecho de Gerlache sigue siendo limitado. Por lo tanto, en el presente estudio se registra la biomasa del mesozooplancton y la estructura del ensamblaje de copépodos epipelágicos en el estrecho durante el verano austral de 2015.
MATERIALES Y MÉTODOS
Área de estudio
La topografía e hidrografía general del Estrecho de Gerlache ha sido resumida por García et al. (2002) y Zhou et al. (2002, 2006). El Estrecho de Gerlache está ubicado en la zona occidental de la Península Antártica, entre el archipiélago Palmer y la costa Danco. Tiene casi 200 km de largo y 50 km de ancho en el lado norte y 10 km de ancho en el lado sur; forma la conexión occidental más profunda entre el mar de Bellingshausen (BS) y el estrecho de Bransfield (BSt) (Figura 1). Sin embargo, cerca de la entrada suroccidental, el estrecho de Gerlache tiene fondos inferiores a los 350 m, que restringen la influencia de gran escala de la corriente circumpolar antártica.
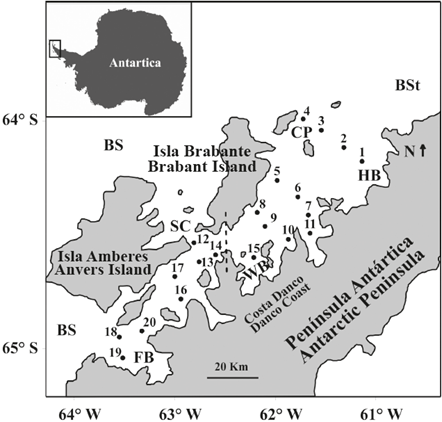
Figura 1 Mapa del área de estudio que muestra las estaciones de muestreo de zooplancton en el estrecho de Gerlache durante la primera Expedición Colombiana a la Antártica. La línea punteada divide el Estrecho en una sección norte (estaciones 1 a la 11, incluyendo la 15) y una sección sur (estaciones 12 a la 20, excluyendo la 15). BS: Mar Bellingshausen, BSt: Estrecho de Bransfield, SC: Canal Schollaert, FB: Bahía Flandres, WB: Bahía Wilhelmina, HB: Bahía Hughes, CP: Pasaje Crocker.
La columna de agua típica del área suroccidental del estrecho de Gerlache está dominada por agua superficial antártica y agua profunda circumpolar local subyacente. Mientras que el área nororiental tiene una capa superior de aguas zonales transicionales con influencia del Mar de Bellingshausen y una capa subyacente de aguas zonales transicionales con influencia del Mar de Weddell, con intrusión intermedia limitada de agua profunda circumpolar local (García et al., 2002). La corriente superficial principal es la Corriente del estrecho de Gerlache, que avanza hacia el nororiente en el centro del canal profundo del estrecho, superando 30cm s-1. Su flujo principal, que alimenta la corriente del estrecho de Bransfield, podría generar la advección de una partícula del Estrecho en 7 a 10 días. Sin embargo, en las bahías somera, o en los alrededores de las islas del estrecho de Gerlache, las partículas quedarían atrapadas dentro de corrientes de vórtice anticiclónicas durante más de 70 días (Zhou et al, 2002, 2006; Jiang et al, 2013).
Recolección de muestras
Se realizaron capturas de zooplancton en el estrecho de Gerlache entre el 17 y el 22 de enero de 2015, a bordo del "ARC 20 Julio", como parte de la "Expedición Caldas", la primera expedición del programa colombiano en la Antártica. El zooplancton para el análisis de copépodos se recolectó en 20 estaciones que abarcaban las porciones norte y sur del estrecho de Gerlache (Figura 1) con arrastres oblicuos desde los 100 m hasta superficie empleando una red de marco circular de 0,7 m de diámetro y con malla de 200 |im, equipada con un medidor de flujo digital Hydro Bios y un copo no filtrante. La velocidad de arrastre fue de cerca de 5,6 km h-1, y se calcularon los volúmenes de agua filtrada, teniendo en cuenta la velocidad neta y el flujo. A bordo, las muestras de zooplancton se preservaron en una solución de formalina tamponada con bórax a 4%, hasta que se realizó su análisis en Colombia. Los perfiles verticales de temperatura y salinidad se tomaron con un CTD-19 y CTD-25 SeaBird® unidos a un sistema de carrusel.
Análisis de muestras
Se analizó un total de 20 muestras. Las muestras preservadas en formaldehído se dividieron, y un cuarto de la muestra se empleó para realizar la clasificación de copépodos y otro cuarto para determinar las biomasas de zooplancton secando lotes a 60° C y pesándolos en una microbalanza (0,0001g) (Postel et al., 2000). Estos valores luego se multiplicaron por 1,25 para ajustar la pérdida de tejido en el formaldehído (Hopkins, 1971). La identificación taxonómica de los copépodos se realizó mediante microscopía óptica hasta el nivel de especie (Razouls et al., 2019). Se construyeron gráficos para describir la variación espacial de la biomasa de zooplancton, de la abundancia total de copépodos (teniendo en cuenta las etapas de desarrollo), y de la abundancia de cada especie identificada en el área de estudio.
Se creó una representación gráfica de la estructura salina y térmica del estrecho de Gerlache durante el periodo de muestreo mediante interpolaciones, usando el método de kriging en el programa Surfer®. Teniendo en cuenta las condiciones geomorfológicas e hidrodinámicas descritas para el estrecho de Gerlache por Zhou et al. (2002), así como la estructura salina y térmica de la capa superficial de la columna de agua durante el periodo de muestreo, el estrecho se dividió en dos secciones: una norte que se comunica directamente con el estrecho de Bransfield y una sur que tiene una conexión restringida con el mar de Bellingshausen (Figura 1), con el propósito de comparar la temperatura, salinidad, biomasa de mesozooplancton y abundancia de copépodos en los 100 m superiores de la columna de agua utilizando una prueba de comparación de Mann-Whitny.
La estructura del ensamble se evaluó en términos de la abundancia (ind 1000 m-3) de las especies que fueron identificadas en las muestras utilizando un gráfico de rango/abundancia de Whittaker (Krebs, 1999). Además, se construyó una matriz de similitud basada en los datos de abundancia transformados con log (Log10 X +1). Se usó esta transformación para reducir la importancia de las especies dominantes y para aumentar la ponderación de las especies más raras (Clarke y Warwick, 2001). Se realizó un análisis de similitud (ANOSIM) para establecer la importancia de la agrupación a priori (Clark, 1993; Clarke y Warwick, 1994). Finalmente, se realizó un análisis de ordenación de escalamiento multidimensional no métrico (MDS) para representar gráficamente las relaciones de la estructura de los ensamblajes (Clarke y Ainsworth, 1993). Teniendo en cuenta las agrupaciones establecidas previamente, se realizó un análisis Simper para determinar qué especies contribuyen a la similitud dentro de cada grupo y a la disimilitud entre grupos (Clarke y Warwick, 2001). Estos análisis se realizaron utilizando el software Primer®.
RESULTADOS
Condiciones de temperatura y salinidad del área de estudio
La temperatura media del agua de 0 a 100 m de profundidad fue significativamente más alta en la sección norte que en la sección sur del estrecho de Gerlache durante el período de muestreo. Así mismo, la columna de agua de la cual se tomaron muestras en la sección norte estuvo estratificada térmicamente, con un ámbito de variación térmica equivalente a 1,2° C, mientras que la sección sur estuvo térmicamente homogénea, con un ámbito de variación de solo 0,2°C entre 0 y 100 m de profundidad (Figura 2). La salinidad media del agua de 0 a 100 m de profundidad fue similar en ambas secciones del estrecho. Además, por debajo de 30 m de profundidad, la columna de agua exhibió fuertes condiciones de estratificación salina en ambas secciones. Sin embargo, en la sección sur del estrecho se detectaron aguas superficiales con baja salinidad (Figura 2).
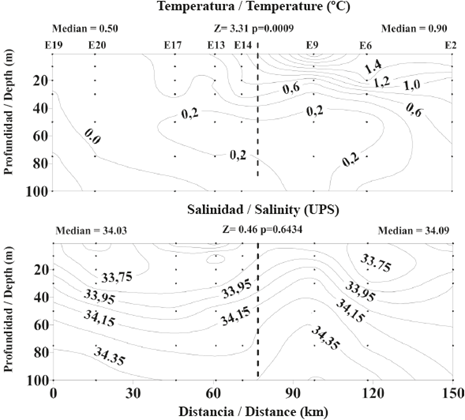
Figura 2 Variación espacial en temperatura (°C) y salinidad (UPS) en la zona superficial (0 a 100 m) de la columna de agua a lo largo de un eje longitudinal en el estrecho de Gerlache durante la primera Expedición Colombiana a la Antártica. La línea punteada divide el estrecho en una sección norte (derecha) y una sección sur (izquierda). Se registra el valor medio de la temperatura y salinidad en cada sección del estrecho.
Biomasa del mesozooplancton y abundancia de copépodos
La biomasa promedio del mesozooplancton fue de 125,89 ± 82,07 mg peso seco/m2 en la sección norte del Estrecho de Gerlache y de 123,98 ± 44,29 mg peso seco/m2 en la sección sur del estrecho. No se detectaron diferencias significativas en la biomasa del mesozooplancton entre las secciones del estrecho (MW, Z = -1,23, p = 0,2380). Sin embargo, la biomasa del zooplancton entre el pasaje Crocker y la bahía Hughes (sección norte externa) fue un orden de magnitud menor que en las estaciones cercanas a la bahía Flandres (sección sur externa), aunque la mayor biomasa (1,02 g peso seco/m2) se observó a la entrada de la bahía Wilhelmina, en la porción central del Estrecho (Figura 3A).
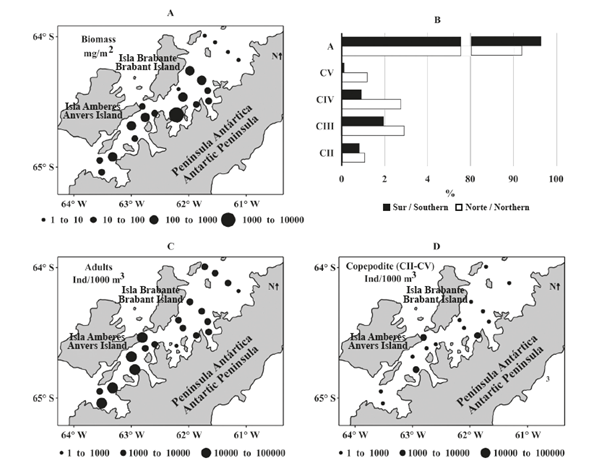
Figura 3 Variación espacial de biomasa del zooplancton y abundancia de copépodos (copepoditos y adultos) en el estrecho de Gerlache durante la primera Expedición Colombiana a la Antártica. A. Biomasa. B. Etapa de desarrollo. C. Abundancia de adultos. D. Abundancia de copepoditos.
Más de 92% de los copépodos recolectados en ambas secciones fueron adultos (Figura 3B) y la proporción de etapa de desarrollo no fue diferente entre las secciones norte y sur (X2 = 55,2; p = 0,0001). La abundancia de copépodos adultos en la sección norte fue un orden de magnitud menor que en la sección sur del estrecho de Gerlache (MN, Z = - 2,78; p = 0,0055), con las abundancias más altas registradas en la entrada del canal Schollaert, que comunica al estrecho con el mar de Bellingshausen y la bahía de Flandres, ambos lugares ubicados en la sección sur del estrecho (Figura 3C).
Ensamblaje de copépodos
En el área de estudio se identificaron en total 17 especies de copépodos pertenecientes a 4 órdenes y 13 familias (Tabla 1). Se identificaron etapas de copepoditos, desde copepodito II (C2) hasta copepodito V (C5), para Oithona similis (C2, C4, C5), Calanoides acutus (C2, C3, C4), Alteuta potter (C2, C3, C4), Subeucalanus mucronatus (C3, C4), Calanus propinquus (C4), y Clausocalanus laticeps (C4). Sin embargo, solo se consideraron los copépodos adultos para el análisis de la estructura del ensamblaje (Figura 4).
Tabla 1 Copépodos epipelágicos recolectados durante la primera Excursión Colombiana a la Antártica en el estrecho de Gerlache durante el verano austral de 2015. ID: acrónimo. *Razouls et al. (2019).
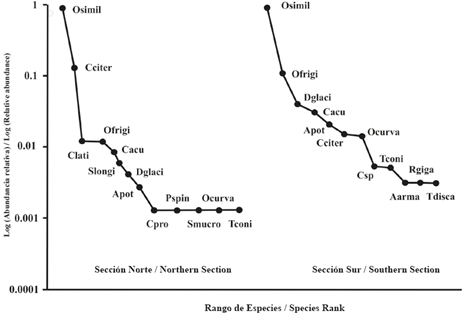
Figura 4 Estructura y composición del ensamblaje de copépodos en la zona epipelágica del estrecho de Gerlache durante la primera Expedición Colombiana a la Antártica.
En términos de abundancia, el ensamblaje de ambas secciones del estrecho de Gerlache estuvo dominado por Oithona similis (Figura 4). La abundancia de esta especie fue un orden de magnitud mayor que la de Oithona frigida, Ctenocalanus citer, Drescheriella glacialis y Calanoides acutus y tres órdenes de magnitud mayor que la de Aetideus armatus, Calanus propinquus, Phaenna spinifera, Rhincalanus gigas, Subeucalanus. mucronatus y Temora discaudata que fueron las especies de copépodos menos abundantes en el estrecho durante el periodo de muestreo (Figuras 4 y 5).
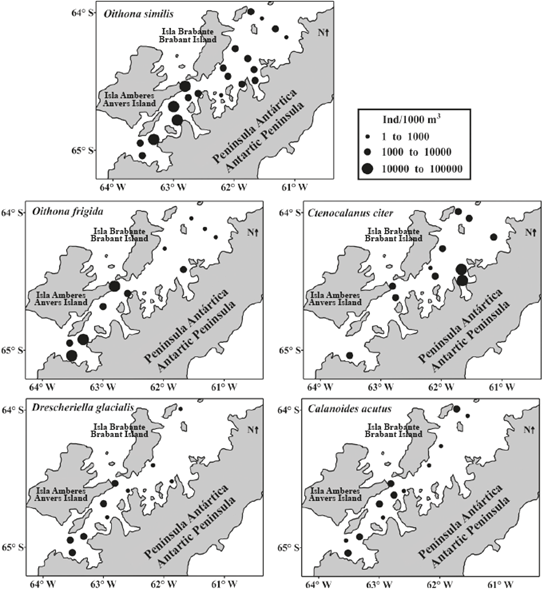
Figure 5 Variación espacial de las especies más frecuentes (frecuencia > 50%) y abundantes de copépodos en la zona epipelágica del estrecho de Gerlache durante la primera Expedición Colombiana a la Antártica.
Fueron evidentes grandes diferencias multivariadas en la estructura de los ensamblajes de copépodos entre las secciones del estrecho de Gerlache (Figura 6). Es decir, en el gráfico del análisis nMDS el ensamblaje en la sección sur (Figura 6: círculos negros) se ubicó en la parte superior izquierda del ensamblaje de la sección norte (Figura 6: círculo blanco). Así mismo, las comparaciones pareadas sugirieron que la composición de los ensamblajes de copépodos difirieron significativamente entre la sección sur y norte del estrecho de Gerlache (Anosim, R = 0,31; p = 0,01).
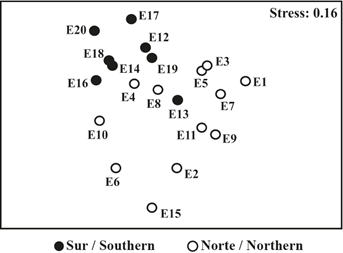
Figura 6 Gráfico de escalamiento multidimensional no métrico (nMDS) del ensamblaje de copépodos epipelágicos en el estrecho de Gerlache durante enero de 2015 (sección norte n = 12, sección sur n = 8).
Las comparaciones de los porcentajes de disimilitud de Bray-Curtis (prueba de Simper) respaldaron esta interpretación. Las diferencias entre las secciones norte y sur del estrecho de Gerlache fueron del 52%, generadas por la contribución de O. frigida, C. acutus, D. glacialis y C. citer (Tabla 2). Adicionalmente, el porcentaje de similitud de Bray-Curtis en la sección sur fue de 57,2% y en la sección norte fue de 67,8% (Tabla 2).
DISCUSIÓN
Con excepción de Aetideus armatus, todas las especies de copépodos registradas en los 100 m superiores del estrecho de Gerlache durante el verano de 2015, han sido citadas previamente en la región de la península Antártica (Hopkins, 1985; Calbet et al., 2005; Gleiber, 2014; Kouwenberg et al., 2014). Este parece ser el primer registro de esta especie en la región occidental de la Antártica, específicamente en la sección sur del estrecho.
La biomasa promedio de mesozooplancton se ubicó en el ámbito de los valores citados en la literatura sobre la región Occidental de la Península Antártica, incluyendo el estrecho de Bransfield y el de Gerlache, en la temporada de verano (Hernández-León et al., 1999, 2000; Cabal, 2002; Calbet et al., 2005). De acuerdo con estudios previos, el mar de Nueva Escocia y las aguas de la plataforma de la península Antártica se caracterizan por una biomasa de mesozooplancton inesperadamente muy variable (Hernández-León et al., 2000, 2013; Cabal et al., 2002; Ward et al., 2004, 2005; Calbet et al., 2005; Gleiber, 2014). Por lo tanto, la baja biomasa de mesozooplancton registrada durante el inicio de la primavera en la región podría estar indicando un retraso en la floración de la primavera debido a la variabilidad temporal de la radiación solar, la variabilidad en el surgimiento del agua subsuperficial rica en hierro, el aumento de la temperatura del agua de mar o una tasa variable de deshielo (Smith et al., 1998; Ducklow et al., 2007; Marrari et al., 2008).
El ensamblaje de copépodos epipelágicos en el estrecho de Gerlache fue un poco variable durante enero de 2015, con una especie dominante en común para todo el estrecho, pero una estructura de ensamblaje sugestivamente diferente en cada sección. Oithona similis fue numéricamente la especie más abundante en todo el estrecho durante el período de muestreo. Esta especie ha sido registrada en todos los sectores antárticos como un copépodo dominante en la parte superior de la columna de agua (Atkinson et al., 1996, 2012; Razouls et al., 2000; Giron, 2004; Ayón et al., 2007). En las muestras estudiadas, esta especie representó 80% de la abundancia relativa de copépodos en todas las áreas de estudio.
Además de Oitona similis, el ensamblaje de copépodos en la sección norte estuvo dominado por una especie Ciclopoidae pequeña (Oitona similis) y una especie Calanoidae pequeña (Ctenocalanus citer), mientras que la sección sur del estrecho de Gerlache estuvo dominada por dos especies pequeñas de Ciclopidae (Oitona similis y O. frigida), una especie de Heparticoidae asociada con el hielo marino (Drescheriella glaciales) y una especie grande de Calanoidae (Calanus acutus). Todos los copépodos pelágicos de tamaño pequeño registrados en nuestras muestras se alimentan de microplancton. Oitona similis y O. frigida se alimentan preferiblemente de ciliados de microzooplancton y microfitoplancton móvil (Nishida, 1985; Eiane y Ohman, 2004; Calbet y Saiz, 2005; Atkinson et al., 2012), mientras que C. citer se alimenta preferiblemente de fitoplancton de tamaño pequeño durante todo el año (Pasternak y SchnackSchiel, 2007). Por otro lado, el copépodo de gran tamaño C. acutus tradicionalmente se ha considerado como una especie principalmente herbívora y se considera un importante consumidor de la producción primaria en aguas antárticas (Huntley y Escritor, 1991; Pasternak y Schanck-Schiel, 2001; Calbet et al., 2006), mientras que el copépodo pequeño, D. glaciales, se alimenta de microfitobentos y diatomeas epífitas que crecen en asociación con el hielo marino (Schnack-Schiel et al., 2001).
Utilizando datos de los veranos de 1995 y 1996, Varela et al. (2002) describieron el Estrecho de Gerlache como uno de los cuerpos de agua más productivos de la península Antártica, donde la producción primaria oscilaba entre 0,87 y 4,54 g C m-2 d-1, la clorofila a entre 90 y 270 mg Chl a m-2, y el microplancton (> 10 μm) dominaba el fitoplancton, representando aproximadamente 80% de la clorofila total, mientras que el nanoplancton (2-10 μm) y el picoplancton (0,2-2 μm) representaban 7% y 15%, respectivamente, en los 50 m superiores. Esta fuente de energía puede ser direccionada por el zooplancton herbívoro de gran tamaño, como copépodos Calanoidae, sálpas o krill (Hernández-León et al., 2001; Bernard et al., 2012; Lee et al., 2013), para sustentar a las poblaciones de los principales depredadores, como aves marinas, focas y ballenas, y para inyectar materia orgánica particulada a aguas profundas o ecosistemas bentónicos a través de empaquetamientos fecales (Ducklow et al., 2007; Ross et al., 2008; Loeb y Santora, 2012; Steinberg et al., 2012).
Recientemente, se ha registrado un cambio en la composición de la comunidad fitoplanctónica del estrecho de Bransfield y el estrecho Gerlache, de grandes diatomeas a pequeñas criptofitas flageladas (Mendes et al., 2013, 2018). De acuerdo con nuestros resultados, el predominio de calanoides pequeños y ciclopoides por encima de calanoides grandes en el estrecho durante el verano de 2015 sugiere que su papel en el flujo de energía de esta área puede estar subestimado. Los copépodos de tamaño pequeño no solo son importantes por su número sino también por su impacto alimentario en la producción primaria y por su impacto en las poblaciones de microplancton flagelado (Froneman y Perissinotto, 1996; Caron et al., 2000; Garzio y Steingerg, 2013). Por lo tanto, una transición de diatomeas a criptofitas representa una disminución fundamental en el espectro del tamaño de la comunidad de fitoplancton, lo que promovería un incremento en la abundancia de copépodos de tamaño pequeño (Sailley et al., 2013; Gleiber, 2014), como se registra para ambas secciones del estrecho de Gerlache.
En conclusión, con base en los datos presentados aquí, y teniendo en cuenta los resultados registrados por García et al. (2002), Rodríguez et al. (2002a, 2002b), Varela et al. (2002), Zhou et al. (2002, 2006), Jiang et al. (2013), Gonçalves-Araujo et al. (2015) y Mendes et al. (2018) sobre la hidrografía y la composición del fitoplancton del estrecho de Gerlache, se sugiere que el ensamblaje de copépodos en este lugar está siendo afectado por condiciones específicas en cada sección del estrecho (por ejemplo, estratificación térmica, ingreso de hielo derretido, tiempo de residencia, composición del tamaño del fitoplancton y conexión con mares adyacentes), que estaría resultando en una estructura particular del ensamblaje de copépodos: la sección norte dominada solo por copépodos de tamaño pequeño y la sección sur dominada por copépodos de tamaño pequeño y grande.











 texto en
texto en