INTRODUCCIÓN
Los equinoideos (erizos de mar) constituyen un componente importante de los ecosistemas de arrecifes de coral poco profundos, y proporcionan nutrientes, microhábitats y refugio para una variedad de organismos ectosimbióticos (Clark, 1976; Birkeland, 1989; Carpenter, 1997; Glynn y Enochs, 2011; Goldberg, 2013; Steneck, 2013), incluyendo peces (Karplus, 2014). En el océano Atlántico occidental tropical se ha registrado una variedad de peces asociados con equinoideos (Teytaud, 1971; Helfman et al., 1982; Schoppe, 1991; Schoppe y Werding, 1996; Monroy López y Solano, 2006; Townsend y Bologna, 2007; Giglio et al., 2017), pero aún resta mucho por aprender acerca de los peces que se asocian con los equinoideos y sus relaciones ecológicas.
Diversos estudios proporcionan evidencia de que los ectosimbiontes se asocian con las espinas de los equinoideos, especialmente con las especies de espinas más largas, para protegerse de los depredadores. Por ejemplo, varios peces (Magnus, 1967; Tamura, 1982; Gould et al., 2014; Giglio et al., 2017) y crustáceos (Castro, 1974; Joseph et al., 1998; Hayes et al., 2016) prefieren individuos, especies o modelos equinoideos con espinas más largas o más densas. Varios peces (Lachner, 1955; Eibl-Eibesfeldt, 1961; Strasburg, 1966; Magnus, 1967; Fricke, 1970; Tamura, 1982; Hartney y Grorud, 2002; Gould et al, 2014) y crustáceos (Lewis, 1956; Chace , 1969; Fricke y Hentschel, 1971; Bruce, 1976, 1982; Patton et al., 1985) se asocian casi exclusivamente con especies equinoideas de espinas largas, nadando hacia lo más profundo de sus espinas cuando se sienten amenazados; algunas de estas especies coinciden con el color de los equinoideos anfitriones, poseen líneas horizontales oscuras en sus cuerpos que se alinean con las espinas equinoideas, o cambian de color cuando se apartan de los equinoideos anfitriones para forrajear en otro lugar.
En este estudio, se proporcionan datos sobre la frecuencia de 11 especies de peces que buscan refugio entre 5 especies de equinoideos en la isla de Roatán, Honduras, en el occidente del mar Caribe. Además, se pone a prueba la hipótesis de que los peces se asocian con mayor frecuencia con la especie de equinoideo de espinas más largas, lo que es consistente con la hipótesis de que los ectosimbiontes buscan refugio entre las espinas de los equinoideos para protegerse de los depredadores.
ÁREA DE ESTUDIO
Roatán es una de las islas del departamento de Islas de la Bahía, Honduras, que se encuentran en la serranía de Bonacca, una cresta en el extremo sur de la profunda fosa de las islas Caimán en el mar Caribe occidental. La isla tiene 47 km de largo y 4 km de ancho, y está ubicada 47 km al norte de Honduras continental, entre 16°25.9' y 16°16.0' N, y entre 86°36.2' y 86°11.4' O. Roatán está conformada principalmente por rocas ígneas y metamórficas. A lo largo de la costa hay afloramientos de piedra caliza, que representan arrecifes fosilizados elevados, que alternan con playas de arena y manglares. Un mosaico de arrecifes y barreras de coral rodea la isla, con arrecifes de parche en las lagunas poco profundas. Las rocas de piedra caliza de las zonas intermareales y submareales en los sitios de estudio en West Bay y West End son bastante ásperas, con una gran cantidad de grietas naturales que varían mucho en tamaño, aunque la mayoría de ellas (si no todas) parecen haber sido realizadas por las actividades de perforación de los equinoideos, que son bien conocidos por perforar rocas (Bak, 1994). La geología de la isla ha sido descrita por McBirney y Bass (1967) y por Lallemant y Gordon (1999) y sus ecosistemas marinos han sido descritos por Wells (1988) y Keck (2000).
MÉTODOS
Métodos de muestreo
Desde el 27 de agosto hasta el 1 de septiembre de 2017 se examinó la asociación de peces con equinoideos en las grietas a lo largo de la costa rocosa de West Bay y West End en Roatán. Se usó equipo de esnórquel para inspeccionar equinoideos a lo largo de la costa rocosa en aguas de <2 m de profundidad a 3 m de la costa rocosa. Para evitar tomar muestras de los mismos equinoideos dos veces, los sitios de estudio se dividieron en secciones y cada sección fue inspeccionada por un equipo de dos personas, una encargada de estudiar los equinoideos y la otra de registrar la información. Esto se hizo a lo largo de aproximadamente 1000 m de costa dentro de un área de aproximadamente 3000 m2 (medida con Google Earth; www.google.com/earth). Los estudios solo se realizaron durante los períodos de buen clima, cuando el cielo estaba despejado o parcialmente nublado y la superficie del mar estaba relativamente calmada.
Se inspeccionó cuidadosamente cada equinoideo en busca de peces. Se determinó que existía una asociación cuando un pez buscaba refugio a 2,5 cm de las espinas del equinoideo y permanecía a 5 cm de distancia de las espinas durante al menos 10 segundos cuando se le molestaba. Puesto que varios equinoideos se encontraban parcialmente ocultos dentro de una roca o grieta de coral, es posible que algunos peces pequeños se hayan pasado por alto, aunque no se inspeccionaron equinoideos que estuvieran mayormente ocultos dentro de una grieta. Cada especie de equinoideo y de pez se identificó en el campo o se fotografió y posteriormente identificó con base en las guías de campo de Humann y DeLoach (2002a, 2002b) y Charteris (2012).
La cantidad de individuos de cada especie de pez que se asociaban con alguna especie de equinoideo se registraron en pizarras de escritura bajo el agua. Para un subconjunto de peces, contamos la cantidad de grietas ocupadas por los equinoideos que cada pez visitaba durante un periodo de 10 minutos. Si bien no se intentó medir la densidad de los equinoideos, el tamaño de las muestras proporciona un estimado general de la abundancia relativa de cada especie.
Análisis estadístico
La frecuencia porcentual de anfitriones equinoideos ocupados por peces y la cantidad media de peces por equinoideo se calcularon para cada especie de pez y para todos los peces combinados. Se calcularon los análisis de χ2 de las tablas de contingencia (Zar, 2010) para comparar las proporciones de peces que se asocian con diferentes especies de equinoideos, poniendo a prueba de esta manera la predicción de que los peces se asocian con mayor frecuencia con la especie de equinoideo de espinas más largas. Para evitar una frecuencia esperada de <1 en las pruebas de χ2, se excluyó la información de las especies de equinoideos en las que no se observaron peces. Cuando el tamaño de la muestra era muy pequeño para evitar una frecuencia esperada de <1, no se empleó la prueba χ2.
Taxonomía
La taxonomía de los equinoideos está basada en Hendler et al. (1995) y la de los peces en Froese y Pauly (2019).
RESULTADOS
Diferencias de asociación entre equinoideos
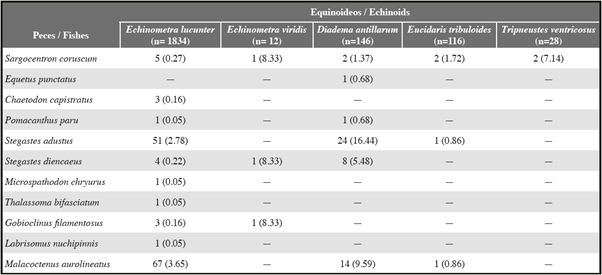
Se identificaron seis especies de equinoideos en grietas a lo largo de las costas rocosas, de las cuales cinco alojaban al menos una especie de pez. La frecuencia de peces que buscaban refugio bajo las espinas de los equinoideos (Tabla 1) difirió significativamente entre las cinco especies de equinoideos (χ2 = 124,83, gl 4, P <0,001) y fue mayor para la especie de espinas más largas, el equinoideo diademátido Diadema antillarum, que representó 88,2% del valor global de χ2. Seis especies de peces se asociaron con 34,3% de D. antillarum, con un promedio de 0,34 peces por equinoideo (n = 146). Tres especies de peces se asociaron con 25,0% del equinoideo equinométrido Echinometra viridis, con un promedio de 0,25 peces por equinoideo (n = 12). Diez especies de peces se asociaron con 7,5% del equinoideo equinométrido Echinometra lucunter, con un promedio de 0,07 peces por equinoideo (n = 1834). Cuatro especies de peces se asociaron con 3,4% del equinoideo cidárido Eucidaris tribuloides, con un promedio de 0,03 peces por equinoideo (n = 116). Una especie de pez se asoció con 7,1% del equinoideo toxopneústido Tripneustes ventricosus, con un promedio de 0,07 peces por equinoideo (n = 28). Ninguna especie de pez se asoció con el equinoideo toxopneústido Lytechinus variegatus, del cual solo se observó uno. Durante nuestras observaciones iniciales, nunca se vio a más de un pez con un equinoideo, pero algunas veces observamos a un pez que posteriormente se unía a otro pez con un equinoideo.
Diferencias de asociación entre peces
Se observaron 196 peces de 11 especies que buscaban refugio al lado de los equinoideos (Tabla 1). Las especies de peces difirieron significativamente en cuanto a su frecuencia de asociación con los equinoideos (χ2 = 527,54, gl = 10, P <0,001). Todos los peces asociados con equinoideos eran pequeños, con una longitud total de <12 cm, y en su mayoría de <6 cm.
El bleni labrisómido Malacoctenus aurolineatus era el asociado más común de los equinoideos, correspondiendo a 41,8% de los peces asociados con los equinoideos. Estaba relacionado con tres especies de equinoideos, pero se asociaba más frecuentemente con el erizo de espinas más larga, D. antillarum, que con las otras dos especies (χ2 = 15,71, gl= 2, P <0,001; Tabla 1). Tanto los jóvenes como los adultos moraban dentro de las grietas ocupadas por equinoideos, descansaban sobre el sustrato dentro de las grietas, usualmente buscaban refugio junto a los equinoideos y rara vez eran vistos a > 1 m de un equinoideo (Figura 1D). Otros dos bleni labrisómido, Gobioclinus filamentosus y Labrisomus nuchipinnis, se comportaban de manera similar, pero se asociaban mucho menos frecuentemente con los equinoideos, representando 1,5% y 1,0%, respectivamente, de los peces asociados con los equinoideos. Los adultos de G. filamentosus (no se observaron jóvenes) solo se asociaban con E. lucunter y los jóvenes de L. nuchipinnis (no se observaron adultos) se asociaban tanto con E. lucunter como con E. viridis (Tabla 1). Ninguno de estos peces se observó a > 1 m de un equinoideo.
El pez pomacéntrido Stegastes adustus fue el segundo asociado más común de los equinoideos, y comprendió 38,8% de los peces que buscaban refugio al lado de los erizos. Estaba asociado con tres especies de equinoideos, pero se asociaba con mayor frecuencia con la especie de espina largas, D. antillarum, que con las otras dos especies (χ2 = 74,87, gl = 2, P <0,001; Tabla 1). Otros dos pomacéntridos, Stegastes diencaeus y Microspathodon chryurus, buscaban refugio junto a los equinoideos, representando 6,6% y 0,5%, respectivamente, de peces asociados con equinoideos. Stegastes diencaeus se asociaba con tres especies de equinoideos y M. chryurus solo se asociaba con E. lucunter (Tabla 1). Aunque los jóvenes y adultos de las tres especies de pomacéntridos con frecuencia nadaban hacia las grietas cuando se les molestaba, solo los jóvenes buscaban refugio junto a los equinoideos (Figura 1C). Tanto jóvenes como adultos de las tres especies se observaron frecuentemente a > 1 m de equinoideos.

Fotografía: A. por F. E. Hayes; B.-D. por S. T. Richards.
Figura 1 Ejemplos de peces que se asocian con equinoideos en Roatán, Honduras: (A) Sargocentron coruscum joven con Echinometra viridis (izquierda) y E. lucunter (derecha); (B) Equetus punctatus joven con Diadema antillarum; (C) Stegastes diencaeus joven con D. antillarum; y (D) Malacoctenus aurolineatus adulto con D. antillarum.
El pez holocéntrido Sargocentron coruscum representó al 6,1% de los peces que buscaban refugio al lado de los equinoideos. Se observó asociación con las cinco especies de equinoideos (Tabla 1). Solo los jóvenes buscaban refugio al lado de los equinoideos (Figura 1A). Tanto los jóvenes como los adultos se observaron a menudo a > 1 m de equinoideos.
Las cuatro especies restantes colectivamente comprendían solo 3,6% de los peces que buscaban refugio al lado de los equinoideos. Jóvenes del pez chaetodóntido Chaetodon capistratus, que comprenden 1,5% de los peces, buscaban refugio junto a E. lucunter (Tabla 1). Jóvenes del pez ángel Pomacanthus paru, que representan 1,0% de los peces, se asociaban con D. antillarum y E. lucunter (Tabla 1). Un pequeño y joven sciaenido Equetus punctatus, que representa 0,5% de los peces asociados con los equinoideos, nadó de ida y vuelta entre dos D. antillarum grandes; los equinoideos se encontraban separados aproximadamente 15 cm en una grieta grande (Figura 1B; Tabla 1). A pesar de que especímenes jóvenes del lábrido Thalassoma bifasciatum nadaban con frecuencia hacia las grietas cuando se les molestaba, se fueron rápidamente; sin embargo, un joven pequeño (aproximadamente 2,5 cm) en una ocasión permaneció al lado de un E. lucunter (Tabla 1) y buscó refugio repetidamente en otro E. lucunter cercano (Tabla 2). Chaetodon capistratus, P. paru y T. bifasciatum jóvenes y adultos se observaron a menudo a > 1 m de equinoideos. El único otro E. punctatus que se observó estaba a > 1 m de un equinoideo.
Tabla 2 Número de grietas diferentes, ocupadas por equinoideos, a las que un solo pez ingresó durante un período de diez minutos.
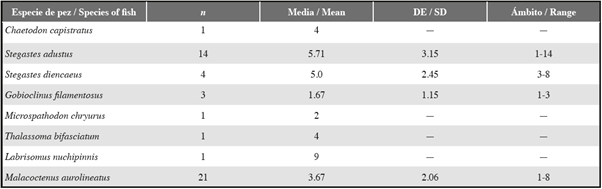
La mayoría de los individuos de ocho especies de peces se aventuraban repetidamente fuera de grietas habitadas por equinoideos y se retiraba repetidamente a grietas cercanas habitadas por equinoideos durante períodos de observación de diez minutos (Tabla 2). Solo una pequeña proporción de individuos de S. adustus, G. filamentosus y M. aurolineatus permaneció al lado de un solo equinoideo durante un período completo de observación de diez minutos (Tabla 2).
DISCUSIÓN
Estudios previos revelaron que el gobiesócido Acyrtus rubiginosus es un comensal inquilino obligado en las madrigueras de E. lucunter en Colombia (Schoppe, 1991; Schoppe y Werding, 1996; Monroy López y Solano, 2006). Se ha registrado que A. rubiginosus se asocia con D. antillarum en las Bahamas (Briggs, 1955) y con D. antillarum y E. lucunter en St. Croix, islas Vírgenes de los Estados Unidos (Teytaud, 1971). En este último lugar, también se registró que el góbido Ginsburgellus novemlineatus se asocia con D. antillarum y E. lucunter (Teytaud, 1971). Ambas especies son muy pequeñas (longitudes máximas de 3,5 cm y 2,5 cm, respectivamente; Froese y Pauly, 2019) y caben fácilmente dentro de las madrigueras de los equinoideos. Sin embargo, no se encontró ninguna de estas especies en Roatán, donde aparentemente no se han registrado (Charteris, 2012), aunque sí lo ha hecho A. rubiginosus en las cercanías de Útila y Cayos Cochinos (Robertson y Van Tassell, 2015).
En Roatán, M. aurolineatus parece asociarse con frecuencia con equinoideos que habitan en madrigueras. Al ser una especie pequeña de pez (longitud máxima de 6 cm; Froese y Pauly, 2019), cabe fácilmente en grietas perforadas por equinoideos. Strasburg (1966) y Lieske y Myers (2002) informaron que generalmente se encuentra cerca de equinoideos, pero no proporcionaron más detalles. Gobioclinus filamentosus jóvenes y adultos (longitud máxima 12 cm; Froese y Pauly, 2019) y L. nuchipinnis jóvenes (longitud máxima de 23 cm; Froese y Pauly, 2019) también pueden morar dentro de madrigueras de equinoideos en Roatán, pero ambos son muchos menos frecuentes que M. aurolineatus.
Todos los peces permanecieron al lado o debajo de las espinas de un equinoideo durante períodos prolongados. Es difícil saber con certeza si los peces se asociaron directamente con los equinoideos para protegerse o simplemente buscaron refugio en zonas profundas de grietas habitadas por equinoideos y, por lo tanto, aparecían coincidentemente junto a un equinoideo. En cualquier caso, se beneficiaron directamente del refugio provisto por las actividades de perforación de E. lucunter (McLean, 1967; Ogden, 1977; Hoskin y Reed, 1985; Asgaard y Bromley, 2008), y quizás de otras especies de equinoideos que también perforan rocas (Bak, 1994).
Las especies de equinoideos, por su parte, difirieron bastante en su morfología (Hendler et al., 1995; Humann y DeLoach, 2002a). Diadema antillarum tiene las espinas más largas y delgadas, de hasta 200 mm de largo. Eucidaris tribuloides tiene espinas gruesas y romas de longitud media, de hasta unos 50 mm de largo. Echinometra lucunter y E. viridis tiene espinas de longitud media, hasta aproximadamente 30 mm de largo en la primera especie y 40 mm de largo en la última. Finalmente, Tripneustes ventricosus y L. variegatus tienen espinas cortas de hasta 20 mm de largo. En el presente estudio, la asociación más frecuente de los peces con la especie de espinas largas, D. antillarum, sugiere que los peces buscaron refugio intencionalmente al lado de los equinoideos para beneficiarse de una mayor protección contra los depredadores. Hayes et al. (2016) encontraron que los crustáceos decápodos también se asociaban con mayor frecuencia con D. antillarum en Roatán.
Los peces más pequeños, que caben debajo o entre las espinas de los equinoideos, tienen más probabilidades de beneficiarse de las espinas protectoras que los peces más grandes (Karplus, 2014). Nunca se observó a un pez con una longitud total > 10 cm asociarse con un equinoideo, la mayoría era de < 6 cm. En cuanto a la observación de solo juveniles de nueve especies de peces asociadas con equinoides, se observa que son consistentes con varios estudios previos de peces que se asocian con equinoideos en el mar Caribe. Sólo los jóvenes de dos especies de Haemulidae, Haemulon plumierii y H. flavolineatum, se asociaron con D. antillarum en St. Croix (Helfman et al., 1983); mientras que solo los jóvenes de tres especies de peces se asociaron con D. antillarum en St. John (Townsend y Bologna, 2007): H. flavolineatum, el sciaenido Pareques acuminatus y el tetraodóntido Canthigaster rostrata.
De las nueve especies de peces asociadas con D. antillarum en la isla Trindade, en el sureste de Brasil (Giglio et al., 2017), solo los jóvenes de cuatro especies de peces se asociaron con el equinoideo: el lábrido Thalassoma noronhanum, el pomacéntrido Chromis multilineata, el apogónido Apogon americanus y el pomacéntrido Stegastes fuscus. Los adultos de cinco especies de peces asociados con D. antillarum en la isla Trindade (Giglio et al., 2017) eran todos pequeños: el labrisómido Malacoctenus brunoi, el bleni Ophioblennius trinitatis, el góbido Elacatinus pridisi, el cirrhítido Amblycirrhitus pinos y el góbido Coryphopterus thrix.
De las 11 especies de peces que se observaron asociadas con los equinoideos, solo se había registrado previamente a M. aurolineatus en dicha asociación (Strasburg, 1966; Lieske y Myers, 2002). Aunque los equinoideos son depredados por al menos 34 especies de peces en el mar Caribe y son el alimento dominante para seis especies (Randall et al., 1964; Randall, 1967), los peces pequeños no representan una amenaza existencial para los equinoideos cuando buscan refugio de posibles depredadores entre las espinas de los equinoideos (Karplus, 2014). Sin embargo, algunos peces asociados con ellos se alimentan de los pedicelarios y de los pies tubulares de sus anfitriones equinoideos (Pfaff, 1942; Briggs, 1955; Dix, 1969; Teytaud, 1971; Russell, 1983; Sakashita, 1992), lo que también puede ocurrir en las asociaciones observadas. Ninguna de las especies de peces objeto del presente estudio se asociaba exclusivamente con equinoideos o estaba especializada para asociarse con ellos, lo que indica que las asociaciones son facultativas en lugar de obligatorias.











 text in
text in