INTRODUCCIÓN
Los organismos planctónicos interactúan con diversos factores bióticos y abióticos que se encuentran en el ambiente marino y su estructura depende de los mismos. El zooplancton está compuesto por organismos que se distribuyen en toda la columna de agua y se convierte en clave de enlace dentro de las redes alimenticias pelágicas, en vista de que al agrupar el segundo nivel trófico, transfiere la energía y/o productividad primaria a los niveles superiores (González, 1998). La mayoría de los integrantes del zooplancton suelen considerarse como indicadores biológicos, por la capacidad que tienen algunos en adaptarse en ambientes hostiles de temperatura y salinidad (Fernández, 2015), también se consideran importantes en las pesquerías, debido a que las larvas de peces presentes en el zooplancton y sus ciclos biológicos resultan ser indicadores del reclutamiento y producción pesquera, así como también indicadores de tendencias de variación ambiental y afectaciones por contaminación (Ramírez y Mianzan, 2011; Fernández, 2015).
Los copépodos son probablemente los organismos más numerosos y diversos en los ambientes acuáticos, aportan la mayor biomasa, entre 40 y 98% de la densidad total del mesozooplancton en el océano Pacífico suelen ser dominantes (Pakhomov et al., 2000; Bernard y Froneman, 2002; Cabal et al., 2002; López, 2012; Jaimes y López, 2013; López y Mojica, 2015; Dorado-Roncancio, 2018). Las principales familias en la Antártica están representadas por Oithonidae, Oncaeidae, Pseudocalanidae, Calanidae y Metrididae (Cabal et al., 2002). Algunas especies de copépodos han mostrado respuestas a estímulos fóticos y otros aspectos de la biología básica que involucran comportamientos visualmente ontogénicos durante las migraciones verticales; estos comportamientos son impulsados por los ojos de los copépodos, incluidos los ojos naupliarios y los órganos de Gicklhorn (función fotoreceptora encontrados en los géneros Calanus y Euchaeta), que varían ampliamente en estructura y función entre las especies (Buskey et al., 2012). Sin embargo, su distribución en las masas de agua está estrechamente relacionada por el patrón de circulación local y regional, así como procesos oceanográficos a gran escala como eventos El Niño Oscilación del Sur-ENOS, que determinan características fisicoquímicas y biológicas en la columna de agua (López, 2008; Steenbeek et al, 2014).
En el Pacífico Sur, se localizan aguas de Panamá, Colombia, Ecuador, Perú y Chile con condiciones hidrodinámicas y características fisicoquímicas cambiantes a causa de permanentes perturbaciones en estas áreas, principalmente por los eventos de surgencia que ocurren de manera temporal incrementándose cuando el ímpetu del viento es más fuerte favoreciendo la productividad marina. La dinámica de corrientes representada principalmente por la corriente de Humboldt, la Contracorriente Ecuatorial, la Corriente del Golfo de Panamá y la Corriente de Colombia, se encuentran afectadas por el desplazamiento de la Zona de Convergencia Intertropical- ZCIT y la ocurrencia periódica de eventos El Niño y La Niña condicionan la dinámica climática y afecta la dispersión de todo el plancton (CCCP, 2002; Tejada et al., 2003).
Hacia el norte de Perú la productividad es alta debido a que las surgencias son permanentes todo el año, aunque estas se intensifican durante el invierno cuando la fuerza del viento es más fuerte desplazando masas con gran aporte de nutrientes (FAO, 1995); la surgencia en el centro de Chile tiene menos intensidad y ocurre durante el verano y primavera, cuando se favorece el crecimiento del fitoplancton (CPPS, 2014). Sin embargo hacia el norte de Chile los valores históricos de temperatura y salinidad indican que los afloramientos ocurren durante todo el año favorecidos por la acción de los vientos siendo más fuertes en verano y más débiles durante el invierno (Marín y Olivares, 1999; Blanco et al., 2001; Santander et al, 2001). Esta área está denominada como una de las más productivas para las pesquerías, capturándose peces pelágicos de Chile y Perú, entre 5,6 y 8,0 MMT (Millones de Toneladas Métricas) por año y aproximadamente un tercio son peces pelágicos pequeños como anchoas y sardinas (Blanco et al., 2001).
La ecorregión Antártica e islas del Atlántico Sur se caracteriza por presentar las temperaturas más bajas; hacia el interior de la masa continental Antártica se puede considerar también como la región más desértica del planeta, ya que, a pesar de la gran disponibilidad de hielo, el agua en estado líquido es sumamente escasa (Izaguirre y Sánchez, 2005). Específicamente el Estrecho de Gerlache es un sistema de cuencas semi-cerradas al sur por la Península Antártica y al norte por el Archipiélago Palmer, posee una longitud de 100 a 150 km y un ancho característico de 40 a 50 km (Anderson, 1999; Lonin, 2015). Oceanográficamente, en el Estrecho de Gerlache la circulación está controlada por una corriente superficial que se sitúa en la zona central del estrecho y que se desplaza hacia el estrecho de Bransfield en dirección noreste (Bárcena et al., 2005). Las aguas superficiales y profundas provienen de los mares de Weddell y Bellingshausen. En general la circulación en el área de estudio está determinada por la corriente principal circumpolar antártica, la cual varía estacionalmente (García et al., 2002).
La dinámica en estas áreas antárticas es constante por el trasporte de Ekman que ocasiona una circulación de aguas superficiales hacia el noreste, alejándose del continente por acción de los vientos. La Corriente Antártica Costera- CCA, que se da por procesos de divergencia, es común que por medio de estos afloramientos llegue a superficie aguas ricas en nutrientes provenientes del Atlántico norte (NADW, por sus siglas en inglés). El mar de Weddell también ayuda a generar la formación de masas de aguas que juegan un papel primordial en la génesis de hielo en las capas superficiales para determinar la dinámica en estas zonas (Loeb et al., 1993; Van der Molen, 2003). También es importante la influencia de otras masas de aguas superficiales que hacen parte de la circulación en el polo sur como es el Agua Subsuperficial Subtropical -SUW, la Corriente Costera- CC y la Confluencia Weddell-Escocia -CWE (Loeb et al., 1993, 1997).
Dentro de la comunidad zooplanctónica en la Antártica el grupo que predomina son los copépodos y después se destaca el krill, que está compuesto por diferentes especies de eufáusidos los cuales son alimento tanto de invertebrados como vertebrados marinos y también temporalmente predominan organismos gelatinosos como las salpas (Pascal, 2012). Las comunidades zooplanctónicas del océano Sur pueden estar dominadas por tres grupos taxonómicos: las salpas, el krill o los copépodos (Siegel y Loeb 1995, Hosie, 2000). Aunque el krill es el taxón dominante en las comunidades macrozooplanctónicas en la Antártica (Laws, 1985; Hopkins, 1985), se ha observado sin embargo que los copépodos pueden dominar tanto en biomasa como en abundancia (Cabal et al., 2002). También existen otras especies de zooplancton como poliquetos, ostrácodos, apendicularios, anfípodos y quetognatos, pero su contribución es menor (Knox, 2006).
Colombia desde 2014 hace parte del Tratado Antártico Internacional, en el cual ha participado en diferentes cruceros de investigación y generado alianzas estratégicas para el desarrollo de la ciencia en este campo. Con el propósito de contribuir al conocimiento del zooplancton e inferir si esta comunidad puede tener un tipo de conectividad entre sistemas tropicales y polares se describe la composición taxonómica, distribución y abundancia del zooplancton distribuido entre los 0 y 200 m de profundidad desde el Pacífico peruano hasta la Antártica.
La hipótesis nula plantea que la densidad zooplanctónica es menor en las aguas Antárticas que en el Pacífico sur, partiendo de la idea que los copépodos son la comunidad que domina en el zooplancton, se esperaría encontrar como dominantes los copépodos de los órdenes Calanoidea y algunos Poecilostomatoida, los cuales han sido descritos a lo largo del Pacífico sur (Monsalve, 1976; López, 2012; Pascal, 2012; Jaimes y López, 2013; López y Mojica, 2015; Medellín-Mora, 2016; Dorado-Roncancio, 2018) sin embargo, existen muchos factores que pueden afectar directa o indirectamente la densidad de estos grupos, ya sea por factores fisicoquímicos y/o ambientales o por la competencia interespecífica dentro del zooplancton con organismos gelatinosos (salpas) y/o eufáusidos que suelen alimentarse de copépodos.
MATERIALES Y MÉTODOS
Entre diciembre de 2016 y febrero de 2017 se llevó a cabo la III Expedición Científica de Colombia a la Antártica "Almirante Padilla" Verano Austral 2016-2017, la cual, se desarrolló en el buque ARC "20 de Julio". Las estaciones de muestreo abarcaron un gradiente latitudinal desde el Pacífico ecuatorial hasta las costas chilenas (4 estaciones, Figura 1), así como una retícula de muestreo en el Estrecho de Gerlache (10 estaciones, Figura 2) en la Península Antártica.
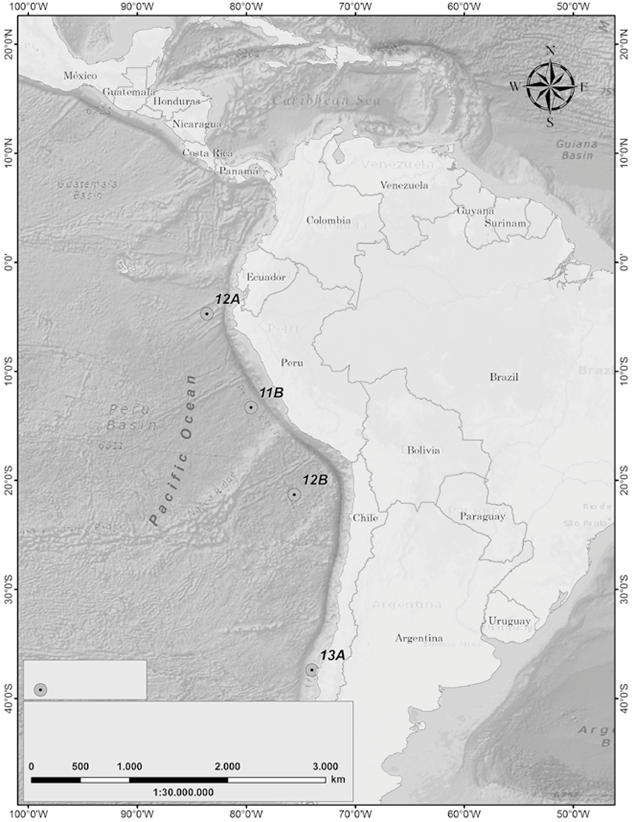
Figura 1 Mapa de las Estaciones muestreadas en el gradiente latitudinal a lo largo del Pacífico Sur, Expedición Antartica Almirante Padilla, Verano Austral 2016-2017. 2016-2017.
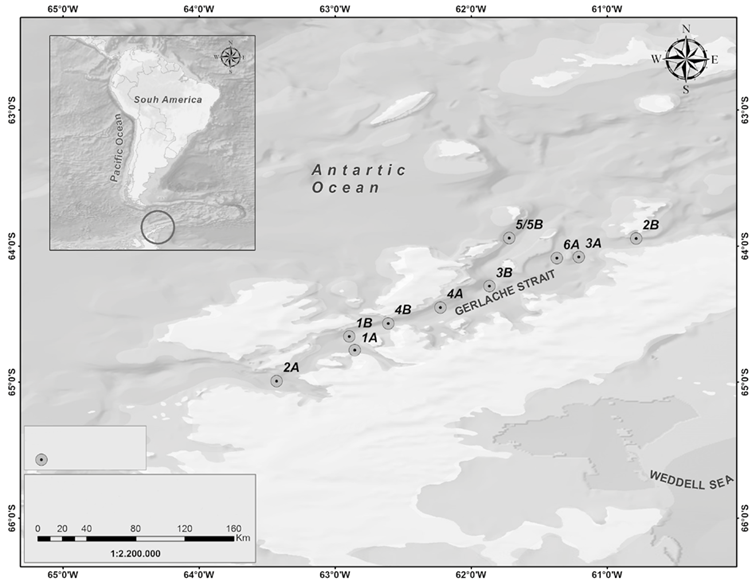
Figura 2 Estaciones muestreadas en el Estrecho de Gerlache (Península Antártica), Expedición Antártica Almirante Padilla, Verano Austral 2016-2017.
Para el componente zooplanctónico se realizaron 14 arrastres verticales, desde los 0 a 200 m de profundidad, utilizando una red de ojo de malla de 250 /<m y 60 cm de diámetro de boca. Para estimar el volumen filtrado se acopló a la red un flujómetro Hydro Bios Kiel®, previamente calibrado y se aplicó el método estándar propuesto por Boltovskoy (1981), que contempla tiempo de arrastre y revoluciones del flujómetro. Posteriormente, las muestras fueron recolectadas en frascos plásticos de 125 mL, empleando como agente preservante y fijador formaldehido diluido al 8%, preparado con agua de mar filtrada y tamponado con ácido bórico (APHA et al, 2005). Las muestras fueron llevadas al laboratorio de la Universidad de Bogotá Jorge Tadeo Lozano, sede Santa Marta, donde se adelantó la limpieza de la totalidad de cada muestra. La separación, conteo e identificación de los zooplánctones se llevó hasta el nivel taxonómico de familia con la ayuda de literatura especializada de Björberg (1981), Boltovskoy (1981), Nishida (1985), Campos-Hernández y Suárez-Morales (1994), Heron y Bradford- Grieve (1995), Palomares et al. (1998), Bradford- Grieve et al. (1999) y Boxhall y Halsey (2004), haciendo uso de un estereoscopio LEICA MZ8 de 32x. Las densidades de los organismos recolectados se registraron en ind•100 m-3, las cuales se calcularon a partir de la ecuación:
Densidad (ind•100 m-3) = C • 100/v,
donde C, es la cantidad de organismos obtenidos en el conteo y v, corresponde a los volúmenes filtrados en cada arrastre.
Para el tratamiento de la información se construyeron inicialmente matrices de datos, relacionando el número de organismos por las familias/morfotipos identificados en cada una de las estaciones. Con esta información, se hicieron gráficos de composición tipo pastel. La comunidad se describió a partir de índices de diversidad de Shannon-Wiener (H'), riqueza de Margalef (d) y uniformidad o equitatividad de Pielou (J') (Moreno, 2001). Para determinar si existían diferencias de los atributos ecológicos entre estaciones del Pacífico Sur con estaciones de la Antártica, se realizaron análisis univariados, como las pruebas t-student (T) (prueba paramétrica) (Zar, 2010). La anterior prueba se definió de acuerdo al cumplimiento de los supuestos de normalidad y homogeneidad de varianzas utilizando el programa estadístico STATGRAPHICS Centurion®.
Se emplearon técnicas multivariadas con la finalidad de evaluar e identificar los posibles patrones espaciales (estaciones) en la estructura de la comunidad zooplanctónica. Para esto, previamente se realizó la transformación de raíz cuarta a los datos, según el modelo propuesto por Taylor (1961). A partir de estos valores, se adelantó un análisis de clasificación basado en la técnica de agrupamiento de ligamiento promedio no ponderado (UPGMA) (Field et al., 1982; Ramírez, 1999), utilizando el programa Primer 6 + Permanova®. Este análisis permite observar asociaciones en términos de composición y abundancia, de acuerdo con el grado de similitud estimado con el índice de Bray-Curtis. Adicionalmente, el índice confenético se estableció con la correlación de Pearson (α = 0,05) con una confianza de 95% entre cada par de variables.
RESULTADOS
La comunidad zooplanctónica estuvo conformada por un total de 75 familias/morfotipos (f/m), pertenecientes a 32 órdenes. El orden Calanoida (20%) y los Perciformes (12%) predominaron en este estudio. Los estadios tempranos como huevos y larvas de peces, bivalvos, cipris, entre otros, aportaron 54% de importancia relativa (Figura 3). Dentro de los copépodos, las familias Calanidae, Paracalanidae, Clausocalanidae, Sagittidae, Oncaeidae y Eucalanidae fueron en términos de abundancia las más representativas del muestreo. Cabe resaltar que para las estaciones 4A, AB y 6A, muestreadas en el Estrecho de Gerlache se encontraron densidades altas de salpas, más específicamente del grupo de las Thaliacea con hasta 281,62 ind•100 m-3 para la estación 4B (Tabla 1). Igualmente, se registra la aparición de salpas en una estación del Pacífico Sur (11B) con 278,75 ind»100 m-3. En este estudio se encontraron otros organismos gelatinosos como quetognatos de la familia Saggitidae (salpas), que presentaron la más alta densidad (2508,78 ind•100 m-3), para la estación 4B. Esta familia se registra en densidades menores para las otras estaciones tanto en la Antártica como en el Pacífico Sur. Otro grupo importante en este estudio es el krill, representado principalmente por la familia Euphausiidae que, como era de esperarse, se encontró en mayor densidad en la estación 3B (Antártica) con (2055,90 ind•100 m-3).El krill constituye el alimento predilecto de ballenas y otros mamíferos marinos que viven en la Antártica, aunque también se encontró en menores concentraciones en las otras estaciones muestreadas en este estudio (Tabla 1; Figura 3).
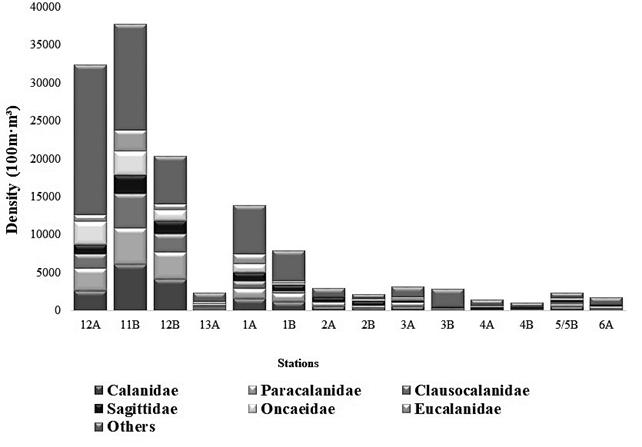
Figura 3 Densidad total y aportes de las familias/morfotipos, identificados en las estaciones muestreadas durante la III Expedición Científica de Colombia a la Antártica "Almirante Padilla" Verano Austral 2016-2017.
Tabla 1 Densidades de la comunidad zooplanctónica desde el Pacífico Sur hasta la Antártica, parte superior estaciones 12A, 11B, 12B y 13A, correspondientes a las estaciones muestreadas en el Pacífico Sur. Parte inferior, resto de estaciones muestreadas en el Estrecho de Gerlache. Muestra las densidades de las Familias-Morfotipos expresadas en ind.•100 m-3.
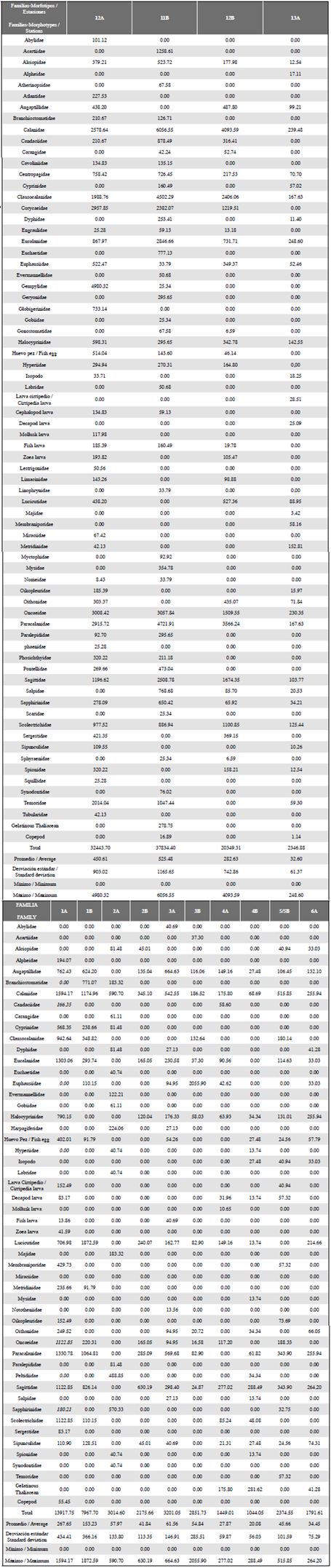
El promedio y desviación estándar del número de familias/morfotipos por estación muestreada fue de 22,64 ± 11,91, oscilando sus valores entre 10- 47 f/m, en la estación 2B y 12A, respectivamente correspondiendo la primera al continente blanco y la última estación al Pacífico ecuatorial. En la retícula de estaciones cabe resaltar que, aunque se registran algunas familias/morfotipos tanto en el Pacífico como en la Antártica, se encontró siempre menos riqueza en el Estrecho de Gerlache. El promedio de densidad fue de 9483 ind•100 m-3 con un ámbito de datos entre 1044 y 37834 ind•100 m3, encontrándose las mayores abundancias en las estaciones 11B (37834 ind•100 m3) y 12A (32444 ind•100 m3; Tabla 1). Dentro de los grupos más importantes, la familia Calanidae presentó la mayor densidad en todo el gradiente latitudinal, 6057 ind•100 m-3 en la estación 11B (Pacífico), y 1594 ind•100 m-3 en la estación 1A (Antártica) (Tabla 1). Los valores de riqueza, diversidad y uniformidad presentaron valores similares entre todas las estaciones (Figure 4); la uniformidad en términos generales es alta, con valores por encima de 0,8 (un máximo de 0,9 en la estación 4A), con excepción de la estación 3B en la que este índice alcanza un valor de 0,5. El índice de diversidad osciló 3,074 y 1,193; así mismo, la riqueza se muestra más alta en las estaciones del Pacífico presentando el máximo en la estación 12A con 4,4 mientras que el mínimo se registró en una estación del polo sur (2,5 en la estación 2B).
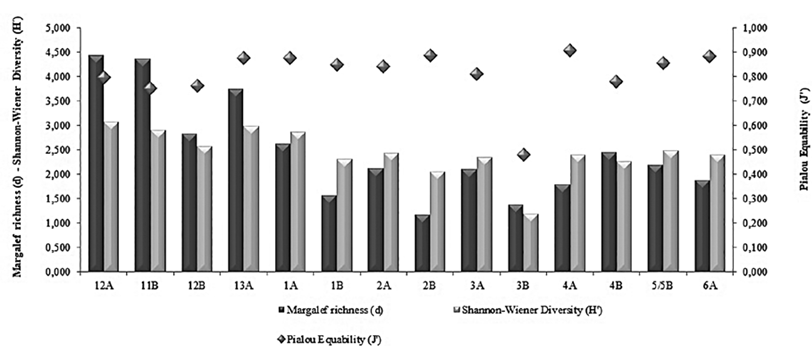
Figura 4 Comportamiento de los índices ecológicos encontrados en la grilla de estaciones, durante la III Expedición Científica de Colombia a la Antártica “Almirante Padilla” Verano Austral 2016-2017
En el anáfisis de clasificación se observaron cuatro agrupamientos (Figura 6). El grupo 1 está representado solamente por la estación 2A (Antártica), que presenta la característica espacial de estar más al sur de los demás puntos de muestreo en la Antártica (Figura 2), además de presentar baja densidad de organismos (3015 ind•100 m-3), donde la mayor abundancia fue representada por la familia Calanidae con 591 ind•100 m-3. El grupo 2 está representado principalmente por el resto de estaciones de la Antártica y la estación más meridional del Pacífico (13A) con una similaridad entre 50 y 70%. El grupo 3 representa una similaridad de 60% aproximadamente y comprende dos estaciones ubicadas en el Estrecho de Gerlache. Estas dos estaciones se relacionan por su baja densidad. El grupo 4 alcanza una similaridad de 60% y abarca las estaciones restantes del Pacífico sur, caracterizadas por presentar altas densidades y diversidad elevada (Figura 6); en estas tres estaciones las altas densidades están influenciadas por la gran abundancia de copépodos de la familia Calanidae, como se observa en la estación 11B con 6057 ind•100 m-3 (Tabla 1, figura 5).
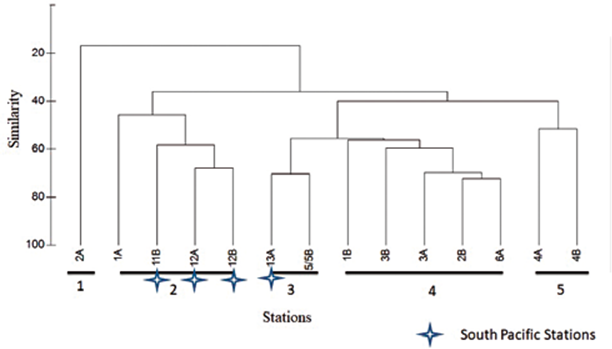
Figura 5 Dendrograma de Similaridad de Bray-Curtis para las estaciones de muestreo en el Pacífico sur y el Estrecho de Gerlache. Indice cofenético: 0,95.
Con el fin de responder a la hipótesis de encontrar el grado de similaridad y/o conectividad entre el Pacífico Sur y La Antártica, se realizaron pruebas estadísticas para confirmar si en las estaciones muestreadas en el Estrecho de Gerlache existe mayor/menor abundancia de zooplanctóntes en comparación al Pacífico. Se partió de la conformación del sistema de corrientes marinas, en la que la Corriente Circumpolar Antártica (CCA) constituye un elemento importante para la circulación profunda global, debido a que transporta agua intermedia y profunda entre los océanos Pacífico, Atlántico e Indico. Por lo tanto, la CCA es una parte importante de la red mundial del transporte oceánico redistribuyendo el calor alrededor de la Tierra. Con lo anterior se esperaría que la comunidad zooplanctónica al presentar gran influencia en su movimiento por las corrientes marinas, aparentemente con alta productividad, fuera mayor en esta zona polar. Se definió un K=2, considerando por una parte las densidades totales de las estaciones de la Antártica y por otra aquellas de las estaciones del Pacífico Sur. No obstante, no se cumplieron los supuestos de normalidad y homogeneidad de varianzas, a partir de la prueba Shapiro-Wilk (Antártica: 0,69, valor-p ≤ 0,01; Pacífico Sur: 0,94, valor-p = 0,62, α = 0,05) y la prueba de Levene (L: 11,75, valor-p ≤ 0,01). Por lo anterior, se realizó la prueba paramétrica de Mood, encontrando que las densidades de la comunidad zooplanctónica en la Antártica son menores que las del Pacífico Sur. (Mood: 1,4, valor -p: 0,24, α = 0,05).
DISCUSIÓN
Los copépodos fue el grupo que mayor aportó en la composición de esta comunidad sin importar la latitud de los puntos de muestreo, lo que valida que este grupo se caracteriza por habitar la zona pelágica de todos los ecosistemas acuáticos del mundo, donde pueden predominar en número y biomasa, llegando a constituir entre 60 y 80 % del zooplancton (Campos y Suárez-Mórales, 1994; Boltovskoy, 1999). Por lo tanto, su rol en las tramas tróficas y en el flujo vertical de carbono es cada vez más reconocido (López y Mojica, 2015). Así mismo, se registran en estudios realizados en el polo sur donde la frecuencia de aparición de copépodos en las muestras zooplanctónicas es de 100% (Bonicelli et al, 2008). La mayoría de las familias de copépodos encontrados en esta investigación han sido registradas tanto para el Pacífico sur como para el continente Antártico (Bonicelli et al, 2008; López, 2012; Pascal, 2012; Jaimes y López, 2013; Medellín- Mora, 2016; Jeréz-Guerrero et al., 2017; Dorado-Roncancio, 2018). Este estudio demuestra de nuevo que los copépodos son los organismos metazoarios más numerosos del planeta (Longhurst, 1985) y están considerados como el mayor componente de la biomasa mesozooplanctónica del océano Sur (Boysen-Ennen et al, 1991). Las principales familias están representadas por Oithonidae, Oncaeidae, Pseudocalanidae, Calanidae y Metrididae (Cabal et al, 2002). La comunidad zooplanctónica que se distribuye desde el Pacífico sur hasta la Antártica, con base a su composición y densidad de organismos, se considera típica de aguas neríticas-oceánicas, presentando dominancia de clases y familias como calanoideos (Calanidae y Paracalanidae) y poecilostomatoides (Oncaeidae), los cuales han sido ampliamente registrados para la Península Antártica (Bonicelli et al, 2008; Pascal, 2012). A este nivel de resolución taxonómica se puede ver una clara interconectividad entre las áreas de muestreo; adicionalmente, cabe resaltar que el patrón de corrientes que se distribuye por la región genera una distribución de los integrantes zooplanctónicos en diferentes densidades, pero manteniendo similar riqueza, lo que a su vez se refleja en el dendrograma de similaridad de Bray-Curtis. Esta interconectividad es debida principalmente a la Corriente Circumpolar Antártica, elemento primordial para circulación global, porque es capaz de transportar agua intermedia y profunda de los océanos 2012; Jaimes and López, 2013; Medellín-Mora, 2016; Jeréz-Guerrero et al., 2017; Dorado- Roncancio, 2018). Pacífico, Atlántico e Índico. Además, contribuye con la circulación en todas las cuencas y, en el caso específico del Pacífico, a partir de la corriente de Chile-Perú o de Humboldt (Figura 4) originar una distribución homogénea de familias desde alta latitudes hasta áreas subtropicales y tropicales de esta cuenca oceánica.
El orden Perciformes fue representativo en este estudio mostrando un 12% de importancia relativa. Las familias que se agrupan en este orden se encuentran en estadios larvales con diferentes niveles en la capacidad de nado y por lo tanto se distribuyen en varios estratos de la columna de agua (Beltran-León y Rios, 2000; Zhou et al, 1994). La mayoría de estos peces son de hábitos diurnos, lo que explica la aparición de varias de sus larvas en este estudio, principalmente porque en el continente blanco durante el verano austral siempre hay luz solar, lo cual suele favorecer a los organismos autótrofos del plancton, generando así alta oferta alimenticia para el zooplancton que resulta ser el recurso alimentario que sostiene el ictioplancton en esta zona. La menor abundancia en porcentaje se encontró en los órdenes Poecilostomatoida y Aulopiformes. El primero lo constituyen copépodos de tallas pequeñas que se han descrito para el Pacífico sur y la Antártica (Schnack-Schial et al., 2010; López, 2012; Pascal, 2012; Jaimes y López, 2013).
De otra parte, diferentes estudios realizados en el Pacífico sur, registran entre 39 y 76 familias/morfotipos (López, 2012, Jaimes y López, 2013), con la riqueza estrechamente relacionada con la época de muestreo; suelen encontrarse comunidades más ricas en época seca, principalmente en aguas abiertas donde la incidencia de los eventos de surgencia suelen ser mayores en comparación a los costeros (Franco- Herrera, 2005); la surgencia favorece el aporte de nutrientes a la columna de agua. Particularmente el continente Antártico es considerado por muchos autores como una región muy productiva para todos los niveles tróficos y también en un área altamente influenciada por eventos de surgencias (Huntley et al, 1990; Loeb et al., 1993; Zhou et al, 1994; Van der Molen, 2003). Sin embargo, al realizar estadística inferencial, para confirmar que allí debería haber mayor densidad del zooplancton, se encontró lo contrario. Por lo tanto, se podría indicar que en la Antártica existen otros factores que pueden influenciar fuertemente la productividad; para estas áreas se han descrito que en algunos puntos se presentan zonas altas en nutrientes pero bajas en clorofila (HNLC, por sus siglas en inglés; Pascal, 2012). Estas zonas son consideradas muchas veces como críticas debido que se estarían afectando directamente los niveles tróficos más altos de la red alimentaria, también las condiciones de temperaturas bajas de la Antártica obligan a las diferentes especies a tener estrategias de supervivencia (Quetin y Ross, 2001). La cantidad de luz y estabilidad de la columna de agua influyen directamente en las comunidades planctónicas; también la radiación ultravioleta UV-B afecta directamente la productividad primaria, ya que inhibe el crecimiento del fitoplancton hasta 90% (Llabrés y Agustí, 2006). Estas áreas sub-Antárticas se han descrito como vulnerables frente al agujero en la capa de ozono, por su cercanía durante el verano; además el reflejo de estos rayos sobre el hielo de esta zona subpolar y el agua contribuye a los elevados niveles de exposición de radiación UV, lo que obliga a adaptaciones fitoplanctónicas o en muchas ocasiones inhibe la productividad en la zona (Hernando, 2016). Esto da respuesta a la baja composición y abundancia del zooplancton en estas áreas por las alteraciones en la oferta alimentaria, posiblemente por esta radiación.
El zooplancton está ubicado en el segundo eslabón de la red trófica marina, que es bien representado por los copépodos y el krill, que resultan ser los consumidores directos del fitoplancton (primer eslabón trófico). Pese a que la Antártica es el continente más aislado, no está libre de contaminación, tanto ambiental como antropogénica, por tal motivo se han detectado en estas áreas altos contenidos de metales pesados (Ribeiro et al., 2011; Sarmiento y Flores, 2014). Estos factores fisicoquímicos pueden explicar también las bajas densidades de organismos zooplanctónicos en las estaciones antárticas muestreadas, pues podrían estar afectando no solo la red trófica marina, sino la industria pesquera y en general toda la dinámica ecosistémica de estas áreas.
Es preciso destacar algunas estrategias de la comunidad zooplanctónica, las cuales explican las diferencias en las densidades de organismos en las estaciones muestreadas. La migración vertical que realizan algunos de los integrantes del zooplancton (Bo-Ping y Straskraba, 1998; Boxshall y Halsey, 2004), desplazándose a la superficie en el día por la influencia de factores abióticos (Bollens y Frost, 1989), ocasiona cambios de densidades en el momento del muestreo. Este proceso migratorio puede variar según la especie, el tamaño y estado de desarrollo (Aveces et al, 2007).
La aparición de la familia Sagittidae en este estudio, y en general de organismos gelatinosos, son concordantes a lo registrado para áreas antárticas (Bonicelli et al., 2008; IAC, 2008; Pascal, 2012). La presencia del phylum Chaetognatha, que incluye organismos gelatinosos con funciones primordiales dentro de la comunidad zooplanctónica, se asocia con cambios biológicos (disponibilidad de alimento y grado de depredación) (Pascal, 2012). Estos organismos gelatinosos del zooplancton se distribuyen desde aguas tropicales a subárticas y subantárticas y en condiciones favorables las salpas pueden proliferar rápidamente llegando a formar densas agregaciones y así dominar la biomasa zooplanctónica (Hereu et al., 2006). En estudios del plancton en países como Costa Rica también se registran grandes cantidades de estos organismos gelatinosos, como bioindicadores de disponibilidad de alimento (Castellanos-Osorio et al., 2012), lo que confirma su alta densidad también en aguas del Pacífico.
En este estudio, fue notable la disminución de taxa y de organismos típicos del zooplancton como los copépodos, para las estaciones 4A y 4B (Antártica), debido principalmente a que predominaron los organismos gelatinosos, no solo de la familia Sagittidae, sino también salpas de la clase Thaliacea. Estos últimos resultan ser típicos de aguas del polo sur y alcanzaron en el presente estudio densidades de hasta 281,62 ind•100 m-3. El zooplancton gelatinoso se ha convertido en los últimos años en un importante objeto de estudio y se ha replanteado su significado ecológico en los procesos ecológicos (Mills, 1995). Estos organismos son depredadores activos dentro del zooplancton, lo cual explica la baja cantidad de otros taxa en especial copépodos calanoideos en estas estaciones (López, 2012). Es este estudio se esperaba encontrar gran cantidad de krill en las estaciones muestreadas en el polo sur, representados principalmente por la familia Euphausiidae, que resulta tener una gran importancia dentro de la trama trófica marina, pero en general fueron muy pocas estaciones las que presentaron altas densidades de esta familia (Tabla 1), similar a lo que ocurrió en el verano austral de 2005, cuando la alta presencia de organismos gelatinosos como las salpas sugiere elevada competencia y/o depredación, lo cual se refleja en bajas densidades del krill antártico (Pascal, 2012).
Sin embargo, en el presente estudio se observó en varios sectores de la Península Antártica una distribución del mesozooplancton que sugiere la presión depredadora sobre los copépodos por parte del krill. La distribución del krill de pequeño tamaño presentó un gradiente inverso a la de los copépodos. Es decir, las estaciones con mayor densidad de krill juvenil mostraron una menor densidad de copépodos (Tabla 1). Debido a ello, se puede pensar que estos tiene preferencias alimentarias sobre los copépodos de mayor tamaño, lo cual es similar a lo registrado por Bonicelli et al. (2008) y Pascal (2012); esto indica que la disminución de copépodos en las zonas antárticas está directamente influenciada por la depredación no solo del krill, sino también de los organismos gelatinosos. Aquellas estaciones con mayores densidades de copépodos en la Antártica (1A, 1B; Tabla 1) parecen estar asociadas a las zonas de deshielo, lo que genera un aporte de nutrientes y que ocasiona una mayor disponibilidad en fitoplancton (oferta alimentaria). El aumento de nutrientes favorece el desarrollo de cocolitofóridos, diatomeas y dinoflagelados que son el alimento predilecto del zooplancton (Sato et al, 2008), lo que proporciona los beneficios nutricionales apropiados para el sostenimiento y aumento de la riqueza de esta comunidad. La dinámica encontrada a partir de los índices ecológicos aplicados refleja una comunidad que, si bien posee una alta representatividad de copépodos, presenta una uniformidad elevada, lo cual resulta ser típico en comunidades zooplanctónicas (López, 2012; Pascal, 2012). La similaridad en términos generales es alta, presentando solo ciertas diferencias espaciales causadas por la aparición de organismos gelatinosos o bien por cambios en la densidad de los grupos cosmopolitas encontrados.
Como ya se ha mencionado en este estudio, la densidad y riqueza de los zooplánctones depende de factores fisicoquímicos y ecológicos. La tendencia principal fue encontrar a individuos de las familias Calanidae, Eucalanidae, Paracalanidae y Sagittidae. Con relación a las tres primeras que pertenecen a los copépodos, es muy probable que este avistamiento se relacione con la disponibilidad de alimento en las áreas y la elección alimentaria de estos individuos (Saiz y Calbet, 2011), como se ha tratado de explicar en estudios sobre aspectos tróficos en México (López y Palomares 2006; Lavaniegos et al, 2012) y Chile (Bóttjer et al., 2010). La familia Calanidae se caracteriza por consumir partículas finas de fitoplancton en descomposición y probablemente poseer hábitos omnívoros (Boxshall y Halsey, 2004). De forma similar, la familia Eucalanidae se alimenta de los productores primarios por filtración de pequeñas partículas de las zonas epi y mezopelágica en aguas oceánicas- neríticas y suele dominar en el plancton debido a su pequeño tamaño (Boxshall y Halsey, 2004). La familia Paracalanidae presenta hábitos herbívoros y omnívoros. Esta familia puede compartir los recursos alimentarios, pero para minimizar la competencia se distribuye en diferentes capas en la columna de agua, acorde con la termoclina, como estrategia para disminuir la competencia por nicho (Fragopoulu et al., 2001); esta familia domina en ambientes oligotróficos tropicales (Schnack-Schiel et al., 2010).
CONCLUSIONES
Con este estudio se encontró conectividad entre las áreas de estudio, debido a que estadísticamente se correlacionan las estaciones y taxonómicamente se encuentras familias típicas en ambos ambientes representativas del zooplancton a nivel cosmopolita; sin embargo, esto no se relaciona al sistema de corrientes globales, puesto que se esperaba encontrar mayor abundancia y diversidad en aguas del polo sur, donde teóricamente convergen todas las corrientes.
El grupo que predominó en general fueron los copépodos, que siguen siendo los más representativos en los muestreos del zooplancton, principalmente los Calanoideos, tanto para el Pacífico sur como para la Antártica.
Se evidenció poca cantidad de krill, lo cual probablemente se asocia con cambios fisicoquímicos en las masas de agua, que pueden relacionarse con el cambio climático global que está afectando la dinámica y distribución de estos crustáceos.
En algunas estaciones de la Antártica se encontraron grandes cantidades de organismos gelatinosos, especialmente salpas, lo cual podría relacionarse como fuerte presión depredadora frente al krill y los copépodos, que estaría afectando la dinámica zooplanctónica.
Las bajas abundancias de zooplancton en la Antártica demuestran posibles cambios y afectaciones hacia el desarrollo en pesquerías y biodiversidad del planeta, para lo cual se necesitan más estudios enfocados hacia las estrategias de vida del zooplancton frente a estos cambios, así como identificación de hábitos alimentarios, metales pesados, biología molecular, isotopos estables, entre otros estudios, que ayuden a caracterizar y entender un poco más la dinámica del plancton en la Antártica y su relación con los otros ecosistemas marinos.











 texto en
texto en 



