INTRODUCCIÓN
Los arrecifes de coral son áreas de intensa competencia entre organismos bentónicos sésiles (Barott et al., 2012), por acceso a espacio (establecer, mantener y expandir territorio), luz, alimento, entre otros recursos (Lang y Chornesky, 1990). El resultado de estas interacciones interespecíficas determina en buena medida la estructura de las comunidades coralinas (Fricke et al., 2011; Barott et al., 2012; Gowan et al., 2014).
La competencia entre corales duros y algas bentónicas es frecuente, incluso en arrecifes de coral saludables (Sandin et al., 2008; Harris et al., 2015). Sin embargo, el aumento en la frecuencia e intensidad de perturbaciones, particularmente de origen antropogénico, han desbalanceado los esquemas naturales de estas interacciones, favoreciendo a las algas, especialmente a los céspedes algales.
Los céspedes algales son ensamblajes mixtos de algas con altura de dosel no mayor a 2.0 cm (Connell et al., 2014), que acumulan sedimentos en sus frondas (Gorgula y Connell, 2004). Tienen el potencial de limitar el asentamiento de larvas de coral (Steneck, 1997; Birrell et al., 2005) y otras algas formadoras de dosel (Kennelly, 1987; Airoldi, 2003). Además, pueden afectar la recuperación del tejido de coral lesionado (Alvarado y Acosta, 2009) y generar la muerte progresiva del tejido coralino adyacente (Jompa y McCook, 2003a, 2003b; Roy, 2004; Harris, 2015), convirtiéndose así en los principales competidores de los corales hermatípicos (Bruggemann et al., 1994; Ledlie et al., 2007; Barott et al., 2012; Hamilton et al., 2014; Harris, 2015). De hecho, son los promotores de un cambio de fase, en donde los arrecifes dominados por corales pasan a ser dominados por algas, especialmente en ambientes perturbados (Barott et al., 2009, 2012; Haas et al., 2010).
Las interacciones coral-césped ocurren cuando una lesión previa por agentes físicos (tormentas, sedimentación, altas temperaturas, contaminación, entre otros) y/o biológicos (epizootias, depredación, y otros) (Rogers et al., 1982; Bythell et al., 1993; Díaz-Pulido y McCook, 2002; Alvarado y Acosta, 2009), generan mortalidad parcial en las colonias, quedando esqueleto de coral libre de tejido, que es colonizado rápidamente por estos céspedes algales, que una vez establecidos comienzan a interactuar con el tejido vivo de coral en sus fronteras (McManus y Polsenberg, 2004; Fricke et al., 2011; Gowan et al., 2014). Estas interacciones son complejas y variables en el tiempo y el espacio, debido a que dependen de las especies que intervienen, tanto de algas como de corales (Titlyanov et al., 2007; Birrell et al., 2008) y del entorno ambiental donde se desarrollan (Vermeij et al., 2010; Barott et al., 2012). Sin embargo, por la dificultad en la identificación de las especies de algas, los céspedes han sido evaluados tradicionalmente de manera generalizada como un único grupo funcional (Connell et al., 2014).
La proliferación de céspedes y de interacciones con corales es evidente especialmente en eventos de gran escala que generan mortalidades masivas, como huracanes, epizootias o blanqueamiento coralino (Rogers et al., 1982; Bythell et al., 1993; Díaz-Pulido y McCook, 2002), pero también ocurre cuando hay mortalidad crónica o episódica de pequeña escala en cada colonia, y pueden pasar desapercibidos en períodos cortos de tiempo (Alvarado y Acosta, 2009). Por su dimensión e implicaciones ambientales, sociales y económicas, es importante cuantificar el daño coralino masivo y crónico y hacer seguimiento de las consecuencias, en las que los céspedes algales pueden jugar un importante papel. No obstante, a nivel mundial pocos estudios han abordado la relación entre el aumento en la cobertura de estos ensamblajes no calcificantes con el cambio climático global (Johnson et al., 2017) y en el Caribe sólo algunos trabajos han relacionado la proliferación de los céspedes a expensas de los constructores de arrecifes como una causa directa de mortalidad de corales pétreos (Roy, 2004; Gómez-Cubillos, 2018). Lo anterior demuestra profundos vacíos de conocimiento en torno al importante papel ecológico que desempeñan los céspedes algales y sus interacciones en los procesos de estructuración de las comunidades de arrecife (Fricke et al., 2011; Barott et al., 2012), y por lo tanto dentro de las posibles trayectorias de recuperación que exhiben los arrecifes perturbados del Caribe colombiano.
Al reconocer la importancia ecológica de las interacciones por espacio en el bentos coralino, y aceptando que los arrecifes están enfrentando escenarios de cambio en diferentes escalas, surge la necesidad de realizar evaluaciones sobre la dinámica espacial de las interacciones coral-césped. En tal sentido, en este estudio se evaluó qué tan frecuentes son las interacciones coral-césped (en relación con otras interacciones), cuál es el resultado aparente de la competencia (coral gana o coral pierde) y cómo algunos factores biológicos y ambientales modulan su frecuencia y resultado. Esto para avanzar en comprender qué tan importantes han sido, son y pueden ser sus efectos en la comunidad coralina. La investigación se desarrolló en el Parque Nacional Natural Tayrona -PNN Tayrona- en el Caribe colombiano, área sujeta a una fuerte alternancia climática entre afloramiento costero y descargas continentales (Zea, 1993; Bayraktarov, 2013; Bayraktarov et al., 2014a, 2014b), y cuya historia de perturbación por diversas presiones naturales y antropogénicas, ha generado en las últimas décadas importantes pérdidas de cobertura coralina (ver compilación de Friedlander et al., 2014), y en consecuencia exposición de esqueleto coralino apto para ser colonizado por céspedes.
Esta evaluación espacial a escala de arrecife (km), proporciona una visión instantánea en el tiempo (Barott et al., 2012), convirtiéndose en línea base de referencia que aportará a la comprensión sobre el balance, recuperación y futuro de las comunidades de arrecife del PNN Tayrona.
MATERIALES Y MÉTODOS
Área de estudio
En el área de Santa Marta y el Parque Nacional Natural Tayrona (Fig. 1, 11° 12'- 11° 22' N y 73° 57'-74° 15"W), los arrecifes coralinos que bordean el litoral rocoso son poco amplios, de tipo franjeante, se desarrollan a profundidad media (entre 8-10 m hasta 20-30 m), y están constituidos principalmente por corales masivos hemisféricos. Solamente al interior de las bahías hay arrecifes de parche que alcanzan la superficie (Werding y Sánchez, 1989).
Dada la orientación geográfica de la costa y la dirección de los vientos predominantes (alisios del nororiente), en los costados occidentales de las bahías que están más expuestos al oleaje, la cobertura de corales pétreos con formas de crecimiento costroso es alta, mientras que en los costados orientales que están protegidos abundan las grandes formas masivas y las formaciones coralinas son más complejas y diversas (Werding y Sánchez, 1989; Díaz et al., 2000; Martínez y Acosta, 2005; Vega-Sequeda et al., 2008; Bayraktarov et al., 2014a). No obstante, a pesar de la gran cantidad de fondos duros adecuados para el establecimiento de arrecifes, las formaciones coralinas del área de Santa Marta son poco desarrolladas y su crecimiento es limitado en comparación con otras áreas del Caribe colombiano, debido a la fuerte influencia de un régimen climático bimodal que oscila entre descargas continentales y afloramiento costero (Zea, 1993).
Durante la temporada de lluvias (mayo a noviembre), la temperatura del agua superficial es más cálida (27-29 °C), la salinidad disminuye (34) y la carga de sedimentos por descargas continentales incrementa la turbidez de las aguas; mientras que en la época seca (diciembre a abril), como resultado del afloramiento costero generado por los vientos alisios del NE, la temperatura del mar desciende (20-25 °C), la salinidad sube (38), aumenta la intensidad del oleaje y en general las aguas son más transparentes (Ramírez, 1983; Zea, 1993; Franco-Herrera, 2005; Vega-Sequeda et al., 2008; Bayraktarov et al., 2014b; Bayraktarov y Wild, 2014). Esta variabilidad climática determina la composición algal, especialmente por una gran proliferación de macroalgas entre enero y abril, que luego disminuyen o desaparecen con el incremento de la temperatura del agua hacia septiembre-noviembre (Bula-Meyer, 1990), dejando los sustratos duros no colonizados por macroinvertebrados recubiertos de céspedes algales y algas costrosas coralinas (Díaz-Pulido y Garzón-Ferreira, 2002).
Cobertura bentónica, frecuencia de interacciones entre corales duros con otras categorías bentónicas y resultado aparente de la competencia coral-césped
La información en campo se recolectó en octubre de 2016, durante la temporada de lluvias, con baja o nula presencia de macroalgas y predominio de céspedes algales. En total se evaluaron 12 estaciones (Figura 1), en cinco bahías del PNN Tayrona, comparando el lado protegido (oriental) y expuesto (occidental), en tres niveles de profundidad, si los había, somero (2 a 6 m), medio (7 a 12 m) y profundo (> 12 m).
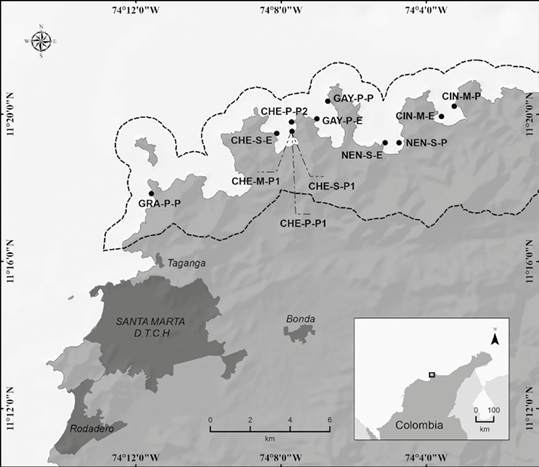
Figura 1 Ubicación de las 12 estaciones de muestreo en el PNN Tayrona, Caribe colombiano. La línea punteada corresponde al polígono que delimita el área protegida. La nomenclatura por estación corresponde a las tres primeras letras del nombre de la bahía (GRA-Granate, CHE-Chengue, GAY-Gayraca, NEN-Nenguange y CIN-Cinto), la inicial del nivel de profundidad (somero-S, medio-M y profundo-P), y la inicial del nivel de relativo de exposición al oleaje (expuesto-E y protegido-P). Fuente: elaborado por Felipe Valencia, especialista SIG.
En cada estación, se ubicó un flexómetro sobre el fondo y se evaluaron de dos a cuatro transectos de banda (10 x 2 m), tomando como referencia los transectos permanentes del Sistema Nacional de Monitoreo de Arrecifes Coralinos de Colombia -SIMAC- (Garzón-Ferreira et al., 2002; Garzón-Ferreira y Rodríguez-Ramírez, 2010).
La composición del bentos se determinó con el método de fotocuadrante (Preskitt et al., 2004). Sobre cada transecto, cada metro y alternando de derecha a izquierda de la cinta se ubicó un cuadrante de PVC de 1" de 50 x 50 cm (0,25 m2) subdividido en 25 cuadrículas (Gowan et al., 2014), para un total de 2,5 m2 evaluados por transecto. Con una cámara digital Canon Powershot G16 con caja estanca se tomaron fotografías de los cuadrantes completos y de porciones de ellos para lograr mayor detalle.
Las fotografías se procesaron con el programa ImageJ. Por cuadrante se contó el número de cuadrículas, se estimó el área (cm2) y midió el perímetro (cm) de las categorías descritas por Caricomp (2001) y Garzón-Ferreira et al. (2002): corales duros (por especie), corales blandos (gorgonáceos y zoantídeos), milepóridos, algas (frondosas, céspedes y costrosas), esponjas (erectas e incrustantes) y sustrato abiótico (arena y escombros). Posteriormente, por cuadrante se calculó la cobertura (%) por categoría bentónica y especie de coral, a partir de la proporción entre el área ocupada por cada categoría/especie y la sumatoria total de las categorías/especies.
Para estimar en general y por estación la frecuencia (%) de interacciones coral-césped y coral-otra categoría bentónica, en cada cuadrante se contó el número de interacciones por cuadrícula y se midió el perímetro (cm) de cada interacción. La frecuencia (%) se calculó a partir de la relación porcentual entre el total de cuadrículas ocupadas por cada tipo de interacción y el total de cuadrículas del cuadrante (n = 25). Empleando el mismo método se calculó la frecuencia (%) de interacciones coral-césped por especie de coral y tipo de organización colonial, la cual depende de la forma del coralite y de la estructura del coralum (Ogilvie, 1896; Reyes et al., 2010). Para entender qué tan representativa es esta frecuencia (%) respecto al total de posibilidades que tiene una especie de coral de interactuar con los céspedes, se calculó un índice de ocurrencia (%) a partir de la relación porcentual entre el total de cuadrículas de la especie en interacción con céspedes y el total de cuadrículas ocupadas por la especie, y se determinó la relación porcentual entre el perímetro ocupado por la interacción coral-césped de una especie de coral y el perímetro total de la especie (en los cuadrantes).
El resultado aparente de la interacción coral-césped se definió por especie de coral y tipo de organización colonial, a partir de las sugerencias hechas por Barott et al. (2012), Márquez y Zea (2012) y Gowan et al. (2014): a) coral pierde, cuando existen daños visibles en el tejido coralino (cambios de coloración, pérdida de continuidad tegumentaria y necrosis) ocasionados por recubrimiento, sombreado o contacto directo del césped; b) coral gana cuando los pólipos del borde forman elevaciones a manera de labios, faldas o montículos que evaden la interacción, y c) aparentemente neutra cuando el tejido coralino y el césped se encuentran en un mismo nivel (ángulo de 180°) y no se observa deterioro de los pólipos en la frontera de interacción.
Análisis de la información
La representatividad con los datos de cobertura (%) de las especies formadoras de arrecife (corales duros y milepóridos) se evaluó por estación y muestra (transecto) mediante diversidad media acumulada de Shannon-Wiener (H') con su respectiva desviación estándar usando el programa EstimateS versión 9.1 (Colwell, 2013) con 1000 permutaciones aleatorias y determinando si la curva alcanzó la asíntota, si el coeficiente de variación de los últimos cinco valores era inferior al 5 % y si la pendiente de la regresión lineal no era significativamente distinta de cero. Con este procedimiento se determinó que en el área de Santa Marta, 3,5 m2 equivalentes a 1,5 transectos, son una muestra representativa de la comunidad bentónica formadora de arrecifes. En consecuencia, para todos los análisis se combinaron todos los transectos de cada estación para obtener un dato por variable por estación.
Las diferencias en la frecuencia de interacciones coral-césped y coral-otras categorías bentónicas entre bahías y estaciones, y el efecto de los factores ambientales (gradiente de perturbación, profundidad de la columna de agua y grado de exposición al viento y oleaje) sobre la frecuencia de estas interacciones, se evaluaron mediante tablas de contingencia y pruebas de independencia de Chi2 a un nivel de confianza de 95 % (Sokal y Rohlf, 1981).
Asumiendo que la cobertura de céspedes algales es mayor en áreas arrecifales perturbadas por actividades humanas (Barott et al., 2012; Harris et al., 2015), se definió un gradiente de perturbación (NE-SW), a partir de la cercanía de la estación al área de desarrollo urbano y portuario de Santa Marta en el lado SW, que se presume disminuye en intensidad y efecto hacia el PNN Tayrona en el NE (Werding y Sánchez, 1988; Zea, 1994; Bayraktarov y Wild, 2014). El análisis del efecto de este factor se realizó sólo para cuatro estaciones con condiciones similares (profundas y protegidas), para evitar que los factores profundidad y exposición enmascararán el efecto del gradiente. Posteriormente, asumiendo que el desarrollo de los céspedes algales es mayor en aguas someras y en sectores protegidos (Fricke et al., 2011), con los datos de las 12 estaciones se evaluó el efecto de la profundidad por niveles (somero, medio y profundo) y por grado de exposición (expuesto y protegido) para cada nivel de profundidad.
Para determinar en general la frecuencia y el resultado (coral gana, coral pierde o aparentemente neutra) de interacciones coral-césped, según la especie de coral y el tipo de organización colonial, se analizaron solamente los datos de las 10 especies de coral que registraron más de 30 interacciones en total. La frecuencia de interacciones se comparó mediante ANOVA a una vía y los resultados de la competencia con pruebas de independencia Chi2 (Sokal y Rohlf, 1981).
Para determinar si la cobertura (%) es covariable del perímetro ocupado por interacciones coral-césped (%), asumiendo a priori que a mayor cobertura de coral mayor es el perímetro de interacción coral-césped, se realizó por separado para cada especie coralina una correlación de Pearson entre el perímetro y la cobertura. Luego, con ANOVA multifactorial (Agresti, 2002) se evaluó si el perímetro por especie de coral varió entre los factores ambientales seleccionados. El perímetro y la cobertura se transformaron con la fórmula de arcoseno (Sokal y Rohlf, 1981) y se probaron los supuestos de normalidad (prueba de Shapiro-Wilk) y homogeneidad de varianzas (prueba de Levene) (Underwood, 1997).
Finalmente, con modelos de regresión binaria (De la Fuente, 2011; Guisande et al., 2013) se evaluó por especie de coral y tipo de organización colonial el efecto de los factores ambientales (gradiente, profundidad y exposición) sobre el resultado de las interacciones coral-césped. Para ello, la variable respuesta (resultado) se transformó a binaria (0-1), siendo cero (0) coral pierde y uno (1) coral no pierde (categoría que incluyó todos los casos en donde el coral ganó o la interacción se mantuvo neutra), y los factores independientes se convirtieron en variables dummy.
RESULTADOS
Interacciones entre corales y otras categorías bentónicas
En los 70,3 m2 evaluados y las 4053 cuadrículas ocupadas por corales hermatípicos, se identificaron 4010 interacciones entre corales duros con otras categorías bentónicas. Las interacciones coral-césped (58,7 %) y coral-algas costrosas (13,9 %) fueron las más frecuentes. El 18,7 % de las interacciones restantes, se presentó entre corales duros con otros corales, milepóridos, macroalgas frondosas, esponjas y corales blandos, y sólo en el 8,7 % de los casos el coral no interactuó con otros organismos bentónicos (Figura 3). En virtud de estos resultados, los siguientes análisis se realizaron considerando sólo tres tipos de interacciones: coral-césped, coral-algas costrosas y coral-otras categorías.
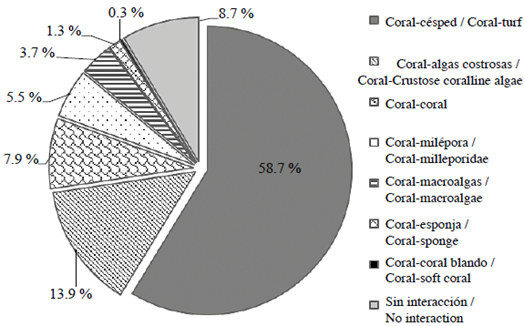
Figura 3 Frecuencia general de interacciones (%) entre corales duros con otras categorías bentónicas, en arrecifes del PNN Tayrona.
La frecuencia de interacciones entre corales con otras categorías bentónicas fue diferente entre bahías (Chi2 = 191,3; P < 0,05; GL = 8) y entre estaciones (Chi2 = 423,1; P < 0,05; GL = 22). La tendencia general mostró que la interacción coral-césped fue la más frecuente (> 56 %), seguida por interacciones coral-otras categorías y coral-algas costrosas, excepto en las estaciones CHE-S-P y GRA-P-P. En CHE-S-P la interacción dominante fue coral-algas costrosas (47,7 %), mientras que en GRA-P-P aunque dominó la interacción coral-césped, las interacciones coral-algas costrosas fueron más frecuentes que coral-otras categorías bentónicas (Figura 4).
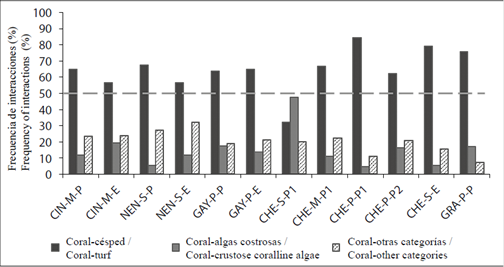
Figura 4 Frecuencia de interacciones (%) entre corales con otras categorías bentónicas en las 12 estaciones de muestreo del PNN Tayrona. La línea punteada indica el corte de la frecuencia al 50 %. Para abreviaturas ver Figura 1.
También se determinó que la frecuencia de interacciones depende de la ubicación de la estación en el gradiente de perturbación propuesto (Chi2 = 25,2; P < 0,05; GL = 4), siendo las interacciones coral-césped más frecuentes en los arrecifes más cercanos a la bahía de Santa Marta (Granate) que en los más lejanos (Gayraca), mientras que las interacciones coral-otras categorías bentónicas tienden a disminuir hacia el SW y las interacciones coral-algas costrosas se mantienen constantes (~15 %) (Figura 5a).
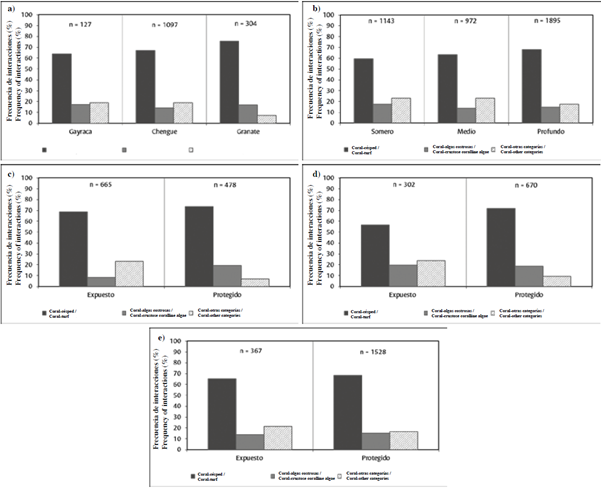
Figura 5 Frecuencia de interacciones (%) entre categorías bentónicas: a) en estaciones profundas-protegidas, que representan el gradiente de perturbación NE-SW; b) entre niveles de profundidad; c) entre niveles de exposición en estaciones someras (2-6 m); d) entre niveles de exposición en estaciones de profundidad media (7-12 m) y e) entre niveles de exposición entre estaciones profundas (> 12 m).
Las pruebas de independencia evidencian que la frecuencia de interacciones varía entre niveles de profundidad (Chi2 = 29,3; P < 0,05; GL = 4). Sin embargo, opuesto a lo esperado, en el PNN Tayrona, las interacciones coral-césped tienden a aumentar con la profundidad, mientras que las interacciones coral-otras categorías bentónicas y coral-algas costrosas fueron ligeramente más frecuentes en ambientes someros (Figura 5b). El análisis individual por nivel de profundidad, mostró que en las estaciones someras (Chi2 = 142,5; P < 0,05; GL = 2; n = 4;) y medias (Chi2 = 54,3; P < 0,05; GL = 2; n = 3), la frecuencia de interacciones, según los datos y las pruebas, estuvo mejor explicada por el grado de exposición al viento y el oleaje; siendo en general, las interacciones coral-césped las más frecuentes, particularmente en las áreas protegidas de las bahías, mientras que las interacciones coral-otras categorías aumentaron en las áreas expuestas, y las interacciones coral-algas costrosas se mantuvieron constantes (~ 19 %), excepto en estaciones someras expuestas, donde su frecuencia no superó 8 % (Figura 5c, d). Por el contrario, en las estaciones profundas (Chi2 = 4,5; P > 0,05; GL = 2; n = 5), la frecuencia de interacciones no tuvo relación con el nivel de exposición, encontrándose que la proporción entre los tres tipos de interacciones evaluadas es similar tanto en estaciones protegidas como expuestas (Figura 4e).
Interacciones coral-césped
Las 2578 interacciones coral-céspedes algales identificadas involucraron 16 especies de corales duros. Para las 10 especies de coral seleccionadas con más de 30 interacciones con céspedes, se encontraron diferencias significativas en la frecuencia de interacciones entre especies de coral (ANOVA, F = 4,9; P < 0,05).
Las especies Pseudodiploria strigosa (24,2 %), Colpophyllia natans (15,9 %) y Montastraea cavernosa (13,1 %) tuvieron el mayor número de bordes interactuando con céspedes algales, opuesto a lo hallado para Diploria labyrinthiformis (2,6 %), Orbicella annularis (1,7 %) y Meandrina meandrites (1,3 %) (Figura 6).
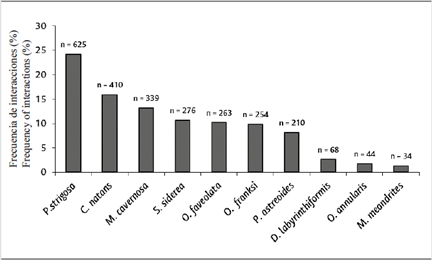
Figura 6 Frecuencia de interacciones (%) con céspedes, según la especie (relativo al total de interacciones con céspedes).
Los resultados del índice de ocurrencia mostraron que Orbicella franksi (85,8 %), Porites astreoides (77,5 %) y M. cavernosa (64,2 %) son las especies con la mayor proporción de sus cuadrículas ocupadas por interacciones con céspedes algales. Mientras que D. labyrinthiformis (38,6 %) y O. annularis (44,9 %) son las especies con menor proporción de su tejido vivo en contacto con céspedes algales (Figura 7a).
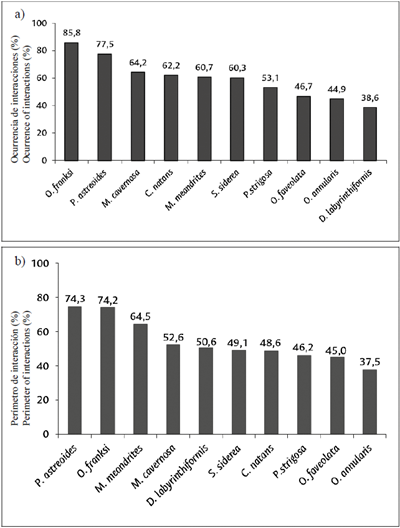
Figura 7 a) Índice de ocurrencia de interacciones (%) con céspedes algales por especie de coral; b) perímetro ocupado por interacciones (%) coral-césped.
Según el perímetro (%) ocupado por interacciones coral-césped por especie de coral, los resultados fueron similares a los del índice de ocurrencia, mostrando que P. astreoides (74,3 %) y O. franksi (74,2 %) son las especies con mayor porcentaje de su perímetro expuesto a los céspedes; mientras que O. annularis (37.5 %) tiene el menor porcentaje de su perímetro en interacción con céspedes (Figura 7b).
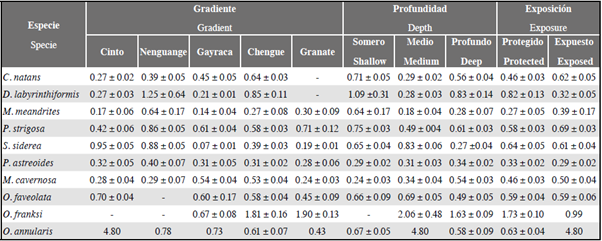
Para ninguna de las 10 especies evaluadas hubo correlación significativa entre la cobertura (%) y el perímetro (%) ocupado por interacciones coral-césped. Esto muestra que la cobertura no es un buen indicador para predecir la frecuencia de interacciones coral-césped (Tabla 1).
Tabla 1 Resultados de las correlaciones de Pearson y ANOVA multifactorial para determinar el efecto de variables ambientales y biológicas sobre la frecuencia de interacciones coral-césped por especie de coral. Números en negrita son valores significativos (P < 0,05); guiones (-) son valores no calculados por el modelo estadístico; abreviaturas: Gradiente (G), profundidad (P), Exposición (E).
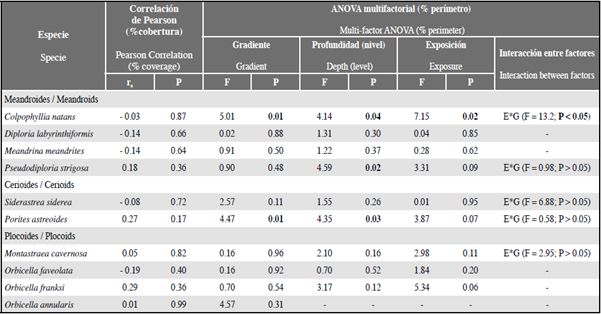
El ANOVA multifactorial mostró que de las 10 especies de coral seleccionadas, solo en C. natans y P. astreoides el perímetro (%) ocupado por interacciones coral-césped varió significativamente con los factores ambientales seleccionados (Tabla 1). En C. natans el perímetro en interacción con céspedes varió con los tres factores (gradiente, profundidad y exposición), y hubo interacción significativa entre la exposición y el gradiente, es decir, que las diferencias en perímetro entre gradientes variaron con la exposición. Estos resultados en conjunto indica que para esta especie el perímetro (%) de interacción coral-césped fue mayor en aguas someras con mayor influencia antropogénica (Tabla 2). Para el caso de P. astreoides, aunque el ANOVA indica que el perímetro en interacción con céspedes varía significativamente con la profundidad y el gradiente, sólo se observó un ligero aumento del perímetro con la profundidad (Tabla 2). Los resultados de este análisis sugieren que en general los factores ambientales estudiados no son determinantes en la frecuencia de interacciones coral-césped en el área de estudio.
Resultado aparente de la competencia coral-césped
Del total de interacciones coral-césped identificadas (n = 2578), se estableció que en 37,5 % de los casos los corales ganaron, en 30,4 % los corales perdieron y en 32,2 % las interacciones se mantuvieron aparentemente neutras.
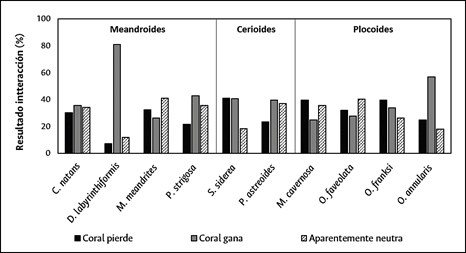
Con los datos de las 10 especies de coral seleccionadas (n = 2523), se determinó que el resultado de la interacción varía según la especie de coral (Chi2 = 168,7; P < 0,05; GL = 18). En la Figura 8 se observa que en D. labyrinthiformis y O. annularis el coral ganó ampliamente. En P. strigosa, C. natans y P. astreoides la proporción entre coral gana y neutra fue similar, pero siempre mayor a coral pierde. Para M. meandrites y O. faveolata predominaron las interacciones neutras. Por el contrario, en M. cavernosa y O. franksi el resultado coral pierde fue dominante y para S. siderea la proporción entre coral pierde y coral gana fue similar.
Adicionalmente, el resultado de interacciones coral-césped dependió del tipo de organización colonial (Chi2 = 55,0; P < 0,05; GL = 4). Al combinar todos los datos por tipo colonial (con independencia de la especie), coral gana fue mayor en colonias con formas meandroides y cerioides, aunque en las cerioides el resultado coral pierde fue mayor que el resultado neutro, mientras que en las colonias meandroides el resultado neutro fue mayor que coral pierde. Por el contrario, en colonias con formas plocoides, el resultado coral pierde fue dominante, seguido por el resultado neutro y coral gana (Figura 9).
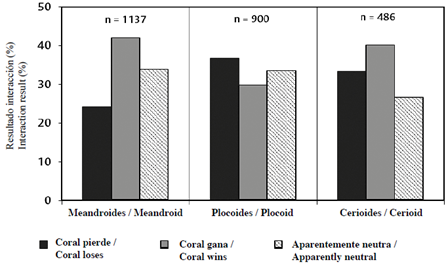
Figura 9 Resultado (%) aparente de las interacciones coral-césped según el tipo de organización colonial.
Los modelos de regresión binaria del resultado de las interacciones coral-césped (0 coral pierde, 1 coral no pierde) por tipo de organización colonial y según las variables ambientales seleccionadas, fueron estadísticamente significativos (meandroides: Chi2 = 11,7; P < 0,05; cerioides: Chi2 = 18,6; P < 0,05 y plocoides: Chi2 = 18,1; P < 0,05) (Tabla 2).
En colonias meandroides el gradiente y la exposición fueron significativos (P < 0.05), y sus coeficientes de correlación (exposición: -0,35, gradiente: -0,15) indican que la posibilidad de que el coral meandroide pierda aumenta con una menor exposición al oleaje y distancia a Santa Marta. Para colonias cerioides el gradiente y la profundidad fueron significativas, y sus coeficientes (gradiente: -0,18 y profundidad: 0,07) indican que la probabilidad de pérdida aumenta con una menor distancia a Santa Marta y una mayor profundidad de la columna de agua. En colonias plocoides sólo la exposición fue significativa, y su coeficiente (-0,94) sugiere que la probabilidad de pérdida aumenta con una menor exposición al oleaje. (Tabla 3).
Tabla 3 Regresión logística binaria para predecir el resultado de la competencia coral-césped (coral pierde y coral no pierde) por tipo de organización colonial y especie de coral, en función a los factores gradiente, profundidad y exposición al oleaje. Números en negrita son valores significativos (P < 0,05); R2 = porcentaje de datos clasificados en el modelo; Chi2 de la prueba de independencia entre los coeficientes de verosimilitud del modelo; Chiw 2 de Wald para pruebas multivariadas; B = coeficiente de correlación en el modelo.
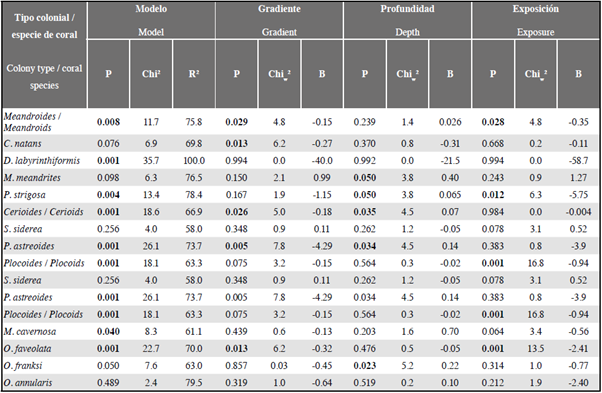
Al realizar este análisis por especie de coral, se encontró que de las 10 especies seleccionadas, en seis de ellas (D. labyrinthiformis, P. strigosa, M. cavernosa, O. faveolata, O. franksi y P. astreoides) los modelos fueron estadísticamente significativos (P < 0,05), mientras que en C. natans, M. meandrites, O. annularis y S. siderea el resultado de la competencia no se puede predecir a partir de las variables seleccionadas (Tabla 3).
La profundidad fue la variable más importante para P. strigosa, O. franksi y P. astreoides, y sus coeficientes (0,06, 0,22 y 0,14, respectivamente) indican que a mayor profundidad aumenta la probabilidad de pérdida para estas especies. El gradiente de perturbación fue la variable más importante para O. faveolata y aportó al modelo de P. astreoides, y sus coeficientes (-0,32 y -4,29, respectivamente) señalan que a menor distancia de Santa Marta mayor es la probabilidad de pérdida. La exposición al oleaje aportó a los modelos de O. faveolata y P. strigosa, y sus coeficientes (-2,41 y -5,75, respectivamente) sugieren que a menor exposición aumenta la probabilidad de pérdida. Para D. labyrinthiformis y M. cavernosa, aunque el modelo fue significativo, ninguna variable pudo explicar el resultado de la competencia (Tabla 3).
Empero para este análisis el R2 de Nagelkerke no superó 27 % en ninguno de los 13 casos evaluados, y el cociente entre la probabilidad de que ocurra el suceso que define la variable dependiente, frente a la probabilidad de que no ocurra en presencia o ausencia del factor, en todos los casos fue menor a 3 %. Por lo tanto, estos modelos, aunque fueron estadísticamente significativos, sólo explican un bajo porcentaje de la varianza de la variable dependiente (coral pierde y coral no pierde), por lo que se asume que los factores seleccionados no son buenos predictores del resultado de la competencia coral-césped.
DISCUSIÓN
Interacciones entre corales y otras categorías bentónicas
En los arrecifes del PNN Tayrona, los corales hermatípicos interactúan con algas (céspedes, macroalgas y costrosas incrustantes), otros corales (masivos, milepóridos y blandos) y esponjas, siendo las interacciones coral-céspedes algales (58,7 %) y coral-algas costrosas (13,9 %) las más frecuentes.
Para interpretar estos resultados, se debe tener en cuenta que las interacciones coral-césped generalmente ocurren cuando agentes físicos y/o biológicos producen una lesión previa en el tejido coralino que causa mortalidad parcial en las colonias (Rogers et al., 1982; Bythell et al., 1993; Díaz-Pulido y McCook, 2002; Alvarado y Acosta, 2009), quedando esqueleto expuesto que es colonizado por los céspedes (McManus y Polsenberg, 2004; Fricke et al., 2011; Gowan et al., 2014). Por lo tanto, el hecho de que las interacciones-coral-césped sean las más frecuentes, refleja el efecto residual de la trayectoria de perturbación a la que han estado expuestos estos arrecifes (Hughes y Connell, 1999). Esta historia incluye acontecimientos como la mortalidad masiva del erizo Diadema antillarum en la década de los años 80 del siglo pasado (Lessios et al., 1984), blanqueamientos masivos en 1987, 1995, 2005 y 2010 (Navas-Camacho et al., 2010), huracanes (Johan en 1988, Lenny en 1999, Mathew en 2016, inmediatamente antes de este estudio), enfermedades coralinas como banda blanca en Acropora spp. (Gladfelter, 1982; Aronson y Precht, 2011) y aspergilosis en Gorgonia spp. entre 1985 y 1988) (Garzón-Ferreira y Zea, 1992), impactos por especies invasoras como Pterois volitans (Acero et al., 2019) y sobrepesca (Friedlander et al., 2014). Estas perturbaciones han provocado que los céspedes algales actualmente sean los principales competidores de corales duros en el PNN Tayrona, tendencia ya registrada para otros arrecifes tropicales (Hughes, 1994; Díaz-Pulido y McCook, 2002; Littler et al., 2006; Hughes et al., 2007; Sandin et al., 2008; Fricke et al., 2011; Barott et al., 2012; Harris et al., 2015).
Por su parte, la baja frecuencia de interacciones coral-algas costrosas, algas importantes para la calcificación y construcción arrecifal (Heyward y Negri, 1999; Vermeij et al., 2010; Gómez-Lemos y Díaz-Pulido, 2017), puede obedecer al efecto derivado de la acción sinérgica de perturbaciones a escala global como la acidificación de los océanos (Cyronaka y Eyrea, 2016) y a escala local como la disminución en las poblaciones de herbívoros (Burkepile y Hay, 2010), factores que limitan la formación de algas costrosas, y por ende su probabilidad de interactuar con otros organismos bentónicos.
Aunque en los arrecifes del PNN Tayrona las interacciones coral-césped son las más frecuentes, se encontraron diferencias en la frecuencia de estas interacciones entre bahías y estaciones. Por ejemplo, en CHE-S-P la interacción coral-algas costrosas fue dominante (47,7 %), tal vez porque esta estación está conformada principalmente por grandes cabezas de corales masivos con pocas áreas muertas, hecho que sugiere que el nivel de impacto de las perturbaciones afecta de manera diferencial cada arrecife, según sea la intensidad, periodicidad y cercanía del evento (Sousa, 1979; Connell, 1997).
Dado que el contexto ambiental juega un papel determinante en la dinámica de las interacciones en el bentos (Airoldi et al., 1995; Burkepile y Hay, 2010; Vermeij et al., 2010; Barott et al., 2012; Swierts y Vermeij, 2016), en esta investigación se encontró que las interacciones coral-césped tienden a ser más frecuentes en arrecifes cercanos a la ciudad de Santa Marta, área de desarrollo urbano y portuario; mientras que en esta misma dirección SW-NE, las interacciones coral-otras categorías bentónicas disminuyen. Lo anterior sugiere una mayor perturbación antropogénica sobre los corales (Zea, 1994), dada por la reducción en las poblaciones de herbívoros e incremento de nutrientes y sedimentos (Gorgula y Connell, 2004; Barott et al., 2012), condiciones que son perjudiciales para los corales e incrementan la pérdida de los organismos calcificadores del arrecife (Díaz-Pulido y McCook, 2002; Barott et al., 2012; Bender-Champ et al., 2014), pero que son ventajosas para los céspedes algales.
Respecto a la profundidad, Fricke et al. (2011) demostraron experimentalmente que, en arrecifes de Curacao, los céspedes algales son más abundantes en aguas someras. No obstante, en este estudio la frecuencia de interacciones coral-césped aumentó con la profundidad y las interacciones coral-otras categorías disminuyeron, indicando que a profundidades de hasta 15 m la luz no es un factor limitante para el desarrollo de ensamblajes de céspedes algales, aunque la composición de los ensamblajes sí varía (Gómez-Cubillos, 2018). Además, la mortalidad parcial de tejido coralino en el PNN Tayrona ha sido mayor en aguas más profundas (> 12 m), particularmente durante eventos de blanqueamiento y por epizootias (Acosta et al., 2018), y la acumulación de sedimentos por resuspensión aumenta con la profundidad (Bayraktarov, 2013; Bayraktarov et al., 2014a), permitiendo su mayor acumulación en las frondas de los céspedes, y por lo tanto incrementando el efecto lesivo de estos ensamblajes en contacto con el tejido coralino.
Para el factor exposición al oleaje, se encontró que las interacciones coral-césped son más frecuentes en áreas protegidas con profundidades menores a 12 m, mientras que, en áreas expuestas, aunque también dominaron las interacciones coral-césped, aumentó la proporción de interacciones coral-otras categorías. Por el contrario, en aguas profundas (>12 m) no se encontraron diferencias en la frecuencia de interacciones entre áreas expuestas y protegidas. Estos resultados sugieren que en áreas protegidas del oleaje con profundidad menor a 12 m donde el efecto de la turbulencia es menor (Bayraktarov, 2013; Bayraktarov et al., 2014a) y la carga de sedimentos aumenta (Roy, 2004), las afectaciones coralinas han sido mayores y se favorece el desarrollo de los céspedes algales, ya que estas algas atrapan y retienen en sus frondas partículas de sedimentos con detritus, que utilizan como material para anclar sus estructuras de fijación y así poder crecer lateralmente (Airoldi y Virgilio, 1998; Connell et al., 2014), desplazando el tejido coralino.
Interacciones coral-césped
Se encontró de manera generalizada que los factores ambientales seleccionados no ejercen influencia significativa sobre la frecuencia de interacciones en la mayoría de las especies de coral. Además, se comprobó que la cobertura (%) de una especie no es covariable de su perímetro en interacción con céspedes, por lo que se desvirtúa la hipótesis de que a mayor o menor cobertura de coral, mayor o menor es el perímetro/frecuencia de interacción.
Estos resultados, junto con la premisa de que una interacción coral-césped usualmente ocurre tras la muerte previa de tejido coralino por acción de agentes físicos y biológicos (Rogers et al., 1982; Bythell et al., 1993; Díaz-Pulido y McCook, 2002; Alvarado y Acosta, 2009), permiten sugerir que la frecuencia actual de interacciones coral-césped es un indicio indirecto de la susceptibilidad particular que tienen cada especie de coral de sufrir lesiones producto del conjunto de perturbaciones que afectan el hábitat de la colonia. Esto complementa la hipótesis de Meesters et al. (1996) de que la susceptibilidad a la mortalidad parcial es específica de la especie de coral, tendencia ya descrita por Ott y Lewis (1972), quienes encontraron que en arrecifes de Barbados la frecuencia de ataque del gusano de fuego Hermodice carunculata, es mayor en colonias de P. astreoides que en P. strigosa.
Resultado aparente de la competencia coral-césped
Del total de casos de interacciones coral-césped identificadas, aparentemente los corales ganan en 37,5 %, pierden en 30,4 % y empatan en 32,1 %. Esto sugiere, que en los arrecifes del PNN Tayrona hay una dinámica de reparación de lesiones a pequeña escala, en donde el coral gana y pierde, lo que permite mantener un balance en la proporción de los posibles resultados de estas interacciones. No obstante, al analizar sólo las 10 especies de coral de interés, se demostró que el resultado de la competencia varía según la especie de coral. Esto coincide con los resultados de otros estudios que confirman que las interacciones coral-césped son altamente variables tanto en el proceso como en el resultado (Jompa y McCook, 2003a), pero que el resultado depende en particular de los mecanismos de competencia y de la morfología y fisiología de las especies que intervienen (Díaz-Pulido y McCook, 2002; Jompa y McCook, 2002; Titlyanov et al., 2007; Barott et al., 2012; Corado-Nava et al., 2014; Swierts y Vermeij, 2016). Asimismo, los resultados del efecto de los factores gradiente, profundidad y exposición sobre el resultado de la competencia según el tipo de organización colonial y la especie de coral, demostraron que para este caso, los factores seleccionados no son buenos predictores del resultado aparente de la competencia coral-césped, en contraste con lo reportado por Airoldi et al. (1995), quienes encontraron relevantes las características del entorno físico donde se desarrolla la competencia.
Al analizar el resultado de interacciones coral-césped según el tipo de organización colonial, y con la salvedad de que al interior de cada tipo las especies varían en su respuesta, se encontró que en colonias meandroides y cerioides coral gana es el resultado más frecuente, mientras que en formas plocoides, particularmente en M. cavernosa el mayor número de casos es coral pierde. Esto confirma que el tipo de organización colonial puede ser en parte determinante en el resultado de la competencia. Por lo anterior, es posible pensar que la selección de los mecanismos de competencia que emplean los corales para luchar en bordes de interacción con céspedes algales son afines entre tipos de organización colonial, y su uso depende del tipo de perturbaciones que están afectando su hábitat. Por su parte, la efectividad de estas estrategias depende de la capacidad de regeneración del tejido lesionado, según sea el tamaño de la lesión (Meesters et al., 1996) y de las tasas de crecimiento (o de evasión/escape) particulares de cada especie (Lang y Chornesky, 1990).
Para interacciones coral-césped aún no se han descrito los posibles mecanismos que intervienen durante la competencia. Por lo tanto, la justificación de la hipótesis arriba planteada se basará en el análisis de los diferentes mecanismos que emplean los corales en interacciones interespecíficas con otros corales (Lang y Chornesky, 1990; McCook et al., 2001), otros organismos bentónicos (Richardson et al., 1979; Karlson, 1980; Chornesky, 1983; López-Victoria et al., 2006) y macroalgas (McCook, 2001; McCook et al., 2001; Nugues et al., 2004), precisando que las interacciones coral-césped ocurren en escalas muy pequeñas (mm), ya que las superficies de contacto que ofrecen las algas del césped son mínimas.
Los corales han desarrollado varios mecanismos físicos y químicos para defenderse directamente de sus competidores (Lang y Chornesky, 1990). Un primer mecanismo es el de evadir la competencia a través del crecimiento por altura (Meesters et al., 1996; López-Victoria et al., 2006), que eleva al coral sobre su competidor a manera de un domo, techo o labio, impidiendo la acción directa y avance lateral de su competidor.
Por otro lado, entre los mecanismos de confrontación directa, los más importantes descritos en la literatura son los de digestión extracelentérica a través del uso de filamentos mesentéricos y tentáculos barredores que generan abrasión, escozor o destrucción de los tejidos blandos del oponente, la producción y liberación en el agua de mar circundante de sustancias químicas para lesionar a oponentes que están fuera de alcance, y la secreción de moco (Richardson et al., 1979; Karlson, 1980; Schoener et al., 1983; Lang y Chornesky 1990; McCook, 2001; Jompa y McCook, 2002).
En el Caribe, los corales con dominancia digestiva son los más abundantes (Maguire y Porter, 1977), y generalmente son formas masivas de crecimiento lento, con pólipos poligonales grandes y pequeños de tipo plocoide y cerioide (Lang y Chornesky, 1990), en tanto que los corales de tipo meandroide usualmente evitan la competencia a través del crecimiento por altura (Barnes, 1973; Meesters et al., 1996). Esto es evidente para P. strigosa en este estudio y otras observaciones histológicas no publicadas, que produce techos y labios de crecimiento que se elevan ligeramente sobre los céspedes y otros organismos, tendiendo a recubrirlos y así evitar ser afectada. Este mecanismo de crecimiento por altura también se emplea para regenerar lesiones pequeñas, ya que cuando un área de la colonia se daña, el tejido alrededor de la lesión crece hacia adentro de esta a manera de evaginación para recuperar la herida (Meesters et al., 1996). Este proceso fue descrito por Roy (2004) en arrecifes de México para colonias de S. siderea expuestas en condiciones con alta carga de sedimentos, y por Meesters et al. (1992) en arrecifes de Curacao para colonias de P. strigosa. No obstante, el proceso de regeneración del tejido, particularmente de lesiones muy grandes puede que no se complete, dejando este espacio disponible para que los céspedes se afiancen y luego continúen avanzando, pero especies meandroides más resistentes como Meandrina meandrites y Mycetophyllia spp. han desarrollado potenciales de regeneración más altos a fin de reducir los daños por interacciones en superficie y periferia (Meesters et al., 1996).
En resumen, en arrecifes frecuentemente perturbados, la evasión de la competencia coral-césped por crecimiento en altura es una estrategia competitiva más exitosa respecto a la obtenida por la digestión extracelentérica (Maguire y Porter, 1977). Este argumento permite entender porque en los arrecifes del PNN Tayrona las colonias meandroides y cerioides (con algunas excepciones al interior de cada tipo, e.g., O. annularis para plocoides, M. meandrites para meandroides) presentaron un mayor número de casos de coral no pierde (gana + neutra), ya que usan este mecanismo. No obstante, el aumento en la frecuencia e intensidad de las perturbaciones, podrían limitar los tiempos de recuperación y la capacidad de defensa de las especies, provocando a futuro cambios en la estructura de las comunidades coralinas. Esto fue documentado por Loya et al. (2001) en los arrecifes de la costa sur de la isla de Sesoko en Japón, donde prevalecieron, tras un evento de blanqueamiento masivo, aquellas especies con estrategias competitivas más exitosas.
En suma, este estudio contribuye a una mejor comprensión de las interacciones coral-césped, y propone dos esquemas generales que podrían ayudar a comprender y cuantificar procesos biológicos en las comunidades arrecifales, al menos del PNN Tayrona en el Caribe colombiano. Uno es que la especie de coral (con frecuencia en asocio con el tipo de organización colonial), más que su tamaño y cobertura, son factores determinantes en la frecuencia y el resultado de interacciones coral-césped. El otro es que esto implica que a futuro sea probable que la composición y complejidad estructural de estos arrecifes también cambie en respuesta al aumento de perturbaciones que incrementen los escenarios de competencia entre corales hermatípicos y céspedes algales, y los potenciales resultados de estas interacciones según las estrategias empleadas los corales.
CONCLUSIONES
En los arrecifes del PNN Tayrona el competidor más frecuente de corales hermatípicos son los céspedes algales, y las interacciones coral-césped son más frecuentes en arrecifes cercanos a Santa Marta, y en áreas protegidas del oleaje con mayor profundidad. Esto refleja el efecto residual de la trayectoria de perturbación a la que han estado sometidos estos arrecifes. Empero, las diferencias en la frecuencia de interacciones entre bahías y estaciones confirma que estas perturbaciones afectan de manera diferencial cada arrecife.
La frecuencia de interacciones coral-césped depende de la especie de coral involucrada y de su susceptibilidad a perder tejido coralino producto del conjunto de perturbaciones que afectan el arrecife donde habita. Por su parte, el resultado de la competencia depende de la especie de coral, en parte en asocio con el tipo de organización colonial, siendo las colonias meandroides y cerioides competidores más exitosos, debido al mecanismo de evasión por crecimiento en altura; mientras que las colonias de tipo plocoide son más propensas a perder. Por el contrario, los factores ambientales (gradiente, profundidad y exposición) parecen no desempeñar un papel preponderante sobre la frecuencia y resultado aparente de estas interacciones.
En tal sentido, a partir de los resultados de esta investigación se predice que el análisis de datos históricos de la cobertura coralina del PNN Tayrona debe mostrar pérdidas mayores o menores en cobertura por especie según el lugar, de acuerdo con la distribución de las condiciones deletéreas para corales y favorecedoras de los céspedes. Además, en el futuro continuarán las mismas tendencias de perturbación, favoreciendo en el largo plazo, con algunas excepciones, a especies de coral de tipo meandroide y cerioide, sobre las plocoides.











 text in
text in