Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta Jan./June 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.771
Artículos de Investigación
Relación entre las variables ambientales y el crecimiento de Pteria colymbus (Mollusca Bivalvia: Pteriidae), en tres profundidades de cultivo
1 Instituto Oceanográfico de Venezuela, Universidad de Oriente, Cumaná, Venezuela.
2 Escuela Superior Politécnica del Litoral (ESPOL), Centro Nacional de Acuicultura e Investigaciones Marinas (CENAIM), Guayaquil, Ecuador. ajmm16@hotmail.com, jormilesteban@gmail.com
3 Grupo de Investigación en Biología y Cultivo de Moluscos, Escuela de Acuicultura y Pesquerías, Facultad de Ciencias Veterinarias, Universidad Técnica de Manabí, Bahía de Caráquez, Manabí, Ecuador. cesarlodeirosseijo@yahoo.es
4 Instituto Superior de Formación Docente Salomé Ureña (Isfodosu), Santo Domingo, República Dominicana. miguevara2003@yahoo.es
Se estudió la influencia de las variables ambientales asociadas con tres profundidades de agua (2, 6 y 10 m) en el crecimiento de la concha, la masa seca de los tejidos blandos (MSTB) y la supervivencia de la ostra alada del Caribe Pteria colymbus (Roding, 1798). La clorofila a (Chl-a), el oxígeno disuelto, la materia orgánica particulada (POM) y la temperatura se estudiaron a cada profundidad. Las ostras se colocaron en 135 cestas de plástico con cinco individuos en cada cesta. Se eligieron tres cestas en cada profundidad a intervalos mensuales para las mediciones de parámetros biométricos, bioincrustaciones y supervivencia. Al final del estudio, la masa seca de los individuos cultivados a 10 m fue significativamente menor (prueba no paramétrica de Kruskal-Wallis KW, P < 0,05), mientras que los valores más altos de MSTB correspondientes a las ostras cultivadas a 2 m de profundidad. El análisis del componente principal mostró una relación inversa (temperatura) y directa (Chl-a y POM) con la varianza observada en el MSTB. Teniendo en cuenta los resultados obtenidos en los rendimientos (crecimiento/supervivencia) de P. colymbus, recomendamos llevar a cabo su cultivo a profundidades de agua entre 2 y 6 m.
PALABRAS CLAVE: bioincrustación; ambiente; profundidad; ostra; supervivencia
We studied the influence of environmental variables associated with three water depths (2, 6 and 10 m) on shell growth, soft tissues dry mass (STDM) and survival of the Caribbean winged oyster Pteria colymbus (Roding, 1798). chlorophyll-a (Chl-a), dissolved oxygen, particulate organic matter (POM) and temperature were studied at each depth. Oysters were placed in 135 plastic baskets with five individuals in each basket. Three baskets at each depth were chosen at monthly intervals for measurements of biometric parameters, biofouling, and survival. At the end of the study, dry mass of the individuals grown at 10 m was significantly lower (Kruskal-Wallis non-parametric test KW, P < 0.05) with the highest values of STDM corresponding to oysters cultivated at 2 m depth. The principal component analysis showed an inverse (temperature) and direct relationship (Chl-a and POM) with respect to the variance observed in the STDM. Taking into account the results obtained in the yields (growth/survival) of P. colymbus we recommend carrying out their culture at water depths between 2 and 6 m.
KEYWORDS: biofouling; environment; depth; oyster; survival
INTRODUCCIÓN
La ostra alada Pteria colymbus es un molusco bivalvo con una concha que se asemeja a unas alas, formada por una extensión de la charnela de ambas valvas. El tamaño de la concha de los individuos adultos puede alcanzar 60-80 mm. Normalmente están fijadas a octocorales en la zona submareal desde Carolina del Norte hasta el sur de Brasil, a profundidades de agua entre 3 y 10 m (Díaz y Puyana, 1994; Lodeiros et al., 1999a). Las ostras aladas tienen un ciclo reproductivo casi continuo en aguas tropicales (Urban, 2001). Estudios relacionados con la ecofisiología y el cultivo de P. colymbus realizados en el Parque Nacional Natural Tayrona, Caribe colombiano (Urban, 2001; Urban y Riascos, 2001; Velasco y Barros, 2010) y el golfo de Cariaco, Venezuela (Lodeiros et al., 1999b; Marques et al., 2000; Mengual et al., 2011; Freites et al., 2017) indicaron que esta especie tiene un gran potencial de acuicultura.
Los bivalvos, como organismos poiquilotérmicos, son susceptibles a las fluctuaciones en las variables ambientales (Yukihira et al., 2000, 2006; Saxby, 2002). Se han observado relaciones entre la temperatura y la disponibilidad de alimentos (de origen fitoplancton y/o seston orgánico) con la tasa de crecimiento en especies de bivalvos de aguas templadas (Thompson y MacDonald, 1991; Pilditch y Grant, 1999; Freites et al., 2017). En general, una disminución en el crecimiento se asocia con un aumento de la profundidad debido a que las condiciones ambientales se vuelven menos favorables (Tomaru et al., 2002). Sin embargo, utilizando la profundidad de cultivo como una estrategia para generar variabilidad ambiental, se observó un bajo crecimiento cerca de la superficie (MacDonald y Bourne, 1989; Román et al., 1999), mientras que se informó un crecimiento reducido por debajo de una profundidad crítica, donde las condiciones de temperatura, la disponibilidad de alimentos y la turbidez a menudo exhiben un gradiente vertical subóptimo (Frechette y Daigle, 2002).
Se han demostrado diferencias significativas en el grosor de las perlas y la profundidad de cultivo en Pteria penguin (Kanjanachatree et al., 2003). Estas diferencias estaban relacionadas con el aumento en la disponibilidad de alimentos fitoplanctónicos a profundidades más bajas. Por lo tanto, comprender cómo las variables ambientales relacionadas con la profundidad del cultivo afectan el crecimiento de los bivalvos es fundamental para establecer estrategias de cultivo en áreas tropicales, particularmente en aquellas con alta variabilidad ambiental.
El golfo de Cariaco, en el noreste de Venezuela, muestra marcadas variaciones en la temperatura y la biomasa fitoplanctónica, en toda la columna de agua, debido al régimen de vientos alisios que provocan períodos de afloramiento (Muller-Karger et al., 1994, 2013). Debido a esta variabilidad ambiental, se han llevado a cabo estudios del cultivo a diferentes profundidades con vieiras con potencial para el cultivo, como Nodipecten nodosus y Euvola ziczac, que mostraron efectos significativos de la profundidad en el crecimiento y la reproducción (Freites et al., 1996; Lodeiros et al., 1998; Lodeiros y Himmelman, 2000). Es de esperar entonces que la variabilidad ambiental propia de la columna de agua del golfo de Cariaco probablemente también genere cambios en el crecimiento de otras especies, como la ostra alada P. colymbus. El presente estudio examina las influencias de la profundidad del cultivo y las variables ambientales asociadas al crecimiento de la ostra alada P. colymbus en cultivos suspendidos en el golfo de Cariaco, Venezuela.
MATERIALES Y MÉTODOS
Área de estudio
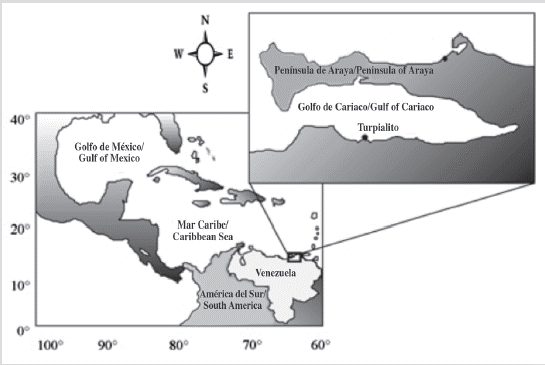
El estudio se realizó entre abril de 2013 y enero de 2014 en el sitio de Turpialito, golfo de Cariaco (Figura 1), noreste de Venezuela (10° 27' 30" N, 64° 01' 52" W). Los juveniles silvestres de P. colymbus fueron cosechados a mano en poblaciones naturales asentadas en redes de jaulas flotantes utilizadas para el cultivo de peces en la bahía Charagato, isla Cubagua, estado Nueva Esparta, Venezuela (10° 49' 49,17" N; 64° 09'40,42" O). Las ostras aladas se transfirieron a la estación de investigación en Turpialito en contenedores aislados, empacados con capas de espuma humedecidas para mantener un ambiente fresco y limitar el estrés.
Condiciones de crecimiento
Las ostras aladas juveniles (29,03 ± 5,48 mm de altura de concha -talla dorsoventral- y 0,15 ± 0,05 g de masa seca total de tejidos) fueron colocadas en cestas cilíndricas hechas de malla de plástico de malla de 2 cm y 25 cm de altura y 15 cm de diámetro, con una superficie total de 1531 cm2. Estas fueron suspendidas de una larga línea ubicada a ~ 100 m de la costa y 20 m de profundidad, mientras que las cestas se desplegaron a 2 m de profundidad, durante una semana, para aclimatarse antes de los ensayos. El experimento comenzó colocando 30 cestas experimentales más 5 cestas de sustitución para cada una a una de las profundidades de cultivo de 2, 6 y 10 m (Figura 2).
Se colocaron cestas de sustitución para mantener la densidad inicial durante todo el período experimental. Al comienzo del experimento, la altura de la concha no varió significativamente entre las ostras que serían colocadas a las tres profundidades (Kruskal-Wallis; P=0,935). Mensualmente, se recolectaban tres canastas de cada profundidad de cultivo para determinar el número de individuos vivos y muertos. En el resto de las canastas experimentales, las ostras muertas fueron contadas y reemplazadas por especímenes vivos para mantener la densidad de población inicial y las canastas fueron limpiadas para eliminar las bio-incrustaciones. La altura del eje de la concha se determinó con un calibrador digital (± 0,01 mm). Las incrustaciones en las conchas de las ostras se extrajeron cuidadosamente y se pesaron después del secado. Se retiraron los tejidos blandos de cada ostra usando equipo de disección y se separaron para determinar la masa seca de tejidos y conchas. Estos componentes se secaron en un horno (60 °C, 48 h) para obtener valores de masa seca utilizando una balanza analítica (± 0,001 g).
El número de ostras vivas se registró en cada canasta y la tasa de supervivencia total (%) se calculó en cada muestreo de la siguiente manera:
Tasa de supervivencia = (Nt/No) x 100
Donde,
Nt es el número de ostras vivas en el momento t
No es el número de ostras vivas al comienzo del experimento
Variables ambientales
La temperatura del agua se controló continuamente a cada profundidad de agua utilizando termógrafos electrónicos (Sealog-Vemco) con una periodicidad de 30 min. Se tomaron muestras de agua cada quince días usando una botella Niskin. Se tomó cuidadosamente una alícuota de cada muestra para evitar burbujas de aire en la determinación de oxígeno disuelto utilizando el método Winkler, dentro de las 6 h posteriores al muestreo (límite de detección 0,07 mg L-1). Las muestras de agua se transportaron al laboratorio en un recipiente de plástico opaco para la determinación de la salinidad con un refractómetro Atago (1 UPS de precisión). Las muestras de biomasa del fitoplancton, determinadas como clorofila a (Chl-α), y el seston total se transfirieron a una botella de plástico opaca.Todas las muestras fueron transportadas al laboratorio en contenedores isotérmicos. Posteriormente, dos réplicas de 1 L se prefiltraron (153 𝜇m) para eliminar partículas grandes y zooplancton y luego se usaron para determinar Chl-α y el seston total para cada una de las profundidades de agua. Las muestras de agua de mar se tamizaron en filtros GF/F de 0,7 𝜇m prequemados y pesados (450 °C durante 4 h), y se enjuagaron con formiato de amonio isotónico (0,5 M). El seston total se estableció después de secar los filtros a una masa constante obtenida a 60 °C (48 h). La materia orgánica particulada (POM) correspondió a la pérdida de peso después de su combustión a 450 °C durante 4 h en una mufla. La abundancia de fitoplancton se estimó determinando la concentración de Chl-α por el método espectrofotométrico siguiendo a Strickland y Parsons (1972).
Análisis estadístico
El análisis estadístico general sobre la altura y masa de la concha, la masa de los tejidos blandos y de las bioincrustaciones, y la supervivencia de las ostras se analizó utilizando la prueba no paramétrica de Kruskal-Wallis (KW), expresada gráficamente en gráficos de caja y bigotes. Este gráfico muestra la mediana, el rango y la distribución de los datos, además de servir como un ANOVA gráfico y no paramétrico. Los datos biométricos de las ostras aladas y la bioincrustación se transformaron en Log10 y el porcentaje de supervivencia se transformó en arcocoseno (Sokal y Rohlf, 1979). Se utilizó una probabilidad de 0,05 para los análisis estadísticos.
Para establecer la relación entre las variables ambientales en cada profundidad de cultivo estudiada, se realizó un análisis de componentes principales (ACP) basado en la matriz de correlación. Las variables consideradas fueron temperatura, MSTB, Chl-α y POM, que ocurrieron durante todo el período experimental (Chatfield y Collins, 1980; Clarke y Warwick, 2001). A este respecto, es necesario mencionar que no se consideró el oxígeno disuelto porque no mostró una correlación previa con ninguna de las variables utilizadas en el análisis.
RESULTADOS
Tamaño de la concha
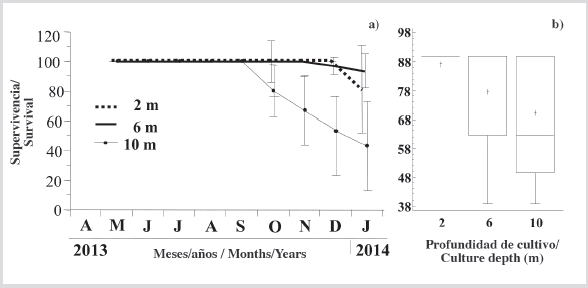
La tasa de crecimiento en la altura de la concha de la ostra mostró un incremento progresivo en las tres profundidades de cultivo (Figura 3a), que fue más evidente desde abril hasta finales de julio de 2013. Posteriormente, las tasas de crecimiento fueron más lentas pero sostenidas, mostrando una pendiente más baja hasta enero de 2014, cuando alcanzaron alturas las conchas de 69,76 ± 0,46, 68,19 ± 1,71 y 65,38 ± 1,58 mm a 2, 6 y 10 m, respectivamente, mostrando una relación estrecha, pero inversamente proporcional entre el crecimiento y la profundidad del cultivo. Sin embargo, al final del período de cultivo, no se observaron diferencias significativas (KW, P > 0,05) de los individuos cultivados en las tres profundidades (Figura 3b).
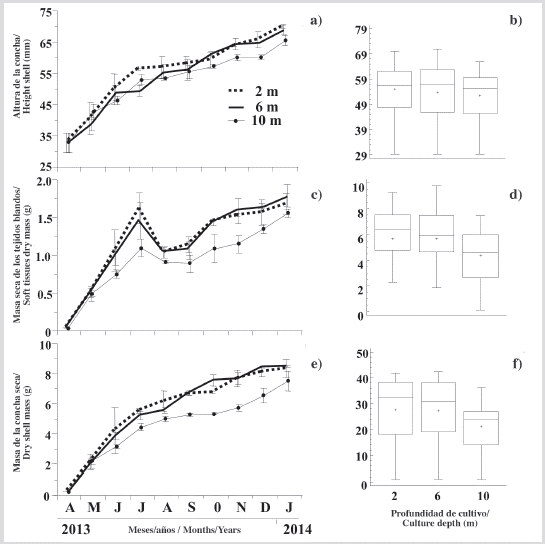
Figura 3 Variación de: a) altura de la concha, c) masa seca de los tejidos blandos y e) masa de la concha de P. colymbus cultivada a las diferentes profundidades estudiadas y sus respectivas figuras de prueba Kruskal Wallis b), d) y f). Los símbolos y las barras de error representan los valores mensuales medios más la desviación estándar, respectivamente. En las gráficas de caja y bigotes, la línea horizontal central de la caja es la mediana de los datos, la parte superior e inferior de la caja son los percentiles (cuartiles) de 25 % y 75 %, y los extremos de los bigotes son los 5 y 95 % percentiles. La muesca en el cuadro es el intervalo de confianza de 95 % de la mediana. Cuando las muescas entre las cajas no se superponen, las medianas se consideran significativamente diferentes (Briceño y Boyer, 2010).
Masa de tejidos blandos
En mayo, junio y julio hubo un marcado aumento en la masa de las ostras cultivadas a las tres profundidades, pero con menor magnitud en las ostras cultivadas a 10 m (Figura 3c). Estas tendencias fueron revertidas con una marcada caída durante agosto por las ostras cultivadas a 2, 6 y 10 m. Posteriormente, hubo una recuperación casi sostenida de la masa de tejidos blandos. Al final del experimento, los individuos tenían una masa seca de tejidos blandos a 2 m (1,67 ± 0,14 g), 6 m (1,78 ± 0,15 g) y 10 m (1,55 ± 0,10 g), siendo la masa seca de los individuos cultivados a 10 m significativamente más baja (KW, P < 0,05) que la de los cultivados a 2 y 6 m (Figura 3d).
Masa de la concha
Similar al patrón de crecimiento descrito en la altura de la concha de la ostra, la masa de la concha mostró un crecimiento sostenido durante todo el período de estudio (Figura 3e). Al final del estudio, los individuos tenían una masa seca máxima cultivada a 2, 6 y 10 m de 8,29 ± 0,60, 8,44 ± 0,40, 7,48 ± 0,67 g, respectivamente. Durante el período experimental, solo se observaron diferencias significativas (KW, P < 0,05) entre los individuos cultivados a 2 m y 10 m (Figura 3f).
Masa de las bioincrustaciones
La masa seca de las bioincrustaciones fijada en los individuos cultivados a las 3 profundidades mostró un aumento similar y moderado hasta julio (Figura 4a), y luego un aumento mayor y sostenido hasta diciembre y una disminución en enero. Después del período experimental, la acumulación de bioincrustación en los individuos no fue significativa (KW, P > 0,05) entre las tres profundidades (Figura 4b). Esto se atribuyó, en parte, a la alta variación de masa de bioincrustación de las réplicas, en cada profundidad de cultivo.
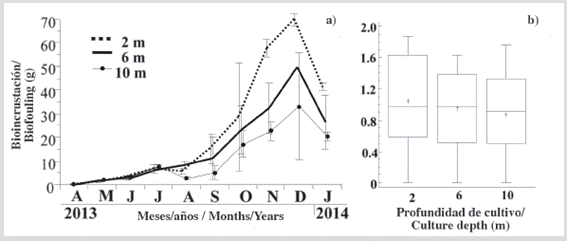
Figura 4 a) Variación de la masa seca de las bioincrustaciones fijadas sobre P. colymbus, cultivadas a las diferentes profundidades estudiadas, y b) sus respectivas pruebas de Kruskal Wallis. Los símbolos y las barras de error representan los valores mensuales medios más la desviación estándar, respectivamente.
Supervivencia
La supervivencia fue de 100 % en individuos cultivados a profundidades de 2 y 6 m hasta noviembre, y por encima de 80 y 93,3 % al final del período experimental, respectivamente (Figura 5a). Por el contrario, los individuos que crecieron a 10 m tuvieron una caída en la supervivencia desde octubre hasta el final del período de estudio, con un porcentaje final ligeramente superior al 40 %. En consecuencia, al final del período experimental se observó una supervivencia significativamente mayor (KW, P < 0,05) de individuos cultivados a 6 m (Figura 5b).
Variables ambientales
La concentración de oxígeno disuelto en las tres profundidades experimentales varió entre 6 y 9 mg L-1 durante todo el período de estudio (Figura 6a). Se observaron dos períodos de marcadas caídas, particularmente a 10 m (abril-mayo/2013, agosto-septiembre/2013) con valores más bajos de ≈ 6,5 mg L-1, y dos períodos con aumentos a las tres profundidades (julio-agosto/2013, diciembre/2013-enero/2014), donde el oxígeno disuelto alcanzó los valores más altos (≈ 8,5 mg L-1). El oxígeno disuelto mostró diferencias significativas (P < 0,05) entre tres profundidades (Figura 6b), con concentraciones más altas a profundidades más bajas.
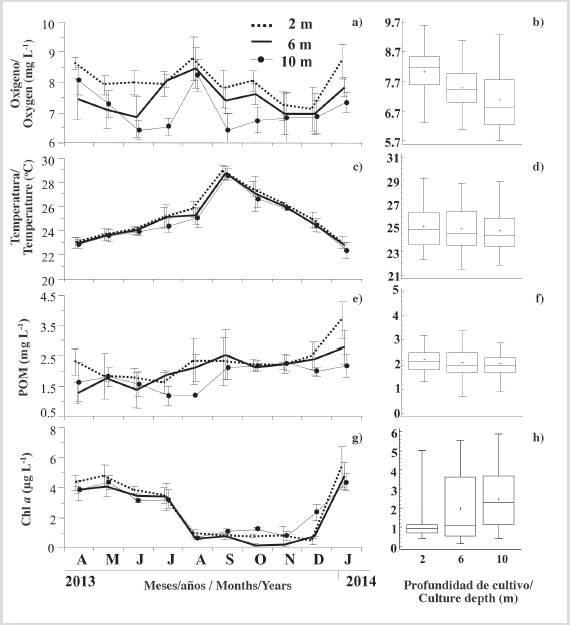
Figura 6 Variación de las variables ambientales: a) oxígeno disuelto; c) temperatura; e) POM y g) Chl-α, a las diferentes profundidades, estudiadas y sus respectivas cifras de prueba de Kruskal Wallis b), d), f), h). Los símbolos y las barras de error representan valores mensuales medios más la desviación estándar, respectivamente.
La temperatura mostró una clara tendencia al alza desde abril hasta septiembre de 2013, donde los valores máximos excedieron los 28 °C en las tres profundidades (Figura 6c). Posteriormente, se observó una disminución marcada y sostenida hasta el final del estudio, con valores de alrededor de 23 °C en las tres profundidades de cultivo. No se observaron diferencias significativas (P > 0,05) entre la profundidad y la temperatura durante el período de estudio (Figura 6d).
En general, las curvas de la materia orgánica particulada (POM) observada en cada profundidad mostraron tendencias similares a las descritas para el oxígeno disuelto, alcanzando valores mínimos en julio de 2013 (Figura 6e), especialmente a 10 m (1,17 mg L-1), y un aumento general hasta septiembre de 2013 de alrededor de 2,2 mg L-1. Finalmente, en enero de 2014, la materia orgánica alcanzó valores máximos, especialmente a profundidades de 2 y 6 m (3,67 y 2,78 mg L-1, respectivamente). No se observaron diferencias significativas (P > 0,05) entre las concentraciones de materia orgánica en las tres profundidades de cultivo (Figura 6f). La Chl-α aumentó en cada profundidad de agua desde abril hasta julio de 2013 con valores entre 4,8 y 3,2 L-1 (Figura 6g), con las concentraciones más altas a 2 m, comenzando en agosto y continuando hasta noviembre, donde las concentraciones de Chl-α disminuyeron bruscamente entre 0,2 a 1,2 𝜇g. Posteriormente, la Chl-α alcanzó su punto máximo desde diciembre de 2013 hasta enero de 2014, con concentraciones entre 5,4 y 4,3 𝜇g L-1, respectivamente, con los valores más altos a 2 m. Durante el estudio, Chl-α mostró diferencias significativas entre profundidades (KW, P < 0,05), con una relación inversa con la profundidad del agua, influenciada por las concentraciones más altas observadas entre septiembre y diciembre a 10 m (Figura 6h).
Influencia de las variables ambientales en la masa del tejido
El análisis de ACP resultó en ecuaciones que muestran una relación entre las diferentes variables estudiadas (MSTB, Chl-α, POM y temperatura), de la siguiente manera:
a) 2 m = 0,375*MSTB + 0,670*
Chl-α - 0,329*Temperatura + 0,550*POM
b) 6 m = 0,052*MSTB + 0,700*
Chl-α - 0,709*Temperatura + 0,076*POM
c) 10 m = 0,477*MSTB + 0,594*
Chl-α - 0,619*Temperatura + 0,191*POM
La ecuación general que tiene en cuenta toda la variabilidad en las tres profundidades de cultivo es:
d) 2-10 m = 0,253*MSTB + 0,662*
Chl-α - 0,634*Temperatura + 0,309*POM
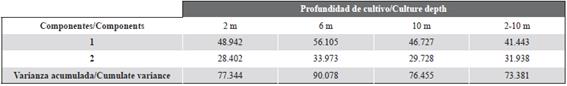
El ACP entre las diferentes variables estudiadas mostró que los dos primeros componentes explicaron un 77 % (2 m), 90 % (6 m), 76 % (10 m) y 73 % (2-10 m) de la varianza observada, lo que indica que estas son representaciones gráficas aceptables (Tabla 1). En todas las ecuaciones, las variables que contribuyen a la varianza a 2, 6 y 10 m fueron Chl-a, MSTB y POM con una correlación positiva, todas ellas inversamente relacionadas con la temperatura. Además, la relación descrita previamente para cada profundidad de cultivo fue similar a la obtenida en el intervalo de columna de agua de 2-10 m (d).
DISCUSIÓN
La disponibilidad y calidad del alimento pueden considerarse factores importantes que afectan los procesos fisiológicos relacionados con el crecimiento (Bayne y Newel, 1983). Las partículas de comida suspendidas varían en calidad y cantidad para los bivalvos y, en general, forman parte del seston, que es una mezcla compleja de organismos pelágicos (principalmente fitoplancton) y detritos suspendidos, frecuentemente asociados positivamente con la temperatura (Navarro y Thompson, 1995; Cranford y Hill, 1999; Hawkins et al., 2001). En este estudio, la biomasa de fitoplancton (Chl-α) mostró los valores más altos en el período de abril-mayo de 2013 y enero de 2014 (1,85-2,78 𝜇g L-1) cuando la temperatura fue más baja, mientras que se observaron bajas concentraciones (0,79 𝜇g L-1) en septiembre, durante la temperatura más alta. Según Lodeiros y Himmelman (2000), la relación inversa entre la temperatura y la abundancia de fitoplancton en la mayoría de los estudios concuerda con los períodos observados de afloramiento costero y estratificación del agua establecidos en el golfo de Cariaco. Los valores de Chl-α mostrados por Mengual et al. (2011) en las cercanías de la bahía de Mochima también mostraron un patrón inverso con la temperatura, es decir, la Chl-α estaba por debajo de 1 mg L-1 cuando se registró la temperatura máxima. Sin embargo, las tendencias del POM no mostraron un patrón definido, con valores generalmente superiores a 1,5 mg L-1. Estos valores son similares a los registrados por Prieto et al. (2001) y Villarroel et al. (2004) en el golfo de Cariaco. Las concentraciones más altas de POM observadas en los últimos tres meses de estudio (2-3,7 mg L-1) coincidieron con un aumento en la masa de tejidos blandos. En este sentido, Cranford y Grant (1990) informaron que, aunque el fitoplancton es una fuente importante de alimento para los bivalvos, los detritos orgánicos pueden contribuir a la absorción de energía en períodos en los que las concentraciones de fitoplancton son demasiado escasas para satisfacer las demandas de energía. Resultados similares han resaltado la importancia de la concentración de POM en ensayos comparativos para evaluar diferentes ubicaciones del cultivo de algunas especies de bivalvos, como Corbicula japonica (Kasay y Nakata, 2005), Chlamys islandica (Blicher et al., 2010), Crassostrea gigas (Beninger et al., 2008), Perna canaliculus (Gardner y Thompson, 2001), Chlamys farreri (Zhang et al., 2010), Nodipecten nodosus (Freites et al., 2003) y Moerella rutile (Kang et al., 2006).
En este estudio, las diferentes ecuaciones (A, B, C) obtenidas de la PCA mostraron que las variables que participaron en la varianza observada fueron POM, Chl-α, temperatura y MSTB de las ostras. Estos resultados concuerdan con otros estudios realizados en el golfo de Cariaco, donde se demostró que la influencia de las variables ambientales asociadas con la profundidad del cultivo puede influir en el crecimiento de algunas especies de bivalvos marinos (Lodeiros et al., 1998; Acosta et al., 2009; García et al., 2016).
Las longitudes de concha alcanzadas en diez meses por la ostra alada cultivada a tres profundidades fueron 69,76 mm (2 m), 67,19 mm (6 m) y 65,38 mm (10 m) mientras que su aumento promedio relativo alcanzó 118, 112 y 104 %, respectivamente (altura inicial ≈ 32 mm). Este crecimiento difiere notablemente de los resultados obtenidos por Gaytan-Mondragon et al. (1993), quienes encontraron un aumento de ≈ 144 % en la altura dorsal-ventral de P. sterna en 10 meses. Un incremento de tamaño similar para P. colymbus se obtuvo en 8 meses (≈ 94 %) (Lodeiros et al., 1999b).
Nuestros resultados implican la factibilidad de cultivo de las ostras aladas en el sitio de Turpialito, donde Lodeiros et al. (2002) también informaron aumentos del 100 % en el crecimiento de la concha de la ostra perla Pinctada imbricata. Los valores encontrados en este estudio para la longitud de la concha fueron más altos que los mostrados por Mengual et al. (2011), quienes cultivaron P. colymbus en la bahía de Mochima y mostraron un aumento menor en el crecimiento del eje longitudinal del 68 %, con un tamaño y un período de cultivo inicial similares. Seis meses después del período experimental, los individuos obtuvieron un incremento de la altura de la concha de 58, 54 y 52 % a profundidades de 2, 6 y 10 m, respectivamente. Estos valores son más altos que el incremento (41 %) observado durante el mismo tiempo de cultivo en la ostra alada Pteria hirundo (tamaño inicial de 39,40 mm) cultivada en Brasil a 1-2 m de profundidad (Albuquerque et al., 2012).
Los individuos muertos solo se observaron en el último muestreo, lo que puede estar relacionado con la presencia de dos especies de gasterópodos de la familia Rannellidae (Linatella caudata y Monoplexpilearis). Estos caracoles también son responsables de la mortalidad de las ostras de perla comercialmente importantes Pinctada martensis (Zhou y Pan, 1999), P. margaritifera (Aji, 2011) y P. imbricata (Malavé et al., 2012).
Las disminuciones en la masa de tejidos blandos observados en el período de agosto a septiembre para las ostras cultivadas a las tres profundidades podrían estar relacionadas con el desove, puesto que Márquez et al. (2000) observaron un pico en el reclutamiento de P. colymbus en el mismo sitio y período anual del presente estudio. Sin embargo, desde octubre hasta el final del período de cultivo, la masa de tejido aumentó en individuos cultivados en las tres profundidades de cultivo, lo que es consistente con el desarrollo de la gónada antes del pico de desove principal mostrado en diciembre por Márquez et al. (2000).
Al final del período experimental, nuestros resultados mostraron un mayor crecimiento de la biomasa de tejidos blandos de individuos cultivados en aguas poco profundas (2 y 6 m) que en aguas profundas (10 m). Esto concuerda con los resultados de Smitasiri et al. (1994) y Kanjanachatree et al. (2003), quienes registraron un mayor crecimiento de individuos de Pteria penguin cultivados en aguas poco profundas (2-5 m de profundidad) que en las profundas (15 m de profundidad). Estos autores atribuyeron esta diferencia a una mayor disponibilidad de alimentos a poca profundidad. Sims (1994) y Lee et al. (2008) también observaron un mayor crecimiento de juveniles de Pinctada margaritifera y P. maxima, respectivamente, cuando se cultivaron en aguas poco profundas. Teniendo en cuenta los resultados obtenidos en el rendimiento (crecimiento/ supervivencia) de los individuos de la ostra alada P. colymbus, recomendamos llevar a cabo su cultivo entre 2 y 6 m de profundidad.
AGRADECIMIENTOS
El estudio fue financiado con subvenciones de proyectos UDO-FONACIT 2011000344 Estación Hidrobiológica de Turpialito del Instituto Oceanográfico de Venezuela de la Universidad de Oriente como Centro de Monitoreo Ambiental y Producción de Semillas de Moluscos Bivalvos. Los autores agradecen a Andrew Dale por mejorar el idioma inglés
REFERENCIAS
Acosta, V., C. Lodeiros, A. Prieto, M. Glem e Y Natera. 2009. Efecto de la profundidad sobre el crecimiento de los mejillones Perna perna y Perna viridis (Bivalvia: Mytilidae) en cultivo suspendido en el golfo de Cariaco, Venezuela. Zoot. Trop., 27(3): 315-328. [ Links ]
Aji, L.P. 2011. An overview of the method, management, problem, and their solution in the pearl oyster (Pinctada margaritifera) culture. J. Coastal Develop., 14(3): 181-190. [ Links ]
Albuquerque, M.C.P., R. Alves, A. Zanandrea, J. Ferreira, C. Melo and A. Magalhães. 2012. Growth and survival of the pearl oyster Pteria hirundo (L., 1758) in an intermediate stage of culture in Santa Catarina, Brazil. Braz. J. Biol., 72: 175-180. [ Links ]
Bayne, B. and R. Newell. 1983. Physiological energetics of marine mollusc: 407-515. In: Salenium, A. and K. Wilbur (Eds.). The Mollusca. Academics Press. New York. [ Links ]
Beninger, P.G., A. Valdizan, P. Decottignies and B. Cognie. 2008. Impact of seston characteristics on qualitative particle selection sites and efficiencies in the pseudolamellibranch bivalve Crassostrea gigas. J. Exp. Mar. Biol. Ecol., 360: 9-14. [ Links ]
Blicher, M.E., S. Rysgaard and M.K. Sejr. 2010. Seasonal growth variation in Chlamys islandica (Bivalvia) from sub-Arctic Greenland is linked to food availability and temperature. Mar. Ecol. Prog. Ser., 407: 71-86. [ Links ]
Briceño, H.O. and J.N. Boyer. 2010. Climatic controls on phytoplankton biomass in a sub-tropical estuary, Florida Bay, USA. Estuar. Coasts, 33: 541-553. [ Links ]
Chatfield, C. and A. Collins. 1980. Introduction to multivariate analysis. Chapman and Hall, London. [ Links ]
Clarke, K. and R. Warwick. 2001. Change in marine communities: An approach to statistical analysis and interpretation. PRIMER-E Ltd., Plymouth. 82 p. [ Links ]
Cranford, P.J. and J. Grant. 1990. Particle clearance and absorption of phytoplankton and detritus by the sea scallop Placopecten magellanicus (Gemelin). J. Exp. Mar. Biol. Ecol., 137: 105-121. [ Links ]
Cranford, P.J . and P.S. Hill. 1999. Seasonal variation in food utilization by the suspension-feeding bivalve mollusks Mytilus edulis and Placopecten magellanicus. Mar. Ecol. Prog. Ser., 190: 223-239. [ Links ]
Díaz, J.M. y M. Puyana, 1994. Moluscos del Caribe colombiano. Un catálogo ilustrado. Colciencias Fundación Natura-INVEMAR. Presencia, Bogotá. 291 p. [ Links ]
Frechette, M. and G. Daigle. 2002. Growth, survival and fluctuating asymmetry of Iceland scallops in a test of density-dependent growth in a natural bed. J. Exp. Mar. Biol. Ecol., 270: 73-91. [ Links ]
Freites, L., A. Vélez y L. Hurtado. 1996. Crecimiento y producción secundaria de Euvola (Pecten) ziczac (L), en cultivo suspendido a tres profundidades. Bol. Inst. Oceanog. Venez., 35(1 y 2): 17-26. [ Links ]
Freites, L ., C. Lodeiros , N. Narváez, G. Estrella and J.M.F. Babarro, 2003. Growth and survival of the scallop Lyropecten (=Nodipecten) nodosus (L., 1758) in suspended culture in the Cariaco Gulf (Venezuela), during a non-upwelling period. Aquacult. Res., 34: 709-718. [ Links ]
Freites, L ., M. Rojas, A.W. Dale, A. Márquez, J. Revilla, C. Lodeiros and L. Tróccoli. 2017. Influence of environmental variables during seasonal upwelling on the growth of the winged oyster Pteria colymbus in a tropical ecosystem. Aquacult. Intern., 25: 1653-1666. [ Links ]
García, M., C. Lodeiros , L. Freites, H. Córdova and J. Babarro. 2016. Comparative performance of the mussels Perna perna and Perna viridis, cultivate at four different depths. Braz. J. Oceanog., 64(3): 249-262. [ Links ]
Gardner, J.P.A. and R.J. Thompson, 2001. Naturally low seston concentration and the net energy balance of the greenshell mussel (Perna canaliculus) at Island Bay, Cook Strait, New Zealand. NZ J. Mar. Freshwater Res., 35: 457-468. [ Links ]
Gaytan-Mondragon, I., C. Cáceres-Martínez and M. Tobias-Sánchez. 1993. Growth of the pearl oysters Pinctada mazatlanica and Pteria sterna in different culture structures at La Paz Bay, Baja California Sur, Mexico. J. World Aquacult. Soc., 24(4): 541-546. [ Links ]
Hawkins, A.J.S., J.G. Fang, P.L. Pascoe, J.H. Zhang, X.L. Zhang and M.Y. Zhu. 2001. Modelling short-term responsive adjustments in particle clearance rate among bivalve suspension-feeders: separate unimodal models of seston volume and composition in the scallop Chlamys farreri. J. Exp. Mar. Biol. Ecol., 261: 61-73. [ Links ]
Kanjanachatree, K., K. Piyathamrongrut and N. Inthonjaroen. 2003. Effects of sea depths and sizes of winged pearl oysters (Pteriapenguin) on pearl culture. Songklanakarin J. Sci. Techn., 25(5): 659-671. [ Links ]
Kasai, A. and A. Nakata, 2005. Utilization of terrestrial organic matter by the bivalve Corbicula japonica estimated from stable isotope analysis. Fish. Sci., 71: 151-158. [ Links ]
Lee, A.M., A. Williams and P.C. Southgate. 2008. Modelling and comparison of growth of the silverlip pearl oyster Pinctada maxima (Mollusca: Pteriidae) cultured in West Papua, Indonesia. Mar. Freshwater Res., 59: 22-31. [ Links ]
Lodeiros C., B. Marín yA. Prieto . 1999a. Catálogo de moluscos de las costas nororientales de Venezuela. Clase Bivalvia. Apudons, Caracas. 103 p. [ Links ]
Lodeiros, C. and J.H. Himmelman. 2000. Identification of factors affecting growth and survival of the tropical scallop Euvola (Pecten) ziczac in the golfo de Cariaco, Venezuela. Aquaculture, 182: 91-114. [ Links ]
Lodeiros, C ., D. Pico, A. Prieto , N. Narváez and A. Guerra. 2002. Growth and survival of the pearl oyster Pinctada imbricata (Roding 1758) in suspended and bottom culture in the golfo de Cariaco, Venezuela. Aquacult. Intern., 10: 327-339. [ Links ]
Lodeiros, C ., J. Rengel and J.H. Himmelman . 1999b. Growth of Pteria colymbus (Roding, 1798) in the golfo de Cariaco, Venezuela. J. Shellfish Res., 18: 155-158. [ Links ]
Lodeiros, C ., J. Rengel, L. Freites , F. Morales, and J.H. Himmelman . 1998. Growth and survival of the tropical scallop Lyropecten (Nodipecten) nodosus maintained in suspended culture at three depths. Aquaculture, 165: 41-50. [ Links ]
Malavé, C., L. Freites , C. Lodeiros , J. Mendoza, L. Tróccoli and A.W. Dale . 2012. Annual recruitment, predation rates, and biocontrol of Linatella caudata (MOLLUSCA: GASTROPODA) in suspended enclosure culture of the pearl oyster Pinctada imbricata. Aquaculture, 354-355: 75-83. [ Links ]
Márquez, B., C. Lodeiros , M. Jiménez y J.H. Himmelman . 2000. Disponibilidad de juveniles por captación natural de la ostra Pteria colymbus (Bivalvia: Pteriidae) en el golfo de Cariaco, Venezuela. Rev. Biol. Trop., 48(1): 151-158. [ Links ]
Mengual, M., C. Lodeiros y A. Márquez. 2011. Crecimiento y supervivencia de la ostra alada Pteria colymbus (Roding 1798), en estructuras tubulares en la Bahía de Mochima, estado Sucre, Venezuela. Zootec. Trop., 29(2): 219-229. [ Links ]
Müller-Karger, F., G.T. Taylor, Y. Astor, R.C. Thunnell, M.I. Scranton, R. Varela, L. Tróccoli , L. Lorenzoni, E. Montes, K.A. Fanning and C. Benitez-Nelson. 2013. The Cariaco Basin Ocean Time-Series. LOICZ Inprint, 1: 3-17. [ Links ]
Müller-Karger, F ., R. Aparicio and R. Castro. 1994. Mesoscale processes affecting phytoplankton abundance in the southern Caribbean Sea. Cont. Shelf Res., 14(2-3): 199-221. [ Links ]
Navarro, J.M. and R.J. Thompson . 1995. Seasonal fluctuations in the size spectra, biochemical composition and nutritive value of the seston available to a suspension-feeding bivalve in a subarctic environment. Mar. Ecol. Prog. Ser., 125: 95-106. [ Links ]
Pilditch, C.A. and J. Grant . 1999. Effect of temperature fluctuations and food supply on the growth and metabolism of juvenile sea scallops (Placopecten magellanicus). Mar. Biol., 134: 235-248. [ Links ]
Prieto, A., O. Ramos, D. Arrieche, J. Villalba yC. Lodeiros . 2001. Producción secundaria e índice de condición en Arca zebra (Molusca: Bivalvia) del golfo de Cariaco, Venezuela. Rev. Biol. Trop., 49: 599-608. [ Links ]
Román, G., M.J. Campos, C.P. Acosta and J. Cano. 1999. Growth of the queen scallop (Aequipecten opercularis) in suspended culture: influence of density and depth. Aquaculture, 178: 43-62. [ Links ]
Saxby, S.A. 2002. A review of food availability, seawater characteristics, and bivalve growth performance at coastal culture sites in temperate and warm temperate regions of the world. Fish. Res. Rep. (W. Australia), 132: 1-42. [ Links ]
Sims, N.A., 1994. Growth of wild and cultured black-lip pearl oysters, Pinctada margaritifera (L.) (Bivalvia, Pteriidae). Aquaculture, 122: 181-191. [ Links ]
Smitasiri, R.R., J. Kajitwimat and P. Tantichodok. 1994. Growth of a winged oyster Pteria penguin suspended at different depths. Phuket Mar. Biol. Cent. Spec. Publ., 13: 213-216. [ Links ]
Sokal, R.R. and F.J. Rohlf. 1979. Biometría. Principios y métodos estadísticos en la investigación biológica. Blume, Madrid. 832 p. Strickland, J. and T. Parsons. 1972. A practical handbook of seawater analysis. Bull. Fish. Res. Board Canada, 167, 310 p. [ Links ]
Thompson, R. and B. MacDonald. 1991. Physiological integrations and energy partitioning. In: An international compendium of scallops' biology and culture. Shumway, S. and P. Sandifer (Eds.). Workshops World Aquac. Soc., Baton Rouge, 14(1): 28-35. [ Links ]
Tomaru, Y., Y. Kumatabara, Z. Kawabata and S. Nakona. 2002. Effect of water temperature and chlorophyll abundance on the shell growth of Japanese pearl oyster, Pinctada fucata martensii, in suspended culture at different depths and sites. Aquaculture Res., 33: 109-116. [ Links ]
Urban, H.J. 2001. Reproductive strategies in tropical bivalves (Pteria colymbus, Pinctada imbricata and Pinna carnea): Temporal coupling of gonad production and spat abundance related to environmental variability. J. Shellfish Res., 20: 1127-1134. [ Links ]
Urban, H.J. and J.M. Riascos. 2001. Estimating gonado-somatic indices in bivalves with fused gonads. J Shellfish Res., 21(1): 249-253. [ Links ]
Velasco, L.A. and J. Barros. 2010. Spat collection and experimental culture of the Atlantic pearl oyster, Pinctada imbricata (Bivalvia: Pteriidae), under suspended conditions in the Caribbean. J. World Aquacult. Soc., 41: 281-297. [ Links ]
Villarroel, E., E. Buitrago andC. Lodeiros . 2004. Identification of environmental factors affecting growth and survival of the tropical oyster Crassostrea rhizophorae in suspended culture in the golfo de Cariaco, Venezuela. Rev. Cient. Facult. Cienc. Veterin., Univ. Zulia, 14: 28-35. [ Links ]
Yukihira, H., J.S. Lucas and D.W. Klumpp, 2006. The pearl oysters, Pinctada maxima and P. margaritifera, respond in different ways to culture in dissimilar environments. Aquaculture. 252: 208-224. [ Links ]
Yukihira, H ., J.S. Lucas and D.W. Klumpp . 2000. Comparative effects of temperature on suspension-feeding and energy budgets of the pearl oysters Pinctada margaritifera and P. maxima. Mar. Ecol. Prog. Ser., 195: 79-188. [ Links ]
Zhang, J.H., J.G. Fang and X.M. Liang. 2010. Variations in retention efficiency of bivalves to different concentrations and organic content of suspended particles. Chin. J. Oceanol. Limn., 28: 10-17. [ Links ]
.Y. and J. Pan. 1999. Species, distribution, and damage of Cymatium in seawater pearl oyster culture zones of Hainan Island. Trop. Oceanog., 18(1): 83-89. [ Links ]
Recibido: 20 de Noviembre de 2018; Aprobado: 05 de Septiembre de 2019











 text in
text in