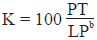Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta Jan./June 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.772
Artículos de Investigación
Presencia de Poecilia mexicana Steindachner en un estuario hiperhalino temporal del golfo de México
a Lab. Ecología Estuarina, Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, Tlalnepantla, Estado de México, México
En esta contribución se registra por primera vez a Poecilia mexicana en un estuario ciego bajo condiciones de hiperhalinidad en el golfo de México y se analizan diversas características ecológicas de la especie. Los especímenes, 170 en total (128 hembras y 42 machos), se recolectaron en mayo de 2013 en el estuario Laguna El Llano, Veracruz, México, el cual presentó aguas cálidas (31,4°C), bien oxigenadas (9,45 mg/L), transparentes, e hiperhalinas (promedio 73 UPS). Las hembras se recolectaron en un intervalo de tallas de 4,28-59,21 mm de longitud patrón y de 0,04-5,48 g en peso; los machos se colectaron en un intervalo de tallas de 15,7351,41 mm LP y de 0,091-2,97 g en peso. El intervalo de talla más numeroso fue de 10-29 mm de longitud patrón. Las hembras presentaron un crecimiento alométrico negativo; los machos presentaron un crecimiento isométrico. La hiperhalinidad del agua no pareció afectar el proceso de reproducción de P. mexicana, pues se encontraron hembras maduras con ovocitos, huevos y embriones, algunas de ellas con superfetación. La fecundidad se registró entre 12-179 ovocitos/hembra, 8-162 huevos/hembra y 29-72 embriones/hembra. El factor de condición se correlacionó positivamente con la longitud patrón y el peso. Esta especie se puede clasificar como un consumidor detritívoro que complementa su dieta con proporciones mínimas de diatomeas.
PALABRAS CLAVE: Laguna El Llano; Poeciliidae; Topote del Atlántico; Veracruz
In this contribution, Poecilia mexicana is recorded for the first time in a blind estuary study under hyperhalin conditions in the Gulf of Mexico and various ecological characteristics of the species are analyzed. 170 specimens in total (128 females and 42 males), were collected in May 2013 in the Laguna El Llano estuary, Veracruz, Mexico, which presented warm waters (31.4 °C), well-oxygenated (9.45 mg/L), transparent, and hyperhaline (average 73 UPS). Females were collected in a size range of 4.28-59.21 mm in standard length and 0.04-5.48 g by weight; males were collected in a size range of 15.73-51.41 mm LP and 0.091-2.97 g by weight. Largest size range was 10-29 mm standard length. The females presented a negative allometric growth; the males presented an isometric growth. Hyperhalinity of the water did not seem to affect the reproduction process of P. mexicana, since mature females were found with oocytes, eggs, and embryos, some of them presenting superfetation. Fertility was recorded between 12-179 oocytes/female, 8-162 eggs/female and 29-72 embryos/ female. Condition factor was positively correlated with the standard length and weight. This species can be classified as a detritivorous consumer that supplements its diet with minimal proportions of diatoms.
KEYWORDS: Laguna El Llano; Poeciliidae; Shortfin Molly; Veracruz
INTRODUCCIÓN
Los estuarios son ecosistemas de alta productividad. Su dinámica ambiental está controlada por combinaciones temporales de factores físicos, hidrológicos y meteorológicos que determinan patrones ecológicos cambiantes (Brito, 2012), por lo que se ven como mosaicos naturales compuestos por distintos hábitats que aportan servicios ecosistémicos a las poblaciones de peces como zonas de refugio, crianza y alimentación (Needles et al., 2015). Las especies marinas son las más numerosas en las comunidades estuarinas de peces, que ocupan estos hábitats en las fases jóvenes de sus ciclos de vida; en contraste, se afirma que las especies de origen dulceacuícola se encuentran en número reducido y en abundancias bajas solo cuando hay aportes consistentes de agua dulce (Potter et al., 2015), por lo que se califican como especies en tránsito o visitantes accidentales (Whitfield, 2015).
Sin embargo, varias especies de la familia Poeciliidae son capaces de colonizar estuarios desde la costa Atlántica de los Estados Unidos hasta Argentina e islas del mar Caribe. En particular, el género Poecilia es nativo de hábitats dulceacuícolas y algunas especies como P sphenops, P. latipinna y P. mexicana se han registrado en otros estuarios del golfo de México (Rodríguez-Varela et al., 2010; Vega-Cendejas et al, 2013; Chávez-López et al, 2015). Hasta ahora, no se ha reconocido la tolerancia a la salinidad de P. mexicana, por lo que en este escrito se describen características de la ecología de esta especie dulceacuícola en el estuario Laguna El Llano de Veracruz, México, bajo condiciones de hiperhalinidad.
MATERIALES Y MÉTODOS
Área de estudio
El estuario Laguna El Llano (ELEL) se localiza a 19°40' 05" N y 96°23' 54" O, en el municipio de Actopan, Veracruz (Figura 1). Es un cuerpo de agua de 226 ha y la profundidad en los márgenes internos es menor de 1 m de profundidad, pero en el canal central alcanza un intervalo de profundidad que varía estacionalmente de 2 a 4 m.
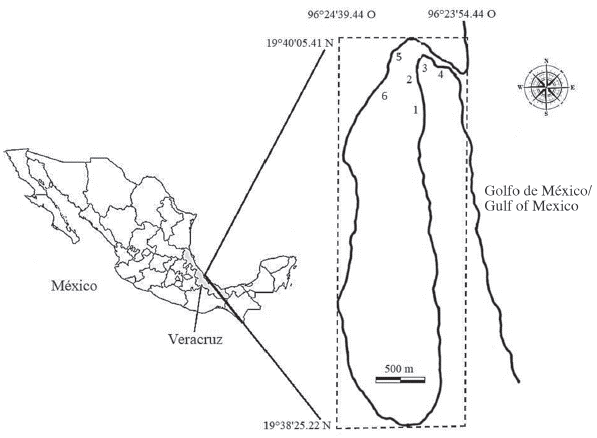
Figura 1 Ubicación del estuario Laguna El Llano (ELEL), municipio de Actopan, Veracruz, México. Los números indican los sitios de muestreo (SM1-SM6) en mayo de 2013.
El clima es cálido húmedo con lluvias en verano (Aw2) (García, 2004), la precipitación anual media es de 1286 mm y la temperatura media anual de 24 °C. En la región se diferencian tres estaciones climáticas: la cálida transcurre entre abril y junio; la de lluvias, entre julio y octubre, y la estación fría sucede de noviembre a marzo (Morán-Silva et al., 2005). Precisamente en esta estación se forma una barra arenosa en la boca de comunicación del estuario debido a procesos sedimentarios costeros. Por esta característica geomorfológica, aquí se usa la definición de estuario de Potter et al. (2010), que alude al aislamiento temporal del estuario y a la potencialidad de que este evento provoque condiciones de hiperhalinidad.
Los especímenes de P. mexicana solo se colectaron en mayo de 2013. Este fue el muestreo inicial de una investigación sobre la comunidad de peces de ELEL que se realizó entre ese mes y mayo de 2014. Las recolectas se realizaron en seis sitios de muestreo (SM) cercanos a riberas de mangle rojo Rhizophora mangle y de mangle negro Avicennia germinans, caracterizados por fondos lodosos y cercanos a arrecifes del ostión Crassostrea virginica. El muestreo se restringió a profundidades menores de 1,2 m; no se extendió hacia la zona sur del estuario debido a lo somero de la columna de agua (menos de 30 cm) y a la consistencia lodosa (> 1 m) del horizonte superior del sustrato. Los SM se ubicaron con un GPS Garmin 10X GPS. También se registró el oxígeno disuelto (mg/L) y la temperatura del agua (°C) con un oxímetro Oakton DO 300 con precisión de 0,1 °C; salinidad (UPS), con un refractómetro Vista A366ATC con precisión de 0,1 UPS; turbidez, con un turbidímetro La Motte 2020 (UNT) con precisión de 0,1 UNT; pH, con un pHmetro Oakton pH 110 Meter con precisión de 0,1 unidad de pH, y profundidad (cm), con una sonda Echotest II Plastimo con precisión de 0,1 cm. Las categorías de salinidad se definieron con base en la propuesta del Sistema de Venecia (Ito, 1959).
Los especímenes fueron capturados usando una red de arrastre tipo chinchorro de 25 m de largo por 2 m de alto con una luz de malla de 6,5 mm. Se procuró que el área de colecta en cada SM fuese de 300 m2; solo en la SM 2 fue de 125 m2. Todos los especímenes colectados se colocaron en hielo y luego en frascos con etanol al 70 %. En el laboratorio se lavaron, se fijaron con formalina al 5 % y se almacenaron en etanol al 70 %. Los especímenes se identificaron con Álvarez del Villar (1970) y Miller et al. (2009). Cada pez se midió con una escala en longitud patrón (LP) hasta 0,01 mm. El peso individual (P), de las gónadas (PG) y del hepatopáncreas (PH) se midieron con una balanza electrónica Cole-Parmer Simmetry con precisión de 0,001 g. La diferencia de P menos PG se tomó como el peso somático (PS).
Análisis estadístico
Se estableció la estructura por tallas separando a los organismos en intervalos de 10 mm de longitud. Las tallas se definieron usando el método de análisis de frecuencias de Pope et al. (2010). El crecimiento relativo se evaluó con base en la relación biométrica LP vs. P, donde LP fue la variable independiente. Esta relación biométrica se ajustó usando una función potencial (Y = aXb), donde a es la ordenada al origen (coeficiente de crecimiento inicial) y b es la pendiente (coeficiente de crecimiento o también llamado coeficiente de alometría). Los valores de LP y P se transformaron a logaritmos y el resultado de la relación lineal se ajustó con una regresión de mínimos cuadrados usando P como variable dependiente (Le Creen, 1951; Ricker, 1975). El grado de asociación entre las variables se estableció mediante el coeficiente de determinación (r2). Se calcularon las relaciones LP vs. P para toda la muestra de peces y por cada sexo.
Para probar la hipótesis de crecimiento isométrico se usó una prueba de t student probando Ho: b = 3 contra H1: b ≠ 3 con n-1 grados de libertad y un nivel de significancia de P = 0,05. De la misma manera, para determinar si ocurrieron diferencias entre los valores de b de machos y hembras, se probó Ho: bmachos - bhembras = 0, lo que indica diferencias entre las pendientes; contra H1: bmachos - bhembras 4 0, que indica diferencias en el valor de b entre los grupos. Además se usó una prueba de ANCOVA para comparar las diferencias entre las relaciones biométricas de LP vs. P entre sexos usando LP como covariado. Todos los procedimientos estadísticos se calcularon con el programa PAST (Hammer et al., 2001) con significancia de P = 0,05.
Se estimó el factor de condición de Fulton K, que se usó para comparar el bienestar de los peces con la suposición de que un pez más pesado a una longitud determinada tiene mejor condición (Le Creen, 1951), de acuerdo con la ecuación:
Donde,
P = peso de cada pez en g
LP = longitud patrón individual en mm
b se usó como la constante de crecimiento relativo y el factor 100, para escalar K a la unidad. Este modelo se aplicó por separado al grupo de machos y de hembras, usando el valor respectivo del coeficiente de alometría b.
Los valores individuales de K de machos y hembras se correlacionaron a sus valores respectivos de LP y P como variables independientes. El Índice Gonadosomático (IGS, De Vlaming et al, 1982) de machos y hembras también se correlacionó con LP, P, PS, PG y PH (Vazzoler, 1996). En todos los casos se usó la prueba de correlación de Pearson con P = 0,05.
La madurez gonádica y los estadios de desarrollo embrionario se definieron con base en los criterios de Riesch et al. (2011). En las gónadas de 50 hembras se contaron los ovocitos y embriones. Con estos registros se estimó la fecundidad.
La composición de la dieta se determinó con el método numérico de rejilla (Trujillo-Jiménez y Toledo, 2007). Los tipos alimentarios se identificaron al nivel taxonómico más preciso posible. Las especies de diatomeas se identificaron con Prescott (1978) y Bellinger y Sigee (2010). La composición de la dieta entre tallas se comparó con una prueba ANDEVA de una vía con P = 0,05.
RESULTADOS
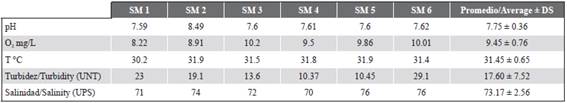
Los registros hidrológicos de mayo de 2013 correspondieron a agua cálida, ligeramente alcalina, bien oxigenada e hiperhalina (Tabla 1). En junio de 2013, la barra arenosa se desintegró y se reanudó el intercambio de agua entre el estuario con la plataforma marina.
Tabla 1 Registros hidrológicos en ELEL para mayo de 2013 durante la fase de boca estuarina cerrada. UNT: Unidades Nefelométricas de Turbidez, UPS: Unidades Prácticas de Salinidad, DS: Desviación Estándar.
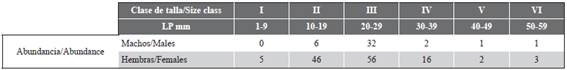
Poecilia mexicana solo se colectó en mayo de 2013 y fue la especie más abundante. También se obtuvieron otras tres especies: Mugil cephalus, Centropomus undecimalis y Lutjanus griseus. De los 170 individuos, 128 fueron hembras en un intervalo de LP de 4,28-59,21 mm y de 0,04-5,48 g P y 42 fueron machos en un intervalo de 15,7351,41 mm LP y de 0,091-2,97 g P. Las clases de talla de 10-19 y 20-29 mm LP fueron las más numerosas. Los organismos de estos intervalos agruparon al 90,5 % de la abundancia de los machos y al 79,7 % de la abundancia de las hembras (Tabla 2).
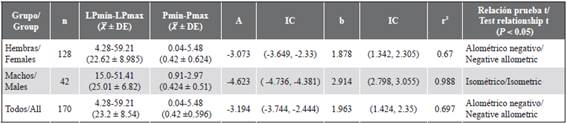
Las hembras de P. mexicana presentaron crecimiento alométrico negativo (P < 0,001) mientras que los machos tendieron hacia un crecimiento isométrico (P < 0,001) (Tabla 3). Los incrementos en peso no fueron diferentes entre machos y hembras (P > 0,05).
Tabla 3 Parámetros del modelo de crecimiento relativo (Peso P vs. Longitud Patrón LP) para hembras, machos y todos los individuos de P. mexicana en ELEL.
El factor de condición K de las hembras se registró en un intervalo de 0,036-4,31 (promedio ± DE: 0,33 ± 0,488) y para los machos, de 0,86-2,64 (promedio ± DE: 0,405 ± 0,464). K se correlacionó positivamente a LP y P de hembras y machos (P < 0.001) (Figura 2a y Figura 2b).
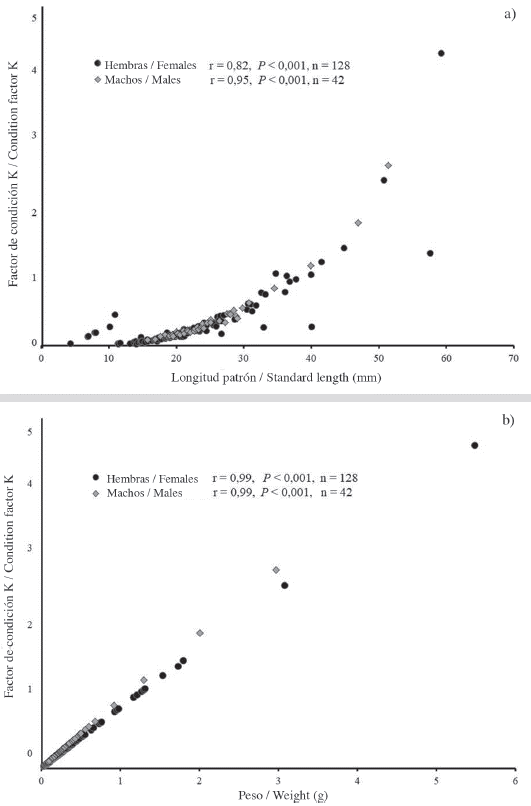
Figura 2 Factor de condición (K) por sexos de P. mexicana en ELEL. a) factor de condición K correlacionado a LP como variable independiente; b) factor de condición K correlacionado a P como variable independiente.
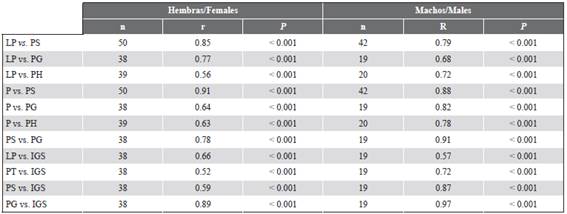
La LP de las hembras mostró relaciones positivas con PS, PG e IGS; por otro lado, el peso (P) tuvo una correlación alta con PS y una correlación positiva con PG, que a su vez mostró correlación positiva con IGS. Estos resultados indican que los incrementos de LP y P de las hembras no influyeron en el desarrollo gonádico. Todas las correlaciones fueron significativas (P < 0,001). En el caso de los machos, se encontraron correlaciones positivas entre LP y P respecto a PS, PG y PH. Las correlaciones con el índice gonadosomático fueron más altas entre LP y P respecto a PG e IGS. También todas las correlaciones fueron significativas (P < 0,001) (Tabla 4).
Tabla 4 Correlaciones entre variables somáticas y variables gonádicas de P. mexicana bajo condiciones de hiperhalinidad en ELEL.
De 50 hembras revisadas, 11 no mostraron desarrollo gonádico. Las hembras con algún nivel de madurez gonádica estuvieron en intervalos de 13,7-34,7 mm LP y de 0,07-1,31 g P. Diez hembras entre 36,3-50,7 mm LP cargaban productos reproductivos como huevos y embriones. De estas últimas, en cuatro se encontraron embriones en diferentes niveles de desarrollo. Finalmente, una hembra de 50,69 mm LP presentó ovocitos, huevos y embriones. La fecundidad se registró entre 12-179 ovocitos/hembra (promedio 31,3 ovocitos/hembra), 8-162 huevos/hembra (promedio 54,3 huevos/hembra) y 29-72 embriones/hembra (promedio 51,2 embriones/hembra). Solo se encontró correlación positiva entre LP de las hembras con el número de ovocitos (n = 7, r = 0,85, P < 0,05).
La dieta de P. mexicana en ELEL se compuso principalmente de detritus (97,7 %). En la porción restante se encontraron diatomeas (1,5 %), algas no identificadas, foraminíferos y restos de crustáceos (0,26 % cada ítem). Las diatomeas observadas corresponden a Navicula radiosa, N. chryptocephala, Diatoma hemiale, Surirella robusta var. splendida, Cymbella sp. y Nitzschia sp. La comparación de la dieta entre las clases de talla no mostró diferencias (P < 0,05); esta composición alimentaria identifica a P. mexicana como un consumidor detritívoro.
DISCUSIÓN
Este es el primer registro de P. mexicana en aguas estuarinas hiperhalinas. Respecto a su tolerancia a la salinidad, Miller (1983) publicó su ocurrencia en estuarios del golfo de México. En escritos posteriores se ha registrado en salinidades menores a 15 UPS (Castro-Aguirre y Mora-Pérez, 1984; Rodríguez-Varela et al., 2010; Aguirre-León et al., 2014; Chávez-López et al., 2015).
La capacidad de P. mexicana para soportar salinidades elevadas puede explicarse por procesos bioquímicos y morfológicos descritos en otras especies, como la secreción de carbohidratos en el intestino (Laverty y Skadhauge, 2015) que provoca la precipitación del calcio y aumenta la capacidad de absorber el cloruro de sodio de las aguas hipersalinas (Whittamore, 2012). Otras investigaciones consideran la reducción de la permeabilidad branquial mediante la regulación de los niveles de proteínas aquaporinas en los epitelios branquiales (Tipsmarck et al., 2010; Verkman, 2012), que se pueden relacionar con cambios en las tasas de ingestión de agua que se incrementan en los peces que colonizan aguas salinas (Nordlie, 2006). Otras evidencias indican que disminuye la permeabilidad iónica de la superficie corporal y en las células secretoras de iones de las branquias, que son esenciales para eliminar grandes cantidades de sales en hábitats marinos e hiperhalinos (González, 2012).
La hiperhalinidad del agua no limitó la reproducción de P. mexicana. La evidencia aportada por las hembras al presentar ovocitos y embriones demuestra el uso de energía para procesos reproductivos, a pesar de que se propone que bajo condiciones de estrés ambiental el presupuesto energético se reorienta hacia el mantenimiento fisiológico basal (Stearns, 1992). Incluso los promedios del número de ovocitos (31,3 ovocitos/hembra) y de huevos (54,3 huevos/hembra) fueron similares a los encontrados en una laguna costera oligohalina de la región (Chávez-López et al., 2015). Además, tanto el factor de condición como el peso gonádico se correlacionaron positivamente con los incrementos de longitud y de peso. Los intervalos de estos dos parámetros fueron similares a los encontrados en hembras colectadas en hábitats acuáticos superficiales y de cavernas del sur de México (Riesch et al., 2006).
El promedio de embriones (51,2 embriones/hembra) fue similar al encontrado para hembras del Sistema Lagunar de Alvarado (promedio 58,9 embriones/hembra). Estos valores contrastan con el intervalo de embriones portados por hembras que habitan aguas sulfurosas en cavernas (1-14 embriones) (Tobler y Plath, 2011). Aunque se hubiese esperado un número bajo de huevos y embriones en las hembras de ELEL por la influencia de la hiperhalinidad, los intervalos registrados en ELEL son más aproximados a los registrados en hábitats oligohalinos de la región, lo que indicaría un efecto mínimo de la salinidad en el esfuerzo reproductivo de las hembras.
En otros cyprinodontiformes se ha encontrado que esta respuesta implica altas inversiones de energía para la reproducción, pero el nivel de la condición corporal disminuye como en Gambusia holbrooki (Alcaraz y García-Berthou, 2007). Los aumentos de la salinidad crean niveles de estrés subletales que provocan un gasto de energía mayor por la osmoregulación adicional y reducen la energía destinada para la reproducción, el mantenimiento de la condición corporal y el aprovisionamiento lecitotrófico (Martin et al., 2009).
El análisis de la dieta mostró que el detritus fue el alimento principal de P. mexicana, por lo que se le reconoce como consumidor detritívoro (Miller, 2009). Esta especie es capaz de modificar su dieta en diferentes condiciones hidrológicas con base en la disponibilidad de otros alimentos; por ejemplo, se encontraron diferentes especies de algas como alimento principal en especímenes del Sistema Lagunar de Alvarado, Veracruz (Chávez-López et al., 2015). En condiciones extremas de cuevas con aguas sulfurosas de Tabasco, México, se consumieron artrópodos acuáticos principalmente, pero en cuevas con corrientes de agua dulce, se encontró un consumo combinado de detritus con guano de murciélago (Tobler, 2008). Con esta evidencia, la alimentación detritívora de P. mexicana destaca como una gran ventaja para sobrevivir en aguas hiperhalinas. Por la vasta disponibilidad del detritus en el estuario, el alimento deja de ser un factor ambiental limitante.
Con base en esta información, P. mexicana es una excepción a las razones que propone Whitfield (2015) para explicar por qué las especies de peces dulceacuícolas están subrepresentadas en los estuarios. La primera razón señala su incapacidad para soportar fisiológicamente intervalos amplios de salinidad. La información que se presenta aquí reveló los niveles de tolerancia de esta especie. La segunda razón se refiere a la adaptación a recursos alimentarios alterados en los estuarios comparados a los sistemas dulceacuícolas. En el caso de P. mexicana, sus hábitos detritívoros le facilitan esta condición. La tercera razón señala que las especies dulceacuícolas no son competidoras hábiles respecto a especies marinas y estuarinas en los estuarios. Aquí se demuestra lo contrario por la mayor abundancia registrada respecto a las especies marinas recolectadas, así como por el mantenimiento de sus procesos reproductivos. La cuarta razón se refiere a su posible combinación en ensamblajes de peces de origen marino y la última razón sugiere que las especies de agua dulce difícilmente logran superar los obstáculos ambientales entre los estuarios y las corrientes de agua dulce. La distribución de P. mexicana en esta región del golfo de México y su ocurrencia en hiperhalinidad señalan una gran capacidad para colonizar hábitats estuarinos en condiciones ambientales extremas.
AGRADECIMIENTOS
Los autores agradecen a la cooperativa El Llano, Tinajitas y El Viejón, representada por el señor Faustino Carmona Prieto, por las facilidades para la colecta de los especímenes y al señor Sergio Montero "Chaleco" por su apoyo y asistencia durante el trabajo de campo. Este trabajo fue apoyado parcialmente por la División de Investigación de la Facultad de Estudios Superiores Iztacala, Universidad Nacional Autónoma de México, México.
REFERENCIAS
Aguirre-León, A., H. E. Pérez-Ponce y S. Díaz-Ruiz. 2014. Heterogeneidad ambiental y su relación con la diversidad y abundancia de la comunidad de peces en un sistema costero del golfo de México. Rev. Biol. Trop., 62(1): 145-163. [ Links ]
Alcaraz, C. and E. García-Berthou. 2007. Life history variation of invasive mosquitofish (Gambusia holbrooki) along a salinity gradient. Biol. Conserv., 139: 83-92. [ Links ]
Álvarez, J. 1970. Peces mexicanos (claves). Instituto Nacional de Investigaciones Biológicas y Pesqueras, México. 166 p. [ Links ]
Bellinger, G.B. and D.C. Sigee. 2010. Freshwater algae. Identification and use as bioindicators. Oxford University Press. UK. 271 p. [ Links ]
Brito, A. C. 2012. A changing definition of estuary? Adjusting concepts to intermittently closed and open coastal systems. J. Ecosyst. Ecogr., 2(1): 1000e106. doi: 10.4172/2157-7625.1000e106 [ Links ]
Castro-Aguirre, J.L. y C. Mora-Pérez. 1984. Relación de algunos parámetros hidrometeorológicos con la abundancia y distribución de peces en la Laguna de la Mancha, Veracruz. An. Esc. Nal. Cienc. Biol. Méx., 75: 657- 702. [ Links ]
Chávez-López, R., A. Rocha-Ramírez and H. Cortés-Garrido. 2015. Some ecology features of Poecilia mexicana Steindachner, 1863 (Osteichthyes: Poeciliidae) from Alvarado Lagoonal System, Veracruz, Mexico. Am. J. Life Sci., 3(2): 76-84. [ Links ]
De Vlaming, V., G. Grossman and F. Chapman.1982. On the use of the gonosomatic index. Comp. Biochem. Physiol., 73A: 31 -39. [ Links ]
García, E. 2004. Modificaciones al sistema de clasificación climática de Kõppen. Universidad Nacional Autónoma de México, México. 91 p. [ Links ]
González, R. 2012. The physiology of hyper-salinity tolerance in teleost fish: a review. J. Comp. Physiol. B, 182: 321-329. [ Links ]
Hammer, Ø., D.A.T. Harpe and P.D. Ryan. 2001. PAST: Paleontological statistics software package for education and data analysis. Paleont. Electr., 4: 9. [ Links ]
Ito, T. 1959. The Venice system for the classification of marine waters according to salinity: Symposium on the classification of brackish waters, Venice, 8-14 April 1958. Jap. J. Limnol., 20(3): 119-120. [ Links ]
Laverty, G. and E. Skadhauge. 2015. Hypersaline environments: 85-106. En: Riesch, R., M. Tobler and M. Plath (Eds.). Extremophile fishes. Springer International Publishing, Switzerland. 325 p. [ Links ]
Le Cren, E. 1951. The length-weight relationship and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis). J. Anim. Ecol., 66: 1504-1512. [ Links ]
Martin, S.B., A.T. Hitch, K.M. Purcell, P.L. Klerks and P.L. Leberg. 2009. Life history variation along a salinity gradient in coastal marshes. Aq. Biol., 8: 15-28. doi: 10.3354/ab00203 [ Links ]
Miller, R.R. 2009. Peces dulceacuícolas de México. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Sociedad Ictiológica Mexicana A.C., El Colegio de la Frontera Sur y Consejo de los Peces del Desierto México-Estados Unidos. México. 559 p. [ Links ]
Miller, R.R. 1983. Checklist and key to the mollies of Mexico (Pisces: Poeciliidae: Poecilia, subgenus Mollienesia). Copeia, (3): 817-822. Stable URL: http://www.jstor.org/stable/1444354. [ Links ]
Morán-Silva, A., L. Martínez-Flores, R. Chávez-López, F. Contreras, F. Gutiérrez, N. Brown-Peterson and M. Peterson. 2005. Seasonal and spatial patterns in salinity, nutrients, and chlorophyll-a in the Alvarado Lagoonal System, Veracruz, México. Gulf Carib. Res., 17: 133-143. [ Links ]
Needles, L.A., S.E. Lester, R. Ambrose, A. Andren, M. Connor, J. Eckman, B. Costa-Pierce, S.D. Gaines, M.S. Peterson, A. Scaroni, J. Weis and D.E. Wendt. 2015. Managing bay and estuarine ecosystems for multiple services. Estuar. Coast. 38(Suppl.1): S35-S48. doi: 10.1007/s12237-013-9602-7. [ Links ]
Nordlie, F.G. 2006. Physicochemical environments and tolerances of cyprinodontoid fishes found in estuaries and salt marshes of eastern North America. Rev. Fish Biol. Fish., 16: 51-106. [ Links ]
Pope, K.L., S.E. Lochman and M.K. Young. 2010. Methods for assessing fish populations: 325-351. In: Quist, M.C. and W.A. Hubert (Eds.). Inland fisheries management in North America. American Fisheries Society, Maryland. 736 p. [ Links ]
Potter, I.C., B.M. Chuwena, S.D. Hoeksemaa and M. Elliott. 2010. The concept of an estuary: A definition that incorporates systems which can become closed to the ocean and hypersaline. Estuar. Coast. Shelf Sci., 87(3): 497-500. [ Links ]
Potter, I.C ., J.R. Tweedley, M. Elliott and A.K. Whitfield. 2015. The ways in which fish use estuaries: a refinement and expansion of the guild approach. Fish Fish, 16(2): 230-239. http://onlinelibrary.wiley.com/doi/10.1111/faf.12050/full. [ Links ]
Prescott, G.W. 1978. How to know the freshwater algae. W. C. Brown Co., Iowa. 293 p. [ Links ]
Ricker, W.E. 1975. Computation and interpretation of biological statistics of fish populations. Fisheries and Marine Service, Ottawa. 382 p. [ Links ]
Riesch, R., I. Schlupp, M. Tobler and M. Plath. 2006. Reduction of the association preference for conspecifics in cave-dwelling Atlantic mollies, Poecilia mexicana. Behav. Ecol. Sociobiol., 60(6): 794-802. doi:10.1007/s00265-006-0223-z. [ Links ]
Riesch, R ., I. Schlupp , R.B. Langerhans and M. Plath. 2011. Shared and unique patterns of embryo development in extremophile poeciliids. PLoS ONE, 6(11): e27377. doi:10.1371/journal.pone.0027377. [ Links ]
Rodríguez-Varela, A.C., A. Cruz-Gómez and H. Vázquez-López. 2010. List of ichthyofauna in the Sontecomapan lagoon, Veracruz, México. Biocyt, 3(9): 107121. [ Links ]
Stearns, S.C. 1992. The evolution of life histories. Oxford University Press, Oxford. 249 p. [ Links ]
Tipsmark, C.K., K.J. Serensen and S.S. Madsen. 2010. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation. J. Exp. Biol., 213:368- 379. [ Links ]
Tobler, M. 2008. Divergence in trophic ecology characterizes colonization of extreme habitats. Biol. J. Linn. Soc., 95: 517-528. [ Links ]
Tobler, M. and M. Plath. 2011. Living in extreme environments: 120-127. In: Evans, J., A. Pilastro and I. Schlupp (Eds.): Ecology and evolution of poeciliid fishes. Chicago University Press, Chicago. 424 p. [ Links ]
Trujillo-Jiménez, P. y B.H. Toledo. 2007. Alimentación de los peces dulceacuícolas tropicales Heterandria bimaculata y Poecilia sphenops (Cyprinodontiformes: Poeciliidae). Rev. Biol. Trop., 55(2): 603-615. [ Links ]
Vazzoler, A. 1996. Biología da reproduçao da peixes teleosteos. EDUEM, São Paulo. 169 p. [ Links ]
Vega-Cendejas, M.E., M. Hernández de Santillana and S. Norris. 2013. Habitat characteristics and environmental parameters influencing fish assemblages of karstic pools in southern Mexico. Neotrop. Ichthyol., 11(4): 859-870. [ Links ]
Verkman, A.S. 2011. Aquaporins at a glance. J. Cell Sci., 124:2107-2112. [ Links ]
Whitfield, A.K. 2015. Why are there so few freshwater fish species in most estuaries? J. Fish Biol., 86: 1227-1250. doi:10.1111/jfb.12641. [ Links ]
Whittamore, J.M. 2012. Osmoregulation and epithelial water transport: lessons from the intestine of marine teleost fish. J. Comp. Physiol. B, 182: 1-39. [ Links ]
Recibido: 29 de Mayo de 2019; Aprobado: 10 de Diciembre de 2019











 text in
text in