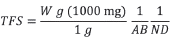Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta Jan./June 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.773
Artículos originales
Evaluación de la estructura comunitaria de las esponjas marinas en parches arrecifales del Caribe sur, Costa Rica
1. Escuela de Ciencias Biológicas, Universidad Nacional, Heredia, Costa Rica.
2. Departamento de Biología, Instituto de Ciencias del Mar, La Habana, Cuba.
Las esponjas marinas cumplen un gran número de funciones críticas para los arrecifes coralinos. A su vez, las variaciones en la estructura comunitaria de los poríferos pueden indicar cambios en las condiciones ambientales de los ecosistemas donde habitan. Sin embargo, su estudio ha sido escaso en el Caribe de Costa Rica, principalmente en el ámbito ecológico. Por tanto, se evaluó la estructura comunitaria de estos organismos en cuatro parches arrecifales (Perezoso, Pequeño, Coral Garden y el 0,36) y se determinó si podía ser explicada por la sedimentación, el sustrato y la profundidad. Se calculó la abundancia relativa (AR) y la cobertura relativa (CR) para cada especie, la densidad de esponjas e índices de diversidad (riqueza de especies, heterogeneidad de Shannon, equitatividad de Pielou y dominancia de Simpson) para cada sitio de muestreo. Se comparó la similitud entre sitios respecto a las abundancias relativas de esponjas versus sedimentación, sustrato y profundidad. Se encontraron 13 nuevos registros de esponjas para el país. Perezoso presentó la mayor cobertura de esponjas (CR = 6,1 %) compuesta principalmente por Cliona caribbaea (CR = 2,0 %) y con Niphates erecta como especie dominante (AR = 59,3 %). La riqueza de especies aumentó a medida que aumentaba la profundidad en los sitios. Perezoso y Coral Garden mostraron la mayor similitud en cuanto a la abundancia de especies y compartieron a N. erecta, Iotrochota birotulata y Scopalina ruetzleri como las especies más abundantes. Asimismo, compartieron las mayores frecuencias de aparición (40 %) de esponjas perforadoras del género Siphonodictyon y la presencia de la especie bioerosionadora C. caribbaea. La similitud entre Perezoso y Coral Garden podría estar influenciada en mayor medida por la alta disponibilidad de pavimento calcáreo como sustrato predominante (48 < PC % < 67), el cual parece favorecer la abundancia de esponjas heterotróficas y generalistas, así como la de especies perforadoras y bioerosionadoras.
PALABRAS CLAVE: Porífera; arrecife de coral; sedimentación; sustrato; profundidad
Marine sponges fulfill many critical functions to coral reefs. In turn, variations in the community structure of the poriferans may indicate changes in the environmental conditions of the ecosystems where they live. However, their study has been scarce in the Caribbean of Costa Rica, mainly in the ecological field. Therefore, the community structure of these organisms was evaluated in four reef patches (Perezoso, Pequeño, Coral Garden, and the 0.36) and it was determined whether it could be explained by sedimentation, substrate, and depth. Relative abundance (RA) and relative coverage (RC) for each species, sponge density, and diversity indices (species richness, Shannon heterogeneity, Pielou's evenness, and Simpson's dominance) were calculated for each sampling site. Similarity between sites was compared to the relative abundance of sponges versus sedimentation, substrate, and depth. 13 new sponge records were found for the country. Perezoso had the highest sponge coverage (RC = 6.1 %) composed mainly by Cliona caribbaea (RC = 2.0 %) and with Niphates erecta as the dominant species (RA = 59.3 %). Species richness increased as site depth increased. Perezoso and Coral Garden showed the biggest similarity in terms of species abundance and shared N. erecta, Iotrochota birotulata and Scopalina ruetzleri as the most abundant species. These sites also shared the highest occurrence frequencies (40 %) of excavating sponges of the genus Siphonodictyon and the presence of the boring species C. caribbaea. Similarity between Perezoso and Coral Garden could be influenced to a greater extent by the high availability of calcareous pavement as a predominant substrate (48 < PC % < 67), which seems to favor the abundance of heterotrophic and generalist sponges, as well as that of excavating species and boring sponges.
KEYWORDS: Porifera; coral reef; sedimentation; substrate; depth
INTRODUCCIÓN
Las esponjas (filo Porifera) conforman uno de los grupos de animales sésiles más diversos y abundantes de los fondos marinos, y se encuentran en ecosistemas tan importantes y diversos como los manglares, pastos marinos, arrecifes de coral y mar profundo (Díaz, 2012; Cruz-Barraza et al., 2012; Carballo et al., 2014). Para los arrecifes coralinos del mar Caribe se han registrado más de 325 especies de esponjas, y se considera que la diversidad y biomasa de estos organismos en dicho ecosistema puede exceder a la de los corales escleractíneos (orden Scleractinia) y a la de los octocorales (subclase Octocorallia) (Cedro et al., 2007; Cortés et al., 2009; Díaz, 2012). En países de la región caribeña, como Belice, Colombia, Cuba y Panamá, se han desarrollado estudios taxonómicos exhaustivos en arrecifes donde se han registrado más de 90 especies (Rützler et al., 2000; Alcolado, 2002; Díaz, 2005; Valderrama y Zea, 2013).
A su vez, los poríferos cumplen roles fundamentales dentro de los ecosistemas arrecifales. Estos brindan refugio a larvas, juveniles y adultos de muchos otros organismos; filtran grandes volúmenes de agua, por lo que se consideran descontaminadores; constituyen alimento para algunos peces, tortugas (Eretmochelys imbricata) e invertebrados; sirven de sustrato; contribuyen a incorporación de material particulado al fondo; y establecen variadas e importantes relaciones simbióticas con otros organismos. Dado que cumplen tan diversas funciones dentro de los arrecifes y otros ecosistemas, resulta de vital importancia el estudio de sus comunidades (Díaz y Rützler, 2001; Rützler, 2004; Wulff, 2006, 2012; Bell, 2008).
Sin embargo, las investigaciones sobre las esponjas marinas de Costa Rica han sido muy escasas y, específicamente para el Caribe costarricense, solo existen seis trabajos sobre las esponjas del litoral (Risk et al., 1980; Loaiza, 1989, 1991; Cortés, 1996; Van der Hal, 2006; Cortés et al., 2009). Además, no se conocen estudios que aborden aspectos ecológicos o de aprovechamiento de estos organismos en los arrecifes coralinos costarricenses. Entre los trabajos que más han aportado al conocimiento de este grupo en el Caribe del país se encuentran los realizados por Loaiza (1989, 1991), los cuales describen 17 especies de la clase Demospogiae para isla Uvita y Puerto Vargas en el Caribe costarricense. Cortés (1996) registró 38 especies de esponjas marinas para esta región del país a partir de revisiones bibliográficas, identificación de ejemplares preservados en el Museo de Zoología de la Universidad de Costa Rica, consultas a expertos y trabajos en progreso durante ese momento. Por su lado, Van der Hal (2006) ha sido el único en realizar un estudio ecológico sobre esponjas marinas para su tesis, específicamente en los pastos marinos y arrecifes someros (1-4 m) de la costa caribeña. Posteriormente, Cortés et al. (2009) registraron 65 especies para el Caribe costarricense comprendidas en una clase, dos subclases, 10 órdenes, 29 familias y 45 géneros. En dichos estudios, los autores concluyeron sobre la necesidad de realizar más investigaciones, principalmente relacionadas con las especies presentes, su distribución, estado de conservación y ecología.
La poca información ecológica generada para el filo Porifera en Costa Rica ha resultado en el desconocimiento del valor ecológico para el desarrollo de planes de manejo de este grupo, y en el poco aprovechamiento de estos organismos como posible fuente de ingresos económicos para las comunidades costeras. Las esponjas, al ser seres sésiles, filtradoras, de amplia distribución, persistentes en el tiempo, de rápido crecimiento y con tasas de cambio en su cubrimiento del fondo, reflejan las condiciones promedio del ambiente. Por tales motivos, variaciones en su estructura comunitaria pueden indicar cambios en las condiciones ambientales de los ecosistemas donde habitan (Alcolado, 2007). Considerando lo anterior, surge la necesidad de desarrollar un estudio de línea base donde se evalúe la estructura comunitaria de las esponjas marinas en los parches arrecifales del Caribe sur costarricense y se determine si puede ser explicada por la influencia de factores abióticos como la sedimentación, el sustrato y la profundidad. Los resultados de este estudio conformarán un insumo importante para el desarrollo de pautas para la conservación y el uso de las esponjas marinas en el país.
ÁREA DE ESTUDIO
El Caribe sur costarricense se caracteriza por poseer playas arenosas con algunas protuberancias rocosas de arrecifes de coral fósil, dos islas cerca de la costa con formaciones coralinas, además de sustratos calcáreos, arenosos y sedimentos terrígenos costa afuera (Cortés y Wehrtmann, 2009). El clima es húmedo (70-100 %) y caluroso, con temperaturas máximas de 32 °C; presenta dos estaciones lluviosas (noviembre a marzo y junio a agosto) con un promedio de 2500 mm anuales en la parte sur (Cortés y Wehrtmann, 2009; Cortés et al., 2010). Las mareas son de tipo mixto, con diurnas predominantes, las cuales varían entre los 30 y 50 cm de amplitud (Fonseca, 2003; Cortés y Wehrtmann, 2009; Cortés et al., 2010). Además, la corriente cercana a la costa es fuerte, así como el oleaje que genera; y se mueve de noroeste a sureste (Fonseca, 2003; Cortés et al., 2010).
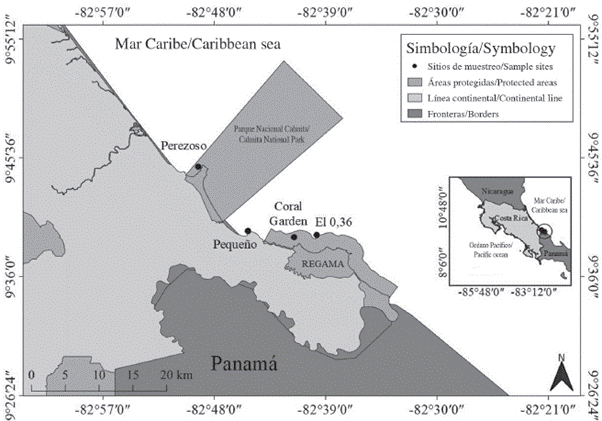
Los arrecifes de esta región pueden dividirse en dos secciones: los parches de arrecife y bancos carbonatados del Parque Nacional Cahuita, y los arrecifes de franja, parches, crestas algales y bancos carbonatados entre Puerto Viejo y Punta Mona. Dentro de estos arrecifes se han registrado en total 41 especies de corales escleractíneos y 26 de octocorales (Cortés y Jiménez, 2003; Cortés y Wehrtmann, 2009).
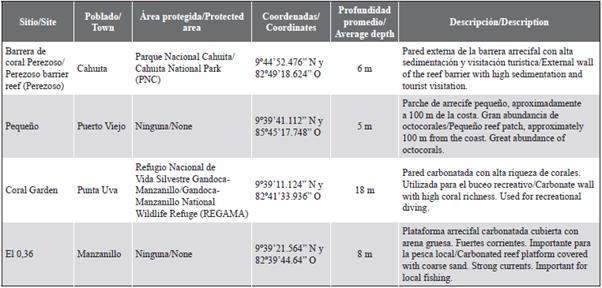
Dentro del área descrita, se identificaron y georreferenciaron cuatro parches arrecifales con presencia de esponjas marinas (Tabla 1, Figura 1) mediante premuestreos (febrero-abril de 2015) y consultas a tour-operadores, buzos y pescadores locales con extenso conocimiento del área marina. Estos sitios, además, se caracterizaron por ser importantes para la economía de la zona debido a la actividad pesquera y turística. Dos de los sitios (Pequeño y el 0,36) quedaron ubicados fuera de áreas protegidas, donde no existe un control sobre las actividades que se realizan (Figura 1).
MATERIALES Y MÉTODOS
Metodología de muestreo y análisis de las muestras
El muestreo se desarrolló con buceo autónomo (SCUBA) en los meses de octubre de 2015 y mayo de 2016, cuando las condiciones oceánicas y atmosféricas del Caribe sur fueron óptimas (i.e. baja precipitación, bajo o nulo oleaje y alta visibilidad). Se realizaron cinco foto-transectos de banda de 10 m de longitud por 1 m de ancho en cada uno de los sitios de muestreo, con una cámara subacuática Nikon COOLPIX AW130. Los transectos se establecieron por medio de un diseño aleatorio sistemático basado en la metodología de monitoreo Caricomp (2001). Como unidad de muestreo se utilizó un marco de 1 m2, elaborado con tubos y codos de PVC y con agujeros cada 10 cm para facilitar su hundimiento en el agua. El marco fue subdividido en un total de 100 cuadrículas de 0,01 m2 utilizando una cuerda delgada, la cual se entrecruzaba entre los agujeros en forma de red (modificado de Weinberg, 1981).
Las fotografías de los marcos de 1 m2 fueron analizadas posteriormente para cuantificar el número de individuos y estimar el porcentaje de cobertura total por especie de esponja o por tipo de sustrato disponible, utilizando como referencia las cuadrículas de 0,01 m2 con una precisión de hasta 0,001 m2. El porcentaje de cobertura del sustrato disponible fue clasificado en pavimento calcáreo desnudo, pavimento calcáreo con sedimentos, pavimento calcáreo con arena gruesa y fondo con sedimentos.
Las especies de esponjas fueron identificadas visualmente hasta el taxón más bajo posible utilizando la guía propuesta por Collin et al. (2005) y el sitio web www. spongeguide.org (Zea et al., 2014). Así mismo, se colectaron en bolsas plásticas previamente rotuladas los especímenes que no pudieron ser identificados in situ y se anotaron las siguientes características: forma, color en vivo, consistencia y tipo de superficie; según los criterios de Loaiza (1991). Posteriormente, las muestras de esponjas fueron preservadas en alcohol al 90 % y llevadas al Laboratorio de Recursos Naturales y Vida Silvestre (LARNAVISI), de la Universidad Nacional de Costa Rica, para su identificación con base en la morfología externa de las esponjas y la morfometría de las espículas, según lo propuesto por Boury-Esnault y Rüztler (1997), Hooper y Van Soest (2002) y Díaz (2005). Para la preparación de las espículas se tomaron al menos tres fragmentos de aproximadamente 2 cm2, correspondientes a distintas partes de la esponja, los cuales se digirieron en hipoclorito de sodio de uso comercial al 3 % por un mínimo de 30 minutos. Seguidamente, las preparaciones fueron observadas al microscopio de luz en portaobjetos para identificar y medir las espículas correspondientes a cada muestra. Las esponjas que no pudieron ser identificadas taxonómicamente se separaron y agruparon según sus características morfológicas externas y sus espículas, y se les asignó un nombre compuesto por la palabra "especie" y un número entero consecutivo.
Determinación de las tasas de sedimentación
Con el fin de determinar si había alguna relación entre la sedimentación y la abundancia de esponjas, se determinaron las tasas de sedimentación por sitio mediante una modificación a la metodología propuesta por Garzón-Ferreira et al. (2002). La misma consistió en el uso de dos trampas de sedimento por sitio, colocadas a la profundidad promedio donde se encontraban las esponjas (Tabla 1). Se aseguró que todas las trampas de sedimento se recolectaran transcurrido el mismo número de días, con una duración de al menos un mes, cuando las condiciones oceanográficas así lo permitieran; o en su defecto, en un máximo de cuatro meses.
Los sedimentos se transportaron hacia el LARNAVISI donde se tamizaron con un colador de 1 mm de ojo de malla.
Posteriormente, se sometieron a dos sesiones de lavado por precipitación en agua dulce durante dos días para eliminar su contenido de sal. Seguidamente, se les retiró el agua con ayuda de una manguera de hule, se colocaron en beakers de 100 ml previamente pesados y se secaron en un horno a 90 °C durante tres días. Finalmente, usando una balanza analítica Setra BL-410S, se determinó el peso seco en gramos. La tasa de sedimentación se calculó a partir de la siguiente ecuación corregida de Garzón-Ferreira et al. (2002):
Donde,
TFS: tasa de sedimentación por fracción (mg/cm2/día)
W: peso (g)
AB: área de la boca de la trampa
ND: número de días que la trampa estuvo bajo el mar
Las tasas de sedimentación fueron calculadas considerando el número de días durante los cuales estuvo sumergida la trampa. Esto permitió realizar comparaciones entre las diferentes trampas a pesar de que fueron retiradas tras transcurrir diferentes tiempos: entre uno y cuatro meses.
Procesamiento de los datos
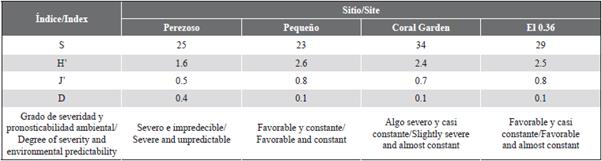
Para cada una de las especies de esponjas por sitio se calculó la abundancia relativa porcentual (AR %) y se estimó el porcentaje de cobertura relativa (CR %), así como las densidades (individuos/m2) totales de esponjas por sitio. Además, se calcularon los siguientes índices: riqueza de especies (S), heterogeneidad de Shannon (H') (Shannon, 1948), equitatividad de Pielou (J') (Pielou, 1969) y dominancia de Simpson (D) (Simpson, 1949), para determinar la diversidad de esponjas por sitio. Estos índices fueron seleccionados para cuantificar, interpretar y comparar la diversidad de las comunidades de esponjas de este estudio con la registrada por otros autores en arrecifes caribeños. Asimismo, los valores de estos índices permitirán realizar comparaciones sobre esta misma área en futuras investigaciones, y detectar si ocurrieron cambios en el tiempo. Adicionalmente, se aplicaron los criterios propuestos por Alcolado (1999; 2007) para determinar el grado de severidad y pronosticabilidad ambiental de los sitios. Este método consiste en un diagrama de inferencia obtenido de un gráfico de dispersión de pares de valores H' y J', el cual se subdivide en en 11 zonas o clases de inferencia que reflejan qué tan severas y constantes son las condiciones para las esponjas marinas en el sitio (Alcolado, 2007).
De estos análisis, excepto del índice S, se excluyeron las esponjas del género Siphonodictyon, pues debido a su hábito perforador y al desarrollo de gran parte de sus tejidos dentro del sustrato que habitan, no fue posible determinar con exactitud el número de individuos, ni estimar su cobertura (Hofman y Kielman, 1992). Por esto, se decidió modificar la metodología y solo registrar su frecuencia de aparición (%) mediante la siguiente ecuación:
Donde,
FA %: Porcentaje de frecuencia de aparición
NCE: Número de marcos de 1m2 con presencia de la esponja
perforadora
TC: Total de marcos de 1m2 por sitio de muestreo
La determinación del grado de similitud entre sitios consideró las abundancias relativas de todas las especies de esponjas en cada sitio. Se usó el índice de similitud Bray-Curtis como medida de la afinidad entre sitios y el ligamiento promedio como método de fusión de los pares de muestras; así como la prueba de Simprof con un nivel de significación del 5 % para determinar si el agrupamiento entre sitios era significativo. Para comparar la similitud de las variables de profundidad, porcentaje de sustrato disponible y tasa de sedimentación versus las abundancias relativas de esponjas entre sitios, se realizó un análisis de coordenadas principales (PCO) (Anderson et al., 2008). Este método revela los tamaños relativos y las direcciones de efectos en diseños experimentales complejos sin trazar las muestras. El análisis se realizó con los programas Primer v7 vs Permanova add-on (Primer-E Ltd, Plymouth, UK).
RESULTADOS
Especies registradas
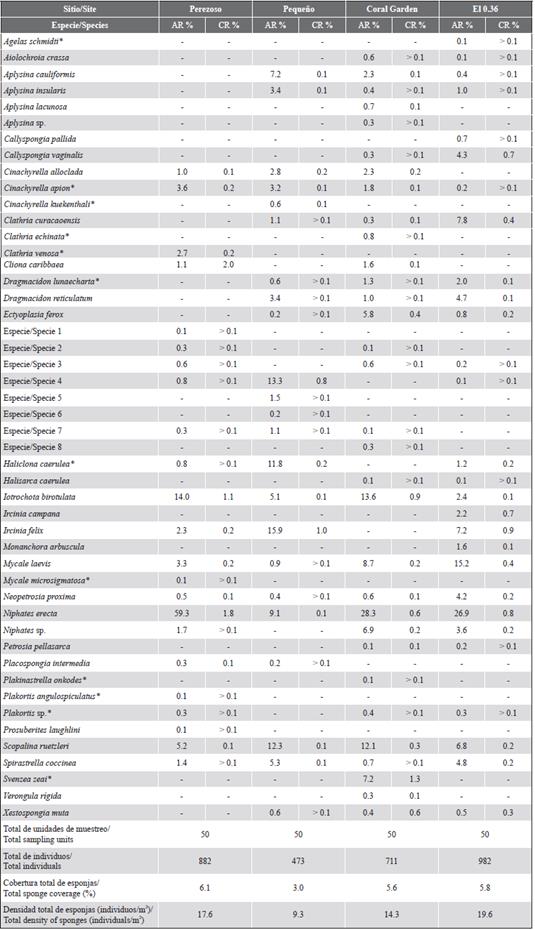
En un total de 200 unidades de muestreo, se cuantificaron 3048 individuos y se identificaron 43 especies correspondientes a dos clases, a 11 órdenes, a 22 familias y a 28 géneros, según la clasificación propuesta por Morrow y Cárdenas (2015) (Anexo 1). De las 43 especies, 28 ya habían sido reportadas para el Caribe costarricense, 13 fueron nuevos registros (Tabla 2), dos fueron identificadas solo hasta género, y ocho especies no pudieron ser identificadas taxonómicamente.
Cobertura y abundancias relativas
La cobertura total del sustrato por parte de las esponjas no sobrepasó el 6,1 % en ninguno de los sitios, siendo Perezoso y Pequeño (3,0 %) aquellos con mayor y menor cobertura, respectivamente (Tabla 2). Las especies con mayor abundancia relativa en Perezoso fueron Niphates erecta (59,3 %), Iotrochota birotulata (14,0 %) y Scopalina ruetzleri (5,2 %). I. birotulata (1,1 %) y N. erecta (1,8 %) también presentaron las mayores coberturas relativas en este sitio junto con C. caribbaea (2,0 %) (Tabla 2).
En el caso de Pequeño, Ircinia felix (15,9 %), la Especie 4 (13,3 %) y S. ruetzleri (12,3 %), tuvieron mayores abundancias relativas. Sin embargo, de estas esponjas, sólo I. felix (1,0 %) y la Especie 4 (0,8 %) mostraron las mayores coberturas relativas, seguidas de Haliclona caerulea (0,2 %) (Tabla 2).
En Coral Garden, N. erecta (28,4 %), I. birotulata (13,7 %) y S. ruetzleri (12,2 %) presentaron las mayores abundancias relativas, similar que en Perezoso. La especie Svenzea zeai solo fue registrada en este sitio, donde presentó la mayor cobertura relativa (1,3 %) junto con otras esponjas como I. birotulata (0,9 %) y N. erecta (0,6 %) (Tabla 2).
En el 0,36, las mayores abundancias relativas estuvieron representadas por N. erecta (26,9 %), Mycale laevis (15,2 %) y Clathria curacaoensis (7,8 %). La esponja I. felix tuvo la mayor cobertura relativa (0,9 %), seguida de N. erecta (0,8 %) e Ircinia campana (0,7 %). En este sitio también se observó el mayor número de individuos (982) entre los cuatro sitios muestreados y, por ende, presentó la mayor densidad de esponjas (19,6 individuos/m2) (Tabla 2).
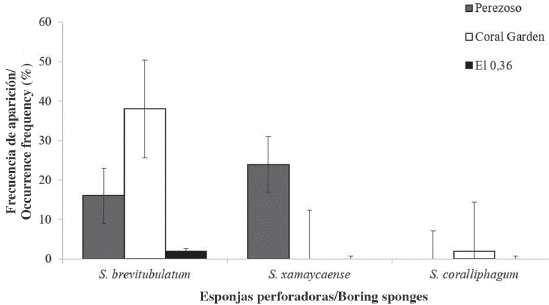
El porcentaje de frecuencia de aparición de esponjas perforadoras del género Siphonodictyon se mantuvo por debajo del 45 % en todos los sitios. En Coral Garden S. brevitubulatum fue la especie perforadora más frecuente (38 %); además, este fue el único sitio donde se registró S. coralliphagum (2 %). La especie S. xamaycaense resultó ser un nuevo registro para el país y se presentó solamente en Perezoso, donde tuvo un mayor porcentaje de frecuencia de aparición (24 %) que S. brevitubulatum (16 %). En el parche arrecifal Pequeño, no se registraron especies de este género durante el muestreo (Figura 2).
Índices de diversidad
En Coral Garden se registró el mayor número de especies de esponjas con un total de 34. A pesar de esto, mostró valores de heterogeneidad, equitatividad y dominancia de especies muy similares a los de Pequeño y el 0,36. Por lo tanto, al aplicar el diagrama de grado de severidad y pronosticabilidad ambiental, se obtuvo que las esponjas de estos tres parches arrecifales viven bajo condiciones de algo severas a favorables y de casi constantes a constantes. Esto contrasta con lo encontrado para Perezoso, el cual, debido a sus valores menores de heterogeneidad y equitatividad, se clasificó como un ambiente severo e impredecible. Sumado a lo anterior, Perezoso presentó el único valor de dominancia mayor a 0,1 (Tabla 3).
Factores abióticos y similitud entre sitios
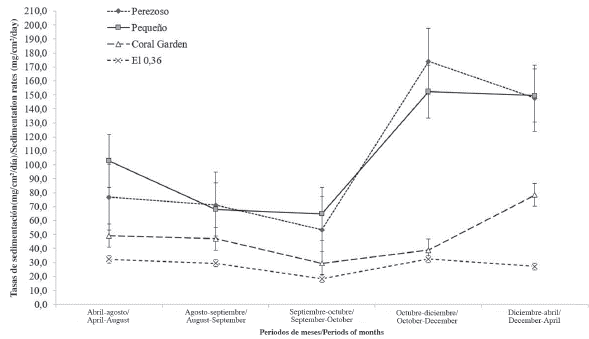
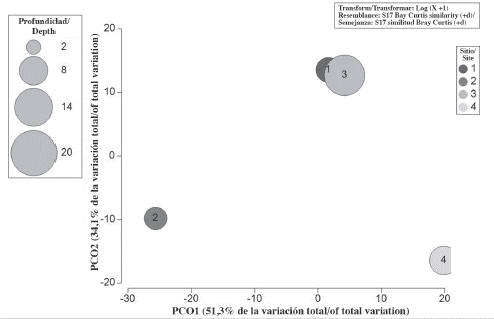
Las tasas de sedimentación se vieron acentuadas durante la transición de la época seca a la lluviosa (octubre-diciembre) y disminuidas con el paso de la época lluviosa a la seca (agosto-septiembre y septiembre-octubre); excepto en el 0,36 donde las tasas se mantuvieron relativamente constantes y no superaron los 32,4 ± 6,0 mg/cm2/día (Figura 3). Las mayores tasas y variaciones de sedimentación por períodos se dieron en Perezoso y en Pequeño. Sin embargo, no parece que lo anterior tenga un efecto en la similitud entre los sitios con respecto a la abundancia relativa de las especies de esponjas presentes (Figura 4).
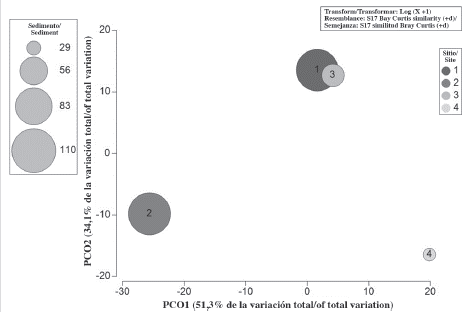
Figura 4 Similitud entre los sitios de muestro respecto a la abundancia relativa de esponjas y a las tasas promedio de sedimentación (mg/cm2/día). 1) Perezoso, 2) Pequeño, 3) Coral Garden, 4) el 0,36.
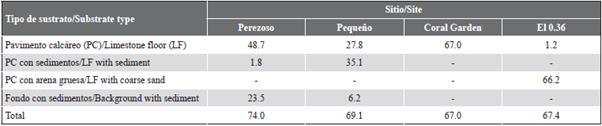
La disponibilidad de sustrato fue igual o mayor a 67,0 % en todos los sitios. Este valor mínimo correspondió a Coral Garden, donde solo se encontró pavimento calcáreo desnudo. La mayor cantidad de sustrato disponible lo presentaron Perezoso (74,0 %) y Pequeño (69,1 %). En ambos sitios se registraron tres de los cuatro tipos de sustrato encontrados en este estudio. No obstante, en Perezoso predominó el pavimento calcáreo desnudo (48,7 %) y en Pequeño, el pavimento calcáreo con sedimentos (35,1 %). Por su lado, en el 0,36 predominó el pavimento calcáreo con arena gruesa (66,2 %) y fue el único sitio donde se encontró este tipo de sustrato (Tabla 4, Figura 5).
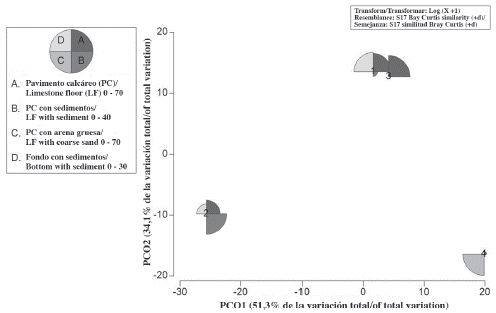
Figura 5 Similitud entre los sitios de muestro respecto a la abundancia relativa de esponjas y al porcentaje de sustrato disponible 1) Perezoso, 2) Pequeño, 3) Coral Garden, 4) El 0,36.
El ámbito de profundad varió entre 5,0 ± 0,9 y 18 ± 3,4 m, siendo Pequeño el sitio más somero y Coral Garden, el más profundo (Figura 6). Los sitios más parecidos entre sí en base a la abundancia relativa de esponjas fueron Perezoso y Coral Garden (1 y 3), con una importante diferenciación con respecto a Pequeño y el 0,36 (Figura 4, Figura 5 y Figura 6).
DISCUSIÓN
Especies registradas
El registro de 13 especies de esponjas no reportadas anteriormente para el Caribe costarricense demuestra la insuficiente investigación desarrollada en el país sobre este grupo. Esto fue señalado por Cortés et al. (2009), quienes con una campaña de recolecta de especímenes en esta región del país incrementaron el número de nuevos registros en 28 especies. Es probable que el desarrollo de estudios relacionados con este grupo en otros parches arrecifales y ecosistemas (manglares, pastos marinos, entre otros) del área lleven a nuevos registros, así como al descubrimiento de nuevas especies, lo cual podría ayudar a entender mejor los patrones de distribución de las esponjas marinas y las dinámicas y los procesos que ocurren en los ecosistemas donde se encuentran.
Cobertura y abundancia relativas
En cuanto a la cobertura de esponjas, ninguno de los cuatro sitios estudiados mostró ser particularmente favorable para el crecimiento horizontal de los poríferos. Esto es evidente si realizamos una comparación con otros arrecifes del Caribe como los de Santa Marta (Zea, 1994) y el golfo de Urabá (Valderrama y Zea, 2003) en Colombia, donde las esponjas cubren por encima del 5,0 % del sustrato y pueden alcanzar hasta un 33,3 % de la cobertura total. Los porcentajes de cobertura encontrados en este estudio (CR<6,1 %) se ubican en un rango similar a los documentados en la costa oriental de la bahía de Cochinos, Cuba, por Caballero et al. (2009). Dichos autores consideraron porcentajes de cobertura de esponjas por debajo del 8 % como bajos y posiblemente asociados a arrecifes en estado natural con predominancia de corales.
Solo dos de las especies registradas presentaron coberturas mayores a 1,5 %, C. caribbaea (2,0 %) y N. erecta (1,8 %), específicamente en Perezoso. Estas esponjas conformaron más de la mitad de la cobertura de estos organismos en el sitio. La especie N. erecta también resultó ser la más abundante (26,9-59,3 %) en tres de los cuatro sitios de muestreo (Perezoso, Coral Garden y el 0,36) y representó más de la mitad de los individuos en Perezoso. Esto se reflejó en el índice de dominancia obtenido (D = 0,4) para este sitio.
Se considera que Niphates erecta es una especie heterótrofa, no posee endosimbiontes fotosinténticos, y depende estrictamente de la filtración como fuente de alimento (Romero et al., 2013). Por esto, es común encontrar altas abundancias de dicha esponja en sitios con condiciones ambientales similares a las de Perezoso, donde la turbulencia, corrientes, descargas de sedimentos y turbidez son altas. Ejemplos documentados de lo anterior incluyen los fondos rocoso-arenosos de la isla Nelson en Trinidad y Tobago (Hubbard, 1990), las zonas coralinas del golfo de Urabá en Colombia (Valderrama y Zea, 2003), playa Mero y Punta Brava en Venezuela (Romero et al., 2013). Además, N. erecta es frecuente en los manglares y se encuentra entre las cinco especies más abundantes en los arrecifes someros de Bocas del Toro (Caribe de Panamá), donde existe un bajo desarrollo urbanístico y turístico, pero el tratamiento de sus aguas residuales es casi nulo (Díaz, 2005; Gotchfield et al., 2007).
Diversidad y factores abióticos
La riqueza de especies de esponjas pareció aumentar con la profundidad promedio de los sitios muestreados. Este patrón ha sido documentado en otros arrecifes de la región caribeña por Valderrama y Zea (2003) en el golfo de Urabá en Colombia y por De la Nuez et al. (2011) en el bajo de Sancho Pardo en Cuba. Sin embargo, los demás índices de diversidad calculados para este estudio no parecieron estar vinculados a ninguno de los factores abióticos considerados. Solo Perezoso mostró excepciones a esta tendencia con valores contrastantes en sus índices (H'=1,6; J'=0,5; D=0,4), además de haber sido el único sitio clasificado como severo e impredecible al aplicar el diagrama de severidad y pronosticabilidad.
Los índices de diversidad y la clasificación dada por el diagrama para Perezoso posiblemente se vieron influenciados por la alta tasa de sedimentación anual promedio (104,5 ± 52,9 mg/cm2/día) que se da en el sitio. Perezoso retiene sedimentos principalmente de origen terrígeno, arrastrados desde ríos como La Estrella, Suárez y la quebrada Perezoso. Dicha sedimentación, rica en contenido orgánico, ya ha sido documentada con tasas entre los 30 y 360 mg/cm2/día (Cortés y Risk, 1984); y se considera que genera efectos muy negativos en los arrecifes de Cahuita (Cortés y Jiménez, 2003). Se cree que la principal fuente estos sedimentos son las plantaciones de banano y la deforestación en el Valle de la Estrella (Cortés, 1981, 1994; Cortés y Jiménez, 2003). Este arrastre de material, generado por la erosión del suelo y la infiltración de agroquímicos en los bordes del río la Estrella, se ve favorecido por la corriente costera que viaja de noroeste a sureste en el Caribe de Costa Rica (Cortés y Jiménez, 2013), así como por la forma de mazo del PNC, la cual propicia la retención de dichos sedimentos en la parte norte donde se ubica la barrera de Perezoso.
Se ha demostrado que la biomasa de esponjas en sitios cercanos a descargas de aguas residuales y agroquímicos tiende a incrementarse en términos de abundancia, cobertura o densidad. A su vez, cuando la concentración de dichos contaminantes orgánicos aumenta, es común una disminución en la diversidad de las esponjas presentes y una proliferación de las especialistas, las cuales pueden ser utilizadas para el monitoreo de dichas condiciones en el ambiente (Rützler, 2004). Este podría ser el caso de C. venosa (AR = 2,7 %; CR = 0,2 %), pues esta especie fue solo encontrada en Perezoso con una cobertura y abundancia relativa similar a la de otras especies comunes como I. felix y M. laevis. Clathria venosa ha sido utilizada como especie bioindicadora de contaminación orgánica en Cuba (Busutil y Alcolado, 2012), por lo tanto, su presencia en Perezoso podría estar relacionada con los contaminantes que son arrastrados en el sedimento por ríos cercanos a plantaciones bananeras como el río La Estrella.
El diagrama de severidad y pronosticabilidad debe ser usado e interpretado con cautela. Para Perezoso, dicho diagrama sí parece ser sensible a los disturbios ambientales por medio de los valores de heterogeneidad y equitatividad obtenidos en el sitio. Sin embargo, para Pequeño mostró discrepancias que no coinciden con los resultados obtenidos. Pequeño presentó una tasa de sedimentación anual promedio similar e incluso mayor que Perezoso (107,6 ± 42,3 mg/cm2/día) y, aun así, se clasificó como un ambiente favorable y constante debido a los valores obtenidos en heterogeneidad (2,6) y equitatividad (0,8).
La incidencia de una alta sedimentación en Puerto Viejo ha sido ya documentada por Cortés y Jiménez (2003). No obstante, la composición y la dinámica de los sedimentos en el sitio parece ser distinta a la de Perezoso. Mientras que en Perezoso los sedimentos procesados eran muy finos, de color negro, parecían ser en su mayoría de origen terrígeno y contenían gran cantidad de materia orgánica en descomposición, en Pequeño los sedimentos poseían una coloración más clara, partículas más gruesas combinadas con arena y menor cantidad de materia orgánica en descomposición. Además, los sedimentos en Perezoso se acumulaban y colmataban muy fácilmente en las paredes y en el fondo de la barrera, contrario a Pequeño, donde se depositaban en algunas grietas, pendientes y en los fondos con sedimentos arenosos.
Lo anterior podría indicar que la composición de los sedimentos, la topografía del fondo y la dinámica de las corrientes permitieron el desplazamiento y la deposición de los sedimentos fuera y en los alrededores del parche, evitando que la sedimentación tuviera un efecto tan pronunciado en la diversidad de esponjas en Pequeño. Asimismo, existe la posibilidad de que las altas tasas de sedimentación en este sitio no tuvieran tanto efecto sobre la composición, diversidad y abundancia de las especies de esponjas como sí pudieron tenerlo sobre su cobertura. Dicho fenómeno podría estar limitando y reduciendo las tasas de crecimiento de este grupo debido a la obstrucción de sus sistemas acuíferos (Bell et al., 2015).
Otra posibilidad es que Pequeño se encontrara ante un proceso de repoblamiento y colonización, pues las esponjas presentes eran principalmente de tamaños pequeños (menores de 10 cm), posiblemente jóvenes y no habían completado su fase crítica de colonización. Esto podría indicar un proceso de selección ambiental aún incompleto (Zea, 1993; Alcolado, 1999), posiblemente ligado al terremoto ocurrido en 1991, el cual elevó la plataforma continental en el Caribe costarricense entre 50 y 190 cm (Cortés et al., 1992). El fenómeno provocó la exposición del sustrato y generó altas mortalidades de invertebrados.
Factores abióticos y similitud entre sitios
El único factor que pareció explicar mejor la similitud entre sitios con respecto a la composición de especies de esponjas y sus abundancias relativas fue el porcentaje de sustrato disponible. Tanto en Perezoso como en Coral Garden, el pavimento calcáreo desnudo fue el sustrato disponible predominante (48 < PC % < 67) y esto podría estar favoreciendo la colonización, el crecimiento y la permanencia de las especies N. erecta, I. birotulata y S. ruetzleri. Estas tres especies fueron compartidas por ambos sitios como las más abundantes a pesar de sus profundidades promedio y sus tasas de sedimentación contrastantes. Lo anterior podría estar ligado al hábito meramente heterotrófico y generalista de dichas esponjas, pues tienen la capacidad de sobrevivir y proliferar bajo el efecto de distintos estresores como fluctuaciones en la salinidad, turbidez, sedimentación iluminación y nutrientes; siempre que cuenten con un sustrato apropiado para su fijación (Nuñez et al., 2010; Romero et al., 2013).
Por otro lado, Perezoso y Coral Garden también compartieron las mayores frecuencias de aparición de esponjas perforadoras del género Siphonodictyon (40 %) y resultaron ser los únicos sitios donde se registró la presencia de la especie bioerosionadora C. caribbaea. La presencia de esponjas del género Cliona en el PNC ya había sido documentada por Cortés y Guzmán (1985), quienes registraron coberturas de hasta 1 m2, similares a lo encontrado en el presente estudio. La esponja C. caribbaea fue encontrada en el archipiélago de San Andrés y del Rosario, Colombia, con una distribución que variaba desde los 5 hasta los 20 m de profundidad y con una ligera tendencia por ser más abundante en sitios con mayor disponibilidad de sustratos calcáreos como coral muerto y pavimento (López-Victoria y Zea, 2005). Esto coincide con el ámbito de profundidad y el tipo de sustrato con mayor disponibilidad que presentaron Perezoso y Coral Garden.
En el Caribe existen registros de que la cobertura de esponjas excavadoras del género Cliona ha incrementado considerablemente durante las últimas tres décadas (López-Victoria y Zea, 2005). Esto resulta preocupante, pues dichas especies, junto con las del género Siphonodictyion, suelen tener crecimientos muy agresivos y afectaciones considerables en los arrecifes cuando su abundancia y cobertura son altas. Por ejemplo, la excavación originada por estas esponjas puede llegar a ocasionar el quiebre de grandes colonias de coral como consecuencia de la erosión, acompañado por la producción de sedimentos lodosos. A su vez, el crecimiento de las esponjas perforadoras y bioerosionadoras puede potenciarse por incrementos en la materia orgánica disponible y por las altas temperaturas (Rützler, 2004), condiciones que también son sumamente estresantes para los corales y que fueron observadas dentro de Perezoso.
CONCLUSIONES
El número de especies de esponjas marinas en el Caribe costarricense sobrepasa las 80, con 13 nuevos registros en este estudio. Las densidades, abundancias y coberturas relativas de las esponjas encontradas son un insumo importante para comprender la dinámica de los parches arrecifales y sus similitudes, así como las posibles presiones naturales y antropogénicas que contribuyen a moldearlos. El uso de índices ecológicos son herramientas que pueden ayudar a inferir el nivel de perturbación al que están expuestas las comunidades de esponjas, siempre que se interpreten con cautela y se contrasten con factores fisicoquímicos del entorno. Se recomienda probar y ajustar el diagrama para la valoración del grado de severidad y de pronosticabilidad ambiental según el área geográfica donde se quiera implementar.
La profundidad del arrecife pareció influir en la riqueza de especies de esponjas presentes, con aumentos en el número de especies conforme aumenta la profundidad. Por su lado, las tasas de sedimentación no mostraron tener un efecto en la similitud entre las comunidades de esponjas, pero el origen y la composición de dichos sedimentos sí podría estar influyendo en la cobertura de los poríferos, la abundancia de especialistas como C. venosa y la dominancia de esponjas resistentes al sedimento y a la turbidez como N. erecta. Sólo los altos porcentajes de pavimento calcáreo desnudo como sustrato disponible predominante pudieron explicar la similitud entre la estructura comunitaria de Perezoso y Coral Garden. Esto pareció favorecer la abundancia de las esponjas heterótrofas y generalistas N. erecta, I. birotulata y S. ruetzleri, así como la frecuencia de aparición de las esponjas del género Siphonodictyon y de la cobertura de las del género Cliona. Además, la evaluación de la frecuencia de aparición y la cobertura de estos dos géneros indicaron que dichas esponjas podrían estar causando efectos negativos para los corales pétreos de Perezoso debido a la bioerosión. El uso de esta información contribuirá a la selección de arrecifes donde sea más urgente tomar medidas de mitigación, e incluso, aquellos con potencialidades para desarrollar proyectos de restauración. Aunque este estudio amplía el entendimiento de la estructura comunitaria de las esponjas marinas en el Caribe de Costa Rica, se recomienda realizar más investigaciones en este campo y determinar si hay otros factores, tanto bióticos (disponibilidad de alimento, depredación, competencia) como abióticos (movimiento del agua, corrientes locales, turbidez, rugosidad del fondo), que pudieran influenciar en mayor medida en la estructura comunitaria de los poríferos.
AGRADECIMIENTOS
A los miembros, asistentes y colaboradores del Proyecto "Indicadores ambientales en ecosistemas marinos y costeros para la definición de estrategias de conservación y manejo en dos áreas protegidas en el Caribe sur de Costa Rica", al Instituto de Oceanología (actual Instituto de Ciencias el Mar) de Cuba, al Dr. Ricardo Jiménez Montealegre; así como a don Manuel, Rafa, Ettel y a los funcionarios del Área de Conservación La Amistad-Caribe
REFERENCIAS
Alcolado, P.M. 1999. Comunidades de esponjas de los arrecifes del archipiélago Sabana-Camagüey, Cuba. Bol. Invest. Mar. Cost., 28: 95-124. [ Links ]
Alcolado, P.M. 2002. Catálogo de las esponjas de Cuba. Avicenia, 15: 53-72. [ Links ]
Alcolado, P.M. 2007. Reading the code of coral reef sponge community composition and structure for environmental bio-monitoring: some experiences from Cuba: 3-10. En: Custódio, M.R., G. Lôbo-Hajdu, E. Hajdu y G. Muricy (Eds.), Porifera research: biodiversity, innovation and sustainability. Museu Nacional, Rio de Janeiro. 684 p. [ Links ]
Anderson, M.J., R.N. Gorley and K.R. Clarke. 2008. Permanova for Primer: guide to software and statistical methods. Primer-E Ltd, Plymouth, UK. 214 p. [ Links ]
Bell, J.J. 2008. The functional roles of marine sponges. Estuar. Coast. Shelf Sci., 79: 341-353. [ Links ]
Bell, J.J., E. McGrath, A. Biggerstaff, T. Bates, H. Bennett, J. Marlow and M. Shaffer. 2015. Sediment impacts on marine sponges. Mar. Pollut. Bull., 94: 5-13. https://doi.org/10.1016/j.marpolbul.2015.03.030. [ Links ]
Boury-Esnault, N. and K. Rüztler. 1997. Thesaurus of sponge morphology. Smithsonian Institution Press, Washington D.C. 55 p. [ Links ]
Busutil, L. y P. Alcolado. 2012. Prueba de un índice de contaminación orgánica urbana basado en comunidades de esponjas de arrecifes de Cuba. Serie Oceanológica, 10: 90-103. [ Links ]
Caballero, H., L. Busutil, Y. García y P.M. Alcolado. 2009. Variación espacial en comunidades de esponjas de la costa oriental de bahía de Cochinos, Cuba. Rev. Mar. Cost., 1: 95-109. [ Links ]
Carballo, J.L., P. Gómez y J.A. Cruz-Barraza. 2014. Biodiversidad de Porifera en México. Rev. Mex. Biodiv., 85: 143-153. https://doi.org/10.7550/rmb.32074. [ Links ]
Caribbean Coastal Marine Productivity (CARICOMP). 2001. Manual of methods for mapping and monitoring of physical and biological parameters in the coastal zone of the Caribbean. CARICOMP Data Management Center, Kingston. [ Links ]
Cedro, V.R., E. Hajdu, H.H. Sovierzosky and M. Dorigo. 2007. Demospongia (Porifera) of the shallow coral reefs of Maceió, Alagoas State, Brazil: 233-237. En: Custódio, M.R ., G. Lôbo-Hajdu , E. Hajdu y G. Muricy (Eds.). Porifera research: biodiversity, innovation and sustainability. Museu Nacional, Rio de Janeiro. 684 p. [ Links ]
Collin, R., M.C. Díaz, J. Norenburg, R.M. Rocha, J.A. Sánchez, A. Schulze, M. Schwartz and A. Valdés. 2005. Photographic identification guide to some common marine invertebrates of Bocas del Toro, Panama. Caribb. J. Sci., 3: 638-707. [ Links ]
Cortés, J. 1981. The coral reef at Cahuita, Costa Rica, a reef under stress. Tesis M. Sc. Univ. McMaster, Hamilton, Ontario, Canadá. 176 p. [ Links ]
Cortés, J. 1994. A reef under siltation stress: a decade of degradation: 240-246. In: Guinsburg, R.N. (compilador), Proc. Coll. Global Aspects Coral Reefs: Health, Hazards History. Univ. Miami. 420 p. [ Links ]
Cortés, J. 1996. Biodiversidad marina de Costa Rica: Filo Porifera. Rev. Biol. Trop., 44(2): 911-914. [ Links ]
Cortés, J. and C. Jiménez. 2003. Past, present and future of the coral reefs of the Caribbean coast of Costa Rica: 223-239. En: Cortés, J . (Ed.). Latin American coral reefs. Elsevier, Ámsterdam, Amsterdam. 508 p. [ Links ]
Cortés, J . and I.S. Wehrtmann, 2009. Diversity of marine habitats of the Caribbean and Pacific of Costa Rica: 1-45. In: Wehrtmann, I. S. y J. Cortés (Eds.). Marine biodiversity of Costa Rica, Central America. Springer, Berlín. 538 p. [ Links ]
Cortés, J . y M. Risk. 1984. El arrecife coralino del Parque Nacional Cahuita. Rev. Biol. Trop., 32: 109-121. [ Links ]
Cortés, J ., A.C. Fonseca, J. Nivia-Ruiz and V. Nielsen-Muñoz. 2010. Monitoring coral reefs, seagrasses and mangrooves in Costa Rica (CARICOMP). Rev. Biol. Trop., 58(3): 1-22. [ Links ]
Cortés, J ., N. Van Der Hal and R.W.M. Van Soest. 2009. Sponges: 137-142. In: Wehrtmann, I. S . y J. Cortés (Eds.). Marine biodiversity of Costa Rica, Central America. Springer, Berlín. 538 p. [ Links ]
Cortés, J ., R. Soto, C. Jiménez and A. Astorga. 1992. Earthquake associated mortality of intertidal and coral reef organisms (Caribbean of Costa Rica). Proc. 7th Int. Coral Reef Symp., Guam, 1: 235-240. [ Links ]
Cruz-Barraza, J.A., J.L. Carballo, A. Rocha-Olivares, H. Ehrlich and M. Hog. 2012. Integrative taxonomy and molecular phylogeny of genus Aplysina (Demospongiae: Verongida) from Mexican Pacific. PLoS ONE, 7(8): e42049. https://doi.org/10.1371/journal.pone.0042049. [ Links ]
Díaz, M.C. 2005. Common sponges from shallow marine habitats from Bocas del Toro Region, Panama. Caribb. J. Sci., 41(3): 365-375. [ Links ]
Díaz, M.C. 2012. Mangrove and coral reef sponge faunas: untold stories about shallow water Porifera in the Caribbean. Hydrobiologia, 687: 179-190. https://doi.org/10.1007/s10750-011-0952-5. [ Links ]
Díaz, M.C. and K. Rützler. 2001. Sponges: an essential component of Caribbean coral reefs. Bull. Mar. Sci., 69(2): 535-546. [ Links ]
Fonseca, A.C. 2003. A rapid assessment at Cahuita National Park, Costa Rica, 1999 (Part 1: Stony corals and algae). Atoll Res. Bull., 496: 248-257. https://doi.org/10.5479/si.00775630.13.248. [ Links ]
Garzón-Ferreira, J., M.C. Reyes-Nivia y A. Rodríguez-Ramírez. 2002. Manual de métodos del Sistema Nacional de Monitoreo de Arrecifes Coralinos en Colombia. INVEMAR, Santa Marta. 57 p. [ Links ]
Gochfeld, D.J., C. Schlõder and R.W. Thacker. 2007. Sponge community structure and disease prevalence on coral reefs in Bocas del Toro, Panama: 335343. En: Custódio, M.R ., G. Lôbo-Hajdu , E. Hajdu y G. Muricy (Eds.), Porifera research: biodiversity, innovation and sustainability. Museu Nacional, Rio de Janeiro. 684 p. [ Links ]
Hofman, C.C. and M. Kielman. 1992. The excavating sponges of the Santa Marta area, Colombia, with description of a new species. Bijdrajen tot de Dierkunde, 61(4): 205-2017. [ Links ]
Hooper, J.N.A. and R.W.M. Van Soest , 2002. Systema Porifera. A guide to the classification of sponges. Springer, New York. 1707 p. https://doi. org/10.1007/978-1-4615-0747-5_1. [ Links ]
Hubbard, R.H. 1990. A sessile shallow-water community dominated by sponges and algae at Nelson island, Trinidad and Tobago. Caribb. Mar. Stud., 1(2): 152-158. [ Links ]
Loaiza, B. 1989. Generalidades del Phylum Porifera y bases para su identificación con sinopsis de algunas de ellas, en Limón, Costa Rica. Tesis Lic. Univ. Nacional, Heredia, Costa Rica. 173 p. [ Links ]
Loaiza, B. 1991. Estudio taxonómico de las esponjas del Parque Nacional Cahuita, sector Puerto Vargas e isla Uvita, Limón, Costa Rica. Brenesia, 36: 21-62. [ Links ]
López-Victoria, M. and S. Zea. 2005. Current trends of space occupation by encrusting excavating sponges on Colombian coral reefs. Mar. Ecol., 26: 33-41. https://doi.org/10.1111/j.1439-0485.2005.00036.x. [ Links ]
Morrow, C. and P. Cárdenas. 2015. Proposal for a revised classification of the Demospongiae (Porifera). Front. Zool., 12(7). https://doi.org/10.1186/s12983-015-0099-8. [ Links ]
Núñez, M., J. G. Rodríguez-Quintal y M. C. Díaz. 2010. Distribución de esponjas (Porifera) a lo largo de un gradiente de profundidad en un arrecife coralino, Parque Nacional San Esteban, Carabobo, Venezuela. Rev. Biol. Trop., 58(3): 175-187. [ Links ]
Pielou, E.C. 1969. An introduction to mathematical ecology. Wiley-Interscience, New York. 292 p. [ Links ]
Risk, M.J., M. Murillo y J. Cortés, J . 1980. Observaciones biológicas preliminares sobre el arrecife coralino en el Parque Nacional Cahuita, Costa Rica. Rev. Biol. Trop., 28(2): 361-382. [ Links ]
Romero, M.A., E. Villamizar y N. Malaver. 2013. Estructura de las comunidades de esponjas (Porifera) en tres arrecifes del Parque Nacional Morrocoy, Venezuela y su relación con algunas variables ambientales. Rev. Biol. Trop., 61(3): 1229-1241. https://doi.org/10.15517/rbt.v61i3.11937. [ Links ]
Rützler, K. 2004. Sponges on coral reefs: a community shaped by competitive cooperation. Boll. Mus. Ist. Biol. Univ. Genova, 68: 85-148. [ Links ]
Rützler, K., M.C. Díaz , R.W.M. Van Soest, S. Zea , K.P. Smith, B. Álvarez and J. Wulff. 2000. Diversity of sponge fauna in mangrove ponds, Pelican Cays, Belize. Atoll. Res. Bull., 476: 229-248. https://doi.org/10.5479/si.00775630.467.229. [ Links ]
Shannon, C.E. 1948. A mathematical theory of communication. Bell Syst. Tech. J., 27: 379-423, 623-656. https://doi.org/10.1002/j.1538-7305.1948.tb01338.x. [ Links ]
Simpson, E.H. 1949. Measurement of diversity. Nature, 163: 688-688. https://doi.org/10.1038/163688a0. [ Links ]
Valderrama, D. andS. Zea . 2013. Annotated checklist of sponges (Porifera) from the southernmost Caribbean reefs (North-West Gulf of Urabá), with description of new records for the Colombian Caribbean. Rev. Acad. Colomb. Cienc., 37(144): 353-378. [ Links ]
Valderrama, D . yS. Zea . 2003. Esquemas de distribución de esponjas arrecifales (Porifera) del noroccidente del golfo de Urabá, Caribe sur, Colombia. Bol. Invest. Mar. Cost.: 32, 37-56. [ Links ]
Van der Hal, N. 2006. Presence and diversity of sponge species along the Caribbean coast of Costa Rica. Thesis Ámsterdam. 43 p. [ Links ]
Weinberg, S. 1981. A comparison of coral reef survey methods. Bijdr. Dierk., 51: 199-218. [ Links ]
Wulff, J.L. 2006. Ecological interactions of marine sponges. Can. J. Zool., 84: 146-166. [ Links ]
Wulff, J.L. 2012. Ecological interactions and the distribution, abundance, and diversity of sponges: 273-344. In: Becerro, M. A., M.J. Uriz, M. Maldonado y X. Turon (Eds). Advances in sponge science: phylogeny, systematics, ecology. Elsevier, UK. 450 p. [ Links ]
Zea, S. 1993. Cover of sponges and other sessile organisms in rocky and coral reef habitats of Santa Marta, Colombian Caribbean Sea. Caribb. J. Sci., 29(1-2): 75-88. [ Links ]
Zea, S. 1994. Patterns of coral and sponge abundance in stressed coral reefs at Santa Marta, Colombian Caribbean. 257-264. En: Van Soest, R.W.M., T.M.G. Van Kempen y J.C. Braekman (Eds). Sponges in time and space: Biology, chemistry, paleontology. A.A. Balkema, Rotterdam, Países Bajos. 515 p. [ Links ]
Zea, S., T.P. Henkel and J.R. Pawlik. 2014. The sponge guide: a picture guide to Caribbean sponges (3era ed.). www.spongeguide.org. 03/11/2016 [ Links ]
ANEXOS Anexo 1. Clasificación taxonómica de las esponjas encontradas en el muestreo (*nuevos registros).
Phylum Porifera
Clase Demospongiae
Orden Agelasida
Familia Agelasidae
Género Agelas (Duchassaing y Michelotti, 1864)
Agelas schmidti* (Wilson, 1902)
Familia Hymerhabdiidae
Género Prosuberites (Topsent, 1893)
Prosuberites laughlini (Díaz, Alvarez y van Soest, 1987)
Orden Axinellida
Familia Axinellidae
Género Dragmacidon (Hallmann, 1917)
Dragmacidon lunaecharta* (Ridley y Dendy, 1886)
Dragmacidon reticulatum (Ridley y Dendy, 1886)
Familia Raspaliinae
Género Ectyoplasia (Topsent, 1931)
Ectyoplasia ferox (Duchassaing y Michelotti, 1864)
Orden Chondrillida
Familia Halisarcidae
Género Halisarca (Johnston, 1842)
Halisarca caerulea (Vacelet y Donadey, 1987)
Orden Clionaida
Familia Clionidae
Género Cliona (Grant, 1826)
Cliona caribbaea (Carter, 1882)
Familia Placospongiidae
Género Placospongia (Gray, 1867)
Placospongia intermedia (Sollas, 1888)
Familia Spirastrellidae
Género Spirastrella (Schmidt, 1868)
Spirastrella coccínea (Duchassaing y Michelotti, 1864)
Orden Dictyoceratida
Familia Irciniidae
Género Ircinia (Nardo, 1833)
Ircinia campana (Lamarck, 1814)
Ircinia felix (Duchassaing y Michelotti, 1864)
Orden Haplosclerida
Familia Callyspongiidae
Género Callyspongia (Duchassaing y Michelotti, 1864)
Callyspongia pallida* (Hechtel, 1965)
Callyspongia vaginalis (Lamarck, 1814)
Familia Chalinidae
Género Haliclona (Grant, 1841)
Haliclona caerulea (Hechtel, 1965)
Familia Niphatidae
Género Niphates (Duchassaing y Michelotti, 1864)
Niphates erecta (Duchassaing y Michelotti, 1864)
Niphates sp.
Familia Petrosiidae
Género Neopetrosia (Laubenfels, 1949)
Neopetrosia proxima* (Duchassaing y Michelotti, 1864)
Género Petrosia Vosmaer, 1885
Petrosia pellasarca (Laubenfels, 1934)
Género Xestospongia (Laubenfels, 1932)
Xestospongia muta (Schmidt, 1870)
Familia Phloeodictyidae
Género Siphonodictyon (Bergquist, 1965)
Siphonodictyon brevitubulatum (Pang, 1973)
Siphonodictyon coralliphagum (Rützler, 1971)
Siphonodictyon xamaycaense* (Pulitzer-Finali, 1986)
Orden Poecillosclerida
Familia Crambeidae
Género Monanchora (Carter, 1883)
Monanchora arbuscula (Duchassaing y Michelotti, 1864)
Familia Iotrochotida
Género Iotrochota (Ridley, 1884)
Iotrochota birotulata (Higgin, 1877)
Familia Microcionidae
Género Clathria (Schmidt, 1862)
Clathria curacaoensis (Arndt, 1927)
Clathria echinata* (Alcolado, 1984)
Clathria venosa (Alcolado, 1984)
Familia Mycalidae
Género Mycale (Gray, 1867)
Mycale laevis (Carter, 1882)
Mycale microsigmatosa (Arndt, 1927)
Orden Scopalinida
Familia Scopalinidae
Género Scopalina (Schmidt, 1862)
Scopalina ruetzleri (Wiedenmayer, 1977)
Género Svenzea (Álvarez, van Soest y Rützler, 2002)
Svenzea zeai* (Álvarez, van Soest y Rützler, 1998)
Orden Tetractinellida
Familia Tetillidae
Género Cinachyrella (Wilson, 1925)
Cinachyrella alloclada (Uliczka, 1929)
Cinachyrella apion* (Uliczka, 1929)
Cinachyrella kuekenthali* (Uliczka, 1929)
Orden Verongiida
Familia Aplysinidae
Género Aiolochroia (Wiedenmayer, 1977)
Aiolochroia crassa (Hyatt, 1875)
Orden Verongiida
Familia Aplysinidae
Género Aplysina (Nardo, 1834)
Aplysina cauliformis (Carter, 1882)
Aplysina insularis (Duchassaing y Michelotti, 1864)
Aplysina lacunosa* (Lamarck, 1814)
Aplysina sp.
Género Verongula (Verrill, 1907)
Verongula rígida (Esper, 1794)
Clase Homoscleromorpha
Orden Homosclerophorida
Familia Plakinidae
Género Plakinastrella (Schulze, 1880)
Plakinastrella onkodes* (Uliczka, 1929)
Género Plakortis (Schulze, 1880)
Plakortis angulospiculatus* (Carter, 1879)
Plakortis sp.
Recibido: 12 de Marzo de 2019; Aprobado: 10 de Enero de 2020











 text in
text in