Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta ene./jun. 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.774
Artículos de Investigación
Evaluación del efecto de Bacillusfirmus C101 en el crecimiento de poslarvas de Litopenaeus vannamei Boone (camarón blanco) y Brachionus plicatilis s.s. Müller (rotífero)
1. Fundación Universidad de Bogotá Jorge Tadeo Lozano. Facultad de Ciencias Naturales e Ingenierías. Programa de Biología Marina. Bogotá, Colombia. jordansteven6@gmail.com; laura_milena'990@hotmail.com
2. Doctorado en Biociencias, Facultad de Ingeniería. Universidad de La Sabana. Chía, Colombia.
La creciente demanda de proteína acuícola sugiere buscar alternativas biotecnológicas que mejoren el cultivo de especies de interés comercial. En este estudio se evaluó Bacillus firmus C101 como promotor del crecimiento y potencial probiótico, el cual fue caracterizado y posteriormente administrado (106 UFC mL-1 * día) en poslarvas de camarón blanco (Litopenaeus vannamei) y en rotíferos (Brachionusplicatilis sensu stricto). Se observó que B. firmus C101 tiene tolerancia a sales biliares, fuerte actividad fosfatasa y actividad antimicrobiana frente a patógenos como Vibrio alginolyticus y Aeromonas hydrophila, entre otros. Por otro lado, tras su administración por tres semanas a poslarvas de camarón causó un aumento significativo (p < 0,05) en la tasa específica de crecimiento (TEC = 3,8 ± 0,7 % día-1), el incremento de peso diario (ADG = 1,5 ± 0,1 mg día-1) y en la tasa de conversión alimenticia (TCA = 1,5 ± 0,1 %) en comparación con los controles sin adición de esta bacteria (PBS estéril). Así mismo, la administración de B. firmus C101 (106 UFC mL-1 * día) a rotíferos causó un aumento en la tasa de crecimiento poblacional (TC = 20,2 ± 1,5 % día-1), fecundidad (F = 0,4 ± 0,03 huevos individuos-1) y productividad (R = 16,0 ± 0,7 individuos mL-1 * día), después de 48 h de cultivo. Con base en lo anterior y en comparación con otros estudios, se sugiere a B. firmus C101 como potencial probiótico y promotor del crecimiento en poslarvas de camarón, y como primer reporte del efecto de su administración en rotíferos. No obstante, se precisan estudios sobre los posibles mecanismos de acción, y pruebas a escala piloto y comercial para validar estos resultados y su posible transferencia al sector productivo.
PALABRAS CLAVE: probiótico; promotor del crecimiento; Bacillus firmus; camarón blanco; rotíferos
The growing demand for aquaculture protein suggests seeking biotechnological alternatives that improve the cultivation of species of commercial interest. In this study, Bacillusfirmus C101 was evaluated as a growth promoter and probiotic potential, which was characterized and subsequently administered (106 CFU mL-1 * day) in post-larvae of white shrimp (Litopenaeus vannamei) and rotifers (Brachionusplicatilis sensu stricto). B. firmus C101 was observed to have the tolerance to bile salts, strong phosphatase activity, and antimicrobial activity against pathogens such as Vibrio alginolyticus and Aeromonas hydrophila, among others. On the other hand, after its administration for three weeks to postlarvae of shrimp, it caused a significant increase (p < 0.05) in the specific growth rate (TEC = 3.8 ± 0.7 % day-1), the increase in daily weight (ADG = 1.5 ± 0.1 mg day-1) and in the feed conversion rate (TCA = 1.5 ± 0.1 %) compared to controls without the addition of this bacterium (sterile PBS). Likewise, the administration of B. firmus C101 (106 CFU mL1 * day) to rotifers caused an increase in the population growth rate (TC = 20.2 ± 1.5 % day1), fertility (F = 0.4 ± 0.03 eggs individuals-1) and productivity (R = 16.0 ± 0.7 individuals mL-1 * day) after 48 h of culture. Based on the above and in comparison with other studies, B. firmus C101 is suggested as a potential probiotic and growth promoter in shrimp postlarvae, and as the first report of the effect of its administration in rotifers. However, studies on the possible mechanisms of action are required, as well as tests on a pilot and commercial scale to validate these results and their possible transfer to the productive sector.
KEYWORDS: probiotic; growth promoter; Bacillusfirmus; white shrimp; rotifers
INTRODUCCIÓN
En acuicultura, los probióticos se definen como "microorganismos vivos que cuando se administran en cantidades apropiadas, proveen beneficios en la salud de los hospederos" (FAO, 2001; Bajagai et al., 2016). Estos microorganismos son capaces de secretar sustancias antagónicas, factores de crecimiento, nutrientes esenciales y enzimas digestivas, que promueven y mejoran la digestión, el crecimiento, la respuesta inmune y la respuesta al estrés (Nimrat et al., 2013; Hoseinifar et al., 2017). Para su aplicación en organismos acuáticos de cultivo, deben cumplir con ciertas características tales como una alta tolerancia a sales biliares, crecimiento a amplios rangos de temperatura, salinidad y pH, así como habilidad para adherirse a la mucosidad del tracto intestinal y no mostrar factores de virulencia (Kazuñ y Kazuñ 2014; Dawood et al., 2018).
En la actualidad, numerosas cepas bacterianas del género Bacillus se utilizan como probióticos para promover el crecimiento en organismos acuáticos cultivados (Kumar et al., 2016; Ringo y Song, 2016), especialmente en estadios larvarios (Newaj-Fyzul et al., 2014; Vieira et al., 2016; Zorriehzahra et al., 2016). De esta manera, se ha descrito previamente el efecto de cepas de B. firmus como promotores del crecimiento y supervivencia en el camarón blanco (Litopenaeus vannamei) (Yuniarti et al., 2013; Barman et al., 2017), una especie de interés comercial que actualmente se ve afectada por enfermedades bacterianas, especialmente durante las etapas larvarias (Flores-Miranda et al., 2012; López León et al., 2016).
Así mismo, se ha demostrado que las bacterias probióticas tienen un efecto positivo en la productividad, crecimiento poblacional y fecundidad de organismos como los rotíferos del género Brachionus sp. (Najmi et al., 2018), los cuales son utilizados como alimento vivo en el cultivo de organismos acuáticos en estadios larvarios (Gatesoupe, 1991; Hirata et al., 1998; Zink et al., 2013). En consecuencia, la creciente demanda en la bioseguridad en la cadena de producción, ha exigido el uso de estrategias biotecnológicas que eviten el uso inadecuado de antibióticos, y que permitan mejorar la respuesta fisiológica en los estadios larvarios y postlarvarios de especies como el camarón blanco, así como la calidad y los parámetros de los cultivos de rotíferos (Vieira et al., 2016; Li et al., 2017). Por consiguiente, el presente estudio presenta las características de B. firmus C101 como promotor del crecimiento y posible candidato probiótico para poslarvas de camarón blanco (L. vannamei), y en el cultivo de rotíferos (B. plicatilis s.s.).
MATERIALES Y MÉTODOS
Obtención de cepas bacterianas y mantenimiento en medios de cultivo
C101 fue aislado de branquias de larvas sanas de Cobia (Rachycentron canadum). Para los ensayos, C101 fue cultivado en agar y caldo Tripticasa Soya (TSA y TSB, Becton Dickinson™) con NaCl 1 % y en agar Marino (Zobell™). Vibrio alginolyticus, se obtuvo de un episodio de mortalidad de Jurel (Caranx hippos) de un acuario local y V. harveyi BB120 (Bassler et al., 1997), ambos se cultivaron en agar Tiosulfato-Citrato-Bilis-Sacarosa (Becton Dickinson™), agar Sangre-Cordero (Becton Dickinson™) y agar Nutritivo (Sigma-Aldrich). Aeromonas hydrophila, Edwardsiella tarda y Streptococcus agalactiae se aislaron de mortalidades de Tilapia (Oreochromis spp.) y fueron obtenidos de la colección de microorganismos de la Facultad de Veterinaria de la Universidad Nacional de Colombia y cultivados en medios TSA, TSB y Sangre-Cordero. Para la preservación a largo plazo, las bacterias se cultivaron en caldo TSB y fueron almacenadas a -80 °C con 20 % de glicerol (Murillo y Villamil, 2011).
Caracterización de C101
La morfología se describió a través de microscopía óptica (Olympus CX22) y el carácter Gram a través de tinción (Claus, 1992). Se realizaron las pruebas catalasa y oxidasa (tetrametil-para-fenilendiamina) y se obtuvo el perfil enzimático con el kit API-ZYM® (Biomérieux). El crecimiento de C101 se evaluó a diferentes temperaturas (4, 28, 36 y 40°C), salinidades (0, 1, y 6,5 % de NaCl), pH (2, 4, 6, 7 y 8), y sales biliares (0,5, 1, 3 y 5 %). La identidad se determinó a partir de la secuenciación parcial del gen 16S ARNr con los primers 63f (5'-CAGGCCTAACACATGCAAGTC-3') y 1387r (5 ' -GGGCGGWGTGTACAAGGC-3 '). Las lecturas se analizaron con el algoritmo BLASTn, y para la asignación de especie se tuvo en cuenta un mínimo de 98,65 % de similitud (Valenzuela-González et al., 2015).
El crecimiento se evaluó según Villamil y Esguerra (2017). En placas de 96 pocillos se mezclaron por triplicado 50 μl del cultivo fresco (106 UFC mL-1) y 50 μl del medio líquido, y se incubaron a 28 °C. El crecimiento fue monitoreado por 72 h y la densidad óptica (DO) (Absorbancia o Abs a 600 nm) fue leída en el espectrofotómetro Modulus Microplate Reader. También, se estimó la viabilidad y supervivencia en agua de mar re-suspendiendo 106 UFC mL-1, incubando por 24 h a 28 °C, y realizando un recuento en placa (UFC mL-1).
Ensayo de actividad antimicrobiana
Los productos extracelulares (ECPs) de C101 fueron extraídos siguiendo la metodología descrita por Cabo et al. (1999) y Villamil et al. (2010) con ligeras modificaciones. Para ello, C101 se cultivó en caldo por 24 h, el cultivo se centrifugó en tres ciclos de 3000 rpm x 15 minutos, y el sobrenadante (que contenía los ECPs) fue recuperado y luego filtrado a 0,2 μm. Posteriormente, en una placa de 96 pocillos se adicionaron por triplicado 50 μl del filtrado y 50 μl del cultivo fresco del patógeno (106 UFC mL-1). La placa se incubó a 28 °C por 24 h y se realizó la lectura de la DO. Se incluyó como control 50 μl del medio de cultivo con los ECPs. El cambio en la DO de los cultivos de las cepas patógenas se expresó como porcentaje de inhibición del crecimiento.
Obtención y mantenimiento de camarones y rotíferos
Las poslarvas (PLs) de camarónblanco (L. vannamei) en estadio PL-21, y los rotíferos (B. plicatilis s.s.) fueron provistos por Ceniacua (Cartagena, Colombia), transportados hasta las instalaciones de la Universidad Jorge Tadeo Lozano (Santa Marta, Colombia), y aclimatados en estanques con aeración continua. Las poslarvas se dispusieron en un acuario de vidrio con 32 L de agua de mar filtrada (35 de salinidad y 28 °C), a una densidad de 16 PLs L-1, y se alimentaron con concentrado Nicovita molido (tamaño 500 μm y donado por Ceniacua) en tres raciones diarias (10 % del peso corporal) (Membreño et al., 2014). Las condiciones se mantuvieron estables, con aeración continua, recambios de agua del 80 % día-1 y foto-período de 12 h luz y 12 h oscuridad. El cultivo masivo de rotíferos (B. plicatilis s.s.) se mantuvo en agua de mar filtrada y estéril (35 de salinidad y 28 °C), con condiciones estables de aeración, iluminación continua, y recambios de agua del 100 % día-1, tamizándolos por 100 y 60 μm, y alimentándolos dos veces al día con Nanochloropsis sp. (106 microalgas mL-1).
Evaluación de B. firmus C101 como probiótico para camarones y rotíferos
C101 se cultivó en caldo TSB por 24 h a 28 °C. El cultivo se centrifugó a 6000 rpm por 15 min a 4 °C, el pellet fue lavado tres veces con solución salina estéril (0,9 % NaCl), y se resuspendió en 15 ml de Buffer Fosfatos (PBS 1 X) estéril. Se estimó la concentración inicial de la suspensión líquida por espectrofotometría (Abs a 600 nm), y se verificó por recuento directo en placa y se reportó como número de unidades formadoras de colonia por unidad de volumen (UFC mL-1).
Evaluación para poslarvas de camarón
Se dispusieron tres contenedores plásticos para el tratamiento con C101 y tres para el control (PBS estéril). En cada contenedor con 2 L de agua de mar ultra-filtrada se sembraron 30 PLs de camarón (para un total de 180 PLs). Todas las condiciones de cultivo y de alimentación se mantuvieron estables realizando recambios de agua del 100 % día-1. La suspensión líquida de C101 fue adicionada diariamente en el agua de los contenedores (Luis-Villaseñor et al., 2011) a una dosis final de 106 UFC mL1 * día (Zhou et al., 2009). Como control se adicionó PBS, sin presencia de C101. El experimento tuvo una duración de tres semanas.
Al inicio del experimento se tomaron datos del peso seco (muestras incubadas a 65 °C por 48 h) y la longitud en fresco de las PLs de camarón (n = 10). Al terminar el experimento se tomaron estos mismos datos tanto de los controles (n = 30, es decir, 10 de cada réplica) como de las poslarvas tratadas con C101 (n = 30). La longitud en fresco se determinó por estereoscopía, mientras que el peso seco se midió en una balanza digital (Sartorius, Cubis®). Adicionalmente, al final del experimento también se determinó el número de PLs vivas antes de tomar las muestras para los análisis. Con los datos obtenidos se calcularon los siguientes índices: Ganancia en peso (GP) (%) = (Wf-Wi)/Wi * 100, Ganancia en talla (GT) (%) = (Lf-Li)/Li * 100, Tasa Específica de Crecimiento (TEC) (% día-1) = (LnWf-LnWi)/t * 100, Promedio de Incremento de Peso por Día (ADG) (mg día-1) = (Wf-Wi)/t, y la Tasa de Conversión Alimenticia (TCA) = R/(Wf-Wi); en donde W es peso promedio, L es la longitud promedio, t es el tiempo de duración (en días) del experimento, y R es la ración diaria del alimento concentrado (Abd El-Rhman et al., 2009; Nimrat et al., 2013). La tasa de supervivencia de los organismos se calculó así: Supervivencia (%) = (nf/ni) * 100, en donde ni es el número total de individuos en cada contenedor al inicio del experimento y nf al final (Nimrat et al., 2012).
Evaluación para rotíferos
Los rotíferos fueron dispuestos en erlenmeyers con 80 ml de agua de mar ultra-filtrada y estéril, a una densidad inicial de 65 ± 4,2 rotíferos mL-1. La adición de B. firmus C101 se llevó a cabo por dos días (una adición diaria, es decir, cada 24 h), a una concentración final de 106 UFC mL-1 * día. Tanto el tratamiento con C101, como el control (medio de cultivo estéril) se realizaron por triplicado. También, todas las condiciones de cultivo y de alimentación fueron constantes con recambios de agua del 100 % día-1.
El efecto de la administración de C101 en los rotíferos se determinó mediante el crecimiento poblacional, medido por el cambio en la densidad de individuos, hembras, machos y huevos. Para ello, se tomó como unidad de muestreo 1,0 ml de cada cultivo y se realizó un conteo por microscopía óptica mediante el método de Edmonson (conteo/volumen) en placa de Sedgewick Rafterm (Biologik®), y se tomaron tres alícuotas por tratamiento para tener en cuenta la variabilidad de las alícuotas. Todas las mediciones se efectuaron por triplicado, y con ello se calcularon los siguientes índices: Tasa de crecimiento poblacional (TC) (% día-1) = (Ln Nt-Ln No/t * 100), Fecundidad (F) (huevos indiv.-1) = (# Huevos/# Hembras) y Productividad (R) (indiv. mL-1 * día) = (Nt-No/t * 100); en donde Nt es la densidad de rotíferos en el tiempo t, No es la densidad inicial y t es el tiempo de suministro en el cultivo (Cisneros, 2011, 2012).
Evaluación del número de bacterias totales cultivables asociadas a camarones y rotíferos
Tras la adición de C101, se realizó un recuento de bacterias totales heterótrofas (BT) a partir de los tejidos de las poslarvas de camarón y de los rotíferos. Para ello, se tomó un individuo (1,0 ml en el caso de los rotíferos) de cada réplica tanto del tratamiento como del control. Las muestras fueron lavadas con abundante agua de mar estéril, y fueron maceradas bajo condiciones de esterilidad. Este macerado fue resuspendido en 0,5 ml de PBS 1X y luego diluido en serie hasta 10-6 según Villamil et al. (2010) y Murillo y Villamil (2011). Después, 0,1 ml de las diluciones 10-3 a 10-6 fueron sembrados por triplicado en agar Marino (Zobell™). Las placas se incubaron a 28 °C por 24 h, y al final se determinó el número de unidades formadoras de colonias por miligramo de tejido (UFC mg-1) y por rotífero (UFC rotífero-1). Todos los recuentos se llevaron a cabo por triplicado.
Análisis estadístico
Los datos se expresaron como promedios ± error estándar (ES). Se probaron los supuestos de normalidad con el test de Shapiro-Wilk, y la homogeneidad de varianzas (homocedasticidad) con una prueba de Levene's. Se realizaron análisis de varianza a una vía (ANOVA) para probar las diferencias estadísticas (p < 0,05). Además, se usó un test de múltiples rangos de Duncan para comparar las medias cuando las diferencias eran detectadas con el ANOVA. Todos los análisis estadísticos se llevaron a cabo en SPSS 15,0 y Statgraphics Centurión XV para Windows (California, USA).
RESULTADOS
Caracterización de C101
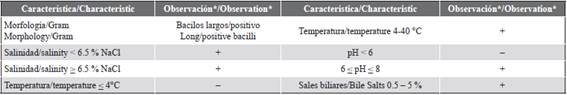
La caracterización morfológica y fisiológica de C101 se describe en la Tabla 1. Este aislado fue identificado como Bacillus firmus (98,8 % de identidad), mostró crecimiento a diferentes temperaturas (entre 4 y 40°C), concentraciones de sal (entre 0 y 6,5 % de NaCl), y concentraciones de sales biliares (entre 0,5 y 5 %), pero no se evidenció crecimiento a pH extremos (< 6 y > 8), ni por debajo de 4°C. El crecimiento ideal de C101 se observó a 28°C, 1 % de NaCl y pH 7,4, condiciones que fueron utilizadas en todos los ensayos posteriores para su cultivo. En cuanto al crecimiento, se observó que continúa creciendo después de las 24 h y hasta las 72 h de incubación a una tasa de 0,0191 ± 0,003 abs h-1, y además, es capaz sobrevivir en agua de mar (28°C y 35 de salinidad) con recuentos de 4,2 ± 1,4 x 106 UFC mL-1 de agua tras 24 h de incubación.
Actividad enzimática y antimicrobiana de C101
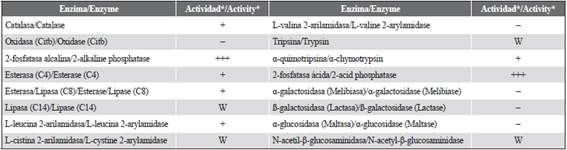
La actividad enzimática de B. firmus C101 se muestra en la Tabla 2. En resumen, B. firmus C101 es catalasa positiva, oxidasa negativa, presentó intensa actividad fosfatasa ácida y alcalina, moderada actividad lipasa/esterasa (C4 - C8) y tripsina/a-quimotripsina y no muestra actividad en la hidrólisis de disacáridos. Adicionalmente, los ECPs de B. firmus C101 mostraron actividad inhibitoria del crecimiento de diferentes patógenos, resultando ser más activos contra V. alginolyticus (49,7 %), A. hydrophila (47,9 %) y S. agalactie (46,8 %) y en menor medida frente a E. tarda (39,6 %) y V. harveyi BB120 (12,3 % de inhibición).
Evaluación para poslarvas de camarón
La longitud y peso promedio iniciales de las poslarvas (PL-21) de camarón blanco (L. vannamei) fueron de 70,2 ± 2,1 mm y 12,3 ± 0,02 mg respectivamente. Luego de la administración de B. firmus C101 (Figura 1), se evidenció un aumento significativo (p < 0,05) para todos los indicadores de crecimiento en relación con el tratamiento control (Tabla 3).

Figura 1 Poslarvas (PLs) de camarón Litopenaeus vannamei administradas con Bacillus firmus C101. a) PLs antes de la adición, b) PLs del control (sin adición), c) y d). PLs administradas con B. firmus C101 (Réplica 1 y 2).
Tabla 3 Indicadores de crecimiento y supervivencia de las poslarvas de camarón blanco (Litopenaeus vannamei) administrados con Bacillus firmus C101.
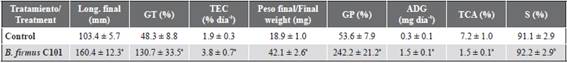
Los datos se expresaron como promedio ± ES. a) Hubo diferencias significativas (p < 0.05) en los promedios del tratamiento con C101 con respecto al control. b) No hubo diferencias significativas (p > 0.05) con respecto al control. Long.: longitud, GT: ganancia en talla, TEC: tasa específica de crecimiento, GP: ganancia en peso, ADG: promedio de incremento en peso diario, TCA: tasa de conversión alimenticia, S: supervivencia.
En general, se observó un incremento en la longitud y peso de las poslarvas con el tratamiento de B. firmus C101, respecto a las del control. Hubo un efecto marcado sobre la tasa específica del crecimiento (TEC = 3,8 ± 0,7 % día-1), el incremento en peso diario (ADG = 1,5 ± 0,1 mg día-1) y la tasa de conversión alimenticia (TCA = 1,5 ± 0,1 %), que fue significativamente menor (p = 0,0011) en relación con el control. Además, no se observaron efectos negativos en la tasa de supervivencia (S > 90 %) de las poslarvas tras la adición de B. firmus C101, ni diferencias significativas con respecto al control (p > 0,05; p = 0,3793).
Evaluación para rotíferos
Las densidades iniciales en los cultivos fueron de 65,0 ± 4,2 indiv. mL-1, 44,7 ± 3,8 hembras mL-1, 20,3 ± 2,3 machos mL-1 y 25,0 ± 3,2 huevos mL-1, y los indicadores del crecimiento poblacional se describen en la Tabla 4. Se observó que para el número de individuos totales y de hembras no hubo diferencias (p > 0,05) entre el tiempo inicial y el tiempo final en el control. No obstante, en el tratamiento con B. firmus C101 sí se encontraron diferencias (p < 0,05). También se observó una disminución significativa (p < 0,05) del número de huevos en el control en el tiempo final. El número de machos se redujo significativamente al final del experimento en el control y tratamiento. Por otro lado, se observó un incremento significativo en el número de individuos (p = 0,0101), hembras (p = 0,0009) y huevos (p = 0,00001) tras la administración de B. firmus C101 con relación al control. Así, se observó que el efecto de B. firmus C101 fue más evidente para el número total de rotíferos (97,0 ± 3,4 indiv. mL-1) y para el de hembras (87,7 ± 1,9 hembras mL-1) y en relación con el control. Los índices de crecimiento poblacional (TC), fecundidad (F) y productividad (R) también fueron significativamente mayores (p < 0,05) tras la administración de B. firmus C101, y en comparación con lo obtenido para el control.
Tabla 4 Parámetros de crecimiento poblacional de los cultivos de rotíferos (Brachionus plicatilis s.s.), administrados sin probiótico (control) y con Bacillus firmus C101, cultivados por 48 h.

Los datos se expresaron como promedio ± ES. a) Hubo diferencias significativas entre el tiempo inicial y el final (p < 0.05). b) No hubo diferencias significativas entre el tiempo inicial y el final (p > 0.05). c) Hubo diferencias significativas en los promedios de los parámetros/índices con relación al control (p < 0.05). d) No hubo diferencias significativas en el promedio de los parámetros con relación al control ♀ hembras, ♂ machos, TC: tasa de crecimiento poblacional, F: fecundidad (egg-ratio) y R: productividad.
Evaluación del número de bacterias totales cultivables asociadas a camarones y rotíferos
Los valores de los recuentos de bacterias totales (BT) cultivables a partir de los tejidos de las poslarvas de camarón blanco y rotíferos se muestran en la Figura 2. En ambos casos, se observó un aumento significativo (p < 0,05) en el recuento en placa de BT tras la administración de B. firmus C101, en relación a los obtenidos para el tratamiento control. En cuanto a las poslarvas de camarón, se obtuvieron recuentos en promedio de 4,9 ± 0,4 x 107 UFC mg-1 de tejido con la adición de B. firmus C101. Para los rotíferos, el recuento promedio fue de 2,9 ± 0,3 x 105 UCF rotífero-1 tras el tratamiento con B. firmus C101.
DISCUSIÓN
Evaluación de B. firmus C101 como probiótico para poslarvas de camarón
Las bacterias del género Bacillus han tenido éxito como aditivos en la dieta de organismos acuáticos de cultivo (Kumar et al, 2016; Ringe y Song, 2016), mejorando la calidad del agua (Zokaeifar et al., 2014; Tang et al., 2016) y evidenciando un potencial efecto sobre el crecimiento y supervivencia en estadios larvarios de diferentes especies marinas de interés comercial (Vieira et al., 2016; Zorriehzahra et al, 2016). En el cultivo de camarón blanco (Litopenaeus vannamei) se ha demostrado el efecto positivo de distintas especies de este género (i.e. Bacillus cereus, B. subtilis, B. pumilus, B. megaterium, B. coagulans y B. licheniformis) cuando se han administrado a diferentes dosis, y en alimentos liofilizados (108 UFC g-1) (Wang, 2007), micro-encapsulados (109 UFC g-1) (Nimrat et al, 2012), pellets (1010 UFC g1) (Zokaeifar et al, 2012; Sadat Hoseini Madani et al, 2018), suspensiones líquidas (106 UFC mL-1 directamente en el agua) (Wang et al, 2016), bio-flóculos (109 UFC mL1) (Ferreira et al, 2015; Pacheco-Vega et al, 2018) y en mezcla con otras bacterias (107 y 109 UFC g-1) (Bernal et al, 2017; Bachruddin et al., 2018).
Además, previamente se ha demostrado el efecto de cepas de B. firmus sobre el crecimiento y resistencia en camarón tigre (Penaeus monodon) (Raghu et al, 2016; Kolanchina et al, 2017) y en L. vannamei (Yuniarti et al., 2013; Barman et al., 2017). En este estudio se reporta que a una dosis de 106 UFC mL-1 de B. firmus C101, administrado directamente en el agua y sin mezclar con otras cepas, se obtiene un incremento significativo en el crecimiento y rendimiento de las PLs de camarón blanco (L. vannamei).
En comparación con otros estudios llevados a cabo en diferentes estadios de L. vannamei (de nauplio a juveniles), la adición de cepas de Bacillus sp. tiene un efecto marcado en la tasa de conversión alimenticia (TCA %), evidenciando valores por debajo de 1,8 % e incluso algunos iguales o menores a 1,5 % (Tabla 4). Estos bajos valores indican un crecimiento rápido y buen aprovechamiento del alimento (Membreño et al., 2014), lo cual a su vez corresponde a la ganancia de talla y peso obtenidos en este estudio. No obstante, para las comparaciones directas sobre el efecto de los probióticos, se debe tener en cuenta la forma de adición (individual o en mezcla), la dosis, la vía y la duración de la administración. Así, con la adición de B. firmus C101 directamente en el agua de cultivo de las poslarvas de camarón, y con una duración de tres semanas, el efecto sobre las tasas específicas de crecimiento, incremento de peso diario y conversión alimenticia, es altamente promisorio si se compara con lo obtenido en otros estudios según el tipo de probiótico (simple o en mezcla), la dosis, la vía de administración y la duración de la misma (Tabla 5).
Tabla 5 Algunos estudios del efecto de la administración de bacterias del género Bacillus sp. en camarón blanco (Litopenaeus vannamei) de diferentes estadios.
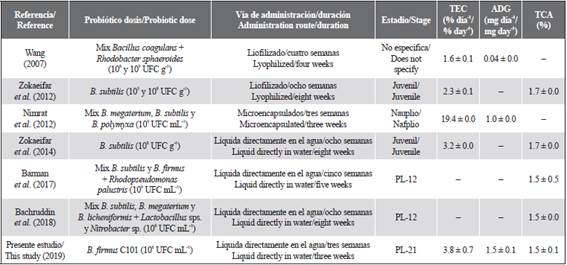
Los datos se expresan como promedio ± DE (desviación estándar). TEC = tasa específica de crecimiento, ADG = promedio de incremento de peso diario y TCA = tasa de conversión alimenticia.
El crecimiento, la resistencia a cambios de temperatura, salinidad, y las condiciones fisiológicas del tracto gastrointestinal (TGI) de los organismos, el cual es ligeramente alcalino (pH ~ 8,0) y con una alta concentración de sales biliares (Heisterkamp et al., 2016), son características que debe cumplir un buen candidato a probiótico (Balcázar et al., 2006; Reddy et al, 2018). De acuerdo con lo anterior, el perfil fisiológico de B. firmus C101 y el hecho de que algunas cepas de B. firmus pueden adherirse y formar biopelículas en el tracto intestinal de organismos acuáticos (Kesarcodi-Watson et al., 2008) sugieren que existe una alta probabilidad de colonización del TGI de las poslarvas de camarón blanco y una alta probabilidad de supervivencia bajo estas condiciones, por lo que en futuras investigaciones sería pertinente efectuar un análisis de la diversidad microbiana intestinal con técnicas independientes de cultivo.
Adicionalmente, el perfil bioquímico de B. firmus C101 sugiere una alta actividad enzimática de hidrolasas como las lipasas/esterasas, quimotripsinas y fosfatasas, las cuales pueden ser benéficas para el hospedero, dado que varios estudios sugieren que una vez estas bacterias se establecen en el TGI pueden secretar estas enzimas, y de esta manera contribuir a la degradación y absorción de los nutrientes esenciales que mejoran la digestión y el aprovechamiento del alimento (Castex et al, 2008; Angelakis, 2017; Gobi et al., 2018). Otras investigaciones indican que la producción de fosfatasas por parte de probióticos como B. subtilis aumenta la absorción de elementos como calcio, hierro y fósforo inorgánico en especies de peces como Epinephelus coioides y Silurus soldatovi (Liu et al, 2010) y facilita la eliminación de ésteres de fosfatos y la detoxificación intestinal, lo que evita problemas de inflamación e infecciones en el TGI que pueden conllevar al estrés y muerte del hospedero (Lallès y Suescún, 2014).
Por otro lado, se sabe que algunas cepas de Bacillus sp. muestran una importante actividad antagónica frente a potenciales patógenos como A. hydrophila (Yi et al, 2018), Edwarsiella tarda (Ran et al., 2012), V. harveyi (Zokaeifar et al., 2012), V. parahaemolyticus (Bernal et al., 2017) y Streptococcus sp. (Liu et al., 2012), que afecta la larvicultura de animales acuáticos (López León et al., 2016). Este estudio resalta la actividad inhibitoria de los ECPs de B. firmus C101 frente a algunos de estos potenciales patógenos. No obstante, posteriores estudios sobre este modo de acción son requeridos, pues algunos autores sugieren que dicha actividad puede deberse a la secreción de compuestos como antibióticos, sideróforos, bacteriocinas, proteasas, formas reactivas del oxígeno (i.e. H2O2) y lisozimas (Khochamit et al., 2015; Newaj-Fyzul y Austin, 2015; Wang et al, 2015), que podrían estar presentes en los ECPs de este candidato.
Con base en todo lo anterior, se propone a B. firmus C101 como un potencial candidato probiótico y promotor del crecimiento en la larvicultura del camarón blanco (L. vannamei), especialmente en estadios post-larvarios y en sistemas de cultivo cerrado. No obstante, se requieren estudios sobre los posibles mecanismos de acción de este candidato, la habilidad para adherirse al TGI y el efecto en la calidad del agua de los cultivos.
Evaluación de B. firmus C101 como probiótico para rotíferos
En las últimas décadas, varios estudios han señalado que las bacterias acido-lácticas (i.e.: Lactobacillus plantarum, L. delbrueckii, L. acidophilus, L. rhamnosus) y del género Bacillus (i.e.: B. subtilis, B. megaterium, B. licheniformis, B. pumilus) tienen un efecto positivo sobre los rendimientos de los cultivos de rotíferos. Por tanto, se ha observado que cultivos mixtos de estas bacterias aumentan su densidad (rotíferos mL-1), carga bacteriana benéfica (UFC rotífero-1) y composición nutricional (Hirata et al, 1998; Douillet, 2000; Najmi et al, 2018). En una publicación previa (Murillo y Villamil, 2011), se registró un efecto notable sobre el crecimiento y regulación de la microbiota de B. plicatilis tratado con B. subtilis CCBM-64 (107 UFC mL1). Otro estudio mostró que mezclas de B. subtilis, B. licheniformis, B. megaterium y B. laterosporous (108 UFC L-1 c/u) tienen un efecto directo sobre la fecundidad de los rotíferos (egg-ratios de 0,30 a las 48 h de tratamiento) (Zink et al., 2013). En concordancia, los datos del presente estudio sugieren un notable efecto de Bacillus firmus C101 sobre el crecimiento poblacional, fecundidad y productividad de B. plicatilis s.s., cuando se administra a una dosis de 106 UCF mL-1, después de 48 h. No obstante, comparaciones directas de la dinámica poblacional entre estudios de rotíferos puede ser complicado debido a la utilización de diferentes cepas, mezclas, mecanismos de suministro y/o condiciones previas o durante el cultivo como el tipo, y cantidad de microalgas suministradas como alimento primario (Snell et al, 1983; Abd Rahman et al., 2018).
Entre los beneficios del enriquecimiento de los cultivos de rotíferos con este tipo de probióticos, se encuentra la modulación de la microbiota endógena del tracto digestivo, que incluye el aumento de la carga de bacterias benéficas, la disminución de la carga de bacterias patógenas (Makridis et al., 2000; Planas et al, 2004) y la secreción de metabolitos y nutrientes esenciales como vitaminas (biotina y VitB12), aminoácidos y factores de crecimiento (Yoshimatsu y Hossain, 2014). Esto contribuye al mejoramiento de la composición nutricional (Rollo et al., 2006), tasa de reproducción (Qi et al, 2009), y tasa de crecimiento (Rombaut et al, 1999) de los rotíferos. En el presente estudio se observó que la administración de B. firmus C101 en los cultivos resultó en un aumento de las densidades poblacionales, lo cual evidencia a su vez un efecto positivo de este candidato probiótico. No obstante, se requieren investigaciones futuras sobre su perfil nutricional y un análisis de la comunidad bacteriana que a su vez permita determinar si el aumento en el número de bacterias totales se debe a la incorporación de este candidato en la microbiota nativa, y no a un aumento de la carga bacteriana de posibles patógenos (i.e. especies del género Vibrio) en los tejidos de los rotíferos.
La importancia del presente aporte en este estudio radica en que el mejoramiento de los cultivos de rotíferos a través de estas estrategias ha resultado ser una herramienta importante para la transferencia de los candidatos probióticos a los organismos de cultivo en etapas larvarias (Jamali et al., 2015). Así, estos organismos pueden aprovechar los múltiples beneficios que brindan las bacterias probióticas, como por ejemplo, la disminución de las enfermedades que afectan a las larvas (Jeeja et al, 2011; Loka et al, 2016). Por tal razón, estudios futuros son necesarios para probar que los rotíferos enriquecidos pueden servir de vehículo en la transferencia de este candidato probiótico hacia las larvas de organismos de cultivo como el camarón, pues algunos estudios sugieren que una vez estos candidatos probióticos se establecen en los tejidos y el tracto digestivo de los rotíferos (o de cualquier otro tipo de alimento vivo) (Kostopoulou y Centre, 2012), dichos candidatos y sus productos pueden llegar efectivamente hasta el TGI de las larvas, que se alimentan de estas presas vivas enriquecidas (Ringe et al, 2003, 2007).
CONCLUSIONES
Es posible confirmar el importante papel de Bacillus firmus C101 como promotor del crecimiento en estadios post-larvarios de camarón blanco (L. vannamei) y en el mejoramiento de los parámetros poblacionales de rotíferos (B. plicatilis s.s.), pues los resultados aquí presentados indican un efecto positivo de la adición directa de esta cepa en cultivos experimentales. A pesar de que en la actualidad existen numerosos reportes sobre el efecto probiótico de diferentes especies de Bacillus sp., el presente estudio puede considerarse como el primer reporte del efecto de la administración individual de B. firmus en rotíferos. No obstante, se requieren estudios adicionales sobre los posibles mecanismos de acción de este candidato probiótico, y pruebas a escala piloto y comercial para validar estos resultados y su posible transferencia a las empresas acuícolas.
AGRADECIMIENTOS
Los autores agradecen a la Fundación Universidad Jorge Tadeo Lozano (sede: Santa Marta, Colombia) por prestar las instalaciones para la ejecución de los experimentos, a Ceniacua (Cartagena, Colombia) por la donación de los organismos experimentales, a Colciencias por la financiación del macroproyecto (código 6507-502-27286), a María Angélica Martínez Silva y Lina María Mejía Quiñones por su aporte en algunos experimentos, y a la Universidad de La Sabana por el apoyo en el material bibliográfico
REFERENCIAS
Abd El-Rhman, A.M., Y.A.E. Khattab and A.M.E. Shalaby. 2009. Micrococcus luteus and Pseudomonas species as probiotics for promoting the growth performance and health of Nile tilapia, Oreochromis niloticus. Fish Shellfish Immunol., 27: 175-180. http://dx.doi.org/10.1016/j.fsi.2009.03.020. [ Links ]
Abd Rahman, A.R., Z.C. Cob, Z. Jamari, A.M. Mohamed, T. Toda and O.H. Ross. 2018. The effects of microalgae as live food for Brachionus plicatilis (Rotifer) in intensive culture system. Trop. Life Sci. Res., 29: 127-138. [ Links ]
Angelakis, E. 2017. Weight gain by gut microbiota manipulation in productive animals. Microb. Pathog., 106: 162-170. http://dx.doi.org/10.1016/j.micpath.2016.11.002. [ Links ]
Bachruddin, M, M. Sholichah, S. Istiqomah and A. Supriyanto. 2018. Effect of probiotic culture water on growth, mortality, and feed conversion ratio of Vanamei shrimp (Litopenaeus vannamei Boone). IOP Conf. Ser. Earth Environ. Sci., 137. [ Links ]
Bajagai, Y.S., A.V. Klieve, P.J. Dart and W.L. Bryden. 2016. Probiotics in animal nutrition: production, impact and regulation. FAO. [ Links ]
Balcázar, J.L., I. de Blas, I. Ruiz-Zarzuela, D. Cunningham, D. Vendrell and J.L. Múzquiz. 2006. The role of probiotics in aquaculture. Vet. Microbiol., 114: 173-186. [ Links ]
Barman, P., S. Raut, S.K. Sen, U. Shaikh and P. Bandyopadhyay. 2017. Effect of a three-component bacterial consortium in white shrimp farming for growth, survival and water quality management. Acta Biologica Szegediensis, 61(1): 35-44. [ Links ]
Bassler, B.L., E.P. Greenberg and A.M. Stevens. 1997. Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi. J. Bacteriol., 179: 4043-4045. [ Links ]
Bernal, M.G., R.M. Marrero, Á.I. Campa-Córdova and J.M. Mazón-Suástegui. 2017. Probiotic effect of Streptomyces strains alone or in combination with Bacillus and Lactobacillus in juveniles of the white shrimp Litopenaeus vannamei. Aquac. Int., 25: 927-939. [ Links ]
Bomba, A., R. Nemcová, D. Mudroñová and R Guba. 2002. The possibilities of potentiating the efficacy of probiotics. Trends Food Sci. Technol., 13: 121-126. [ Links ]
Cabo, M.L., M.A. Murado, M.P. González and L. Pastoriza. 1999. A method for bacteriocin quantification. J. Appl. Microbiol., 87: 907-914. [ Links ]
Castex, M., L. Chim, D. Pham, P. Lemaire, N. Wabete, J.L. Nicolas, P. Schmidely and C. Mariojouls. 2008. Probiotic P. acidilactici application in shrimp Litopenaeus stylirostris culture subject to vibriosis in New Caledonia. Aquaculture, 275: 182-193. [ Links ]
Cisneros, R. 2011. Rendimiento poblacional del rotífero nativo Brachionus sp. "Cayman", utilizando diferentes enriquecedores. Ecol. Apl., 10: 99-105. [ Links ]
Cisneros, R. 2012. Crecimiento poblacional del rotifero nativo Brachionus sp."Cayman", al evaluar diferentes microalgas como alimento. Revista cubana de investigaciones pesqueras, 29(1): 18-23. [ Links ]
Claus, D. 1992. A standardized Gram staining procedure. World J. Microbiol. Biotechnol., 8: 451-452. [ Links ]
Dawood, M.A.O., S. Koshio, M.M. AbdelDDaim and H. Van Doan. 2018. Probiotic application for sustainable aquaculture. Rev. Aquac., 11(3): 907-924. [ Links ]
Douillet, P.A. 2000. Bacterial additives that consistently enhance rotifer growth under synxenic culture conditions 2. Use of single and multiple bacterial probiotics. Aquaculture, 182: 241-248. [ Links ]
Fao, W.H.O. 2001. Evaluation of health and nutritional properties of probiotics in food, including powder milk with live lactic acid bacteria. Food Agric. Organ. UN World Heal. Organ. Expert Consult. Rep. [ Links ]
Ferreira, G.S., N.C. Bolívar, S.A. Pereira, C. Guertler, F. do N. Vieira, J.L.P. Mouriño and W.Q. Seiffert. 2015. Microbial biofloc as source of probiotic bacteria for the culture of Litopenaeus vannamei. Aquaculture, 448: 273-279. [ Links ]
Flores-Miranda, M.C., A. Luna-González, Á.I. Campa Córdova, J.A. Fierro-Coronado, B.O. Partida-Arangure, J. Pintado and H.A. González-Ocampo. 2012. Isolation and characterization of infectious Vibrio sinaloensis strainsfrom the Pacific shrimp Litopenaeus vannamei (Decapoda: Penaeidae). Rev. Biol. Trop., 60: 567-576. [ Links ]
Gatesoupe, F.J. 1991. The effect of three strains of lactic bacteria on the production rate of rotifers, Brachionus plicatilis, and their dietary value for larval turbot, Scophthalmus maximus. Aquaculture, 96: 335-342. [ Links ]
Gobi, N., B. Vaseeharan, J.C. Chen, R. Rekha, S. Vijayakumar, M. Anjugam and A. Iswarya. 2018. Dietary supplementation of probiotic Bacillus licheniformis Dahb1 improves growth performance, mucus and serum immune parameters, antioxidant enzyme activity as well as resistance against Aeromonas hydrophila in tilapia Oreochromis mossambicus. Fish Shellfish Immunol., 74: 501-508. https://doi.org/10.1016/j.fsi.2017.12.066. [ Links ]
Heisterkamp, I.M., A. Schramm, D. de Beer and P. Stief. 2016. Direct nitrous oxide emission from the aquacultured pacific white shrimp (Litopenaeus vannamei). In: Drake H.L. (Ed.). Appl. Environ. Microbiol., 82: 4028 LP-4034. [ Links ]
Hirata, H., O. Murata, S. Yamada, H. Ishitani and M. Wachi. 1998. Probiotic culture ofthe rotifer Brachionus plicatilis. Hydrobiologia, 387: 495-498. [ Links ]
Hoseinifar, S.H., M. Dadar and E. Ringe. 2017. Modulation of nutrient digestibility and digestive enzyme activities in aquatic animals: The functional feed additives scenario. Aquac. Res., 48: 3987-4000. [ Links ]
Jamali, H., A. Imani, D. Abdollahi, R. Roozbehfar and A. Isari. 2015. Use of probiotic Bacillus spp. in Rotifer (Brachionus plicatilis) and Artemia (Artemia urmiana) enrichment: effects on growth and survival of Pacific white shrimp, Litopenaeus vannamei, Larvae. Probiotics Antimicrob. Proteins., 7: 118-125. [ Links ]
Jeeja, P.K., Imelda-Joseph and R. Paul Raj. 2011. Nutritional composition of rotifer (Brachionusplicatilis Muller) cultured using selected natural diets. Indian J. Fish., 58: 59-65. http://he.scribd.com/doc/93625862/Jeeja-et-al-2011. [ Links ]
Kazuñ, B. and K. Kazuñ. 2014. Probiotics in aquaculture. Med. Veter., 70: 25-28. [ Links ]
Kesarcodi-Watson, A., H. Kaspar, M.J. Lategan and L. Gibson. 2008. Probiotics in aquaculture: The need, principles and mechanisms of action and screening processes. Aquaculture, 274: 1-14. [ Links ]
Khochamit, N., S. Siripornadulsil, P. Sukon and W. Siripornadulsil. 2015. Antibacterial activity and genotypic-phenotypic characteristics of bacteriocin-producing Bacillus subtilis KKU213: potential as a probiotic strain. Microbiol. Res., 170: 36-50. http://dx.doi.org/10.1016/j.micres.2014.09.004. [ Links ]
Kolanchina, P., P.R. Kumari, T.S. Gnanam, G. John and A. Balasundar. 2017. Performance evaluation of two probiotic species, on the growth, body composition and immune expression in Penaeus monodon. J. Fish. Aquat. Sci., 12: 157-167. http://www.scialert.net/abstract/?doi=jfas.2017.157.167. [ Links ]
Kostopoulou, V. and H. Centre. 2012. The rotifer Brachionus plicatilis: an emerging bio-tool for numerous applications. J. Biol. Res., 17: 97-112. [ Links ]
Kumar, V, S. Roy, D.K. Meena and U.K. Sarkar. 2016. Application of probiotics in shrimp aquaculture: importance, mechanisms of action, and methods of administration. Rev. Fish. Sci. Aquac., 24: 342-368. [ Links ]
Lallès, J.P. and J.P. Suescún. 2014. Intestinal alkaline phosphatase: an enzyme with anti-inflammatory properties. CES Med. Vet. Zootec., 9: 94-103. [ Links ]
Li, E., X. Wang, K. Chen, C. Xu, J.G. Qin and L. Chen. 2017. Physiological change and nutritional requirement of Pacific white shrimp Litopenaeus vannamei at low salinity. Rev. Aquac., 9: 57-75. [ Links ]
Liu, C.H., C.H. Chiu, S.W. Wang and W. Cheng. 2012. Dietary administration of the probiotic, Bacillus subtilis E20, enhances the growth, innate immune responses, and disease resistance of the grouper, Epinephelus coioides. Fish Shellfish Immunol., 33: 699-706. http://dx.doi.org/10.1016/j.fsi.2012.06.012. [ Links ]
Liu, W., X.M. Zhang and L.B. Wang. 2010. Digestive enzyme and alkaline phosphatase activities during the early stages of Silurus soldatovi development. Zool. Res., 31: 627-632. [ Links ]
Loka, J., S.M. Sonali, P. Saha, K. Devaraj and K.K. Philipose. 2016. Use of commercial probiotics for the improvement of water quality and rotifer density in outdoor mass culture tanks. Indian J. Fish., 63: 145-149. [ Links ]
López León, P., A. Luna González, R. Escamilla Montes, M.C. Flores-Miranda and J.A. Fierro Coronado. 2016. Isolation and characterization of infectious Vibrio parahaemolyticus, the causative agent of AHPND, from the whiteleg shrimp (Litopenaeus vannamei). Lat. Am. J. Aquat. Res., 44: 470-479. [ Links ]
Luis-Villaseñor, I.E., M.E. Macías-Rodríguez, B. Gómez-Gil, F. Ascencio-Valle and Á.I. Campa-Córdova. 2011. Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei. Aquaculture, 321: 136-144. [ Links ]
Makridis, P., A.J. Fjellheim, J. Skjermo and O. Vadstein. 2000. Control of the bacterial flora of Brachionus plicatilis and Artemia franciscana by incubation in bacterial suspensions. Aquaculture, 185: 207-218. [ Links ]
Membreño, L., S. Morales and E. Martínez. 2014. Crecimiento de camarones blancos. Rev. Cient. UNAN-León., 5: 103-115. [ Links ]
Murillo, I. and L.M. Villamil-Díaz. 2011. Bacillus cereus and Bacillus subtilis used as probiotics in rotifer (Brachionus plicatilis) cultures. J. Aquac. Res. Dev., 1: 1-5. https://www.omicsonline.org/bacillus-cereus-and-bacillus-subtilis-used-as-probiotics-in-rotifer-brachionus-plicatilis-cultures-2155-9546.S1007.php?aid=2309. [ Links ]
Najmi, N., M. Yahyavi and A. Haghshenas. 2018. Effect of enriched rotifer (Brachionusplicatilis) with probiotic lactobacilli on growth, survival and resistance indicators of western white shrimp (Litopenaeus vannamei) larvae. Iran. J. Fish. Sci., 17: 11-20. [ Links ]
Newaj-Fyzul, A., A.H. Al-Harbi and B. Austin. 2014. Review: Developments in the use of probiotics for disease control in aquaculture. Aquaculture, 431: 1-11. http://dx.doi.org/10.1016/j.aquaculture.2013.08.026. [ Links ]
Newaj-Fyzul, A . andB. Austin . 2015. Probiotics, immunostimulants, plant products and oral vaccines, and their role as feed supplements in the control of bacterial fish diseases. J. Fish Dis., 38: 937-955. [ Links ]
Nimrat, S., P. Tanutpongpalin, K. Sritunyalucksana, T. Boonthai and V. Vuthiphandchai. 2013. Enhancement of growth performance, digestive enzyme activities and disease resistance in black tiger shrimp (Penaeus monodon) postlarvae by potential probiotics. Aquac. Int., 21: 655-666. [ Links ]
Nimrat, S ., S. Suksawat, T. Boonthai and V. Vuthiphandchai . 2012. Potential Bacillus probiotics enhance bacterial numbers, water quality and growth during early development of white shrimp (Litopenaeus vannamei). Vet. Microbiol., 159: 443-450. http://dx.doi.org/10.1016/j.vetmic.2012.04.029. [ Links ]
Pacheco-Vega, J.M., M.A. Cadena-Roa, J.A. Leyva-Flores, O.I. Zavala-Leal, E. Pérez-Bravo and J.M.J. Ruiz-Velazco. 2018. Effect of isolated bacteria and microalgae on the biofloc characteristics in the Pacific white shrimp culture. Aquac. Reports., 11: 24-30. [ Links ]
Planas, M., J.A. Vázquez, J. Marqués, R. Pérez-Lomba, M.P. González and M. Murado. 2004. Enhancement of rotifer (Brachionus plicatilis) growth by using terrestrial lactic acid bacteria. Aquaculture, 240: 313-329. [ Links ]
Qi, Z., K. Dierckens, T. Defoirdt, P. Sorgeloos, N. Boon, Z. Bao and P. Bossier. 2009. Effects of feeding regime and probionts on the diverting microbial communities in rotifer Brachionus culture. Aquac. Int., 17: 303-315. [ Links ]
Raghu, P., M. Rajikkannu, R. Baburajan, A. Deva and R. Nandakumar. 2016. Effect of Bacillus coagulans and B. firmus incorporated probiotic diet on superoxide dismutase activity and catalase activity in Penaeus monodon. World Sci. News., 44: 224-235. [ Links ]
Ran, C., A. Carrias, M.A. Williams, N. Capps, B.C.T. Dan, J.C. Newton, J.W. Kloepper, E.L. Ooi, C.L Browdy, J.S. Terhune and M.R. Liles. 2012. Identification of Bacillus strains for biological control of catfish pathogens. PLoS One 7. [ Links ]
Reddy, S.J., D. Vineela and B.K. Kumar. 2018. Influence of probiotics on growth and development of aquaculture-a review. World J. Pharm. Res., 7: 291-315. [ Links ]
Ringo, E. and S.K. Song. 2016. Application of dietary supplements (synbiotics and probiotics in combination with plant products and p-glucans) in aquaculture. Aquac. Nutr., 22: 4-24. [ Links ]
Ringe, E., R.E. Olsen, T.M. Mayhew and R. Myklebust. 2003. Electron microscopy of the intestinal microflora of fish. Aquaculture, 227: 395-415. [ Links ]
Ringe, E ., R. Myklebust , T.M. Mayhew andR.E. Olsen . 2007. Bacterial translocation and pathogenesis in the digestive tract of larvae and fry. Aquaculture, 268: 251-264. [ Links ]
Rollo, A., R. Sulpizio, M. Nardi, S. Silvi, C. Orpianesi, M. Caggiano, A. Cresci and O. Carnevali. 2006. Live microbial feed supplement in aquaculture for improvement of stress tolerance. Fish Physiol. Biochem., 32: 167-177. [ Links ]
Rombaut, G., P. Dhert, J. Vandenberghe, L. Verschuere, P. Sorgeloos and W. Verstraete. 1999. Selection of bacteria enhancing the growth rate of axenically hatched rotifers (Brachionus plicatilis). Aquaculture, 176: 195-207. [ Links ]
Sadat Hoseini Madani, N., T.J. Adorian, H. Ghafari Farsani and S.H. Hoseinifar. 2018. The effects of dietary probiotic Bacilli (Bacillus subtilis and Bacillus licheniformis) on growth performance, feed efficiency, body composition and immune parameters of whiteleg shrimp (Litopenaeus vannamei) postlarvae. Aquac. Res., 49: 1926-1933. [ Links ]
Snell, T.W., C.J. Bieberich and R. Fuerst. 1983. The effects of green and blue-green algal diets on the reproductive rate of the rotifer Brachionus plicatilis. Aquaculture, 31: 21-30. [ Links ]
Tang, J., Y. Dai, Y. Li, J. Qin and Y. Wang. 2016. Can application of commercial microbial products improve fish growth and water quality in freshwater polyculture? N. Am. J. Aquac., 78: 154-160. [ Links ]
Valenzuela-González, F., R. Casillas-Hernández and E. Villalpando. 2015. The 16S rRNA gene in the study of marine microbial communities. Ciencias Marinas, 41(4): 297-313. [ Links ]
Vieira, F. do N., A. Jatobá, J.L.P. Mouriño, C.C.B. Neto, J.S. Da Silva, W.Q. Seiffert , M. Soares and L.A. Vinatea. 2016. Use of probiotic-supplemented diet on a Pacific white shrimp farm. Rev. Bras. Zootec., 45: 203-207. [ Links ]
Villamil Díaz, L.M., A. Figueras, M. Planas and B. Novoa. 2010. Pediococcus acidilactici in the culture of turbot (Psetta maxima) larvae: Administration pathways. Aquaculture, 307: 83-88. http://dx.doi.org/10.1016/j.aquaculture.2010.07.004. [ Links ]
Villamil Díaz, L.M . y D. Esguerra Rodríguez. 2017. Enterococcus, Myroides y Exiguobacterium: géneros bacterianos con potencial probiótico para el cultivo de tilapia nilótica (Oreochromis niloticus). Acta Biol. Col., 22: 331-339. [ Links ]
Wang, C., X. Song, X. Zhang, S. Zhang, X. Sun, B. Liu, W. Gao and J. Huang. 2016. Effects of adding Bacillus cereus PC465 to rearing water on disease resistance of Litopenaeus vannamei. J. Fish. Sci. China, 23: 146-155. [ Links ]
Wang, Y. 2007. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture, 269: 259-264. [ Links ]
Wang, Y., Y. Sun, X. Zhang , Z. Zhang, J. Song, M. Gui and P. Li. 2015. Bacteriocin-producing probiotics enhance the safety and functionality of sturgeon sausage. Food Control., 50: 729-735. http://dx.doi.org/10.1016/j.foodcont.2014.09.045. [ Links ]
Yi, Y., Z. Zhang , F. Zhao, H. Liu, L. Yu, J. Zha and G. Wang. 2018. Probiotic potential of Bacillus velezensis JW: Antimicrobial activity against fish pathogenic bacteria and immune enhancement effects on Carassius auratus. Fish Shellfish Immunol., 78: 322-330. https://doi.org/10.1016/j.fsi.2018.04.055. [ Links ]
Yoshimatsu, T. and M.A. Hossain. 2014. Recent advances in the high-density rotifer culture in Japan. Aquac. Int., 22:1587-1603. [ Links ]
Yuniarti, A., D.A. Guntoro and A.M. Hariati. 2013. Response of indigenous Bacillus megaterium supplementation on the growth of Litopenaeus vannamei (Boone), a new target species for shrimp culture in East Java of Indonesia. J. Basic. Appl. Sci. Res., 3: 747-754. [ Links ]
Zhou, X.X., Y.B Wang and W.F. Li. 2009. Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities. Aquaculture, 287: 349-353. [ Links ]
Zink, I.C., P.A. Douillet and D.D. Benetti. 2013. Improvement of rotifer Brachionus plicatilis population growth dynamics with inclusion of Bacillus spp. probiotics. Aquac. Res., 44: 200-211. [ Links ]
Zokaeifar, H., J.L. Balcázar, C.R. Saad, M.S. Kamarudin, K. Sijam, A. Arshad and N. Nejat. 2012. Effects of Bacillus subtilis on the growth performance, digestive enzymes, immune gene expression and disease resistance of white shrimp, Litopenaeus vannamei. Fish Shellfish Immunol., 33: 683-689. [ Links ]
Zokaeifar, H ., N. Babaei, C.R. Saad , M.S. Kamarudin , K. Sijam andJ.L. Balcázar . 2014. Administration of Bacillus subtilis strains in the rearing water enhances the water quality, growth performance, immune response, and resistance against Vibrio harveyi infection in juvenile white shrimp, Litopenaeus vannamei. Fish Shellfish Immunol., 36: 68-74. [ Links ]
Zorriehzahra, M.J., S.T. Delshad, M. Adel, R. Tiwari, K. Karthik, K. Dhama and C.C. Lazado. 2016. Probiotics as beneficial microbes in aquaculture: an update on their multiple modes of action: A review. Vet. Q., 36: 228-241. [ Links ]
Recibido: 22 de Febrero de 2019; Aprobado: 21 de Febrero de 2020











 texto en
texto en