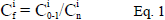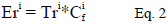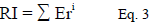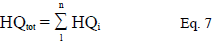Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta ene./jun. 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.775
Artículos de Investigación
Estimación del riesgo ecológico y a la salud humana del mercurio en una zona de manglar del estuario La Puntilla, provincia de El Oro, sur del Ecuador
1 Universidad Técnica de Machala, Unidad de Ciencias Agropecuarias, Ecuador.
2 Canadian International Resource and Development Institute, The University of British Columbia, Vancouver, Canadá.
3 Escuela Superior Politécnica de Chimborazo, Grupo de investigación Ciencias de Datos, Facultad de Ciencias, Riobamba, Ecuador.
4 Universidad Nacional de Chimborazo, Facultad de Ingeniería, Riobamba, Ecuador.
El presente estudio se centra en la evaluación de los niveles de concentración de mercurio total y la estimación del riesgo ecológico (Er), el índice de riesgo ecológico (RI) y el coeficiente de riesgo tóxico o peligro (HQ) para la salud humana en un área de manglar junto a las desembocaduras de los ríos Chaguana y Siete, en el estuario de La Puntilla en el sur de Ecuador. Para la determinación de Er, RI y HQ, identificamos tres indicadores de contaminación por mercurio: sedimentos, raíz de mangle y tejido blando del bivalvo Anadara tuberculosa. En el área de manglar que bordea la desembocadura del río Chaguana, las concentraciones de mercurio fluctuaron entre 0,11±0,06 mg/kg en sedimentos, 0,06±0,01mg/kg en raíz de mangle, con una consistente presencia de A. tuberculosa, pero solo una muestra del bivalvo registró un nivel de 0,034 mg/kg de mercurio. En contraste, en el área de manglar adyacente a la desembocadura del río Siete, las concentraciones de mercurio oscilaron entre 0,77±0,42 mg/kg en sedimentos y 0,15±0,12 mg/kg en la raíz de manglar, siendo imperceptible la presencia de A. tuberculosa. Los resultados del análisis de riesgo indicaron que en la desembocadura del río Chaguana, el Er y el índice de RI se colocaron en la categoría "baja". En contraste, en la desembocadura del río Siete, el Er resultó "alto" y RI resultó "moderado". El riesgo potencial para la salud humana fue bajo, en consistencia con el valor de HQ < 1 que considera el consumo de A. tuberculosa y el contacto dérmico a través de sedimentos; sin embargo, la escasa presencia del bivalvo en la desembocadura del río Siete es de preocupación.
PALABRAS CLAVE: índice de riesgo ecológico; mercurio; Anadara tuberculosa; ecosistema de manglar
Present study focused on the evaluation of total mercury concentration and the estimation of ecological risk (Er), the ecological risk index (IR); and the toxic risk or hazard quotient (HQ) for human health in a mangrove area that borders the mouths of the Chaguana and Siete rivers, in La Puntilla estuary in the south of Ecuador. For the determination of the Er, RI, and HQ, we identified three indicators of mercury contamination: sediments, mangrove root, and soft tissue of the bivalve mollusk Anadara tuberculosa. In the mangrove area that borders the mouth of the Chaguana river, the mercury concentration fluctuated between 0,11-0,06 mg/kg in sediments, 0.06-0,01mg/kg in mangrove root, with a more consistence presence of A. tuberculosa, but one bivalve sample reported a level of 0,034 mg/kg of mercury. In contrast to the mangrove area adjacent to the mouth of the Siete river, whose concentrations ranged from 0,77-0,42 in sediments, and 0,15-0,12 in mangrove root, we found the highest mercury contamination, being imperceptible to the presence of A. tuberculosa. Results of the risk analysis indicated that, at the mouth of the Chaguana river, the Er and the RI index were placed in the "low" category. In contrast, at the mouth of the Siete river, the Er was "high," and RI was "moderate." Potential risk to human health was low, consistent with the value of HQ < 1 that considers the consumption of A. tuberculosa and dermal contact through sediments; however, the low presence of the bivalve at the mouth of the Siete river is of concern.
KEYWORDS: ecological risk index; mercury; Anadara tuberculosa; mangrove ecosystem
INTRODUCCIÓN
Los procesos de contaminación generados por las actividades naturales y antrópicas en las cercanías de los cuerpos de agua son un problema cada vez más común que enfrentan los ecosistemas acuáticos. En regiones tropicales, la contaminación por metales pesados puede llegar a zonas de manglar, hábitat de especies marinas importantes para el sustento de comunidades costeras (Silva et al., 2003). Aproximadamente desde hace unos 25 años, mineros de la región sur del Ecuador utilizan mercurio para la recuperación del oro, considerándose una de las principales causas de contaminación en ríos y quebradas y superando en algunos casos los niveles permisibles establecidos según las normativas internacionales para agua de río y sedimentos (Velásquez-López et al., 2011). Se estima que en el 2010 la actividad minera de oro a nivel artesanal y en pequeña escala fue responsable del 29 % de mercurio liberado a la atmósfera en América Latina y el Caribe (Santana et al., 2014). El desecho resultante de las actividades extractivas y de procesamiento mineral finalmente alcanza el cauce de ríos causando la acumulación de sedimentos enriquecidos con mercurio (Appleton et al., 2001; Carling et al., 2013). Por ejemplo, el mercurio desechado en las actividades mineras ha sido encontrado 250 km aguas abajo en el río Puyango al sur del Ecuador (Schudel et al., 2019). Una vez que el mercurio alcanza los ecosistemas acuáticos, puede precipitarse en el fondo (Marchand et al., 2006; Bazzi, 2014), permaneciendo allí durante largos períodos o bien, puede ser bioacumulado y biomagnificado en la cadena alimenticia (Morel et al., 1998; Chen et al., 2009; Le et al., 2017). Dentro de la cadena trófica, los moluscos bivalvos por su capacidad de filtración son reconocidos como organismos centinelas para biomonitoreo de mercurio en sistemas acuáticos (Maanan, 2008). En términos de riesgo a la salud humana, el consumo de moluscos bivalvos puede ser la principal vía de exposición al mercurio (World Health Organization, 1996); sin embargo, otra forma de exposición es el contacto dérmico a través de sedimentos contaminados (U.S. Environmental Protection Agency, 2001). Aceptando el peligro que representa la contaminación por mercurio, muchos de los países de la región han tomado medidas emergentes. Consecuentemente, en octubre del 2013, Ecuador suscribió su adhesión al Convenio de Minamata. Desde ese entonces, se ejecutan acciones para identificar puntos críticos de contaminación e incrementar las capacidades técnicas de monitoreo de mercurio en diferentes matrices ambientales para una aplicación eficaz de los compromisos adquiridos dentro del acuerdo internacional.
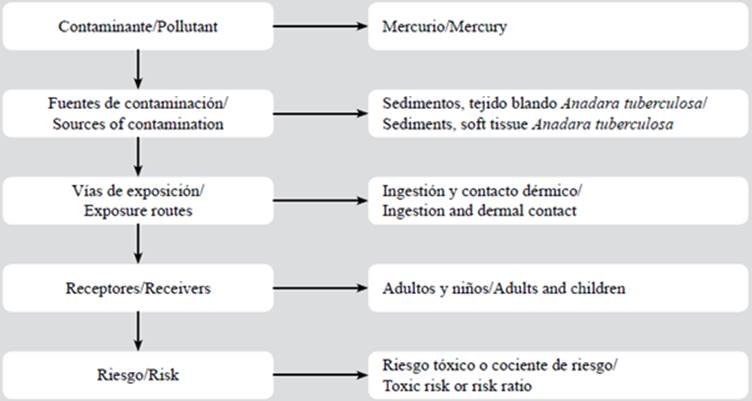
En el sur del Ecuador, a 25 km de distancia de la zona costera, por alrededor de 25 años, mineros artesanales y pequeños mineros utilizan mercurio para la extracción de oro. Estudios previos sugieren que el mercurio puede alcanzar zonas de manglar, pero la información acerca de los niveles de concentración y posibles riesgos en estas áreas marítimas es limitada. Los manglares representan nichos ecológicos que albergan diversas especies de aves, peces y reptiles (Medina et al., 2007; Cardoso et al., 2009). A pesar de la importancia ecológica social y económica del ecosistema de manglar en el sur del Ecuador y la evidente contaminación por metales pesados en su proximidad, los riesgos asociados a la presencia de metales en estos ambientes frágiles han sido escasamente estudiados. En países en vías de desarrollo como Ecuador, los manglares benefician la práctica de la pesca artesanal y actividades de recreación, y debido a la potencial contaminación, existe interés en entender el estado ambiental de estas regiones para la formulación de medidas de protección y manejo. El objetivo del presente estudio fue determinar la concentración de mercurio en sedimentos, raíz de mangle y en el molusco bivalvo Anadara tuberculosa en dos sitios del estuario La Puntilla y estimar el Índice de Riesgo Ecológico (RI) y el Riesgo Tóxico o Hazard Quotient (HQ) para la salud humana. El escenario de investigación consideró el muestreo in situ en zonas de manglar del estuario colindantes a las desembocaduras de los ríos Chaguana y Siete para un análisis comparativo del 1) Índice de Riesgo Ecológico (RI), y 2) Riesgo Tóxico o Hazard Quotient (HQ) para la salud humana.
El análisis de riesgo sanitario ambiental se define como la cuantificación del daño toxicológico producido por efectos de un contaminante, que llega a un potencial receptor a través de diversas vías de migración y exposición (US. Environmental Protection Agency, 1989). Por otro lado, la estimación de riesgo ecológico es una herramienta utilizada para realizar diagnóstico cuantitativo de sensibilidad ambiental basado en el análisis de concentraciones de contaminantes (mercurio) en el sitio de estudio y su afectación al medio en que está presente (Hakanson, 1980). Aunque el presente estudio solo ofrece información esencial acerca de la contaminación y riesgos asociados al mercurio en una zona de manglar, es un significativo aporte al conocimiento sobre lo que, con seguridad, es un área de enorme interés académico respecto a la contaminación por metales pesados en zonas de manglar. El estudio beneficia a organismos internacionales y organizaciones que trabajan en la preservación ecológica, y ofrece información a aquellos que están encargados de formular medidas de protección y manejo de los recursos costeros.
METODOLOGÍA
El presente estudio se realizó en el bioma de manglar situado en las desembocaduras de los ríos Chaguana y Siete, en el estuario La Puntilla, provincia de El Oro, Ecuador. El área de estudio colinda con la provincia de Guayas hacia el norte y con la provincia de Azuay hacia el noroeste. El estuario de La Puntilla nace en la falda occidental de la Cordillera de Los Andes en los cantones Ponce-Enríquez (provincia del Azuay) y El Guabo, (provincia de El Oro), teniendo como principales afluentes a los ríos Chaguana y Siete. El flujo de agua en ambos ríos varía considerablemente. El río Siete tiene un promedio de 0,2-0,3 m3/s mientras que, en épocas de alta intensidad lluviosa, el caudal se incrementa a 2,5-7 m3/s (Secretaria Nacional de Planificación y Desarrollo, 2009). El río Chaguana está conectado con los ríos Pagua y Bonito, que corrientemente le aportan un caudal de alrededor de 4 m3/s, constituyendo un cuerpo de agua significativamente más grande que el río Siete.
En los meses de febrero y agosto del año 2018 se realizaron cuatro campañas de muestreo en el ecosistema de manglar del Estuario la Puntilla junto a las desembocaduras de los ríos Chaguana y Siete (Figura 1). Se localizaron dos sitios de muestreo, uno junto a la desembocadura del río Chaguana, y otro junto a la desembocadura del río Siete. El estuario presenta dos pleamares y dos bajamares cada día. Los muestreos se realizaron en bajamar, cuando es posible acceder al terreno de manglar, ya que no está inundado por agua. Las muestras fueron tomadas en el fango del bioma de manglar donde habitan bivalvos y crustáceos. Para el muestreo se consideró indispensable el conocimiento de los pescadores artesanales, con quienes se planificó el acceso según el estado intermareal y acorde al desplazamiento de un conchero por jornada diaria (entre 4-6 horas). Con el acompañamiento de los pescadores artesanales se tomaron muestras de sedimentos, Anadara tuberculosa y raíz de mangle de la especie Rhizophora mangle sp. en cada sitio. Las muestras fueron tomadas de manera separada para evitar riesgos de contaminación cruzada. En cada estación se tomaron muestras simples de sedimentos y de raíz de mangle, acumuladas en recipientes separados e íntegramente limpios. Para el caso de A. tuberculosa, los organismos fueron colocados en canastillas luego de una limpieza superficial para desechar la presencia de sedimento y lodo en las valvas externas. En cada jornada de muestreo, los materiales y utensilios se lavaron y enjuagaron con ácido nítrico al 5 %.
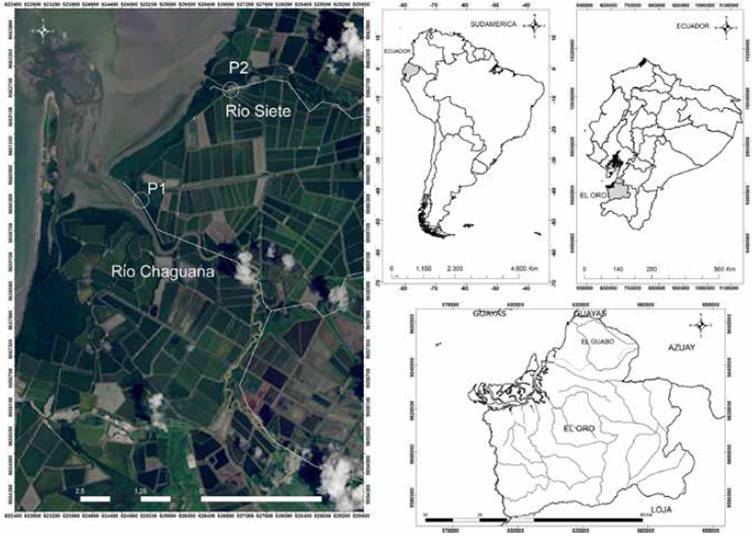
Figura 1 Zona de estudio: Estuario La Puntilla, perteneciente a Bajo Alto, cantón El Guabo, provincia de El Oro, Ecuador.
Muestreo de sedimentos
En cada punto, siguiendo la secuencia del pescador artesanal y usando un tubo PVC de 6 pulgadas de diámetro, se tomaron al azar aproximadamente 3000 g de sedimento en varios puntos a una profundidad de alrededor 20 cm. De las muestras simples de sedimentos se constituyó una muestra compuesta de alrededor de 500 g, la cual fue empaquetada en fundas plásticas con cierre hermético y almacenada en un recipiente especialmente preparado para los sedimentos. Posteriormente, las muestras fueron sometidas a secado, molienda y tamizado (75 μm, 150 μm, 300 μm y 850 μm) y empaquetadas herméticamente para su posterior transporte al laboratorio analítico.
Muestreo de raíz de Rhizophora sp.
En los dos sitios de muestreo previamente descritos y siguiendo la trayectoria del pescador artesanal, se obtuvieron muestras de la raíz de manglar, las cuales fueron tomadas cortando la parte final y blanda de la raíz suspendida. Por lo general, la raíz de mangle contiene partículas en suspensión y microorganismos. Las muestras con todo su contenido fueron almacenadas. Una muestra consistió en varios fragmentos de raíz de mangle para completar aproximadamente 250 g. La muestra fue colocada en fundas plásticas con cierre hermético y dispuesta en un recipiente en frío.
Muestreo de Anadara tuberculosa
La captura de bivalvos se realizó con especial atención a la obtención de la concha negra A. tuberculosa, la cual se realizó con ayuda del pescador quien fue el único que extrajo el bivalvo del fango del hábitat de manglar a una profundidad alrededor de 20 cm. Las conchas fueron recibidas por otra persona con manos limpias que se dedicó al manejo de estas, esto es, al enjuague en agua de mar para eliminar el exceso de sedimentos, empaquetado y almacenamiento en el recipiente colector. En laboratorio y bajo íntegras condiciones de asepsia, se realizó la disección del organismo bivalvo para extraer el tejido blando asegurando un peso de alrededor de 100 g acorde a lo requerido por el laboratorio analítico. Del número de individuos capturados en las cuatro campañas de muestreo, se obtuvieron 22 muestras que fueron analizadas. Cada muestra consistió en alrededor de 20 a 30 ejemplares de A. tuberculosa. Se registró tamaño y peso de los individuos capturados medidos por medio de un escalímetro y una balanza digital con sensibilidad a 0,1 g, respectivamente. El almacenamiento de muestras de sedimentos, raíz de mangle y A. tuberculosa fue realizado por separado con recipientes térmicos para preservación a bajas temperaturas y teniendo presente criterios de conservación y transporte de muestras (Instituto de Investigaciones Marinas y Costeras, 2013).
Análisis de mercurio
Las concentraciones de mercurio total en las muestras de sedimento, raíz de manglar y del bivalvo A. tuberculosa fueron analizadas en el laboratorio de la Subsecretaría de Calidad e Inocuidad del Ministerio de Acuacultura y Pesca del Ecuador, con acreditación para la determinación de mercurio. El método analítico consistió en la técnica de vapor frío con el uso de un espectrofotómetro de absorción atómica (método de referencia P1-MP1 VARIAN AA 60), de acuerdo con procedimientos intrínsecos para el análisis en el laboratorio. El límite de detección reportado por el laboratorio fue de 0,09 mg/kg de Hg y los valores reportados corresponden al peso seco de las muestras. Los resultados de la concentración de mercurio fueron analizados mediante análisis de varianza de una vía (ANOVA) para determinar si existe diferencia significativa entre los promedios determinados para cada componente en los dos puntos del estero La Puntilla.
Cálculo del riesgo ecológico
Para el cálculo del riesgo ecológico, se utilizó el método descrito por Hakanson (1980), que tiene como propósito identificar la concentración de metales pesados en la muestra para evaluar el factor de contaminación
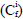 , el potencial de riesgo ecológico (Eri) y el índice de potencial riesgo ecológico (RI). El factor de contaminación identifica qué tan contaminante puede llegar a ser el mercurio y se calculó de la siguiente manera:
, el potencial de riesgo ecológico (Eri) y el índice de potencial riesgo ecológico (RI). El factor de contaminación identifica qué tan contaminante puede llegar a ser el mercurio y se calculó de la siguiente manera:
Donde,
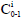 es la concentración de mercurio en la muestra
es la concentración de mercurio en la muestra
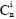 corresponde a los valores de referencia de mercurio cuyo valor propuesto por Hakanson es de 0,25
corresponde a los valores de referencia de mercurio cuyo valor propuesto por Hakanson es de 0,25
El factor potencial de riesgo ecológico ayuda a conocer el riesgo ambiental (Er) que puede tener el mercurio con base en la relación del factor de contaminación y los valores de respuesta tóxica, y se interpretan de la siguiente manera:
Donde,
Tri corresponde al factor de respuesta tóxica de la sustancia, con un valor de 40 para el mercurio.
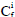 representa al factor de contaminación.
representa al factor de contaminación.
El índice de riesgo ecológico (RI) integra los factores de potencial de riesgo ecológico del mercurio y permite establecer si las concentraciones en la muestra de estudio tienen riesgo ambiental. La categoría del RI varía desde bajo a alto y se calculó con la siguiente ecuación:
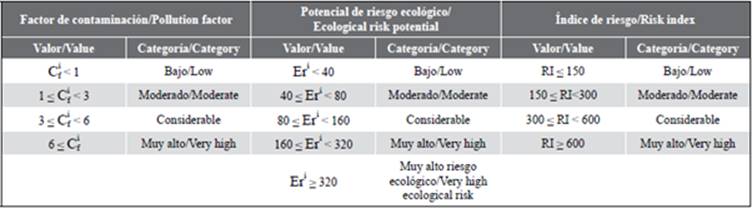
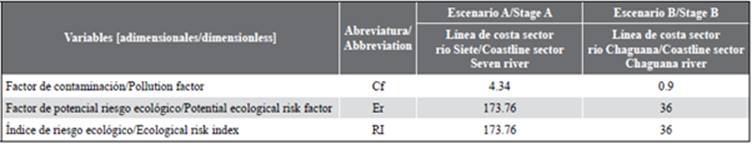
La interpretación del factor de contaminación potencial de riesgo ecológico e índice de riesgo ecológico se resume en la Tabla 1, donde se presentan los valores y sus respectivas categorías.
Análisis de riesgo sanitario ambiental
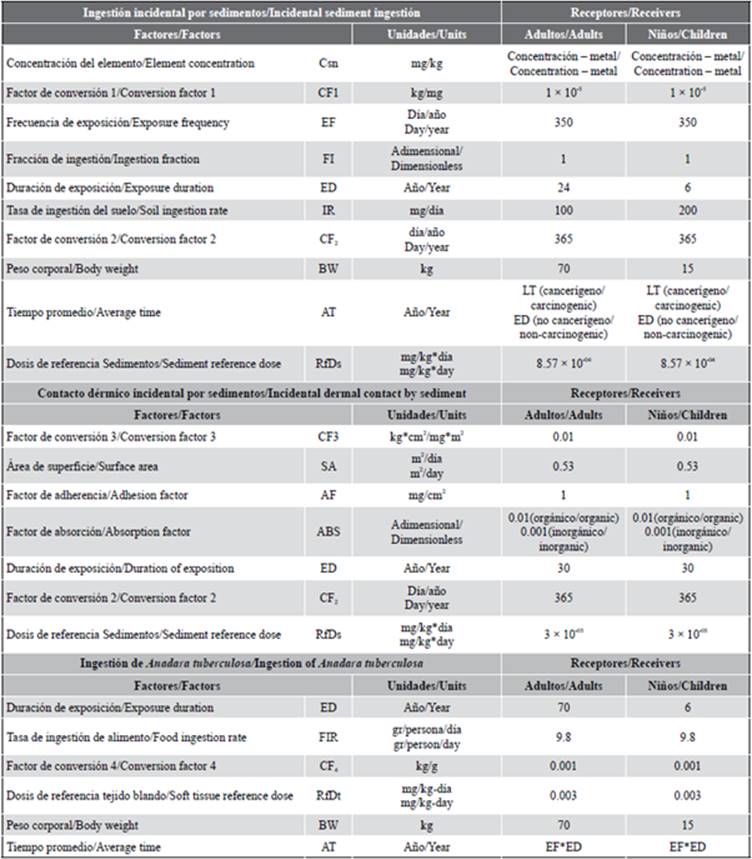
El cálculo del riesgo sanitario ambiental se realizó tomando en cuenta vías activas de exposición: ingestión (Ec. 4) y contacto dérmico (Ec. 5). Se considera que el sitio de estudio representa un hábitat donde se asientan pequeños grupos familiares que aprovechan el manglar para la pesca artesanal y, por tanto, subsisten de este recurso. Por otro lado, se calculó el riesgo producido por la ingesta de mercurio a través del consumo de conchas del género A. tuberculosa (Ec. 6), considerando que este bivalvo es distribuido y consumido en diversas partes de la región. La Tabla 2 muestra la descripción de las variables, los valores y las unidades utilizadas.
El HQ es un índice de peligro que identifica cuantitativamente si la exposición al mercurio supera la dosis tolerable o de referencia La RfD estima la exposición media diaria que no produce efectos adversos apreciables en el organismo humano durante el trascurso de su vida. El coeficiente de peligro total se considera como la suma de los coeficientes individuales. Para la determinación del HQ total se realizó la siguiente sumatoria donde se considera a vía de exposición i-ésima.
Los estándares para la protección humana definidos por diversos organismos internacionales preveen los siguientes criterios de aceptabilidad: para el riesgo no cancerígeno (exposición a una o más sustancias) HQ, HQ < 1.0 (Environmental Protection Agency, 1997).
RESULTADOS
Concentración de mercurio en sedimentos, raíz de mangle y bivalvo Anadara tuberculosa
En la Figura 2 se muestran los resultados de los niveles de concentración de mercurio (Hg) en sedimentos, tejido blando de Anadara tuberculosa y raíz de mangle detectados en el estuario La Puntilla a lo largo del lecho de manglar que colinda con las desembocaduras de los ríos Siete y Chaguana.
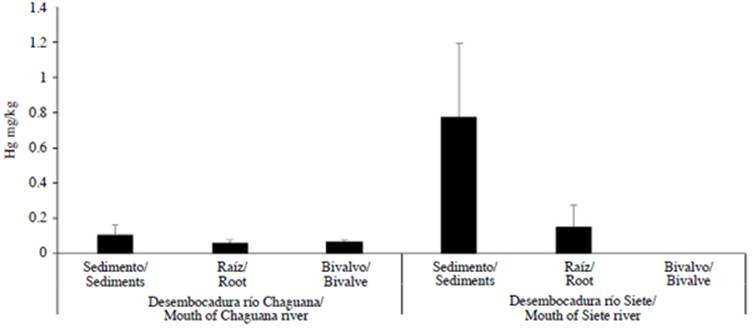
Figura 2 Concentración de mercurio en sedimentos, Anadara tuberculosa, y raíz de mangle. El eje vertical muestra los niveles de mercurio respecto a sedimento, raíz de mangle y el bivalvo A. tuberculosa, y el eje horizontal expone los componentes analizados en la zona de manglar colindante con las desembocaduras de los ríos Chaguana y Siete, en el estuario La Puntilla, provincia de El Oro, sur del Ecuador.
En el sector de manglar colindante con la desembocadura del río Chaguana se tomaron 29 muestras de sedimentos con niveles de concentración de mercurio de 0,12±0,06 mg/kg. El valor determinado representa cinco muestras (18,5 %) del total de las muestras obtenidas, de tal forma que 24 muestras (81,5 %) registraron concentraciones bajo el límite de detección. Esto supone que la presencia de mercurio es inconstante en el área de manglar próxima a la desembocadura del río Chaguana. Por otra parte, al dirigirse hacia el sector de manglar que colinda con el río Siete, el ingreso al sitio fue difícil en bajamar por la excesiva sedimentación que existe en el lecho del estuario, formando una barrera que impide el acceso hacia el río. En el fango del lecho de manglar contiguo a la desembocadura del río Siete se tomaron cinco muestras de sedimento, con lo cual se identificó en todas las muestras presencia de mercurio cuyas concentraciones fluctuaron alrededor de 0,77±0,42 mg/kg. El análisis de varianza muestra que la concentración de mercurio en sedimentos de la zona de manglar colindante al río Siete fue significativamente diferente a la concentración registrada para la zona de manglar colindante al río Chaguana (p > 0,05). Adicionalmente, a diferencia de lo observado en la desembocadura del río Chaguana, en los sedimentos del área de manglar contigua al río Siete se determinó una distribución homogénea al registrarse la concentración más alta con 1,09 mg/kg de mercurio.
En lo que respecta a la concentración de mercurio en raíz de mangle en el río Chaguana, de un total de 23 muestras, cinco muestras (21 %) registraron una concentración de mercurio de 0,06±0,01 mg/kg. En comparación, 18 muestras (79 %) registraron concentraciones bajo límite de detección. En contraste, en el río Siete, cinco muestras de raíz de mangle obtenidas reportaron una concentración de 0,151±0,121 mg/kg. El análisis de varianza muestra que la concentración de mercurio en raíz de mangle en el área colindante a la desembocadura del río Chaguana no fue significativamente diferente a la concentración registrada cerca al río Siete (p>0,05).
En relación con A. tuberculosa, 60 % de los individuos capturados tuvo un tamaño entre 3-4 cm, 31 % entre 4-5 cm y 9 % entre 5-5,5 cm. Análogamente, los pesos con valvas de los individuos registrados fueron de 15,5 g, 44,2 g y 78,7 g respectivamente según su tamaño. El peso del tejido muscular representó aproximadamente un 30 % de su peso total, es decir, que varió entre 4,46-23,60 gramos de peso húmedo por individuo. La composición de una muestra se consiguió juntando entre 20 y 30 ejemplares según el tamaño de los individuos. En el lecho de manglar hacia la desembocadura del río Chaguana se recolectaron 450 individuos con lo cual se completó un total de 15 muestras. De ellas, 14 registraron concentraciones por debajo del límite de detección y solo una reportó presencia de mercurio con una concentración de 0,034 mg/kg. En contraste, en el lecho de manglar hacia la desembocadura del río Siete la escasa presencia del bivalvo A. tuberculosa imposibilitó completar una muestra del peso requerido para el análisis, coincidiendo con la presencia de algunos ejemplares muertos en el hábitat.
Análisis de riesgo ecológico y riesgo sanitario ambiental
La Tabla 3 muestra los valores de los índices de riesgo ecológico para los escenarios A y B. En el sector hacia el río Siete, se estimó que el Cf está en la categoría "considerable", el Er es considerado "alto" mientras que el RI está en un nivel "moderado". En contraste, hacía la zona del estuario que conecta la desembocadura del río Chaguana, los factores Cf, Er y el índice RI se situaron en la categoría "bajo".
El presente estudio define un modelo que considera los sedimentos como vía de exposición por contacto dérmico, y el tejido blando de A. tuberculosa como vía de exposición por ingestión. El contacto dérmico está asociado a la manipulación de sedimento y del bivalvo contaminado por mercurio. Esto sucede por absorción percutánea del elemento que puede ingresar al cuerpo humano al estar en contacto con elementos posiblemente contaminados. Los receptores considerados corresponden a adultos y niños que habitan en el sector o realizan faneas de pesca en los bosques del manglar (Figura 3).
El análisis de riesgo sanitario ambiental fue realizado designando valores a los parámetros mostrados en las ecuaciones 4-7 considerando los factores y valores mostrados en la Tabla 4. Los datos de concentración de mercurio en sedimentos para el río Chaguana y el río Siete correspondieron a 0,225 mg/kg y 1,086 mg/kg, respectivamente, estimados a través del criterio UCL de la EPA (U.S. Environmental Protection Agency, 2002). Los valores de cálculo del riesgo en el escenario A, correspondiente al hábitat de manglar colindante a la desembocadura del río Siete para adultos y niños, fueron 2,00 x 10-02 y 1,74 x 10-01, respectivamente; en cambio, para el escenario B, correspondiente al hábitat de manglar colindante al río Chaguana, los valores para adultos y niños son 1,83 x 10-02 y 1,02 x 10-01, respectivamente.
Tabla 4 Valores obtenidos del cálculo del Hazard Quotient para adultos y niños para los escenarios 1 y 2.
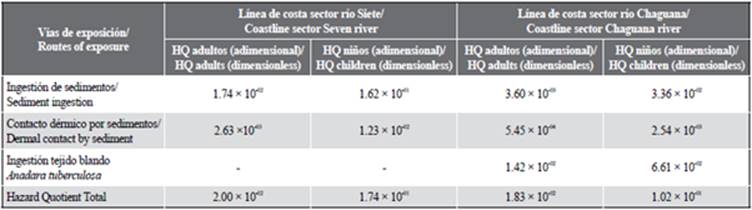
A partir de los resultados obtenidos sobre la estimación del riesgo total para adultos y niños, se observa que los límites de tolerancia del HQ = 1 no son superados en ninguno de los dos sitios. Sin embargo, los valores registrados en el río Chaguana son significativamente menores a los determinados en los sitios cercanos al río Siete.
DISCUSIÓN
El presente trabajo analizó las concentraciones de mercurio en tres componentes del hábitat de manglar en el estuario de La Puntilla, al sur del Ecuador. Se estimó el riesgo ecológico y sanitario-ambiental del mercurio en dos sitios. Es importante resaltar que las muestras fueron tomadas en el hábitat del manglar y no precisamente en el lecho del estuario. Por tanto, las muestras de sedimentos representan al fango que caracteriza el bioma de manglar colindante a las desembocaduras de los ríos Chaguana y Siete.
De acuerdo con los resultados obtenidos se observa que los mecanismos de transporte y difusión de mercurio hacia el estuario La Puntilla se realizan por drenaje fluvial desde la parte alta donde se descargan desechos y relaves de minería que alcanzan la zona costera. Estudios previos sobre la concentración de mercurio en sedimentos del lecho del río Siete reportaron concentraciones de mercurio de 2,0 mg/kg (Tarras-Wahlberg et al., 2000), 13 mg/kg (Appleton et al., 2001) y 1,4 mg/kg (Carling et al., 2013). En el estuario del río Tumbes, Schudel et al. (2018) determinaron niveles de 0,13 mg/kg de mercurio en sedimentos y mediante análisis isotópico confirmaron que el elemento está asociado a descargas de material de desecho de actividades mineras agua arriba del río Puyango-Tumbes. Alta variabilidad en las concentraciones de mercurio se observó en los tres componentes del río Chaguana con el 80 % de muestras bajo limite detección. Esto puede deberse a múltiples factores tales como la mezcla y dilución de agua en el estuario, así como también a la dinámica intermareal que caracteriza la zona costera (Tam y Wong, 1995). Aproximadamente a 20 km del área de estudio, se han reportado concentraciones de 3,97 ± 0,73 mg/kg de mercurio en sedimentos (Marin et al., 2016). Lacerda et al. (1993), al investigar manglares en una zona litoral de Brasil, evidenció mayor concentración de metales en sedimentos del lecho del estuario que en el manglar. Similarmente, Silva et al. (2003) determinó concentraciones de mercurio entre 0,022-0,060 mg/kg y corroboró que este elemento se acumula mayormente en los sedimentos del lecho del estuario en comparación con los depósitos del bosque de manglar. Cuando el mercurio entra en ambientes acuáticos, se precipita debido a su alta densidad y se incorpora en el fondo, que actúa como sumidero donde se adhiere a las partículas más finas (Andren y Harriss, 1975; Vane et al., 2009). En virtud de lo examinado, se requieren estudios más puntuales para comprender los mecanismos que gobiernan la movilidad del mercurio en el bioma de manglar del río Siete y sus alrededores.
Las concentraciones de mercurio encontradas en el fango del manglar muestran superioridad con relación a los limites estándares de Canadá para la protección de la vida acuática que está en 0,49 mg/kg. Adicionalmente, las concentraciones de mercurio detectadas en el presente estudio superan los niveles de remediación (Soil Cleanup Target Levels) establecidos por el Departamento de Ambiente y Toxicología de la Universidad de Florida (Center for Environmental & Human Toxicology, 2005). Estos criterios están basados en la lixiviación de contaminantes sobre agua superficial marina (Leachability Based on Marine Surface Water Criteria) que establece un límite de 0,03 mg/kg. La legislación ecuatoriana no establece criterios de remediación de sedimentos para ambientes de manglar. El hábitat de manglar caracteriza aproximadamente el 75 % de la línea costera del Ecuador, y representa una importante ecorregión para el crecimiento y la reproducción de algunas especies marinas de peces, moluscos y crustáceos. En el presente estudio, la muestra de raíz de mangle contenía material particulado, microalgas e invertebrados, lo cual supone una posible contaminación de peces marinos que en marea alta o pleamar se acercan al manglar para alimentarse. En el río Chaguana, la concentración de mercurio en sedimentos fue aproximadamente dos veces superior a la concentración de mercurio en raíz de mangle. En el río Siete, la diferencia fue ocho veces superior. Esto sugiere mayor absorción de mercurio en sedimentos y una distribución menor de mercurio en el sistema radicular de los manglares en relación con los sedimentos (Silva et al., 2003; Alongi, 2005). Aunque, la investigación sobre mercurio en la raíz de mangle es limitada, Huang et al. (2020) discute procesos de absorción de mercurio en raíz de mangle e indica que los mecanismos de transporte pueden estar sujetos a las variaciones intermareales. El mercurio adherido a las raíces aéreas del manglar puede sufrir un proceso de volatilización por efecto de la radiación solar en el momento de exposición a la atmósfera en marea baja (Huang et al., 2020).
En relación con la contaminación por mercurio en bivalvos, se conoce que en un mismo lugar la concentración difiere entre diferentes especies e individuos (Elder y Collins, 1991), pudiendo la edad de los organismos influir en la acumulación de mercurio (Otchere et al., 2003). Estudios en manglares de la India determinaron baja correlación entre la concentración de mercurio en sedimentos y el determinado en el gasterópodo Pirinella cingulata. La investigación sobre el mercurio en bivalvos en los últimos 50 años ha sido revisada por Otchere (2019), quien reporta una extensa lista de moluscos bivalvos de varias localidades y diversos ambientes cuyas concentraciones promedio fluctúan alrededor de 0,92±1,67 mg/kg, con un valor mínimo de 0,03 mg/kg y máximo de 7,5 mg/kg. Los valores registrados en el presente estudio en las muestras de la concha negra A. tuberculosa obtenidas en el manglar contiguo al río Chaguana están cerca de valores mínimos reportados en otros estudios. Estos niveles no se consideran altos en referencia a los límites permisibles de la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS), que presentan un valor de referencia de 0,5 mg/kg (World Health Organization, 2008). Es importante considerar que una muestra estuvo compuesta por 20 a 30 individuos, lo que supone variabilidad en la concentración de mercurio entre los especímenes que forman una muestra correspondiente a una misma especie en una misma localidad. Consecuentemente, un solo ejemplar podría reportar concentraciones entre 0,68 a 1,02 mg/kg, conforme al rango manifestado por Otchere (2019).
Se ha reportado que el mercurio puede ocasionar alteración en células sanguíneas de moluscos bivalvos pudiendo a ciertas concentraciones tener efecto letal en organismos acuáticos (Jakimska et al., 2011; Denil et al., 2017). Otros investigadores deducen la presencia de mecanismos de defensa frente a los metales a través de vesículas que facilitan la excreción celular (Dallinger, 1993; Claisse et al., 2001), o mediante una protección a través de sus valvas como biopelículas de protección (Scardino et al., 2013). En ese mismo orden, otros estudios afirman que la concha externa tiene mayor capacidad de absorber el metal del agua o sedimento alcanzando concentraciones incluso más altas que las de los tejidos internos (Zuykov et al., 2011, 2012). Adicionalmente, factores biológicos tales como especie, edad, tamaño, sexo, genotipo, fenotipo, actividad de alimentación y estado reproductivo influyen en la acumulación de metales y su toxicidad (Riget et al., 1996; Kehrig et al., 2006; Sevillano-Morales et al., 2015), aspectos que requieren más atención en la zona de estudio.
El estuario La Puntilla es una zona dinámica influenciada por mareas que provienen del océano y por el drenaje de agua dulce de los ríos. En el sur del Ecuador, la dinámica del estuario está asociada con una intensa acuacultura costera. En el río Siete se observó un cuerpo fluvial de escaso caudal; por tanto, se presume un efecto más severo en la configuración del cauce (Figura 3a). En contraste, en el río Chaguana (Figura 3b) se observó un cuerpo de agua más saludable, donde se observa la vida acuática y silvestre de algunas especies incluyendo aves, bivalvos y crustáceos. La percepción de los pescadores artesanales ante la situación observada en el estuario es negativa y crítica. Ellos demuestran preocupación por el escaso caudal del río y los desechos de la actividad minera aguas arriba. Así mismo, de manera general, asocian los problemas del hábitat a las descargas de aguas de desecho de las granjas camaroneras. Con especial cuidado al río Siete, los pescadores no se acercan al lugar indicando que A. tuberculosa y otras especies bioacuáticas tales como el cangrejo rojo son imperceptibles en esa zona.

Figura 3 Imágenes de la zona de estudio donde se realizaron los muestreos a) río Siete b) río Chaguana.
De los resultados obtenidos, la contaminación por mercurio en el manglar del estuario La Puntilla define dos escenarios de riesgo, referidos como escenario A (desembocadura del río Siete) y escenario B (desembocadura del río Chaguana). Para ninguno de los casos se superó el HQ, que presentó valores inferiores a 1. Sin embargo, es importante considerar que el HQ no es más que una estimación conservadora de los efectos potenciales para la salud humana. Los factores de riesgo e índices de riesgo ecológico, asociados al río Siete, son aproximadamente cuatro veces mayores que en el río Chaguana. La escasa presencia de A. tuberculosa en la desembocadura del río Siete demuestra un efecto ecológico severo en este cuerpo fluvial y es motivo de incertidumbre local, por lo cual se requiere profundizar en la investigación en este sitio. La presencia de otros metales que se han reportado en la cuenca hídrica del río Siete y que podrían sumar efectos tóxicos para los organismos acuáticos no fue motivo de análisis en el presente trabajo. Es substancial ejecutar un programa de investigación integral en áreas de manglar considerando el análisis de otros metales y parámetros abióticos en el ecosistema.
AGRADECIMIENTOS
El presente trabajo se desarrolló a través del acuerdo de cooperación entre la Universidad Técnica de Machala-Ecuador y el Canadian International Resource and Develoment Institute (CIRDI) para la ejecución de los proyectos "TransMAPE" y "Contaminación por metales pesados". Se deja especial reconocimiento a los pescadores artesanales de la parroquia Tendales, en especial a la familia Guerrero-García, por su apoyo y acompañamiento en las faenas de campo y por el interés mostrado en la situación ecológica del lugar en el que habitan y trabajan.
REFERENCIAS
Alongi, D.M. 2013. Mangrove-microbe-soil relations. Interactions between macro- and microorganisms in marine sediments: 85-103. https://doi.org/10.1029/CE060p0085. [ Links ]
Andren, A.W. and R.C. Harriss. 1975. Observations on the association between mercury and organic matter dissolved in natural waters. Geochim. Cosmochim. Acta, 39: 1253-1258. https://doi.org/10.1016/0016-7037(75)90132-5. [ Links ]
Appleton, J.D., T.M. Williams, H. Orbea and M. Carrasco. 2001. Fluvial contamination associated with artisanal gold mining in the Ponce Enriquez, Portovelo-Zaruma and Nambija areas, Ecuador. Water Air Soil Poll., 131(1-4): 19-39. [ Links ]
Bazzi, A. 2014. Heavy metals in seawater, sediments and marine organisms in the Gulf of Chabahar, Oman Sea. J. Oceanogr. Mar. Sci., 5(3): 20-29. https://doi.org/10.5897/JOMS2014.0110. [ Links ]
Cardoso, P.G., A.I. Lillebe, E. Pereira, A.C. Duarte and M.A. Pardal. 2009. Different mercury bioaccumulation kinetics by two macrobenthic species: the bivalve Scrobicularia plana and the polychaete Hediste diversicolor. Mar. Environ. Res., 68(1): 12-18. https://doi.org/10.1016/j.marenvres.2009.03.006. [ Links ]
Carling, G.T., X. Diaz, M. Ponce, L. Perez, L. Nasimba, E. Pazmino and W.P. Johnson. 2013. Particulate and dissolved trace element concentrations in three southern Ecuador rivers impacted by artisanal gold mining. Water Air Soil Poll., 224(2): 1415. [ Links ]
Center for Environmental & Human Toxicology. 2005. Final technical report: Development of Cleanup Target Levels (CTLs). Division of Waste Management FDEP. [ Links ]
Chen, C.Y., M. Dionne, B.M. Mayes, D.M. Ward, S. Sturup and B.P. Jackson. 2009. Mercury bioavailability and bioaccumulation in estuarine food webs in the Gulf of Maine. Environ. Sci. Technol., 43(6): 1804-10. https://doi.org/10.1021/es8017122. [ Links ]
Claisse, D., D. Cossa, J. Bretaudeau-Sanjuan, G. Touchard and B. Bombled. 2001. Methylmercury in molluscs along the French coast. Mar. Pollut. Bull., 42(4): 329-332. https://doi.org/10.1016/S0025-326X(01)00036-4. [ Links ]
Dallinger, R. 1993. Strategies of metal detoxification in terrestrial invertebrates: 245-289. In Ecotoxicology of metals in invertebrates. Lewis Publishers, London. [ Links ]
Denil, D.J., F.F. Ching and J. Ransangan. 2017. Health risk assessment due to heavy metals exposure via consumption of bivalves harvested from Marudu Bay, Malaysia. Open J. Mar. Sci., 7: 494-510. https://doi.org/10.4236/ojms.2017.74035. [ Links ]
Elder, J.F. and J.J. Collins. 1991. Freshwater molluscs as indicators of bioavailability and toxicity of metals in surface-water systems. Rev. Environ. Contam. Toxicol., 122: 37-79. https://doi.org/10.1007/978-1-4612-3198-1_2. [ Links ]
Environmental Protection Agency. 1997. Analysis of risk for environmental pollutants application of deterministic and probabilistic methods for a school scenario. [ Links ]
Hakanson, L. 1980. An ecological risk index for aquatic pollution control. A sedimentological approach. Water Res., 14(8): 975-1001. https://doi.org/10.1016/0043-1354(80)90143-8. [ Links ]
Huang, S., R. Jiang, Q. Song, Y. Zhang, Q. Huang, B. Su, ... and H. Lin. 2020. Study of mercury transport and transformation in mangrove forests using stable mercury isotopes. Sci. Total Environ., 704, 135928. [ Links ]
Institute of Marine and Coastal Research. 2013. Manual of analytical techniques for the determination of isicochemical parameters and marine pollutants (water, sediments and organisms). Inst. Coast. Mar. Res., Santa Marta. https://doi.org/10.1017/CBO9781107415324.004. [ Links ]
Jakimska, A., P. Konieczka, K. Skóra and J. Namiesnik. 2011. Bioaccumulation of metals in tissues of marine animals, Part I: the role and impact of heavy metals on organisms. Pol. J. Environ. Stud., 20(5): 1117-1125. [ Links ]
Kehrig, H. A., M. Costa, I. Moreira and O. Malm. 2006. Total and methyl mercury in different species of molluscs from two estuaries in Río de Janeiro state. J. Braz. Chem. Soc., 17(7): 1409-1418. [ Links ]
Lacerda, L.D., C.E. Carvalho, K. Tanizaki, A. Ovalle and C. Rezende. 1993. The biogeochemistry and trace metals distribution of mangrove rhizospheres. Biotropica, 252-257. [ Links ]
Le, D.Q., K. Tanaka, L.V. Dung, Y.F. Siau, L. Lachs, S.T. Kadir, ... and K. Shirai. 2017. Biomagnification of total mercury in the mangrove lagoon foodweb in east coast of Peninsula, Malaysia. Reg. Stud. Mar. Sci., 16, 49-55. https://doi.org/10.1016/j.rsma.2017.08.006. [ Links ]
Maanan, M. 2008. Heavy metal concentrations in marine molluscs from the Moroccan coastal region. Environ. Poll., 153(1): 176-183. https://doi. org/10.1016/j.envpol.2007.07.024. [ Links ]
Marchand, C., E. Lallier-Vergès, F. Baltzer, P. Albéric, D. Cossa and P. Baillif. 2006. Heavy metals distribution in mangrove sediments along the mobile coastline of French Guiana. Mar. Chem., 98(1): 1-17. https://doi.org/10.1016/j.marchem.2005.06.001. [ Links ]
Marín, A., V.H. González, B. Lapo, E. Molina y M. Lemus. 2016. Niveles de mercurio en sedimentos de la zona costera de El Oro, Ecuador. Gayana, 80(2): 147-153. http://dx.doi.org/10.4067/S0717-65382016000200147 [ Links ]
Medina, M.H., J. Correa and C. Barata. 2007. Micro-evolution due to pollution: possible consequences for ecosystem responses to toxic stress. Chemosphere, 67(11): 2105-2114. https://doi.org/10.1016/j.chemosphere.2006.12.024. [ Links ]
Morel, F.M., A. Kraepiel and M. Amyot. 1998. The chemical cycle and bioaccumulation of mercury. Annu. Rev. Ecol. Syst., 29(1): 543-66. https://doi.org/10.1146/annurev.ecolsys.29.1.543. [ Links ]
Otchere, F.A. 2019. A 50-year review on heavy metal pollution in the environment: Bivalves as bio-monitors. Afr. J. Environ. Sci. Tech., 13(6): 220-227. [ Links ]
Otchere, F.A., C.R. Joiris and L. Holsbeek. 2003. Mercury in the bivalves Anadara (Senilia) senilis, Perna perna and Crassostrea tulipa from Ghana. Sci. Total Environ., 304: 369-375. https://doi.org/10.1016/S0048-9697(02)00582-X. [ Links ]
Riget, F., P. Johansen and G. Asmund. 1996. Influence of length on element concentrations in blue mussels (Mytilus edulis). Mar. Pollut. Bull., 32(10): 74551. doi:10.1016/0025-326X(96)00067-7. [ Links ]
Santana, V., G. Medina y A. Torre. 2014. El convenio de Minamata sobre el mercurio y su implementación en la región de América Latina y el Caribe. http://www.mercuryconvention.org/Portals/11/documents/publications/informe_Minamata_LAC_ES_FINAL.pdf. [ Links ]
Scardino, A., R. De Nys, O. Ison, W. O'Connor and P. Steinberg. 2003. Microtopography and antifouling properties of the shell surface of the bivalve molluscs Mytilus galloprovincialis and Pinctada imbricata. Biofouling, 19: 221-230. doi: 10.1080/0892701021000057882. [ Links ]
Schudel, G., R.A. Miserendino, M.M. Veiga, P.C. Velásquez-López, P.S.J. Lees, S. Winland-Gaetz, J.R. Guimarães and B.A. Bergquist. 2018. An investigation of mercury sources in the Puyango-Tumbes River: using stable Hg isotopes to characterize transboundary Hg pollution. Chemosphere, 202: 777-787. https://doi.org/10.1016/j.chemosphere.2018.03.081. [ Links ]
Schudel, G ., R. Kaplan, R.A. Miserendino , M.M. Veiga , P.C. Velásquez-López , J.R. Davée Guimarães and B.A. Bergquist . 2019. Mercury isotopic signatures of tailings from artisanal and small-scale gold mining (ASGM) in southwestern Ecuador. Sci. Total Environ., 686: 301-10. https://doi.org/10.1016/j.scitotenv.2019.06.004. [ Links ]
Secretaria Nacional de Planificación y Desarrollo. 2009. Evaluación social y técnica de los recursos hídricos de las subcuencas de los ríos Jagua, Balao, Gala, Tengel y Siete, en la provincia de Azuay. https://es.scribd.com/doc/29929927/INVENTARIO-R-HIDRICOS-JAGUA-TENGUELGALA-SIETE. [ Links ]
Sevillano, J.S., M. Cejudo-Gómez, A.M. Ramírez-Ojeda, F. Cámara-Martos and R. Moreno-Rojas. 2015. Risk profile of methylmercury in seafood. Curr. Opin. Food. Sci., 6: 53-60. https://doi.org/10.1016j.cofs.2016.01.003. [ Links ]
Silva, F.S., W. Machado, F. Lisboa and D. Lacerda. 2003. Mercury accumulation in sediments of a mangrove ecosystem in SE Brazil. Water Air Soil Poll., 145: 67-77. https://doi.org/10.1023/A. [ Links ]
Tam, N. e Y. Wong. 1995. Spatial and temporal variations of heavy metal contamination in sediments of a mangrove swamp in Hong Kong. Mar. Pollut. Bull., 31(4-12): 254-261. https://doi.org/10.1016/0025-326X(95)00141-9. [ Links ]
Tarras-Wahlberg, N.H., A. Flachier, G. Fredriksson and S. Lane. 2000. Environmental impact of small-scale and artisanal gold mining in southern Ecuador. AMBIO, 29(8): 484-491. doi: 10.1579/0044-7447-29.8.484. [ Links ]
U.S. Environmental Protection Agency. 1989. Risk assessment guidance for superfund. Vol. I Human Health Evaluation Manual (Part A). https://doi.org/EPA/540/1-89/002. [ Links ]
U.S. Environmental Protection Agency. 2001. Water quality criterion for the protection of human health: methylmercury. Methylmercury water quality criterion. EPA-823-R-. https://doi.org/EPA-823-F-01-001. [ Links ]
U.S. Environmental Protection Agency. 2002. Calculating upper confidence limits for exposure point concentrations at hazardous waste sites. Washington. [ Links ]
Vane, C.H., I. Harrison, A.W. Kim, V. Moss-Hayes, B.P. Vickers and K. Hong. 2009. Organic and Metal contamination in surface mangrove sediments of south China. Mar. Pollut. Bull., 58: 134-144. https://doi.org/10.1016j.marpolbul.2008.09.024. [ Links ]
Velásquez López, P.C., M.M. Veiga , B. Klein, J.A. Shandro and K. Hall. 2011. Cyanidation of mercury-rich tailings in artisanal and small-scale gold mining: identifying strategies to manage environmental risks in southern Ecuador. J. Clean. Prod., 19(9-10): 1125-1133. https://doi.org/10.1016/j.jclepro.2010.09.008. [ Links ]
World Health Organization. 1996. Guidelines for drinking water quality. Vol. 2. Geneva: WHO library. [ Links ]
World Health Organization. 2008. Guidance for identifying populations at risk from mercury exposure. Geneva. https://doi.org/10.1289/ehp.7856. [ Links ]
Zuykov, M., E. Pelletier, C. Belzile and S. Demers. 2011. Alteration of shell nacre micromorphology in blue mussel Mytilus edulis after exposure to free-ionic silver and silver nanoparticles. Chemosphere, 84: 701-706. doi: 10.1016/j.chemosphere.2011.03.021. [ Links ]
Zuykov, M ., E. Pelletier , R. St-Louis, A. Checa and S. Demers . 2012. Biosorption of thorium on the external shell surface of bivalve mollusks: The role of shell surface microtopography. Chemosphere, 86: 680-683. https://doi.org/10.1016/j.chemosphere.2011.11.023. [ Links ]
Recibido: 24 de Agosto de 2019; Aprobado: 20 de Abril de 2020











 texto en
texto en