Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta ene./jun. 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.777
Artículos de Investigación
Variación estacional de la comunidad de copépodos en el sector oriental del golfo de Cariaco, estado Sucre, Venezuela
1 Lab. Zooplancton. Dpto. Biología Marina. Instituto Oceanográfico de Venezuela, Universidad de Oriente, Sucre, Venezuela. bmarquez200'@gmail.com *Autora para correspondencia.
2 Instituto de Investigaciones Científicas, Facultad de Ciencias del Mar. Universidad de Oriente, Núcleo Nueva Esparta, Cumaná, Sucre, Venezuela. luis.troccoli@gmail.com
3 Facultad de Ciencias del Mar, Universidad Estatal Península de Santa Elena, Ecuador.
4 Lab. Plancton. Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela, Caracas. evelyn.zoppi@gmail.com
Los copépodos son el grupo más numeroso del zooplancton en los sistemas costeros tropicales; ellos se ven afectados principalmente por los gradientes de salinidad, como ocurre en el sector oriental del golfo de Cariaco. El propósito de este estudio fue estudiar las variaciones temporales y espaciales de la estructura de la comunidad de copépodos durante junio, julio, agosto y septiembre de 2009 (época de lluvia) y octubre, noviembre y diciembre de 2009 y enero de 2010 (época de sequía). Las muestras se recolectaron con una red estándar de zooplancton de 60 cm de diámetro con una malla de 330 μm a nivel superficial. La temperatura, salinidad y oxígeno disuelto se tomaron in situ con una sonda multiparamétrica (YSI). La salinidad presentó una marcada variabilidad mensual, con valores entre 32,5 ± 1,56 y 38,5 ± 0.25 UPS en las épocas de lluvia y sequía, respectivamente. Se identificó un total de 45 taxones de copépodos y Acartia tonsa fue la especie más representativa durante todo el estudio, seguido por Temora turbinata, Paracalanus quasimodo, Subeucalanus subcrassus y S. subtenuis. El presente estudio no mostró un claro patrón estacional en la abundancia, diversidad y la uniformidad de la comunidad de copépodos y los valores de salinidad; por lo tanto, puede considerarse espacialmente uniforme y estacionalmente homogéneo en relación a estos parámetros.
PALABRAS CLAVE: cambios estacionales; copépodos; golfo de Cariaco; sureste Caribe
Copepods are the most numerous group of zooplankton in tropical coastal systems; they are mainly affected by salinity gradients, as occurs in the eastern sector of the Gulf of Cariaco. This study purposed to study the temporal and spatial variations in the structure of the copepod community during June, July, August, and September 2009 (rainy season) and October, November, and December 2009 and January 2010 (dry season). Samples were collected with a standard 60 cm diameter zooplankton net with a 330 μm mesh at the surface level. Temperature, salinity, and dissolved oxygen were taken in situ with a multi-parameter probe (YSI). Salinity presented a marked monthly variability, with values between 32.5 ± 1.56 and 38.5 ± 0.25 UPS in the rainy and dry seasons, respectively. A total of 45 copepod taxa were identified and Acartia tonsa was the most representative species throughout the study, followed by Temora turbinata, Paracalanus quasimodo, Subeucalanus subcrassus and S. subtenuis. The present study did not show a clear seasonal pattern in the abundance, diversity, and uniformity of the copepod community and the salinity values; therefore, it can be considered spatially uniform and seasonally homogeneous concerning these parameters.
KEYWORDS: seasonal changes; copepods; gulf of Cariaco; south-eastern Caribbean
INTRODUCCIÓN
Dentro del zooplancton, los copépodos pertenecientes a los crustáceos constituyen el grupo predominante. Entre ellos, los pelágicos son los más abundantes en los océanos, debido a tres razones: i) cuerpo en forma de torpedo, antenas sensoriales y el fuerte engranaje del motor muscular para la detección y escape de depredadores, ii) la capacidad de detectar presas de forma remota y capturarlas cuando llegan en una corriente de exploración, o cuando nadan a través de la esfera perceptiva del copépodo y iii) a la búsqueda eficiente de pareja en un ambiente diluido, permitiendo la reproducción sexual con apareamiento real en cada generación, poco común en el plancton; esto brinda ventajas en términos de eliminación de mutaciones malas y promoción de "genes buenos" a través de la selección sexual (Kierboe, 2011). Debido a esto, los copépodos representan entre 60 y 90 % de la biomasa en ambientes costeros (Bradford-Grieve et al., 1999; Ruíz-Pineda et al., 2016; Neumann-Leitão et al., 2018).
El zooplancton presenta variaciones detectables, producto de cambios cíclicos en los factores ambientales (Mclusky y Elliot, 2004; López-Peralta y Mojica-López, 2015; Rose et al., 2019); por consiguiente, los patrones de variabilidad en composición, abundancia y distribución de los copépodos planctónicos, se establecen en función de su acoplamiento con los procesos físicos (i.e.: gradientes de salinidad, temperatura, concentración de nutrientes y patrones internos de circulación) a distintas escalas (Marques et al., 2006; Escamilla et al, 2011; Ruíz-Pineda et al., 2016).
Por otra parte, Magalháes et al. (2009, 2015) y Neumann-Leitão et al. (2018) mencionan que la variabilidad estacional y espacial observada en la ocurrencia y distribución de los copépodos planctónicos en sistemas estuarino-costeros tropicales está directamente relacionada con factores abióticos (i.e.: salinidad, turbidez y temperatura) y factores bióticos (i.e.: competencia, depredación, hábitos, disponibilidad y calidad del alimento) o una combinación de ambos. En consecuencia, no se pueden considerar como un conjunto homogéneo de organismos, ya que su distribución no solo cambiará en el espacio y el tiempo, debido a la influencia de factores físico-químicos, sino también por procesos biológicos (Seda y Devetter, 2000; Beisner, 2001; Vukanic et al., 2018).
En las zonas costeras o estuarinas, los valores de biomasa y diversidad (9 a 50 mg m-3 y 8-10 especies, respectivamente) de los copépodos, son relativamente bajos cuando se comparan con las zonas oceánicas. Estas diferencias se atribuyen a las peculiares condiciones fisiográficas de dichas zonas, que favorecen a un reducido grupo de especies de copépodos (Vásquez-Yeomans et al, 2012; Rice et al., 2015; Ruíz-Pineda et al., 2016). En ese sentido, los gradientes de salinidad resultantes de las interacciones entre la influencia marina y la escorrentía de agua dulce, a menudo representan el parámetro principal para definir los patrones de distribución local y de sucesión de especies (Escamilla et al., 2011; Ruíz-Pineda et al., 2016). El sector oriental del golfo de Cariaco tiene una marcada influencia de agua dulce, debido a los ríos Carinicuao y Cariaco, los cuales mantienen una comunicación con el golfo durante algunos meses del año, originando una zona estuarina (Caraballo, 1982). Por otra parte, los procesos de convección y afloramiento en el golfo de Cariaco tienden a desarrollar fenómenos de renovación de aguas superficiales cálidas por aguas profundas más frías y ricas en nutrientes que estimulan el desarrollo del fitoplancton y del zooplancton (Bonilla et al., 1985). Por lo tanto, el estudio de los patrones de variabilidad de los copépodos en el zooplancton estuarino podría revelar información importante de la dinámica de la comunidad local, con implicaciones a otros sistemas estuarino-costeros tropicales. En ese sentido, el monitoreo de la comunidad de copépodos permite detectar y dar seguimiento a niveles de perturbación y deterioro ecológico (Branco et al, 2007; Escamilla et al., 2011).
Es importante mencionar, que debido a todo lo antes expuesto en el golfo de Cariaco los copépodos han sido ampliamente estudiados habiéndose identificado un número importante de especies. De las 723 especies señaladas para la zona de Venezuela, en dicho golfo se han registrado 136 (Legaré, 1961; Zoppi, 1961; Infante y Urosa, 1986; Márquez-Rojas et al., 2006, 2011, 2014a, 2014b; Razouls et al., 2005-2019). Sin embargo, en el sector oriental o saco del golfo de Cariaco, el conocimiento sobre las comunidades de copépodos es relativamente escaso, a pesar de que varios estudios confirman un marcado gradiente de salinidad en esta zona (Márquez et al, 2011; Martínez et al., 2011).
Actualmente no existe información publicada sobre la estructura de la comunidad de copépodos en el sector oriental del golfo de Cariaco y cómo éstos se ven afectados por las variaciones estacionales en la salinidad, las precipitaciones y la escorrentía de agua dulce. Por consiguiente, el objetivo principal del presente estudio es evaluar la composición taxonómica del ensamble de los copépodos en el sector oriental del golfo de Cariaco y caracterizar los patrones de abundancia y dominancia estacionales en relación con las variaciones anuales de salinidad.
MATERIALES Y MÉTODOS
Área de estudio
El sector oriental o saco del golfo de Cariaco (Figura 1), tiene aproximadamente 9 km de ancho y 17 km de largo. En este sector se localizan las menores profundidades del golfo, las cuales se aproximan a los 40 metros. En su extremo oriental, desembocan los ríos Carinicuao y Cariaco y en el sur las quebradas Oricoto y López, conformando los mayores afluentes continentales y probablemente la fuente proveedora de gran parte de los materiales sedimentarios que se depositan en el área de estudio (Caraballo, 1982). La vegetación en este sector está caracterizada por la presencia de manglares y zonas xerófilas.
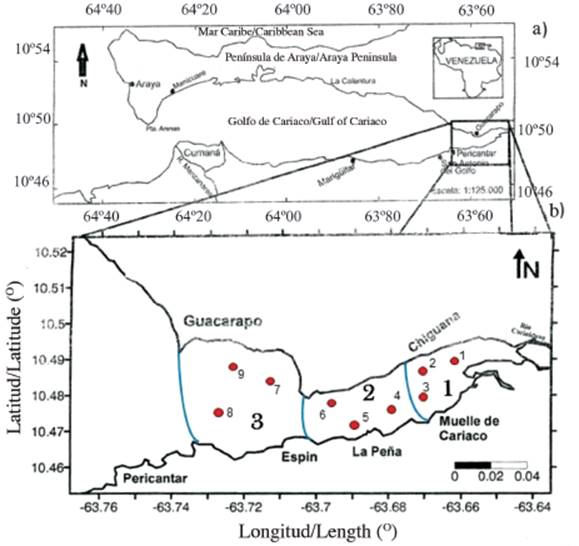
Figura 1 a) Localización geográfica del golfo de Cariaco y b) detalles del extremo oriental o saco del golfo, mostrando las zonas y las estaciones de muestreo.
El área de estudio presenta estacionalidad pronunciada que se puede observar en los parámetros físicos de la columna de agua en el comienzo del año causado por el desplazamiento estacional de la zona de convergencia intertropical (ITCZ) que genera una variabilidad significativa en el régimen del viento, las corrientes y descarga de ríos (Lorenzoni et al., 2013; López-Monroy y Tróccoli-Ghinaglia, 2015).
Muestreo de campo
El diseño para tomar las muestras se realizó por medio de un muestreo por conglomerado bietápico con submuestra (Cochran, 1977), el cual consistió en dividir el sector oriental o saco del golfo en tres zonas; dentro de cada zona se escogieron tres estaciones al azar, para un total de 9 muestras por salida (Figura 1b). Las muestras se recolectaron mensualmente entre junio de 2009 y enero de 2010, garantizando la representatividad en el período de lluvias (junio-septiembre) y sequía (octubre-diciembre y enero), en las nueve estaciones en el sector oriental del golfo de Cariaco (Figura 1b).
Las muestras zooplanctónicas fueron recolectadas a nivel superficial, con una red de Bongo (333 y 555 μm de abertura de malla y 60 cm de diámetro), a una velocidad de 3,7 km/h durante 15 min. Para el presente trabajo se utilizaron solamente las muestras de mesozooplancton (333 nm), dicha red estaba equipada con un flujómetro para estimar el volumen de agua filtrado. Todas las muestras fueron inmediatamente colocadas en botellas de poliuretano de 500 mL de capacidad y conservadas en formalina tamponada con tetraborato sódico, manteniendo la concentración final al 5 %.
En cada estación se midieron la temperatura, la salinidad y el oxígeno disuelto superficial por medio de una sonda multiparamétrica (YSI). Simultáneamente, se recolectaron muestras en botellas de polietileno oscuras (2 L) para las determinaciones de clorofila a (Clor. α) empleando el método espectrofotométrico descrito por Lorenzen modificado por Strickland y Parsons (1972), los resultados se expresaron en mg Clor. α.m3.
Trabajo en el laboratorio
Para el zooplancton, cada muestra de la malla de 333 nm se homogenizó y dividió en dos porciones iguales por medio de un separador Folsom; una porción fue destinada al estudio de la estructura de la comunidad y la otra para el análisis de la biomasa para otros estudios. Para la determinación taxonómica, de las muestras concentradas (400 mL) se obtuvieron 3 submuestras de 5 mL con una pipeta Stempel, y se procedió bajo un microscopio estereoscópico, al conteo e identificación de los copépodos adultos y juveniles al más bajo nivel taxonómico posible, empleando las claves de identificación especializadas de Campos-Hernández y Suárez-Morales (1994), Suárez-Morales (1995), Bradford-Grieve et al. (1999), así como la base de datos de Razouls et al. (2005-2019). El número de organismos contados se dividió entre el volumen de agua filtrada, por lo que los resultados se estandarizaron a ind.m-3. Los datos de pluviosidad analizados fueron suministrados por el Servicio Meteorológico de la Fuerza Armada Nacional del Aeropuerto Antonio José de Sucre de la ciudad de Cumaná.
Análisis de la información
Los datos cuantitativos obtenidos de la muestra se usaron para calcular la abundancia absoluta y relativa de las especies de copépodos, mientras los índices ecológicos (diversidad y equidad) se calcularon por mes. La diversidad de los copépodos se calculó usando el índice de Shannon-Wiener (H') y la equidad a través del índice de Pielou (J) de acuerdo a lo señalado por Krebs (1999).
La comparación de las variables abióticas (temperatura, salinidad y oxígeno disuelto), bióticas (Clor. α), la abundancia total y diversidad de los copépodos entre las estaciones y zonas se realizó con la prueba no paramétrica Kruskal-Wallis, luego de comprobar que no se cumplieron los supuestos del análisis paramétrico mediante la prueba de normalidad de Kolmogorov-Smirnov y homocedasticidad de Levene (Sheskin, 2004). Las comparaciones de los períodos estudiados, se realizaron con la prueba de Mann-Whitney o test Wilcoxon (Zar, 1999). Se calculó el coeficiente de correlación de Spearman para caracterizar las relaciones entre la salinidad, la abundancia de los copépodos y los índices ecológicos. Para estas pruebas se utilizó el software estadístico Statgraphics plus 5,1.
Para visualizar el comportamiento de la diversidad de los copépodos entre los diferentes períodos estacionales y los meses de muestreo, se realizaron curvas de K-dominancia (Lambshead et al., 1983). En su construcción se utilizan el rango de las especies (en el eje de las abscisas) y el porcentaje de abundancia acumulado (en las ordenadas).
Con los datos de los copépodos se construyeron matrices de disimilitud Bray-Curtis previamente transformados a Log (x + 1), mientras que los datos ambientales (temperatura, oxígeno disuelto, salinidad y clorofila α) se normalizaron y se emplearon distancias Euclidianas para su construcción (Legendre y Legendre, 1998). Las matrices generadas de los copépodos se utilizaron para analizar la similitud entre las abundancias mensuales por medio de un análisis de clasificación (Cluster) y el escalamiento multidimensional no métrico (nMDS) para visualizar la ordenación de la abundancia de los copépodos en dos dimensiones con respecto a las dos épocas estudiadas; para estos análisis se utilizó el programa Primer 6 (Clarke y Gorley, 2006).
Con el fin de conocer las posibles relaciones entre las especies de copépodos más abundantes y las variables ambientales registradas durante los dos períodos estudiados, se efectuó un análisis de correspondencia canónica (ACC). Este procedimiento permitió posicionar las especies de copépodos más abundantes (> 10 %) con las variables temperatura, salinidad, oxígeno disuelto y clorofila a, en un sistema sintetizado de coordenadas (componentes 1 y 2) (Ter Braak y Verdonschot, 1995).
RESULTADOS
Variables abióticas
En el presente estudio, la temperatura, oxígeno disuelto, salinidad, clorofila α, así como la abundancia y los índices ecológicos no mostraron diferencias significativas espaciales (p > 0,05) entre las nueve estaciones muestreadas, ni en las tres zonas de estudio (p > 0,05). Por lo tanto, los valores reportados para cada mes de muestreo fueron agrupados y evaluados en escalas estacionales (período de lluvia/período de sequía).
La temperatura superficial del agua no mostró una marcada variación entre los períodos estudiados (Mann-Whitney U-test = 556; p > 0,05), registrando valores entre 24-28,6 °C en el período de lluvia y 23,4-27,6 °C para el período de sequía. El oxígeno disuelto mostró marcadas fluctuaciones mensuales, registrando diferencias significativas entre los dos períodos (Mann-Whitney U-test = 156; p < 0,05); en la época de lluvia se registraron los valores más altos (4,9-9,9 mLO2.L-1), mientras en la época de sequía fluctuaron entre 1,4-7,8 mLO2.L-1.
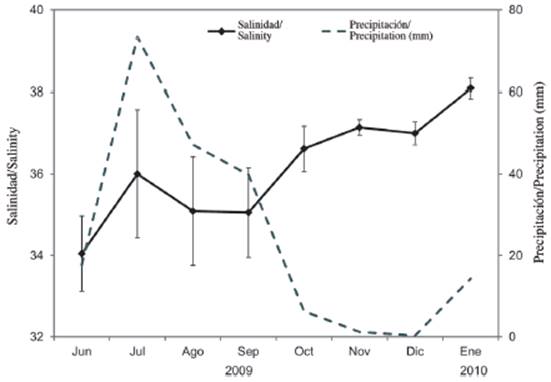
La salinidad presentó una marcada variabilidad mensual, con diferencias de hasta 6 unidades. Se detectaron diferencias significativas estacionales (Mann-Whitney U-test = 1103,5; p < 0,05). El valor más bajo (32,5 ± 1,6; media ± desviación estándar) fue registrado en junio de 2009 (época de lluvia), mientras el valor más alto (38,5 ± 0,2) fue medido en enero de 2010 (época de sequía) (Figura 2). Cuando se relaciona la salinidad con las precipitaciones, se observa una tendencia contraria, presentándose los valores más altos de precipitación (17,7 a 73,4 mm) en la época de lluvia (Figura 2).
Variables bióticas
La concentración de Clor. α presentó una gran fluctuación durante el estudio, con valores comprendidos entre no detectable (ND) y 26,5 mg Clor. α.m-3. Las concentraciones más altas se midieron al comienzo del estudio (época de lluvia), registrando en julio de 2009 magnitudes de 17,6 ± 6.4 mg Clor. α.m3. Durante los meses restantes, los valores medios de Clor. α fueron más bajos, oscilando entre 0,9 y 8,9 mg Clor. α.m3. Se detectó diferencias significativas (Mann-Whitney U-test = 1008; p < 0,05) entre los períodos estudiados.
Composición y abundancia de copépodos
Se identificaron un total de 45 especies de copépodos (Tabla 1). La abundancia media mensual de los copépodos varió entre 513 ± 79 ind.m-3 en diciembre de 2010 (época de sequía) y 7156 ± 627 ind.m-3 en julio de 2009 (época de lluvia) (Figura 3a). Acartia tonsa (Dana) fue la más abundante y representativa de todo el estudio, aportando un 83,2 ± 2,6 % en lluvia y 60,8 ± 4,7 % en época de sequía del total de la abundancia de los copépodos (Tabla 1). A escala mensual, la abundancia de esta especie superó el 90 % en julio, noviembre y diciembre de 2009 (Figura 5c). A esta especie le siguió Temora turbinata (Dana), con una abundancia relativa de 5,3 y 30,3 % para los períodos de lluvia y sequía, respectivamente. Durante el período de sequía (octubre de 2009 y enero de 2010), se obtuvieron las abundancias más altas de esta especie. Paracalanus quasimodo (Bowman) fue la tercera especie en orden de abundancia, sobresaliendo en el período de lluvia excelling in the rainy season (2.15 %), mainly in June and (2,15 %), principalmente en junio y septiembre de 2009. September 2009.
Tabla 1 Composición taxonómica, abundancia absoluta (media ± DS) y relativa de los copépodos colectados durante la época de lluvia y sequía en el saco del golfo de Cariaco, estado Sucre, Venezuela.
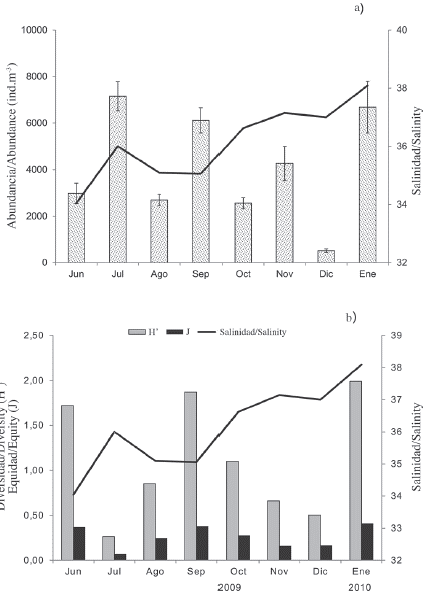
Figura 3 a) Media mensual (± desviación estándar) de la abundancia de los copépodos y b) índices ecológicos de los copépodos recolectados en el saco del golfo de Cariaco, estado Sucre, Venezuela. Estos datos siempre fueron dibujados con la salinidad (línea).
Subeucalanus subcrassus y S. subtenuis, siguieron en orden de abundancia, con representaciones relativamente bajas (0,97 y 0,99 %, respectivamente) y destacándose en el período de lluvia (Tabla 1, Figura 5c).
Dentro de las principales especies, A. tonsa (K-W = 28,3, p < 0,001) y T. turbinata (K-W = 23,5, p < 0,001) mostraron diferencias significativas estacionales en la abundancia. Variaciones estacionales también fueron observadas en la abundancia total de los copépodos (K-W = 31,4, p < 0,001). El coeficiente de Spearman mostró relaciones significativas entre la salinidad y la abundancia de T. turbinata (rs = 0,37, p < 0,05), entre la abundancia de los copépodos y A. tonsa (rs = 0,72; p < 0,001) y T. turbinata (rs = 0,57; p < 0,01). Por otro lado, se hallaron correlaciones significativas negativas entre la diversidad y equidad con A. tonsa (rs = -0,57 y rs = -0,66; p < 0,001, respectivamente) y entre la abundancia y la equidad (rs = -0,49; p < 0,01).
Estructura comunitaria
Las fluctuaciones mensuales de la abundancia, diversidad y equidad de los copépodos fueron diagramadas con respecto a la salinidad (Figura 3b). No se detectaron diferencias significativas en la diversidad de los copépodos con respecto a los períodos estudiados (Mann-Whitney U-test = 641; p > 0,05). Los valores fueron similares durante los dos períodos, registrando en la época de lluvia valores medios de 1,2 ± 0,8 bits.ind-1, con un mínimo de 0,3 bits.ind-1 en julio de 2009 y un máximo de 1.9 bits.ind-1 en septiembre de 2009. En la época de sequía se obtuvo un valor medio de 1,1 ± 0,9 bits.ind-1, con un mínimo de 0.5 bits.ind-1 en diciembre de 2009 y un máximo de 2,0 bits.ind-1 en enero de 2010. La leve disminución de los valores de diversidad durante los meses de sequía, coincidió con la menor abundancia de copépodos (Figura 3b). Resultados contrarios fueron hallados para la equidad, encontrándose diferencias significativas entre los períodos (Mann-Whitney U-test = 808,5; p < 0,05), pero al igual que en la diversidad, los valores mayores se registraron en lluvia (0,3 ± 0,1), mientras que en sequía la media fue de 0,2 ± 0,1.
La curva de K-dominancia durante la época de lluvia mostró alta dominancia con menor diversidad durante julio y agosto, mientras que junio y septiembre reveló menor dominancia con una mayor diversidad de especies (Figura 4a). Durante los tres primeros meses del período de sequía, tuvieron un comportamiento similar, alta dominancia con menor cantidad de especies, mientras que enero de 2010 registró la menor dominancia del estudio con mayor diversidad de especies (Figura 4b). La curva de K-dominancia también exhibió diferencia en la diversidad y en la abundancia relativa de las especies entre los períodos estudiados (Figura 4c), mostrando en la época de sequía menor dominancia de las especies más abundantes, esto se puede corroborar en la Tabla 1.
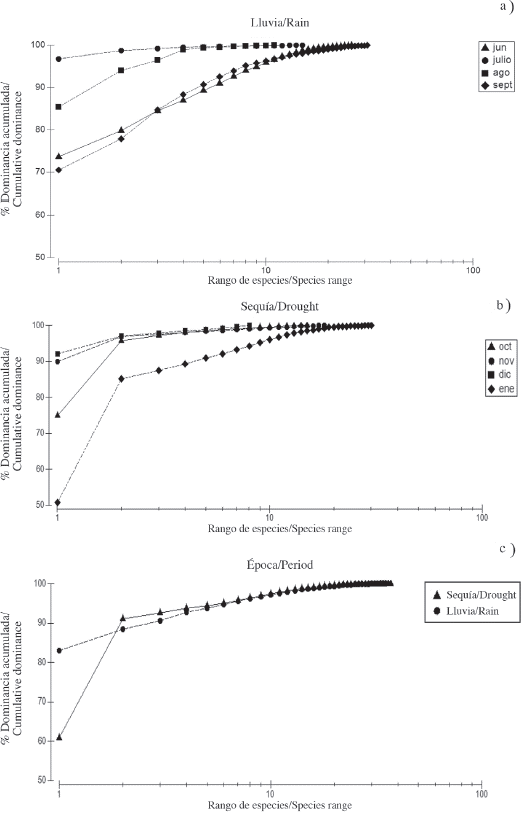
Figura 4 Curva de dominancia acumulada de los copépodos en lluvia a) y sequia b) y durante los dos períodos estudiados c) en el saco del golfo de Cariaco.
De acuerdo a los análisis de Cluster y nMDS agrupamos a la comunidad de copépodos del saco del golfo de Cariaco en dos conjuntos de acuerdo a la variabilidad estacional (Figura 5a, Figura 5b). En el Cluster, a un corte al 75 % de similitud, se observan estos dos grupos. El primero entre noviembre y diciembre de 2009 (época de sequía). Durante estos meses se observó un elevado porcentaje de abundancia (> 80 %) de Acartia tonsa asociada con una salinidad relativamente alta (Figura 5c). El segundo grupo se puede dividir en dos subgrupos, un primer subgrupo en julio, agosto y octubre de 2009 con porcentajes de abundancia altos (75-95 %) de Acartia tonsa relacionada con alta salinidad y el segundo subgrupo en junio y septiembre de 2009 y enero de 2010 con una mejor distribución de los porcentajes de abundancias entre las otras especies de copépodos Temora turbinata y Paracalanus quasimodo (Figura 5c). En el nMDS, el grupo I, lo constituyeron principalmente los meses de lluvia, donde T. turbinata y P. quasimodo registraron sus mayores porcentajes de abundancia; no obstante, el grupo II se asoció con la época de sequía, donde el porcentaje de abundancia de A. tonsa fue casi absoluto (Figura 5b).
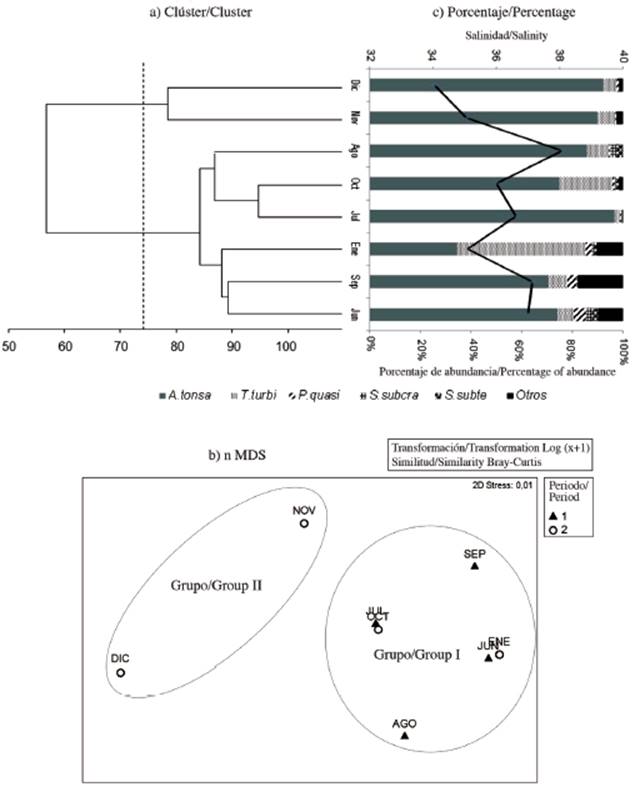
Figura 5 a) Análisis de Cluster y b) nMDS basado en la abundancia de los taxa de copépodos. c) Porcentaje de abundancia de los taxa de copépodos con la salinidad (línea continua negra) muestreados en el saco del golfo de Cariaco. A. tonsa: Acartia tonsa, T. turbi: Temora turbinata, P. quasi: Paracalanus quasimodo, S. subcra: Subeucalanus subcrassus, S. subte: Subeucalanus subtenuis. Período lluvia (triángulo negro) y sequía (círculo blanco).
El ACC considerando las especies más abundantes, durante la época de lluvia, mostró una correlación entre variables ambientales y el conjunto de especies de 0,69, se caracterizó por una relación directa de A. tonsa con la salinidad y la clorofila a, mientras que el componente 2, que tuvo una correlación ambiente-especies de 0,45, estuvo caracterizado por una relación directa de T. turbinata y P. quasimodo con la temperatura y el oxígeno disuelto (Figura 6a).
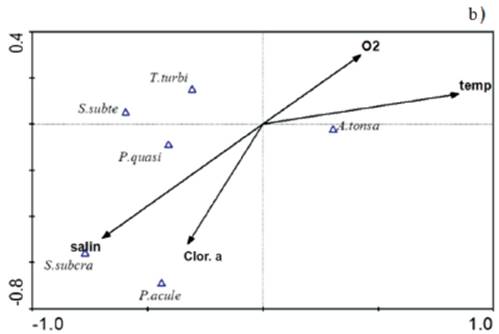
Figura 6 Proyección ortogonal del ACC en época de lluvia a) y sequía b) entre las especies de copépodos más abundantes y las variables ambientales medidas en el saco del golfo de Cariaco. salin: salinidad, temp: temperatura, O2: oxígeno disuelto, Clor. a: clorofila α, A. tonsa: Acartia tonsa, P. quasi: Paracalanus quasimodo, P. acule: Paracalanus aculeatus, S. subcra: Subeucalanus subcrassus, S. subte: Subeucalanus subtenuis, T. turbi: Temora turbinata.
Por otra parte, en la época de sequía, mostró una correlación ambiente-especies de 0,69, se caracterizó por una relación directa de A. tonsa con la salinidad y el oxígeno disuelto, mientras que el componente 2, tuvo una correlación ambiente-especies de 0,43, estuvo caracterizado por una relación directa de S. subcrassus con la salinidad y la clorofila a con P. aculeatus. Los resultados del ACC corroboran lo encontrado en las correlaciones no paramétricas de Spearman, que sugiere que la abundancia de las especies más abundantes de copépodos mostraron variaciones estacionales significativas, principalmente en A. tonsa y T. turbinata e incluso en estas especies quedó demostrado las relaciones significativas con la salinidad.
DISCUSIÓN
Al considerar los ecosistemas estuarinos tropicales en Venezuela (Zoppi, 1974; Gómez, 1983; Briceño et al., 2009; Márquez-Rojas et al., 2017; Villalba et al., 2017) y en todo el mundo (Sterza y Fernandes, 2006; Garboza da Costa et al., 2008; Magalháes et al., 2009; Da Costa et al., 2011) se corrobora que los cambios estacionales en la salinidad están influenciados principalmente por las lluvias. Esta afirmación quedo corroborada en el saco del golfo de Cariaco con la marcada fluctuación estacional que presentó la salinidad. Los valores elevados en las precipitaciones registrados entre junio y septiembre de 2010, incrementaron los caudales de los ríos, especialmente Carinicuao y Cariaco, reflejando una disminución de los valores de salinidad en la época de lluvias. Esta variación temporal de la salinidad en el extremo oriental del golfo coincidió con lo mencionado por Simpson y Griffiths (1967), Okuda et al. (1978) y más recientemente con Márquez et al. (2011), Martínez et al. (2011), Márquez-Rojas et al. (2017).
El patrón estacional de distribución observado en la abundancia total de copépodos, con los valores más altos registrados en la época de lluvias, estuvo en parte relacionada con el comportamiento de Acartia tonsa, que fue la especie más abundante; esto también fue encontrado en muchos otros sistemas estuarinos (Magalháes et al., 2009; Da Costa et al., 2011; Escamilla et al., 2011; Teiguel-C, 2015; Ruíz-Pineda et al., 2016). Este copépodo calanoide planctónico es una especie cosmopolita, dominante en muchas zonas subtropicales y zonas templadas (Mauchline, 1998), muestra alto grado de tolerancia a los cambios ambientales logrando soportar normalmente intervalos de salinidad desde 5 UPS (Cervetto et al., 1999) hasta 30 UPS (Calliari et al., 2006), excepcionalmente se han encontrado ejemplares en sistemas con salinidad de 0 UPS (Cronin et al., 1962) hasta 52 UPS (Rey et al., 1991).
La ausencia de correlación significativa entre Acartia tonsa y la salinidad en el saco del golfo de Cariaco, indica que esta especie no demostró preferencia por las aguas estuarinas. Sin embargo, la tolerancia intraespecífica a las salinidades bajas y moderadas podría explicar la mayor cantidad numérica de A. tonsa durante todo el período de lluvia. Para Temora turbinata, una especie ampliamente distribuida en regiones tropicales y subtropicales, miembro conspicuo de las comunidades mesozooplanctónicas superficiales y cercanas a la superficie en estuarios y en aguas neríticas y oceánicas (Ara, 2002), la correlación entre la salinidad y la abundancia fue significativa y positiva. Las abundancias altas registradas en el período de sequía sugieren que la presencia de esta especie en el área estudiada, depende del aumento de la salinidad.
Ruíz-Pineda et al. (2016) mencionan que los géneros Acartia, Temora, Paracalanus y Labidocera son elementos faunísticos eurihalinos y euritérmicos, con afinidad estuarina. Por lo tanto, A. tonsa y T. turbinata ha sido reportada con gran éxito en medios estuarinos, en lagunas costeras con fuerte influencia marina y en zonas con influencia terrígena (Peck et al., 2015), ratificando una vez más la presencia de estas especies en el extremo oriental del golfo. Por su parte, P. quasimodo fue la tercera especie en abundancia en la presente investigación, con incrementos más altos en la época de lluvia; sin embargo, no se halló correlación con la salinidad. Los resultados en cuanto a la abundancia de esta especie coincidió con lo reportado por Villalba et al. (2017) en la laguna costera El Morro, isla de Margarita, Venezuela, donde la contabilizaron como la segunda especie más abundante durante el período de relajación. Por consiguiente, los copépodos A. tonsa, T. turbinata y P. quasimodo estuvieron presentes en ambos períodos estudiados y en elevadas abundancias; por lo tanto, se puede concluir que estas especies son residentes permanentes de este cuerpo de agua.
La gran variabilidad de las condiciones físico-químicas en los estuarios, requiere que las especies que allí habitan tengan una mayor tolerancia a los cambios ambientales, lo que resulta en comunidades ecológicas menos diversas que en los ecosistemas acuáticos adyacentes, por lo que no solamente la tolerancia fisiológica de las especies es importante, sino también las estrategias de alimentación (Elliott y Whitfield, 2011; Márquez-Rojas et al., 2017). Por ejemplo, los copépodos típicamente estuarinos, A. tonsa y T. turbinata son conocidos por ser especies eurihalinas (Paffenhõfer, 1991; Ara, 2002; Hwang et al., 2006), incluso, la primera tiene un amplio intervalo de tolerancia (0-50 UPS) (Paffenhõfer, 1991; Rey et al., 1991; Martínez-Barragán et al., 2009), en tanto que A. tonsa tiene un espectro más amplio de alimentos con una mayor capacidad de seleccionar su presa entre la materia inorgánica, incluso debido a su capacidad omnívora, le permite ingerir grandes células de fitoplancton (que son comunes en medios con influencia de aguas continentales) y controlar a sus competidores potenciales, depredando a sus nauplios y copepoditos (Paffenhõfer, 1991), en contraste con T. turbinata que se alimenta principalmente de diatomeas con fróstulas (Eskinazi-Sant'anna, 2000). Esta estrategia de alimentación de A. tonsa es una ventaja en el extremo oriental del golfo de Cariaco, debido a la influencia de las aguas continentales, es una zona con alta turbidez, alto contenido de materia en suspensión, concentraciones altas de nutrientes principalmente de origen terrestre (Márquez et al., 2011; Martínez et al., 2011). Además, esta premisa quedó confirmada con la relación directa de A. tonsa con la salinidad y la clorofila a en el ACC, durante la época de lluvias. De igual manera, Camatti et al. (2019) corroboraron que la distribución estacional de A. tonsa en la laguna de Venecia, mar Mediterráneo, estaba asociada positiva y significativamente con la temperatura, el fitoplancton, la clorofila a y el gradiente de salinidad, confirmando que es una especie tolerante oportunista que puede tomar provecho de los ecosistemas eutróficos.
En el extremo oriental del golfo de Cariaco, la diversidad no mostró diferencias estacionales significativas; no obstante, la comunidad de copépodos presentó valores un poco más altos en lluvia. Este ligero aumento durante los meses de lluvias probablemente estuvo relacionado con la mayor riqueza de especies registradas en este período, a pesar que durante estos meses hubo una mayor contribución de A. tonsa en la abundancia total de los copépodos. En este sentido, la abundancia de A. tonsa se incrementó con el descenso de la salinidad, debido al incremento de la descarga de los ríos Carinicuao y Cariaco que descargan justamente en la zona de estudio; sin embargo, no se encontró una correlación significativa entre esta especie y la salinidad, donde se pueda deducir que la salinidad la afecta directamente. Numerosos estudios en estuarios han descrito la reducción en la diversidad de los copépodos durante la estación lluviosa (Mwaluma et al., 2003; Osore et al., 2004; Magalháes et al., 2015); sin embargo, se verificó una tendencia opuesta en el saco del golfo de Cariaco. Los valores bajos de diversidad de copépodos obtenidos en el sector oriental del golfo de Cariaco coinciden con lo encontrado por Magalháes et al. (2009) en el estuario de Curuçá, Brasil (0,5-2,7 bits/ind-1) y por Ruíz-Pineda et al. (2016) en el sistema estuarino de la bahía de Chetumal, México (1,1-1,8 bits/ind-1).
La equidad a diferencia de la diversidad, si presentó diferencia estacional; no obstante, siguió el mismo patrón de la diversidad, con valores más altos en lluvia. Esta situación coincidió con un incremento en la frecuencia y abundancia de los géneros de hábitos estuarinos Labidocera, Pseudodiaptomus y Saphirella y podría ser el resultado de un fenómeno de "deriva" del zooplancton proveniente del mar Caribe adyacente. De acuerdo con Bradford-Grieve et al. (1999) y Ordóñez-López y Ornelas-Roa (2003) estos géneros con su condición estuarina-costera son frecuentes en el zooplancton costero y su presencia en el saco del golfo de Cariaco indica intercambio de fauna entre los ambientes estuarinos y marinos. El ligero aumento de los índices ecológicos del zooplancton en la época de lluvias apoya esta hipótesis.
Por consiguiente, se evidenció que durante la época de lluvias se incrementó significativamente el número de individuos y la ocurrencia de ciertas especies. Esto también fue registrado en varios sistemas estuarinos tropicales, registrando densidades altas durante la temporada de lluvias, como por ejemplo el trabajo de Sterza y Fernandes (2006) en la bahía Vitória, sureste de Brasil, el de Garboza da Costa et al. (2008) y Da Costa et al. (2011) en el estuario Taperaçu y Caeté, respectivamente, norte de Brasil. De hecho, estudios sobre la comunidad de copépodos realizados en zonas estuarinas de regiones tropicales y subtropicales, mencionados anteriormente, coinciden en que la salinidad es el factor determinante en la distribución espacial de algunas especies mientras que factores como la lluvia, la temperatura y el oxígeno disuelto pueden determinan la distribución temporal (Villate et al., 2017).
Diversos trabajos han discutido largamente la relación de los zooplanctéres y el ambiente estuarino, sin embargo es evidente que la abundancia de las poblaciones cambian (Day et al., 1989; Ordóñez-López y Ornelas-Roa, 2003). En este sentido, el gradiente halino, la temperatura y la descarga de agua dulce no fueron los únicos factores que determinaron los patrones de distribución de los copépodos planctónicos, es probable que factores biológicos como el flujo de estadios tempranos (naupliares o copepoditos), la competencia y la depredación tengan un papel importante en la variación de la abundancia de los organismos para las poblaciones de copépodos del saco del golfo de Cariaco. Estas presunciones también son apoyadas por Chaalali et al. (2013) y David et al. (2016), quienes mencionan que la coexistencia y dominancia de pocas especies en el mismo sistema podría ser explicado por las segregaciones espaciales y temporales causadas por las diferencias en las estrategias reproductivas y la dieta.
Los cambios mensuales y estacionales en el balance de la abundancia relativa de las principales especies de copépodos como se visualiza en las curvas de K-dominancia, influyeron directamente en el comportamiento de los índices ecológicos. En particular, los cambios en la contribución de A. tonsa en los períodos estudiados fueron responsables de las alteraciones en estos índices.
El presente estudio no ha mostrado, en el sector oriental del golfo de Cariaco, un claro patrón estacional en la abundancia, diversidad y la uniformidad de la comunidad de copépodos y los valores de salinidad, lo cual también se ha visualizado en el cluster y en el análisis de escalamiento multidimensional (MDS). Por lo tanto, el área estudiada puede considerarse espacialmente uniforme y estacionalmente homogéneo en relación a estos parámetros. Sin embargo, hay que mencionar que la comunidad de copépodos registró una mayor abundancia y riqueza de especies en el período de lluvias. Por lo tanto, investigaciones nuevas sobre la biomasa y estructura comunitaria de los copépodos en el saco del golfo de Cariaco, deben ser evaluadas para proporcionar una mejor comprensión de la estructura trófica de este ecosistema.
En definitiva, se sabe que los copépodos son particularmente sensibles a los cambios ambientales, ya sea como resultado de las condiciones ambientales naturales o por acción antropogénica (Li et al., 2000; Camatti et al., 2019). La interacción entre la actividad antropógena, el cambio climático y las comunidades planctónicas, centrándose en los cambios sistemáticos en la estructura comunitaria, en la abundancia y la distribución en las últimas décadas, es un tema global clave, así como los potenciales impactos socioeconómicos de estos cambios (Hays et al., 2005). En ambientes con constantes cambios, como el extremo oriental del golfo de Cariaco, por la influencia de la surgencia costera, la descarga de las aguas servidas y la sobrepesca, el monitoreo de la dinámica ecológica de las especies es de suma importancia. En particular, deben considerarse las modificaciones continuas de los ensamblajes de copépodos en respuesta a factores estresantes antropógenicos y ambientales. El monitoreo continuo del plancton actuará como investigación centinela para identificar futuros cambios en este complejo ecosistema fuertemente impactado y su red alimentaria relacionada que proporciona sustento a especies como la sardina (Sardinella aurita), el principal recurso pesquero en el golfo (Quintero et al., 2002).
AGRADECIMIENTOS
Los autores agradecen al personal de apoyo y técnicos del Instituto Oceanográfico de Venezuela que participaron en el trabajo de campo y laboratorio. La primera autora agradece al Consejo de Investigación de la Universidad de Oriente, por el apoyo económico a través del proyecto intitulado Estudio planctónico en el saco del golfo de Cariaco (CI-2-030601-1411/08).
REFERENCIAS
Ara, K. 2002. Variabilidad temporal y producción de Temoraturbinata (Copepoda: Calanoida) en el complejo estuarino-lagunar de Cananéia, São Paulo, Brasil. Sci. Mar., 66(4): 399-406. doi:10.3989/scimar.2002.66n4399. [ Links ]
Beisner, B.E. 2001. Plankton community structure in fluctuating environments and the role of productivity. Oikos. 95: 496-510. doi. 10.1034/j.1600-0706.2001.950315.x. [ Links ]
Bonilla, J., A. Márquez y B. Gamboa. 1985. Características geoquímicas en núcleos de sedimentos de la región nororiental y río Orinoco, Venezuela. Bol. Inst. Oceanogr. Venez., 24(1- 2): 43-61. [ Links ]
Bradford-Grieve, J., E.L. Markhaseva, C.E. Rocha y B. Abiahy. 1999. Copepoda. 869-1098. En: Boltovskoy, D. (Ed.). South Atlantic Zooplankton, Netherlands. Backhuys. 1706 p. [ Links ]
Branco, C.W., B. Kozlowsky-Suzuki and F.A. Esteves. 2007. Environmental changes and zooplankton temporal and spatial variation in a disturbed Brazilian coastal lagoon. Braz. J. Biol., 67: 251-262. doi.10.1590/S1519-69842007000200010. [ Links ]
Briceño, H., R. Buonocore, C. Sangronis, L. García, J. Rojas, J. Chirinos, A. González y C. López. 2009. Composición y abundancia del plancton de la Costa noreste de la bahía El Tablazo, Sistema de Maracaibo, Venezuela. Bol. Centro Invest. Bio., 43(4): 463-485. [ Links ]
Calliari, D., C.M. Andersen, P. Thor, E. Gorokhova and P. Tiselius. 2006. Salinity modulates the energy balance and reproductive success of co-occuring copepods Acartia tonsa and Acartia clause in different ways. Mar. Ecol. Prog. Ser., 312: 177-188. [ Links ]
Camatti, E., M. Pansera and A. Bergamasco. 2019. The copepod Acartia tonsa dana in a microtidal Mediterranean lagoon: history of a successful invasion. Water, 11(6): 1200. doi:10.3390/w11061200. [ Links ]
Campos-Hernández, A y E. Suárez-Morales. 1994. Copépodos pelágicos del golfo de México y mar Caribe. 1. Biología y Sistemática. Centro de Investigaciones de Quintana Roo. Conacyt. México. 398 p. [ Links ]
Caraballo, M. 1982. El golfo de Cariaco. Parte I. Morfología y batimetría submarina. Estructuras y tectonismo reciente. Bol. Inst. Oceanogr., 21(1 y 2): 13-35. [ Links ]
Cervetto, G., R. Gaudy and M. Pagano. 1999. Influence of salinity on the distribution of Acartia tonsa (Copepoda, Calanoida). J. Exp. Mar. Biol. Ecol., 239(1): 33-45. doi:10.1016/S0022-0981(99)00023-4. [ Links ]
Chaalali, A., G. Beaugrand, V. Raybaud, E. Goberville, V. David, P. Boëty and B. Sautour. 2013. Climatic facilitation of the colonization of an estuary by Acartia tonsa. PLoS ONE 8: e74531. doi:10.1371/journal.pone.0074531. [ Links ]
Clarke, K and R. Gorley. 2006. PRIMER v5 (and v6): User manual/tutorial. Plymouth: PRIMER-E. [ Links ]
Cochran, W.G. 1977. Sampling Techniques. (3rd edition). Wiley, New York. [ Links ]
Cronin L.E., J.D. Daiber and E.M. Hulbert. 1962. Quantitative seasonal aspects of zooplankton in the Delaware River Estuary. Chesapeake Sci., 3: 63-93. [ Links ]
Da Costa, R.M., P. Atique, K.G. Da Costa and L.C. Pereira. 2011. Seasonal and spatial variation in hydrological parameters and microzooplankton communities in an Amazonian estuary. J. Coastal. Res., (64): 1477-1481. [ Links ]
David, V., J. Selleslagh, A. Nowaczyk, S. Dubois, G. Bachelet, H. Blanchet, B. Gouillieux, N. Lavesque, M. Leconte, N. Savoye, B. Sautour and J. Lobry. 2016. Estuarine habitats structure zooplankton communities: Implications for the pelagic trophic pathways. Estuar. Coast. Shelf. S., 179: 99-111. doi:10.1016/j.ecss.2016.01.022. [ Links ]
Day. J.W., C.A. Hall, W.M. Kemp and A. Yanez-Arancibia. 1989. Estuarine ecology. John Wiley and Sons, New York. [ Links ]
Elliott, M. and A.K. Whitfield. 2011. Challenging paradigms in estuarine ecology and management. Estuar. Coast. Shelf. S., 94(4): 306-314. doi:10.1016/j.ecss.2011.06.016. [ Links ]
Escamilla, J.B., U. Ordóñez-López U y E. Suárez-Morales . 2011. Variabilidad espacial y estacional de Acartia (Copepoda) en una laguna costera del sur del golfo de México. Rev. Biol. Mar. Oceanogr., 46: 379-390. doi:10.4067/S0718-19572011000300008. [ Links ]
Eskinazi-Sant'anna, E.M. 2000. Estudo da dieta natural de Parvocalanus crassirostris, Paracalanus quasimodo, Temora stylifera e Temora turbinata (Copepoda, Calanoida), no Canal de São Sebastião (SP, Brasil). São Paulo, Tese (Doutorado em Oceanografia). Universidade de São Paulo. [ Links ]
Garboza da Costa, I.K., L.C. Carneiro y M. Da Costa. 2008. Short and long-term temporal variation of the zooplankton in a tropical estuary (Amazon region, Brazil). Bol. Mus. Para. Emílio Goeldi. Cienc. Nat., Belém. 3(2): 127-141. [ Links ]
Gómez, A. 1983. Pigmentos clorofílicos, producción primaria y abundancia planctónica en el canal de entrada a la laguna de La Restinga, Venezuela. Bol. Inst. Oceanogr. Venez., 22(1-2): 43-63. [ Links ]
Hays, G.C., A.J. Richardson and C. Robinson. 2005. Climate change and marine plankton. Trends Ecol. Evol., 20: 337-344. doi:10.1016/j.tree.2005.03.004. [ Links ]
Hwang, J.S., S. Souissi, L.C. Tseng, L. Seuront, F. Schmitt and L.S. Fang. 2006. A 5-year study of the influence of the northeast and southwest monsoons on copepod assemblages in the boundary coastal waters between the East China Sea and the Taiwan Strait. J. Plank. Res., 28(10): 943-958. doi:10.1093/plankt/fbl031. [ Links ]
Infante, J. y L. Urosa. 1986. Distribución vertical de copépodos en aguas deficientes de oxígeno. Bol. Inst. Oceanogr. Venez., 25(1-2): 175-194. [ Links ]
Kierboe, T. 2011.What makes pelagic copepods so successful? J. Plank. Res., 33(5): 677-685. [ Links ]
Krebs, C.J. 1999. Ecological methodology. Second edition. New York: Addison-Wesley. Educational Publishers, Inc., Menlo Park. 620 p. [ Links ]
Lambshead, P.J., H.M. Platt and K.M. Shaw. 1983. The detection of differences among assemblages of marine benthic species based on an assessment of dominance and diversity. J. Nat. Hist., 17: 859-874. [ Links ]
Legaré, E.H. 1961. Estudios preliminares del zooplancton en la región de Cariaco. Bol. Inst. Oceanogr. Venez., 1(1): 191-218. [ Links ]
Legendre, P. and L. Legendre. 1998. Numerical ecology. 2nd English Edition, Elsevier Science, Amsterdam. 852 p. [ Links ]
Li, M., A. Gargett and K. Denman. 2000. What determines seasonal and interannual variability of phytoplankton and zooplankton in strongly estuarine systems? Application to the semi enclosed estuary of Strait of Georgia and Juan de Fuca Strait. Estuar. Coast. Shelf. Sci., 50: 467-488. [ Links ]
López-Monroy, F. y L. Tróccoli. 2015. Aproximación sobre la climatología de la isla de Margarita y su importancia en los procesos oceánicos. Saber, 26(4): 467-471. [ Links ]
López-Peralta, R.H. y L.H. Mojica-López. 2015. Influencia abiótica sobre algunos géneros de copépodos (Crustacea) epipelágicos en el pacífico colombiano. Septiembre de 2002. Revista Fac. Ciencias B. Universidad Militar Nueva Granada, 11(1): 20-33. [ Links ]
Lorenzoni, L., G.T. Taylor, C. Benítez, D.A. Hansell, E. Montes, R. Masserini, K. Fanning, R. Varela, Y. Astor, L. Guzmán and F. Muller-Karger. 2013. Spatial and seasonal variability of dissolved organic matter in the Cariaco Basin. J. Geophys. Res-Biogeo., 118:951-962. doi.org/10.1002/jgrg.20075. [ Links ]
Magalhães, A., L.C. Pereira and R.M. Costa. 2015. Relationships between copepod community structure, rainfall regimes, and hydrological variables in a tropical mangrove estuary (Amazon coast, Brazil). Helgol. Mar. Res., 69(1): 123-136. https://doi.org/10.1007/s10152-014-0421-4. [ Links ]
Magalhães, A ., N. Leite, J.G. Silva, L.C. Pereira and R.M. Da Costa . 2009. Seasonal variation in the copepod community structure from a tropical Amazon estuary, Northern Brazil. An. Acad. Bras. Ciênc., 81(2): 187-197. [ Links ]
Marques, S.C., U.M. Azeiteiro, J.C. Marques, J. Neto and M.A. Pardal. 2006. Zooplankton and ichthyoplankton communities in a temperate estuary: spatial and temporal patterns. J. Plank. Res., 28(3): 297-312. doi:10.1093/planktfbi126. [ Links ]
Márquez, A., W. Senior, A. Benítez, I. Fermín, G. Martínez, A. González, J. Castañeda, L. Alcalá y R. De la Cruz. 2011. Sector oriental del golfo de Cariaco, Venezuela. Una descripción de su dinámica hidroquímica, procesos y del rol de la surgencia costera estacional. Bol. Inst. Oceanogr. Venez., 50(2): 255-272. [ Links ]
Márquez-Rojas, B., B. Marín, E. Zoppi y C. Moreno. 2006. Zooplancton del golfo de Cariaco. Bol. Inst. Oceanogr. Venez., 45(1): 61-78. [ Links ]
Márquez-Rojas, B ., E. Zoppi de Roa, L. Tróccoli y E. Montiel. 2017. Cambios estructurales del mesozooplancton en relación a las condiciones hidrográficas en el golfo de Cariaco, Venezuela. Biota Colombiana 18(1): 148-171. DOI: 10.21068/c2017.v18n01a9. [ Links ]
Márquez-Rojas, B ., L. Tróccoli , L. Marcano, J. Morales, T. Allen, B. Marín y R. Díaz. 2011. Estructura comunitaria del zooplancton en dos localidades del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 45(1): 61-78. [ Links ]
Márquez-Rojas, B ., O. Díaz-Díaz, L. Tróccoli , J. Morales y L.M. Marcano. 2014a. Corycaeidae Dana, 1852 (Copepoda: Poecilostomatoida) del golfo de Cariaco, Venezuela. MES., 9(3): 1-18. [ Links ]
Márquez-Rojas, B ., O. Díaz-Díaz , L. Tróccoli , J. Morales y L.M. Marcano . 2014b. Distribución espacial y abundancia de la Familia Corycaeidae Dana, 1852 (Copepoda: Poecilostomatoida) en el golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 53(2): 221-233. [ Links ]
Martínez, G., D. Hernández, A. Quintero, A. Márquez, W. Senior y A. González . 2011. Estudio fisicoquímico de las aguas del sector oriental del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 50(2): 273-287. [ Links ]
Martínez-Barragán, M., J. Medina-Calderón, A. Franco-Herrera y A. Santos-Martínez. 2009. La comunidad de copépodos (Crustacea) en las islas de Providencia y Santa Catalina (Caribe colombiano) durante el período lluvioso de 2005. Bol. Invest. Mar. Cost., 38(1): 85-103. [ Links ]
Mauchline, J. 1998. The Biology of Calanoid copepods. Advaces in Marine Biology. V. 33, Academic Press, New York. 710p. [ Links ]
Mclusky, D.S. and M. Elliott. 2004. The estuarine ecosystem: ecology, threats and management. Oxford University Press, New York. 216 p. [ Links ]
Mwaluma, J., M. Osore, J. Kamau and P. Wawiye. 2003. Composition, abundance and seasonality of zooplankton in Mida Creek, Kenya. Western Indian Ocean J. Mar. Sci., 2(2): 147-155. doi:10.4314/wiojms.v2i2.28440. [ Links ]
Neumann-Leitão, S., P.A. Melo, R. Schwamborn, X.F. Diaz, L.G. Figueiredo, A.P. Silva and M. Araújo. 2018. Zooplankton from a reef system under the influence of the Amazon River plume. Front. Microbiol., 9: 355-361. doi:10.3389/fmicb.2018.00355. [ Links ]
Okuda, T., J. Bonilla, J . Benítez, A. García y G. Cedeño. 1978. Características hidrográficas del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez., 17(1-2): 69-88. [ Links ]
Ordóñez-López, U. y M. Ornelas-Roa. 2003. Variación de la comunidad de copépodos pláncticos en el gradiente estuarino-costero de Celestún, Yucatán, México. Hidrobiológica, 13: 231-238. [ Links ]
Osore, M.K., J.M. Mwaluma, F. Fiers and M.H. Daro. 2004. Zooplankton composition and abundance in Mida Creek, Kenya. Zool. Stud., 43(2): 415-424. [ Links ]
Paffenhõfer, G. 1991. Some characteristics of abundant subtropical copepods in estuarine, shelf and oceanic waters. Proc. 4th International Conference on Copepoda. Bull. Plank. Soc. Jpn. Spec., l: 201-216. [ Links ]
Peck, N., J. Peters, R. Diekmann, S. Laakmann and J. Renz. 2015. Interactive effects of temperature and salinity on populations of the calanoid copepod Acartia tonsa. J. Plank. Res., 37(1): 197-210. doi:10.1093/plankt/fbu093. [ Links ]
Quintero, A., G. Terejova, G. Vicent, A. Padrón y J. Bonilla J. 2002. Los pescadores del golfo de Cariaco. Interciencia, 27(6): 286-292. [ Links ]
Razouls, C., F. De Bovée, J. Kouwenberg y N. Desreumaux. 2005-2019. Diversity and geographic distribution of marine planktonic copepods. http://copepodes.obs-banyuls.fr/en.19/07/2019. [ Links ]
Rey, J.R., T. Kain, R. Crossman, M. Peterson, J. Shaffer y F. Vose. 1991. Zooplankton of impounded marshes and shallow areas of a subtropical lagoon. Florida Scientist., 54(3-4): 191-203. [ Links ]
Rice, E., H.G. Dam y G. Stewart. 2015. Impact of climate change on estuarine zooplankton: surface water warming in long island sound is associated with changes in copepod size and community structure. Estuaries and Coasts, 38:13-23. doi:10.1007/s12237-014-9770-0. [ Links ]
Rose, T.H., J.R. Tweedley, R.M. Warwick y I.C. Potter. 2019. Zooplankton dynamics in a highly eutrophic microtidal estuary. Mar. Pollut. Bull., 142: 433-451. https://doi.org/10.1016/j.marpolbul.2019.03.047. [ Links ]
Ruíz-Pineda, C., E. Suárez-Morales y R. Gasca. 2016. Copépodos planctónicos de la bahía de Chetumal, Caribe mexicano: variaciones estacionales durante un ciclo anual. Rev. Biol. Mar. Oceanogr., 51(2): 301-316. doi: 10.4067/S0718-19572016000200008. [ Links ]
Seda, J. and M. Devetter. 2000. Zooplankton community structure along a trophic gradient in a canyon-shaped dam reservoir. J. Plank. Res., 22(10): 1829-1840. doi:10.1093/plankt/22.10.1829. [ Links ]
Sheskin, D. 2004. Parametric and nonparametric statistical procedures. 4ed. Boca Ratón, Florida: Chapman & Hall. 585 p. [ Links ]
Simpson, J. y R. Griffith. 1967. La distribución de densidad pesquera en el golfo de Cariaco, Venezuela. Serie: Recursos y explotación pesqueros, 1(8): 305-320. [ Links ]
Sterza, J.M. and L. Fernandes. 2006. Zooplankton community of the Vitória Bay estuarine system (Southeastern Brazil). Characterization during a three-year study. Braz. J. Oceanogr., 95-105. doi: 10.1590/S1679-87592006000200001. [ Links ]
Strickland, J.D. and T.R. Parsons. 1972. A practical handbook of seawater analysis. 2ed. J. Fish. Res. Board. Can. Bulle. 167 p. [ Links ]
Suárez-Morales, E. 1995. Clave ilustrada para la identificación de los copépodos pláncticos de la bahía de Chetumal. Ava. Cient., 12: 16-24. [ Links ]
Teiguel-C, N.K. 2015. Efecto del estrés halino en la tasa de crecimiento y Reproducción de Acartia tonsa en el estuario del río Valdivia. Universidad Austral de Chile. Tesis de maestría. Chile. 177 p. [ Links ]
Ter Braak, C.J. and P.E. Verdonschot. 1995. Canonical correspondence analysis and related multivariate methods in aquatic ecology. Aquat. Sci., 57(3): 255-289. [ Links ]
Vásquez-Yeomans, L., I. Castellanos, E. Suárez-Morales y R. Gasca . 2012. Variación espacio-temporal de la biomasa de zooplancton en un sistema estuarino del Caribe Occidental durante dos ciclos anuales. Rev. Biol. Mar. Oceanogr., 47(2): 213-225. doi.org/10.4067/S0718-19572012000200005. [ Links ]
Villalba, W., Márquez-Rojas, B ., L. Tróccoli , M. Alzolar y J. López. 2017. Composición y abundancia del zooplancton en la laguna El Morro, isla de Margarita, Venezuela. Rev. Peru. Biol., 24(4): 343-356. doi: http://dx.doi.org/10.15381/rpb.v24i4.14062. [ Links ]
Villate, F., A. Iriarte, I. Uriarte and I. Sánchez. 2017. Seasonal and interannual variability of mesozooplankton in two contrasting estuaries of the Bay of Biscay: Relationship to environmental factors. J. Sea Res., 130: 189-203. doi:10.1016//.seares.2017.05.002. [ Links ]
Vukanic, V., N. Glisovic, T. Jaksic, N. Zivic y D. Vukanic. 2018. Seasonal abundance of copepods in the Bojana Estuary (Southeastern Adriatic Sea). Fresen Environ Bull., 27: 7209-7221. [ Links ]
Zar, J.H. 1999. Biostatistical Analysis, 4th ed., Prentice Hall, Englewoods Cliff, New Jersey. 699 p. [ Links ]
Zoppi, E. 1961. Distribución vertical del zooplancton en el golfo y extremo este de la fosa de Cariaco. Bol. Inst. Oceanogr. Venez., 1(1): 219-248. [ Links ]
Zoppi, E. 1974. Comparación de algunas características del plancton entre las lagunas costeras de Tacarigua y Unare, Venezuela. Bol. Inst. Oceanogr. Venez., 13(1-2): 129-146. [ Links ]
Recibido: 26 de Agosto de 2019; Aprobado: 29 de Abril de 2020











 texto en
texto en