Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta Jan./June 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.778
Artículos de Investigación
Variación espacio-temporal de larvas de peces en el golfo de Guayaquil, Ecuador
1 Instituto Nacional de Pesca. Guayaquil, Ecuador.
2 Lab. Ictioplancton. Guayaquil, Ecuador.
Este estudio presenta la densidad, composición taxonómica, distribución espacial y temporal de larvas de peces en el golfo de Guayaquil, así como la relación con algunas variables físico-químicas. Se recolectaron muestras en 16 estaciones, tomadas en la primera milla náutica del estuario externo e interior del golfo, ubicadas frente a la provincia de Guayas y noroeste de la isla Puná, durante junio a diciembre de 2012. Se realizaron arrastres superficiales con una red cónica simple (ojo de malla: 300 μm; diámetro de boca: 0,3 m; largo: 1,2 m). La temperatura, salinidad y transparencia fueron medidas antes de cada arrastre. Se detectaron diferencias significativas entre zonas, registrando mayor temperatura, menor salinidad y transparencia en el estuario interior. Se colectaron 321 638 ind/100m3 de larvas de peces, pertenecientes a 13 familias y 36 especies entre la zona externa e interna. Engraulidae (58,9 %) fue la familia más abundante en las estaciones del estuario exterior, seguida de Sciaenidae (22,8 %) y Haemulidae (9,6 %). Las familias más frecuentes en el estuario interior fueron Engraulidae (74,4 %) y Gobiidae (16,1 %). El 85 % de la densidad total fue aportada por cinco especies, de las cuales Anchoa sp. y Bairdiella sp. fueron las más abundantes y dominantes, principalmente durante diciembre. La estructura y composición de la comunidad larvaria fue significativamente diferentes entre áreas (MW-U = 450; p < 0,05) y meses de muestreo (KW = 14,24; p < 0,05), con mayores registros en el estuario exterior durante diciembre. Con el análisis de redundancia (ADR) se observa que, en el área externa, las especies estuvieron asociadas con la transparencia del agua, mientras que las especies que concurrieron en la zona interna se relacionaron positivamente con la salinidad. En términos generales, la abundancia y riqueza de larvas de peces en el área externa del golfo de Guayaquil está relacionada con las condiciones de transparencia y salinidad local, las cuales favorecieron a la presencia larval.
PALABRAS CLAVE: ictioplancton; golfo de Guayaquil; variables hidrográficas; estuario; Ecuador
This study presents the density, taxonomic composition, spatial and temporal distribution of fish larvae in the Gulf of Guayaquil, as well as the relationship with some physical-chemical variables. Samples were collected at 16 stations, taken in the first nautical mile of the external and internal estuary of the gulf, located in front of the province of Guayas and northwest of the island of Puná, during June to December 2012. Surface trawls were carried out with a simple conical network (mesh eye: 300 μm; mouth diameter: 0.3 m; length: 1.2 m). Temperature, salinity, and transparency were measured before each drag. Significant differences were detected between zones, registering higher temperatures, lower salinity, and transparency in the interior estuary. 321 638 ind/100m3 of fish larvae were collected, belonging to 13 families and 36 species between the external and internal zone. Engraulidae (58.9 %) was the most abundant family in the exterior estuary stations, followed by Sciaenidae (22.8 %) and Haemulidae (9.6 %). Most frequent families in the interior estuary were Engraulidae (74.4 %) and Gobiidae (16.1 %). 85 % of the total density was contributed by five species, of which Anchoa sp. and Bairdiella sp. were the most abundant and dominant, mainly during December. Structure and composition of the larval community were significantly different between areas (MW-U = 450; p < 0.05) and months of sampling (KW = 14.24; p < 0.05), with higher records in the exterior estuary during December. With the redundancy analysis (ADR) it is observed that in the exterior area, the species were associated with the transparency of the water, while the species that concurred in the interior zone were positively related to salinity. In general terms, the abundance and richness of fish larvae in the external area of the Gulf of Guayaquil is related to the conditions of transparency and local salinity, which favored the larval presence.
KEYWORDS: ichthyoplankton; gulf of Guayaquil; hydrographic variables; estuary; Ecuador
INTRODUCCIÓN
El golfo de Guayaquil constituye el rasgo geomorfológico más singular de todo el perfil de la costa ecuatoriana. Se trata de una región oceánica y otra costera dividida en dos grandes sistemas estuarinos con propiedades fisiográficas, geológicas y oceanográficas, características representadas por su alta productividad, baja diversidad y un pronunciado estrés ambiental, dominado por impredecibles fluctuaciones de salinidad (Comisión Asesora Ambiental [CAAM], 1995).
Los estuarios juegan un rol destacado en el ciclo vital de muchas poblaciones marinas (Ketchum, 1992). Son identificados como sitios importantes de crianza, dada la disponibilidad apropiada de áreas para refugio y/o alimentación, lo cual genera condiciones favorables para el asentamiento de larvas y juveniles de diferentes organismos acuáticos de valor económico (Barletta et al., 1998, 2003; Able et al., 1999) como crustáceos, moluscos y peces. Estos últimos están considerados como uno de los grupos más importantes, puesto que desempeñan roles ecosistémicos significativos tales como transformación del potencial energético del detritus, transferencia de energía entre diferentes niveles de las redes tróficas y balance de energía entre ecosistemas vecinos (Yánez-Arancibia y Nugent, 1977; Beck et al, 2001).
Las comunidades de peces estuarinos representan una combinación de especies de agua dulce y marina, que viven en el límite de su distribución, residentes estuarinos y especies migratorias que atraviesan el estuario con fines reproductivos o tróficos (Maes et al., 1998). La distribución de sus etapas planctónicas está determinada en conjunto por diversos factores fisicoquímicos, ciclo de mareas y corrientes, dado que las larvas al permanecer suspendidas en la columna de agua están en mayor grado relacionadas a los movimientos de los ciclos mareales. De igual modo, están sujetas a los ciclos anuales de maduración de los adultos conjuntamente con sus estrategias reproductivas, ya que más del 80 % de los peces litorales utilizan el estuario en alguna de sus etapas de madurez y/o desarrollo (Yáñez-Arancibia y Nugent, 1977). La gran mayoría entran al estuario como larvas, desde ambientes marinos adyacentes; otros peces desovan dentro del estuario hasta completar su ciclo de vida y lo abandonan siendo juveniles (Whitfield, 1999). Por ende, la composición del ictioplancton de un estuario es fluctuante a lo largo del tiempo y existe poca relación con la composición de adultos cuando se trata de especies no residentes. Dado esto, el conocimiento de la distribución temporal y espacial del ictioplancton es fundamental, no solo para el entendimiento de las fluctuaciones poblacionales de los adultos y sus áreas potenciales de desove, sino también para comprender el funcionamiento general del ecosistema estuarino (Moser y Smith, 1993a; Cowan y Shaw, 2002; Ottersen et al., 2010) y la recurrencia de las especies en este sistema.
En Ecuador, se han desarrollado variadas investigaciones taxonómicas de larvas de peces marinos, pudiendo establecer su distribución y abundancia. Los trabajos de Cajas e Hinostroza (1981), Peribonio et al. (1981), García (1983), Ortega et al. (1996), Luzuriaga de Cruz et al. (1998), Torres et al. (2003-2004) y Calderón et al. (2018) enfatizan al golfo de Guayaquil como un área productiva, siendo particularmente al sur de la isla Puná donde se presenta la mayor dominancia de huevos y larvas de peces primordialmente de interés comercial, y que se extiende al norte del golfo hacia la costa y al sur del océano, donde según Jiménez y Bonilla (1980) existe una relación entre el patrón de distribución del fitoplancton con el del ictioplancton. Recientemente, Salcedo y Coello (2018), en su trabajo sobre la dinámica del plancton frente a la provincia de El Oro, reportan la dominancia de larvas de peces de la familia Engraulidae con dos períodos de abundancia, de junio a agosto y de octubre a diciembre, resultado de las concentraciones de Anchovia macrolepidota, la especie característica de este ecosistema. El presente trabajo de investigación determinó los patrones de densidad y distribución (espacial y temporal) de larvas de peces en el estuario interior y exterior adyacente del golfo de Guayaquil, evaluando su relación con las condiciones locales de temperatura, salinidad y transparencia, durante junio a diciembre de 2012, meses que caracterizan a la época seca y de transición en el Ecuador.
MATERIALES Y MÉTODOS
Área de estudio
La provincia del Guayas está ubicada al suroeste de Ecuador y recibe la influencia de varias corrientes marinas, especialmente la fría de Humboldt durante la época seca, de julio a noviembre, y la cálida de El Niño en la época lluviosa, de enero a mayo, mientras que junio y diciembre son considerados meses de transición (Twilley et al., 2001; Prado et al., 2015), los cuales producen un clima de tipo tropical sabana y tropical monzón con temperaturas promedio de 25° C y precipitaciones anuales entre 500 a 1000 mm (Twilley et al., 2001). En el margen costero de esta provincia, está ubicado el golfo de Guayaquil (3° S. 80° W), principal estuario del Pacífico sudeste, el cual se divide en dos áreas específicas: una denominada estuario exterior, región oceánica abierta influenciada por las masas de aguas del pacífico tropical, que se inicia a la altura de la puntilla de Santa Elena y posee como límite la plataforma a lo largo del meridiano 81° W hasta el lado occidental de la isla Puná (80° 15' W), con predominio de cordones litorales y acantilados altos e inestables (Ayón, 1987). Por otra parte, el estuario interior, conocido como el estuario del río Guayas, se encuentra conformado al noroeste por el estero Salado y al sureste por el estero Churute, que recibe los aportes de los ríos Taura y Churute (Cucalón, 1996), regido principalmente por las mareas, la descarga fluvial y el esfuerzo del viento, con abundancia de manglar que le da un aspecto de un gran pantano (CAAM, 1995). En términos generales, la profundidad del golfo de Guayaquil en la plataforma continental va desde 180 m en el borde occidental hasta menos de 20 m en la parte interior (Montaño-Armijos y Sanfeliu-Montolio, 2008).
Muestreo
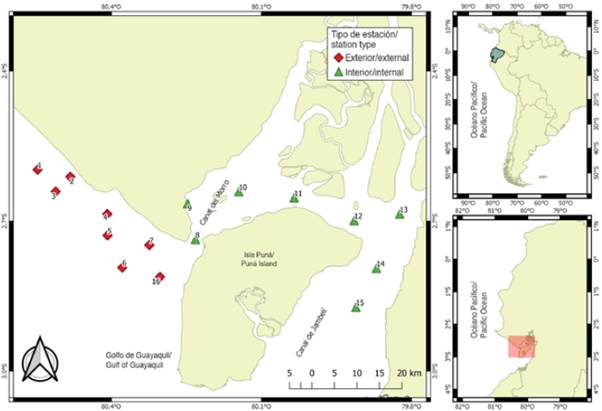
El material proviene de 112 muestras de zooplancton recolectadas en 16 estaciones de muestreo, ubicadas a 1 mn (1,8 km) de distancia del margen costero frente a la provincia del Guayas y el noroeste de la isla Puná, durante el período de época seca (julio a noviembre) y transición (junio y diciembre) de 2012. Las estaciones fueron seleccionadas por su importancia como áreas de actividad reproductiva de peces y categorizadas en función de su ubicación: la zona interna o estuario interior, representada por ocho (8,9,10,11,12,13,14 y 15) estaciones someras y cercanas a la influencia de estuarios y ríos, y la zona externa o estuario exterior por ocho (1,2,3,4,5,6,7 y 16) estaciones con mayor influencia marina (Figura 1).
En cada estación se efectuaron registros verticales de temperatura y salinidad con un perfilador de CTD marca Sea-Bird, modelo Seacat S19V2, y la transparencia del agua se determinó con un disco Secchi (m). Las muestras de zooplancton fueron colectadas durante marea alta mediante arrastres superficiales (0-1 m de profundidad), diurnos (entre las 08:00 y 11:00 horas), circulares, con una duración de 5 min y a una velocidad de 3,7 km/h a bordo de una embarcación con motor fuera de borda. Se utilizó una red cónica simple de 30 cm de diámetro, 1,2 m de longitud y 300 μm de abertura de malla. En la boca de la red se adosó un flujómetro General Electric® para cuantificar el volumen de agua filtrada y estandarizar la abundancia por unidad de volumen. Las muestras de zooplancton fueron fijadas en una solución de formalina con agua de mar a una concentración final de 4 % y se transportaron al Laboratorio de Ictioplancton del Instituto Nacional de Pesca (Guayaquil, Ecuador).
Análisis de laboratorio
Se revisó la totalidad de cada una de las muestras. Se separaron, contaron y estandarizaron a número de individuos/100 m3 de superficie marina, a partir del método descrito por Smith y Richardson (1979). Las larvas fueron identificadas hasta el menor nivel taxonómico posible, siguiendo los criterios establecidos en Moser (1996), Beltrán-León y Ríos (2000-2001), Richards (2005) y Calderón (2011).
Análisis de datos
Se evaluaron las diferencias de la variabilidad hidrográfica y la abundancia de larvas de peces, considerando como factor de variabilidad en el espacio las zonas de estudio (interna y externa) y utilizando la prueba paramétrica de Mann Whitney (MW-U) (Sheskin, 2004) mediante el programa Statgraphics Plus 5,1.
Con los datos cuantitativos se procedió al cálculo de la abundancia relativa de las familias y especies de larvas de peces por meses y zonas de estudio. La estimación de la riqueza especifica (S), diversidad (H') y equidad (J') de la comunidad larvaria se describió mediante los índices de atributos comunitarios de Shannon-Weaver (Shanon y Weaver, 1963) y Pielou utilizando el logaritmo base 2 (Tsirstsis y Karydis, 1998; Krebs, 1999) con una unidad de bits/Ind y desarrollado con el software estadístico de libre acceso Past 3,0. Además, se utilizó el método de interpolación "inverso a la distancia" con el programa computacional QGIS® 3,0 para representar la variación espacial de la abundancia de larvas de peces y las condiciones oceanográficas en el área para la época de estudio.
Para establecer posibles diferencias en la estructura comunitaria de larvas de peces entre zonas, se utilizó el análisis multidimensional no paramétrico (MDS-Anosim), y para determinar el aporte de las especies entre zonas, se obtuvo el porcentaje de similaridad Simper. Todos los análisis multivariados se realizaron mediante el software Past 3,0 (Hammer et al, 2001). Por último, se evaluó el grado de relación entre la estructura establecida del ensamblaje de larvas de peces y las condiciones físico-químicas por cada zona de estudio utilizando un análisis de redundancia (RDA) desarrollado con el software estadístico de libre acceso PcOrd 6,0 (McCune y Grace, 2002). Esta prueba de asociación multivariada maximiza el grado de correlación entre la abundancia de larvas peces y los parámetros físico-químicos.
RESULTADOS
Condiciones ambientales
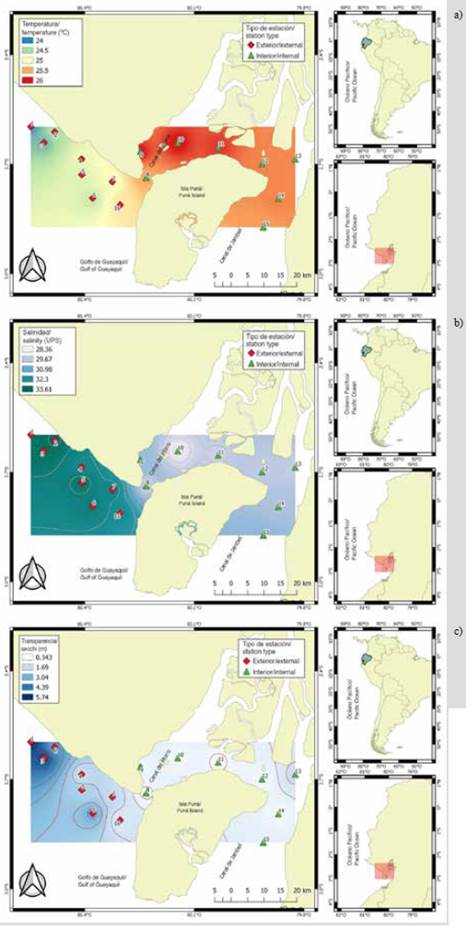
La variabilidad de la temperatura superficial del mar (TSM) permitió identificar diferencias significativas (MW-U: 2632; p < 0,05) entre las zonas de estudio (Figura 2; Tabla 1) y los mayores registros promedios en el estuario interior (25,7 °C), principalmente en las estaciones cercanas al canal del Morro (estación nueve, 10 y 11) (Figura 3a). La variación temporal de la TSM mostró un promedio de 25,2 °C (± 0,71) con el valor mínimo (24,3 °C) en agosto y el máximo (26,5 °C) en junio. En conjunto, los meses de la época de transición (junio y diciembre) registraron los valores más altos de temperatura superficial del mar (26,1-25,5 °C) (Figura 2a y Figura 2b).
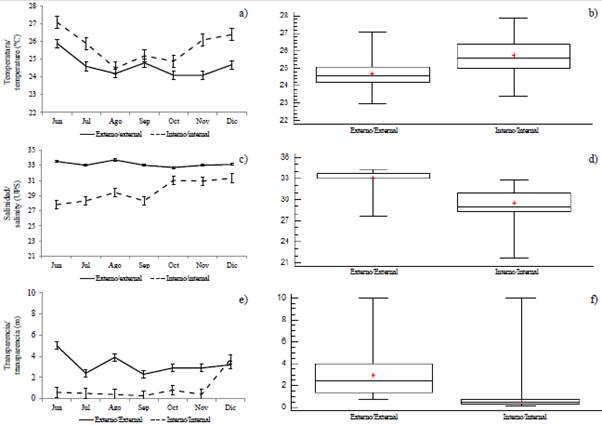
Figura 2 Variación mensual y por zonas: a y b) temperatura, c y d) salinidad, e y f) transparencia, en el estuario exterior e interior del golfo de Guayaquil frente a la provincia del Guayas entre junio y diciembre de 2012. La línea horizontal corresponde a la mediana y el punto al promedio.
Tabla 1 Parámetros físico-químicos registrados en el estuario exterior e interior del golfo de Guayaquil frente a la provincia del Guayas entre junio y diciembre de 2012. |i: promedio, D.s.: desviación estándar, Min: valor mínimo registrado. Max: valor máximo registrado. W: valor de Wilcoxon, p: valor de probabilidad.
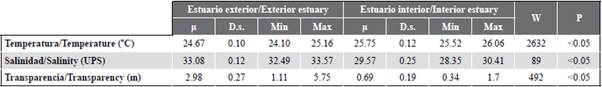
La salinidad presentó diferencias significativas (Figura 2; Tabla 1) entre zonas de muestreo (MW-U: 89; p < 0,05), con los menores registros en el estuario interior, principalmente en las estaciones ocho y diez. En el estuario exterior, los máximos valores de salinidad se registraron en las estaciones dos y tres, ubicadas cerca de la costa de Santa Elena y con mayor aporte marino (Figura 3b). La salinidad promedio de junio a diciembre fue de 31,4 (± 0,7) con rangos de 30,7 a 32,2 ups, con el mínimo en junio, julio y agosto, y el máximo en noviembre (Figura 2c y Figura 2d).
La transparencia del agua mostró un promedio de 2,0 m (± 2,4), con diferencias significativas (Figura 2, Tabla 1) entre zonas (MW-U: 120; p < 0,05), con los menores registros en el estuario interior, principalmente en las estaciones ubicadas en la boca del canal del Morro (8, 9, 10) y el canal Cascajal (11 y 12) (Figura 3c). En los meses estudiados, la transparencia mostró el menor registro (1,3 m) en julio y el máximo (2,6 m) en junio (Figura 2g y Figura 2h). En general, se observó la zona externa con menor temperatura, pero con mayor salinidad y transparencia con respecto a la zona interna del golfo de Guayaquil (Figura 3, Tabla 1).
Estructura comunitaria de larvas de peces
Se cuantificaron un total de 321 638 larvas/100 m3, con diferencias significativas entre las zonas de muestreo (MW-U: 450; p < 0,05) (Figura 4). La distribución espacial mostró mayores densidades larvales promedio hacia el estuario exterior (8 458 larvas/100 m3, ± 25 215), con máximos (122 648 larvas/100 m3) en la estación siete y mínimos (16 376 larvas/100 m3) en la estación cinco. El estuario interior, con un promedio de 2 272 larvas/100 m3 (± 4 967), registró la máxima densidad en la estación ocho, ubicada en la bocana del canal del Morro, con 8 676 larvas/100 m3 y menor densidad en la estación nueve con 906 larvas/100 m3 (Figura 4).
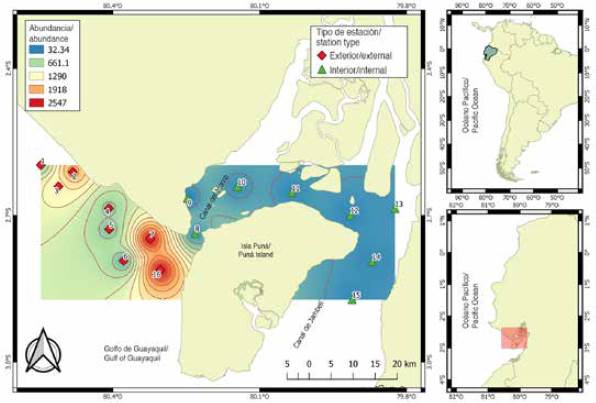
Figura 4 Variabilidad espacial de la abundancia de larvas de peces en el estuario exterior e interior del golfo de Guayaquil frente a la provincia del Guayas.
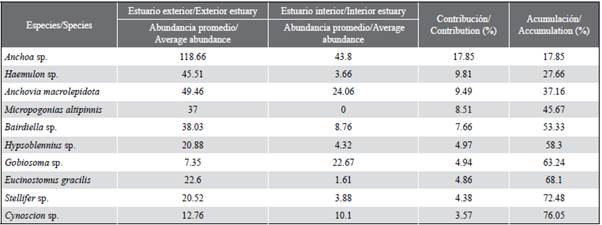
La abundancia larval mostró variaciones temporales, con diferencias significativas entre los meses (KW=14,24; p < 0,05). Las máximas densidades de larvas correspondieron a diciembre (121 220 larvas/100 m3) y julio (107 631 larvas/100 m3), mientras que la mínima fue registrada en noviembre (6 690 larvas/100 m3). El patrón general exhibió mayores abundancias hacia el estuario exterior del golfo de Guayaquil, enmarcada hacia el inicio de la época seca (julio) y de transición (diciembre) (Figura 5a y Figura 5b). Las especies larvales que caracterizaron la zona externa e interna fueron Anchoa sp. y Bairdiella sp., con altos valores durante diciembre, en tanto que Gobiosoma sp. y Haemulon sp. registraron máximas densidades durante julio, y Anchovia macrolepidota en agosto (Tabla 2).
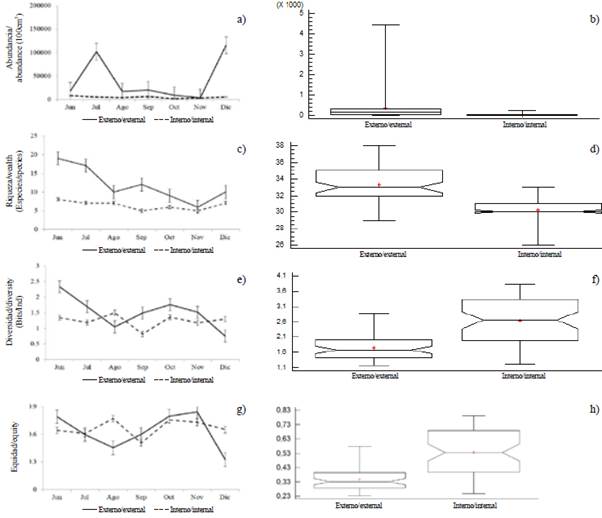
Figura 5 Variación mensual de a y b) abundancia, c y d) riqueza, e y f) diversidad y g y h) equidad del ictioplancton en la zona externa y estuario interior del golfo de Guayaquil frente a la provincia del Guayas entre junio y diciembre de 2012. La línea horizontal corresponde a la mediana y el punto, a promedio.
Tabla 2 Lista taxonómica de larvas de peces encontrados en el estuario exterior (E) e interior (I) del golfo de Guayaquil, durante julio a diciembre de 2012. Se indican la abundancia relativa (Ar. %) y meses de ocurrencia de las larvas recolectadas las dos zonas de estudio.
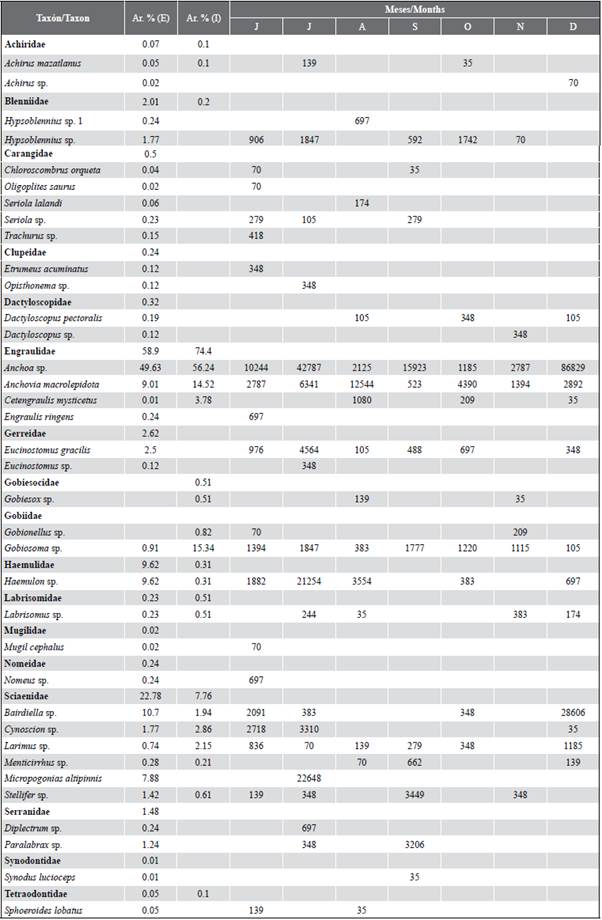
Se identificó un total de 17 familias y 36 especies, de las cuales 34 concurrieron en las estaciones del estuario exterior y 16 en el estuario interior (Tabla 2). Un total de tres familias (Engraulidae, Gobiidae y Sciaenidae) estuvieron presentes consistentemente durante todos los meses de estudio. Las muestras en la zona externa estuvieron dominadas por larvas de las familias Engraulidae (58,9 %), Sciaenidae (22,8 %) y Haemulidae (9,6 %), representadas por las especies Anchoa sp. (49,6 %), Bairdiella sp. (10,7 %) y Haemulon sp. (9,6 %), respectivamente. Mientras tanto, en el estuario interior, fueron Engraulidae (74,4 %) y Gobiidae (16,1 %) los grupos más abundantes y representados en este mismo sentido por Anchoa sp., (56,2 %), Anchovia macrolepidota (14,5 %) y Gobiosoma sp. (15,3 %). En general, los taxones Anchoa sp. (50,3 %). Bairdiella sp. (9,7 %) Anchovia macrolepidota (9,6 %), Haemulon sp. (8,6 %) y Gobiosoma sp. (7,0 %) representaron 85 % del total de la densidad larval para las dos zonas de estudio (Tabla 2).
La riqueza específica varió de 9 especies en noviembre a 20 en junio con un promedio temporal de 13 especies (± 3,89). Se observaron diferencias significativas entre zonas (MW-U: 325; p < 0,05), mostrando la mayor riqueza en el estuario exterior con similar tendencia que la abundancia larval registrada (Figura 5c y Figura 5d).
La diversidad larval (H') varió significativamente entre las zonas de estudio (MW-U: 2655; p < 0,05), registrándose valores mínimos en el estuario interno durante septiembre (0,81 bits/ind) y máximo en agosto (1,5 bits/ind). En el estuario exterior durante junio (2,32 bits/ind) se observó la mayor diversidad y en diciembre (0,74 bits/ind), la menor (Figura 5e y Figura 5f). En general, la diversidad observada en la zona interna tuvo un comportamiento más constante en el tiempo en comparación con las registradas en la zona externa (Figura 5e y Figura 5f).
La equidad mínima (0,31) se observó en diciembre y la máxima, en octubre (0,77). Entre zonas se presentaron diferencias significativas (MW-U: 2702, p < 0,05), mostrando una mayor homogeneidad en la zona estuarina (Figura 5g y Figura 5h).
Al explorar las relaciones de similitud (MDS Anosim) entre las comunidades de ictioplancton se establecieron diferencias significativas (R: 0,62; p < 0,05) entre las zonas externa e interna del golfo de Guayaquil. No obstante, se observa que hay especies que se encuentran en ambas zonas y muestran una mayor heterogeneidad en las estaciones internas con un estrés de 0,11 (Figura 6). Al realizar el análisis de porcentajes de similitud (Simper) para explorar los aspectos de la estructura interna de las zonas del estuario interior y exterior, se notaron diferencias entre las dos, distinguiéndose a Anchoa spp., Haemulon sp., Anchovia macrolepidota como las especies que más contribuyeron a separar las zonas (Tabla 3).
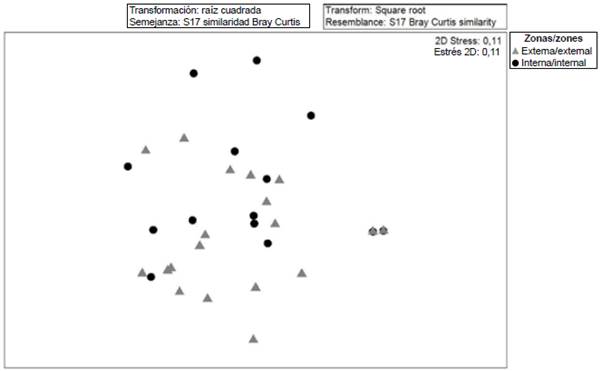
Figura 6 Diagrama de análisis de escalamiento multidimensional (MDS) de la estructura comunitaria de larvas de peces en el estuario exterior e interior del golfo de Guayaquil frente a la provincia del Guayas entre junio y diciembre de 2012.
Relación entre larvas de peces y variables ambientales
El análisis de redundancia (RDA) permitió estudiar la relación entre la estructura de ictioplancton y las variables ambientales del estuario interior y exterior. El RDA para la zona exterior explicó 14,0 % de la varianza total en los dos primeros ejes, con una correlación de Pearson de r = 0,50, indicando la correlación positiva de las especies y las variables ambientales (Tabla 4). El primer eje explicó 12,1 % de la varianza y presentó un eigenvalor de 0,54. La variable transparencia (m) registró correlación negativa alcanzando el valor de r = -0,63. El eje dos solo contribuyó con 1,9 % y presentó un eigenvalor de 0,50, registrando la salinidad con correlación negativa de r = -0,53 (Tabla 4). El diagrama de dispersión muestra que las especies como Etrumeus acuminatus, Achirus mazatlanus, Sphoroiedes lobatus, Oligoplites saurus Diplectrum sp., se asociaron a una mayor transparencia del agua. En tanto que las especies como Gobiosoma sp., Labrisomus sp., Larimus sp., Cynoscion sp., Synodus lucioceps, Eucinostomus gracilis, Seriola lalandi y Stellifer sp. se relacionaron con valores altos de salinidad (Figura 7a).
Tabla 4 Análisis de redundancia sobre la relación espacial de las especies de ictioplancton en el estuario exterior e interior del golfo de Guayaquil frente a la provincia del Guayas entre junio y diciembre de 2012.
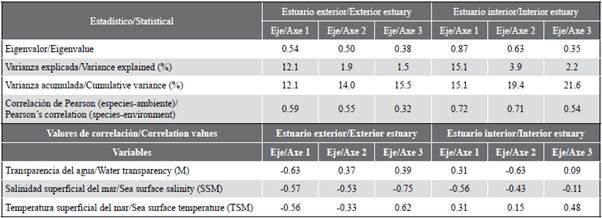
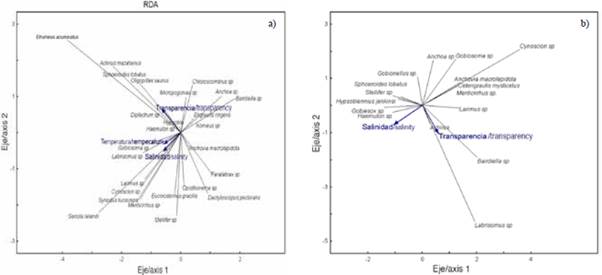
Figura 7 Diagrama de dispersión de larvas de peces en el estuario exterior a) y estuario interior b) del golfo de Guayaquil frente la provincia del Guayas entre junio y diciembre 2012. Temperatura (TSM). Salinidad (SSM). Transparencia (M).
Para la zona interna, el RDA explicó una varianza en los dos primeros ejes de 19,4 %, con un coeficiente de correlación de Pearson de r = 0,71. El primer eje fue el que más contribuyó con 15,5 % de la varianza explicada y un eigenvalor de 0,87 (Tabla 4). La variable salinidad registró correlación negativa con valor de r = -0,56. El eje dos tan solo aportó 3,9 % del total y presentó un eigenvalor de 0,63. La variable transparencia registró correlación negativa de r = -0,63 con respecto a este eje (Tabla 4). El diagrama de dispersión muestra que Gobiesox sp. y Haemulon sp. se asociaron con altas concentraciones de salinidad. Los taxas como Bairdiella sp., Labrisomus sp. y Larimus sp. se relacionaron con las estaciones de mayor trasparencia. En contraste, Anchoa sp. Anchovia macrolepidota, Gobiosoma sp. y Cetengraulis mysticetus se asociaron con valores bajos de salinidad (Figura 7b).
DISCUSIÓN Y CONCLUSIONES
En el presente estudio, las diferencias de las condiciones hidrográficas del golfo de Guayaquil en el estuario exterior e interior son claras, evidenciadas por las relaciones de temperatura, salinidad y transparencia. Una zona externa, donde la influencia oceánica es evidente -con menor temperatura, mayor salinidad y transparencia- con respecto a la zona interna del golfo, donde la profundidad se reduce por el gran aporte sedimentario, los procesos de mezcla aumentan y la salinidad disminuye, especialmente durante la estación seca, producto del flujo de mareas (semidiurno) influenciado por el aporte de agua dulce del río Guayas (Stevenson, 1981) y, en conjunto, regulada por las fluctuaciones estacionales de la época seca, con temperaturas frías a partir de julio a noviembre, oscilación normal dada la intensificación de la corriente fría de Humboldt que avanza desde el sur hacia la costa del Ecuador, desplazando sus aguas frías, salinas y ricas en nutrientes para estos meses.
Nuestros resultados muestran características similares a las observadas en otros estudios realizados en el golfo de Guayaquil o áreas adyacentes (Cajas e Hinostroza, 1981; Ortega y Elías, 1996; Torres et al, 2003; Elías et al., 2007; Calderón et al, 2018; Salcedo y Coello, 2018), con densidades larvales relativamente altas en la zona externa del golfo, con predominancia de larvas de engráulidos y baja diversidad larval. La mayor abundancia larval se registró en la parte exterior del golfo, específicamente en las estaciones colindantes al canal del Morro, donde al parecer la temperatura, salinidad y transparencia del agua fueron más estables; por tanto, podrían haber favorecido el desarrollo de huevos y larvas de peces (Saborido, 2008). Otro elemento que pudo contribuir a dicha distribución es la combinación de ambientes en los sitios externos, como fondos rocosos y/o arenosos y la mayor influencia marina, los cuales permiten que mayor diversidad de adultos se agrupen, ya sea con fines reproductivos, alimentación o de refugio (Whitfield, 1999), y afecten así la composición y abundancia del ictioplancton. Por ejemplo, en estos sitios aparecieron especies como Hypsoblennius sp. 1, que habitan principalmente fondos rocosos y únicamente fueron encontrados en los sitios externos. A medida que se ingresa en el estuario interior, se observa que las densidades larvales decrecen como respuesta a varios factores, entre ellos la topografía del fondo, que incide sobre las mareas y la turbulencia, puesto que, al disminuir la profundidad, aumentan los procesos de mezcla y reducen la fotosíntesis por la presencia de partículas suspendidas y disueltas (Prado y Buchelli, 2012), lo que se traduce en un reducido alimento y en menor presencia de larvas de peces.
Una de las características distintivas de los ensamblajes de larvas de peces en estuarios tropicales es la dominancia de pocas especies, las cuales generalmente aparecen asociadas a un alto número de especies en baja abundancia que frecuentan el estuario de manera ocasional (Whitfield, 1989, 1999; Morais, 1994; Barletta-Bergan et al., 2002; Barletta y Barletta-Bergan, 2009). En el golfo de Guayaquil se observa esta condición, ya que estuvo dominado por larvas de tres familias de peces: engráulidos, sciánidos y góbidos, coincidente con lo descrito por Calderón et al. (2018) y Salcedo y Coello (2018).
Así mismo, en los sistemas heterogéneos existe una alta variedad de especies de peces con distintos requerimientos y/o patrones de desove, donde algunas especies se reproducen durante todo el año y otras exhiben uno o dos picos de reproducción (Pittman et al., 2004). Con base en esto, en el golfo, la variabilidad temporal encontrada puede reflejar los diferentes patrones reproductivos que presentan las especies que, como adultos, habitan en este sistema. Los engráulidos, representados principalmente por Anchoa sp., sobresalieron con máximas densidades en toda el área -tanto en la zona interna como externa- y meses de estudio, lo que sugiere que su presencia como estadio larval no es estacional, y que probablemente en esta área de estudio se reproduzca varias veces al año, pudiendo desovar en la zona externa para que sus larvas ingresen y se desarrollen en el estuario interior (Day et al., 1989; Whitfield, 1999). Igualmente, su distribución estaría explicada por ser una familia al igual que Gobiidae de hábitat salobre-marino (Whitehead et al., 1988; Whitehead y Rodríguez-Sánchez, 1995), las cuales son reportadas regularmente en estuarios o bahías (Silva-Segundo et al., 2008). Mientras tanto, aquellos estadios larvales que solo fueron registrados en una área y/o mes de muestreo -como por ejemplo los sciánidos, especies demersales, estuario-dependientes, con desoves en áreas costeras, estuarios y bahías (Ocaña-Luna y Sánchez Ramírez, 2003) y que migran desde el área de puesta a las desembocaduras de las zonas de crianza- podrían corresponder a especies con un solo período reproductivo anual en el área externa del golfo.
La diversidad varió en el espacio y en el tiempo. En el estuario interior se registró la mayor diversidad larval, observándose una relación inversa entre la abundancia y riqueza de especies. Esto sugiere un importante intercambio y mezcla de especies marinas y del estuario. En relación, Day et al. (1989) y McLusky y Elliot (2004) señalaron que es común que en áreas con influencia marina, la riqueza de organismos del zooplancton sea mayor, particularmente en la bocana, conformando una comunidad mixta. Por otro lado, otros autores señalan que las áreas internas favorecen la agregación larval por brindar condiciones de refugio y alimentación, relacionadas con una mayor turbidez, las grandes raíces de manglar y la alta sedimentación debida a la descarga de agua de los esteros (Barletta-Bergan et al., 2002; Barletta y Barletta-Bergan, 2009). Sin embargo, no necesariamente es un reflejo de la diversidad larval en cada zona, debido a que no todas las etapas larvarias ocupan esta área permanentemente, ya que un alto número de ellas son arrastradas por las corrientes de mareas (Neira y Potter, 1992; Ramos et al., 2005), dado que su locomoción es limitada en las primeras etapas de vida (Jiménez, 2008).
En cuanto a la riqueza de especies, es posible identificar un incremento en las estaciones con mayor influencia marina (estuario exterior), pero en la boca del canal del Moro (estación ocho y nueve) el pulso es máximo como reflejo de un alto tránsito de especies, que coinciden con la distribución de la salinidad, variable que juega un rol importante en la distribución y los procesos reproductivos de las especies. Esto no solo evidencia las estrategias biológicas y ecológicas especializadas que poseen las especies -como por ejemplo Anchoa sp., que posee condiciones para moverse en zonas de gran variabilidad ambiental (Yáñez-Arancibia et al., 1985)-, sino que también revela a este sitio como zona importante de reclutamiento de muchas especies, que aprovechan las condiciones propicias que ofrece este sistema como son alta productividad biológica y el refugio del ambiente como área de cría y puesta.
Si bien se conoce que generalmente en zonas estuarinas tropicales, la distribución espacio-temporal de peces adultos y juveniles está influenciada por los cambios en los factores ambientales (como temperatura y salinidad) (Laroche et al., 1997) y por la precipitación y cambios de mareas. Cada estuario presenta características morfológicas particulares como tipo de sustrato, distancia hacia el océano, etc., factores que también influyen en la estructura de las comunidades de peces (Pérez-Ruzafa et al., 2007).
Con base en ello, mediante el análisis de redundancia, se pudo observar que, para el golfo de Guayaquil, las relaciones larvales se dieron mayormente en torno a la turbidez y la salinidad del agua. En general, se considera que, para muchas especies marinas, los estadios larvales y juveniles resultan más tolerantes a la variabilidad ambiental que los adultos (Holliday, 1971). Las especies de larvas como Gobiosoma sp., Labrisomus sp., Larimus sp., Cynoscion sp., Synodus lucioceps, Haemulon sp., Eucinostomus gracilis, Seriola lalandi, Stellifer sp., Gobiesox sp., Anchoa sp., Anchovia macrolepidota, y Cetengraulis mysticetus, que son consideradas, en su mayoría, especies estuarinas, estuvieron asociadas con alta y baja salinidad. Lo anterior sugiere que estas especies evidencian mayor tolerancia a rangos de salinidad, por lo que muchas de ellas estuvieron presentes tanto en el ambiente estuarino como de influencia marina en tanto que especies como Etrumeus acuminatus, Achirus mazatlanus, Sphoeroiedes lobatus, Oligoplites saurus, Bairdiella sp., Diplectrum sp., Engraulis ringens y Opisthonema sp., las cuales en su mayoría pertenecen al componente marino como Etrumeus acuminatus, Engraulis ringens y Opisthonema sp., permanecieron en una zona o área. Específicamente en la zona externa se asociaron positivamente con la mayor transparencia, lo que refleja la preferencia de estas especies por características fisicoquímicas específicas.
Por lo tanto, es posible hipotetizar que, en un ambiente estuarino, la variación temporal de las condiciones ambientales estaría modulando la distribución, abundancia y, en general, la comunidad de larvas de peces. Así mismo, estas fluctuaciones estacionales y temporales representan las estrategias reproductivas de cada especie vinculadas a su hábitat (Sánchez, 1997), teniendo como premisa la disponibilidad de alimento para su supervivencia (Whitehead et al., 1988), dado que, frecuentemente, la abundancia de larvas de peces está estrechamente relacionada con la biomasa de zooplancton (Kaunda-Arara et al., 2009).
De acuerdo con los resultados obtenidos, el golfo de Guayaquil, al menos durante el período muestreado, presentó un ensamblaje de larvas de peces con una composición taxonómica integrada principalmente por la presencia de especies estuarinas con la dominancia de una familia (Engraulidae). Esta dominancia podría ser el resultado del efecto de varios factores físico-químicos, entre los que destacaron la salinidad, la transparencia y los eventos reproductivos de las especies presentes en el área, lo que permiten inferir que en general esta sección del golfo (área externa) es un área importante como sala-cuna para las especies. Sería interesante realizar más estudios y con muestreos más prolongados para comprobar el comportamiento del sistema en una ventana de tiempo mayor.
AGRADECIMIENTOS
Al oceanógrafo Mario Hurtado por la elaboración de los mapas de este manuscrito. A la Senescyt (Secretaría Nacional de Educación Superior, Ciencia, Tecnología e Innovación) de Ecuador, ente que financió este proyecto dentro de la primera milla náutica frente a la costa ecuatoriana de la provincia de Guayas durante junio a diciembre de 2012. Proyecto ejecutado por el Instituto Nacional de Pesca a través del convenio específico 20120132.
REFERENCIAS
Able, K., J. Manderson and A. Studholme. 1999. Habitat quality for shallow water fishes in an urban estuary: the effects of man-made structures on growth. Mar. Ecol. Prog. Ser., 187: 227-235. [ Links ]
Arias de la Peña, C.M. 1991. Preliminary study of some groups of the ichthyoplankton of the Gulf of Nicoya. Costa Rica. Master's Thesis. Univ. Costa Rica. Ayón, H. 1987. Main geomorphological features of the Ecuadorian coast. Guayaquil. 10 p. [ Links ]
Barletta, M. and A. Barletta-Bergan. 2009. Endogenous activity rhythms of larval fish assemblages in a mangrove-fringed estuary in North Brazil. Open. Fish. Sci. J., 2: 15-24. [ Links ]
Barletta, M ., A. Barletta-Bergan and U. Saint-Paul. 1998. The description of the fishery structure in the mangrove dominated region of Braganga (State of Pará-North Brazil). Ekotropical, 4: 41-53. [ Links ]
Barletta-Bergan, A., M. Barletta and U. Saint-Paul . 2002. Structure and seasonal dynamics of larval fish in the Caeté River in northern Brazil. Est. Coast. Shelf Sci., 154: 193-206. [ Links ]
Beck, M., K. Heck, K. Able, D. Childers, D. Eggleston, B. Gillanders, B. Halpern, C. Hays, K. Hostino, T. Minello, R. Orth, P. Sheridanand and M. Weinstein. 2001. The role of nearshore ecosystems as fish and shellfish nurseries. Bioscience, 51: 633-641. [ Links ]
Beltrán-León, B. and R. Ríos. 2000. Early stages of fish in the Colombian Pacific. Vol. 1. National Institute of Fisheries and Aquaculture. Buenaventura. 359 p. [ Links ]
Beltrán-León, B. and R. Ríos. 2001. Early stages of fish of the Colombian Pacific. Volume 2. National Institute of Fisheries and Aquaculture. Buenaventura. 360-727 p. [ Links ]
Boyer, J., J. Fourqrean and R. Jones. 1997. Spatial characterization of water quality in Florida Bay and Whitewater Bay by multivariate analyzes: Zones of similar influence. Estuaries, 20: 743-758. [ Links ]
CAAM (Environmental Advisory Commission). 1995. Development and environmental problems of the Gulf of Guayaquil area. Create Image, Quito. [ Links ]
Calderón, G. 2011. Catalog of fish eggs and larvae collected in Ecuadorian waters. Special Bull., 2(4): 118. [ Links ]
Calderón, G., G. Ayora and E. Elías. 2018. Distribution and abundance of ichthyoplankton within the first nautical mile off the province of Santa Elena Ecuador. Rev. Cienc. Mar Limnol., 12(1): 10. [ Links ]
Cajas, L. and D. Hinostroza. 1981. Clupeid and engraulid eggs and larvae in the Gulf of Guayaquil. Rev. Cienc. Mar. Limnol., 2: 37-47. [ Links ]
Cowan Jr, J.H. and R.F. Shaw. 2002. Recruitment: 88-111. In: Fuiman L.A. and R.G. Werner (Eds.). Fish. Sci.: the unique contributions of the early stages. Blackwell Science. 326 p. [ Links ]
Cucalón, E. 1996. First part: Oceanography and physical systems. In Biophysical Systems of the Gulf of Guayaquil (1st ed.: 1-109). Quito: Environmental Advisory Commission of the Presidency of the Republic of Ecuador. [ Links ]
Day, J.W, C.A.S. Hall, W.M. Kemp and A. Yañez-Arancibia (Eds). Estuarine Ecology. John Wiley & Sons, Inc., New York, 558 p. [ Links ]
Favero, M. and C.A. Lasta. 2001. Fish breeding area of the Samborombón Bay (Argentina) as sustenance for migratory fish-eating birds: trophic interactions. Final report. Torch Foundation. Project A-13672/1-4: 44. [ Links ]
García, M.L. 1983. Variability in the distribution and abundance of mackerel eggs and larvae (Scomber japonicusperuanus) and some clupeids in Ecuadorian waters. FAO Fish. Rep., 291(2): 553. [ Links ]
Hammer, O., D. Harper and P. Ryan. 2001. Paleontological statistics software: package for education and data analysis. Palaeontol. Electron., 4: 1-9. [ Links ]
Holliday, F.G.T. 1971: Salinity: Animals-Fishes: 997-1033. In: Kinne, O. (Ed.). Marine Ecology Vol. 1. Part. 2. Wiley-Interscien, London. [ Links ]
Jiménez, I.L. 2008. Prospecting ichthyoplankton on the surface of the Colombian Pacific Ocean. Period 19.sep-08.oct.04. regional study of the El Niño phenomenon (ERFEN). Thesis. Univ. Militar Nueva Granada. [ Links ]
Jiménez, R and D. Bonilla. 1980. Composition and distribution of plankton biomass on the equatorial front. Inocate Ecuador Oceanogr. Act. Pac., 1(1): 19-64. [ Links ]
Kaunda-Arara, B., J.M. Mwaluma, G.A. Locham, V. Oresland and M.K. Osore. 2009. Temporal variability in fish larval supply to Malindi Marine Park, coastal Kenya. Aquat. Conserv. Mar. Freshw. Ecosyst., 19(S1): S10-S18. [ Links ]
Ketchum, B.H. 1992. Ecosystems of the World. Est. Encl. Be., 183-203. [ Links ]
Krebs, C. 1999. Ecological methodology. Benjamin Cumming. California. 760 p. [ Links ]
Laroche, J., E. Baran and N.B. Rasoanandrasana. 1997. Temporal patterns in a fish assemblage of a semiarid mangrove zone in Madagascar. J. Fish Biol., 51: 3-20. [ Links ]
Luzuriaga de Cruz, M., D. Ortega andE. Elías . 1998. Abundance and distribution of ichthyoplankton, phytoplankton, and zooplankton in the Ecuadorian Sea in April 1995. Act. Oceanogr. Esp., 9(1). [ Links ]
Maes, J., A. Taillieu., P.A. Van Damme, K. Cottenie and F. Ollevier. 1998. Seasonal patterns in the fish and crustacean community of a turbid temperate estuary (Zeeschelde Estuary. Belgium). Est. Coast. Shelf Sci., 47: 143-151. [ Links ]
McCune, B. and J.B. Grace. 2002. Analysis of ecological communities. Bruce McCune, US. 143-164. [ Links ]
McLuski, D. and E. Marriot. 2011. Challenging paradigms in estuarine ecology and management. Est. Coast. Shelf Sci., 94. [ Links ]
Meadow, M. and R. Buchelli. 2012. Distribution and abundance of plankton in the Daule-Peripa reservoir during 2011-2012. Bol. Cient. Tecn., 14(2). [ Links ]
Montaño-Armijos, M. and T. Sanfeliu-Montolio. 2008. Guayas ecosystems (Ecuador). Environ. Sust. Rev. Tecn. ESPOL., 21(1): 1-6. [ Links ]
Morais, T. 1994. The abundance and diversity of larval and juvenile fish in a tropical estuary. Est. Coast. Shelf Sci., 17: 216-225. [ Links ]
Moser, H.G. 1996. The early stages of fishes in the California Current region. CalCOFI. Atlas No. 33. 1505 p. [ Links ]
Moser, H.G. and P.E. Smith. 1993. Larval fish assemblages and oceanic boundaries. Bull. Mar. Sci., 53(2): 283-289. [ Links ]
Neira, F. and I. Potter. 1992. Movement of larval fishes through the entrance channel of a seasonally open estuary in Western Australia. Est. Coast. Shelf Sci., 35: 213-224. [ Links ]
Ocaña-Luna, A. and M. Sánchez-Ramírez. 2003. Diversity of Ichthyoplankton in Tampamachoco Lagoon. Veracruz. Mexico. An. Inst. Biol., 74(2): 179-193. [ Links ]
Ortega, D., E. Elías and R Zurita. 1996. Distribution of ichthyoplankton and zooplankton on the Ecuadorian coast in September 1995. Bol. Cient. Tec., 14(1): 52-64. [ Links ]
Ottersen, G., S. Kim, G. Huse, J. J. Polovina and N.C. Stenseth. 2010. Major pathways by which climate may force marine fish populations. J. Mar. Syst., (3): 343-360. [ Links ]
Pérez-Ruzafa, A., M.C. Mompean and C. Marcos. 2007. Hydrographic, geomorphologic and fish assemblage relationships in coastal lagoons. Hydrobiologia, 107-125. [ Links ]
Peribonio, R., R. Repelín, M. Luzuriaga, D. Hinostroza and M.E. Villarroel. 1981. Ecological study of the mesoplankton of the Gulf of Guayaquil abundance. nictemeral cycles and relationships between the Guayas river estuary and the ocean. Bol. Cient. Tecn., 4(2). [ Links ]
Pittman, S.C., A. McAlpine and K. Pittman. 2004. Linking fish and prawns to their environment: a hierarchical landscape approach. Mar. Ecol. Prog Ser., 283: 233-254. [ Links ]
Prado, M., L. Troccoli and E. Moncayo. 2015. Structural changes of microfitoplankton in the coastal zone of the El Oro-Ecuador province in the dry season. Bol. Inst. Oceanogr. Venez., 542: 139-152. [ Links ]
Ramos, S., R. Cowen and A. Bordalo. 2005. Temporal and spatial distributions of larval fish assemblages in the Lima estuary (Portugal). Est. Coast. Shelf Sci., 66: 303-314. [ Links ]
Richards, W.J. and K.C. Lindeman. 1987. Recruitment dynamics of reef fishes' planktonic processes settlement and demersal ecologies and fishery analysis. Bull. Mar. Sci., (41): 392-410. [ Links ]
Richards, W. 2005. Early stages of Atlantic fishes: an identification guide for the Western Central North Atlantic. Vol. 1. Taylor and Francis Group. CRC Press. Boca Raton. USES. 2640 p. [ Links ]
Saborido, F. 2008. Ecology of reproduction and reproductive potential in marine fish populations. Inst. Invest. Mar. Univ. Vigo. 71 p. [ Links ]
Salcedo, J. and D. Coello. 2018. Plankton dynamics in the first nautical mile off the province of El Oro. Ecuador. Rev. Biol. Trop., 66(2): 836-847. [ Links ]
Sánchez-Ramírez, G. 1997. Abundance, growth and mortality of Chloroscombrus chysurus (Pisces Carangidae) larvae in the southern Gulf of Mexico. Doctoral thesis. Univ. Nac. Aut. México. 85 p. [ Links ]
Shannon, C.E. and W. Weaver. 1963. The mathematical theory of communication. Urban. Univ. Illinois Press, 117 p. [ Links ]
Silva-Segundo, C.A, R. Funes-Rodríguez, M.E. Hernández-Rivas, E. Ríos-Jara, E.G. Robles-Jarero and A. Hinojosa-Medina. 2008. Associations of fish larvae in relation to environmental changes in the Bays of Chamela, Jalisco and Santiago, Manzanillo, Colima (2001-2002). Hydrobiologia, 18(1): 89-103. [ Links ]
Smith, E. and S. Richardson. 1979. Model techniques for prospecting eggs and larvae of pelagic fish. FAO. Doc. Tec. Pesca, (175): 1-107. [ Links ]
Sheskin, D. 2004. Parametric and nonparametric statistical procedures. Chapman and Hall. Boca Raton. US. 423 p. [ Links ]
Stevenson, M. 1981. Seasonal variations in the Gulf of Guayaquil, a tropical estuary. Bol. Cient. Tecn., 4(1): 5-28. [ Links ]
Tsirtsis, G. and M. Karydis. 1998. Evaluation of phytoplankton community indices for detecting eutrophic trends in the marine environment. Environ. Monit. Assess., 50: 255-269. [ Links ]
Torres, G., V. Calderón, E. Franco, T. Cedeño and E. Salazar. 2003-2004. Composition of plankton in the Puntilla de Santa Elena during August 2002. Act. Oceanogr. Pac., 12(1): 63-74. [ Links ]
Twilley, R., W. Cárdenas, V. Rivera-Monroy, J. Espinoza, R. Suescum, M. Armijos and L. Solórzano. 2001. The Gulf of Guayaquil and the Guayas river estuary. Ecuador: 245-263. Coast. Mar. Ecosyst. of Latin America. [ Links ]
Whitehead, P.J.P., G.J. Nelson and T. Wongratana. 1988. FAO species catalog. Clupeoid fishes of the world (Suborder Clupeoidei). An annotated and illustrated catalog of the herrings, sardines, pilchards, sprats, anchovies, and wolf-herrings. Part 2. Engraulidae. FAO Fish. Syn., 125(17): 305-579. [ Links ]
Whitehead, P.J.P . and R. Rodríguez-Sánchez. 1995. Engraulidae. In: Fischer W. F Krupp, W. Schneider, C. Sommer, K.E. Carpenter and V.H. Niem (Eds). FAO Guide to Species Identification for Fishing Purposes. Central-Eastern Pacific. Vol. II and III Parts 1 and 2: 1067-1068. [ Links ]
Whitfield, A. 1989. Fish larval composition abundance and seasonality in a Southern-African estuarine lake. S.A. J. Zool., 24: 217-224. [ Links ]
Whitfield, A. 1999. Ichthyofaunal assemblages in estuaries: A South African case study. Rev. Fish Biol. Fish., 9: 151-186. [ Links ]
Yáñez-Arancibia, A. and R. Nugent. 1977. The ecological role of fish in estuaries and coastal lagoons. An. Centro Cien. Mar Limnol. Univ. Nac. Auton. Mexico. 4: 107-117. [ Links ]
Yáñez-Arancibia, A ., A.L. Lara-Domínguez, A. Aguirre-León, S. Díaz-Ruiz, F. Amezcua-Linares, D. Flores-Hernández and P. Chavance. 1985. Ecology of dominant fish populations in tropical estuaries: environmental factors that regulate biological strategies and production: 311-366. In: Yáñez-Arancibia, A . (Ed.). Fish community ecology in estuaries and coastal lagoons: Towards ecosystem integration. Univ. Nac. Aut. México. [ Links ]
Recibido: 16 de Agosto de 2019; Aprobado: 03 de Mayo de 2020











 text in
text in