Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.1 Santa Marta ene./jun. 2020
https://doi.org/10.25268/bimc.invemar.2020.49.1.779
NOTA
Abundancia del pez león invasor Pterois volitans en los arrecifes de coral costeros del Caribe colombiano
1 Instituto de Investigaciones Marinas y Costeras (INVEMAR), Santa Marta, Colombia
Se evaluó la abundancia del pez león invasor Pterois volitans mediante censos visuales realizados en 2015 y 2016 en 54 sitios de seis localidades con arrecifes de coral a lo largo de la costa Caribe colombiana. El invasor se observó en todos los lugares y en la mayoría de las inmersiones, con una frecuencia de avistamiento de 88 %, valores de abundancia desde 0 hasta 9,7 ± 2,1 ind/250 m2 (388 ind/ha) y un promedio de 0,8 ± 1,3 ind/250 m2 (32 ind/ha). La densidad media fue similar a los valores reportados en otros trabajos que contaron pez león en una amplia escala espacial en el área invadida y el valor más alto se aproximó a la densidad máxima estimada en Colombia y otros lugares del Caribe.
PALABRAS CLAVE: Caribe sur; especie exótica invasora; censos visuales submarinos; densidad de pez león
The abundance of the invasive lionfish Pterois volitans was assessed through visual censuses conducted in 2015 and 2016 at 54 sites in six localities with coral reefs across the Colombian Caribbean coast. The invader was observed across locations and in most of the dives, with sighting frequency of 88 %, abundance values from 0 to 9.7 ± 2.1 ind/250 m2 (388 ind/ha), and 0.8 ± 1.3 ind/250 m2 (32 ind/ha) as total mean. The average density was similar to values reported in other works that counted lionfish in a broad spatial scale on the invaded area and the highest value approximated the maximum density estimated in Colombia and other locations around the Caribbean.
KEY WORDS: southern Caribbean; invasive alien species; underwater visual census; lionfish density
El pez león Pterois volitans (Linnaeus) es un escorpénido nativo del Indopacífico que fue introducido en el Atlántico occidental (AO) hace más de tres décadas. La primera captura conocida de la especie en el AO tuvo lugar en Florida, EE. UU., en 1985, y en la década siguiente se conocieron registros adicionales en lugares de EE. UU. y las Bermudas (Schofield, 2009). Para el 2010, el pez león ya se consideraba una especie exótica invasora en la mayor parte del gran Caribe, incluida Colombia (González et al., 2009; Schofield, 2010). Mostrando una notable capacidad de dispersión, el invasor en menos de 30 años hizo presencia en gran parte del AO, desde Carolina del Norte en la costa este de los EE. UU., el golfo de México y el Caribe (USGS-NAS, 2020). Con un área ocupada de casi 7,3 millones de km2 (Côté et al., 2013), la invasión del pez león es ahora reconocida como la más rápida por un pez marino en la historia (Hamner et al, 2007; Schofield, 2010; Betancur-R et al, 2011). Incluso hay un registro de un pez león capturado en 2014 tan al sur como lo es Río de Janeiro, Brasil (Ferreira et al., 2015).
El pez león posee un conjunto de características biológicas que determinan su éxito como invasor y lo convierten en una seria amenaza para la biota nativa del AO: un rápido crecimiento (Pusack et al., 2016) y un alto rendimiento reproductivo (Gardner et al, 2015; Fogg et al., 2017), así como rasgos generalistas en hábitat y dieta (Muñoz et al, 2011; Claydon et al, 2012; Cure et al., 2014; Acero et al., 2019); además de una serie de características fisiológicas, morfológicas y de comportamiento que lo convierten en un cazador poderoso y en una presa difícil (Morris, 2013; Díaz-Ferguson y Hunter, 2019; Green et al, 2019; Rojas et al., 2019). La aparente ubicuidad y la abundancia de la especie en el área invadida, en sinergia con su carácter de depredador voraz y oportunista, le dan un gran potencial para afectar catastróficamente las comunidades de peces nativos (Côté et al., 2013; Ballew et al, 2016; Ingeman, 2016). Las poblaciones de peces en los arrecifes de coral están particularmente en riesgo de descenso por el pez león, poniendo en peligro la economía local de los pescadores (Albins y Hixon, 2008; Green et al., 2012) e incluso provocando efectos en cascada en la estructura de las comunidades bentónicas (Lesser y Slattery, 2011).
El primer avistamiento registrado de pez león en Colombia data de diciembre de 2008 en el sitio de buceo Manta City, en la isla de Providencia, a 5 m de profundidad (Schofield, 2009). Cinco meses después, la especie se registró en el Parque Nacional Natural (PNN) Tayrona a 16 m de profundidad (González et al., 2009), y desde entonces se han recibido muchos registros de todo el Caribe colombiano en la base de datos del INVEMAR (http://invasoresmarinos. invemar.org.co/). Desde ese primer registro, se han adelantado en el país investigaciones sobre la invasión en varios temas, desde la caracterización de la especie (Hernández-Abello et al., 2015; González et al., 2011) hasta aspectos de su ecología trófica (e.g.Muñoz-Escobar y Gil-Agudelo, 2012; Pabón y Acero, 2015; Acero et al., 2019). Algunos estudios han estimado la abundancia del pez león en lugares específicos, como el PNN Tayrona y Santa Marta (Bayraktarov et al., 2014; Coronado-Carrascal et al., 2015; García-Urueña et al., 2015), y en la isla de San Andrés (González-Corredor et al., 2016), pero hasta la fecha, solo existe un trabajo publicado en el que se evaluaron lugares distantes (Rojas-Vélez et al., 2019). Hasta el momento, no hay estudios de la abundancia de esta especie con metodologías estandarizadas y en un número de localidades que permitan comparaciones en una escala espacial más amplia. En ese sentido, este trabajo ofrece información sobre la distribución y abundancia del pez león a nivel regional en Colombia, contribuyendo al acervo de información sobre esta invasión biológica en el país.
Entre agosto-octubre de 2015 y mayo-septiembre de 2016 se visitaron las seis localidades con la mayor extensión de formaciones coralinas en el Caribe continental colombiano, a fin de verificar la presencia y estimar la abundancia del pez león (Figura 1; Tabla 1). Los censos de pez león se hicieron entre las 7 a. m. y las 5 p. m. siguiendo la metodología de Green (2013), ampliamente utilizada en el AO. Mediante buceo SCUBA se realizó una búsqueda intensiva del pez león en transectos de 25 x 10 m, cuidando de buscar bajo las salientes y entre las grietas y oquedades del arrecife.
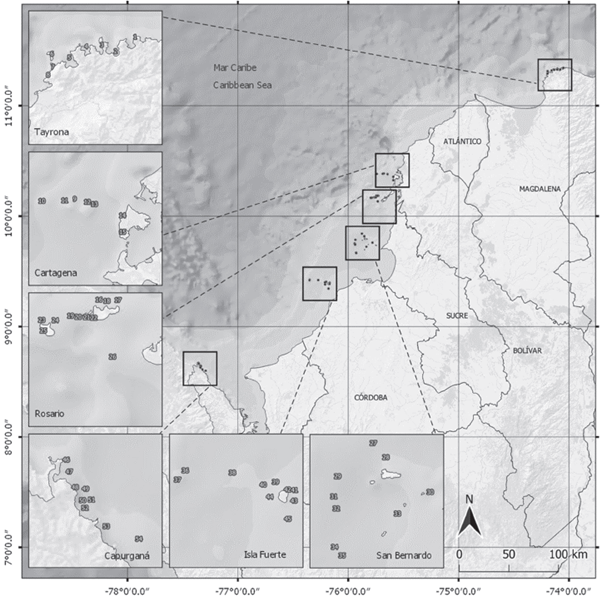
Figura 1 Sitios de muestreo en seis localidades de la costa Caribe colombiana donde se evaluó la abundancia del pez león en 2015 y 2016. Los nombres de los sitios correspondientes a cada número en los cuadros de localidades se encuentran en la Tabla 1.
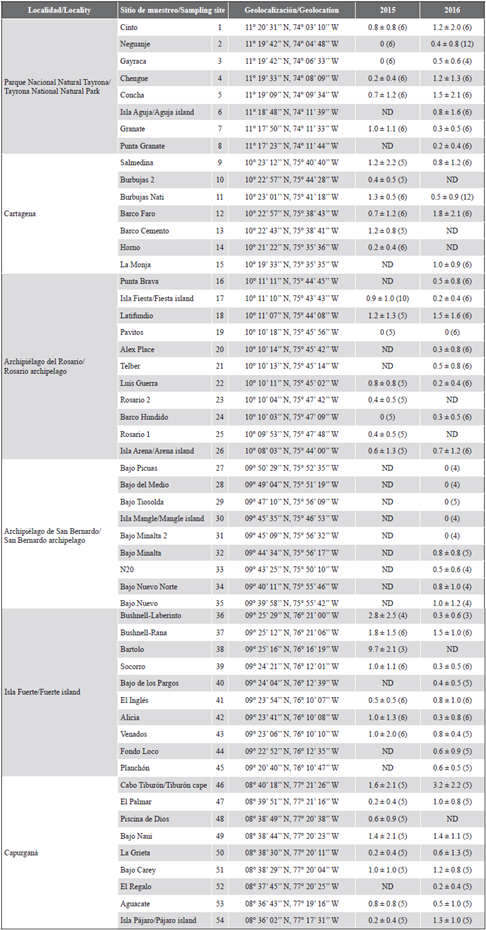
Tabla 1 Abundancia del pez león en la costa Caribe colombiana en 2015 y 2016. Densidad promedio (individuos/250 m2) ± 1 desviación estándar con el número de censos por sitio de muestreo entre paréntesis. ND significa que el sitio no fue evaluado ese año.
Los valores de densidad se estimaron en individuos por 250 m2, que se promediaron por sitio y localidad y se extrapolaron a hectáreas para comparación con otros estudios. El número de censos fue variable entre sitios (3 a 12) (Tabla 1) porque el tiempo para evaluar cada transecto cambió de acuerdo con los rasgos físicos de los sitios de muestreo (e.g. mayor/menor complejidad estructural, profundidad, visibilidad); así como con el tiempo de buceo en línea con los límites de descompresión del buceo con aire. Para evaluar las diferencias de densidad entre años, entre ubicaciones y en relación con la profundidad, se utilizó la prueba estadística para medianas de Mood. Previamente, se analizó la normalidad y la homocedasticidad de los datos con las pruebas de Shapiro-Wilk y Bartlett. Para los análisis, se clasificaron las profundidades así: 1: 1-10 m, 2: > 10-20 m, 3: > 20-30 m, 4: > 30-40 m. Todos los análisis se hicieron con Statgraphics Centurion XVI.
Se hicieron en total 452 censos en 54 sitios en las seis localidades durante los dos años (191 en 2015; 261 en 2016), cubriendo un área muestreada total de 113 000 m2 entre 4,5 y 44 m de profundidad. La búsqueda en cada transecto duró 17,3 min en promedio para un tiempo total de muestreo de alrededor de 130 h, durante el cual se observaron 350 peces león en 185 transectos de 48 sitios. De un total de 85 inmersiones, el invasor se observó en 75, para una frecuencia de avistamiento de 88 %, lo que permite considerar la especie como frecuente en los lugares y años de muestreo (> 70 %), de acuerdo con los estándares de Schmitt y Sullivan (1996). Los sitios donde no se registró la especie durante los censos fueron Pavitos, en el archipiélago del Rosario, que se visitó en ambos años (n = 11), y Bajo Picuas (n = 4), Bajo del Medio (n = 4), Bajo Tiosolda (n = 4), isla Mangle (n = 4) y Bajo Minalta 2 (n = 4), que están en el archipiélago de San Bernardo y que se visitaron solamente en 2016 (Tabla 1).
Durante el estudio se registraron valores de densidad entre 0 y 12 ind/250 m2 (480 ind/ha), con un promedio general de 0,8 ± 1,3 ind/250 m2 (32 ind/ha). En 2015, la densidad promedio fue de 0,9 ± 1,6, y en 2016 fue de 0,7 ± 1,1 ind/250 m2. La densidad promedio más alta por sitio fue de 9,7 ± 2,1 ind/250 m2 (388 ind/ha) y se registró en Bartolo (isla Fuerte) en octubre de 2015. La localidad con la densidad promedio más alta en los dos años fue isla Fuerte con 1,2 ± 2,8 ind/250 m2 (48 ind/ha), seguido de Capurganá y Cartagena con 0,9 ± 1,3 ind/250 m2 y 0,9 ± 1,2 ind/250 m2, respectivamente. La densidad promedio más alta por sitio cuando se extrapola a hectáreas es similar a la densidad máxima de pez león reportada en Colombia por González-Corredor et al. (2016), que es de 379,03 ind/ha durante 2012 en la isla de San Andrés. Los valores de densidad del pez león de San Andrés y Bajo Bartolo están cerca de algunas de las densidades más altas reportadas para la especie en el área invadida por estudios que utilizaron métodos similares (Tabla 2).
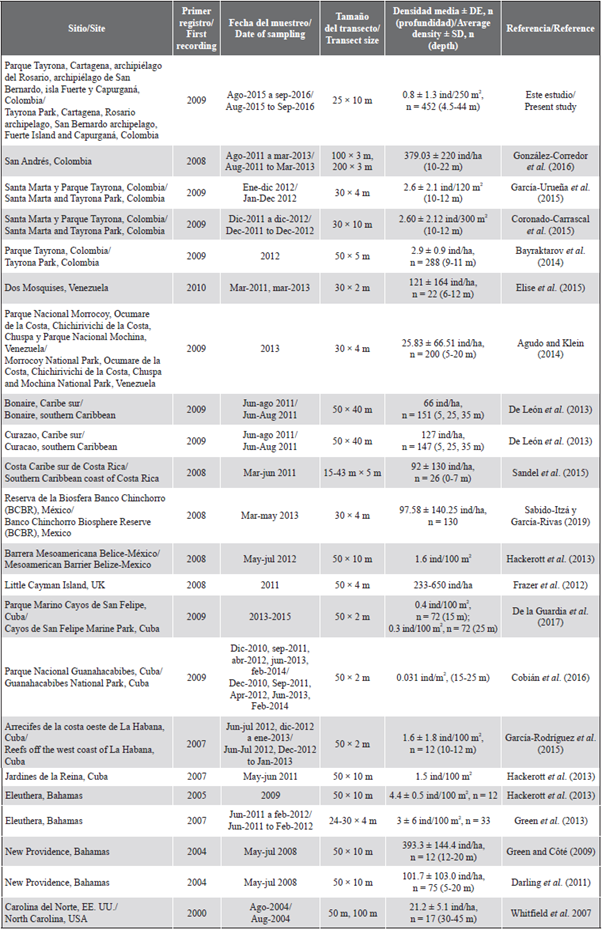
Tabla 2 Densidades de pez león estimadas mediante censos visuales en estudios realizados en varios lugares del Atlántico occidental. DE: Desviación estándar; n: número de transectos.
Bartolo es una elevación del fondo marino ubicada a unos 10 km al noroeste de isla Fuerte, cuya parte más somera tiene alrededor de 35 m de profundidad. Esto hace que el sitio no sea adecuado para la pesca submarina o el buceo recreativo, y por lo tanto, que la extracción del pez león haya sido inusual o ausente en Bartolo antes de este trabajo. Otros lugares con densidades significativas de pez león fueron Bushnell-Laberinto (2,8 ± 2,5 ind/250 m2), también en isla Fuerte, y cabo Tiburón, en la localidad de Capurganá (3,2 ± 2,2 ind/250 m2). En términos generales, estos son sitios remotos, donde las acciones para controlar la invasión son poco frecuentes o nulas por problemas logísticos para el buceo y una presencia limitada de las autoridades ambientales debido a que no son áreas realmente protegidas. La densidad media más baja del pez león se registró en el archipiélago de San Bernardo con solo 13,7 ind/ha (0,3 ± 0,7 ind/250 m2), e incluso estuvo ausente en cinco de los nueve sitios muestreados en esta localidad (Tabla 1).
Si se asume que, en los dos años, la densidad promedio en todos los sitios (0,8 ± 1,3 ind/250 m2; 32 ind/ha) fue representativa de la abundancia de pez león en el Caribe continental colombiano, se puede decir que este valor fue bajo en comparación con las densidades reportadas en trabajos con métodos similares (i.e. censos visuales en transectos) en otros lugares del Caribe como Bahamas, islas Caimán, Cuba, Belice, México, Costa Rica, Venezuela, y Curazao (Tabla 2). En Colombia, se han registrado densidades mucho más altas en sondeos locales, como el de González-Corredor et al. (2016) en San Andrés, y en el estudio de García-Urueña et al. (2015) en Santa Marta (Tabla 2). Sin embaigo, al hacer comparaciones sobre la densidad del pez león entre estudios, se debe considerar un conjunto de factores como la profundidad, la fecha de muestreo, el tiempo transcurrido desde la llegada del invasor, el tamaño del transecto (largo y ancho) y la escala espacial del muestreo, entre otros.
Al considerar solo densidades reportadas por estudios que incluyeron múltiples ubicaciones en una escala regional (e.g. superior a 100 km), encontramos valores similares a la densidad promedio registrada aquí. Por ejemplo, Agudo y Klein (2014) muestrearon cinco localidades distribuidas en más de 400 km de costa venezolana en 2013 e informaron 25,83 ind/ha; Whitfield et al. (2007) exploraron sitios a lo largo de 160 km en la costa de Carolina del Norte en 2004 y reportaron densidades de 21,2 ind/ha. Por lo tanto, parece que las densidades de pez león obtenidas por estudios con varias localidades dispersas en grandes áreas pueden ser más diagnósticas de esta invasión biológica a escala nacional. Además, tales estudios permiten hacer comparaciones directas entre lugares por la consistencia en los métodos de muestreo, lo que destaca la importancia de establecer programas de monitoreo estandarizados en el país.
En Colombia no existen estudios que evalúen la abundancia de pez león en una escala espacial amplia mediante censos visuales en transectos. Recientemente, Rojas-Vélez et al. (2019), evaluando una hipótesis de resistencia biológica, contaron P. volitans mediante censos visuales errantes y reportaron densidades equivalentes a 84 ind/ha (0,84 ± 0,89 ind/100 m2). Las diferencias en los métodos, la intensidad de muestreo y los sitios impiden una comparación directa con los resultados de este estudio; sin embargo, a pesar del menor esfuerzo de muestreo (44 censos en 24 sitios versus 452 transectos en 54 sitios), su densidad promedio es tres veces mayor que la registrada en esta investigación, lo que podría explicarse por diferencias metodológicas y sus conteos en la isla de San Andrés, donde se han registrado las densidades más altas de pez león en Colombia (González-Corredor et al., 2016).
El único lugar en Colombia con varias publicaciones sobre la abundancia del pez león estimada a través de censos visuales en transectos es el PNN Tayrona, y la variabilidad en los valores de densidad es notoria, pues van desde 2,9 ind/ha (Bayraktarov et al., 2014) hasta 216,7 ind/ha (García-Urueña et al., 2015). Las abundancias estimadas en este estudio para esa localidad (Tabla 1) son más similares a las de Coronado-Carrascal et al. (2015), que reportaron valores equivalentes a 68, 63,7 y 37 ind/ha para Cinto, Chengue e isla Aguja. No se puede descartar que toda esta variabilidad en las estimaciones de abundancia del pez león, incluso en un solo lugar, puede ser un reflejo de poblaciones altamente dinámicas por las variaciones en el esfuerzo reproductivo y el éxito del reclutamiento versus la mortalidad natural más la mortalidad por pesca debido a esfuerzos de control diferentes en cada localidad. Sin embargo, en ausencia de resultados de un monitoreo a largo plazo con métodos estándar, es más fácil atribuir esa variabilidad a las diferencias en los métodos y al esfuerzo de muestreo entre los diferentes estudios. De ahí la importancia de establecer un programa nacional de monitoreo para la invasión por pez león.
Las densidades de pez león en la mayoría de los sitios estudiados fueron similares entre años; sin embargo, se obtuvieron algunos valores extremos con algunos sitios que muestran densidades mucho más altas que el promedio, y otros donde no se registró la presencia de pez león (Figura 2). La prueba de la mediana de Mood mostró que no hubo diferencias significativas en las densidades de pez león entre los años muestreados (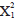 = 1,70; p = 0,19), ni entre las localidades (
= 1,70; p = 0,19), ni entre las localidades (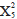 = 5,93; p = 0,31), ni entre las profundidades de muestreo (
= 5,93; p = 0,31), ni entre las profundidades de muestreo (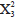 = 1,47; p = 0,68).
= 1,47; p = 0,68).
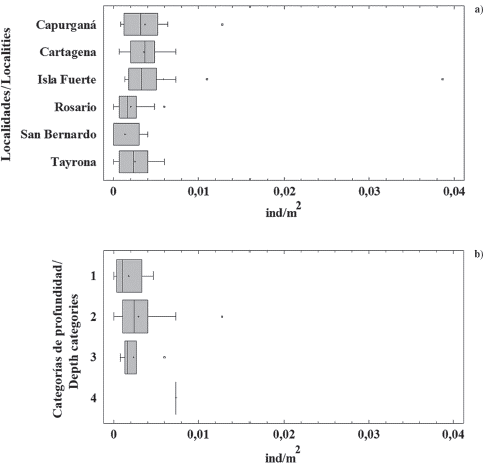
Figura 2 a) Densidad del pez león en seis localidades de la costa Caribe colombiana: Capurganá (n = 77), Cartagena (n = 63), isla Fuerte (n = 84), Rosario (n = 99), San Bernardo (n = 38), Tayrona (n = 88). b) Densidad del pez león a diferentes profundidades: 1 (1-10 m, n = 25), 2 (> 10-20 m, n = 108), 3 (> 20-30 m, n = 34), 4 (> 30-40 m, n = 3). La línea dentro de las cajas representa la mediana, los límites de las cajas son los percentiles 25 y 75, los bigotes marcan los valores mínimo y máximo, y los puntos por fuera de las cajas son datos atípicos.
Las variaciones en la densidad del pez león entre localidades podrían deberse a diferencias en el régimen de acciones de control, principalmente porque los torneos de pez león y la cacería frecuente que hacen las escuelas de buceo están ocurriendo solo en algunas áreas. Por ejemplo, las localidades Rosario, San Bernardo y Tayrona, al ser áreas protegidas en el Sistema Nacional de Parques Naturales, tienen acciones de control de la invasión desde 2010 (e.g. Resolución MAVDT 0132 de 2010). Además, debido a la proximidad de las ciudades turísticas a estas áreas, la cacería del pez león por parte de pescadores y buzos es frecuente (L. Chasqui obs. pers.). Por el contrario, Capurganá e isla Fuerte son lugares remotos que carecen de figuras de protección y donde la presencia de buzos es escasa; por lo tanto, las acciones de control de las poblaciones del invasor han sido prácticamente inexistentes. Diferentes estudios en el AO destacan la necesidad de controlar el número de peces león mediante la cacería constante y los torneos de pesca, que son quizás las únicas acciones disponibles hasta la fecha para enfrentar la invasión biológica por P. volitans (Barbour et al., 2011; Frazer et al, 2012; De León et al, 2103; Green et al, 2017).
Las variaciones en la abundancia (y tamaño) del pez león han sido documentadas previamente en diferentes lugares del área invadida, y a menudo aumentan con la profundidad (e.g.Claydon et al., 2012; González et al., 2016; Hunt et al., 2019). Entre las explicaciones, se ha mencionado la mayor presión de pesca en aguas poco profundas, ya que la presión de la pesca disminuye con la profundidad hasta ser prácticamente inexistente en entornos fuera del alcance del buceo recreativo (e.g. ecosistemas coralinos mesofóticos - MCE). Al respecto, Andradi-Brown et al. (2017), al estudiar poblaciones de pez león en un gradiente de profundidad, encontraron altas densidades a más de 30 m, así como tamaños más grandes y hembras más fértiles, lo que puede estar minando los esfuerzos de control en aguas someras. Ellos señalan la necesidad de entender y considerar la importancia de los MCE en el ciclo de vida de la especie, y de buscar estrategias para extender las acciones de control de la invasión del pez león a esos ambientes.
Múltiples factores que actúan solos o en sinergia pueden influir en la distribución y abundancia del pez león, y podrían haber determinado las diferencias observadas en la densidad entre los sitios de muestreo; por ejemplo, la complejidad estructural del fondo, la disponibilidad de refugios, la conectividad espacial de los parches de hábitat y la abundancia de presas, entre otros (Biggs y Olden, 2011; Hernández-Abello et al., 2015; Rivera-Aponte et al., 2019; Díaz-Ferguson y Hunter, 2019).
AGRADECIMIENTOS
El trabajo se realizó como parte del convenio 275 de 2015 entre MinAmbiente e INVEMAR, y la Resolución 0478 de MinAmbiente de 2016. Gracias a Arnold Fonseca, Maria Parrado, Javier Torres, Adolfo Sanjuan, Diana Vergara, Carlos Aponte, Arnold Llorente, Deibis Seguro y Diego Arnedo por su ayuda en la toma de datos. Gracias al personal del PNN Corales del Rosario y San Bernardo y del PNN Tayrona por el apoyo logístico durante el trabajo de campo en sus áreas protegidas. Gracias a David Forero por elaborar el mapa del área de estudio. Gracias a los evaluadores por su contribución a mejorar considerablemente el manuscrito. Número de contribución de INVEMAR # 1266.
REFERENCIAS
Acero P., A., D. Bustos-Montes, P. Pabón Q., C.J. Polo-Silva and A. Sanjuan M. 2019. Feeding habits of Pterois volitans: a real threat to Caribbean coral reef biodiversity. 269-314. En: Makowski, C. and C.W. Finkl (Eds). Impacts of Invasive Species on Coastal Environments. Coastal Research Library, vol. 29. Springer, Cham. 482 p. [ Links ]
Agudo, E.A. and E. Klein. 2014. Lionfish abundance, size structure and spatial distribution along the Venezuelan coast (Pterois volitans, Pteroinae: Scorpaenidae). Rev. Biol. Trop., 62(3): 151-158. [ Links ]
Albins, M.A. and M.A. Hixon. 2008. Invasive Indo-Pacific lionfish Pterois volitans reduce recruitment of Atlantic coral-reef fishes. Mar. Ecol. Prog. Ser., 367: 233- 238. doi: 10.3354/meps07620 [ Links ]
Andradi-Brown, D.A., R. Grey, A. Hendrix, D. Hitchner, C.L. Hunt, E. Gress, K. Madej, R.L. Parry, C. Régnier-McKellar, O.P. Jones, M. Arteaga, A.P. Izaguirre, A.D. Rogers and D.A. Exton. 2017. Depth-dependent effects of culling - do mesophotic lionfish populations undermine current management? R. Soc. open sci., 4: 170027. http://dx.doi.org/10.1098/rsos.170027 [ Links ]
Ballew, N.G., N.M. Bacheler, G.T. Kellison and A.M. Schueller. 2016. Invasive lionfish reduce native abundance on a regional scale. Sci. Rep. 6, 32169; doi: 10.1038/srep32169 (2016). [ Links ]
Barbour, A.B., M.S. Allen, T.K. Frazer and K.D. Sherman. 2011. Evaluating the potential efficacy of invasive lionfish (Pterois volitans) removals. PLoS ONE, 6(5): e19666. doi:10.1371/journal.pone.0019666. [ Links ]
Bayraktarov, E., J. Alarcón-Moscoso, A. Polanco F. and C. Wild. 2014. Spatial and temporal distribution of the invasive lionfish Pterois volitans in coral reefs of Tayrona National Natural Park, Colombian Caribbean. PeerJ 2:e397; DOI 10.7717/peerj.397. [ Links ]
Betancur-R., R., A. Hines, A. Acero P ., G. Ortí, A.E. Wilbur and D.W. Freshwater. 2011. Reconstructing the lionfish invasion: insights into Greater Caribbean biogeography. J. Biogeogr., 38(7): 1281-1293. doi:10.1111/j.1365-2699.2011.02496.x. [ Links ]
Biggs, C.R. and J.D. Olden. 2011. Multi-scale habitat occupancy of invasive lionfish (Pterois volitans) in coral reef environments of Roatan, Honduras. Aquat. Invasions, 6(3): 347-353. doi: 10.3391/ai.2011.6.3.11. [ Links ]
Claydon, J.A.B., M.C. Calosso and S.B. Traiger. 2012. Progression of invasive lionfish in seagrass, mangrove and reef habitats. Mar. Ecol. Prog. Ser., 448: 119-129. doi: 10.3354/meps09534. [ Links ]
Darling , D., P. Chevalier Monteagudo, J.J. Schmitter-Soto, R.I. Corrada Wong, H. Salvat Torres, E. Cabrera Sansón, A. García Rodríguez, A. Fernández Osorio, L. Espinosa Pantoja, D. Cabrera Guerra, L.M. Pantoja Echevaria, H. Caballero Aragón and S. Perera Valderrama. 2016. Density, size, biomass, and diet of lionfish in Guanahacabibes National Park, western Cuba. Aquat. Biol., 24: 219-226. doi: 10.3354/ab00651. [ Links ]
Coronado-Carrascal, V., R. García-Urueña y A. Acero P . 2015. Comunidad de peces arrecifales en relación con la invasión del pez león: el caso del Caribe sur. Bol. Invest. Mar. Cost., 44(2): 291-302. [ Links ]
Côté, I.M., S.J. Green andM.A. Hixon . 2013. Predatory fish invaders: Insights from Indo-Pacific lionfish in the Western Atlantic and Caribbean. Biol. Conserv., 164: 50-61. http://dx.doi.org/10.1016/j.biocon.2013.04.014. [ Links ]
Cure, K., J.L. McIlwain and M.A. Hixon . 2014. Habitat plasticity in native Pacific red lionfish Pterois volitans facilitates successful invasion of the Atlantic. Mar. Ecol. Prog. Ser., 506: 243-253. doi: 10.3354/meps10789. [ Links ]
Darling, E.S., S.J. Green, J.K. O'Leary and I.M. Côté. 2011. Indo-Pacific lionfish are larger and more abundant on invaded reefs: a comparison of Kenyan and Bahamian lionfish populations. Biol. Invasions, 13: 2045-2051. DOI 10.1007/s10530-011-0020-0. [ Links ]
De la Guardia, E., D. Cobián-Rojas, L. Espinosa, Z. Hernández, L. García y J.E. Arias-González. 2017. Distribución y abundancia del pez león Pterois volitans (Scorpaeniformes: Scorpaenidae) y especies nativas asociadas en el Parque Marinos Cayos de San Felipe, Cuba. Rev. Biol. Trop., 65(1): 117-125. [ Links ]
De León, R., K. Vane, P. Bertuol, V.C. Chamberland, F. Simal, E. Imms and M.J.A. Vermeij. 2013. Effectiveness of lionfish removal efforts in the southern Caribbean. Endang. Species Res., 22: 175-183. doi: 10.3354/esr00542. [ Links ]
Díaz-Ferguson, E.E. and M.E. Hunter. 2019. Life history, genetics, range expansion and new frontiers of the lionfish (Pterois volitans, Perciformes: Pteroidae) in Latin America. Reg. Stud. Mar. Sci., 31: 100793. https://doi.org/10.1016/j.rsma.2019.100793. [ Links ]
Elise, S., I. Urbina-Barreto, H. Boadas-Gil, M. Galindo-Vivas and M. Kulbicki. 2015. No detectable effect of lionfish (Pterois volitans and P. miles) invasion on a healthy reef fish assemblage in Archipelago Los Roques National Park, Venezuela. Mar. Biol., 162: 319-330. https://doi.org/10.1007/s00227-014-2571-y. [ Links ]
Ferreira, C.E.L., O.J. Luiz, S.R. Floeter, M.B. Lucena, M.C. Barbosa, C.R. Rocha and L.A. Rocha. 2015. First record of invasive lionfish (Pterois volitans) for the Brazilian coast. PLoS ONE 10(4): e0123002. doi:10.1371/journal.pone.0123002. [ Links ]
Fogg, A.Q., N.J. Brown-Peterson and M.S. Peterson. 2017. Reproductive life history characteristics of invasive red lionfish (Pterois volitans) in the northern Gulf of Mexico. Bull. Mar. Sci., 93(3): 791-813. https://doi.org/10.5343/bms.2016.1095. [ Links ]
Frazer, T.K., C.A. Jacoby, M.A. Edwards, S.C. Barry and C.M. Manfrino. 2012. Coping with the lionfish invasion: can targeted removals yield beneficial effects? Rev. Fish. Sci., 20(4): 185-191, DOI: 10.1080/10641262.2012.700655. [ Links ]
García-Rodríguez, A., P.P. Chevalier M., E. Cabrera S., H. Caballero A., J.L. Hernández L. 2015. Densidad y biomasa de Pterois volitans/miles (Teleostei: Scorpaenidae) en arrecifes del litoral oeste de la Habana, Cuba. Rev. Invest. Mar., 35(1): 21-36. [ Links ]
García-Urueña, R., A. Acero P . y V. Coronado-Carrascal. 2015. Comunidad de peces arrecifales en presencia del pez león (Pterois volitans) en Santa Marta, Caribe colombiano. Rev. MVZ Córdoba, 20 (Supl.): 4989-5003. [ Links ]
Gardner, P.G., T.K. Frazer, C.A. Jacoby and R.P.E. Yanong. 2015. Reproductive biology of invasive lionfish (Pterois spp.). Front. Mar. Sci., 2:7. doi:10.3389/fmars.2015.00007. [ Links ]
González, J., M. Grijalba-Bendeck, A. Acero P . and R. Betancur-R . 2009. The invasive red lionfish, Pterois volitans (Linnaeus, 1758), in the southwestern Caribbean Sea. Aquat. Invasions, 4(3): 507-510. DOI 10.3391/ai.2009.4.3.12. [ Links ]
González, J. D., A. Acero P ., A. Serrat-LL y R. Betancur-R . 2011. Caracterización taxonómica de la población del pez león Pterois volitans (Linnaeus 1758) (Scorpaenidae) residente en el Caribe colombiano: merística y morfometría. Biota Colomb., 12(2): 15-21. [ Links ]
González-Corredor, J.D., A. Acero P . y R. García-Urueña. 2016. Densidad y estructura de tallas del pez león Pterois volitans (Scorpaenidae) en el Caribe occidental insular colombiano. Bol. Invest. Mar. Cost., 45(2): 317-333. [ Links ]
Green, S.J. 2013. El monitoreo: una actividad fundamental. 59-82. En: J.A. Morris Jr. (ed.) El pez león invasor: guía para su control y manejo. Gulf and Caribbean Fisheries Institute Special Publication Series Number 2, Marathon, Florida, USA. 126 p. [ Links ]
Green, S.J. and I.M. Côté. 2009. Record densities of Indo-Pacific lionfish on Bahamian coral reefs. Coral Reefs, 28: 107. DOI 10.1007/s00338-008-0446-8. [ Links ]
Green, S.J ., J.L. Akins, A. Maljkovic and I.M. Côté . 2012. Invasive lionfish drive Atlantic coral reef fish declines. PLoS ONE, 7(3): e32596. doi:10.1371/journal.pone.0032596. [ Links ]
Green, S.J ., N. Tamburello, S.E. Miller, J.L. Akins and I.M. Côté . 2013. Habitat complexity and fish size affect the detection of Indo-Pacific lionfish on invaded coral reefs. Coral Reefs, 32: 413-421. DOI 10.1007/s00338-012-0987-8. [ Links ]
Green, S.J ., E.B. Underwood and J.L. Akins . 2017. Mobilizing volunteers to sustain local suppression of a global marine invasion. Conserv. Lett., 10: 728-735. DOI: 10.1111/conl.12426. [ Links ]
Green, S.J ., E.R. Dilley, C.E. Benkwitt, A.C.D. Davis, K.E. Ingeman, T.L. Kindinger, L.J. Tuttle and M.A. Hixon . 2019. Trait-mediated foraging drives patterns of selective predation by native and invasive coral-reef fishes. Ecosphere, 10(6):e02752.10.1002/ecs2.2752. [ Links ]
Hackerott, S., A. Valdivia, S.J. Green , I.M. Côté , C.E. Cox, L. Akins, C.A. Layman, W.F. Precht and J.F. Bruno. 2013. Native predators do not influence invasion success of Pacific lionfish on Caribbean Reefs. PLoS ONE, 8(7): e68259. doi:10.1371/journal.pone.0068259. [ Links ]
Hamner, R.M., D.W. Freshwater and P.E. Whitfield. 2007. Mitochondrial cytochrome b analysis reveals two invasive lionfish species with strong founder effects in the western Atlantic. J. Fish. Biol., 71(Supp. B): 214-222. doi:10.1111/j.1095-8649.2007.01575.x. [ Links ]
Hernández-Abello, J.M., R.P. García-Urueña y A. Acero P . 2015. Estructura de tallas y preferencia al sustrato del pez león (Pterois volitans) (Scorpaeniformes: Scorpaenidae) en Santa Marta (Colombia). Acta Biol. Colomb., 20(2):175-182. doi: http://dx.doi.org/10.15446/abc.v20n2.41611. [ Links ]
Hunt, C.L., G.R. Kelly, H. Windmill, J. Curtis-Quick, H. Conlon, M.D.V. Bodmer, A.D. Rogers and D.A. Exton . 2019. Aggregating behavior in invasive Caribbean lionfish is driven by habitat complexity. Scientific Reports, 9:783. DOI:10.1038/s41598-018-37459-w. [ Links ]
Ingeman, K.E. 2016. Lionfish cause increased mortality rates and drive local extirpation of native prey. Mar. Ecol. Prog. Ser., 558: 235-245. doi: 10.3354/ meps11821. [ Links ]
Lesser, M.P. and M. Slattery. 2011. Phase shift to algal dominated communities at mesophotic depths associated with lionfish (Pterois volitans) invasion on a Bahamian coral reef. Biol. Invasions, 13: 1855-1868. DOI 10.1007/s10530-011-0005-z. [ Links ]
Morris, J.A. Jr. (Ed). 2013. El pez león invasor: guía para su control y manejo. Gulf and Caribbean Fisheries Institute Special Publication Series, No. 2, Marathon, Florida. USA. 126 p. [ Links ]
Muñoz, R.C., C.A. Currin and P.E. Whitfield . 2011. Diet of invasive lionfish on hard bottom reefs of the Southeast USA: insights from stomach contents and stable isotopes. Mar. Ecol. Prog. Ser., 432: 181-193. doi: 10.3354/meps09154. [ Links ]
Muñoz-Escobar, L. y D.L. Gil-Agudelo. 2012. Composición dietaria del pez león, Pterois volitans (Pisces: Scorpaenidae), en Santa Marta y el Parque Nacional Natural Tayrona. Bol. Invest. Mar. Cost., 41(2): 471-477. [ Links ]
Pabón Q., P. y A. Acero P . 2015. Ecología trófica del invasor pez león Pterois volitans en el Caribe colombiano: impacto sobre familias ícticas de Santa Marta y San Andrés. 51-74. En: Campos, N.H. y A. Acero P . (eds.). 2015. Contribuciones en Ciencias del Mar de la Universidad Nacional de Colombia-2015. Cecimar, Sede Caribe, Universidad Nacional de Colombia, Santa Marta, 130 p. [ Links ]
Pusack, T.J., C.E. Benkwitt , K. Cure and T.L. Kindinger . 2016. Invasive red lionfish (Pterois volitans) grow faster in the Atlantic Ocean than in their native Pacific range. Environ. Biol. Fish., 99: 571-579. DOI 10.1007/s10641-016-0499-4. [ Links ]
Rivera-Aponte, I.M., E. Hernández-Delgado, J. Bauzá-Ortega y W. Ithier-Guzmán. 2019. Distribución espacial y preferencia de hábitat del pez león Pterois volitans en el estuario urbano de la Bahía de San Juan. Perspectivas en Asuntos Ambientales, 7: 75-91. [ Links ]
Rojas-Vélez, S., J. Tavera and A. Acero. 2019. Unraveling lionfish invasion: is Pterois volitans truly a morphologically novel predator in the Caribbean? Bio. Invasions, 21: 1921-1931. https://doi.org/10.1007/s10530-019-01946-6. [ Links ]
Sabido-Itzá, M.M. and M.C. García-Rivas. 2019. Record of abundance, spatial distribution and gregarious behavior of invasive lionfish Pterois spp. (Scorpaeniformes: Scorpaenidae) in coral reefs of Banco Chinchorro Biosphere Reserve, southeastern Mexico. Lat. Am. J. Aquat. Res., 47(2): 349-355. DOI: 10.3856/vol47-issue2-fulltext-15. [ Links ]
Sandel, V., D. Martínez-Fernández, D. Wangpraseurt and L. Sierra. 2015. Ecology and management of the invasive lionfish Pterois volitans/miles complex (Perciformes: Scorpaenidae) in Southern Costa Rica. Rev. Biol. Trop., 63(1): 213-221. [ Links ]
Schofield, P.J. 2009. Geographic extent and chronology of the invasion of non-native lionfish (Pterois volitans [Linnaeus 1758] and P. miles [Bennett 1828]) in the Western North Atlantic and Caribbean Sea. Aquat. Invasions, 4(3): 473-479. DOI 10.3391/ai.2009.4.3.5 [ Links ]
Schofield, P.J. 2010. Update on geographic spread of invasive lionfishes (Pterois volitans [Linnaeus, 1758] and P. miles [Bennett, 1828]) in the Western North Atlantic Ocean, Caribbean Sea and Gulf of Mexico. Aquat. Invasions, 5(Supp1): S117-S122. doi: 10.3391/ai.2010.5.S1.024. [ Links ]
Schmitt, E.F. and K.M. Sullivan. 1996. Analysis of a volunteer method for collecting fish presence and abundance data in the Florida Keys. Bull. Mar. Scie., 59(2): 404-416. [ Links ]
USGS-NAS. 2020. United States Geological Survey - Nonindigenous Aquatic Species Database (USGS-NAS). https://nas.er.usgs.gov , Access Date: 5/13/2020. [ Links ]
Whitfield, P.E., J.A. Hare, A.W. David, S.L. Harter, R.C. Muñoz and C.M. Addison. 2007. Abundance estimates of the Indo-Pacific lionfish Pterois volitans/ miles complex in the Western North Atlantic. Biol. Invasions, 9: 53-64. DOI 10.1007/s10530-006-9005-9. [ Links ]
Recibido: 09 de Marzo de 2020; Aprobado: 24 de Junio de 2020











 texto en
texto en 


