Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.2 Santa Marta jul./dic. 2020 Epub 20-Dic-2020
https://doi.org/10.25268/bimc.invemar.2020.49.2.940
Artículos de Investigación
Incidencia estacional de mareas rojas en la bahía de Santa Marta y sectores adyacentes, Caribe colombiano
1Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (Invemar), Santa Marta D.T.C.H., Colombia.; julian.franco@invemar.org.co; luisa.espinosa@invemar.org.co
Con el propósito de describir las condiciones ambientales y climáticas asociadas con la ocurrencia de seis eventos de mareas rojas entre 2010 y 2017 en Santa Marta (Caribe colombiano), se recopiló la información biológica y fisicoquímica obtenida durante estos eventos. Adicionalmente, se consultaron los datos de precipitación y el Índice Oceánico de El Niño (ONI) entre 2010 y 2017. Los resultados mostraron que el dinoflagelado Cochlodinium sp. fue el responsable de tres eventos ocurridos en octubre de 2010, octubre de 2011 y noviembre de 2015, períodos en los que alcanzó densidades máximas de 5 x 106 cél. L-1. Estos eventos se asociaron con un incremento en las precipitaciones y la temperatura superficial del agua de mar (29,7 °C) y con un descenso en la salinidad (< 35,5). El ciliadoMesodinium cf. rubrum fue responsable de otros tres eventos (enero de 2015, enero de 2017 y marzo de 2017), períodos en los que registró concentraciones máximas de 9,2 x 106 cél. L-1. Durante estos últimos eventos, no se presentaron precipitaciones y se evidenciaron elevadas concentraciones de nutrientes, incrementos en la salinidad (> 36,6) y temperaturas del mar inferiores a 26 °C. Al asociar las ocurrencias de mareas rojas y los valores del índice ONI, se evidenció que las floraciones de Cochlodinium sp. ocurrieron durante años influenciados por eventos climáticos (térmicos) moderados y fuertes (ONI > ±1 °C) en tanto que las floraciones de M. cf. rubrum se presentaron durante años neutrales (ONI entre 0,5 y -0,5 °C). Las mareas rojas presentaron un patrón temporal de ocurrencia en la región del Magdalena, influenciadas por la variabilidad climática y ambiental de cada época, sin representar hasta el momento un riesgo para la salud humana.
PALABRAS CLAVE: mareas rojas; floraciones algales; variabilidad climática; Caribe colombiano
In order to describe the environmental and climatic conditions associated with the occurrence of six red tide events between 2010 and 2017, in Santa Marta (Colombian Caribbean), biological and physicochemical information during these events was collected. Additionally, precipitation data and the Oceanic Niño Index (ONI) between 2010 and 2017 were consulted. The results showed that the dinoflagellate Cochlodinium sp. was responsible for three events that occurred in October 2010, October 2011 and November 2015, reaching a maximum densities of 5 x 106 cells L-1. These events were associated with an increase in rainfalls and seawater surface temperature (29.7 °C) and a decrease in salinity (< 35.5). The Mesodinium cf. rubrum ciliate was responsible for three other events (January 2015, January 2017 and March 2017), recording maximum concentrations of 9.2 x 106 cells L-1. During these last events, there was no rainfall and high concentrations of nutrients, increases in salinity (> 36.6) and sea temperatures below 26 °C were evident. Associating the occurrences of red tide events and the ONI index, it was evidenced that Cochlodinium sp. blooms occurred during years influenced by moderate-strong climatic (thermal) events (ONI > ±1 °C) whereas the blooms of M. cf. rubrum occurred during neutral years (ONI between 0.5 and -0.5 °C). The red tides presented a temporal pattern of occurrence in the Magdalena region, influenced by the climatic and environmental variability of each period, without representing a risk to human health until now.
KEYWORDS: red tides; algae blooms; climatic variability; Colombian Caribbean
INTRODUCCIÓN
Las mareas rojas son fenómenos naturales que normalmente causan cambios en la coloración del agua como consecuencia del incremento en el tamaño, la densidad o la acumulación de organismos planctónicos pigmentados, entre los cuales se incluyen microalgas, cianobacterias y ciliados microzooplanctónicos. Estos eventos ocurren en diversas partes del mundo y su aparente incremento tanto en frecuencia como en intensidad, en las últimas décadas, es cada vez más evidente a escala global (Sar et al., 2002; Hallegraeff et al., 2004). Algunos estudios indican que son varios los factores que influyen en la formación de mareas rojas, incluyendo la salinidad, la temperatura del agua, las concentraciones de nutrientes y la disponibilidad de luz (McGaraghan et al., 2012; California Ocean Science Trust, 2016).
Estas mareas suelen ser inocuas y poco frecuentes cuando ocurren en áreas con una tasa alta de intercambio de agua o donde no se emplea la acuicultura a gran escala. Sin embargo, en algunos casos, pueden considerarse un problema cuando causan impactos a nivel socioeconómico y afectan el comercio y el turismo. Pueden llegar, incluso, a generar un riesgo para la salud pública, particularmente si las floraciones son producidas por especies nocivas que representan un peligro para los organismos, incluyendo el ser humano, ya que algunas de ellas tienen la capacidad de producir toxinas potentes (Sar et al., 2002; Hallegraeff et al., 2004; Reguera et al., 2011, 2016).
En Colombia, los eventos de mareas rojas han sido evidentes por años en el ámbito local, en zonas costeras, pero la mayoría de esta información no es pública. Sin embargo, se han divulgado algunos reportes sobre la presencia de microalgas potencialmente nocivas y el impacto negativo producido por las floraciones algales nocivas (FAN) (Mancera-Pineda et al., 2009, 2014; Rodríguez et al., 2010; Arbeláez et al., 2017; Ruiz y Mancera-Pineda, 2019). En los últimos años, se ha observado un incremento en la frecuencia de aparición de mareas rojas en la zona costera del departamento del Magdalena (Colombia), particularmente en la región de Santa Marta (Invernar, 2010, 2015a, 2015b, 2017a, 2017b; Malagón y Perdomo, 2013). Por esta razón, el presente estudio tiene como objetivos analizar la posible influencia de las variables ambientales y climáticas en la aparición de los eventos de mareas rojas ocurridas entre 2010 y 2017 y tratar de identificar patrones temporales de ocurrencia.
ÁREA DE ESTUDIO
Santa Marta se encuentra ubicada en la porción nororiental del Caribe colombiano (11°15'-22' N y 73°57'-74°12' W) (Figura 1; Díaz et al., 2000), en el área de influencia de uno de los ecosistemas más estratégicos del país: la Sierra Nevada de Santa Marta, declarada por la Unesco como Reserva de la Biosfera desde 1979. La región incluye aproximadamente diez bahías que representan diversos ecosistemas, las cuales, en su mayoría, están ubicadas en el Parque Nacional Natural Tayrona (PNNT), una de las áreas protegidas del Caribe colombiano.
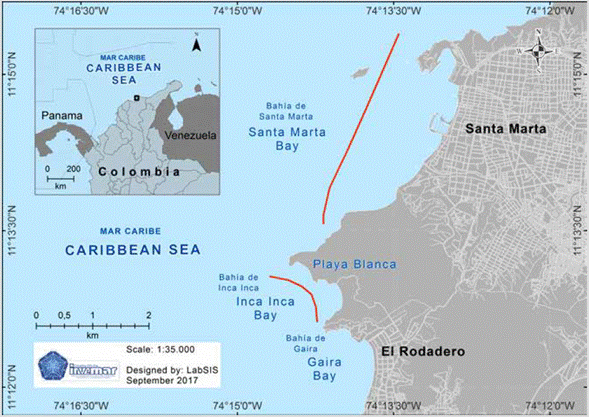
Figura 1 Mapa de Santa Marta (Caribe colombiano) con las localidades en las cuales se han detectado mareas rojas (línea roja). Elaborado por el Laboratorio de Servicios de Información (Labsis) del Invemar.
El área urbana que integra la bahía de Santa Marta presenta una población de aproximadamente 507 000 habitantes (Cámara de Comercio de Santa Marta, 2018). En esta región predominan las actividades portuarias y turísticas, las cuales han experimentado un rápido incremento y se han convertido en el ingreso económico más importante de la ciudad, junto con el comercio y la pesca local, en orden de importancia (Vega-Sequeda et al., 2008).
El clima de la región se encuentra regido por el patrón climático de la costa Caribe colombiana: una época seca de diciembre a abril y una época de lluvias de mayo a noviembre. Sin embargo, en detalle, se han descrito cuatro épocas climáticas: seca mayor (de diciembre a abril), en la cual la presencia de los vientos alisios del norte genera eventos de surgencia, así como disminución de la temperatura del agua de mar (20-25 °C) e incremento de la salinidad (> 38) y de la intensidad del oleaje; lluviosa menor (de mayo a junio), que se caracteriza por una leve disminución de los vientos alisios y la aparición de precipitaciones ligeras; seca menor o "veranillo de San Juan" (de julio a agosto), cuya característica principal es la intensificación de los vientos alisios, que vuelven a ser dominantes pero con menor fuerza, y lluviosa mayor (de septiembre a noviembre), época en la cual se incrementan las precipitaciones (más del 65 % del volumen anual), desaparecen los vientos alisios, tiende a aumentar la temperatura del mar (27-29 °C), disminuye la salinidad del agua (< 34) y se acrecienta la carga de sedimentos, lo cual a su vez aumenta la turbidez del agua a causa del incremento en aportes continentales (Ramírez, 1983; Bula-Meyer, 1985; Díaz et al., 2000; Garzón-Ferreira y Díaz, 2003; Rodríguez-Ramírez y Garzón-Ferreira, 2003; Franco-Herrera, 2005). Cabe resaltar que este patrón puede variar, particularmente al haber influencia de eventos climáticos como el fenómeno de La Niña y El Niño (Franco-Herrera, 2005; Montealegre, 2014).
En cuanto a la hidrodinámica, la bahía de Santa Marta se ve influenciada principalmente por dos tipos de macrocorrientes: la corriente del Caribe, formada por la acción de los vientos alisios durante la época seca, y la contracorriente Panamá-Colombia (durante el período de lluvias), proveniente del suroeste de la cuenca del Caribe. Ambas macrocorrientes regulan parcialmente los patrones de circulación superficial local dentro de las bahías ubicadas en la región del Magdalena (Franco-Herrera, 2005). Así mismo, la bahía de Santa Marta recibe aportes continentales atribuidos no solo a la escorrentía, sino también a la desembocadura del río Manzanares, el cual cruza la ciudad y descarga sus aguas directamente en el sector sur de la bahía.
MATERIALES Y MÉTODOS
La información biológica y de parámetros fisicoquímicos fue recopilada durante seis eventos de mareas rojas ocurridos en las bahías de Santa Marta y de Gaira entre 2010 y 2017 (Invernar, 2010, 2015a, 2015b, 2017a, 2017b; Malagón y Perdomo, 2013). Para determinar las características del agua durante estos eventos se hicieron observaciones y se identificó la dispersión de los parches rojizos. Una vez ubicados los parches, se establecieron de tres a cuatro puntos de muestreo para cada evento, en los cuales se midieron aspectos como temperatura del agua, salinidad, oxígeno disuelto y pH, y se recolectaron muestras de un litro de agua para realizar el análisis de nutrientes inorgánicos disueltos (nitrógeno y fósforo). Estas muestras se depositaron en botellas plásticas lavadas previamente y se transportaron al laboratorio para realizar los análisis correspondientes de acuerdo con las metodologías establecidas (Strickland y Parsons, 1972; APHA et al., 2012).
Con el propósito de establecer si el cambio en la coloración del agua era causado por la floración de organismos microscópicos, en los mismos puntos en los cuales se recolectaron las muestras para el análisis fisicoquímico se tomaron directamente muestras de 500 y 80 mL de agua superficial (< 1 m). En cada evento, la muestra de 80 mL se almacenó sin fijar y la de 500 mL se fijó con lugol neutral en proporción 1/100 (Reguera et al., 2016). Luego, las muestras se transportaron a la Unidad de Laboratorios de Calidad Ambiental Marina (Labcam) del Invemar para su análisis.
Las muestras sin fijador se analizaron inmediatamente para observar las células en vivo. Entre tanto, sobre las muestras fijadas con lugol se llevó a cabo un análisis cuantitativo, para lo cual se sedimentaron por tres horas alícuotas de 1 a 3 mL de la muestra debido a la alta concentración de células, siguiendo el método de sedimentación de Utermöhl (Reguera et al., 2016); se usó un microscopio invertido para hacer las observaciones (Edler y Elbrächter, 2010).
La identificación de organismos se realizó con base en las guías de Balech (1988) y Vidal (1995, 2010). Por su parte, los datos de precipitaciones (sumatoria mensual) y de temperatura superficial de mar se solicitaron al Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM, 2015; estación del aeropuerto Simón Bolívar) mientras que el Índice Oceánico de El Niño (ONI) se consultó en el sitio web de NOAA (2020).
El índice ONI es una medida de El Niño-Oscilación del Sur (ENSO) utilizada para detectar eventos cálidos y fríos como El Niño y La Niña, respectivamente, en el océano Pacífico tropical. Este índice se fundamenta en la media de tres meses consecutivos de las anomalías térmicas superficiales del mar, a partir de mediciones en la región de El Niño 3,4 (que corresponde a 5 °N-5 °S, 120-70 °W). Los valores neutrales corresponden a aquellos entre ±0,5 °C, valores superiores a 0,5 °C indican eventos de El Niño y valores inferiores a -0,5 °C indican eventos de La Niña por, al menos, cinco períodos consecutivos (NOAA, 2020).
RESULTADOS
El dinoflagelado Cochlodinium sp. (= Margalefidinium sp.; Figura 2) fue responsable de las tres mareas rojas detectadas en octubre de 2010, octubre de 2011 (Malagón y Perdomo, 2013) y noviembre de 2015. Los dos primeros eventos se observaron principalmente en la bahía de Santa Marta en tanto que el evento de 2015 se presentó en una bahía aledaña (bahía de Gaira). Estas floraciones se caracterizaron por la presencia de manchas de tono rojizo en el agua, las cuales se mantuvieron alejadas de la línea de costa y a una profundidad no mayor de 2 m. Los parches rojizos presentaron un desplazamiento de sur a norte, asociado con la contracorriente Panamá-Colombia, predominante entre septiembre y noviembre. Este período coincide con la época anual de lluvias, acompañada de ligeros vientos del sureste.

Figura 2 Células de Cochlodinium sp. (= Margalefidinium sp.) observadas en las muestras recolectadas durante el evento de mareas rojas ocurrido en las bahías de Santa Marta y Gaira en noviembre de 2015. Barra de escala: 20 µm.
Cochlodinium sp. (= Margalefidinium sp.) fue la especie más representativa entre las microalgas observadas durante los muestreos, con abundancias relativas (AR) superiores a 95 %. Los individuos se encontraban aislados o formaban cadenas de cuatro células (Figura 2) y, con menos frecuencia, de ocho células. La densidad máxima (5 x 106 cél L-1) se observó en la bahía de Santa Marta en octubre de 2010. Durante los tres eventos (octubre de 2010, octubre de 2011 y noviembre de 2015), las condiciones ambientales típicas del período de lluvias se caracterizaron por el incremento de las precipitaciones (> 90 mm [volumen total por mes]) y el consecuente descenso de los vientos alisios, así como por el incremento del aporte de aguas continentales provenientes del río Manzanares y de otros aportes. Esto último generó una disminución de la salinidad (< 35,5) y un aumento en la temperatura del agua (> 29,7 °C) (Tabla 1).
Tabla 1 Variables fisicoquímicas registradas durante los eventos de mareas rojas (valores relacionados con las densidades máximas). Los valores con el símbolo < se refieren a concentraciones de nutrientes por debajo del límite de detección.
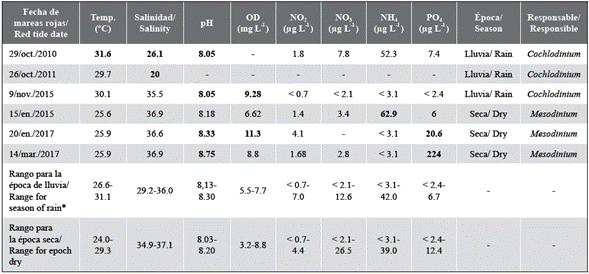
* Rango histórico de valores registrados en la bahía de Santa Marta de 2014 a 2017, en la época lluviosa y seca. Datos del monitoreo de microalgas nocivas en Colombia realizado por el Invemar.
Nota: los números en negrilla indican los valores observados por fuera del rango histórico registrado en la bahía de Santa Marta de 2014 a 2017.
Tres eventos más se registraron durante enero de 2015, enero de 2017 y marzo de 2017 atribuidos al ciliado Mesodinium cf. rubrum (Figura 3), el cual formó manchas de color rojo intenso. El presente estudio corresponde al primer registro de mareas rojas producido por dicho ciliado en las costas del Caribe colombiano. Estos organismos alcanzaron densidades máximas de 5,5 x 104 y 9,2 x 106 cél. L-1 y una AR de 90 %. Los eventos fueron evidentes durante la época seca, influenciada por vientos alisios y precipitaciones totales por mes inferiores a 0,1 mm. La mayor densidad celular se asoció con altas concentraciones de fosfatos (> 224 µg L-1), incremento de la salinidad (> 36,6) y temperatura del agua inferior a 26 °C (Tabla 1).
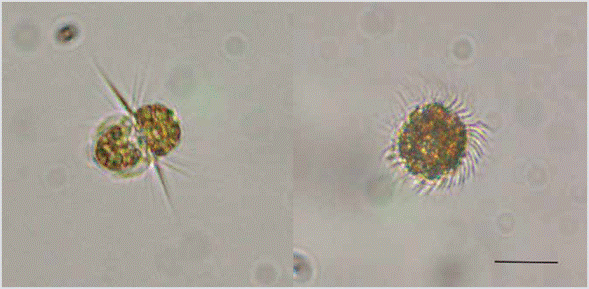
Figura 3 Células del ciliado Mesodinium cf. rubrum observadas durante la marea roja ocurrida en la bahía de Santa Marta en enero de 2017. Izq. Vista lateral de la célula. Der. Vista superior de la célula. Barra de escala: 20 µM.
En la mayoría de los eventos de mareas rojas registrados en la bahía de Santa Marta y en bahías cercanas a esta, las variables fisicoquímicas tales como la concentración de oxígeno disuelto en el agua y algunos nutrientes inorgánicos disueltos superaron el rango de concentraciones típicas de la zona (Tabla 1), siendo esta una característica clave que permite formular una hipótesis sobre las causas de la presencia de una floración algal. Durante los períodos en los que se registraron las mareas rojas, las fluctuaciones climáticas fueron más evidentes en la costa del Caribe colombiano, particularmente durante 2010-2011 y 2014-2016. Estos períodos plurianuales se vieron influenciados por dos eventos climáticos: un evento de La Niña durante 2010 que se mantuvo hasta 2011 y en el cual las precipitaciones incrementaron drásticamente (> 1000 mm) y un evento de El Niño, que inició en 2014 con intensidad moderada, se fortaleció en 2015 y se prolongó hasta mediados de 2016 (IDEAM, 2015; UNGRD, 2016).
Cabe mencionar que, a pesar de la fuerte sequía predominante en 2015, durante noviembre de ese año, mes en el cual se presentó una de las mareas rojas, se registró un incremento de las precipitaciones en Santa Marta (IDEAM), las cuales superaron 139 mm. Analizando los eventos de mareas rojas registrados y el índice ONI como indicador principal para monitorear los eventos de El Niño y La Niña, se hace evidente que las floraciones de Cochlodinium sp. (= Margalefidinium sp.) ocurrieron durante años influenciados por eventos climáticos moderados-fuertes, con valores ONI superiores a ± 1,0 °C. Por su parte, las floraciones causadas por Mesodinium cf. rubrum se presentaron durante años neutrales, con valores inferiores a ± 0,5 °C (Figura 4).
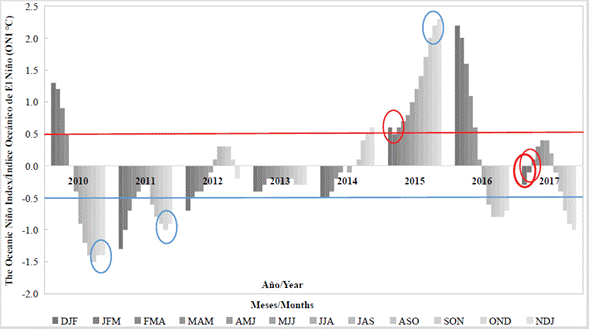
Figura 4 Índice ONI calculado entre 2010 y 2017. Eventos climáticos superiores a 0,5 °C se consideran influenciados por el fenómeno de El Niño mientras que eventos inferiores a -0,5 °C se consideran influenciados por el fenómeno de La Niña. Valores superiores a ±1,5 °C indican eventos climáticos fuertes. Los círculos azules corresponden a las mareas rojas de Cochlodinium sp. (= Margalefidinium sp.); los círculos rojos, a las de Mesodinium cf. rubrum ocurridas en la bahía de Santa Marta y en bahías aledañas.
DISCUSIÓN
Se registró un total de seis eventos de mareas rojas entre 2010 y 2017 en la región del Magdalena: tres fueron producidos por el dinoflagelado Cochlodinium sp. (= Margalefidinium sp.) y los otros tres por el ciliado Mesodinium cf. rubrum.Koray (1984) indica que regularmente las concentraciones de células en las mareas rojas varían de 106 cél. L-1 a 108 cél. L-1. Incluso, se alcanzan densidades superiores a 5,0 x 104 cél. L-1, valores similares a los observados en el área de estudio durante las floraciones de ambas especies.
Las mareas rojas producidas por Cochlodinium sp. (= Margalefidinium sp.) en octubre de 2010, octubre de 2011 y noviembre de 2015, durante la época de lluvias en el Magdalena, reflejan un comportamiento reiterativo en la proliferación de este dinoflagelado en el área, particularmente durante años en los que se presentaron eventos climáticos moderados-fuertes (negativos y positivos). Lo anterior podría mostrar la preferencia de estos dinoflagelados por condiciones extremas relacionadas principalmente con altas temperaturas (> 29,7 °C) del agua y disminución de la salinidad (< 35).
Morse et al. (2013) han observado floraciones repetitivas producidas por la especie Cochlodinium polykrikoides (= Margalefidinium polykrikoides) en la bahía de Chesapeake, en los Estados Unidos (océano Atlántico). Los autores indican que estas mareas rojas se originan en las desembocaduras de los ríos cuando la temperatura del agua aumenta durante los períodos de vientos débiles y bajas concentraciones de nutrientes. Similar a lo observado en la bahía de Santa Marta, la floración de C. polykrikoides en la bahía de Chesapeake y la ensenada de La Paz, golfo de California, coincidió con períodos de lluvia después de un prolongado período de sequía de verano. En estos eventos, el aporte de aguas continentales no solo fertilizó las aguas, sino que también generó gradientes verticales de densidad y temperatura que favorecieron la estabilidad de la columna de agua y crearon las condiciones adecuadas para la supervivencia y el crecimiento de C. polykrikoides (Alonso, 2004; Mulholland et al., 2009; López-Cortés et al., 2014). Así mismo, otros autores, incluidos Gárate-Lizárraga et al. (2000, 2004) y Gárate-Lizárraga (2013) en el golfo de California, Anton et al. (2008) en las costas de Malasia y Azanza et al. (2008) en Filipinas, también relacionaron las floraciones de este dinoflagelado con una alta concentración de nutrientes causada por la influencia de la lluvia y los vientos. Por esta razón, se considera que la concentración de nutrientes disueltos en el agua, así como la hidrodinámica de la zona, tiene una influencia significativa en sus altas densidades.
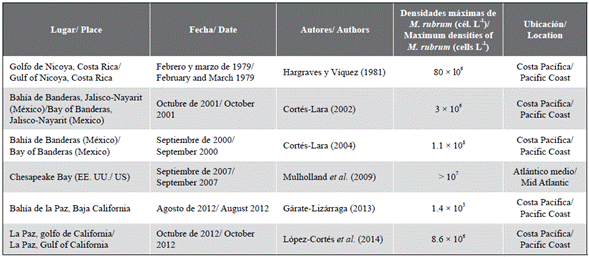
La mayoría de las floraciones o mareas rojas producidas por C. polykrikoides (= Margalefidinium polykrikoide) en América del Norte se han registrado en la costa del Pacífico, incluyendo las bahías de México y Costa Rica y el golfo de California (Tabla 2; Freer y Vargas-Montero, 2003; Gárate-Lizárraga y Muñetón-Gómez, 2008; Dorantes-Aranda et al., 2009; Calvo-Vargas y Arguedas-Rodríguez, 2012; López-Cortés et al., 2014). Algunas de estas floraciones han generado consecuencias drásticas para varias especies de peces. En Colombia, considerando la información recolectada por el Invemar mediante el sistema de monitoreo de microalgas nocivas en la región del Magdalena, el género Cochlodinium (= Margalefidinium) no suele ser común en el área: solo se observa al presentarse floraciones.
Tabla 2 Densidades de Cochlodinium (= Margalefidinium) registradas durante diferentes eventos de mareas rojas en la costa Pacífica y el Atlántico medio.
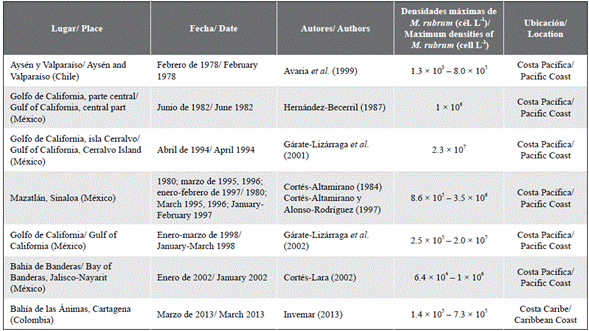
Por otra parte, las mareas rojas producidas por Mesodinium cf. rubrum fueron reiterativas durante los primeros meses del año (época seca) cuando la presencia de los vientos alisios generó las condiciones básicas para la ocurrencia de eventos de surgencia en las aguas costeras de la región del Caribe colombiano, proceso que enriquece las aguas superficiales con nutrientes como fósforo y nitrógeno, que se reincorporan en la columna de agua desde el fondo (Lindholm, 1985; Franco-Herrera, 2005; Jiménez y Gualancaña, 2006). Las densidades máximas alcanzadas por este ciliado durante las mareas rojas en el Caribe colombiano excedieron a las registradas por otros autores durante varios eventos que ocurrieron en ciudades costeras de Chile y México (Tabla 3). Sin embargo, algunos autores registraron densidades máximas superiores a 2 x 107 (Gárate-Lizárraga et al., 2001, 2002) durante las mareas rojas producidas en el golfo de California (Tabla 3). Esto indica que las densidades de M. cf. rubrum durante las proliferaciones registradas en Santa Marta están dentro del intervalo de máximos registrados en América del Norte. Además, en enero de 2013 se observó una marea roja de M. rubrum en la bahía de las Ánimas, ubicada en Cartagena de Indias (Caribe colombiano), con densidades máximas de 7,3 x 105 cél. L-1 (Tabla 3).
Tabla 3 Densidades de Mesodinium cf. rubrum registradas durante diferentes eventos de mareas rojas en la costa Caribe y Pacífica (modificado de Gárate-Lizárraga et al. , 2002).
Lindholm (1985) y Crawford (1989) mencionan que M. rubrum es una especie cosmopolita que produce floraciones ocasionales en zonas de surgencia, estuarios, fiordos y aguas costeras templadas. Las proliferaciones de M. rubrum también se han registrado en diferentes costas del mundo, incluyendo Estados Unidos (Johnson et al. , 2013), Inglaterra (Kifle y Purdie, 1993; Williams, 1996) y Brasil (De Oliveira, 2004), entre otros.
Las mareas rojas son recurrentes en la bahía de Santa Marta y en sectores cercanos y, de momento, no han representado un riesgo aparente para la salud pública ni de otros organismos. Sin embargo, algunas especies del género Cochlodinium (= Margalefidinium) han causado un alto número de muertes de organismos marinos en otros países costeros debido a su actividad hemolítica y a la producción de otros compuestos oxidantes (ROS = reactive oxygen species). Aunque su toxicidad no es clara y, hasta la fecha, existe controversia en torno a su mecanismo de acción (Kim et al., 2002; Gobler et al., 2008), algunos estudios han confirmado sus efectos adversos que incluyen hemólisis, alteración osmorreguladora y asfixia de organismos a causa de la producción de mucus (Lee, 1996; Kim et al., 1999, 2000, 2002). Por tal motivo, la especie Cochlodinium polyclicoides (= Margalefidinium polykrikoides) se encuentra incluida en la lista de referencias taxonómica de la COI de Unesco como especie productora de toxinas.
Por otro lado, las floraciones de Mesodinium cf. rubrum son generalmente inofensivas (Johnson y Stoecker, 2005). En casos extremos se han asociado con la muerte de peces y algunos invertebrados marinos debido a condiciones de hipoxia y anoxia causadas por la disminución en las concentraciones de oxígeno disuelto en el agua (Hayes et al., 1989; Cortés-Lara, 2002) y el taponamiento de sus branquias (Horstman, 1981). Las floraciones de este ciliado también podrían representar un riesgo indirecto considerando que estos organismos son el alimento esencial de los dinoflagelados mixótrofos del género Dinophysis, los cuales producen toxinas diarreicas (DST). Así pues, las floraciones de M. cf. rubrum podrían desencadenar el incremento en las densidades de Dinophysis y aumentarían el riesgo de intoxicaciones diarreicas a través de consumo de mariscos expuestos a estas poblaciones.
Adicionalmente, la aparición de mareas rojas en lugares como bahías puede generar inconvenientes de tipo ambiental, puesto que, al tratarse de una concavidad en la línea costera, el flujo de agua en una bahía tiende a ser menor que en el de un sistema abierto y, por lo tanto, la retención de agua es más prolongada y pueden ocurrir situaciones que pongan en peligro el sistema como, por ejemplo, la muerte de organismos marinos por anoxia (Alonso et al., 2016). Así mismo, las mareas rojas pueden generar inconvenientes de tipo socioeconómico, particularmente en sectores con una alta afluencia turística como es el caso de las bahías en la región del Magdalena. Los cambios de color del agua y el fuerte olor a mariscos que se produce pueden no ser agradables para los bañistas que se encuentran donde se produce el evento.
CONCLUSIONES
Se detectaron floraciones de alta biomasa (> 106 cél. L-1, mareas rojas) de Mesodinium cf. rubrum en la época seca (primeros meses del año) y de Cochlodinium sp. (= Margalefidinium sp.) en época de lluvias (octubre y noviembre). Estas mareas rojas mostraron un patrón cíclico de ocurrencia en la bahía de Santa Marta y en bahías cercanas, influenciadas por las condiciones ambientales y la variabilidad climática de cada época.
Mediante el índice ONI fue posible evidenciar que las mareas rojas producidas por Mesodinium cf. rubrum ocurrieron en años con condiciones climáticas típicas de la zona, en tanto que las mareas de Cochlodinium sp. ocurrieron durante años con eventos climáticos (La Niña y El Niño) moderados-fuertes, lo cual indica la preferencia de estos dinoflagelados por condiciones ambientales extremas.
Aunque las mareas rojas detectadas en la bahía de Santa Marta y en otras bahías cercanas no se han catalogado como perjudiciales para la salud humana y la de otros organismos, estos eventos deben continuar siendo monitoreados y estudiados para evitar futuros inconvenientes en el área. Esta información, junto con el monitoreo permanente de microalgas potencialmente nocivas en el Magdalena, podría considerarse como un insumo relevante para la construcción de un sistema de alerta temprana de las FAN en la región del Caribe colombiano, el cual ayudaría a las autoridades ambientales del país a tomar medidas cuando ocurran estos eventos.
AGRADECIMIENTOS
Los autores agradecen al Organismo Internacional de Energía Atómica (OIEA) por su apoyo para llevar a cabo el monitoreo de microalgas nocivas en el Caribe colombiano a través de proyectos regionales. Así mismo, agradecen al Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (Invernar) por el apoyo técnico y al Ministerio de Medio Ambiente y Desarrollo Sostenible de Colombia por el apoyo económico. Contribución 1275 del Invemar.
REFERENCIAS
Alonso, R. 2004. Hidrología y condiciones ambientales que determinan la proliferación de dinoflagelados causantes de mareas rojas en la bahía de Mazatlán, Sin., México. Tesis Ph.D. Ciencias. Centro de Investigaciones Biológicas del Noroeste, S.C. La Paz. 116 p. [ Links ]
Alonso, R., Á. Moreira, S. Méndez, and B. Reguera. 2016. Introduction. 5. In: Reguera, B., R. Alonso, A. Moreira, S. Méndez, and M.Y. Dechraoui-Bottein. (Eds). 2016. Guide for designing and implementing a plan to monitor toxin-producing microalgae. 2nd Ed. IOC Manuals and Guides, (59). Unesco and IAEA, Paris and Vienna. 66 p. [ Links ]
Anton, A, P.L. Teoh, S.R. Mohd-Shaleh, and N. Mohammad-Noor. 2008. First occurrence of Cochlodinium blooms in Sabah, Malaysia. Harmful Algae, 7: 331-336. [ Links ]
APHA, AWWA, and WEF. 2012. Standard methods for the examination of water and wastewater. 22.° Ed. American Water Works Association, Washington. 1463 p. [ Links ]
Arbeláez, N., J.E. Mancera y B. Reguera. 2017. Dinoflagelados epífitos de Thalassia testudinum en dos sistemas costeros del Caribe colombiano. Bol. Investig. Mar. Costeras, 46(2): 9-40. [ Links ]
Avaria, S., M. Cáceres, P. Muñoz, S. Palma y P. Vera. (Eds.). 1999. Plan nacional sobre floraciones de algas nocivas en Chile. Comité Oceanográfico Nacional, Santiago de Chile. 31 p. [ Links ]
Azanza, R.V., L.T. David, R.T. Borja, I.U. Baula, and Y. Fukuyo. 2008. An extensive Cochlodinium bloom along the western coast of Palawan, Philippines. Harmful Algae, 7: 324-330. [ Links ]
Balech, E. 1988. Los dinoflagelados del Atlántico sudoccidental. Ministerio de Agricultura, Pesca y Alimentación, Madrid. 310 p. [ Links ]
Bula-Meyer, G. 1985. Un nuevo núcleo de surgencia en el Caribe colombiano detectado en correlación con las macroalgas. Bol. Ecotrópica, 12: 2-26. [ Links ]
California Ocean Science Trust. 2016. Framing the science around harmful algal blooms and California fisheries: scientific insights, recommendations and guidance for California. California Ocean Science Trust, Oakland, CA. 20 p. [ Links ]
Calvo-Vargas, E. y M. Arguedas-Rodríguez. 2012. Muestreo de las floraciones algales nocivas (FANs) en el golfo de Nicoya, Puntarenas, Costa Rica. Universidad Nacional, Heredia, Costa Rica. 7 p. [ Links ]
Cámara de Comercio de Santa Marta. 2018. Informe económico: indicadores económicos 2017-2018. Unidad de Desarrollo Competitivo (UDC). Coordinación Proyectos e Investigaciones. Santa Marta. 56 p. [ Links ]
Cortés-Altamirano, R. 1984. Mareas rojas producidas por el ciliado Mesodinium rubrum (Lohman) en el litoral de Mazatlán, Sinaloa, México. Biótica, 9: 259-269. [ Links ]
Cortés-Altamirano, R. y R. Alonso-Rodríguez. 1997. Mareas rojas durante 1997 en la bahía de Mazatlán, Sinaloa, México. Cienc. Mar, 15: 31-37. [ Links ]
Cortés-Lara, M.C. 2002. Primer registro de marea roja del 2002. Bahía de Banderas Jalisco-Nayarit (enero de 2002). Rev. Biomed., 13(3): 229-230. https://doi.org/10.32776/revbiomed.v13i3.321 20/08/2018. [ Links ]
Cortés-Lara, M.C., R. Cortés-Altamirano y A.P. Sierra-Beltrán. 2004. Presencia de Cochlodinium catenatum (Gymnodiniales: Gymnodiniaceae) en mareas rojas de bahía de Banderas, Pacífico mexicano. Rev. Biol. Trop., 52: 35-49. [ Links ]
Crawford, D.W. 1989. Mesodinium rubrum: the phytoplankter that wasn't. Mar. Ecol. Prog. Ser., 58: 161-174. [ Links ]
Crawford, D.W. and T. Lindholm, 1997. Some observations on vertical distribution and migration of the phototrophic ciliate Mesodinium rubrum (= Myrionecta rubra) in a stratified brackish inlet. Aquat. Microb. Ecol., 13: 267-274. [ Links ]
De Oliveira, L.A. 2004. A red water caused by Mesodinium rubrum on the coast of Santa Catarina, southern Brazil. Braz. J. Oceanogr., 52(2): 153-161. [ Links ]
Díaz, J. M., L. M. Barrios, M.H. Cendales, J. Garzón-Ferreira, J. Geister, M. López-Victoria, G.H. Ospina, F. Parra-Velandia, J. Pinzón, B. Vargas-Ángel, F.A. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Ser. Publ. Espec., (5). Invemar, Santa Marta. 176 p. [ Links ]
Dorantes-Aranda, J.J., L.M. García-De la Parra, R. Alonso-Rodríguez, and L. Morquecho. 2009. Hemolytic activity and fatty acids composition in the ichthyotoxic dinoflagellate Cochlodinium polykrikoides isolated from Bahía de La Paz, Gulf of California. Mar. Pollut. Bull., 58: 1401-1405. [ Links ]
Edler, L. and M. Elbrächter. 2010. The Utermöhl method for quantitative phytoplankton analysis: 13-20. In: Karlson, B., C. Cusack, and E. Bresnan. (Eds.) Microscopic and molecular methods for quantitative phytoplankton analysis. IOC Manuals and Guides, (55). Unesco. Paris. 110 p. [ Links ]
Franco-Herrera, A. 2005. Una aproximación a la oceanografía de la ensenada de Gaira: El Rodadero, más allá que un centro turístico. Univ. Jorge Tadeo Lozano, Santa Marta. 58 p. [ Links ]
Freer, E. y M. Vargas-Montero. 2003. Floraciones algales nocivas en la costa pacífica de Costa Rica: toxicología y sus efectos en el ecosistema y salud pública. Acta Med. Costarric., 45(4): 158-164. [ Links ]
Gárate-Lizárraga, I. 2013. Bloom of Cochlodinium polykrikoides (Dinophyceae: Gymnodiniales) in Bahía de La Paz, Gulf of California. Mar. Pollut. Bull., 67: 217-222. [ Links ]
Gárate-Lizárraga, I. y M.S. Muñetón-Gómez. 2008. Los riesgos de las mareas rojas en el Pacífico mexicano. Conversus, 3: 20-23. [ Links ]
Gárate-Lizárraga, I., J.J. Bustillos-Guzmán, L.M. Morquecho, and C.H. Lechuga-Deveze. 2000. First outbreak of Cochlodinium polykrikoides in the Gulf of California. Harmful Algae News, 21: 7. [ Links ]
Gárate-Lizárraga, I., M.L. Hernández-Orozco, C. Band-Schmidt, and G. Serrano-Casillas. 2001. Red tides along the coasts of Baja California Peninsula, México 1984 to 2001. Oceánides, 16(2): 127-134. [ Links ]
Gárate-Lizárraga, I., C. Band-Schmidt, R. Cervantes-Duarte y D. Escobedo-Urías. 2002. Mareas rojas de Mesodinium rubrum (Lohmann) Hamburger y Buddenbrock en el golfo de California (invierno de 1998). Hidrobiológica, 12: 15-20. [ Links ]
Gárate-Lizárraga, I., D.J. López-Cortés, J.J. Bustillos-Guzmán, and F.E. Hernández-Sandoval. 2004. Blooms of Cochlodinium polykrikoides (Gymnodiniaceae) in the Gulf of California, México. Rev. Biol. Trop., 52(Suppl. 1): 51-58. [ Links ]
Garzón-Ferreira, J. and J.M. Díaz. 2003. The Caribbean coral reefs of Colombia: 275-301. In: Cortés, J. (Ed.). Latin American Coral Reefs. Elsevier Science B.V., Amsterdam. 508 p. [ Links ]
Gobler, C.J., D.L. Berry, O.R. Anderson, A. Burson, F. Koch, B.S. Rodgers, L.K. Moore, J.A. Golesky, B. Allam, P. Bowers , Z.Y. Tang, and R. Nuzzi. 2008. Characterization, dynamics, and ecological impacts of harmful Cochlodinium polykrikoides blooms on eastern Long Island, NY, USA. Harmful Algae, 7: 293-307. [ Links ]
Hallegraeff, G.M., D.M. Anderson, and A.D. Cembella. 2004. Manual on harmful marine microalgae. Monographs on Oceanographic Methodology. Unesco, Paris. 793 p. [ Links ]
Hargraves, P.E. and R. Víquez. 1981. The dinoflagellate red tide in Golfo de Nicoya, Costa Rica. Rev. Biol. Trop., 29: 31-38. [ Links ]
Hayes, G.C., D.A. Puerdie, and J.A. Williams. 1989. The distribution of ichtyoplankton in Southampton water in response to low oxygen levels produced by Mesodinium rubrum bloom. J. Fish. Biol., 34: 811-813. [ Links ]
Hernández-Becerril, D.U. 1987. Un caso de mareas rojas en el golfo de California. Rev. Latinoam. Microbiol., 29: 171-174. [ Links ]
Horstman, D.A. 1981. Reported red-water outbreaks and their effects on fauna of the west and south coasts of South Africa, 1959-1980. Fish. Bull. S. Afr., 15: 71-88. [ Links ]
IDEAM. 2015. Anuario climatológico 2015. Inst. Hidrol., Meteorol. Est. Ambient., Bogotá. 363 p. [ Links ]
Invemar. 2010. Concepto técnico sobre el evento de florecimiento de microalgas en el área de Santa Marta. CPT-CAM-044-10. Inst. Investig. Mar. Costeras, Santa Marta. 10 p. [ Links ]
Invemar. 2013. Concepto técnico sobre el análisis del fitoplancton de cuatro muestras de agua de la bahía de Cartagena tomadas por el CIOH el 27 de marzo de 2013. CTP-CAM-008-13. Inst. Investig. Mar. Costeras, Santa Marta. 6 p. [ Links ]
Invemar. 2015a. Concepto técnico sobre aparición de mancha roja frente a playa Blanca y la bahía de Santa Marta. CPT-CAM-001-15. Inst. Investig. Mar. Costeras, Santa Marta. 18 p. [ Links ]
Invemar. 2015b. Concepto técnico sobre posible evento de floración de microalgas frente a la Playa del Rodadero. CPT-CAM-020-15. Inst. Investig. Mar. Costeras, Santa Marta. 12 p. [ Links ]
Invemar. 2017a. Concepto técnico sobre la mancha roja observada desde la bahía de Santa Marta hasta el sector de Playa Blanca. CPT-CAM-002-17. Inst. Investig. Mar. Costeras, Santa Marta. 12 p. [ Links ]
Invemar. 2017b. Concepto técnico sobre la mancha roja observada entre la bahía de Santa Marta y Taganga. CPT-CAM-008-17. Inst. Investig. Mar. Costeras, Santa Marta. 14 p. [ Links ]
Jiménez, R. y E. Gualancaña. 2006. Floraciones de Mesodinium rubrum en los procesos de surgencia en el pacífico ecuatorial. Acta Oceanogr. Pac., 13(1): 71-78. [ Links ]
Johnson, M.D. and D.K. Stoecker. 2005. Role of feeding in growth and photophysiology of Myrionecta rubra. Aquat. Microb. Ecol., 39: 303-312. [ Links ]
Johnson, M.D., D.K. Stoecker, and H.G. Marshall. 2013. Seasonal dynamics of Mesodinium rubrum in Chesapeake Bay. J. Plankton Res, 35(4): 877-893. https://doi.org/10.1093/plankt/fbt028 [ Links ]
Kifle, D. and D.A. Purdie. 1993. The seasonal abundance of the phototrophic ciliateMesodinium rubrum in Southampton Water, England. J. Plankton Res., 15(7): 823-833. [ Links ]
Kim, C.S., S.G. Lee, C.K. Lee, H.G. Kim, and J. Jung. 1999. Reactive oxygen species as causative agents in the ichthyotoxicity of the red tide dinoflagellate Cochlodinium polykrikoides. J. Plankton Res., 21(11): 2105-2115. [ Links ]
Kim, C.S., S.G. Lee, and H.A. Kim. 2000. Biochemical responses of fish exposed to a harmful dinoflagellate Cochlodinium polykrikoides. J. Exp. Mar. Biol. Ecol., 254: 131-141. [ Links ]
Kim, D., T. Oda, T. Muramatsu, D. Kim, Y. Matsuyama, and T. Honjo. 2002. Possible factors responsible for the toxicity of Cochlodinium polykrikoides, a red tide phytoplankton. Comp. Biochem. Physiol. C., 132(4): 415-423. https://doi.org/10.1016/S1532-0456(02)00093-5 [ Links ]
Koray, T. 1984. The occurrence of red tide and causative organisms in Izmir Bay, E.U. Fac. Sci. J. Ser. B., 7(1): 75-83. [ Links ]
Lee, J.S. 1996. Bioactive components from the red tide plankton Cochlodinium polykrikoides. J. Kor. Fish. Soc., 29: 165-173. [ Links ]
Lindholm, I. 1985. Mesodinium rubrum: a unique photosynthetic ciliate. Adv. Aq. Microbiol., 3: 1-48. [ Links ]
López-Cortés, D.J., C.J. Band-Schmidt, J.J. Bustillos-Guzmán, F.E. Hernández-Sandoval, A. Mendoza-Flores y E.J. Núñez-Vázquez. 2014. Condiciones ambientales durante un florecimiento de Cochlodinium polykrikoides (Gymnodiniales, Dinophyceae) en la ensenada de La Paz, golfo de California. Rev. Biol. Mar. Oceanogr., 49: 97-110. [ Links ]
Malagón, A. and L.V. Perdomo. 2013. Cochlodinium polykrikoides bloom in the Colombian Caribbean. Harmful Algae News, 47: 14-15. [ Links ]
Mancera-Pineda, J.E., B. Gavio y G. Arencibia. 2009. Floraciones algales nocivas, intoxicación por microalgas e impactos en el desarrollo regional: el caso de San Andrés isla, Caribe colombiano. 46-62. En: Mancera-Pineda, J.E., O. Sierra y S. Pérez. 2009. (Eds). Reserva de Biosfera Seaflower. Problema Ambiental. Cuad. Car. 13, 78 p. [ Links ]
Mancera-Pineda, J.E., M. Montalvo-Talaigua y B. Gavío. 2014. Dinoflagelados potencialmente tóxicos asociados a material orgánico flotante (drift) en San Andrés Isla, Reserva Internacional de la Biosfera - Seaflower. Caldasia, 36: 139-156. [ Links ]
McGaraghan, A., R. Kudela, and K. Negrey, 2012. A primer on California harmful algal blooms: common questions and answers for stakeholders, decision makers, coastal managers, and the education community. http://fisheries.legislature.ca.gov/sites/fisheries.legislature.ca.gov/files/u8/Primer%20on%20 HAB%20westcoast.pdf 30/05/2018. [ Links ]
Montealegre, J.E. 2014. Actualización del componente meteorológico del modelo institucional del IDEAM sobre el efecto climático de los fenómenos El Niño y La Niña en Colombia como insumo para el Atlas Climatológico. IDEAM, Bogotá. 80 p. [ Links ]
Morse, R.E., M.R. Mulholland, W.S. Hunley, S. Fentress, M. Wiggins, and J.L. Blanco-García. 2013. Control on the initiation and development of blooms of the dinoflagellate Cochlodinium polykrikoides Margalef in lower Chesapeake Bay and its tributaries. Harmful Algae, 28: 71-82. [ Links ]
Mulholland, M.R., R.E. Morse, G.E. Boneillo, P.W. Bernhardt, K.C. Filippino, L.A. Procise, J.L. Blanco-Garcia, H.G. Marshall, T.A. Egerton, W.S. Hunley, K.A. Moore, D.L. Berry, and C.J. Gobler. 2009. Understanding causes and impacts of the dinoflagellate, Cochlodinium polykrikoides, blooms in the Chesapeake Bay. Estuaries Coast., 32(4): 734-747. [ Links ]
NOAA. 2020. Climate prediction center. Cold & warm episodes by season. Nat. Oc. Atm. Adm. https://origin.cpc.ncep.noaa.gov/products/analysis_ monitoring/ensostuff/ONI_v5.php 16/02/2020. [ Links ]
Ramírez, G. 1983. Características fisicoquímicas de la bahía de Santa Marta (agosto, 1980-julio, 1981). An. Inst. Investig. Mar. Punta Betín, 13: 111-121. [ Links ]
Reguera, B. , R. Alonso, A. Moreira y S. Méndez. 2011. Guía para el diseño y puesta en marcha de un plan de seguimiento de microalgas productoras de toxinas. Manuales y guías de la COI. Unesco y OIEA, París y Viena. 59 p. [ Links ]
Reguera, B. R. Alonso, A. Moreira, S. Méndez, and M.Y. Dechraoui-Bottein (Eds). 2016. Guide for designing and implementing a plan to monitor toxin-producing microalgae. 2nd Ed. IOC Manuals and Guides (59). Unesco and IAEA, Paris and Vienna. 66 p. [ Links ]
Rodríguez, A., J.E. Mancera-Pineda, and B. Gavio. 2010. Survey of benthic dinoflagellates associated to beds of Thalassia testudinum in San Andrés Island, Seaflower Biosphere Reserve, Caribbean Colombia. Acta. Biol. Colomb., 15(2): 229-246. [ Links ]
Rodríguez-Ramírez, A. y J. Garzón-Ferreira. 2003. Monitoreo de arrecifes coralinos, pastos marinos y manglares en la bahía de Chengue (Caribe colombiano): 1993-1999. Ser. Publ. Espec., (8). Invernar, Santa Marta. 170 p. [ Links ]
Ruiz, A. and J.E. Mancera-Pineda. 2019. Potentially toxic dinoflagellates associated to seagrass on isla de Barú, Colombian Caribbean, during El Niño 2015. Acta. Biol. Colomb., 24: 109-117. [ Links ]
Sar, E.A., M.E. Ferrario y B. Reguera. (Eds.). 2002. Floraciones algales nocivas en el cono sur americano. Inst. Esp. Oceanogr., Madrid. 311 p. [ Links ]
Strickland, D.H. and T.R. Parsons. 1972. A practical handbook of seawater analysis. 2.° Ed. Fish. Res. Board Can. Bull. 157. 310 p. [ Links ]
UNGRD. 2016. Fenómeno El Niño, análisis comparativo 1997-1998//2014-2016. Unid. Nal. Gestión Riesgo Desastres, Bogotá. 143 p. [ Links ]
Vega-Sequeda, J., A. Rodríguez-Ramírez, M.C. Reyes-Nivia y R. Navas-Camacho. 2008. Formaciones coralinas del área de Santa Marta: estado y patrones de distribución espacial de la comunidad bentónica. Bol. Investig. Mar. Costeras, 37(2): 87-105. [ Links ]
Vidal, L.A. 1995. Estudio del fitoplancton en el sistema lagunar estuarino tropical Ciénaga Grande de Santa Marta, Colombia, durante el año 1987. Tesis M.Sc. Biol. Universidad Nacional de Colombia, Bogotá. 207 p. [ Links ]
Vidal, L.A. 2010. Manual del fitoplancton hallado en la Ciénaga Grande de Santa Marta y cuerpos de agua aledaños. Fund. Univ. Bogotá Jorge Tadeo Lozano, Bogotá. 384 p. [ Links ]
Williams, J.A. 1996. Blooms of Mesodinium rubrum in Southampton Water: do they shape mesozooplankton distribution? J. Plankton Res., 18(9): 1685-1697. [ Links ]
Recibido: 22 de Octubre de 2019; Aprobado: 12 de Agosto de 2020











 texto en
texto en 


