Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 no.2 Santa Marta jul./dez. 2020 Epub 20-Dez-2020
https://doi.org/10.25268/bimc.invemar.2020.49.2.889
Artículos de Investigación
Biodiversidad de esponjas en arrecifes rocosos del Chocó norte, Pacífico colombiano
1Programa de Biología Marina, Facultad de Ciencias Naturales e Ingeniería, Universidad de Bogotá Jorge Tadeo Lozano, sede Caribe, Santa Marta, Colombia. nicollp.lizarazor@utadeo.edu.co
2Instituto de Estudios en Ciencias del Mar (Cecimar), Universidad Nacional de Colombia, sede Caribe, Santa Marta, Colombia.
3Instituto de Investigaciones Marinas y Costeras "José Benito Vives de Andréis" (Invemar), Santa Marta D.T.H.C., Colombia. luis.chasqui@invemar.org.co, natalia.rincon@invemar.org.co
En comparación con otros grupos de invertebrados, la taxonomía de esponjas (Porífera) ha sido poco desarrollada en el Pacífico Oriental Tropical (POT), en general, y en el Pacífico colombiano, en particular. Este trabajo busca incrementar el conocimiento de la biodiversidad del grupo en los arrecifes rocosos del norte del Chocó. Se recolectaron muestras de esponjas mediante buceo autónomo, las cuales fueron procesadas e identificadas en laboratorio por métodos estándar. Se confirmó la baja riqueza de especies y la predominancia de morfologías incrustantes y hábitos crípticos, que ha sido encontrada en otros estudios en la región. Se identificaron 24 morfotipos pertenecientes a 13 órdenes, 17 familias y 21 géneros. Doce (12) morfotipos se reconocieron a nivel de género o con identidad específica tentativa y los otros 12 fueron confirmados a nivel de especie. Seis (6) especies son morfológicamente similares a las del Caribe, lo que indica que las poblaciones posiblemente no han divergido lo suficiente desde el cierre del istmo de Panamá o, alternativamente, pueden haber cruzado recientemente el canal de Panamá.
PALABRAS CLAVE: biodiversidad de esponjas; Demospongiae; arrecifes rocosos del Pacífico; Pacífico colombiano; Pacífico Oriental Tropical
Compared to other groups of invertebrates, sponge (Porifera) taxonomy has been poorly developed in the Eastern Tropical Pacific (ETP) in general and in the Colombian Pacific in particular. This work aims to increase knowledge of the group's biodiversity in the rocky reefs of northern Chocó. Sponge samples were collected by autonomous diving, which were then processed and identified in the laboratory by standard methods. It was confirmed the low species richness and the predominance of encrusting morphologies and cryptic habits, which have been found in other studies in the region. Twenty-four (24) morphotypes belonging to 13 orders, 17 families and 21 genera were identified. Twelve (12) morphotypes were recognized at the genus level or with a tentative specific identity and the other 12 were confirmed at the species level. Six (6) species are morphologically similar to those of the Caribbean, indicating that populations may not have diverged sufficiently since the closure of the Isthmus of Panama or, alternatively, may have recently crossed the Panama Canal.
KEYWORDS: sponges' biodiversity; Demospongiae; Pacific rocky reefs; Colombian Pacific; Eastern Tropical Pacific
INTRODUCCIÓN
En la costa norte del departamento del Chocó (Pacífico colombiano), se destacan formaciones rocosas conocidas como riscales y morros, que son arrecifes rocosos sumergidos y pequeños islotes, respectivamente (Guzmán et al., 2004). Estas formaciones compuestas por rocas ígneas basálticas máficas y ultramáficas tienen diferentes niveles de complejidad topográfica, moldeada por siglos de exposición a factores de erosión marina que han creado paredes rocosas y cúmulos de grandes rocas con grietas y cuevas de tamaño variable. Los riscales y morros proveen sustrato duro para el asentamiento de biota bentónica como corales blandos, algas y esponjas, así como refugio a una amplia variedad de invertebrados móviles y peces (Velandia y Díaz, 2016).
Entre la biota característica de esas formaciones rocosas, las esponjas (Porifera) están entre los más conspicuos e importantes organismos bentónicos sésiles. Son filtradores que incorporan al fondo materia orgánica particulada y disuelta de la columna de agua que luego, por medio de un proceso de regeneración celular, devuelven en forma de nutrientes inorgánicos y detritus particulado al medio (Goeij et al., 2008, 2013). En el Caribe y en mares del océano Índico Occidental e Indonesia, las esponjas son los organismos más conspicuos y diversos en las aguas costeras, después de los corales y las algas, ya que pueden encontrarse en diferentes hábitats como raíces de manglar, arrecifes de coral y fondos blandos, entre otros (Zea, 1987, 1998; Van Soest, 1994; Hooper et al., 2002). En comparación con otros grupos taxonómicos de invertebrados, el estudio sistemático de las esponjas está poco desarrollado a raíz de la escasez de taxónomos especializados, la dificultad para identificar las especies, la ambigüedad de las características y lo disperso de la literatura (Hooper et al., 2002). No obstante, la popularización del buceo autónomo, el desarrollo de la fotografía submarina y la implementación de técnicas histológicas y moleculares han ayudado a paliar el problema (Worheide et al., 2005; Cárdenas et al., 2012).
Aunque esto ha permitido aumentar el inventario de la biodiversidad del grupo en las últimas décadas, se cree que el número de especies válidas descritas corresponde, como mucho, a la mitad de las especies existentes (Van Soest et al., 2012). Es importante entonces continuar realizando esfuerzos para consolidar el inventario de la biodiversidad global de poríferos, especialmente en regiones menos exploradas como el Pacífico Oriental y, en particular, en la costa Pacífica de Colombia.
Las primeras descripciones de esponjas en la costa Pacífica americana se realizaron a partir de material obtenido desde buques de investigación como la expedición Challenger, donde Ridley y Dendy (1887) describieron 23 especies de esponjas monoaxónicas para el sur de Chile y la Patagonia. Posteriormente, Vosmaer y Vernhout (1902) estudiaron seis especies del género Placospongia recolectadas en América Central y del Sur por la expedición Siboga, y von Lendenfeld (1910) describió 46 especies de la familia Geodidae recolectadas por el barco Albatross. En el siglo XX se comenzaron a desarrollar estudios locales más exhaustivos. De Laubenfels (1932) describió 101 especies marinas y de agua dulce de California y De Laubenfels (1935) añadió ocho nuevas especies de aguas someras de Baja California, México. Green y Gómez (1986) registraron 14 especies de esponjas en la bahía de Mazatlán (Sinaloa, México), siendo ese el primer trabajo para la costa rocosa del Pacífico tropical. Desqueyroux-Faúndez y Van Soest (1997) describieron 45 especies de esponjas de aguas poco profundas en las islas Galápagos, Van Soest y Hajdu (2000) describieron seis especies de esponjas de la costa Pacífica de Panamá y Díaz et al. (2005) describieron una nueva especie de esponja de aguas someras en el golfo de Chiriquí en Panamá.
Recientemente, los trabajos se han concentrado en la costa Pacífica mexicana. Por ejemplo, Carballo et al. (2004) elaboraron un completo estudio de las esponjas excavadoras de coral, y Carballo y Cruz-Barraza (2008) registraron una nueva especie para el Parque Nacional Isla Isabel en el mar de Cortés. Luego, Vega (2012) registró 88 especies de esponjas en el Pacífico mexicano, de las cuales 18 fueron nuevos registros y posiblemente 33 son especies nuevas para la ciencia. El más reciente trabajo es el de Carballo et al. (2019), que incluye 87 especies de esponjas asociadas a arrecifes de coral a lo largo del Pacífico mexicano.
Por otra parte, algunos trabajos han abordado la cuestión de la similitud en las especies de esponjas a ambos lados del istmo de Panamá, un tema de gran interés en el contexto evolutivo de la fauna marina del Caribe y del Pacífico Oriental Tropical (POT). Por ejemplo, De Laubenfels (1936b) efectuó una comparación entre esponjas de aguas poco profundas en el lado Pacífico del canal de Panamá con las del lado Caribe y encontró características morfológicas diferenciables, trabajo corroborado posteriormente por Wulff (1996).
Para el Pacífico colombiano solo se conocen tres trabajos no publicados que, en suma, han registrado 33 especies de esponjas (Narváez, 1999; Escobar, 2000; García-Suárez et al., 2012). Esos trabajos se han enfocado en la porción sur del Pacífico colombiano y, principalmente, en esponjas asociadas a ecosistemas coralinos. Considerando estos antecedentes, el presente estudio busca contribuir al conocimiento de la biodiversidad de esponjas del Pacífico colombiano y del POT en general, con énfasis en las esponjas asociadas a los arrecifes rocosos de la porción norte del Chocó.
ÁREA DE ESTUDIO
El estudio se realizó en el Pacífico norte colombiano, entre cabo Corrientes (5° 29' N, 77° 32' W) y cabo Marzo (6° 49' N, 77° 41' W). En esta área, el fondo marino se caracteriza por una plataforma continental de extensión variable, estrecha y empinada frente a los cabos y ancha y tendida en los golfos. Esta topografía submarina es el resultado de la interacción entre una abundante escorrentía terrestre y las fuerzas erosivas marinas que han actuado por siglos en antiguas costas rocosas de origen ígneo, asociadas a la formación de la serranía del Baudó (Posada et al., 2009).
En ese fondo marino más bien quebrado hay docenas de arrecifes rocosos, conocidos localmente como "morros" y "riscales", los cuales surgen de profundidades variables y a diferentes distancias de la costa. En esas formaciones rocosas, compuestas de rocas ígneas basálticas máficas y ultramáficas, se observan diferentes niveles de complejidad topográfica; pero, en su mayoría, consisten en paredes rocosas y grupos de grandes rocas con cuevas y agujeros de tamaño variable. Estas estructuras sumergidas ofrecen un sustrato duro ideal para el asentamiento de fauna y flora bentónicas (v. g. corales blandos, esponjas, algas erectas e incrustantes, tunicados y briozoos, entre otros), así como refugio para centenares de invertebrados vágiles y peces, lo que hace de estos sitios importantes caladeros de pesca artesanal (Velandia y Díaz, 2016). El esfuerzo de muestreo se concentró en los arrecifes rocosos someros de los sectores de cabo Corrientes, golfo de Tribugá, bahía Solano, bahía Cupica, Punta Cruces y cabo Marzo (Figura 1).
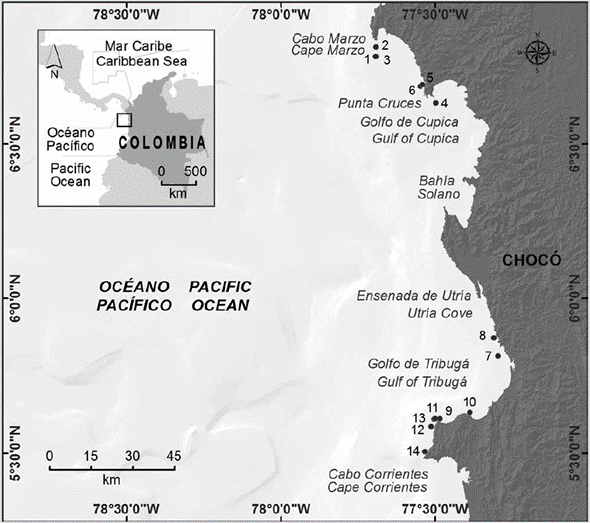
Figura 1 Área de estudio en el sector norte del departamento del Chocó (Pacífico colombiano). Las localidades de muestreo están numeradas: 1) Piedra de Rodrigo (6° 47' 2,07" N, 77° 41' 36,6" W). 2) Piedra de Eroito (6° 48' 52,84" N, 77° 41' 32,99" W). 3) La Foca (6° 40' 42,7044" N, 77° 41' 42,71" W). 4) La Viuda (6° 37' 58,872" N, 77° 29' 58,92" W). 5) La Mina (6° 41' 11,76" N, 77° 32' 57,48" W). 6) La Parguera-Piñas (6° 41' 30,084" N, 77° 32' 29,76" W). 7) Morros de Jurubidá (5° 48' 47,16" N, 77° 17' 49,56" W). 8) Morromico Norte (5° 48' 47,16" N, 77° 17' 49,56" W). 9) Punta Arusí (5° 36' 39,996" N, 77° 29' 6,36" W). 10) Punta Orión (5° 37' 50,664" N, 77° 23' 18,59" W). 11) Piedra de Jairo (5° 36' 36,04" N, 77° 30' 2,52" W). 12) Roñosa 5° 35' 6,22" N, 77° 30' 50,76" W). 13) Parguera-Corrientes (5° 36' 35,60" N, 77° 30' 14,76" W). 14) Piedra de Colo (5° 30' 43,87" N, 77° 32' 1,32" W).
MATERIALES Y MÉTODOS
Durante una expedición realizada en 2015 se evaluaron 14 estaciones de muestreo entre 11-19 m de profundidad, donde se fotografiaron todas las esponjas presentes y se recolectaron especímenes completos o fragmentos que se fijaron en etanol al 96 %. En el laboratorio se realizaron montajes permanentes de espículas limpias y esqueletos, como se describe en Zea (1987), los cuales se observaron y fotografiaron empleando un microscopio óptico (Zeiss, Axio Lab. A1). Se midieron hasta 25 espículas de cada clase y las estructuras del esqueleto más relevantes. Las medidas de las espículas se presentan como mínimo-promedio-máximo de largo por ancho en µm. Las identificaciones se llevaron a cabo consultando las claves del Systema Porifera (Hooper et al., 2002) y las descripciones de material del Pacífico, especialmente del Pacífico Oriental, con la ayuda de las listas de especies del World Porifera Database (http://www.marinespecies.org/porifera; Van Soest et al., 2018). El material estudiado se depositó en la colección de esponjas (siglas INV POR) del Museo de Historia Natural Marina de Colombia (MHNMC) del Invemar mientras que la información se ingresó en las bases de datos del Sistema de Información en Biodiversidad Marina de Colombia (SIBM).
RESULTADOS
Se identificaron 24 especies de 13 órdenes, 17 familias y 21 géneros, de las cuales 21 son nuevos registros para el Pacífico colombiano (*). Doce (12) especies/ morfotipos quedaron identificados a nivel de género o con una asignación tentativa a nivel de especie. En la Tabla 1 se presenta la lista de especies y, a continuación, se adelanta la descripción de cada una.
Tabla 1 Lista de especies de esponjas en el Pacífico norte colombiano, agrupadas por orden. En negrita se indican las especies que tienen una contraparte morfológicamente similar en el Caribe.
Clase Demospongiae Sollas, 1885
Subclase Heteroscleromorpha Cárdenas, Pérez y Boury-Esnault, 2012
Orden Agelasida Hartman, 1980
Familia Hymerhabdiidae Morrow, Picton, Erpenbeck, Boury-Esnault, Maggs y Allcock, 2012
Especie 1. Prosuberites aff. laughlini (Díaz, Álvarez y Van Soest, 1987)

Figura 2 Prosuberites aff. laughlini. A) Tiloestilos con diferentes terminaciones en cabeza y punta. B) Tiloestilos. C) y D) Corte perpendicular mostrando ectosoma y coanosoma.

LÁMINA 1 fig. 1.Prosuberites aff. laughlini INV POR1361 con octocoral, La Parguera-Piñas, 13 m; fig. 2.Axinella nayaritensis INV POR1372, golfo de Tribugá, 7.8 m; fig. 3.Dragmacidon sp. INV POR1362, La Parguera-Piñas, 6 m; fig. 4.Desmanthus levii (naranja rojizo, izq.), INV POR1376, golfo de Tribugá, 12 m, con Prosuberites aff. laughlini (naranja pálido, der.); fig. 5.Acanthella sp., INV POR1373, golfo de Tribugá, 7.1 m; fig. 6.Crambe panamensis., INV POR1365, La Parguera, 6 m.

Figura 3 Axinella nayaritensis. A) Oxeas. B) Estilos I. C) Estilos II. D) y E) Tractos del coanosoma.
?Eurypon laughliniDíaz, Álvarez y Van Soest, 1987: 33, Lám. I-A, fig. 2.
Eurypon aff. laughlini;Escobar, 2000: 62, figs. 22-23.
Prosuberites laughlini;Nichols, 2005: 91, Apéndice A (Especímenes: UCMPWC952 y UCMPWC875).
Prosuberites aff. laughlini;García-Suárez et al. 2012: 21.
Material estudiado: INV POR1361, Punta Cruces, La Parguera-Piñas, 13 m, col. L. Chasqui, 16-08-2015. INV POR1375, golfo de Tribugá, Morromico, 11,9 m, col. L. Chasqui, 20-08-2015. INV POR1389, Punta Cruces, La Viuda, 13-15 m, col. L. Chasqui, 14-08-2015. INV POR1395, Punta Cruces, La Mina, 15 m, col. L. Chasqui, 16-08-2015. INV POR1407, cabo Marzo, Piedra de Rodrigo, 18,5 m, col. L. Chasqui, 15-08-2015.
Forma: revestimiento grueso, ampliamente extendido sobre el sustrato rocoso; superficie corrugada, con espículas erectas que atraviesan la piel; ósculos dispersos con un collar elevado transparente. Color: naranja brillante; marrón claro, a veces amarillo pálido en alcohol. Consistencia: suave, frágil; híspida al tacto. Ectosoma: pinacodermo delgado, atravesado por espículas grandes. Coanosoma: tractos erectos o espículas individuales saliendo de la base de fijación, 38115 nm de grosor, separados 46-230 µm (Figura 2C, 2D). Espículas: tiloestilos, 184-568-1221 µm por 5,0-11,0-18,3 Hm (Figura 2A, 2B).
Hábitat: sustratos rocosos verticales expuestos y en paredes de cuevas.
Distribución en el Pacífico: Pacífico de Panamá (Nichols, 2005); isla de Malpelo (García-Suárez et al., 2012); isla Palma en bahía Málaga (Escobar, 2000); Pacífico norte colombiano.
Comentarios: al revisar las descripciones de Díaz et al. (1987) para especímenes del Caribe y de Escobar (2000) para especímenes del Pacífico, se puede hipotetizar que se trata de poblaciones de la misma especie que fueron separadas por el levantamiento del istmo de Panamá hace unos tres millones de años. O, alternativamente, podría tratarse de una dispersión reciente a través del canal de Panamá. Aunque existen trabajos moleculares con la especie (Nichols, 2005), estos no permiten hacer comparaciones de las poblaciones a ambos lados del istmo (ver también Holmes y Blanch, 2007; Schuster et al., 2015). Deben realizarse estudios más detallados para determinar si hay diferencias morfológicas entre las poblaciones del Pacífico y el Caribe, y de ser diferentes, darle un nombre a la especie del Pacífico. García-Suárez et al. (2012) registran Prosuberites aff. laughlini para la isla Malpelo con base en una fotografía submarina, por lo cual se incluye esa localidad aquí en la distribución de la especie; sin embargo, ese registro debe confirmarse con material biológico.
Orden Axinellida Lévi, 1953
Familia Axinellidae Carter, 1875
Especie 2. Axinella nayaritensis Carballo, Bautista-Guerrero y Cruz-Barraza, 2018
Axinella nayaritensisCarballo, Bautista-Guerrero y Cruz-Barraza, 2018: 114, figs. 2-3.
Material estudiado: INV POR1372, golfo de Tribugá, Punta Orión, 7,8 m, col. L. Chasqui, 20-08-2015. INV POR1404, cabo Corrientes, La Roñosa, 14,4 m, col. L. Chasqui, 21-08-2015.
Forma: erecta, arborescente, 15-30 cm de altura; ramas como dedos, se van estrechando apicalmente; superficie muy irregular y corrugada. Color: naranja brillante; amarillo pálido en alcohol. Consistencia: firme, poco compresible. Ectosoma: pinacodermo sostenido por mechones de espículas del final de los tractos ascendentes. Coanosoma: tractos difusos de espículas, 32-139 |im de grosor, separados 46-223 µm, interconectados irregularmente por espículas de forma dispersa. Los tractos ascienden desde la parte central de la rama y divergen hacia la superficie, llegando perpendicularmente a ella (Figura 3D, 3E). Espículas: oxeas, 241-362-632 µm por 6,9-11,5-17,5 µm (Figura 3A); estilos I: delgados y rectos, la punta se agudiza gradualmente, 223-307-388 µm por 7,8-12,4-17,8 µm (Figura 3B); estilos II: gruesos y ligeramente doblados a manera de rabdoestilo, 407-518-642 µm por 4,6-9,0-12,3 µm (Figura 3C).
Hábitat: en zonas poco expuestas del arrecife rocoso.
Distribución: Pacífico tropical mexicano (Carballo et al., 2018), Pacífico norte colombiano.
Comentarios: las espículas y la estructura del esqueleto son característicos de las especies arbustivas o ramosas del género AxinellaSchmidt, 1862. Carballo et al. (2018) la describieron como nueva especie para el Pacífico tropical mexicano. Se enviaron fotografías in vivo y de material procesado en el laboratorio de los especímenes recolectados en este estudio al profesor J. L. Carballo, quien confirmó la similitud con A. nayaritensis.
Especie 3. Dragmacidon sp.
Material estudiado: INV POR1362, Punta Cruces, La Parguera-Piñas, 6 m, col. L. Chasqui, 16-08-2015.
Forma: revestimiento grueso (varios mm), 10 x 5 cm; superficie lisa, ósculos dispersos. Color: rojo escarlata; amarillo pálido en alcohol. Consistencia: firme, poco compresible. Ectosoma: pinacodermo orgánico sostenido por mechones de espículas de los tractos ascendentes. Coanosoma: red prismática de tractos espiculares plumosos ascendentes y divergentes, 181-549 |im de grosor, separados 74-155 µm, interconectados por tractos transversales, 79-133 µm de grosor (Figura 4C, 4D); ojo de malla 119-255 µm (Figura 4B). Espículas: estilos curvos y gruesos, doblados a manera de rabdoestilo, con la cabeza ligeramente pronunciada, 152-302-374 µm por 8,7-18,826,1 µm (Figura 4A).
Hábitat: arrecife rocoso somero.
Distribución: Pacífico norte colombiano.
Comentarios: el espécimen se ubicó en este género por la forma de crecimiento, el color y la organización del coanosoma (Álvarez y Hooper, 2002), a pesar de no presentar oxeas. Austin et al. (2013) describieron una nueva especie de Columbia Británica y aguas adyacentes en Canadá y la llamaron Dragmacidon kishinensis, pero sus características no concuerdan con el material de Colombia. Por esta razón, se debe hacer un estudio más detallado (incluyendo marcadores moleculares) para confirmarla como nueva especie.
Orden Bubarida Morrow y Cárdenas, 2015
Familia Desmanthidae Topsent, 1893
Especie 4. Desmanthus levii Van Soest y Hajdu, 2000

Figura 5 Desmanthus levii. A) y B) Estilos. C) Desmas II (tetracrépidas). D) Desmas I. E) Coanosoma.
Desmanthus leviiVan Soest y Hajdu, 2000: 22, figs. 1F-I.
Material estudiado: INV POR1376, golfo de Tribugá, Morromico, 12 m, col. L. Chasqui, 20-08-2015.
Forma: revestimiento delgado recubriendo ampliamente el sustrato; superficie lisa, finamente granulada.
Color: naranja rojizo, púrpura opaco en alcohol. Consistencia: indefinida por lo delgada. Ectosoma: pinacodermo perforado por estilos largos, erectos, dispuestos entre desmas II. Coanosoma: capa basal de desmas I, seguida por una o varias capas de desmas II, con el cladoma predominantemente orientado hacia arriba y el rabdoma hacia abajo; estilos erectos dispersos (Figura 5E). Espículas: estilos lisos, 177-434-846 µm por 4,5-8,5-16,5 µm, rectos o curvados a manera de rabdoestilos (Figura 5A, 5B); desmas I: múltiples ramificaciones delgadas, 56100-141 µm por 5,2-10,8-18,8 µm (Figura 5D); desmas II (tetracrépidas): rabdomas cónicos, robustos, en forma de zanahoria, 43-72-112 µm por 10,5-20,6-36,7 µm, cladoma 60-93-166 µm por 21-15-10 µm (Figura 5C).
Hábitat: paredes de arrecife rocoso en aguas poco profundas.
Distribución: costa Pacífica de Panamá (Van Soest y Hajdu, 2000); Pacífico norte colombiano.
Comentarios: la identificación se realizó con base en el trabajo previo de Van Soest y Hajdu (2000) de la costa Pacífica de Panamá. Es posible que Desmanthus incrustans (Topsent, 1889) del Caribe sea una especie hermana de D. levii por su similitud en la morfología y estructura espicular; sin embargo, se requieren trabajos comparativos con marcadores moleculares para establecer esa afinidad.
Familia Dictyonellidae Van Soest, Díaz y Pomponi, 1990
Especie 5. Acanthella sp.

Figura 6 Acanthella sp. A) Estrongilos sinuosos. B) Estilos. C) Extremos de estrongilos sinuosos. D) Extremos de estilos. E) Sección transversal del esqueleto.
Material estudiado: INV POR1381, golfo de Tribugá, Morros de Jurubidá, 12 m, col. L. Chasqui, 20-08-2015. INV POR1383, Morros de Jurubidá, 13,3 m, col. L. Chasqui, 2008-2015. INV POR1386, Morros de Jurubidá, 10 m, col. L. Chasqui, 20-08-2015. INV POR1373, golfo de Tribugá, Punta Orión, 7,1 m, col. L. Chasqui, 20-08-2015.
Forma: masa incrustante con lóbulos a arbustos bajos de hasta unos 5 cm de altura; ramitas de 1-5 mm de diámetro, poco divididas, saliendo casi desde la base; superficie aterciopelada o corrugada, microhíspida, frecuentemente con sedimento atrapado, especialmente hacia las bases. Color: naranja brillante; amarillo pálido en alcohol. Consistencia: suave, compresible. Ectosoma: pinacodermo sostenido por tractos erectos y espículas tangenciales. Coanosoma: tractos plumosos de espículas, 42-138 µm de grueso (Figura 6E), dendríticos, que divergen desde el centro de las ramitas hacia la superficie, llegando a esta diagonalmente, interconectados muy irregularmente por espículas sencillas en todas las direcciones. Espículas: estilos lisos y rectos, los más pequeños ligeramente curvados, 348-590-813 µm por 4,4-9,0-15,1 µm (Figura 6B, 6C, 6D); estrongilos sinuosos, 36 -651-910 µm por 3,6-6,0-9,6 µm (Figura 6A).
Hábitat: arrecifes rocosos someros en aguas turbias.
Distribución: Pacífico norte colombiano.
Comentarios: la ubicación genérica de esta esponja es tentativa, con base en la presencia de tractos dendríticos y espículas de estilos curvos y estrongilos sinuosos (Van Soest et al., 2002), aunque hay otros géneros con ese mismo tipo de espiculación (v. g. AulettaSchmidt, 1870, Phakellia Bowerbank, 1862, Phycopsis Carter, 1883), pero del orden Axinellida (Van Soest et al., 2018). Acanthella daneriiCosta, Barvastrello, Pansini y Bertolino, 2020 se describió de los fiordos chilenos en el Pacífico suroriental. Difiere de Acanthella sp. en tener oxeas sinuosas, curvas o dobladas, en adición a los estilos y los estrongilos sinuosos (Costa et al. , 2020). La estructura del esqueleto en tractos plumosos y las espículas que presenta son características muy similares a Acanthella cubensis (Alcolado, 1984) del Caribe, pero difiere de ella en la forma de crecimiento. Debe ser sometida a una revisión más exhaustiva para considerarla como una nueva especie, ya que hay varias especies del género descritas para el Pacífico Occidental y el océano Índico (Van Soest et al., 2018; Costa et al., 2020).
Orden Clionaida Morrow y Cárdenas, 2015
Familia Placospongiidae Gray, 1867
Especie 6. Placospongia aff. intermedia Sollas, 1888

Figura 7 Placospongia aff. intermedia. A) Esferáster. B) Extremos de tiloestilos y tiloestilos. C) Selenásteres (i, ii, iii estadios). D) y E) Coanosoma.
? Placospongia intermediaSollas, 1888: 273 (especie válida del Caribe).
Placospongia intermedia;De Laubenfels, 1936b: 454.
Material estudiado: INV POR1364, Punta Cruces, La Parguera-Piñas, 6 m, col. L. Chasqui, 16-08-2015.
Forma: incrustante, superficie dividida en placas poligonales por elevaciones irregulares o surcos. Color: rosa preservada en alcohol. Consistencia: dura, tenaz. Ectosoma: placas formadas por selenásteres densamente agrupados, de hasta 2 mm de grosor. Coanosoma: capa basal de selenásteres, 202341 µm de grosor, de la que se elevan tractos multiespiculados de tiloestilos, 137-290 µm de grosor, separados 163-711 µm, a manera de columnas, que sostienen las placas ectosómicas. Numerosos selenásteres dispersos entre las columnas (Figura 7D, 7E). Espículas: megascleras: tiloestilos, 180-657874 µm por 5,2-10,6-17,6 µm (Figura 7B). Microscleras: esferásteres, 9,2-10,9-13,6 µm de diámetro (estadíos de desarrollo 16,1-18,3-19,5 µm) (Figura 7A); selenásteres en varios estadíos de desarrollo, pequeños, 20,3-26,5-32,8 µm por 7,3-10-13,1 µm (Figura 7C-i); medianos, 43-36-55 µm por 16,9-25,0-33,4 µm (Figura 7C-ii); y desarrollados, 5566-76 µm por 42-52-62 µm (Figura 7C-iii).
Hábitat: sobre sustratos rocosos someros.
Distribución: Pacífico de Panamá (De Laubenfels, 1936b); Pacífico norte colombiano.
Comentarios: Sollas (1888) describió Placospongia intermedia de Punta Arenas, que luego fue confundida con una localidad con ese nombre en el Pacífico de Costa Rica. Sin embargo, en la sección "Species of the faunistic provinces", p. 383, Sollas (1888) localiza a P intermedia en la provincia Caribe. En el World Porifera Database (http://www.marinespecies.org/porifera/porifera.php?p=distribution&id=651010) se ubica la localidad tipo de P. intermedia en Punta Arenas, isla de Margarita. De Laubenfels (1936b) describió el material de P. intermedia tanto del lado Pacífico como del Caribe del istmo de Panamá, considerándolos la misma especie. Van Soest (2009) argumentó que el material de De Laubenfels del Caribe era diferente al del Pacífico, pero Rützler et al. (2014: 35) revisaron sus láminas originales sin encontrar diferencias. Es posible que el material del Pacífico sea una especie diferente que requiera de un nombre nuevo, aunque Nichols y Barnes (2005) no encontraron, a partir de análisis molecular de la región ITS que codifica en el ARN ribosomal, diferencias importantes entre varios especímenes del Caribe y del Pacífico de Panamá (Clado C8, sin identificar). Esto podría indicar que las dos poblaciones no han divergido lo suficiente desde que fueron separadas por el istmo, pero será necesario examinar morfológicamente ese material para llegar a una conclusión más precisa. En el Pacífico colombiano, Escobar (2000) describió P. carinata (Bowerbank, 1858), la cual es indudablemente otra especie, pues carece de esferásteres y su coloración es café oscuro. El registro de una fotografía submarina de Placospongia carinata de García-Suárez et al. (2012) de bahía Málaga no puede confirmarse por no haber material para examinar.
Orden Haplosclerida Topsent, 1928
Familia Chalinidae Gray, 1867
Especie 7. Chalinula nematifera (De Laubenfels, 1954)
Nara nematiferaDe Laubenfels, 1954: 76, fig. 46.
Chalinula nematifera;De Weerdt, 2002: 853; Cruz-Barraza y Carballo, 2008: 748, figs. 5, 7C; Vega, 2012: 105, figs. 7.2.57. A, B, C (transferencia de género).
Material estudiado: INV POR1380, golfo de Tribugá, Morromico, 12 m, col. L. Chasqui, 20-08-2015.
Forma: revestimiento a manera de cojín delgado, de aprox. 1 cm de diámetro. Superficie finamente híspida. Color: púrpura claro en alcohol. Consistencia: suave y compresible. Ectosoma: sin red ectosomal tangencial; formado por extremos de fibras ascendentes uniespiculares. Coanosoma: red cuadrada a poligonal de fibras de espongina rellenas por una o dos espículas, 6-22 µm de grosor, con mallas de 65-326 µm de diámetro (Figura 8B, 8C). Espículas: oxeas, 63-80-94 µm por 2,6-3,7-5,1 µm (Figura 8A).
Hábitat: arrecifes rocosos someros.
Distribución: Pacífico central y occidental tropical (De Laubenfels, 1954); mar de Cortez (México) (Cruz-Barraza y Carballo, 2008); Pacífico norte colombiano.
Comentarios: fue descrita por primera vez por De Laubenfels (1954:76) como Nara nematifera con material del Pacífico centro-occidental. Luego, De Weerdt (2002) la transfirió al género Chalinula, que se define por tener un crecimiento finamente incrustante, en forma de almohadilla, y presentar oxeas cortas, que van desde vestigios a cigarros. La identificación de esta especie se realizó comparando las características que describen Cruz-Barraza y Carballo (2008) del Pacífico mexicano. Según Ávila y Carballo (2009), C. nematifera es una especie invasora nativa del Pacífico central y occidental que se registró desde 2003 en el Pacífico mexicano, donde se considera una amenaza potencial para los arrecifes coralinos por crecer sobre colonias vivas de Pocillopora spp.
Orden Poecilosclerida Topsent, 1928
Familia Crambeidae Lévi, 1963
Especie 8. Crambepanamensis Maldonado, Cardona, Van Soest y Pomponi, 2001

Figura 9 Crambe panamensis. A) Desmas astroclonas. B) Subtiloestilos delgados. C) Tiloestilos. D) Isochelas. E) Oxyáster. F) Tiloestilos. G) Subtiloestilo delgado. H) e I) Corte perpendicular a la superficie (arriba izq.) y vista de la costra basal de astroclonas (arriba der.). J) Corte parcialmente macerado que muestra parte del ectosoma (espículas verticales y mechones) y del coanosoma.
Crambe panamensisMaldonado, Carmona, Van Soest y Pomponi, 2001:1264, fig. 1.
Material estudiado: INV POR1365, Punta Cruces, La Parguera-Piñas, 6 m, col. L. Chasqui, 16-08-2015.
Forma: revestimiento delgado de 15-20 cm de diámetro. Color: naranja-roja; blanco en alcohol.
Consistencia: dura, poco compresible. Ectosoma: tiloestilos y subtiloestilos erectos, a veces en mechones, sostienen el pinacodermo. Coanosoma: estrato basal de astroclonas, del que ascienden subtiloestilos y tiloestilos principales, convirtiéndose en mechones híspidos al llegar a la superficie (Figura 9H). Espículas: megascleras: tiloestilos ligeramente curvados con la cabeza bien definida, a veces irregular, 217-308-427 µm por 8,8-17,8-29,7 µm, diámetro del tilo 10,1-16,5-27,6 µm (Figura 9C, 9F); subtiloestilos rectos y delgados con la cabeza ligeramente ovalada, 77-185-232 µm por 2,4-4,0-5,8 µm (Figura 9B, 9G); desmas astroclonas, con un centro bien desarrollado, del cual irradian cuatro a seis actinas, 50-84-117 µm (diámetro total) (Figura 9A). Microscleras: oxiásteres, 4-5 radios, 9,9-21,129,8 µm de diámetro (Figura 9E); isoquelas con tres dientes, 19,7-23,9-29,9 µm (Figura 9D).
Hábitat: sobre paredes verticales del arrecife rocoso.
Distribución: Pacífico de Panamá (Maldonado et al., 2001); Pacífico norte colombiano.
Comentarios: se confirmó el registro de Crambe panamensis por la presencia de desmas astroclonas junto con una categoría de tiloestilos coanosomales, subtiloestilos ectosomales pequeños y una categoría de isochelas (Maldonado et al., 2001). La localidad tipo es cercana al Pacífico norte colombiano.
Especie 9. Discorhabdella littoralis Maldonado, Carmona, Van Soest y Pomponi, 2001
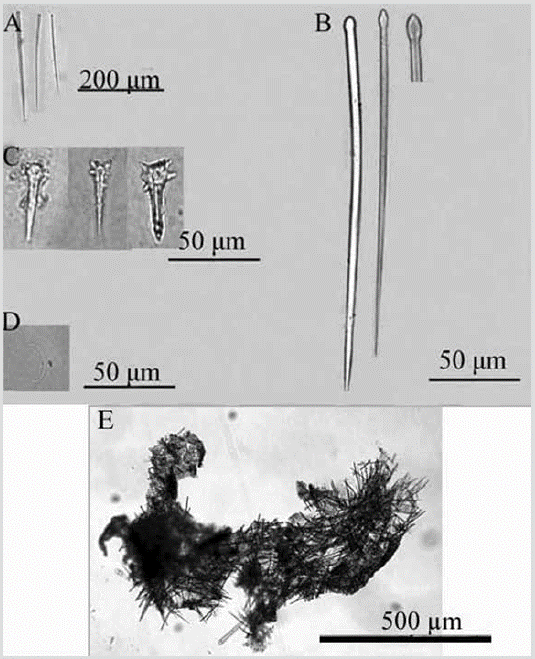
Figura 10 Discorhabdella littoralis. A) Tiloestilo principal. B) Subtiloestilo secundario. C) Acanthoestilo. D) Sigma. E) Coanosoma.
Discorhabdella littoralisMaldonado, Carmona, Van Soest y Pomponi, 2001: 1270, fig. 3.
Material estudiado: INV POR1401, cabo Marzo, La Foca, prof. 17 m, col. L. Chasqui, 15-08-2015.
Forma: revestimiento delgado. Color: blanco en alcohol. Consistencia: muy delgada para notarlo; textura híspida al tacto. Ectosoma: espículas perforando el pinacodermo. Las sigmas se encuentran principalmente debajo de la superficie. Coanosoma: acantoestilos agrupados densamente en la base sobre una capa de espongina, de la que se proyectan hacia arriba los tiloestilos principales, que luego atraviesan la superficie de la esponja. Los subtilostilos secundarios están dispuestos en forma de ramas o mechones alrededor de los tiloestilos (Figura 10E). Espículas: megascleras: tiloestilos principales levemente curvados con la cabeza oval, 128-178-247 µm por 2,9-5,9-9,2 µm (Figura 10A); subtiloestilos secundarios, 118-144-171 µm por 3,2-5,37,2 µm (Figura 10B); acantoestilos, 20-30-42 µm por 4,16,1 -8,7 µm y con la cabeza grande, 9,2-12,3-18,1 µm de diámetro (Figura 10C). Microscleras: sigmas, 11,2-22,532,1 µm (Figura 10D).
Hábitat: arrecifes rocosos someros.
Distribución: Pacífico de Panamá (Maldonado et al. , 2001); Pacífico norte colombiano.
Comentarios: se comparó con las especies de Discorhabdella descritas por Maldonado et al. (2001) para la costa Pacífica de Panamá. Se definió como D. littoralis por la presencia de tiloestilos, subtiloestilos y sigmas.
Familia Microcionidae Carter, 1875
Especie 10. Clathria (Microciona) sp.

Figura 11 Clathria (Microciona) sp. A) Subtiloestilos. B) Acanthoestilos auxiliares. C) Toxas. D) Isochelas. E) Estilos principales.

LÁMINA 2 fig. 1.Clathria (Microciona) sp., INV POR1400, cabo Marzo, 17 m; fig. 2.Scopalina sp. 2., INV POR1396, Punta Cruces, 15 m (revestimiento naranja sobre caracol); fig. 3.Axinyssa isabela, INV POR1397, cabo Marzo, 19 m; fig. 4.Terpios sp., INV POR1403, cabo Marzo, 17 m (revestimiento amarillo sobre octocoral Carijoa riisei);fig. 5.Aplysilla sp., INV POR1366, cabo Corrientes, 18 m (con octocoral Carijoa riisei);fig. 6.Chelonaplysilla violacea sensuGómez et al., 2002, INV POR1368, cabo Corrientes, 19 m.
Material estudiado: INV POR1400, cabo Marzo, La Foca, 17 m, col. L. Chasqui, 15-08-2015.
Forma: revestimiento delgado, ampliamente distribuido sobre el sustrato rocoso. Color: rojo escarlata, blanca en alcohol. Consistencia: frágil. Espículas: megascleras: estilos principales levemente curvados, ligeramente robustos en la base, cabeza con proyecciones espinosas y terminación en punta roma o afilada, 176-247-354 µm por 4,5-11,2-15,9 µm (Figura 11E); subtiloestilos delgados y rectos, 140-196-248 µm por 3,2-6,2-8,2 µm (Figura 11A); acantoestilos auxiliares rectos, con espinas a lo largo de toda la espícula, y la terminación de la punta gradualmente afilada, 68-93-120 µm por 3,8-5,8-8,0 µm (Figura 36B). Microscleras: isoquelas con ejes delgados, 16,5-19,1-30,0 µm (Figura 11D); toxas lisas en forma de V, 49-114-148 por 1,4-2,6-4,1 µm (Figura 11C).
Hábitat: en paredes del arrecife rocoso somero.
Distribución: Pacífico norte colombiano.
Comentarios: se tomó de referencia a Aguirre et al. (2011), quienes realizaron un cuadro comparativo de las especies del género ClathriaSchmidt, 1862 del POT. La composición espicular es típica del subgénero Microciona Bowerbank, 1862, con estilos principales que en su mayoría tienen espinas solo en la cabeza, subtiloestilos auxiliares lisos, toxas lisas en una o dos categorías de longitud y con frecuencia de más de 100 |im de longitud, e isoquelas en una sola categoría, normalmente menores de 15 |im de largo. Se debe hacer un análisis más detallado y con material adicional para confirmar si se trata de una nueva especie.
Orden Scopalinida Morrow y Cárdenas, 2015
Familia Scopalinidae Morrow, Picton, Erpenbeck, Boury-Esnault, Maggs y Allcock, 2012
Especie 11. Scopalina aff. ruetzleri (Wiedenmayer, 1977)

Figura 12 Scopalina aff. ruetzleri. A) y B) Anisoxeas. C) Estilos. D) y E) Tractos del coanosoma que atraviesan el ectosoma.
?Ulosa ruetzleriWiedenmayer, 1977: 145; Lámina 30, figs. 6-7.
Scopalina ruetzleri;Vega, 2012: 103, figs. 7.2.55. A, B.
Material estudiado: INV POR1378, golfo de Tribugá, Morromico, 12 m, col. L. Chasqui, 20-08-2015.
Forma: revestimiento delgado; superficie conulosa, con ósculos dispersos membranosos. Color: beige en alcohol.
Consistencia: débil, blandamente compresible. Ectosoma: pinacodermo orgánico sostenido por los finales de los tractos ascendentes del coanosoma, que conforman los cónulos. Coanosoma: esqueleto de fibras multiespiculadas (4 a 7 espículas) ascendentes de 18-55 µm de grosor, que se ramifican hacia la superficie. Poca espongina recubre los tractos (Figura 12D). Espículas: estilos largos, ligeramente curvos de puntas simples, 299-552-761 µm por 4,1-6,9-11,6 µm (Figura 12C); anisoxeas (oxeas con un extremo más grueso y corto), 85-333618 µm por 3,0-6,5-11,6 µm (Figura 12B, 12C).
Hábitat: arrecifes rocosos someros.
Distribución: Pacífico mexicano (Vega, 2012); Pacífico norte colombiano.
Comentarios: las características del esqueleto y de las espículas son similares a Scopalina ruetzleri (Wiedenmayer, 1977) del Caribe (ver Zea, 1987); sin embargo, debe hacerse un análisis más detallado para determinar si se trata de la misma especie o de especies hermanas que no han divergido fenotípicamente lo suficiente desde que ocurrió asilamiento reproductivo por el levantamiento del istmo de Panamá, o si se trata de una colonización transístmica, para definir el uso de un nombre nuevo en los especímenes del Pacífico.
Especie 12. Scopalina sp. 2
Material estudiado: INV POR1396, Punta Cruces, La Mina, sobre concha de gasterópodo, 15 m, col. L. Chasqui, 16-08-2015. INV POR1408, cabo Marzo, Piedra de Rodrigo, sobre madera, 18.5 m, col. L. Chasqui, 15-08-2015.
Forma: revestimiento delgado extendiéndose aprox. 60 mm de manera irregular sobre el sustrato y sobre concha de gasterópodo, conuloso. Color: naranja; amarillo pálido en alcohol. Consistencia: suave, híspida al tacto. Ectosoma: pinacodermo orgánico; cónulos sostenidos por tractos espiculares erectos. Coanosoma: esqueleto de tractos multiespiculados ascendentes con 2 a 7 espículas en sección transversal, 34-91 µm de grosor, que se ramifican en la superficie; alta presencia de material foráneo (Figura 13C). Espículas: estilos delgados y largos, levemente curvos, 463-845-1265 µm por 4,3-6,5-8,9 µm (Figura 13A, 13B).
Hábitat: sobre gasterópodo y madera en arrecife rocoso.
Distribución: Pacífico norte colombiano.
Comentarios: la ubicación genérica de este espécimen se realizó usando el Systema Porifera (Hooper et al., 2002). Exceptuando Scopalina aff. ruetzleri descrita aquí y en Vega (2012), no existen otras especies del género Scopalina registradas para el POT. Aunque tienen el mismo color, Scopalina sp. 2 es menos porosa y transparente, además de poseer solo estilos más elongados.
Orden Suberitida Chombard y Boury-Esnault, 1999
Familia Halichondriidae Gray, 1867
Especie 13. Axinyssa isabela Carballo yCruz-Barraza, 2008

Figura 14 Axinyssa isabela. A) Oxeas. B) Extremos de oxeas. C) Corte perpendiculares a la superficie mostrando ectosoma y coanosoma.
Axinyssa isabela Carballo y Cruz-Barraza, 2008: 60, figs. 2-5.
Material estudiado: INV POR1385, golfo de Tribugá, Morros de Jurubidá, 13,3 m, col. L. Chasqui, 20-08-2015. INV POR1397, cabo Marzo, Piedra de Eroito, 19 m, col. L. Chasqui, 15-08-2015.
Forma: masiva amorfa, con lóbulos bajos redondeados, extendiéndose irregularmente sobre el sustrato. Superficie lisa, ósculos de forma circular u ovalada de 1-4 mm de diámetro aprox. Color: amarillo oscuro, marrón a ocre en alcohol. Consistencia: firmemente compresible y carnosa en vida; preservada, se desmorona. Ectosoma: pinacodermo parcialmente desprendible, sin esqueleto especializado; tractos y espículas del coanosoma periférico lo atraviesan, pero también organizadas de forma entrecruzada o paratangencial. En la región subectosomal hay una capa de colágeno denso con espículas individuales o tractos. Coanosoma: tractos irregulares y plumosos, 48-94 µm, ascienden y divergen hacia la superficie; muchas espículas en confusión (Figura 14C). Espículas: oxeas grandes y delgadas, ligeramente curvadas (Figura 14A), de puntas muy variables: afiladas, mucronadas, escalonadas y romas (Figura 14A, 14B), 526-647-765 µm por 5,6-10,6-16,1 µm.
Hábitat: en paredes verticales del arrecife rocoso, cuevas y salientes.
Distribución: Pacífico mexicano (Carballo y Cruz-Barraza, 2008); Pacífico norte colombiano.
Comentarios: el profesor J.L. Carballo examinó las fotos tomadas en campo del espécimen in vivo y en el laboratorio del esqueleto y espículas y confirmó que se trata de esta especie por la forma de crecimiento y características morfológicas.
Especie 14. Epipolasis sp.
Material estudiado: INV POR1387, golfo de Tribugá, Morros de Jurubidá, 10 m, col. L. Chasqui, 20-08-2015.
Forma: revestimiento delgado con superficie lisa, un poco corrugada de 6 mm de grosor aprox. Color: púrpura en alcohol, posiblemente por estar preservada junto a una Aplysina. Consistencia: compresible a desmoronadiza. Ectosoma: corteza de espículas más pequeñas y juntas que en el coanosoma. Coanosoma: esqueleto confuso de oxeas de varios tamaños (Figura 15C, 15D). Espículas: megascleras: oxeas ligeramente curvadas en el centro y frecuentemente dobladas en tres porciones, robustas, de puntas afiladas o romas, 149-195-290 µm por 6,4-10,4-16,9 µm (Figura 15A). Microscleras: rafidios rectos y delgados, 94-253-386 µm por 1,0-1,7-2,9 µm (Figura 15B).
Hábitat: sobre arrecifes rocosos someros.
Distribución: Pacífico norte colombiano.
Comentarios: la ubicación genérica se basó en el trabajo de Díaz et al. (1993), quienes hicieron una revisión de los géneros de Halichondriidae del Atlántico central. La diagnosis del género Epipolasis en De Laubenfels (1936a) concuerda con la del espécimen aquí descrito. Este es el primer registro del género en el POT.
Familia Suberitidae Schmidt, 1870
Especie 15. Terpios sp.

Figura 16 Terpios sp. A) Tiloestilos. B) y C) Cortes perpendiculares a la superficie mostrando ectosoma y coanosoma.
Material estudiado: INV POR1403, cabo Marzo, La Foca, sobre octocoral, 17 m, col. L. Chasqui, 15-08-2015.
Forma: revestimiento delgado liso. Color: amarillo brillante; amarillo pálido en alcohol. Consistencia: suave. Ectosoma: pinacodermo atravesado por mechones o hileras de espículas coanosomales, perpendiculares a la superficie. Coanosoma: esqueleto confuso con tractos o grupos de espículas sin dirección definida (Figura 16B, 16C). Espículas: tiloestilos cortos, ligeramente curvos, con cabeza irregular arrugada, abultada, estrecha, aplanada, o lobulada, 137-219-339 µm por 2,1-3,1-4,1 µm (Figura 16A).
Hábitat: sobre octocoral Carijoa riisei en arrecife rocoso.
Distribución: Pacífico norte colombiano.
Comentarios: no ha sido descrita ninguna esponja con tiloestilos de cabeza lobulada o irregular para el Pacífico Oriental, por lo que la identificación se realizó con base en Rützler y Smith (1993), quienes describieron nuevas especies del género Terpios en el Caribe. Se requiere de más material para definir su estatus taxonómico.
Orden Tetractinellida Marshall, 1876 Suborden Astrophorina Sollas, 1887 Familia Geodiidae Gray, 1867 Subfamilia Geodiinae Gray, 1867
Especie 16. Geodia media Bowerbank, 1873

Figura 17 Geodia media. A) Estrongiloxea. B) Ortotriaena. C) Estilo. D) Anatriena. E) Oxea. F) Plagiotriaena. G) Esterráster. H) Oxiáster. I) Estrongilástere. J) y K) Corte perpendicular mostrando la corteza ectosómica y el coanosoma.
Geodia media Bowerbank, 1873: 13, Lám. II; Lendefeld, 1910, Lám. 16, figs. 1-21, Lám. 17, figs. 1-22; Desqueroux-Faúndes y Van Soest, 1997: 408, figs. 69-76; Vega, 2012: 56, figs. 7.2.8. A, B, C.
Material estudiado: INV POR1363, Punta Cruces, La Parguera-Piñas, 6 m, col. L. Chasqui, 16-08-2015.
Forma: masiva amorfa, de pequeño tamaño, no más de 1-2 cm de diámetro y 0,9 cm de grosor. Superficie microrrugosa, llana. Color: blanca en alcohol. Consistencia: corteza dura, coanosoma frágil. Ectosoma: corteza de esterrásteres fuertemente agrupados, de 1576-1940 µm de grosor, conteniendo también oxiásteres y estrongilásteres. Coanosoma: tractos de ortotriaenas y anatriaenas, 123-422 µm de ancho, separados entre sí 60-671 µm, sosteniendo la corteza (Figura 17J). Espículas: megascleras: oxeas ligeramente curvas, 288-938-1445 µm por 10,2-21,3-32,7 µm (Figura 17E); estrongiloxeas con puntas desiguales, con terminaciones afiladas y romas, ligeramente curvas, 132-182-313 µm por 4,1-6,4-17,4 µm (Figura 17A); estilos robustos, poco frecuentes, 993-1049-1106 µm por 36,5 38,9-41,2 µm (Figura 17C); ortotriaenas, rabdoma de 5121012-1497 µm por 35-44-62 µm, cladoma 140-270-405 µm, clados 73-154-200 µm por 15,6-28,9-40,6 µm (Figura 17B); plagiotraenas, rabdoma 382-956-1301 µm por 16,5-23,938,0 µm, cladoma 64-176 -314 µm, clados 43-65-85 µm por 10,5-16,8-21,5 µm (Figura 17F); anatriaenas, rabdoma 382-727-879 µm por 16,5-28,6-40,6 µm, cladoma 64-156246 µm, clados 22,6-26,2-30,0 µm por 10,5-13,4-17,5 µm, (Figura 17D). Microscleras: esterrásteres, 37-68-91 µm por 40-55-70 µm (Figura 17G); estrongilásteres, 3,2-4,9-7,2 µm (Figura 17I); oxiásteres, 18,6-27,2-37,8 µm (Figura 17H).
Hábitat: en paredes de arrecifes rocosos someros.
Distribución: Costa Pacífica de México (Bowerbank, 1873; Vega, 2012); Panamá (Lendenfeld, 1910); islas Galápagos (Desqueyroux-Faúndez y Van Soest, 1997); Pacífico norte colombiano.
Comentarios: la identificación se basó en Lendenfeld (1910) y Desqueyroux-Faúndez y Van Soest (1997). La muestra es más similar a la que describe Lendenfeld (1910) por presentar estilos y orto-plagiotriaenas; sin embargo, las medidas difieren un poco de las de Colombia. La diferenciación entre especies de este género es bastante difícil, ya que se han descrito muchas hasta la actualidad.
Subclase Keratosa Grant, 1861
Orden Dendroceratida Minchin, 1900
Familia Darwinellidae Merejkowsky, 1879
Especie 17. Aplysilla sp.
?Aplysilla sulphurea;Thiele 1905: 488, figs. 112, 114.
Non Aplysilla sulfúreaSchulze, 1878 (especie válida del Mediterráneo y el Atlántico Oriental).
Non Aplysilla "sulfúrea";Escobar 2000: 101, fig. 39.
Non Aplysilla sulphurea;Vega, 2012: 113, figs. 7.2.65. A, B.
Material estudiado: INV POR1366, cabo Corrientes, Piedra de Jairo, 18 m, col. L. Chasqui, 18-08-2015. INV POR1367, cabo Corrientes, Piedra de Jairo, 18 m, col. L. Chasqui, 1808-2015. INV POR1369, cabo Corrientes, Piedra de Colo, 14 m, col. L. Chasqui, 19-08-2015.
Forma: revestimiento de unos pocos mm de grosor; superficie conulosa. Color: amarillo pálido, beige en alcohol. Consistencia: blanda, fibras elásticas, pero algo templadas. Ectosoma: fibras de espongina sostienen el pinacodermo, pero pueden perforarlo y sobresalir más allá. Los cónulos en el material preservado tienen una altura de 118-342 µm (Figura 18C, 18D). Coanosoma: fibras de espongina individuales, erectas, de 35-89 µm de diámetro, que salen de una placa basal; algunas se ramifican y ascienden hacia la superficie (Figura 18A, 18B).
Hábitat: sobre arrecife rocoso junto con octocoral Carijoa riisei.
Distribución: Pacífico norte colombiano.
Comentarios: Aplysilla polyraphisDe Laubenfels, 1930 registrada en California se distingue por ser púrpura oscura en vida y preservada, lo que difiere con las muestras chocoanas. Las fibras de espongina de Aplysilla lendenfeldiThiele, 1905 de Chile son más gruesas, por lo que tampoco correspondería a esa especie. Las características de A. sulfurea, descrita para el estrecho de Magallanes (Thiele, 1905), son similares, pero debe hacerse un análisis más detallado para asegurar que se trata de la misma especie, especialmente por la gran distancia respecto al Pacífico colombiano. Ya que originalmente A. sulfurea se encuentra en el Atlántico oriental y el Mediterráneo, sería incorrecto llamar así al material del Pacífico Oriental. Escobar (2000) y Vega (2012) describen una Aplysilla sulphurea (sulphurea en el caso de Vega, 2012 y "sulfurea" en el caso de Escobar, 2000), que es amarilla en vida y se oxida a púrpura al ser fijada en alcohol, por lo que se infiere que tampoco se trataría de la misma especie.
Especie 18. Chelonaplysilla violacea (Lendenfeld, 1883) sensu Gómez, Carballo, Vázquez y Cruz, 2002

Figura 19 Chelonaplysilla violacea sensuGómez et al., 2002. A) y B) Red de sedimento reforzando el ectosoma. C) y D) Fibras de espongina en los cónulos.
?Aplysilla violaceaLendenfeld, 1883: 237, Lám. X, figs. 5, 7.
Chelonaplysilla violacea;Gómez, Carballo, Vázquez y Cruz, 2002: 234, fig. 7 (con sinonimia adicional); Vega, 2012: 114, figs. 7.2.66. A, B.
Material estudiado: INV POR1368, cabo Corrientes, Piedra de Colo, 19 m, col. L. Chasqui, 19-08-2015. INV POR1379, golfo de Tribugá, Morromico, fragmentos de roca, 11,9 m, col. L. Chasqui, 20-08-2015.
Forma: cojines delgados de algunos centímetros de diámetro, conulosos, con ósculos dispersos, ligeramente elevados con un collar orgánico. Color: púrpura grisáceo, con el collar oscular más oscuro; púrpura oscuro en alcohol. Consistencia: suave y frágil. Ectosoma: superficie conulosa reforzada por una red poligonal de detritus de 33-72 µm de grosor y ojo de malla de 50-164 µm (Figura 19A, 19B). Coanosoma: fibras solitarias de espongina de 37-80 µm de grosor (Figura 19C, 19D), que surgen de una placa basal y ascienden hacia la superficie; las fibras son meduladas y la médula ocupa 37-67 % del diámetro.
Hábitat: sobre arrecife rocoso somero.
Distribución: costa Pacífica de México (Gómez et al., 2002); Pacífico norte colombiano.
Comentarios: el material se ajusta al que describen Gómez et al. (2002) de la costa Pacífica de México. Fue descrita originalmente del Pacífico Occidental, por lo que podría tratarse de un complejo de especies crípticas. De ahí la decisión de adscribirla solo al sentido de dichos autores. Es muy similar a Chelonaplysilla americanaVan Soest, 2017 del Caribe, descrita para Colombia por Zea (1987) como C. erectaRow, 1911, lo que sugiere que serían especies hermanas.
Orden Dictyoceratida Minchin, 1900 Familia Thorectidae Bergquist, 1978 Subfamilia Thorectinae Bergquist, 1978
Especie 19. Scalarispongia similis (Thiele, 1905)

Figura 20 Scalarispongia similis. Cortes perpendiculares a la superficie mostrando el ectosoma y las redes de espongina del coanosoma.
Cacospongia similisThiele, 1905: 481, fig. 108; Desqueyroux-Faúndez y Van Soest, 1997: 455, figs. 200205.
Scalarispongia similis;Cook y Bergquist, 2000: 398 (transferencia de género).
Material estudiado: INV POR1392, Punta Cruces, La Viuda, 13-15 m, col. L. Chasqui, 14-08-2015.
Forma: revestimiento delgado, con superficie conulosa. Color: rosado opaco en alcohol. Consistencia: firme, poco compresible. Ectosoma: pinacodermo grueso y fibroso; cónulos de 114-281 µm de altura, separados 314-1173 µm, formados por fibras primarias que sobresalen del coanosoma. Coanosoma: red regular prismática de espongina con fibras primarias ascendentes, 20-80 µm de grosor, rellenas con espículas foráneas y sedimento, separadas 143-373 µm, interconectadas por fibras secundarias transversales, 25-7 µm de grosor, o una red secundaria con aberturas de 55-521 µm de diámetro (Figura 20).
Hábitat: sobre arrecife rocoso somero.
Distribución: islas Galápagos (Desqueyroux-Faúndez y Van Soest, 1997); islas Juan Fernández y Desventuradas de Chile (Thiele, 1905); hay un registro de la costa argentina (Burton, 1940) que requiere confirmación; Pacífico norte colombiano.
Comentarios: la organización en red rectangular y la presencia de espículas u otras partículas foráneas dentro de las fibras es diagnóstico de esta especie; el diámetro de las fibras es muy parecido al original, aunque las fibras secundarias son más gruesas en la muestra colombiana. Thiele (1905) la describió por primera vez en Chile, lo que puede indicar que esta especie se distribuye por todo el Pacífico Oriental. De confirmarse el registro de Burton (1940), se extendería también al sur del Atlántico americano.
Subclase Verongimorpha Erpenbeck, Sutcliffe, De Cook, Dietzel, Maldonado, Van Soest, Hooper y Wörheide, 2012
Orden Chondrosiida Boury-Esnault y Lopes, 1985
Familia Chondrosiidae Schulze, 1877
Especie 20. Chondrosia tenochca Carballo, Gómez, Cruz-Barraza y Flores-Sánchez, 2003

Figura 21 Chondrosia tenochca. Cortes perpendiculares mostrando el ectosoma y el coanosoma, con canales y ósculos.

LÁMINA 3 fig. 1.Chondrosia tenochca, INV POR1371, cabo Corrientes, 11 m. (en cuadro); fig. 2.Aplysina chiriquiensis, INV POR1402, cabo Marzo, 18.3 m; fig. 3.Aplysina gerardogreeni, INV POR1388, Punta Cruces, 13-15 m; fig. 4.Aplysina cf. revillagigedi, INV POR1390, Punta Cruces, 13-15 m; fig. 5.Vansoestia sp., INV POR1370, cabo Corrientes, 14 m (señalada con flecha).
Chondrosia tenochca Carballo, Gómez, Cruz-Barraza y Flores-Sánchez, 2003: 517; Vega, 2012: 87, figs. 7.2.39. A, B, C.
Material estudiado: INV POR1371, cabo Corrientes,
Piedra de Colo, 11 m, col. L. Chasqui, 19-08-2015.
Forma: revestimiento de 1-2 mm de grueso, estirado sobre el sustrato y parcialmente fragmentado; superficie lisa, llana, brillante. Color: púrpura oscuro a negro, beige en la superficie y púrpura grisáceo en el interior en alcohol. Consistencia: tenaz, correosa. Ectosoma: sin esqueleto. En cortes se observa una corteza orgánica de unos 300 µm de grosor compuesta de dos capas, la más superficial más clara y la interna más densa, producto aparente de células granulosas. Coanosoma: muy denso, fibroso, pero menos granuloso que el ectosoma, sin esqueleto de fibras de espongina o espículas; se observan algunos canales que desembocan en los ósculos (Figura 21).
Hábitat: sobre arrecife rocoso somero.
Distribución: costa Pacífica de México (Carballo et al. , 2003; Vega, 2012); Pacífico norte colombiano.
Comentarios: inicialmente se creía que se trataba de una ascidia colonial, pero se descartó al evidenciar una corteza densa de células que va disminuyendo hacia la parte basal y algunos canales carnosos en el coanosoma. Hasta el momento, este es el segundo registro de esta especie para el POT.
Orden Verongiida Bergquist, 1978
Familia Aplysinidae Carter, 1875
Especie 21. Aplysina chiriquiensis Díaz, Van Soest, Rützler y Guzmán, 2005

Figura 22 Aplysina chiriquiensis. A) y B) Corte histológico de esqueleto. C) y D) Retículo esquelético tridimensional (tejido eliminado en baño de hipoclorito).
Aplysina chiriquiensisDíaz, Van Soest, Rützler y Guzmán, 2005: 3, figs. 1-3.
Material estudiado: INV POR1402, cabo Marzo, La Foca, 18,3 m, col. L. Chasqui, 15-08-2015. INV POR1405, cabo Marzo, Piedra de Rodrigo, 18,5 m, col. L. Chasqui, 15-08-2015.
Forma: erecta, de ramas cilíndricas engrosadas o lateralmente comprimidas con hinchazones anulares, proyecciones en forma de dedos o redondeadas y extremos nudosos que salen del tallo principal. Altura entre 10 y 45 cm; ramas 3-12 mm de grosor y 21-71 mm de largo. Ósculos circulares, distribuidos en una o más filas a lo largo de las ramas, con una membrana tipo collar. Color: exterior amarillo ocre, interior amarillo intenso; púrpura oscuro en alcohol. Consistencia: ligeramente compresible y elástica. Ectosoma: superficie microconulosa; cónulos distribuidos regularmente, formados por los finales en crecimiento de las fibras del coanosoma, que sostienen el pinacodermo. Coanosoma: esqueleto como una red poligonal u oval de fibras color ámbar (Figura 22C, 22D), laminadas concéntricamente, 49-117 µm de grosor, formando mallas de 135-535 µm de diámetro. Las fibras tienen una médula granular oscura que ocupa 31-57 % del diámetro. Hacia la superficie, las fibras tienden a ser dendríticas, con un largo de 189-584 µm (Figura 22A, 22B), más delgadas que las ubicadas hacia el tallo principal.
Hábitat: abundante en los arrecifes rocosos someros.
Distribución: Costa Rica, Panamá, islas Galápagos (Díaz et al., 2005); Pacífico norte colombiano.
Comentarios: se registra por primera vez para el Pacífico norte colombiano y para el Pacífico colombiano en general. Es la única especie del género con forma de ramas verticales en el POT.
Especie 22. Aplysina gerardogreeni Gómez y Bakus, 1992

Figura 23 Aplysina gerardogreeni. A) Fibras dendríticas bifurcadas en la superficie. B) Médula de la fibra de espongina. C) Detalle de fibras con corteza y médula nodular y protuberancias cortas (señaladas con flechas). D) Red poligonal tridimensional. E) y F) Corte histológico. G) Retícula esquelética tridimensional (en G y en A-D el tejido fue eliminado en baño de hipoclorito).
Aplysina gerardogreeniGómez y Bakus, 1992: 176, Lám. 1-2; Cruz-Barraza, Carballo, Rocha-Olivares, Ehrlich y Hog, 2012: 4, figs. 1E, F; 2I, J; Vega, 2012: 116, figs. 7.2.68. A, B.
Suberea gerardogreeni;Escobar, 2000: 108, figs. 41-42.
Material estudiado: INV POR1374, golfo de Tribugá, Morromico, 11,7 m, col. L. Chasqui, 20-08-2015. INV POR1377, Morromico, 11,9 m, col. L. Chasqui, 20-082015. INV POR1388, Punta Cruces, La Viuda, 13-15 m, col. L. Chasqui, 14-08-2015. INV POR1393 y 1394, Punta Cruces, La Mina, 15 m, col. L. Chasqui, 16-08-2015. INV POR1398 y 1399, cabo Marzo, Piedra de Eroito, 17,5 m, col. L. Chasqui, 15-08-2015.
Forma: masiva y lobular, de hasta 10-15 cm de diámetro y unos 5-10 cm de altura; superficie conulosa; ósculos en el tope de los lóbulos, usualmente con una membrana a manera de collar. Color: externamente amarillo oscuro (ocre) con tonos púrpura en vivo, interior amarillo; púrpura oscuro en alcohol. Consistencia: firme y ligeramente compresible. Ectosoma: pinacodermo fácilmente desprendible, sostenido por finales de las fibras del coanosoma, que conforman los cónulos. Coanosoma: red poligonal tridimensional de fibras de espongina con abertura de malla de 148-1037 µm de diámetro (Figura 23D). Fibras de 53-156 µm de diámetro, con corteza de color ámbar con protuberancias pequeñas y médula de 33-84 % del diámetro (Figura 23C). Cerca de la superficie, las fibras se tornan dendríticas y generalmente se bifurcan y forman la superficie conular, que termina en puntas redondeadas, con un largo de 571-643 µm.
Hábitat: abundante en los arrecifes rocosos del Pacífico norte colombiano.
Distribución: sur de Baja California a Oaxaca (México) (Gómez y Bakus, 1992; Cruz-Barraza et al., 2012; Vega, 2012); bahía Málaga en el Pacífico colombiano (Escobar, 2000); Pacífico norte colombiano.
Comentarios: se revisaron los estudios de Gómez y Bakus (1992) y Cruz-Barraza et al. (2012) del Pacífico mexicano. La presencia de una red poligonal tridimensional regular y las medidas del diámetro son similares en ambas descripciones; sin embargo, comparando la abertura de malla, es más pequeña que la que registran Gómez y Bakus (1992), 1,1-1,9 mm vs 0,2-1 mm en nuestro material. También se compararon las especies descritas por Gómez et al. (2018) del golfo de California. La forma de crecimiento y el color externo de nuestro material es similar a A. airapii, pero el esqueleto, en lugar de una malla uniplanar, cuenta con una red poligonal de donde surgen fibras dendríticas, lo cual también difiere de A. sinuscaliforniensis, que tiene un esqueleto totalmente reticulado, sin fibras dendríticas.
Especie 23. Aplysina cf. revillagigedi Cruz-Barraza, Carballo, Rocha-Olivares, Ehrlich y Hog, 2012

Figura 24 Aplysina cf. revillagigedi. A) Corte histológico. B) Reticulación esquelética tridimensional (tejido eliminado en baño de hipoclorito).
Aplysina revillagigediCruz-Barraza, Carballo, Rocha-Olivares, Ehrlich y Hog, 2012: 3, figs. 1B, C; 2F-H.
Material estudiado: INV POR1382, golfo de Tribugá, Morros de Jurubidá, 14,5 m, col. L. Chasqui, 20-08-2015. INV POR1390 y 1391, Punta Cruces, La Viuda, 13-15 m, col. L. Chasqui, 14-08-2015. INV POR1406, cabo Marzo, 18,5 m, col. L. Chasqui, 15-08-2015.
Forma: masiva amorfa, lobulada, de aproximadamente 5 cm de diámetro y hasta unos 3 cm de alto. Superficie lisa, cónulos evidentes en muestras preservadas, suaves al tacto. Ósculos dispersos o alineados en el tope de los lóbulos, 1,6-6,7 mm de diámetro. Color: amarillo brillante; púrpura oscuro en alcohol. Consistencia: flexible, ligeramente compresible. Ectosoma: finales de la red coanosómica sostienen el pinacodermo. Coanosoma: esqueleto tridimensional reticulado, poligonal a irregular, y muy abierto, con mallas de 153-1037 µm de diámetro. Fibras de color ámbar o marrón oscuro, 119-60 µm de diámetro, con médula de 29-74 % del diámetro (Figura 24A). Hacia la superficie, terminan a manera de fibras dendríticas de 3261749 µm de largo, con puntas redondeadas (Figura 24B).
Hábitat: arrecifes rocosos someros.
Distribución: Pacífico mexicano (Cruz-Barraza et al. , 2012); Pacífico norte colombiano.
Comentarios: la identificación es tentativa, pues es difícil separar las especies masivas de Aplysina del POT. La forma de crecimiento y la organización de la red de espongina se confunde con la de A. gerardogreeni, ya que algunas muestras son lóbulos tubulares con un ósculo apical, pero, en estas, la organización del esqueleto cerca de la superficie muestra fibras que se ramifican y terminan en puntas redondeadas como las de A. revillagigedi.
Familia Ianthellidae Hyatt, 1875
Especie 24. Vansoestia sp.

Figura 25 Vansoestia sp. A) y C) Cordones granulosos. B) Red ectosómica de cordones granulosos. D) Partículas foráneas aparentemente incluidas en una fibra.
Material estudiado: INV POR1370, cabo Corrientes, Piedra de Colo, 14 m, col. L. Chasqui, 19-08-2015. INV POR1384, golfo de Tribugá, Morros de Jurubidá, 10 m, col. L. Chasqui, 20-08-2015.
Forma: revestimiento delgado extendiéndose irregular y fraccionadamente sobre el sustrato, por varios centímetros. Color: púrpura claro; púrpura oscuro en alcohol. Consistencia: suave. Ectosoma: pinacodermo con una especie de red de cordones de mayor densidad celular, con ojo de malla de 17-57 µm de diámetro (Figura 25C). Coanosoma: cordones granulosos de células, a manera de fibras, 96-182 µm de diámetro (Figura 25A, 25B). En los cortes y macerados se vislumbran fibras verticales cortas con gran acumulación de detritos (Figura 25D), pero son difíciles de discernir por lo pigmentado de las células.
Hábitat: sobre arrecife rocoso y otros organismos.
Distribución: Pacífico norte colombiano.
Comentarios: se incluyó en el género Vansoestia por su similitud con Vansoestia caribensisDíaz, Thacker, Redmond, Pérez y Collins, 2015 tanto en la morfología externa como en la presencia de cordones granulosos. No parece haber fibras de espongina tipo Aplysilla (limpias), pero podría haber fibras tipo Pleraplysilla (rellena de detritos); por ello, Zea et al. (2014) llamaron Pleraplysilla sp. a sus muestras de V. caribensis, por la presencia aparente de fibras verticales cortas no divididas, rellenas de detritos. Confirmarlo requiere de métodos histológicos diferentes como cortes desbastados y pulidos.
DISCUSIÓN
La diversidad conocida de esponjas en la región del POT, con no más de un centenar de especies (Van Soest et al. , 2012), es mucho menor que la del Caribe, con al menos 519 especies (Miloslavich et al., 2010). La primera y más obvia razón es un esfuerzo de muestro desigual entre ambas regiones, lo cual fue notado por Van Soest et al. (2012). Mientras en el Caribe se considera que el grupo es bien conocido (> 70 % de las especies descritas, al menos cuatro guías de identificación; Miloslavich et al., 2010), la fauna de esponjas del POT está entre las menos conocidas globalmente, con solo cuatro estudios recientes que incluyen listas de especies (Escobar, 2000; Berman, 2004; Lizarazo, 2018; Carballo et al., 2019).
En Colombia, ese sesgo es aún más marcado, pues mientras para el Caribe existen más de 25 trabajos publicados sobre biodiversidad de esponjas (Zea, 1987; Zea et al., 2014), así como una guía de identificación (Zea, 1987), para el Pacífico colombiano se conocen solamente tres trabajos no publicados (Narváez, 1999; Escobar, 2000; Lizarazo, 2018). En consecuencia, mientras que para el Caribe colombiano se han registrado más de 150 especies de esponjas (Silva y Zea, 2017), para el Pacífico se conocen solo 46 especies. Sin embargo, esa diferencia en la biodiversidad de esponjas entre las dos costas va más allá de un mero sesgo de muestreo, como lo sugieren los resultados de Carballo et al. (2019). Ellos compararon la diversidad de esponjas en arrecifes coralinos del POT, el Caribe y el Pacífico Occidental, y muestran grandes diferencias en abundancia y riqueza de especies, así como en formas de crecimiento (masivas y expuestas en el Caribe y Pacífico Occidental versus pequeñas, incrustantes y crípticas en el POT). Observaciones realizadas durante el trabajo de campo en este estudio comparadas con observaciones de los autores en hábitats "similares" (i. e. arrecifes e islotes rocosos) de la costa Caribe sugieren que las observaciones de Carballo et al. (2019) sobre la marcada diferencia entre las comunidades de esponjas de arrecifes coralinos del Pacífico mexicano y del Caribe aplican también para los ecosistemas de arrecifes rocosos en Colombia.
Varias explicaciones se han propuesto para esas diferencias en las comunidades de esponjas entre las dos regiones, que involucran factores biológicos (v. g. depredación, competencia) y físicos (v. g. sedimentación, turbulencia, abrasión) a escala local, así como fenómenos a escala regional y global (v. g. surgencia, ENSO) (Wulff, 1997; Carballo et al., 2019). En cuanto a la diferencia en las formas de crecimiento predominantes en ambas costas (i. e. incrustantes y masivas pequeñas ocultas entre el arrecife en el POT versus grandes colonias erectas en la columna de agua en el Caribe), se cree que una fuerte presión de depredación en el POT, en especial de peces espongívoros, sobre especies que en su mayoría carecen de defensas químicas restringe la colonización y un mayor desarrollo en ambientes expuestos (Bakus, 1964; Wulff, 1997). Carballo et al. (2019) atribuyen esa fuerte diferencia en las comunidades de esponjas entre el Caribe y el POT al efecto de un acentuado régimen de perturbaciones naturales locales y de gran escala que actúan a largo plazo sobre una biota que quizá no fue nunca particularmente exuberante [i. e. hablando específicamente de esponjas asociadas a arrecifes coralinos, ver López-Pérez (2017) para un contexto general sobre origen de la biota coralina del POT] y que quedó virtualmente aislada hace alrededor de tres millones de años con el levantamiento del istmo de Panamá. Entonces, perturbaciones naturales de gran impacto como los cambios en temperatura superficial y régimen de nutrientes causados por el ENSO (Wang et al., 2017), así como eventos recurrentes de mareas bajas extremas, entre otros, pudieron generar procesos de extinción local y regional en comunidades de esponjas, lo que sumado a una ausencia de efecto de rescate debido al levantamiento del istmo y a la virtual imposibilidad de colonización natural de nuevas especies de esponjas a través de la barrera del Pacífico (i. e. más de 7000 km de aguas abiertas y profundas) podrían ser las fuerzas principales que han sentenciado una empobrecida fauna de Porifera en el POT.
Por otra parte, es bien conocida la marcada diferencia en biodiversidad marina entre el POT y el Caribe, especialmente en lo que se refiere a la biota de los arrecifes coralinos (Veron, 1995). En términos generales, una escasa presencia y desarrollo de formaciones coralinas en el POT afecta enormemente cualquier comparación de biodiversidad con el Caribe, la segunda región en desarrollo coralino del mundo, en cualquier taxón que esté fuertemente asociado a esos ecosistemas, como es el caso de las esponjas.
Incluso, no solo la baja presencia de arrecifes coralinos, sino de arrecifes en general (i. e. incluyendo arrecifes rocosos) en el Pacífico colombiano (v. g.Posada et al., 2009) afecta los indicadores de diversidad de la biota sésil que requiere sustrato duro para asentarse.
De las esponjas identificadas, seis especies son morfológicamente similares (especies geminadas) con especies del Caribe colombiano, lo que podría indicar que: 1. Se trata de especies hermanas con un ancestro común previo al cierre del istmo; 2. Se trata de poblaciones de una misma especie quizá en un lento proceso de divergencia evolutiva vía especiación vicariante; 3. Alguna de las dos poblaciones es una invasión biológica mediada por el transporte marítimo (i. e. como biofouling) vía canal de Panamá. La respuesta necesariamente pasa por el análisis genético molecular de un número de especímenes de esas "especies geminadas", el cual está fuera del alcance de este trabajo; sin embargo, este asunto deja ver que la historia evolutiva de poblaciones de especies marinas a ambos lados del istmo de Panamá sigue siendo de total relevancia y materia de interés.
En cuanto a la distribución geográfica de las esponjas encontradas en el Pacífico colombiano, se agruparon en cinco sectores biogeográficos (*especies registradas por Escobar (2000), **especies registradas por Narváez (1999): Pacífico Oriental Tropical y provincia costera californiana: Spheciospongia sp. (posiblemente S. raromisclerosa)*; Pacífico Oriental y provincia costera Chile-Perú: Scalarispongia similis; Pacífico Oriental Tropical (desde México hasta Ecuador): Axinella nayaritensis, Desmanthus levii, Crambe panamensis, Discorhabdella littoralis, Axinyssa isabela, Geodia media, Chondrosia tenochca, Aplysina chiriquiensis, A. gerardogreeni, Spirastrella sabogae*, Niphates perforata*, T. (Tedania)"nigrescens" (posiblemente T. (Tedania) tropicalis)*, A. azteca* (como Suberea), Aplysina cf. revillagigedi; Pacífico Oriental y Occidental Tropical: Chalinula nematifera, Chelonaplysilla violácea, Mycale cecilia*, Pseudosuberites "sulcatus"*; Tentativamente solo en Colombia mientras se define su estatus taxonómico (posiblemente nuevas especies, pero se requiere de estudios detallados): Prosuberites aff. laughlini, Dragmacidon sp., Acanthella sp., Placospongia aff. intermedia, Clathria (Microciona) sp., Scopalina aff. ruetzleri, Scopalina sp. 2., Epipolasis sp., Terpios sp., Aplysilla sp., Vansoestia sp.,Xestospongia sp.**,Anphimedon sp.**, Aaptos sp.**, Geodia sp.**, Desmanthus aff. incrustans*, Geodia sp.*, Amorphinopsis sp.*, Topsentia aff. ophiraphidites*, Mycale sp.*, Haliclona sp. 1, Haliclona sp. 2, Haliclona sp. 3, Haliclona sp. 4*, Placospongia carinata (P. intermedia en el Pacífico Oriental), Aplysilla "sulfurea" *.
Finalmente, con la descripción realizada en este trabajo de 24 especies halladas en los arrecifes rocosos (riscales y morros) del Pacífico norte colombiano (21 son nuevos registros para Colombia), se eleva a 46 el número de especies de esponjas para el Pacífico colombiano. Esta riqueza de especies se considera baja en comparación con la biodiversidad conocida del Caribe colombiano (> 150 especies). Algunas de las esponjas aquí registradas tienen características morfológicas externas y del esqueleto muy similares a especies del Caribe, lo que indica que podrían ser especies geminadas; sin embargo, el análisis realizado con base en caracteres exclusivamente morfológicos no permite concluir si son o no especies diferentes y si requieren de un nuevo nombre; por tanto, la pregunta queda abierta a la espera de análisis más detallados, que incluyan la revisión de un mayor número de muestras de esas especies proveniente de ambas costas, y desde luego, del análisis de caracteres moleculares.
AGRADECIMIENTOS
El trabajo fue financiado por el Instituto de Investigaciones Marinas y Costeras (Invemar), a través del proyecto "Investigación científica hacia la generación de información y conocimiento de las zonas marinas y costeras de interés de la nación" (código BPIN 2017011000113) y hace parte del estudio "Caracterización biótica de los arrecifes rocosos con desarrollo significativo en el Pacífico norte colombiano". Agradecemos a José Luis Carballo por la confirmación de la especie Axinella nayaritensis; a Mateo López V. y a otro revisor anónimo cuyos comentarios contribuyeron a mejorar el manuscrito; a Eroito Álvarez, Luisa Ruiz, Arnold Llorente, Rodrigo Fajardo, y a Turquí Paradise Hotel and Dive Center por brindar facilidades logísticas y apoyo durante el trabajo de campo. Gracias a Felipe Valencia por elaborar el mapa del área de estudio y a Felipe Gentil por apoyar en la edición de imágenes. La colecta y depósito de muestras siguen las indicaciones del Decreto 309-2003 del Ministerio de Ambiente y Desarrollo Sostenible. Contribución número 1276 del Invemar. El trabajo de S. Zea es la contribución 500 del Instituto de Estudios en Ciencias del Mar (Cecimar), Universidad Nacional de Colombia, sede Caribe.
REFERENCIAS
Aguirre, L.K., Y. Hooker, W. Philippe, and E. Hajdu. 2011. A new Clathria (Demospongiae, Microcionidae) from Peru occurring on rocky substrates as well as epibiontic on Eucidaris thouarsii sea urchins. Zootaxa, 3085: 41-54. https://doi.org/10.11646/zootaxa.3085.L3 [ Links ]
Alcolado, P.M. 1984. Nuevas especies de esponjas encontradas en Cuba (new species of sponges from Cuba). Poeyana, 271: 1-22. [ Links ]
Álvarez, B. and J.N.A. Hooper. 2002. Family Axinellidae Carter, 1875. 724-747. In: Hooper, J.N.A., R.W.M. Van Soest, and P. Willenz. (Eds.). Systema Porifera. A guide to the classification of sponges. Springer: Boston. 1100 p. https://doi.org/10.1007/978-1-4615-0747-5_80 [ Links ]
Austin, W.C., B.S. Ott, H.M. Reiswig, P. Romagosa, and N.G. McDaniel. 2013. Two new species in the family Axinellidae (Porifera, Demospongiae) from British Columbia and adjacent waters. ZooKeys, 338: 11-28. https://doi.org/10.3897/zookeys.803.22543 [ Links ]
Ávila, E. and J.L. Carballo. 2009. A preliminary assessment of the invasiveness of the Indo-Pacific sponge Chalinula nematifera on coral communities from the tropical Eastern Pacific. Biol. Inv., 11: 257-264. https://doi.org/10.1007/s10530-008-9230-5 [ Links ]
Bakus, G.J. 1964. The effects of fish-grazing on invertebrate evolution in shallow tropical waters. Allan Hancock Fund. Publ. Occ., 27:1-29. [ Links ]
Bergquist, P.R. 1978. Sponges. Hutchinson, London. 268 p. [ Links ]
Berman, J. 2004. Sponge diversity in coral frameworks and coral communities within the Las Perlas archipelago, Panama. M. Sci. Thesis, Heriot-Watt University, Edinburgh. 83 p. [ Links ]
Boury-Esnault, N. and M.T. Lopes. 1985. Les Démosponges littorales de l'Archipel des Açores. Ann. Inst. Oceanogr. París, 61(2): 149-225. [ Links ]
Boury-Esnault, N., M. Klautau, C. Bézac, J. Wulff, and A.M. Solé-Cava. 1999. Comparative study of putative conspecific sponge populations from both sides of the Isthmus of Panama. J. Mar. Biol. Ass. U.K., 79: 39-50. https://doi.org/10.1017/S0025315498000046 [ Links ]
Bowerbank, J.S. 1858. On the anatomy and physiology of the Spongiadae. Part I. On the Spicula. Philos. Trans. Royal Soc. A., 148(2): 279-332. [ Links ]
Bowerbank, J.S. 1862. On the anatomy and physiology of the Spongiadae. Part II. Philos. Trans. Royal Soc., 152(2): 747-829. [ Links ]
Bowerbank, J.S. 1873. Contributions to a general history of the Spongiadae. Proc. Zool. Soc. Lond., 3: 3-25. [ Links ]
Burton, M. 1940. Las esponjas marinas del Museo Argentino de Ciencias Naturales. Parte 1. Anales del Museo Argentino de Ciencias Naturales Bernardino Rivadavia, 40(6): 95-121. [ Links ]
Carballo, J.L. and J.A. Cruz-Barraza. 2008. First record of Axinyssa Lendenfeld, 1897 (Demospongiae, Halichondrida) from the East Pacific Ocean, with the description of Axinyssa isabela sp. nov. Zootaxa, 1784: 58-68. https://doi.org/10.11646/zootaxa.1784.L4 [ Links ]
Carballo, J.L., P. Gómez, J.A. Cruz-Barraza, and D.M. Flores-Sánchez. 2003. Sponges of the family Chondrillidae (Porifera: Demospongiae) from the Pacific coast of Mexico, with the description of three new species. Proc. Biol. Soc. Wash., 116(2): 515-527. [ Links ]
Carballo, J.L., J.A. Cruz-Barraza, and P. Gómez. 2004. Taxonomy and description of clionaid sponges (Hadromerida, Clionaidae) from the Pacific Ocean of México. Zool. J. Linn. Soc., 141(3): 353-397. https://doi.org/10.1111/j.1096-3642.2004.00126.x [ Links ]
Carballo, J.L., E. Bautista-Guerrero and J.A. Cruz-Barraza. 2018. Description and molecular phylogeny of Axinella nayaritensis n. sp. (Porifera: Axinellida) from East Pacific and remarks about the polyphyly of the genus Axinella. Zootaxa, 4482(1): 111-124. https://doi.org/10.11646/zootaxa.4482.L4 [ Links ]
Carballo, J.L., J.A. Cruz-Barraza, C. Vega, H. Nava, and M.C. Chávez-Fuentes. 2019. Sponge diversity in Eastern Tropical Pacific coral reefs: an interoceanic comparison. Sci. Rep., 9: 94-09. https://doi.org/10.1038/s41598-019-45834-4 [ Links ]
Cárdenas, P., T. Pérez, and N. Esnault. 2012. Sponge systematics facing new challenges. 79-209. In: Becerro, M.A., M.J. Uriz, M. Maldonado, and X. Turon. (Eds.). Advances in sponge science: phylogeny, systematics, ecology. Elsevier, 61. https://doi.org/10.1016/B978-0-12-387787-1.00010-6 [ Links ]
Carter, H.J. 1875. Notes introductory to the study and classification of the Spongida. Part II. Proposed classification of the Spongida. Ann. Mag. nat. Hist., 4(16): 126-145. [ Links ]
Carter, H.J. 1883. Contributions to our knowledge of the Spongida. Ann. Mag. Nat. Hist., 11(65): 344-369. https://doi.org/10.1080/00222938309459163 [ Links ]
Chombard, C. and N. Boury-Esnault. 1999. Good congruence between morphology and molecular phylogeny of Hadromerida, or how to bother sponge taxonomists. Mem. Qld. Mus., 44: 100. [ Links ]
Cook, S. and P.R. Bergquist. 2000. Two new genera and five new species of the Cacospongia group (Porífera, Demospongiae, Dictyoceratida). Zoosystema, 22(2): 383-400. [ Links ]
Costa, G., G. Bavastrello, M. Pansini, and M. Bertolino. 2020. Acanthella danerii sp. nov. (Demospongiae, Bubarida, Dictyonellidae) from Chilean fjords (South Pacific Ocean). Zootaxa, 4790(2): 393-396. https://doi.org/10.11646/zootaxa.4790.2.13 [ Links ]
Cruz-Barraza, J.A. and J.L. Carballo. 2008. Taxonomy of sponges (Porifera) associated with corals from the Mexican Pacific Ocean. Zool. Stud., 47(6): 741-758. [ Links ]
Cruz-Barraza, J.A., J.L. Carballo, A. Rocha-Olivares, H. Ehrlich, and M. Hog. 2012. Integrative taxonomy and molecular phylogeny of genus Aplysina (Demospongiae: Verongida) from Mexican Pacific. PLoS ONE, 7(8): 42-49. https://doi.org/10.1371/journal.pone.0042049 [ Links ]
De Laubenfels, M.W. 1930. The sponges of California. Abstracts of dissertations for the degree of Doctor of Philosophy. Stanford Univ. Bull., 5(98): 24-29. [ Links ]
De Laubenfels, M.W. 1932. The marine and fresh water sponges of California. Proc. U.S. Nat. Mus., 81(2927): 1-140. https://doi.org/10.5479/si.00963801.81-2927.1 [ Links ]
De Laubenfels, M.W. 1935. Some sponges of lower California (México). Am. Mus. Nov., 779: 1-14. [ Links ]
De Laubenfels, M.W. 1936a. A discussion of the sponge fauna of the Dry Tortugas in particular and the West Indies in general, with material for a revision of the families and orders of the Porifera. Carnegie Inst. Wash. Publ., 467: 1-225. [ Links ]
De Laubenfels, M.W. 1936b. A comparison of the shallow-water sponges near the Pacific end of the Panamá canal with those at the Caribbean end. Proc. U.S. Natl. Mus., 83: 441-454. [ Links ]
De Laubenfels, M.W. 1954. The sponges of the West-Central Pacific. Zool. Stud., 7. Oregon State College, Corvallis. 306 p. https://doi.org/10.5962/bhl.title.6516 [ Links ]
De Weerdt, W.H. 2002. Family Chalinidae Gray, 1867. 852-873. In: Hooper, J.N.A., R.W.M. Van Soest, and P. Willenz (Eds.). Systema Porifera. A guide to the classification of sponges. Springer: Boston. 1100 p. https://doi.org/10.1007/978-1-4615-0747-5_91 [ Links ]
Desqueyroux-Faúndez, R. and R.W.M. Van Soest. 1997. Shallow waters Demosponges of the Galápagos Islands. Rev. Suisse Zool., 104(2): 379-467. [ Links ]
Díaz, J.M., L. Guillot y M.C. Velandia. 2016. La pesca artesanal en la costa norte del Pacífico colombiano: un horizonte ambivalente. Fundación Marviva, Bogotá. 158 p. [ Links ]
Díaz, M.C., B. Álvarez, and R.W.M. Van Soest. 1987. New species of Demospongiae (Porifera) from the national park Archipiélago de Los Roques, Venezuela Bijdr. Dierkd, 57(1): 31-41. https://doi.org/10.1163/26660644-05701003 [ Links ]
Díaz, M.C., S.A. Pomponi, and R.W.M. Van Soest . 1993. A systematic revision of the central West Atlantic Halichondrida (Demospongiae, Porifera). Part III: Description of valid species. Sci. Mar., 57(4): 283-306. [ Links ]
Díaz, M.C., R.W.M. Van Soest, K. Rützler, and H.M Guzmán. 2005. Aplysina chiriquiensis, a new pedunculate sponge from the Gulf of Chiriquí, Panamá, Eastern Pacific (Aplysinidae, Verongida). Zootaxa, 1012: 1-12. https://doi.org/10.11646/zootaxa.1012.L1 [ Links ]
Díaz, M.C., R.W. Thacker, N.E. Redmond, T. Pérez, and A.G. Collins. 2015. Vansoestia caribensis gen. nov., sp. nov.: first report of the family Ianthellidae (Verongida, Demospongiae) in the Caribbean. Zootaxa, 3956(3): 403-412. https://doi.org/10.11646/zootaxa.3956.3.5 [ Links ]
Erpenbeck, D., P. Sutcliffe, S. Cook, A. Dietzel, M. Maldonado, R.W.M. Van Soest, J.N.A. Hooper, and G. Wörheide. 2012. Horny sponges and their affairs: On the phylogenetic relationships of keratose sponges. Elsevier, 63(3): 809-816. https://doi.org/10.1016/j.ympev.2012.02.024 [ Links ]
Escobar, T. 2000. Inventario y estudio taxonómico de las esponjas (Phylum Porifera) de algunas áreas del Pacífico colombiano. Tesis Biol. Mar. Univ. Valle, Buenaventura. 149 p. [ Links ]
García-Suárez, S.D., A. Acosta, E. Londoño-Cruz y J.R. Cantera K. 2012. Organismos sésiles y móviles del litoral rocoso: en el Pacífico colombiano: una guía visual para su identificación. Ser. Doc. Esp., (26). Invemar, Santa Marta. 133 p. [ Links ]
Goeij, J.M., H. van den Berg, M.M. van Oostveen, E.H. Epping, and F.C. Van Duyl. 2008. Major bulk dissolved organic carbon (DOC) removal by encrusting coral reef cavity sponges. Mar. Ecol. Prog. Ser., 357: 139-151. https://doi.org/10.3354/meps07403 [ Links ]
Goeij, J.M., D. Oevelen, M.J. Vermeij, R. Osinga, J.J. Middelburg, A.F. de Goeij, and W. Admiraal. 2013. Surviving in a marine desert: the sponge loop retains resources within coral reefs. Science, 342: 108-110. https://doi.org/10.1126/science.1241981 [ Links ]
Gómez, P. and G. Bakus. 1992. Aplysina gerardogreeni and Aplysina aztecus (Porifera: Demospongiae) new species from the Mexican Pacific. An. Inst. Cienc. Mar Limnol., 19(2): 175-180. [ Links ]
Gómez, P., J.L. Carballo, L.E. Vázquez, and J.A. Cruz. 2002. New records for the sponge fauna (Porifera: Demospongiae) of the Pacific coast of México (eastern Pacific Ocean). Proc. Biol. Soc. Wash., 115(1): 223-237. [ Links ]
Gómez, P., B. González-Acosta, C. Sánchez-Ortíz, Z. Hoffman, and C. Hernandéz-Guerrero. 2018. Amended definitios for Aplysinidae and Aplysina (Porifera, Demospongiae, Verongiida): on three new species from a remarkable population in the Gulf of California. Zootaxa, 4455(2): 322-342. https://doi.org/10.11646/zootaxa.4455.2.4 [ Links ]
Grant, R.E. 1861. Tabular view of the primary divisions of the Animal Kingdom, intended to serve as an outline of an elementary course of recent zoology (caino-zoology); or, the natural history of existing animals. Walton and Maberly, London. 91 p. [ Links ]
Gray, J.E. 1867. Notes on the arrangement of sponges, with the descriptions of some new genera. Proc. Zool. Soc. Lond., (2): 492-558. [ Links ]
Green, G. y P. Gómez. 1986. Estudio taxonómico de las esponjas de Mazatlán Sinaloa, México. An. Inst. Cienc. Mar Limnol. Univ. Nal. Autón. México, 13(3): 273-300. [ Links ]
Guzmán, H., C.A. Guevara, and O. Breedy. 2004. Distribution, diversity, and conservation of coral reefs and coral communities in the largest marine protected area of Pacific Panamá (Coiba Island). Environ. Conserv., 31: 111-121. https://doi.org/10.1017/S0376892904001250 [ Links ]
Hartman, W.D. 1980. Systematics of the Porifera. 24-51. En: Hartman, W.D., J.W. Wendt y F. Wiedenmayer. (Eds.). Living and fossil sponges, notes for a short course. Univ. Miami, Miami. 274 p. [ Links ]
Holmes, B. and H. Blanch. 2007. Genus-specific associations of marine sponges with group I crenarchaeotes. Mar. Bio., 150: 759-772. https://doi.org/10.1007/s00227-006-0361-x [ Links ]
Hooper, J.N.A., R.W.M. Van Soest , and P. Willenz. (Eds.). 2002. Systema Porifera. A guide to the classification of sponges. Springer: Boston . 1100 p. https://doi.org/10.1007/978-1-4615-0747-5 [ Links ]
Hyatt, A. 1875. Revision of the North American Poriferae; with remarks upon foreign species. Part I. Mem. Read. Boston Soc. Nat. Hist., 2: 399-408. [ Links ]
Lendenfeld, R. von. 1883. Über Coelenteraten der Südsee. II.Mittheilung. Neue Aplysinidae. Z. wiss. Zool., 38(2): 234-313. [ Links ]
Lendenfeld, R. von. 1910. The Sponges. 1. Geodiidae. En: Reports of the expeditions to the Eastern Tropical Pacific, in the charge of Alexander Agassiz, by the U.S. Fish Commission Steamer Albatross. Mem. Mus. Comp. Zool. Harv. Coll., 41(1): 224-259. [ Links ]
Lévi, C. 1953. Sur une nouvelle classification des Démosponges. C. r. hebd. séances Acad. sci, 236(8): 853-855. [ Links ]
Lévi, C. 1963. Spongiaires d'Afrique du Sud. Poecilosclérides. Trans. R. Soc. S. Afr., 37(1): 1-72. [ Links ]
Lizarazo, N. 2018. Esponjas asociadas al ecosistema rocoso (Riscales y Morros) del Pacífico norte chocoano, Colombia. Tesis Biol. Mar. Univ. Jorge Tadeo Lozano, Santa Marta. 100 p. [ Links ]
López-Pérez, A. 2017. Revisiting the Cenozoic history and the origin of the Eastern Pacific coral fauna. 30-57. In: Glynn, P.W., D.P. Manzanello, and I.C. Enochs. (Eds.). Coral reefs of the Eastern Tropical Pacific. Springer, Dordrecht. https://doi.org/10.1007/978-94-017-7499-4_2 [ Links ]
Maldonado, M., M.C. Carmona, R.W.M. Van Soest , and S.A. Pomponi. 2001. First record of the sponge genera Crambe and Discorhabdella for the Eastern Pacific, with description of three new species. J. Nat. Hist., 35(9): 1261-1276. https://doi.org/10.1080/002229301750384293 [ Links ]
Marshall, W. 1876. Ideen über die Verwandtschaftsverhältnisse der Hexactinelliden. Z. wiss. Zool., 27(1): 113-136. [ Links ]
Merejkowsky, C. 1879. Études sur les Éponges de la Mer Blanche. Mem. Acad. Sci. St. Petersb., 26(7): 1-51. [ Links ]
Miloslavich, P., J.M. Díaz, E. Klein, J.J. Alvarado, C. Díaz, J. Gobin, E. Escobar-Briones, J.J. Cruz-Motta, E. Weil, J. Cortés, A.C. Bastidas, R. Robertson, F. Zapata, A. Martín, J. Castillo, A. Kazandjian, and M. Ortiz. 2010. Marine biodiversity in the Caribbean: regional estimates and distribution patterns. PloS ONE, 5(8): e11916. https://doi.org/10.1371/journal.pone.0011916 [ Links ]
Minchin, E.A. 1900. Sponges: 1-178. In: Lankester, E. R. (Ed.). A treatise on zoology. The Porifera and Coelenterata. Adam Charles Black, London. [ Links ]
Morrow, C. and P. Cárdenas. 2015. Proposal for a revised classification of the Demospongiae (Porifera). Front. Zool., 12: 7. https://doi.org/10.1186/s12983-015-0099-8 [ Links ]
Morrow, C., B. Picton, D. Erpenbeck, N. Boury-Esnault, C. Maggs and A. Allcock. 2012. Congruence between nuclear and mitochondrial genes in Demospongiae: A new hypothesis for relationships within the G4 clade (Porifera: Demospongiae). Mol. Phylog. Evol., 62(1): 174-190. https://doi.org/10.1016/j.ympev.2011.09.016 [ Links ]
Narváez, K. 1999. Identificación y aspectos ecológicos de las esponjas del arrecife coralino de Playa Blanca, isla Gorgona (Pacífico colombiano). Tesis Biol. Mar., Univ. Valle, Cali. 57 p. [ Links ]
Nichols, A. 2005. An evaluation of support for order-level monophyly and interrelationships within the class Demospongiae using partial data from the large subunit rDNA and cytochrome oxidase subunit I. Mol. Phylog. Evol., 34: 81-96. https://doi.org/10.1016/j.ympev.2004.08.019 [ Links ]
Nichols, A. and A.G. Barnes. 2005. A molecular phylogeny and historical biogeography of the marine sponge genus Placospongia (Phylum, Porifera) indicate low dispersal capabilities and widespread crypsis. J. Exp. Mar. Biol. Ecol., 323: 1-15. https://doi.org/10.1016/j.jembe.2005.02.012 [ Links ]
Posada, B.O., W. Henao y G. Guzmán. 2009. Diagnóstico de la erosión y sedimentación en la zona costera del Pacífico colombiano. Ser. Publ. Espec., (17). Invemar, Santa Marta. 148 p. [ Links ]
Ridley, S.O. and A. Dendy. 1887. Report on the Monaxonida collected by H.M.S. 'Challenger' during the years 1873-1876. Report on the scientific results of the voyage of H.M.S. 'Challenger', 1873-1876. Zoology, 20(59): 1-275. [ Links ]
Row, R.W.H. 1911. Reports on the marine biology of the Sudanese Red Sea, from Collections made by Cyril Crossland, M. A., B.Sc., F.Z.S. XIX. Report on the Sponges collected by Mr. Cyril Crossland in 1904-5. Part II. Non-Calcarea. Zoology, 31(208): 287-400. https://doi.org/10.1111/j.1096.3642.1911.tb00461.x [ Links ]
Rützler, K. and K.P. Smith. 1993. The genus Terpios (Suberitidae) and new species in the "Lobiceps" complex. Sci. Mar., 57(4): 381-393. [ Links ]
Rützler, K., C. Piantoni, R.W.M. Van Soest, and M.C. Díaz. 2014. Diversity of sponges (Porífera) from cryptic habitats on the Belize barrier reef near Carrie Bow Cay. Zootaxa, 3805(1): 1-129. https://doi.org/10.11646/zootaza.3805.L1 [ Links ]
Schmidt, O. 1862. Die Spongien des adriatischen Meeres. Wilhelm Engelmann, Leipzig. 88 p. [ Links ]
Schmidt, O. 1870. Grundzüge einer Spongien-Fauna des atlantischen Gebietes. Wilhelm Engelmann, Leipzig. 88 p. [ Links ]
Schulze, F.E. 1877. Untersuchungen über den Bau und die Entwicklung der Spongien. Die Gattung Halisarca. Z. wiss. Zool., 28: 1-48. [ Links ]
Schulze, F.E. 1878. Untersuchungen über den Bau und die Entwicklung der Spongien. Vierte Mittheilung. Die Familie der Aplysinidae. Z. wiss. Zool., 30: 379-420. [ Links ]
Schuster, A, D. Erpenbeck, A. Pisera, J.N.A. Hooper, M. Bryce, and J. Fromont. 2015. Deceptive desmas: molecular phylogenetics suggests a new classification and uncovers convergent evolution of lithistid demosponges. PLoS ONE 10(1): e116038. https://doi.org/10.1371/journal.pone.0116038 [ Links ]
Silva, J.A. and S. Zea. 2017. New records of sponges of the genera Petrosia and Xestospongia (Demospongiae: Haplosclerida: Petrosiidae) from the Colombian Caribbean. Bol. Investig. Mar. Costeras, 46(1): 114-134. [ Links ]
Sollas, W.J. 1885. A classification of the sponges. Ann. Mag. Nat. Hist., 16(95): 1-395. https://doi.org/10.1080/00222938509459901 [ Links ]
Sollas, W.J. 1887. Sponges: 412-429. In: Black, A. (Ed.), Encyclopaedia Britannica. 9th edition, 22. [ Links ]
Sollas, W.J. 1888. Report on the Tetractinellida collected by H.M.S. Challenger, during the years 1873-1876. Report on the Scientific Results of the Voyage of H.M.S. Challenger, 1873-1876. Zoology, 25(63): 273-274. https://doi.org/10.5962/bhl.title.6513 [ Links ]
Thiele, J. 1905. Die kiesel-und hornschwämme der Sammlug plate. Zoologische Jahrbücher, Supplementun 6 (Fauna Chilensis III): 417-490. [ Links ]
Topsent, E. 1889. Quelques spongiaires du Banc de Campêche et de la Pointe-à-Pître. Mém. Soc. Zool. France, 2: 30-52. [ Links ]
Topsent, E. 1893. Nouvelle série de diagnoses d'éponges de Roscoff et de Banyuls. Arch. Zool. Exp. Gén., 10: 33-43. [ Links ]
Topsent, E. 1928. Spongiaires de l'Atlantique et de la Méditerranée provenant des croisières du Prince Albert ler de Monaco. Résultats des campagnes scientifiques accomplies par le Prince Albert I, Monaco, 74: 1-376. [ Links ]
Van Soest, R.W.M. 1994. Demospongiae distribution patterns. 213-223. En: Soest, R.W.M. van, T.M.G. Kempenn van, and J.C. Braekman. (Eds.) Sponges in time and space: biology, chemistry, paleontology. Balkema, Amsterdam. 515 p. [ Links ]
Van Soest, R.W.M. 2009. New sciophilous sponges from the Caribbean (Porifera: Demospongiae). Zootaxa, 2107: 1-40. https://doi.org/10.11646/zootaxa.2107.1.1 [ Links ]
Van Soest, R.W.M. 2017. Sponges of the Guyana shelf. Zootaxa, 4217: 1-225. https://doi.org/10.11646/zootaxa.4217.L1 [ Links ]
Van Soest, R.W.M. and E. Hajdu. 2000. New species of Desmanthus (Porifera, Demospongiae) with a discussion of its ordinal relationships. Zoosystema, 22(2): 299-312. [ Links ]
Van Soest, R.W.M., M.C. Díaz, and S.A. Pomponi. 1990. Phylogenetic classification of the Halichondrids (Porifera, Demospongiae). Beaufortia, 40(2): 15-62. [ Links ]
Van Soest, R.W.M., D. Erpenbeck, and B. Álvarez. 2002. Family Dictyonellidae Van Soest, Díaz and Pomponi, 1990. 773-786. In: Hooper, J.N.A., R.W.M. Van Soest, and P. Willenz (Eds.). Systema Porifera. A guide to the classification of sponges. Kluwer Academic/Plenum, Publishers: New York. 1100 p. https://doi.org/10.1007/978-1-4615-0747-5_83 [ Links ]
Van Soest, R.W.M., N. Boury-Esnault, J. Vacelet, M. Dohrmann, D. Erpenbeck, N.J. De Voogd, N. Santodomingo, B. Vanhoorne, M. Kelly, and J.N.A. Hooper. 2012. Global diversity of sponges (Porifera). PLoS ONE, 7(4): e35105. doi:10.1371/journal.pone.0035105 [ Links ]
Van Soest, R.W.M., N. Boury-Esnault, J.N.A. Hooper, K. Rützler, N.J. de Voogd, B. Álvarez, E. Hajdu, A.B. Pisera, R. Manconi, C. Schönberg, M. Klautau, B. Picton, M. Kelly, J. Vacelet, M. Dohrmann, M.C. Díaz, P. Cárdenas, J.L. Carballo, P. Ríos, and R. Downey. 2018. World Porifera database. http://www.marinespecies.org/porifera14/09/2018. [ Links ]
Vega, C. 2012. Composición y afinidades biogeográficas de esponjas (Demospongiae) asociadas a comunidades coralinas del Pacífico mexicano. Tesis Ph.D. Ciencias Mar. Inst. Politéc. Nal. La Paz, México. 253 p. [ Links ]
Velandia, M.C. y J.M Díaz. 2016. Atlas marino-costero del Pacífico norte colombiano. Fundación Marviva, Bogotá. 130 p. [ Links ]
Veron, J.E.N. 1995. Corals in space and time. The biogeography and evolution of the Scleractinia. xiii +. UNSW press, Sydney. 321 p. https://doi.org/10.1017/S0016756800008050 [ Links ]
Vosmaer, G.C.J. and J.H. Vernhout. 1902. The Porifera of the Siboga Expedition I. The Genus Placospongia. In: Siboga Expedites, 6(a): 1-17. [ Links ]
Wang, C., C. Deser, J.Y. Yu, P. DiNezio, and A. Clement. 2017. El Niño and Southern Oscillation (ENSO): A review. 84-106. In: Glynn, P.W., D.P. Manzanello, and I.C. Enochs. (Eds.). Coral reefs of the Eastern Tropical Pacific. Springer: Dordrecht. https://hdl.handle.net/10.1007/978-94-017-7499-4 [ Links ]
Wiedenmayer, F. 1977. Shallow-water sponges of the western Bahamas. Experientia Suppl., 28: 1-287. https://doi.org/10.1007/978-3-0348-5797-0 [ Links ]
Worheide, G., A. Cava, and J.N.A. Hooper. 2005. Biodiversity, molecular ecology and phylogeography of marine sponges: patterns, implications and outlooks. Integr. Comp. Biol., 45: 377-385. https://doi.org/10.1093/icb/45.2.377 [ Links ]
Wulff, J.L. 1996. Do the same sponge species live on both the Caribbean and Eastern Pacific sides of the Isthmus of Panama? Bull. Inst. Royal Sci. Nat. Belgique, 66: 165-173. [ Links ]
Wulff, J.L. 1997. Causes and consequences of differences in sponges diversity and abundance between the Caribbean and Eastern Pacific at Panamá. 1377-1382. In: H.A. Lessios and I.G. Macintyre. (Eds.). Proc. 8th Internat. Coral Reef Symp. Vol. 2. Smithsonian Tropical Research Institute, Panama. [ Links ]
Zea, S. 1987. Esponjas del Caribe colombiano. Catalogo Científico, Bogotá. 286 p. [ Links ]
Zea, S. 1998. Estado actual del conocimiento de sistemática de esponjas marinas (Porifera) del Caribe colombiano. Bol. Ecotrópica, 33: 45-59. [ Links ]
Zea, S., T.P. Henkel, and J.R. Pawlik. 2014. The sponge guide: a picture guide to Caribbean sponges. 3rd edition. www.spongeguide.org 08/05/2018. [ Links ]
Recibido: 26 de Junio de 2019; Aprobado: 11 de Septiembre de 2020











 texto em
texto em 







