Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 supl.1 Santa Marta Dec. 2020 Epub Sep 03, 2021
https://doi.org/10.25268/bimc.invemar.2020.49.suplesp.1061
Artículos de Investigación
Tasas de crecimiento somático de tortuga carey, Eretmochelys imbricata, en el Parque Nacional Natural Gorgona, Colombia, entre 2004 y 2018
1Grupo Herpetológico de Antioquia (GHA), Instituto de Biología, Universidad de Antioquia, Medellín, Colombia, vivianpaez1@gmail.com
2Parques Nacionales Naturales de Colombia, Cali, Colombia. estacioncientificagorgona@gmail.com
3Centro de Investigación para el Manejo Ambiental y el Desarrollo (CIMAD). amorocho.diego@gmail.com
4Grupo Herpetológico de Antioquia (GHA), Instituto de Biología, Universidad de Antioquia, Medellín, Colombia.
The Hawksbill Turtle, Eretmochelys imbricata, is globally assessed as Critically Endangered, and information in the Eastern Pacific Ocean is limited. For this reason, this investigation evaluated the somatic growth rates in an immature hawksbill sea turtle aggregation using capture-mark-recapture on the coral reefs at Playa Blanca and La Azufrada in the Gorgona Natural National Park, Colombia. Between 2004 and 2018, we made 89 captures of 49 hawksbill individuals. The mean curved carapace length (CCL) obtained was 41.6 cm (range 32-58 cm), and the mean straight-line carapace length (SCL) was 39.1 cm (range 30.0-54.1 cm), showing these reefs to be critical foraging grounds for immature individuals. The mean body condition index was 1.3 (range 1.0-1.5), suggesting that environmental conditions maintain the health of this aggregation in good conditions. Using the von Bertalanffy growth model and establishing a maximum length (L∞) of 63 cm of CCL (where the lowest coefficient of variation is obtained), we estimated a k of 0.081 and an average annual growth rate of 1.5 ± 1.8 cm/year. This indicated that individuals in this aggregation reach a CCL of 63 cm at 33-34 years of age, close to the sexual maturity for the tropical eastern Pacific region (approximately 66 cm CCL). This indicates the vulnerability of this species due to its late maturity and slow growth. Because of this, conservation efforts for this species must be long-term to ensure its recovery, since species with these characteristics tend to express very low population growth rates.
KEY WORDS: sea turtle; Cheloniidae; Tropical Eastern Pacific; body condition index; foraging areas.
La tortuga carey, Eretmochelys imbricata, se encuentra a nivel global en peligro crítico de extinción, y la información demográfica en el Océano Pacífico Oriental es limitada. Por esta razón, esta investigación evalúa las tasas de crecimiento somático en una agregación de individuos inmaduros de tortuga carey empleando el método de captura-marca-recaptura en los arrecifes coralinos de Playa Blanca y la Azufrada en el Parque Nacional Natural Gorgona, Colombia. Entre 2004 y 2018 se realizaron 89 capturas de 49 individuos de tortuga carey. El largo curvo del caparazón promedio (LCC) obtenido fue de 41,6 cm (rango 32-58 cm) y el largo recto del caparazón promedio (LRC) fue de 39,1 cm (rango 30,0-54,1 cm), lo que muestra que estos arrecifes son áreas de forrajeo importantes para individuos inmaduros de esta especie. El índice de condición corporal promedio fue de 1,3 (rango 1,0-1,5). Esto sugiere que las condiciones ambientales mantienen en buen estado la salud de esta agregación. Usando el modelo de crecimiento de von Bertalanffy y estableciendo una talla máxima (L∞) de 63 cm de LCC (donde se obtiene el menor coeficiente de variación), se estimó una k de 0,081 y una tasa anual de crecimiento promedio de 1,5 ± 1,8 cm/año. Esto indica que los individuos en esta agregación estarían alcanzando una LCC de 63 cm entre los 33 y 34 años, talla cercana a la de madurez sexual en la región del Pacífico oriental (aproximadamente 66 cm LCC). Lo anterior ratifica la vulnerabilidad de esta especie debido a las lentas tasas de crecimiento somático y madurez sexual tardía. Se sugiere que los esfuerzos de conservación para esta especie deben ser a largo plazo para procurar su recuperación, en vista de que especies con estas características tienden a expresar tasas de crecimiento poblacional muy bajas.
PALABRAS CLAVE: tortugas marinas; Cheloniidae; Pacífico Oriental Tropical; índice de condición corporal; áreas de forrajeo.
INTRODUCCIÓN
La tortuga carey, Eretmochelys imbricata, se encuentra clasificada a nivel global en Peligro Crítico (CR A2bd; Mortimer y Donnelly, 2008), ya que se ha evidenciado una reducción de más de 80 % de sus poblaciones en las últimas tres generaciones (UICN, 2012). Esta reducción se debe principalmente al uso de su caparazón en la elaboración de joyas y artesanías, al consumo de su carne y sus huevos y a la pérdida de hábitats de forrajeo y de anidación (National Research Council, 1990; Llamas et al., 2017). Hasta hace una década se creía que la especie había sido eliminada de la región del Océano Pacífico Oriental (OPO; Campbell, 2014), pero recientemente se han encontrado hábitats de forrajeo y playas de anidación en esta región (Altamirano et al., 2010; Gaos et al., 2012; Campbell, 2014; Chacón-Chaverri et al., 2015; Llamas et al., 2017).
El ciclo de vida de las tortugas carey luego de nacer las crías y entrar al mar comienza en hábitats oceánicos. Al alcanzar la etapa juvenil, los individuos migran a hábitats de forrajeo neríticos (Lutz y Musick, 1997) donde se encuentran principalmente asociados a arrecifes coralinos y otros fondos duros, como consecuencia de sus requerimientos de hábitat y alimento (Bjorndal y Bolten, 2010). Allí, aparentemente, permanecen como residentes durante un periodo prolongado de tiempo y las condiciones locales determinan su supervivencia (Blumenthal et al., 2009). Se ha documentado que los individuos inmaduros tienen una talla de reclutamiento en hábitats neríticos de entre 20 a 35 cm de Longitud Curva del Caparazón (LCC; Lutz y Musick, 1997; Blumenthal et al., 2009; Bjorndal y Bolten, 2010). Al alcanzar la madurez sexual, se desplazan a otras áreas de forrajeo y reproducción (Lutz y Musick, 1997) donde se encuentran asociadas a arrecifes coralinos y a estuarios de manglar (Lutz y Musick, 1997; Chacón-Chaverri et al., 2015; Gaos et al., 2017). La madurez sexual en el OPO se ha determinado con la talla mínima registrada para hembras anidantes en El Salvador y Nicaragua, de 66 cm de LCC (Altamirano et al., 2010; Chacón-Chaverri et al., 2015). En el Caribe (Puerto Rico) se identificaron machos adultos con una Longitud Recta del Caparazón (LRC) mayor a 68 cm (Diez y van Dam, 2002).
Debido a que se ha observado la permanencia de las tortugas carey juveniles a las áreas de forrajeo durante periodos prolongados (Blumenthal et al., 2009; Carrión-Cortez et al., 2013; Wood et al., 2013; Llamas et al., 2017) y estas áreas son vulnerables a contaminación y cambios climáticos (Muñoz y Zapata, 2013), es importante diagnosticar el estado físico de los animales con el fin de evaluar la dinámica en la salud de estas poblaciones. Para esto, se utiliza con frecuencia el índice de condición corporal (ICC), el cual tiene un poder predictivo significativo en modelos de crecimiento somático de la tortuga verde (Chelonia mydas) y también ha sido usado en estudios de calidad del hábitat en tortugas carey (Bjorndal y Bolten, 2010). Algunos promedios de los valores de ICC registrados para estas tortugas en el Caribe, en donde se ha evidenciado que los individuos se encuentran en buen estado físico, varían entre 1,16 en el acantilado Mona (Diez y van Dam, 2002) hasta 1,25 ± 0,17 en Little Cayman (Blumenthal et al., 2009), mientras que este índice no ha sido registrado en el OPO.
Por otra parte, cuantificar las tasas de crecimiento corporal de los individuos permite estimar el tiempo que les toma alcanzar la talla y/o la edad mínima de madurez sexual, la cual es un atributo fundamental para comprender sus historias de vida y el potencial de crecimiento poblacional, así como para desarrollar estrategias de manejo (van Dam, 2000; Bell y Pike, 2012). En estudios realizados en la Gran Barrera de Arrecifes (GBR) en Australia se ha observado un patrón en las tasas de crecimiento que sugiere un ajuste al modelo de von Bertalanffy para tortugas carey (Chaloupka y Limpus, 1997; Bell y Pike, 2012). En la población de tortuga carey en Hawái se evidenció que el modelo de von Bertalanffy se ajustaba mejor a los datos: se estimó un coeficiente de crecimiento característico (k) de 0,09 y una tasa de crecimiento corporal anual para individuos inmaduros de 4,59 cm/año (SD = 2,04) por medio de esqueletocronología (Snover et al., 2012). Este modelo de crecimiento usualmente se ajusta mejor a los datos de crecimiento corporal en tortugas, en las cuales frecuentemente las tasas de crecimiento de los juveniles son mayores que en adultos, y permite proyectar cuánto tiempo tardan los individuos en llegar a la madurez sexual (Bjorndal y Zug, 1995).
La mayoría de los estudios sobre crecimiento para la tortuga carey no utilizan el modelo de crecimiento de von Bertalanffy, sino que registran la tasa de crecimiento corporal (TCC). En estos estudios se observa una gran variación espacial en las TCC estimadas para diferentes categorías de talla y sexo, en diferentes regiones del Pacífico oriental, occidental y del Caribe (Limpus, 1992; Boulon, 1994; Chaloupka y Limpus, 1997; Diez y van Dam, 2002; Blumenthal et al., 2009; Bell y Pike, 2012; Wood et al., 2013; Zárate, 2015; Bjorndal et al., 2016; Llamas et al., 2017). Adicionalmente, en la región del Pacífico, Bjorndal y Bolten (2010) evidenciaron que las tortugas carey tienen tasas de crecimiento monotónicas y relativamente lentas, lo cual quiere decir que la tasa de crecimiento va aumentando en el mismo grado de variación, sin tener picos máximos, mientras que Diez y van Dam (2002) evidenciaron un patrón no monotónico en la región Caribe, con tasas de crecimiento más bajas en individuos pequeños y un pico de crecimiento mayor en categorías de talla entre los 30 y 40 cm de LRC.
El OPO es considerado como una de las Unidades de Manejo Regional de mayor amenaza para la tortuga carey y no se tiene aún conocimiento sobre algunos parámetros demográficos fundamentales para evaluar planes de manejo de la especie en esta región (Wallace et al., 2011). Por ello, en esta investigación se evaluaron algunos de estos parámetros, como son la proporción de diferentes categorías de talla, el ICC y la tasa de crecimiento somático, para la agregación de tortuga carey en los arrecifes coralinos Playa Blanca y La Azufrada del Parque Natural Nacional Gorgona (PNNG) Colombia, por medio de datos obtenidos a través del método de captura-marca-recaptura entre 2004 y 2018. Esta información contribuye al mejoramiento del monitoreo de tortugas marinas realizado en el PNNG y aporta nuevo conocimiento sobre la especie en el OPO, lo que, a su vez, genera información esencial para los planes de conservación y de manejo en la región.
ÁREA DE ESTUDIO
El muestreo fue ejecutado en el PNNG (02° 55′ 45″-03° 00′ 55″ N y 78° 09′ 00″-78° 14′ 30″ W), ubicado en el departamento del Cauca, en el océano Pacífico, al suroccidente de Colombia (Amorocho et al., 2015), en dos arrecifes de borde bien desarrollados: Playa Blanca y La Azufrada, ubicados al costado oriental (sotavento) de la isla (Figura 1). Los dos arrecifes poseen en general una estructura y una zonación similares (Muñoz y Zapata, 2013). Playa Blanca tiene un área de 9,9 ha, 930 m de largo y entre 60 y 230 m de ancho, mientras que La Azufrada tiene un área de 11,2 ha, 780 m de largo y entre 80 y 180 m de ancho, ambos con profundidades que no exceden 10 m en marea alta (Muñoz y Zapata, 2013).
MATERIALES Y MÉTODOS
Captura-marca-recaptura
La toma de datos para este análisis inició en 2004 con el apoyo del CIMAD (Centro de Investigación para el Manejo Ambiental y el Desarrollo) y el WWF-Colombia (Fondo Mundial para la Naturaleza) y desde 2008 hasta 2018 del PNNG (Amorocho et al., 2015). Estos episodios no fueron sistemáticos, ya que no se definió un transecto, una periodicidad, ni un tiempo específico para las búsquedas, ni se tiene registro de los eventos de muestreo sin individuos capturados.
En ambos arrecifes, el personal encargado del monitoreo realizó la búsqueda de los individuos a pulmón (apnea). Cada episodio de búsqueda duró entre 20 y 50 min y en su mayoría se realizaron entre 20:00 y 21:00 h, periodo durante el cual las tortugas descansan, lo cual facilita su captura. Todos los individuos fueron medidos, pesados, marcados y liberados en la playa El Poblado, ubicada a una distancia aproximada de 3305 y 1407 m de los arrecifes de Playa Blanca y La Azufrada, respectivamente. Las medidas morfométricas tomadas fueron LRC y LCC, desde el escudo nucal hasta el punto medio de la muesca posterior entre los escudos supracaudales (Bolten, 2000). Las medidas rectas se tomaron con la ayuda de una forcípula (con una precisión de 0,1 cm), las medidas curvas con una cinta métrica flexible (con una precisión de 0,1 cm) y el peso con una balanza romana marca Continental (con una precisión de 0,5 kg). Cada individuo fue marcado con una placa metálica (Monel o Inconel, n.° 681) en la segunda escama de la aleta anterior, previamente desinfectada con yodopovidona (Balazs, 2000).
Análisis de datos
Se agruparon las tortugas por categorías de talla, determinadas arbitrariamente de la siguiente manera: categoría 1 (30 cm < LCC < 34,9 cm), categoría 2 (35 cm < LCC < 39,9 cm), categoría 3 (40 cm < LCC < 44,9 cm), categoría 4 (45 cm < LCC < 49,9 cm) y categoría 5 (LCC ≥ 50 cm). La caracterización de la estructura poblacional para cada arrecife se halló con la proporción de tortugas presentes en cada categoría de talla. Para determinar si se presentaba alguna diferencia en estas proporciones entre arrecifes, se realizó una prueba exacta de Fisher (1934). El ICC se calculó con el peso y la LRC por medio de la siguiente ecuación (Bjorndal y Bolten, 2010):
Se calculó el crecimiento somático por medio del modelo de von Bertalanffy para la agregación de tortugas carey de ambos arrecifes, con las medidas de LCC de la primera y la última captura porque estas son usadas con mayor frecuencia en estudios de tortugas marinas, lo cual facilita la comparación con otros trabajos. Para calcular el coeficiente característico de crecimiento corporal (k), el cual describe cuán rápido crece un animal desde su nacimiento hasta su máxima longitud, se usó la siguiente ecuación (Munro, 1982):
donde:
L∞ es la longitud máxima que pueden alcanzar los individuos de la población (en este caso, se calculó para longitudes entre 60 y 66 cm),
Lm es la longitud curva del caparazón (LCC) en la primera captura,
Lr es la LCC en la última recaptura,
r y m son las fechas de la última recaptura y primera captura, respectivamente, y
e es la base del logaritmo natural.
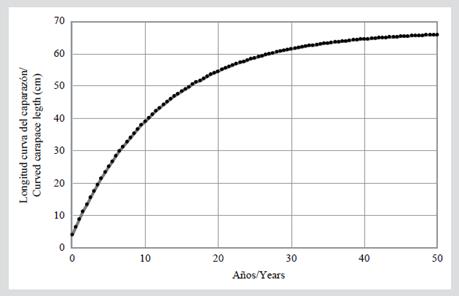
Este coeficiente se calculó para todos los individuos recapturados. A partir de estos datos, se calculó su promedio y el coeficiente de variación (CV). Posteriormente, por medio del modelo de von Bertalanffy, se estimó la longitud correspondiente a cada año de vida de los individuos en esta población (Lt), desde el año 0, en el que el individuo mide aproximadamente 4 cm LCC (Altamirano et al., 2010), hasta alcanzar la longitud máxima. En este estudio se fijó una longitud máxima de 63 cm LCC porque a este tamaño se obtuvo el menor CV y porque es un valor cercano a 66 cm de LCC, la talla mínima de madurez sexual registrada para las hembras en el OPO (Altamirano et al., 2010). Con estos valores se estimó el tiempo en años que tardarían los individuos de la población monitoreada en el PNNG en alcanzar la talla mínima de madurez.
Donde:
t0 es el tiempo de la eclosión, y
Talla promedio al nacer = 4 cm
Además, se calculó la tasa de crecimiento corporal (TCC), siendo esta la diferencia entre la longitud de la última captura (Lr) y la primera (Lm) sobre el tiempo (TCC = (Lr − Lm)/año; Lutz y Musick, 1997).
RESULTADOS
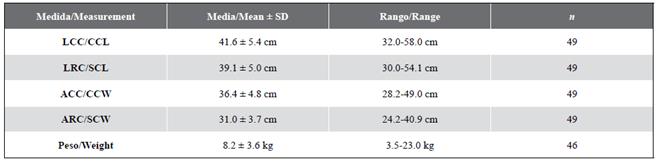
Desde 2004 hasta 2018 se realizaron 66 episodios de búsqueda nocturnos exitosos (al menos un individuo capturado), 44 en el arrecife Playa Blanca y 22 en La Azufrada. Se capturaron 49 individuos de tortuga carey, de los cuales se recapturaron 19 (38,8 %) al menos dos veces (nueve individuos fueron capturados dos veces, seis individuos tres veces, dos individuos cuatro veces, un individuo cinco veces y un individuo diez veces). Durante las inmersiones, se observaron las tortugas principalmente descansando (81,0 %), explorando (15,2 %) y en menor proporción alimentándose (3,8 %). Además, todas las recapturas (menos un individuo) se presentaron siempre en el mismo arrecife. Los promedios y desviaciones estándar de las medidas morfométricas en la primera captura se pueden observar en la Tabla 1.
Tabla 1 Promedio y rango de medidas morfométricas tomadas en la primera captura de tortugas carey, Eretmochelys imbricata, en el PNNG.
En la Tabla 2 se pueden observar las medidas para cada una de las cinco categorías de talla en cada arrecife. Ya que los individuos no superan los 66 cm de LCC, son considerados inmaduros; además, ninguno de los individuos capturados exhibió características sexuales secundarias evidentes, como una mayor longitud de cola en machos (Bolten, 2000). La categoría con una mayor proporción de individuos fue la 2 (LCC entre 35 y 39,9 cm) con 32,7 %, seguida por la 3 (LCC entre 40 y 44,5 cm) con 30,6 % (Figura 2). La categoría 1 (entre 30 y 34,9 cm LCC) representó 12,2 % de la población y la 5 (LCC ≥ 50 cm) tal solo 8,2 % de la población. De los 49 individuos capturados, 19 estaban en el arrecife La Azufrada y 30 en Playa Blanca. En La Azufrada se observa un mayor porcentaje de individuos en la categoría 2 mientras que en Playa Blanca un mayor porcentaje de individuos en la 3, como se puede observar en la Figura 3. No se encontró una diferencia significativa en las proporciones de categorías entre los arrecifes (prueba exacta de Fisher: P = 0,314). El ICC promedio (10-4 kg/cm3) de las capturas realizadas en ambos arrecifes fue de 1,3 ± 0,11 (n = 46, rango 1,0-1,5).
Tabla 2 Promedio de las medidas morfométricas de las tortugas carey, Eretmochelys imbricata, capturadas entre 2004 y 2018 para cada categoría de talla y arrecife coralino. LCC: longitud curva del caparazón. LRC: longitud recta del caparazón. SD: desviación estándar. * Se hallaron dos outliers en las medidas de peso, uno en La Azufrada en la categoría 3 y otro en Playa Blanca en la categoría 2.
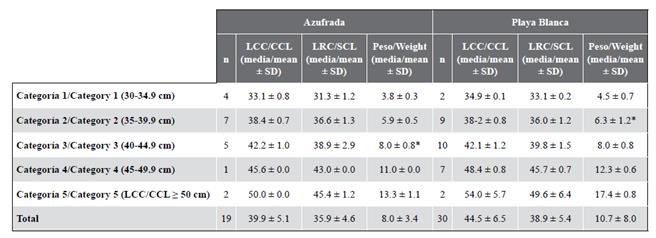

Figura 2 Porcentaje de individuos de tortugas carey, Eretmochelys imbricata, capturados en cada categoría de talla (LCC) en ambos arrecifes del PNNG entre 2004 y 2018.
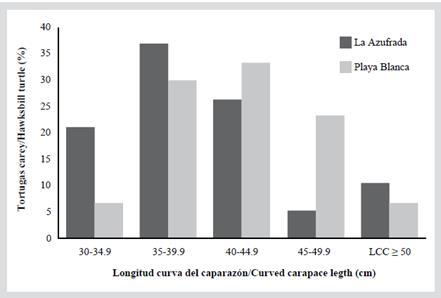
Figura 3 Porcentaje de individuos de tortugas carey, Eretmochelys imbricata, capturados por primera vez en cada categoría de talla (LCC) en cada arrecife coralino del PNNG entre 2004 y 2018.
En el análisis de crecimiento somático, el menor CV se obtuvo con una longitud máxima de 63 cm LCC (CV= 0,96), y arrojó un promedio de coeficiente característico de crecimiento corporal (k) de 0,081. La curva de crecimiento de von Bertalanffy indicó que los individuos en esta población alcanzarían esta talla entre los 33 y 34 años de edad (Figura 4). Además, se estimó una TCC anual de 1,5 ± 1,8 cm/año (rango 0-7,3 cm/año).
DISCUSIÓN
Las tortugas carey halladas en este estudio son inmaduras debido a que no superan los 66 cm LCC, longitud mínima descrita para hembras reproductivas en el OPO (Witzell, 1983; Altamirano et al., 2010; Chacón-Chaverri et al., 2015) ni la registrada para machos (LRC > 68 cm, Diez y van Dam, 2002). El rango de longitud curva del caparazón documentado (32-60 cm) es similar al que se encontró en otras áreas de forrajeo en el Pacífico, como el Parque Nacional Coiba, Panamá (Tabla 3; Llamas et al., 2017) y Golfo Dulce, Costa Rica (34,8 y 81,1 cm de LCC; Chacón-Chaverri et al., 2015). Adicionalmente, la distribución de categorías de talla (32,7 % entre 35 y 39,9 cm LCC) fue similar a la hallada por Llamas et al. (2017) en Panamá y al anterior estudio realizado en el PNNG por Tobón-López y Amorocho (2014) . No se encontró una diferencia estadísticamente significativa en las proporciones de categorías entre ambos arrecifes, lo que indica que la talla de las tortugas carey es independiente del arrecife. El hecho de haber capturado cuatro individuos pequeños (categoría 1 entre 30 y 34,9 cm LCC) sin marcar entre 2014 y 2018 podría estar indicando el reclutamiento continuo de nuevos individuos a esta zona de forrajeo. Todo esto nos sugiere que los arrecifes del PNNG proveen un hábitat de desarrollo y forrajeo importante para esta especie, y que la ausencia de individuos adultos insinúa una migración a otras áreas de reproducción y forrajeo al transitar de inmaduros a adultos durante su desarrollo, como lo sugieren Tobón-López y Amorocho (2014).
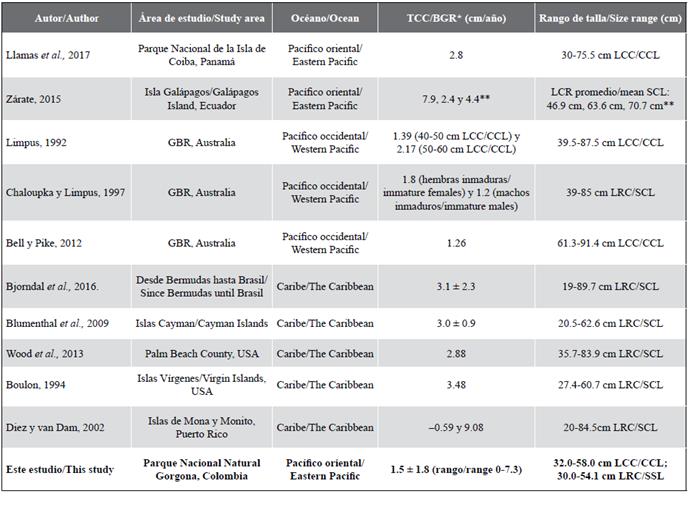
Tabla 3 Tasas de crecimiento corporal anual estimadas para diferentes poblaciones de Eretmochelys imbricata en diferentes regiones. *En algunos estudios se especifica la tasa de crecimiento por categoría de talla y por eso aparecen dos valores. Algunos estudios registran desviación estándar y otros no. **En este estudio fueron recapturados tres individuos.
Dado que 98 % de los individuos marcados y liberados en la playa de El Poblado fueron recapturados en el mismo arrecife, se insinúa la fidelidad de las tortugas carey a cada arrecife del PNNG, como lo mencionan Tobón-López y Amorocho (2014), y se evidencia la residencia a largo plazo de algunos individuos (recaptura de un individuo después de 10 años). La fidelidad de las tortugas carey a las áreas de forrajeo ha sido documentada en otros estudios (Carrión-Cortez et al., 2013; Wood et al., 2013; Llamas et al., 2017). Solo se observó un caso en el que el individuo fue capturado cuatro veces durante el año 2011 en ambos arrecifes. Esto pudo deberse a la conectividad entre los dos arrecifes, ya que se ubican relativamente cerca. Por otra parte, no se encontraron individuos marcados previamente en otras áreas de forrajeo ni tortugas marcadas en el PNNG en otras áreas de forrajeo o de anidación en países vecinos donde se ha realizado marcaje y monitoreo (Altamirano et al., 2010; Liles et al., 2011; Carrión-Cortez et al., 2013; Heidemeyer et al., 2014; Chacón-Chaverri et al., 2015; Llamas et al., 2017). Lo anterior advierte sobre la importancia de proteger el área de forrajeo para esta agregación y sugiere que se debe continuar con el monitoreo en el OPO para lograr identificar rutas de migración y complementar los planes de conservación regionales de la población de tortugas carey.
El ICC (1,3 ± 0,11) indica que la agregación de tortuga carey presente en esta área protegida se encuentra en buen estado físico y de salud, ya que es ligeramente superior a los índices estimados en la región del Caribe, como en Little Cayman (1,25 ± 0,17) y Grand Cayman (1,24 ± 0,18; Blumenthal et al., 2009); en el arrecife Mona (1,18), el acantilado Mona (1,16) y el acantilado Monito (1,24) en Puerto Rico (Diez y van Dam, 2002), y en la reserva Union Creek (1,17 ± 0,08), en Bahamas (Bjorndal y Bolten, 2010), donde se registra un buen estado de las tortugas carey. A pesar de que la región del OPO se encuentra fuertemente influenciada por el desplazamiento latitudinal de la Zona de Convergencia Intertropical (ZCIT) y el fenómeno de El Niño, los cuales influyen en las condiciones climáticas y oceanográficas del PNNG (Zapata, 2017), que podría tener efectos en la disponibilidad de alimento, el ICC indica que la población permanece saludable y no tiene déficit de alimentos. Por otra parte, aunque una de las mayores perturbaciones físicas en los arrecifes del PNNG son las repetidas exposiciones aéreas durante las mareas bajas extremas, las cuales disminuyeron considerablemente la cobertura de coral vivo entre 1998 y 2008, esta cobertura coralina se ha recuperado (Zapata, 2017), lo que indica que este fenómeno no debe afectar el desarrollo de las tortugas carey en esta área de forrajeo. El ICC sugiere que las condiciones ambientales que se presentan en los arrecifes del PNNG son ideales para mantener en buen estado la salud de esta agregación de tortugas, lo cual reafirma que esta es un área de forrajeo importante para la conservación de la especie en la región del OPO.
El coeficiente característico de crecimiento corporal (k) estimado en este estudio (0,081) es comparable con el valor encontrado (0,09) por Snover et al. (2012) para tortugas carey en Hawái por medio de esqueletocronología, donde se sugiere que las tortugas de esa población alcanzarán la madurez sexual con una LRC de 78,6 cm entre los 17 y 22 años de edad. En otros estudios realizados con tortugas marinas utilizando el modelo de von Bertalanffy, se han registrado para Chelonia mydas valores de k entre 0,021 (costa atlántica de EE. UU; Goshe et al., 2010) y 0,21 (bahía San Diego, CA, EE. UU.; Eguchi et al., 2012); para Caretta caretta valores de k entre 0,044 (costa atlántica de Florida; Bjorndal et al., 2001) y 0,769 (costas de Italia; Casale et al., 2009), y para Lepidochelys kempii valores de k entre 0,115 (costa atlántica de Florida) y 0,25 (golfo de México; Avens et al., 2017). Con el valor de k que se estimó en este estudio por medio de la curva de von Bertalanffy, los individuos de esta agregación podrían tardar alrededor de 33-34 años en alcanzar una LCC de 63 cm (Figura 4), cerca de la talla mínima de madurez para las hembras registrada para el OPO (Witzell, 1983; Altamirano et al. 2010; Chacón-Chaverri et al., 2015). Esta estimación es mayor a la registrada para las tortugas carey en Hawái por Snover et al. (2012), pero comparable a la de Bjorndal y Zug (1995) y Bell y Pike (2012) en el norte de la GBR (Australia), la cual se estimó entre 30 y 40 años. Esto nos indica que la tasa de crecimiento somático de los individuos capturados en el PNNG está dentro de los rangos estimados para otras poblaciones de esta especie. Por otra parte, en este estudio se halló una TCC de 1,5 cm/año (rango 0-7,3 cm/año), la cual es menor a la tasa promedio de las demás tasas estimadas en otras regiones del Pacífico oriental, occidental y del Caribe (Tabla 3). Sin embargo, el rango en la TCC (0-7,3 cm/año) está dentro del observado en el Atlántico occidental (-2,1-22,6 cm/año; Bjorndal et al., 2016).
Las bajas tasas de crecimiento somático en la tortuga carey en comparación con las de otras tortugas marinas como C. caretta y L. olivácea pueden estar asociadas a una gran variedad de factores, tanto intrínsecos del individuo (coevolución con otros atributos de su historia de vida, restricciones filogenéticas, variabilidad genética, entre otros) como extrínsecos (temperatura, alimentación), que afectan el crecimiento en tortugas marinas (Sterns, 1992; Diez y van Dam, 2002; Bell y Pike, 2012). Debido a que el ICC sugiere que esta agregación se encuentra en un área de forrajeo adecuada para el buen desarrollo de la tortugas carey, el PNNG fue declarado área marina protegida desde 1984 y los arrecifes Playa Blanca y La Azufrada han permanecido cerrados al público no científico durante los últimos años, ya que son considerados Valores Objeto de Conservación. La principal causa de estas tasas de crecimiento somático lentas es su tipo de historia de vida, ya que las tortugas marinas en general y E. imbricata en particular, se caracterizan por tener una edad de madurez sexual tardía y una expectativa de vida larga bajo condiciones naturales (Sterns, 1992; Lutz y Musick, 1997). Como una edad de madurez sexual tardía se correlaciona con tasas lentas de crecimiento poblacional (Doak et al., 1994) y tasas altas de sobrevivencia anual de los subadultos y adultos (Heppell et al., 1996; Heppell, 1998; Jonsson y Ebenman, 2001), una reducción sostenida en el valor de las tasas de sobrevivencia de estas dos clases puede conducir a la extinción local o global de la especie (Musick, 1999).
Debido a que el OPO es considerado como una de las Unidades de Manejo Regional con mayor amenaza para las tortugas carey, este necesita atención inmediata tanto en la reducción de las amenazas como en el incremento de los monitoreos para evaluaciones más rigurosas sobre sus riesgos y amenazas (Wallace et al., 2011). Para evidenciar si la población está en riesgo y fortalecer los planes de manejo es necesario conocer el estado demográfico de las poblaciones de tortugas marinas en las áreas de forrajeo por medio de la documentación de la dinámica con parámetros como abundancia y supervivencia (Bjorndal, 2000), los cuales son desconocidos para las poblaciones de tortuga carey en el OPO. En vista de que uno de los autores de este trabajo (LFP) estima que en al menos 20 % de los episodios de búsqueda no se encontraron individuos, no se pudo utilizar el programa Mark para estimar estos parámetros, ya que estos datos no se encuentran en las bases de datos. Por esto, se recomienda que el monitoreo de esta especie se ejecute de forma sistemática (esfuerzos de tiempo y áreas de búsqueda consistentes entre años) y que los eventos de muestreo no exitosos (sin individuos capturados) sean registrados en dichas bases de datos. Con esta metodología, será posible estimar la probabilidad de supervivencia anual, la detectabilidad y la abundancia absoluta de la agregación de tortuga carey en los arrecifes coralinos de Playa Blanca y La Azufrada del Parque Natural Nacional Gorgona (PNNG).
CONCLUSIONES
Este estudio contribuye al conocimiento de características demográficas de la agregación de tortuga carey que habita dos arrecifes coralinos en el área protegida del PNNG en el OPO al presentar información necesaria para la conservación y el manejo de la especie en la región. Se evidencia que los arrecifes coralinos del PNNG son de gran valor como área de forrajeo para esta especie, ya que pueden mantener agregaciones productivas y saludables de tortugas carey basados en el índice de condición corporal, el cual se encuentra cerca de índices encontrados en agregaciones en el Caribe. Además, se observa la fidelidad de estos individuos a los arrecifes coralinos del PNNG y su permanencia en largos periodos durante su desarrollo. Esto pone en evidencia que estos hábitats son críticos para el desarrollo de las tortugas carey juveniles del Pacífico colombiano. Como pasan gran parte de sus vidas en hábitats neríticos, principalmente en arrecifes coralinos, y los esfuerzos centrados únicamente en playas de anidación pueden ser insuficientes (Lutz y Musick, 1997; Gaos et al., 2017; Llamas et al., 2017; Wildermann et al., 2018), se debe promover la protección de fuentes de mortalidad antropogénica como pesca incidental o choques con botes en la pesquería alrededor de esta región para la recuperación de la población.
Por otra parte, un componente clave para la evaluación de la viabilidad de las poblaciones es el conocimiento sobre su edad de madurez para establecer plazos de recuperación razonables en los planes de manejo. Este estudio presenta datos que evidencian la vulnerabilidad de esta especie debido a la madurez tardía y al crecimiento lento en esta agregación de tortugas marinas en el OPO, lo cual indica que los esfuerzos de conservación para esta especie deben ser a largo plazo para procurar su recuperación. Debido a que esta agregación se compone de individuos inmaduros y no se tienen datos de crecimiento para categorías de talla menores a 30 cm o superiores a 60 cm de LRC, esta extrapolación de crecimiento hasta la madurez debe interpretarse con cautela. Estudios con tortugas de agua dulce con edad conocida, por ejemplo, revelan que la remoción de individuos pequeños en los análisis genera cambios en la asíntota de la curva de crecimiento, lo cual también modifica la estimación de la edad de madurez (Bjorndal y Zug, 1995). La aproximación que se presenta en este estudio sobre la edad de madurez de las tortugas carey en el PNNG es importante como línea base para comparaciones futuras y, asimismo, para fortalecer los planes de manejo de la especie en el OPO.
AGRADECIMIENTOS
Los autores agradecen al personal del Parque Nacional Natural Gorgona (PNNG) por realizar el monitoreo de tortugas marinas durante estos años, especialmente a Héctor Chirimía y a Ximena Zorrilla. Al Centro de Investigación para el Manejo Ambiental y el Desarrollo (CIMAD) y al Fondo Mundial para la Naturaleza (WWF-Colombia). Al Grupo Herpetológico de Antioquia y a la Universidad de Antioquia, especialmente a Brian C. Bock.
REFERENCIAS
Altamirano, E.J. 2010. Informe final de proyecto de conservación de tortuga carey (Eretmochelys imbricata) en la RN Estero Padre Ramos, temporada 2010. Nicaragua: Flora y Fauna Internacional. [ Links ]
Amorocho, D.F., J.A. Rodríguez-Zuluaga, L.F. Payán, L.A. Zapata y P.A. Rojas. 2015. Plan de manejo de las tortugas marinas del Parque Nacional Natural Gorgona. Parques Nacionales Naturales, Cali. 88 p. [ Links ]
Avens, L., L.R. Goshe, L. Coggins, D.J. Shaver, B. Higgins, A.M. Landry, and R. Bailey. 2017. Variability in age and size at maturation, reproductive longevity, and long-term growth dynamics for Kemp’s Ridley sea turtles in the Gulf of Mexico. PLoS ONE, 12: 1-25. https://doi.org/10.1371/journal.pone.0173999 [ Links ]
Balazs, G.H. 2000. Factores a considerar en el marcado de tortugas marinas. 116-125. En: Eckert, K.L., K.A., Bjorndal, F.A., Abreu-Grobois y M., Donnelly (Eds). Técnicas de investigación y manejo para la conservación de las tortugas marinas. Grupo Especialista en Tortugas Marinas UICN/CSE, Washington, D. C. 270 p. [ Links ]
Bell, I. and D.A. Pike. 2012. Somatic growth rates of Hawksbill Turtles Eretmochelys imbricata in a northern Great Barrier Reef foraging area. Mar. Ecol. Progr. Ser., 446: 275-283. https://doi.org/10.3354/meps09481. [ Links ]
Bjorndal, K.A. 2000. Prioridades para la investigación en hábitats de alimentación. 13-15. En: Eckert, K.L., K.A., Bjorndal, F.A., Abreu-Grobois y M., Donnelly (Eds). Técnicas de investigación y manejo para la conservación de las tortugas marinas. Grupo Especialista en Tortugas Marinas UICN/CSE, Washington, D. C. 270 p. [ Links ]
Bjorndal, K.A. and A.B. Bolten. 2010. Hawksbill sea turtles in seagrass pastures: success in a peripheral habitat. Mar. Biol., 157: 135-145. https://doi.org/10.1007/s00227-009-1304-0 [ Links ]
Bjorndal, K.A. and G. Zug. 1995. Growth and age of sea turtles. 599-603. In: K.A., Bjorndal. (Ed). Biology and conservation of sea turtles. Smithsonian Institution Press, Washington and London. 615 p. [ Links ]
Bjorndal, K.A. A.B. Bolten, B. Koike, B.A. Schroeder, D.J. Shaver, W.G. Teas, and W.N. Witzell. 2001. Somatic growth function for immature loggerhead sea turtles, Caretta caretta, in southeastern U.S. waters. Fish. Bull., 99: 240-246. [ Links ]
Bjorndal, K.A. , M. Chaloupka, V.S. Saba, C.E. Diez, R.P. van Dam, B.H. Krueger, et al. 2016. Somatic growth dynamics of west Atlantic hawksbill sea turtles: a spatio-temporal perspective. Ecosphere, 7: 1-14. https://doi.org/10.1002/ecs2.1279 [ Links ]
Blumenthal, J.M., T.J. Austin, C.D.L. Bell, J.B. Bothwell, A.C. Broderick, G. Ebanks-Petrie, J.A. Gibb, K.E. Luke, J.R. Olynik, M.F. Orr, J.L. Solomon, and B.J. Godley. 2009. Ecology of Hawksbill Turtles, Eretmochelys imbricata, on a western Caribbean foraging ground. Chelonian Cons. Biol., 8: 1-10. https://doi.org/10.2744/ccb-0758.1 [ Links ]
Bolten, A.B. 2000. Técnicas para la medición de tortugas marinas. 126-131. En: Eckert, K.L., K.A., Bjorndal, F.A. , Abreu-Grobois y M., Donnelly (Ed). Técnicas de investigación y manejo para la conservación de las tortugas marinas. Grupo Especialista en Tortugas Marinas UICN/CSE, Washington, D. C. 270 p. [ Links ]
Boulon, R.H. 1994. Growth rates of wild juvenile Hawksbill Turtles, Eretmochelys imbricata, in St. Thomas, United States Virgin Islands. Copeia, 3: 811-814. https://doi.org/10.2307/1447200 [ Links ]
Campbell, C.L. 2014. Estado de conservación de la tortuga carey en las regiones del Gran Caribe, Atlántico occidental y Pacífico Oriental. Secretaría Pro Tempore CIT, Virginia, EE. UU. 76 p. [ Links ]
Carrión-Cortez, J., C. Canales-Cerro , R. Arauz, and R. Riosmena-Rodríguez. 2013. Habitat use and diet of juvenile Eastern Pacific Hawksbill Turtles (Eretmochelys imbricata) in the north Pacific coast of Costa Rica. Chelonian Cons. Biol., 12: 235-245. https://doi.org/10.2744/ccb-1024.1 [ Links ]
Casale, P., P.P. D’Astore, and R. Argano. 2009. Age at size and growth rates of early juvenile loggerhead sea turtles (Caretta caretta) in the Mediterranean based on length frequency analysis. Herpetol. J., 19: 29-33. [ Links ]
Chacón-Chaverri, D., D.A. Martínez-Cascante, D. Rojas y L.G. Fonseca. 2015. Golfo Dulce, Costa Rica, un área importante de alimentación para la tortuga carey del Pacífico Oriental (Eretmochelys imbricata). Rev. Biol. Trop., 63: 351-362. https://doi.org/10.15517/rbt.v63i1.23114 [ Links ]
Chaloupka, M.Y. and C.J. Limpus. 1997. Robust statistical modelling of hawksbill sea turtle growth rates (southern Great Barrier Reef). Mar. Ecol. Progr. Ser., 146: 1-8. https://doi.org/10.3354/meps146001. [ Links ]
Diez, C.E. and R.P. van Dam. 2002. Habitat effect on hawksbill turtle growth rates on feeding grounds at Mona and Monito Islands, Puerto Rico. Mar. Ecol. Progr. Ser., 234: 301-309. https://doi.org/10.3354/meps234301. [ Links ]
Doak, D., Kareiva, P., and Klepetka, B. 1994. Modeling population viability for the Desert Tortoise in the western Mojave desert. Ecol. Appl., 4: 446-460. [ Links ]
Eguchi, T., J.A. Seminoff, R.A. LeRoux, D. Prosperi, D.L. Dutton, and P.H. Dutton. 2012. Morphology and growth rates of the Green Sea Turtle (Chelonia mydas) in a northern-most temperate foraging ground. Herpetologica, 68: 76-87. https://doi.org/10.1655/herpetologica-d-11-00050.1 [ Links ]
Fisher, R.A. 1934. Statistical methods for research workers. 5th ed. Oliver and Boyd, Edimburgh. 319 p. [ Links ]
Gaos, A.R., R.L. Lewison, I.L. Yáñez, B.P. Wallace, M.J. Liles, W.J. Nichols, A. Baquero, C.R. Hasbún, M. Vasquez, J. Urteaga, and J.A. Seminoff. 2012. Shifting the life-history paradigm: Discovery of novel habitat use by Hawksbill Turtles. Biol. Lett., 8: 54-56. https://doi.org/10.1098/rsbl.2011.0603 [ Links ]
Gaos, A.R. , M.J. Liles, V. Gadea, A.P. De Niz, F. Vallejo, C. Miranda, J.J. Darquea, A. Henríquez, E. Altamirano, A. Rivera, S. Chavarría, D. Melero, J. Urteaga, C.M. Pacheco, D. Chacón, C. LeMarie, J. Alfaro-Shigueto, J.C. Mangel, I.L. Yáñez, and J.A. Seminoff . 2017. Living on the edge: Hawksbill Turtle nesting and conservation along the Eastern Pacific Rim. Latin Am. J. Aq. Res., 45: 572-584. https://doi.org/10.3856/vol45-issue3-fulltext-7 [ Links ]
Goshe, L.R., L. Avens, F.S. Scharf, and A.L. Southwood. 2010. Estimation of age at maturation and growth of Atlantic green turtles (Chelonia mydas) using skeletochronology. Mar. Biol., 157: 1725-1740. https://doi.org/10.1007/s00227-010-1446-0.0 [ Links ]
Heidemeyer, M., R. Arauz-Vargas, and E. López-Agüero. 2014. New foraging grounds for hawksbill (Eretmochelys imbricata) and green turtles (Chelonia mydas) along the northern pacific coast of Costa Rica, Central America. Rev. Biol. Trop., 62: 109-118. https://doi.org/10.15517/rbt.v62i4.20037 [ Links ]
Heppell, S.S. 1998. Application of life-history theory and population model analysis to turtle conservation. Copeia, 2(2): 367-375. [ Links ]
Heppell, S.S., L.B. Crowder, and D.T. Crouse. 1996. Models to evaluate headstarting as a management tool for long-lived turtles. Ecol. Appl., 6: 556-565. [ Links ]
Jonsson, A. y B. Ebenman. 2001. Are certain life histories particularly prone to local extinction? J. Theor. Biol., 209: 455-463. [ Links ]
Liles, M.J., M.V. Jandres, W.A. López, G.I. Mariona, C.R. Hasbún, and J.A. Seminoff. 2011. Hawksbill Turtles Eretmochelys imbricata in El Salvador: nesting distribution and mortality at the largest remaining nesting aggregation in the eastern Pacific Ocean. Endang. Spec. Res., 14: 23-30. https://doi.org/10.3354/esr00338 [ Links ]
Limpus, C.J. 1992. The Hawksbill Turtle, Eretmochelys imbricata, in Queensland: population structure within a southern Great Barrier Reef feeding ground. Wildlife Res., 19: 489-506. https://doi.org/10.1071/WR9920489 [ Links ]
Llamas, I., E.E. Flores, M.E. Abrego, J.A. Seminoff, C.E. Hart, R. Donadi, B. Peña, G. Álvarez, W. Poveda, D.F. Amorocho, and A. Gaos. 2017. Distribution, size range and growth rates of Hawksbill Turtles at a major foraging ground in the eastern Pacific Ocean. Latin Am. J. Aq. Res., 45: 597-605. https://doi.org/10.3856/VOL45-ISSUE3-FULLTEXT-9 [ Links ]
Lutz, P.L. and J.A. Musick. 1997. The biology of sea turtles. CRC Mar. Sci. Ser., Florida. 432 p. [ Links ]
Mortimer, J.A. and M. Donnelly. 2008. IUCN SSC Marine Turtle Specialist Group 2008. Eretmochelys imbricata. IUCN Red List Threat. Species. Version 2014.2. https://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T8005A12881238.en [ Links ]
Munro, J.L. 1982. Estimation of the parameters of the von Bertalanffy growth equation from recapture data at variable intervals. ICES J Mar. Sci., 40: 199-200. [ Links ]
Muñoz, C. y F. Zapata. 2013. Plan de manejo de los arrecifes coralinos del Parque Nacional Natural Gorgona, Pacífico colombiano. Parques Nacionales Naturales y WWF-Colombia, Cali. 68 p. [ Links ]
Musick, J.A. 1999. Ecology and conservation of long-lived marine animals. 1-10. En: Musick, J.A. (Ed.). Life in the slow lane: ecology and conservation of long-lived marine animals. Am. Fish. Soc. Symp. 23, Bethesda, Maryland. [ Links ]
National Research Council. 1990. Decline of the sea turtles: causes and prevention. The National Academies Press, Washington, D. C. https://doi.org/10.17226/1536 [ Links ]
Snover, M.L., G.H. Balazs, S.K.K. Murakawa, S.K. Hargrove, M.R. Rice, and W.A. Seitz. 2012. Age and growth rates of Hawaiian Hawksbill Turtles (Eretmochelys imbricata) using skeletochronology. Mar. Biol., 160: 37-46. https://doi.org/10.1007/s00227-012-2058-7 [ Links ]
Tobón-López, A. y D.F. Amorocho. 2014. Estudio poblacional de la tortuga carey Eretmochelys imbricata (Cheloniidae) en el Pacífico sur de Colombia. Acta Biol. Col., 19: 447-457. [ Links ]
UICN. 2012. Categorías y criterios de la lista roja de la UICN: Versión 3.1. 2.° ed. Gland, Suiza y Cambridge, Reino Unido: UICN. vi + 34 p. [ Links ]
Van Dam, R.P. 2000. Medición del crecimiento en tortugas marinas. 171-173. En: Eckert, K.L., K.A., Bjorndal, F.A. ,Abreu-Grobois y M., Donnelly (Eds). Técnicas de investigación y manejo para la conservación de las tortugas marinas. Grupo Especialista en Tortugas Marinas UICN/CSE, Washington, D. C. 270 p. [ Links ]
Wallace, B.P., A.D. DiMatteo, A.B. Bolten, M.Y. Chaloupka, B.J. Hutchinson, F.A. Abreu-Grobois, et al. 2011. Global conservation priorities for marine turtles. PLoS One, 6: 1-4. https://doi.org/10.1371/journal.pone.0024510 [ Links ]
Wildermann, N.E., C. Gredzens, L. Avens, H.A. Barrios-Garrido, I. Bell, J. Blumenthal, et al. 2018. Informing research priorities for immature sea turtles through expert elicitation. Endang. Spec. Res., 37: 55-76. https://doi.org/10.3354/esr00916 [ Links ]
Witzell, W.N. 1983. Synopsis of biological data on the hawksbill turtle Eretmochelys imbricata (Linnaeus, 1766). FAO Fish. Synop., 1-78. https://doi.org/10.1016/0025-326x(84)90297-2 [ Links ]
Wood, L.D., R. Hardy, P.A. Meylan, and A.B. Meylan. 2013. Characterization of a Hawksbill Turtle (Eretmochelys imbricata) foraging aggregation in a high-latitude reef community in southeastern Florida, USA. Herpetol. Cons. Biol., 8: 258-275. [ Links ]
Zárate, P.M, K.A. Bjorndal, J.A. Seminoff, P.H. Dutton, and A.B. Bolten. 2015. Somatic growth rates of Green Turtles (Chelonia mydas) and Hawksbills (Eretmochelys imbricata) in the Galápagos Islands. J. Herpetol., 49: 641-648. [ Links ]
Zapata, F.A. 2017. Temporal dynamics of coral and algal cover and their drivers on a coral reef of Gorgona Island, Colombia (Eastern Tropical Pacific). Rev. Acad. Col. Cienc. Exac., Fís. Nat., 41: 306-310. https://dx.doi.org/10.18257/raccefyn.486 [ Links ]
Recibido: 30 de Julio de 2020; Aprobado: 03 de Octubre de 2020











 text in
text in