Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 supl.1 Santa Marta Dec. 2020 Epub Sep 05, 2021
https://doi.org/10.25268/bimc.invemar.2020.49.suplesp.1088
Artículos de Investigación
Dinámica de la estructura de la comunidad bentónica en las formaciones coralinas someras del archipiélago de San Bernardo, Caribe colombiano
1Investigador independienteColombia
2Sanjuan y Asociados Ltda. Santa Marta - Magdalena-Colombia clauctg@hotmail.com
3Hyser Ltda., Barranquilla, Colombia. lmendozamazzeo@gmail.com
4Departamento de Ciencias Biológicas y Ambientales, Facultad de Ciencias Naturales e Ingeniería, Universidad Jorge Tadeo Lozano, Sede Santa Marta, El Rodadero, Santa Marta, Colombia. adolfo.sanjuan@utadeo.edu.co
Coral reefs have experienced an extensive degradation over the last decades as a result of anthropogenic and natural disturbances. This study presents an historical characterization (1989-2015) of changes in composition of the substrate in coral formations in the San Bernardo Archipelago. In addition, in 2015 coral reef health (presence of deterioration signs) was evaluated, and satellite temperature data were analyzed. In general, coral cover showed a stable trend between 1989 and 2010. The observed differences in the coral reef formations in 2013 and 2015 could have been due to the increase in coverage of species of the genus Orbicella, Porites, Agaricia, Siderastrea and the hydrocoral Millepora complanata. The lower coverage in 1989, 1991 and 2005 was possibly related to massive mortality events of reef species due to diseases and bleaching. Abiotic substrate and algal cover exhibited opposing behavior, and algae became the dominant component of the substrate since 2013. Spatially, there were different trends: stations at Ceycen, Tintipán and Mangle presented better coral development conditions over time, while stations at Cabruna and Palma, closer to urban centers, showed signs of deterioration. In addition, temperatures above the bleaching tolerance threshold (29.4 °C) were recorded since June 2015, which is possibly why corals faced thermal stress and bleached in 18 of the 19 evaluated stations. Management actions on local impacts are essential, accompanied by information provided by monitoring programs, so that coral reefs can recover from the natural and anthropogenic impacts that affect them.
KEY WORDS: coral reefs; coral monitoring; reef cover; Corales del Rosario y San Bernardo Natural National Park; Colombian Caribbean.
Los arrecifes de coral han sufrido una extensa degradación en las últimas décadas como resultado de perturbaciones antropogénicas y naturales. Este estudio presenta una caracterización histórica (1989-2015) de los cambios en la composición del sustrato en formaciones coralinas en el archipiélago de San Bernardo. Adicionalmente, en el 2015 se evaluó la salud arrecifal (presencia de signos de deterioro) y se analizaron datos satelitales de temperatura. En general, la cobertura de coral mostró una tendencia estable entre 1989 y 2010. En 2013 y 2015 se registraron diferencias en el ensamblaje coralino las cuales pueden estar asociadas al incremento en la cobertura de las especies de los géneros Orbicella, Porites, Agaricia, Siderastrea y del hidrocoral Millepora complanata. Las menores coberturas observadas en 1989, 1991 y 2005 estuvieron posiblemente relacionados con eventos de mortalidades masivas de especies arrecifales por enfermedades y blanqueamiento. Se registró un comportamiento opuesto entre el sustrato abiótico y las algas, siendo este último grupo el componente dominante del sustrato desde el 2013. Espacialmente se presentaron diferentes tendencias. Las estaciones en Ceycen, Tintipán y Mangle presentaron mejores condiciones de desarrollo coralino en el tiempo, mientras que las estaciones en Cabruna y Palma, lugares más cercanos a los centros urbanos, presentaron indicios de tendencia hacia el deterioro. Adicionalmente, a partir de junio del 2015 se registraron valores de temperatura por encima del umbral de tolerancia al blanqueamiento (29,4 °C), por lo que posiblemente los corales enfrentaron un estrés térmico que causó blanqueamiento en 18 de las 19 estaciones evaluadas. Son esenciales las acciones de gestión sobre los impactos locales, acompañados de la información suministrada por los programas de monitoreo, para que los arrecifes puedan recuperarse de los impactos naturales y antropogénicos que los afectan.
PALABRAS CLAVE: arrecifes coralinos; monitoreo coralino; cobertura arrecifal; Parque Nacional Natural Corales del Rosario y San Bernardo; Caribe colombiano
INTRODUCCIÓN
Los arrecifes de coral constituyen uno de los ecosistemas más valiosos, productivos y biodiversos del planeta, ofreciendo variados servicios ecosistémicos a la población costera; son fuente de gran valor económico para la pesca tradicional y el turismo (Birkeland, 1997; Buddemeier et al., 2004; Burke et al., 2011). Este ecosistema es muy sensible a cambios en su entorno, por lo que ha sido catalogado como un indicador de perturbaciones ambientales (Zea, 1991; Bernhard, 2007). Por ello, la variación temporal de la cobertura coralina es considerada un buen indicador del estado de salud de los arrecifes coralinos, debido a que los corales son los constructores fundamentales del ecosistema (Birkeland, 1997; Hughes et al., 2010).
A pesar de su valor, los arrecifes coralinos han sufrido una extensa degradación en las últimas décadas y cerca del 75 % de ellos están bajo amenaza como resultado de perturbaciones antropogénicas y naturales (Burke et al., 2011). Factores como la sobrepesca, la pesca destructiva, la contaminación, las altas tasas de sedimentación, las enfermedades, el blanqueamiento y el cambio climático, son las causas más importantes de deterioro identificadas a nivel mundial y nacional, incluyendo el área de las islas de San Bernardo, en el Caribe colombiano (Birkeland, 1997; Díaz et al., 2000; Wilkinson y Souter, 2008; Burke et al., 2011).
Si bien se han realizado algunos estudios en los arrecifes coralinos del archipiélago de San Bernardo desde 1975 (Erhardt y Meinel, 1975; Duque y Gómez, 1983; Prahl y Erhardt, 1985; Díaz et al., 2000; López-Victoria y Díaz, 2000; Garzón-Ferreira y Díaz, 2003), son escasas las investigaciones que han evaluado la dinámica de los arrecifes del área en una amplia escala espacial y temporal. Se destaca la revisión de Alvarado et al. (2011) y la información suministrada por el Sistema Nacional de Monitoreo de Arrecifes Coralinos (SIMAC) que en San Bernardo inició actividades desde 2002 (Rodríguez-Ramírez et al., 2010; Navas-Camacho et al., 2011; Bastidas et al., 2014).
Desde la perspectiva del manejo y ante la problemática del cambio climático, es importante entender la dinámica de los ecosistemas en el tiempo y detectar sus cambios (Vega-Sequeda et al., 2017). En las formaciones coralinas del archipiélago de San Bernardo se realizó un monitoreo de cinco muestreos entre 1989 y 2010, en el marco del programa de Seguimiento y Monitoreo de Ecosistemas Naturales Marinos del Plan de Manejo Ambiental del Terminal de Coveñas de Ecopetrol S.A. (la empresa petrolera estatal colombiana), en el que se evaluó la cobertura del sustrato y la composición, abundancia y diversidad coralina. Adicionalmente, se llevaron a cabo campañas de muestreo adicionales en 2013 y 2015. En esta investigación se analizaron los cambios temporales en la cobertura y composición de las formaciones coralinas, así como el ensamblaje de corales escleractinios en el archipiélago de San Bernardo entre 1989 y 2015.
ÁREA DE ESTUDIO
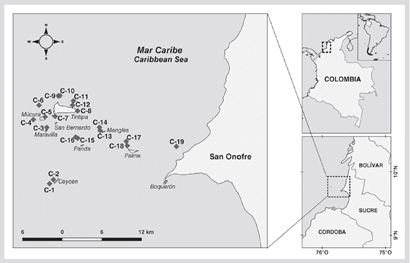
El archipiélago de San Bernardo está localizado frente a la costa del departamento de Sucre en el Caribe colombiano (Figura 1). Este archipiélago está compuesto por 12 islas y 4 islotes, destacándose el islote artificial de Santa Cruz del Islote como el que tiene la mayor población humana nativa, la cual deriva su sustento principalmente de la pesca artesanal y en menor medida del turismo (Duque-Rico y Torres-Gómez, 2011). El área sumergida hace parte del Parque Nacional Natural Corales del Rosario y San Bernardo (PNNCRSB), que abarca un área marina protegida de 120000 ha (Zarza-González, 2011).
El clima de la región es tropical, con una época seca (diciembre-abril) con mayor influencia de los vientos alisios del NE, un ligero descenso de la temperatura del agua (27 °C) y un incremento en la acción del oleaje, así como una época de lluvias (mayo-noviembre), cuando los vientos alisios se debilitan, el agua es más cálida (29 °C), las lluvias son frecuentes y llegan las descargas del río Sinú que incrementan la turbidez (Pujos etal., 1986; Patiño y Flores, 1993; Andrade-Amaya, 2001; Gutiérrez-Moreno et al., 2011).
El archipiélago de San Bernardo posee un complejo arrecifal parcialmente emergido con parches, arrecifes franjeantes y bancos coralinos que ocupan una extensión aproximada de 213,3 km², de los cuales 134,5 km2 corresponden a cobertura viva, presentando un mayor desarrollo en los flancos norte y occidente. Las formaciones más destacadas de este sector se encuentran al norte y noroccidente de isla Mangle, al norte de isla Tintipán y en los costados norte y occidente de los bajos Las Nubes, Minalta y Julián (Díaz et al., 2000).
Los arrecifes coralinos de las islas de San Bernardo han sufrido fuertes impactos antropogénicos desde la década de 1980. Estos se han atribuido a enfermedades epizoóticas coralinas, sedimentación y turbidez provenientes del río Sinú (López-Victoria y Díaz, 2000; Alvarado et al., 2011), pesca con dinamita y sobrepesca, desarrollo costero, turismo incontrolado, construcción en las islas y extracción de corales para artesanías (Ramírez, 1990; Díaz et al., 2000; Garzón-Ferreira y Díaz, 2003; Alvarado et al., 2011).
MATERIALES Y MÉTODOS
Fase de campo
Se utilizaron los datos de los monitoreo realizados en 1989, 1991, 1999, 2005 y 2010, documentados por Ramírez 1990, 1992, 2000, 2010) e Invemar (2005). El monitoreo inicial evaluó 11 estaciones, en 1999 se ampliaron a 18 y en 2005 se añadió una más para completar 19 estaciones (Figura 1) que se encuentran entre 4 y 12 m de profundidad. Para cada monitoreo se siguieron las coordenadas geográficas históricas de cada punto. Las estaciones están dispuestas en los alrededores de las islas Ceycen (C-1 y C-2), Maravilla (C-3), Múcura (C-4 a C-6), Tintipán (C-7 a C-12), Mangle (C-13 y C-14), Panda (C-15 y C-16), Palma (C-17 y C-18) y Cabruna (C-19). En cada estación se estimó la cobertura del sustrato por algas, corales (por especie), otros invertebrados (poliquetos sésiles, esponjas y anémonas) y sustrato abiótico, por el método de punto intercepto en transecto. En cada sitio se extendieron dos transectos no fijos de 75 m, anotando cada 10 cm el componente del sustrato que estaba debajo hasta completar 1500 puntos.
En 2013 y 2015, se emplearon las categorías del sustrato descritas por Garzón-Ferreira et al. (2002) con algunas modificaciones: algas, corales duros (por especie), esponjas, corales blandos (gorgonáceos y zoantídeos), otros invertebrados y sustrato abiótico. Adicionalmente, en el 2015 se registró la presencia de enfermedades coralinas y blanqueamiento con base en Sutherland et al. (2004) y Raymundo et al. (2008).
Se obtuvieron datos de la temperatura superficial del mar y del índice “grados semanas de calentamiento” (Degree Heating Weeks - DHW) del 2015 a partir de las bases de datos satelitales de la NOAA Coral Reef Watch (2020). La serie del índice DHW muestra la cantidad de estrés térmico acumulado en los corales durante las últimas 12 semanas. Este índice considera el “umbral de tolerancia” al blanqueamiento coralino, que para el Caribe colombiano es de 29,4 °C. Un DHW superior a 4 °C-semanas ha demostrado un blanqueamiento significativo y valores por encima de 8 °C-semanas han causado blanqueamiento masivo y mortalidad asociada (Liu et al., 2018).
Análisis de la información
Para describir el ensamblaje coralino se calcularon las medidas de riqueza específica (S), diversidad de Shannon-Wienner (H’) y la uniformidad de Pielou (J’), calculando el promedio, error estándar y coeficiente de variación por estación. Es necesario tener en cuenta que en los resultados de los monitoreos previos al 2013 Agaricia sp. agrupó a A. agaricites y A. tenuifolia, Orbicella annularis integró a O. faveolata y O. Franksi, y Siderastrea sp. incluyó a S. siderea y S. radians.
Los patrones de variación temporal (entre años) del ensamblaje coralino fueron representados por promedios Bootstrap en gráficos de Escalamiento Multidimensional o MDS (por sus siglas en inglés) multivariada y sus respectivos intervalos Boostrap de 95 %, con 100 repeticiones por grupo y un coeficiente de correlación mínimo de 0,99 (Clarke y Gorley, 2015). Para determinar posibles diferencias significativas de la estructura entre años se aplicó un PERMANOVA con 999 permutaciones (Anderson, 2001). Se definieron los corales que mayor contribución tuvieron a la disimilitud entre grupos mediante el análisis SIMPER (Clarke, 1993). Al realizar las comparaciones en el ámbito local y nacional, se obviaron las diferencias derivadas de los métodos de evaluación en campo. De este modo, la comparación e interpretación se limita a los valores de cobertura de las principales categorías del sustrato y la abundancia de especies coralinas.
RESULTADOS
Caracterización histórica
Entre 1989 y 2010, en las formaciones coralinas del archipiélago de San Bernardo el sustrato abiótico fue el componente más conspicuo. No obstante, entre 1989 y 2015 se presentó un descenso cercano al 45 %. Durante la década de 1990 el componente algal presentó una reducción en su cobertura, siendo 1999 el único año en el que estuvo por debajo de los corales. Sin embargo, a partir del 2010 se registró un incremento, alcanzando un máximo en 2013, cuando se volvió el componente predominante.
En cuanto al componente coralino, entre 1989 y 1991 presentó baja cobertura (inferior a 20 %). A partir de 2005 se registró un incremento gradual en la cobertura que en 2015 fue cercana a 30 %. No obstante, en 2005 se observó una reducción de la cobertura en 6 % con respecto a 1999 (Figura 2).
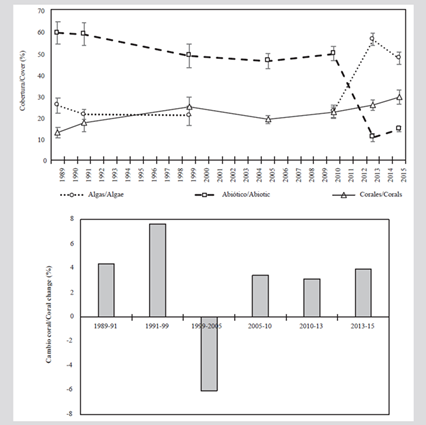
Figura 2 A) Cobertura promedio (± error estándar) de coral, algas y sustrato abiótico. B) Tasa de cambio de la cobertura coralina entre 1989 y 2015 en el archipiélago de San Bernardo.
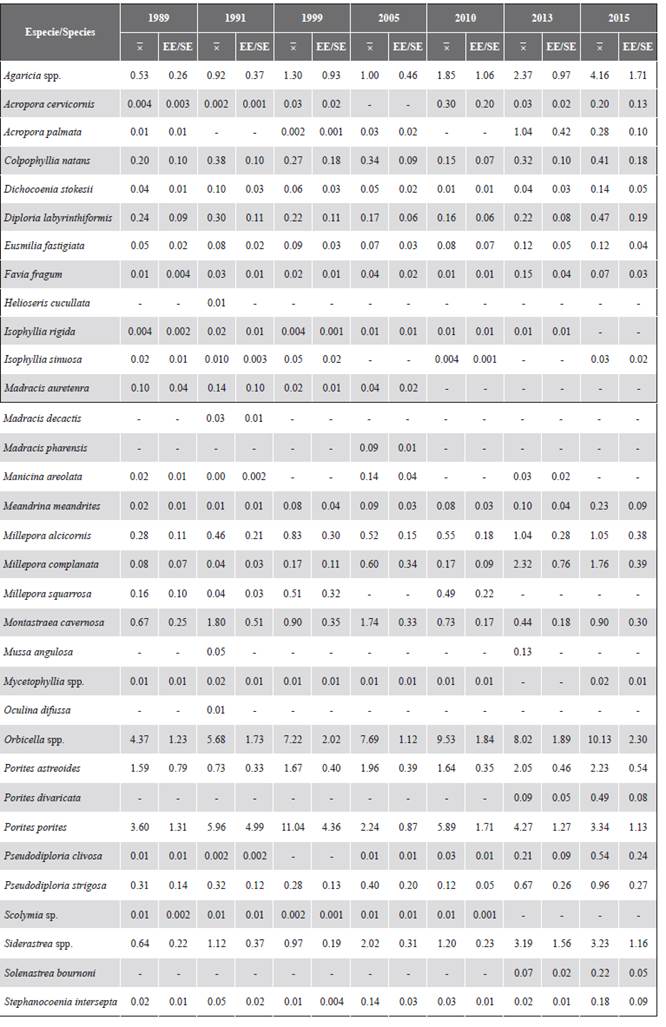
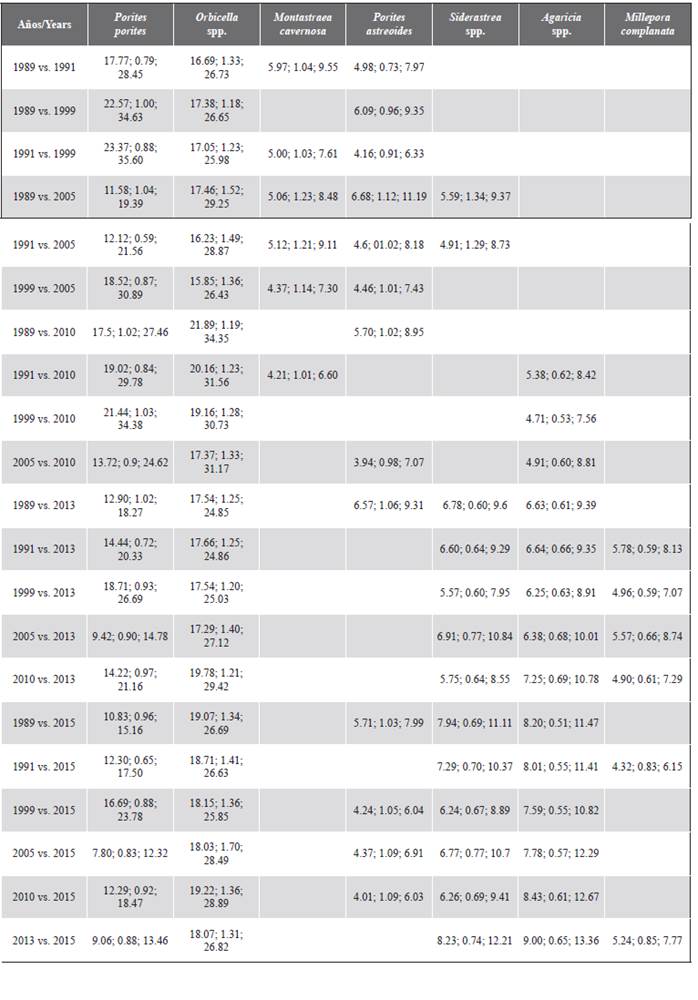
En la Tabla 1 se muestra la cobertura de cada taxón coralino registrado en cada uno de los años. Desde 1989 los corales que en general registraron una mayor abundancia relativa en el área de estudio fueron Orbicella spp. y Porites porites, seguidos de Agaricia spp., P. astreoides y Siderastrea spp. Se destaca la contribución histórica del género Orbicella que fue mayor a 35 %, así como su cobertura, la cual se incrementó en el tiempo. Adicionalmente, en el descenso de la cobertura del 2005, los géneros más afectados fueron Colpophyllia, Porites y Pseudodiporia.
Tabla 1 Porcentaje de cobertura media
 y error estándar (EE) de los corales en el archipiélago de San Bernardo entre 1989 y 2015.
y error estándar (EE) de los corales en el archipiélago de San Bernardo entre 1989 y 2015.
A nivel espacial, se evidenció un patrón de mayor cobertura de algas y, por lo general, menor cobertura de coral, en los sectores que se encuentran más cerca del continente como Palma (C-18) y Cabruna (C-19), especialmente en 2015 (Figura 3). En estas estaciones fueron abundantes los corales de los géneros Agaricia y Porites. Por el contrario, las estaciones C-6 (Múcura), C-11 (Tintipán) y C-14 (Mangle) estuvieron entre los sitios que históricamente registraron mayores valores de cobertura coralina, en las que el género Orbicella fue el más abundante (Tablas 1 y 2).
Tabla 2 Cobertura relativa de coral (%) y profundidad (m) en cada una de las estaciones evaluadas en el archipiélago de San Bernardo entre 1989 y 2015.
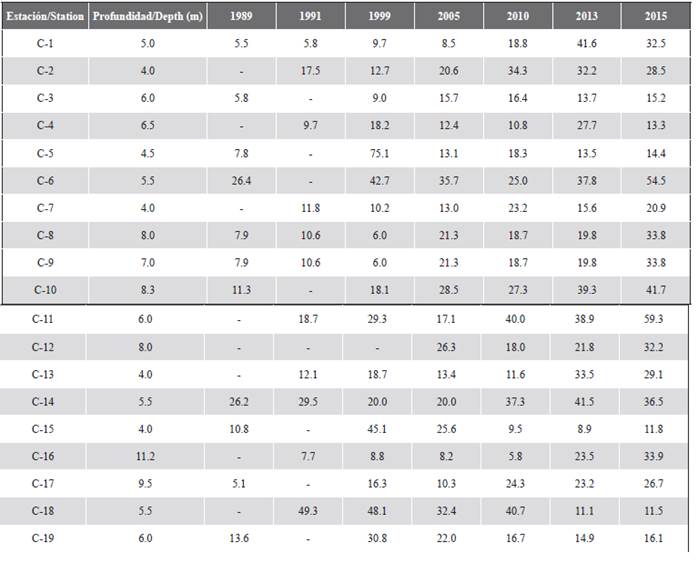
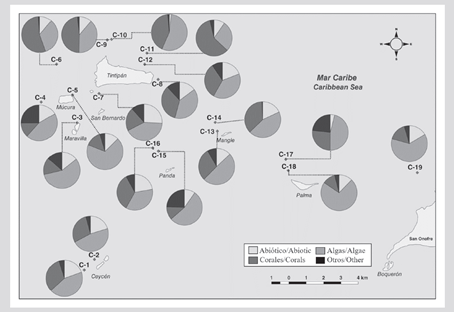
Figura 3 Cobertura de los componentes del sustrato (%) en cada una de las estaciones en el área del archipiélago de San Bernardo en 2015. C-1 y C-2 corresponden al sector Ceycen; C-3 a Maravilla; C-4, C-5 y C-6 a Múcura; C-7, C-8, C-9, C-10, C-11 y C-12 a Tintipán; C-13 y C-14 a Mangle; C-15 y C-16 a Panda; C-17 y C-18 a Palma, y C-19 a Cabruna.
Según el índice de Shannon-Wiener (Ln), la diversidad promedio históricamente ha sido mayor a 1,6 nits, exceptuando los años 1999 y 2010. La baja diversidad en estos dos años se relaciona con una menor uniformidad, ya que fueron los únicos periodos en que este último índice fue inferior a 0,6. La mayor diversidad en 2015 y 2005 fue más por efecto de una mayor uniformidad (J’ׯ > 0,69), mientras en 1989 y 1991 fue más resultado de una mayor riqueza (Sׯ> 13; Figura 4).
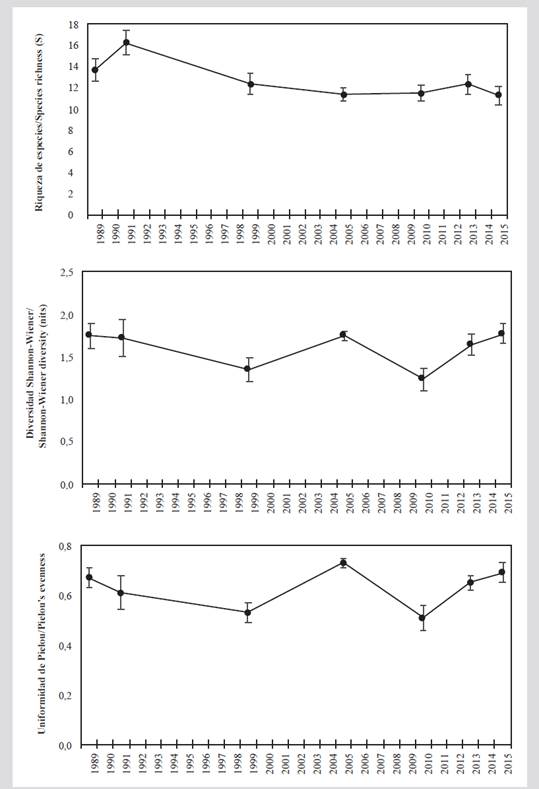
Figura 4 Medidas de diversidad promedio (± error estándar) del ensamblaje coralino en el archipiélago de San Bernardo entre 1989 y 2015. A) Riqueza de especies. B) Diversidad de Shannon-Wiener (nits). C) Uniformidad de Pielou.
La estructura (composición y abundancia) del ensamblaje coralino presentó diferencias significativas temporales (PERMANOVA, F(6,116) = 2,19; P = 0,001). Pruebas de t por parejas indicaron que particularmente 2015 y 2013 fueron diferentes de los otros años (P < 0,05), mas no entre ellos, y que además 1989 presentó diferencias significativas con 2005 (Tabla 3), como evidencia la gráfica de promedios Bootstrap (Figura 5).
Tabla 3 Comparación entre años de los resultados estadísticos de la prueba t (probabilidad), usando 999 permutaciones. El asterisco indica donde se registraron diferencias significativas.
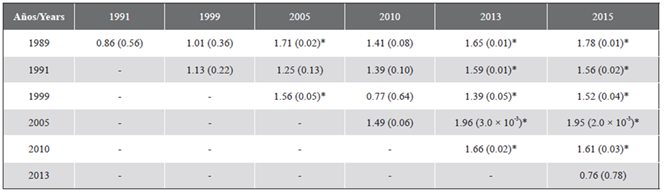
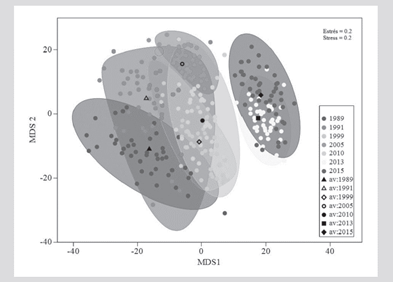
Figura 5 Gráfica bivariada de promedios Bootstrap del ensamblaje coralino entre años. Los círculos indican el promedio de cada repetición (transectos en un año), los marcadores negros el promedio general de cada año y los límites de las figuras geométricas corresponden a la región Bootstrap de 95 % de confianza.
La prueba SIMPER reveló que los corales Orbicella spp., P. porites, Agaricia spp., Siderastrea spp. y Millepora complanata contribuyeron con al menos 70 % de la disimilitud temporal (Tabla 4). Estas especies presentaron mayor cobertura en 2013 y 2015. En el caso de P. porites, aunque su contribución relativa a la disimilitud temporal del ensamblaje coralino varió entre 21,2 % (1999) y 12,8 % (2013), su cobertura tiende a ser cíclica después del 2005, momento que registró una reducción cercana a 9 % (Tabla 1).
Tabla 4 Taxa que más contribuyen a la disimilitud del ensamblaje coralino entre años con base en el análisis SIMPER a un corte de contribución acumulada de mínimo el 70 %. El primer valor corresponde a la disimilitud promedio (%), el segundo a la consistencia (disimilitud/desviación estándar) y el tercero a la contribución relativa (%) de cada taxón.
En cuanto a la presencia de signos de deterioro coralino, en 2015 se observó blanqueamiento en todas las estaciones, excepto en C-7. Las especies más afectadas fueron Orbicella annularis, O. faveolata, Agaricia tenuifolia y Siderastrea siderea (Tabla 5) y en todos los casos el blanqueamiento afectó las colonias de forma parcial. Se registraron las enfermedades de plaga blanca, banda negra y lunares oscuros; esta última enfermedad fue la más frecuente (presente en 13 estaciones; Figura 6) y afectó principalmente al coral S. siderea.
Tabla 5 Especies de coral observadas con blanqueamiento en las estaciones evaluadas en el archipiélago de San Bernardo en 2015.
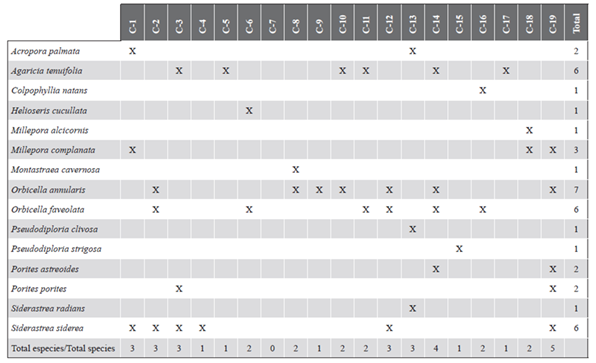
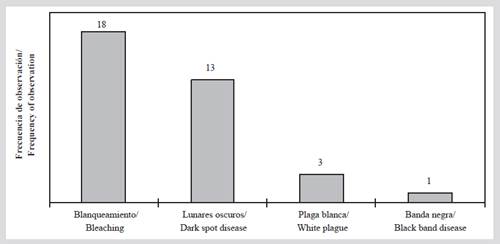
Figura 6 Cantidad de estaciones con la presencia de enfermedades coralinas y blanqueamiento en el archipiélago de San Bernardo en 2015.
En la Figura 7 se muestra la temperatura superficial del mar (TSM) diaria durante 2015 en relación con el umbral de tolerancia al blanqueamiento de 29,4 °C. A partir de junio se registraron temperaturas que superaron el umbral y los valores más altos (30,6 °C) se presentaron en julio y septiembre. Durante el monitoreo en agosto de 2015, se registró un DHW de 1,5 °C-semanas, que indica que los corales estuvieron experimentado un bajo estrés térmico. Posteriormente, entre octubre y diciembre se registraron valores de DWH entre 4 y 8 °C-semanas, indicando un estrés térmico alto que puede ocasionar un blanqueamiento significativo.
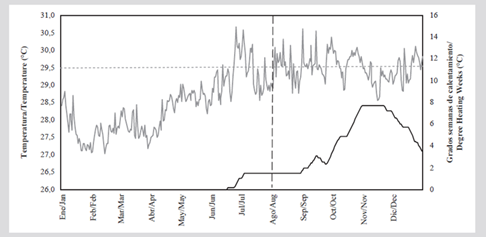
Figura 7 Temperatura superficial del mar (°C, línea gris) y estrés térmico DHW (°C-semanas, línea negra continua) entre enero y diciembre de 2015. Datos satelitales de la NOAA para Colombia, resolución 5 km (NOAA Coral Reef Watch, 2020). La línea roja punteada indica el umbral de tolerancia al blanqueamiento de la NOAA (29,4 °C). La línea punteada vertical indica el momento en que fue realizado el seguimiento.
DISCUSIÓN
Desde la década de 1980, las formaciones coralinas del Caribe colombiano, incluyendo las del Parque Nacional Natural Corales del Rosario y San Bernardo (PNNCRSB), han presentado cambios en la dominancia de los componentes bentónicos, composición coralina, mortandades masivas de organismos, disminución de la cobertura coralina, eventos de blanqueamiento e incremento de la prevalencia de enfermedades (Werding y Sánchez, 1979; Duque y Gómez, 1983; Alvarado et al., 1986, 2011; Cendales et al., 2002; Garzón-Ferreira y Díaz, 2003; Rodríguez-Ramírez et al., 2010; Jackson et al., 2014).
En el PNNCRSB y específicamente en las islas de San Bernardo se han identificado como principales amenazas la pesca sobre los recursos hidrobiológicos (Martínez-Viloria et al., 2011), la actividad turística (Mendoza et al., 2011), el uso de material biológico para elaboración de artesanías y recuerdos (Ordosgoitia y Zarza-González; 2011) y el blanqueamiento coralino (Gómez-Campo et al., 2011).
Otras amenazas locales que se pueden sumar son la posible influencia de los sedimentos y el agua dulce provenientes del río Sinú y los hidrocarburos provenientes del tránsito de embarcaciones turísticas y derrames accidentales por las actividades asociadas al terminal marítimo de Coveñas. La influencia de agua dulce se evidencia en las concentraciones de alcalinidad tanto en época lluviosa (107,5 a 116,6 mg/L) como en época seca (119,2 a 130,8 mg/L) de 2013 en San Bernardo (Hyser, 2014). Estos valores están por debajo de los límites ideales (175-200 mg/L) e incluso aceptables (124-225 mg/L) establecidos para el cultivo de corales (Borneman, 2008), lo cual limita la calcificación y disminuye la tasa de crecimiento y la densidad esquelética (Borneman, 2008; Hurtado, 2015).
En el caso de los hidrocarburos, los resultados de Betancourt-Portela et al. (2011), que hacen parte del seguimiento que realiza la REDCAM de Invemar, encontraron concentraciones por debajo del nivel de referencia internacional de 10 mg/L en el PNNCRSB. Asimismo, este documento mostró que desde 2003 todos los muestreos han registrado un bajo nivel de contaminación que no representa riesgo para los organismos acuáticos. Tampoco hay evidencia que los derrames que se han producido en el golfo de Morrosquillo han llegado a afectar las formaciones coralinas del archipiélago de San Bernardo (Carsucre, 2014).
En el archipiélago de San Bernardo, entre 1989 y 1991 se registró una baja cobertura coralina (< 20 %) y altos valores del sustrato abiótico (> 50 %), los cuales estuvieron posiblemente asociados a varios de los hechos indicados. Uno de los sucesos de mayor impacto fue la mortandad masiva de las especies coralinas dominantes en ese momento, A. palmata y A. cervicornis, debido a la enfermedad de la banda blanca, la cual diezmó sus poblaciones en Colombia y demás regiones del Caribe (Díaz et al., 2000; Porter et al., 2001; Garzón-Ferreira y Díaz, 2003; Sutherland et al., 2004; Green et al., 2008).
Previo a este suceso, Erhardt y Meinel (1975) y Erhardt y Prahl (1985) mencionan la presencia de grandes parches coralinos, así como de extensos setos del género Acropora principalmente en la cresta arrecifal y numerosas colonias de corales mixtos en sotavento. Asimismo, en Ceycen, observaron la dominancia de corales foliáceos en el borde del talud, los cuales fueron reemplazados por corales masivos a partir de los 12 m de profundidad. Posteriormente, en los resultados del monitoreo de 1989, Ramírez (1990) destaca el deterioro coralino, ya que el coral muerto (16,4 %), que pasó a formar parte del sustrato abiótico, fue superior a la cobertura coralina (12,7 %) y fue el componente dominante del sustrato. Al parecer, los cambios posteriores entre este componente y las algas, se debieron en parte al cambio de investigadores en la campaña del 2013. Durante los seguimientos entre 1991 y 2010, los numerosos esqueletos de coral a pesar de estar colonizados por algas, fueron registrados como sustrato abiótico y desde el 2013 como algas. De este modo, es posible que la dominancia de este último componente se haya presentado realmente desde la década de 1990.
El incremento en la cobertura y dominancia de las algas, que persiste en la actualidad, ha sido documentado en otros arrecifes en Colombia y en el Caribe desde 1990, evidenciándose un cambio de fase, donde los arrecifes son dominados por algas y no por corales (Done, 1992; Hughes, 1994; Díaz et al., 2000; Garzón-Ferreira y Díaz, 2003; Díaz-Pulido et al., 2004; Rodríguez-Ramírez et al., 2010; Bastidas et al., 2014; Jackson et al., 2014). Los resultados de este monitoreo coinciden con esta condición, ya que históricamente, a excepción de 1999, la cobertura de las algas fue superior a la coralina. Este escenario evidencia el proceso de deterioro que han enfrentado los arrecifes del archipiélago de San Bernardo en las últimas décadas como consecuencia de factores de perturbación como enfermedades coralinas, blanqueamiento, cambio climático, turismo masivo, sobrepesca, contaminación, y desarrollo costero, entre otros, tal como ha ocurrido en otros arrecifes alrededor del mundo (Hughes, 1994; McClanahan y Mutinga, 1998; Buddemeier et al., 2004; Díaz-Pulido et al. 2004; Rodríguez-Ramírez et al., 2010; Alvarado et al., 2011).
Adicionalmente, la reducción en la cobertura coralina registrada en el 2005 estuvo posiblemente asociada al blanqueamiento masivo que se presentó ese mismo año, el cual fue uno de los eventos más severos y que produjo mortalidades coralinas en el Gran Caribe (Wilkinson y Souter, 2008; Eakin et al., 2010). En las formaciones arrecifales del archipiélago y áreas aledañas, este evento afectó severamente entre 1 y 70 % de los corales en los primeros 12 m de profundidad, con una mortalidad asociada de 5 % (Rodríguez-Ramírez et al., 2008; Gómez-Campo et al., 2011).
No obstante, el blanqueamiento podría ser un factor determinante en la mortandad coralina, amenazando el futuro de los arrecifes, considerando que estos eventos son cada vez más frecuentes (Hughes et al., 2017, 2018; Oliver et al., 2018). Adicionalmente, la respuesta adaptativa que pueden desarrollar los corales después de un blanqueamiento es demasiado lenta para mantenerse al día con la velocidad actual del cambio climático (Fabricius et al., 2007; Ainsworth et al., 2016).
Para el Gran Caribe, Jackson et al. (2014) documentaron una tendencia general a la reducción en la cobertura coralina, en promedio cercano a 20 %, entre la década de 1980 y 2011. Este mismo patrón fue observado en los arrecifes del Caribe colombiano (Díaz et al., 2000; Alvarado et al., 2011). Según la información del programa de monitoreo SIMAC, la cobertura coralina en cinco áreas arrecifales fue relativamente estable desde 1998 hasta 2004 (Rodríguez-Ramírez et al., 2010). Resultados posteriores, hasta el 2013, sugieren que las áreas de Santa Marta y las islas de San Bernardo permanecen estables, mientras que en las islas del Rosario, San Andrés y Urabá chocoano existe una tendencia al descenso (Bastidas et al., 2014). Similar a lo reportado por el SIMAC, en el presente monitoreo en el archipiélago de San Bernardo los corales presentaron una tendencia general a la estabilidad entre 1989 y 2010.
La riqueza de especies coralinas observada en este monitoreo (40 especies) es cercana a la documentada en el área de estudio de 49 y al de otras regiones como San Andrés y Urabá chocoano, ambas con 41 especies, Providencia con 49 especies, las islas del Rosario y Santa Marta, ambas con 53 especies (Prahl y Erhardt, 1985; Díaz et al., 2000). No obstante, esta información debe ser tomada con cautela, ya que la evaluación estuvo restringida a los primeros 12 m, lo cual pudo excluir otros hábitats y formaciones coralinas.
Históricamente los corales con mayor cobertura y que más contribuyeron al ensamblaje coralino fueron Orbicella spp., Porites porites, Agaricia spp., P. astreoides y Siderastrea spp., por lo que pueden ser consideradas actualmente como los principales constructores de las formaciones coralinas estudiadas. Este esquema se ajusta en cierta forma a lo documentado por otros estudios (Alvarado et al., 1986; Cendales et al., 2002; Rodríguez-Ramírez et al., 2010; Alvarado et al., 2011) en las formaciones coralinas aledañas a Barú y a las islas del Rosario.
De acuerdo con los registros de Erhardt y Meinel (1975) y Erhardt y Prahl (1985), antes de la década de 1980, si bien el género Acropora fue abundante también describieron la presencia de numerosas especies coralinas distribuidas homogéneamente en el archipiélago. No obstante, P. porites fue más comúnmente observado en la laguna arrecifal entremezclado con Millepora spp. Las colonias de S. siderea y P. astreoides, cuyo diámetro era menor a 30 cm de diámetro, se encontraron principalmente como rodolitos en sustrato inestables. Adicionalmente, en algunas zonas protegidas del oleaje, A. tenuifolia fue dominante en parches a 6 m de profundidad. Por su parte, colonias masivas de Orbicella y Colpophyllia fueron abundantes a profundidades mayores a 12 m.
Como consecuencia de la mortalidad de los acropóridos en los arrecifes del Caribe, incluyendo a Colombia, Bruckner (2002), Cendales et al. (2002) y Green et al. (2008) afirman que se presentó un cambio en la composición de la comunidad coralina, en el que especies pioneras con estrategias oportunistas como A. tenuifolia, P. astroides y especies de crecimiento lento con alta tasa de supervivencia como las del género Orbicella y Siderastrea están ocupando el lugar de los acropóridos. Estos cambios han traído como resultado la presencia de especies de coral capaces de vivir bajo condiciones de estrés. El aumento en la cobertura coralina en 2013 puede estar asociado al cambio de investigadores en este seguimiento. Sin embargo, podría haber una contribución por el crecimiento de estas especies con eficaces estrategias de vida, aunque no existen mediciones que demuestren el crecimiento de estas colonias durante este periodo.
A lo largo del monitoreo, la cobertura de acropóridos fue muy baja, menor a 1 %. Esto sugiere que en general, en el área evaluada, las poblaciones de este grupo han tenido una baja recuperación. Estudios realizados en diferentes años enfocados en este género coralino en el Caribe colombiano concluyeron que, a pesar de poseer una alta tasa de crecimiento, no hay evidencias de su real recuperación (Díaz et al., 2000; Garzón-Ferreira et al., 2004). Adicionalmente, aunque García-Urueña y Garzón-Machado (2020), documentaron diferentes respuestas en su condición según la especie y su ubicación, el género Acropora en el archipiélago de San Bernardo no mostró signos de mejoría, especialmente A. cervicornis.
Considerando la ubicación de las estaciones dentro del archipiélago, se evidenció una mayor cobertura de algas y, por lo general, una menor cobertura de coral en los sectores que se encuentran más cerca del continente como Cabruna y Palma. En estos sectores existe una mayor influencia de factores de perturbación de origen humano, por lo que estas formaciones coralinas probablemente enfrentan un proceso continuo de amenazas por las actividades que se desarrollan en la zona costera y que las conducen al deterioro. Indicadores como un descenso de la cobertura coralina a lo largo del monitoreo fue registrado en varias de las estaciones de estos sectores (C-15, C-18 y C-19). La continua exposición de estas formaciones coralinas a los tensores causantes de deterioro coralino podría limitar su capacidad de recuperación, amenazando su persistencia (Hughes, 1994; Buddemeier et al., 2004; Hughes et al., 2010; Burke et al., 2011). Este deterioro afecta la estructura y la dinámica del ecosistema y representa una amenaza permanente para el mantenimiento de los bienes y servicios que se derivan de él.
Por el contrario, hay formaciones coralinas que mostraron mejores condiciones de estado como C-6, C-11 y C-14, ubicadas al N y NO de las islas Múcura, Tintipán y Mangle, respectivamente. En varias de estas estaciones se observó una mayor presencia de corales juveniles y un incremento en la cobertura de coral en el tiempo. Estas estaciones podrían estar entre los lugares del archipiélago que se encuentran mejor conservados y donde existe una buena probabilidad de incrementarse la presencia de corales juveniles. Por lo tanto, se debe tener especial atención en su gestión y protección, ya que podrían ser clave en el mantenimiento de las comunidades coralinas del área.
Los arrecifes de coral tienen un ámbito estrecho de tolerancia térmica, entre 18 y 36 °C con un intervalo óptimo entre 25 y 29 °C (Stoddar, 1969; Hubbard, 1997; Raymundo et al., 2008), por lo que este ecosistema es extremadamente susceptible al estrés térmico (Harvell et al., 2007). En 2015 las formaciones coralinas enfrentaron un estrés causado por las altas temperaturas acumuladas de meses atrás que estuvo reflejado, en parte, en la presencia del blanqueamiento en 18 de las 19 estaciones evaluadas y el registro de algunas enfermedades. Sin embargo, su impacto fue bajo, ya que las colonias fueron afectadas sólo de forma parcial. No obstante, a finales del 2015 y en el 2016 se registró un evento masivo de blanqueamiento global, asociado a altas temperaturas, que afectó severamente a los arrecifes del Pacífico Occidental y en Colombia fue considerado como un evento de nivel bajo (Hughes et al., 2017, 2018; Oliver et al., 2018).
Desde la perspectiva de la resiliencia, la protección que pueden proveer los parques nacionales es sólo una parte de la solución para la conservación de los ecosistemas, ya que esta debe ir acompañada de otros mecanismos como fuertes medidas de manejo (Hughes et al., 2010) y restauración ecológica (Pizarro et al., 2014). Igualmente, son esenciales las acciones de gestión sobre los impactos locales como la sobrepesca, la actividad turística, la degradación de la calidad del agua, la contaminación, la deforestación, entre otros, para detener el deterioro y comenzar a proteger los arrecifes coralinos para que puedan adaptarse a los cambios ambientales y así aumentar su recuperación frente al cambio climático (Wooldridge et al., 2005; Hughes et al., 2007, 2010; Knowlton y Jackson, 2008). Esto va de la mano con la continuidad de los programas de monitoreo para generar información sobre el estado, tendencias y cambios de los ecosistemas marinos.
CONCLUSIONES
Esta evaluación de largo plazo evidenció una dinámica opuesta y una gran variación en la cobertura del sustrato abiótico y de las algas, siendo este último grupo el componente más abundante del fondo marino desde el 2013 y que corresponde al panorama general observado en los arrecifes coralinos a nivel mundial. El ensamblaje coralino presentó una tendencia estable entre 1989 y 2010. Sin embargo, la disimilitud temporal registrada en el 2013 y 2015 con los demás años fue a causa de las mayores coberturas de los corales Orbicella spp., P. porites, Agaricia spp., Siderastrea spp. y M. complanata, cuyas estrategias de vida, con la excepción de M. complanata, les ha permitido llegar a ser los principales constructores de las formaciones coralinas del archipiélago de San Bernardo. La dinámica temporal de los principales componentes del sustrato es consecuencia del efecto de las perturbaciones naturales y antropogénicas a las que han sido sometidos estos arrecifes en las últimas décadas. No obstante, a nivel espacial se puede apreciar una gran variabilidad de coberturas coralinas donde se destacan arrecifes ubicados en las islas Múcura, Tintipán y Mangle que presentaron mejores condiciones de estado. Adicionalmente, la mayor frecuencia de observación de blanqueamiento en el 2015, que coincidió con el registro de altas temperaturas, pone en evidencia que la TSM es un factor de perturbación importante que actualmente están afectando a las formaciones coralinas.
AGRADECIMIENTOS
Este estudio se desarrolló en el marco del programa de Seguimiento y Monitoreo de Ecosistemas Naturales Marinos del Plan de Manejo Ambiental del Terminal de Coveñas por Ecopetrol S.A., al cual se agradece enormemente por su apoyo y financiación. Los autores también agradecen a la empresa Hyser Ltda. por todo su apoyo en la gestión y realización de esta investigación. Asimismo, al Parque Nacional Natural Corales del Rosario y San Bernardo por su acompañamiento. Por último, a Shirly Bello-Escobar por la elaboración de la cartografía y a Milena Marrugo, Alejandro Henao, David Acevedo y Diego Quiroga por el apoyo en las actividades de campo.
REFERENCIAS
Ainsworth, T., S., Heron, J.C., Ortiz, P., Mumby, A.,Grech , D., Ogawa, C.M.,Eakin, and W.,Leggat . 2016. Climate change disables coral bleaching protection on the Great Barrier Reef. Science, 352(6283): 338-342. [ Links ]
Anderson, M. 2001. A new method for non-parametric multivariate analysis of variance. Austral Ecol., 26: 32-46. [ Links ]
Andrade-Amaya, C.A. 2001. Las corrientes superficiales en la cuenca de Colombia observadas con boyas de deriva. Rev. Acad. Colomb. Cienc. Ex. Fis. Nat., 25 (96): 321-335. [ Links ]
Alvarado, E.M., F., Duque, L., Flórez y R., Ramírez. 1986. Evaluación cualitativa de los arrecifes coralinos de las islas del Rosario (Cartagena, Colombia). Bol. Ecotrópica, 15: 1-30. [ Links ]
Alvarado, E., V., Pizarro y A., Sarmiento-Segura. 2011. Formaciones arrecifales. 109-123. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Bastidas, M., N., Rangel, D., Morales, C., Ricaurte, D.I., Gomez-López, R., Navas-Camacho, S.M., Navarrete, D., Alonso, L.J., Vivas-Aguas, P.S., Obando, J.A., Rodríguez-Rodríguez, L.V., Licero-Villanueva y L., Perdomo. 2014. Estado del ambiente y los ecosistemas marinos y costeros. 23-82. En: Informe del estado de los ambientes y recursos marinos y costeros en Colombia: año 2013. Ser. Publ. Per. Invemar, (3), Santa Marta. 192 p. [ Links ]
Bernhard, R. 2007. Extreme climatic events and coral reefs: How much short-term threat from global change? 315-341. In: Aronson, R.B. (Eds). Geological approaches to coral reef ecology. Springer, New York. 439 p. https://doi.org/10.1007/978-0-387-33537-7_10 [ Links ]
Betancourt-Portela, J.M., L.F., Espinosa, S., Narváez, J., Vivas-Aguas y J.P., Parra. 2011. 67-77. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Birkeland, C. 1997. Life and death of corals reefs. Chapman & Hall, Nueva York. 536 p. [ Links ]
Borneman, E. 2008. Introduction to the husbandry of corals in aquariums: A review. 3-14. In: Leewis, J. and M. ,Janse (Eds.). Advances in coral husbandry in public aquariums. Public Aquarium Husbandry Series, 2. Burgers’ Zoo, Arnhem. 444 p. [ Links ]
Bruckner, A. 2002. Proceedings of the Caribbean Acropora Workshop: Potential application of the U.S. endangered species act as a conservation strategy. NOAA Technical Memorandum NMFS-OPR-24. Silver Spring, USA. 184 p. [ Links ]
Buddemeier, R.W., J.A., Kleypas, and R.B., Aronson. 2004. Coral reefs and global climate change: Potential contributions of climate change to stresses on coral reef ecosystems. Pew Center on Global Climate Change, Arlington. 44 p. [ Links ]
Burke, L., K., Reytar, M., Spalding, and A., Perry. 2011. Reef at risk: revisited. World Resources Institute, Washington. 114 p. [ Links ]
Carsucre, 2014. Informe de seguimiento en el sector de la parte trasera de la ciénaga de La Caimanera, municipio de Coveñas y en sector de las playas del Francés-Alegría, vía Guacamayas, municipio de Santiago de Tolú, por derrames de hidrocarburos. Informe final, Sincelejo. 7 p. [ Links ]
Cendales, M., S., Zea y J., Díaz. 2002. Geomorfología y unidades ecológicas del complejo de arrecifes de las Islas del Rosario e isla Barú (mar Caribe, Colombia). Rev. Acad. Colomb. Cienc., 26(101): 497-510. [ Links ]
Clarke, K.R. 1993. Non-parametric multivariate analyses of changes in community structure. Aus. J. Ecol., 18: 117-143. [ Links ]
Clarke, K.R., and R.N., Gorley. 2015. PRIMER v7: User manual/tutorial. PRIMER-E: Plymouth. Devon, UK. 296 p. [ Links ]
Díaz, J.M., L.M., Barrios, M.H., Cendales, J., Garzón-Ferreira, J., Geister, M., López-Victoria, G.H., Ospina, F., Parra-Velandia, J., Pinzón, B., Vargas-Ángel, F.A., Zapata y S., Zea. 2000. Áreas coralinas de Colombia. Invemar. Ser. Publ. Esp. Invemar, (5), Santa Marta. 179 p. [ Links ]
Díaz-Pulido, G., J., Sánchez, S., Zea, J., Díaz y J., Garzón-Ferreira. 2004. Esquemas de distribución espacial en la comunidad bentónica de arrecifes coralinos continentales y oceánicos del Caribe colombiano. Rev. Acad. Colomb. Cienc., 24(108): 337-347. [ Links ]
Done, T.J. 1992. Phase shifts in coral reef communities and their ecological significance. Hydrobiologia, 247: 121-132. [ Links ]
Duque, F., y H., Gómez. 1983. El archipiélago de San Bernardo y su fauna íctica. Tesis Biol. Mar., Univ. Jorge Tadeo Lozano, Bogotá. 90 p. [ Links ]
Duque-Rico, M.A., y L., Torres-Gómez. 2011. Aspectos socioeconómicos de las principales comunidades del archipiélago de San Bernardo, sector Barú y archipiélago de Nuestra Señora del Rosario. 26-37. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Eakin, C.M., J.A., Morgan, S.F., Heron, T.B., Smith, G., Liu, L., Álvarez-Filip, B., Baca, et al. 2010. Caribbean corals in crisis: record thermal stress, bleaching, and mortality in 2005. PLoS ONE, 5(11): e13969. https://doi.org/10.1371/journal.pone.0013969 [ Links ]
Erhardt, H., and W., Meinel. 1975. Die scleractinen Korallen der Insel Ceycén, Islas San Bernardo, vor der kolumbianischen Atlanfikküste. Philippia, 2: 236-247. [ Links ]
Fabricius, K., O., Hoegh-Guldberg, J., Johnson, L., McCook, and J., Lough. 2007. Vulnerability of coral reefs of the Great Barrier Reef to climate change. 515-554. In: Johnson, J. y Marshall, P.A. (Eds). Climate change and the Great Barrier Reef. Chapter 17. Great Barrier Marine Park Authority and Australian Greenhouse Office, Australia. 801 p. [ Links ]
García-Urueña, R., and M.A., Garzón-Machado. 2020. Current status of Acropora palmata and Acropora cervicornis in the Colombian Caribbean: demography, coral cover and condition assessment. Hydrobiologia, 847: 2141-2153. https://doi.org/10.1007/s10750-020-04238-6 [ Links ]
Garzón-Ferreira, J., M.C., Reyes-Nivia y A., Rodríguez-Ramírez. 2002. Manual de métodos del SIMAC - Sistema Nacional de Monitoreo de Arrecifes Coralinos en Colombia. Informe final, Invemar, Santa Marta. 61 p. [ Links ]
Garzón-Ferreira, J. and,J.M., Díaz. 2003. The Caribbean coral reefs of Colombia. 275-301. En: Cortés, J. (Ed.). Latin American Coral Reefs. Elsevier Science B.V., Ámsterdam. 508 p. [ Links ]
Garzón-Ferreira, J., M., Moreno-Bonilla y J.M., Valderrama. 2004. Condición actual de las formaciones coralinas de Acropora palmata y A. cervicornis en el Parque Nacional Natural Tayrona (Colombia). Bol. Invest. Mar. Cost., 33: 117-136. [ Links ]
Gómez-Campo, K., T., López-Londoño, D.L., Gil-Agudelo, R., Navas-Camacho, J.A., Rojas y J., Garzón-Ferreira. 2011. Blanqueamiento coralino, amenaza para el futuro de los arrecifes de coral de los archipiélagos Nuestra Señora del Rosario y San Bernardo. 319-328. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y San Bernardo. Parques Nacionales Naturales de Colombia, Cartagena de Indias, Colombia. 416 p. [ Links ]
Green, D., P., Edmunds, and R., Carpenter. 2008. Increasing relative abundance of Porites astreoides on Caribbean reefs mediated by an overall decline in coral cover. Mar. Ecol. Prog. Ser., 359: 1-10. [ Links ]
Gutiérrez-Moreno, C.M., Marrugo, P., Lozano-Rivera, P. C., Sierra y C., Andrade. 2011. Clima marino. 39-47. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Harvell, D., E., Jordán-Dahlgren, S., Merkel, E., Rosenberg, L. Raymundo , G., Smith, E., Weil, and B., Willis. 2007. Coral diseases environmental drivers and the balance and balance between coral and microbial associates. Oceanography, 20(1): 172-195. [ Links ]
Hubbard, D. 1997. Reefs as dynamic systems. 43-67. In: Birkeland, C. (Ed). Life and death of coral reefs. Chapman y Hall, Nueva York, USA. 536 p. [ Links ]
Hughes, T.P. 1994. Catastrophes, phase-shifts, and large-scale degradation of a Caribbean coral-reef. Science, 265: 1547-1551. [ Links ]
Hughes, T.P., M.J., Rodríguez, D.R., Bellwood, D., Ceccarelli, O., Hoegh-Guldberg, and L., McCook. 2007. Phase shifts, herbivory, and the resilience of coral reefs to climate change. Curr. Biol., 17: 360-365. [ Links ]
Hughes, T.P., N., Graham, J., Jackson, P., Mumby, and P., Steneck. 2010. Rising to the challenge of sustaining coral reef resilience. Trends Ecol. Evol., 11: 633-642. [ Links ]
Hughes, T.P., J.T., Kerry, M., Álvarez-Noriega, J.G., Álvarez-Romero, K.D., Anderson, A.H., Baird, R.C., Babcock, et al. 2017. Global warming and recurrent mass bleaching of corals. Nature, 543: 373-377. https://doi.org/10.1038/nature21707 [ Links ]
Hughes, T.P., K.D., Anderson, S.R., Connolly, S.F., Heron, J.T., Kerry, J.M., Lough, A.H., Baird, J.K., Baum, M.L., Berumen, T.C., Bridge, D.C., Claar, C.M., Eakin, J.P., Gilmour, N.A.J., Graham, H., Harrison, J.P.A., Hobbs, A.S., Hoey, M., Hoogenboom, R.J., Lowe, M.T., McCulloch, J.M., Pandolfi, M., Pratchett, V., Schoepf, G., Torda, and S.K., Wilson. 2018. Spatial and temporal patterns of mass bleaching of corals in the Anthropocene. Science, 359: 80-83. https://doi.org/10.1126/science.aan8048 [ Links ]
Hurtado, N. 2015. Understanding coral growth: in situ and ex situ experiments with Caribbean species for restoration purposes. Tesis Mg. Cienc. Mar., Univ. Jorge Tadeo Lozano, Santa Marta. 122 p. [ Links ]
HYSER. 2014. Caracterización de los ecosistemas marinos en el Golfo de Morrosquillo. Monitoreo año 2013. Informe final, Coveñas. 310 p. [ Links ]
Invemar. 2005. Monitoreo de corales en el golfo de Morrosquillo. Informe final, Ecopetrol, Cúcuta. [ Links ]
Jackson, J.B.C., M.K., Donovan, K.L., Cramer, and V.V., Lam. 2014. Status and trends of Caribbean coral reefs: 1970-2012. Global Coral Reef Monitoring Network, IUCN, Gland, Switzerland. 254 p. [ Links ]
Knowlton, N., and J.B.C., Jackson. 2008. Shifting baselines, local impacts, and global change on coral reefs. PLoS Biol., 6: 215-220. [ Links ]
Liu, G., C.M., Eakin, M., Chen, A., Kumar, J.L., de la Cour, S.F., Heron, E.F., Geiger, W.J., Skirving, K.V., Tirak, and A.E., Strong. 2018. Predicting heat stress to inform reef management: NOAA Coral Reef Watch’s 4-month coral bleaching outlook. Front. Mar. Sci., 5(57). https://doi.org/10.3389/fmars.2018.00057. [ Links ]
López-Victoria, M., y J.M., Díaz. 2000. Morfología y estructura de las formaciones coralinas del archipiélago de San Bernardo, Caribe colombiano. Rev. Acad. Colomb. Cienc., 24(91): 219-230. [ Links ]
Martínez-Viloria, H.M., L.A., Martínez-Whisgman, A., Vargas-Pineda y J.C., Narváez-Barandica. 2011. Efectos de la pesca sobre los recursos hidrobiológicos del Parque Nacional Natural Corales del Rosario y de San Bernardo. 273-289. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
McClanahan, T., and N., Mutinga. 1998. An ecological shift in a remote coral atoll of Belize over 25 years. Environ. Conserv., 25(2): 122-130. [ Links ]
Mendoza, J., L.A., Castro, P., Herrón, C., Montaño y F., Castro. 2011. Características de la actividad turística. 305-318. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Navas-Camacho, R., J., Vega-Sequeda, K., Gómez-Campo, T., López-Londoño, D., Gil-Agudelo, L., Muñoz-Escobar, J., Rojas y D.L., Duque. 2011. El “Sistema Nacional de Monitoreo de Arrecifes Coralinos en Colombia-SIMAC” en el Parque Nacional Natural Corales del Rosario y San Bernardo: 1998-2009. 330-350. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
NOAA Coral Reef Watch. 2020. Caribbean 5 km regional virtual station time series data. Colombia Atlantic (version 3.1). https://coralreefwatch.noaa.gov/product/vs/data/colombia_atlantic.txt.06/07/2020. [ Links ]
Oliver, J.K., R., Berkelmans, and C.M., Eakin. 2018. Coral bleaching in space and time. 27-49. In: van Oppen, M. and J., Lough (Eds). Coral Bleaching. Patterns, processes, causes and consequences. Volume 233. Springer, Switzerland. https://doi.org/10.1007/978-3-319-75393-5_3 [ Links ]
Ordosgoitia, Y., y E., Zarza-González. 2011. Características de la comercialización de material biológico marino para la elaboración de artesanías y venta de recordatorios. 290-304. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Patiño, F y F. Flores. 1993. Estudio ecológico del Golfo de Morrosquillo. Universidad Nacional de Colombia y Fondo FEN-Colombia, Bogotá. 295 p. [ Links ]
Pizarro, V., V. Carrillo y A. García-Rueda. 2014. Revisión y estado del arte de la restauración ecológica de arrecifes coralinos. Biota Colomb., 15(Supl. 2): 132-149. [ Links ]
Prahl, H.V., y H., Erhardt . 1985. Colombia, corales y arrecifes Coralinos. Fondo FEN-Colombia, Bogotá. 295 p. [ Links ]
Porter, J., P., Dustan, W., Jaap, K., Patterson, V., Kosmynin, O., Meier, M., Patterson, and M., Parsons. 2001. Patterns of spread of coral disease in the Florida Keys. Hydrobiologia, 460: 1-24. [ Links ]
Pujos, M., J. L., Pagliardini, R., Steer, G., Vemette y O., Weber. 1986. Influencia de la contra-corriente norte colombiana para la circulación de las aguas en la plataforma continental su acción sobre la dispersión de los efluentes en suspensión del río Magdalena. Bol. Cient. CIOH, 6: 3-15. [ Links ]
Ramírez, A. 1990. Monitoreo de los ecosistemas coralinos del golfo de Morrosquillo y el archipiélago de San Bernardo. Fase II. Informe final, Ecopetrol-DCC, Cúcuta. [ Links ]
Ramírez, A. 1992. Los ecosistemas coralinos del archipiélago de San Bernardo. Golfo de Morrosquillo, mar Caribe. Informe final, Ecopetrol-DCC, Cúcuta. [ Links ]
Ramírez, A. 2000. Monitoreo de Corales en el golfo de Morrosquillo. Informe final, contrato Ecopetrol DCC-4AMT-47200-99-0007, Cúcuta. [ Links ]
Ramírez, A. 2010. Monitoreo de Corales en el golfo de Morrosquillo. Informe final, contrato Ecopetrol N.° 4027656, Bogotá. 119 p. [ Links ]
Raymundo, L., C., Couch, and C., Harvell. 2008. Coral disease handbook: guidelines for assessment monitoring and management. Coral Reef Targeted Research and Capacity Building for Management Program, Melbourne, Australia. 121 p. [ Links ]
Rodríguez-Ramírez, A., C., Bastidas, S., Rodríguez, Z., Leão, R., Kikuchi, M., Oliviera, D., Gil, J., Garzón-Ferreira, M.C., Reyes-Nivia, R., Navas-Camacho, N., Santodomingo, G., Díaz-Pulido, D., Venera-Pontón, L., Flórez-Leiva, A., Rangel-Campo, C., Orozco, J. C., Márquez, S., Zea, M., López-Victoria, J.A., Sánchez, and M.C., Hurtado. 2008. The effects of coral bleaching in Southern Tropical America: Brazil, Colombia, and Venezuela. 105-114. In: Wilkinson, C. and D., Souter (Eds). Status of Caribbean Coral Reefs after Bleaching and Hurricanes in 2005. Global Coral Reef Monitoring Network and Reef and Rainforest Research Centre, Townsville, Australia. 148 p. [ Links ]
Rodríguez-Ramírez, A., M.C., Reyes-Nivia, S., Zea, R., Navas-Camacho, J., Garzón-Ferreira, S., Bejarano, P., Herrón, and C., Orozco. 2010. Recent dynamics and condition of coral reefs in the Colombian Caribbean. Rev. Biol. Trop., 58(Suppl. 1): 107-131. [ Links ]
Stoddart, D. 1969. Ecology and morphology of recent coral reefs. Biol. Rev. Cambridge Phil. Soc., 44: 433-498. [ Links ]
Sutherland, K., J., Porter, and C., Torres. 2004. Diseases and immunity in Caribbean and Indo-Pacific zooxanthellate corals. Mar. Ecol. Prog. Ser., 266: 273-302. [ Links ]
Vega-Sequeda, J., S., Zea y G., Bernal. 2017. Efectos de eventos oceánicos extremos en formaciones coralinas de islas del Rosario, Caribe colombiano. Cicimar Oceánides, 32(1): 25-38. [ Links ]
Werding, B., y H., Sánchez. 1979. Informe faunístico y florístico de las islas del Rosario en la costa norte de Colombia. Situación general y estructuras arrecifales. An. Inst. Invest. Mar. Punta Betín, 11: 7-20. [ Links ]
Wilkinson, C., and D., Souter. 2008. Status of Caribbean coral reefs after bleaching and hurricanes in 2005. Global Coral Reef Monitoring Network y Reef and Rainforest Research Centre, Townsville. 148 p. [ Links ]
Wooldridge, S., T., Done, R., Berkelmans, R., Jones, and P., Marshall. 2005. Precursors for resilience in coral communities in a warming climate: a belief network approach. Mar. Ecol. Prog. Ser., 295: 157-169. https://doi.org/10.3354/meps295157 [ Links ]
Zarza-González, E. 2011. El Parque Nacional Natural Corales del Rosario y San Bernardo. 8-11. En: Zarza-González, E. (Ed). El entorno ambiental del Parque Nacional Natural Corales del Rosario y de San Bernardo. Ministerio de Medio Ambiente y Desarrollo Sostenible, Parques Nacionales Naturales de Colombia, Banco Mundial - GEF, Patrimonio Natural - Fondo para Biodiversidad y las Áreas Protegidas, Cartagena de Indias, Colombia. 416 p. [ Links ]
Zea, S. 1991. Establecimiento de estaciones base para monitorear el efecto de condiciones naturales y de origen humano en comunidades coralinas de Santa Marta y Parque Nacional Natural Tayrona. Informe final, Invemar, Santa Marta. 62 p. [ Links ]
Recibido: 09 de Agosto de 2020; Aprobado: 01 de Noviembre de 2020





![Diet and trophic niche breadth of the neotropical cormorant [Nannopterum brasilianus (Gmelin, 1789)] in the Flora and Fauna Sanctuary Ciénaga Grande de Santa Marta, Caribbean Colombia](/img/en/next.gif)





 text in
text in