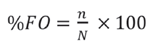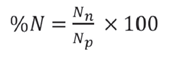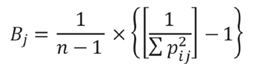Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 supl.1 Santa Marta Dec. 2020 Epub Sep 04, 2021
https://doi.org/10.25268/bimc.invemar.2020.49.suplesp.1072
Artículos de Investigación
Dieta y amplitud del nicho trófico del cormorán neotropical [Nannopterum brasilianus (Gmelin, 1789)] en el Santuario de Flora y Fauna Ciénaga Grande de Santa Marta, Caribe de Colombia
1Universidad del Magdalena, Santa Marta, Colombia.
2Santuario de Flora y Fauna Ciénaga Grande de Santa Marta, Parques Nacionales Naturales de Colombia, Ciénaga, Colombia. aristideslpz@gmail.com
3Dirección Territorial Caribe, Parques Nacionales Naturales de Colombia, Santa Marta, Colombia. rebeca.franke@parquesnacionales.gov.co
4Universidad del Magdalena, Santa Marta, Colombia. gieep@unimagdalena.edu.co
The neotropical cormorant (Nannopterum brasilianus) is a piscivorous bird with colonial nesting. It is distributed from southern North America to Argentina. The largest colony of N. brasilianus in Colombia is located in the locality of Punta Blanca, in the Flora and Fauna Sanctuary Ciénaga Grande de Santa Marta (FFS CGSM), in the lagoon complex with same name (LC CGSM). The diet and niche width of N. brasilianus were analyzed from pellets collected on the western edge of the Punta Blanca nesting colony during the breeding season of 2017. Prey identification was based on mainly on the morphology of the fish otoliths found in these pellets (n = 64). There were eight fish species identified in the diet of N. brasilianus of which three are new records for the diet of the population of the lagoon complex (Mugil liza, M. curema y M. cephalus). It is highlighted the representativeness of Cathorops mapale is reported, as the main prey consumed during the study (89.5 % in number and 91.8% in frequency of occurrence). A narrow trophic niche breadth was observed (Levin’s 0.002) and a diet with low equitability (q2 = 2.1), which corresponds to an adaptive response modeled by the availability of prey.
KEY WORDS: acuatic birds; swamps; coastal ecosystems; Phalacrocoracidae
El cormorán neotropical (Nannopterum brasilianus) es un ave piscívora con reproducción colonial. Se distribuye desde el sur de Norteamérica hasta Argentina. La colonia más grande en Colombia se encuentra en la localidad de Punta Blanca, localizada en el Santuario de Flora y Fauna Ciénaga Grande de Santa Marta (SFF CGSM), en el complejo lagunar del mismo nombre (CL CGSM). En el presente estudio se analizó la dieta y la amplitud de nicho de N. brasilianus a partir de egagrópilas recolectadas en el borde occidental de la colonia de anidación de Punta Blanca durante la época reproductiva de 2017. La identificación de presas se basó principalmente en la morfología de los otolitos de peces encontrados en las egagrópilas (n = 64). Se identificaron ocho especies de peces en la dieta de N. brasilianus, de las cuales tres fueron nuevos registros para la dieta de la población del complejo lagunar (Mugil liza, M. curema y M. cephalus). Se destacó la representatividad de Cathorops mapale como principal presa consumida durante el estudio (89,5 % en número y 91,8 % en frecuencia de ocurrencia). Se observó una amplitud de nicho trófico estrecha (Levin’s de 0,002) y una dieta con baja equitatividad (q2 = 2,1), lo que corresponde a una respuesta adaptativa modelada por la disponibilidad de presas.
PALABRAS CLAVES: aves acuáticas; ciénagas; ecosistemas costeros; Phalacrocoracidae.
INTRODUCCIÓN
El sitio Ramsar Sistema Delta Estuarino del río Magdalena o complejo lagunar Ciénaga Grande de Santa Marta (CL CGSM) alberga altas concentraciones de aves acuáticas tanto residentes como migratorias, por lo que ha sido categorizado como un área de importancia para la conservación de las aves (Ruiz-Guerra et al., 2008; BirdLife International, 2018). En su interior existen dos áreas protegidas de carácter nacional administradas por Parques Nacionales Naturales de Colombia: el Vía Parque Isla de Salamanca (VIPIS) y el Santuario de Flora y Fauna Ciénaga Grande de Santa Marta (SFF CGSM).
El CL CGSM ha sido afectado desde finales de 1960 por acciones humanas tanto en su interior como en sus afluentes, generando un desequilibrio hidrológico del sistema, la pérdida de bosque de manglar y la reducción de las poblaciones de peces, moluscos y crustáceos, los cuales juegan un papel fundamental en el funcionamiento del ecosistema y sustentan la pesquería artesanal, de la que dependen diferentes poblaciones locales (Botero y Salzwedel, 1999; Sánchez-Ramírez y Rueda, 1999; Lorenz y Serafy, 2006). Si bien se han realizado obras de rehabilitación hídrica, siguen presentándose afectaciones dentro del sistema (Invemar, 2019). Esta situación es percibida por los pobladores locales y por diferentes actores vinculados al sistema como la causante de una disminución en aproximadamente la mitad de los servicios ecosistémicos del humedal, lo cual amerita mayores esfuerzos de conservación (Vilardy et al., 2012; Invemar, 2019).
Los estudios de ecología trófica son cruciales para la conservación de ecosistemas amenazados, debido a que proporcionan información importante sobre el rol funcional de las especies y sus hábitats (Bó et al., 2007). Entre los aspectos más importantes de la ecología trófica se encuentra la composición dietaría, la partición de recursos tróficos y la amplitud de nicho alimentario, ya que permiten incrementar el conocimiento sobre las interacciones tróficas de un depredador con sus presas y sus implicaciones en la conservación y preservación de las especies y del ecosistema (López-Calleja, 1995; Bó et al., 2007). Estos aspectos pueden variar con la abundancia de las presas, hábitats y/o sitios geográficos y pueden ser modelados, entre otros, con la teoría de forrajeo óptimo, que predice un aumento en la amplitud de nicho y en la diversidad de presas frente a la reducción en la disponibilidad de sus presas más optimas y una mayor especificidad al aumentar la disponibilidad de estas (Valdovinos et al., 2010; Román-Palacios y Román-Valencia, 2015). En cormoranes los estudios de ecología trófica aportan bases para comprender su rol en los ecosistemas acuáticos, su influencia en la comunidad íctica y su interacción con poblaciones de pescadores (Dias et al., 2012).
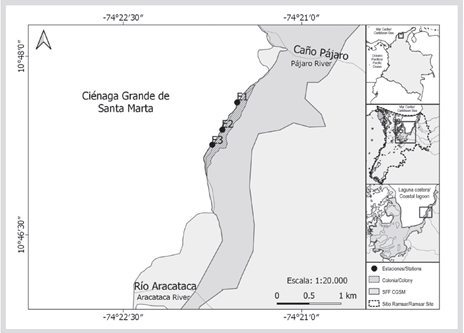
La principal colonia reproductiva del cormorán neotropical (Nannopterum brasilianus) de Colombia está ubicada en el CL CGSM, al noroccidente del SFF CGSM (Figura 1). Se estima que esta colonia puede superar los 30 000 individuos (Ruiz-Guerra et al., 2008; Ruiz-Guerra et al., 2012). Estudios tróficos previos han determinado que N. brasilianus es un ave piscívora y generalista, que se alimenta mediante buceo y zambullida en medios marinos, dulceacuícolas y estuarinos (Gil de Weir et al., 2011; Conde-Tinco y Iannacone, 2013). Esta especie elimina las partes de las presas que no puede digerir, regurgitando egagrópilas generalmente una vez al día (Orta, 1992; Zijlstra y Van-Eerden, 1995).
El cormorán presenta una alta plasticidad que le permite adaptarse a la disponibilidad de presas, observándose casos como el del lago Dos Patos (Brasil) donde, siendo una especie generalista, cambia su estrategia a especialista durante una parte del año, condición que Barquete et al. (2008) llamaron “especialización temporal”. A la fecha se han reconocido como parte de la dieta del cormorán neotropical los peces óseos bentónicos o mesopelágicos de las familias Ariidae, Engraulidae, Sciaenidae, Mugilidae y Gerreidae (Barquete et al., 2008; Muñoz et al., 2008; Gil de Weir et al., 2011). El único antecedente de la dieta de N. brasilianus en el CL CGSM fue realizado por Hennig (1997), cuyo estudio coincidió con las acciones de rehabilitación en el complejo lagunar de 1995-1999 y los eventos de muerte masiva de peces de 1994-2000.
El conocimiento sobre la ecología trófica de N. brasilianus dentro el CL CGSM es importante considerando su tamaño poblacional y su rol como depredador de peces, lo que le confiere influencia en la estructura y función de los humedales (Smith y Smith, 2001; Begon et al., 2005). El presente estudio pretender aportar información de la ecología trófica de N. brasilianus durante su periodo de nidación en el CL CGSM en 2017. Para ello se revisó la composición taxonómica de la dieta, la amplitud de nicho alimentario, la riqueza de presas, la diversidad trófica y la equitatividad de presas. Los resultados obtenidos se analizaron en el contexto de estudios previos realizados en Latinoamérica.
ÁREA DE ESTUDIO
La colonia reproductiva de N. brasilianus se encuentra ubicada en el sector nororiental del SFF CGSM, entre la desembocadura del río Aracataca y la desembocadura de caño Pájaro (Figura 1). El clima del CL CGSM es tropical árido, ya que la acción de los vientos alisios al norte de los 10° N es suficiente durante todo el año para inhibir en gran medida las precipitaciones, presentándose temperaturas promedio anuales entre 27° y 30 °C en la columna de agua y una humedad relativa entre 50-100 % (Andrade-Amaya, 2000; Blanco et al., 2006). El régimen anual de lluvias varía entre 401 y 1321 mm, con un promedio de 897 mm/año, el cual se distribuye en un patrón climático unimodal con un periodo de vientos entre diciembre y abril, y un periodo de calmas, en el cual se observan las precipitaciones de mayo a noviembre, teniendo un máximo de pluviosidad entre septiembre y noviembre (Blanco et al., 2006; García et al., 2013).
MATERIALES Y MÉTODOS
Fase de campo
El muestreo se efectuó semanalmente entre mayo (cuatro semanas) y junio (dos semanas) de 2017 coincidiendo con el periodo reproductivo de N. brasilianus en ese año. Se visitaron tres estaciones de muestreo entre las 9 y 11 a. m., seleccionadas previamente por su accesibilidad y disposición de material para recolectar, evitando estresar a las aves según lo proponen Olmos et al. (2000) y Petraci et al. (2009). La recolección de egagrópilas se realizó manualmente con ramas, hojas y raíces de mangle, con el esfuerzo de dos recolectores durante 30-35 min por sitio. Las egagrópilas se guardaron en seco dentro de bolsas con sello hermético, rotuladas externamente con sellos adhesivos e internamente con etiquetas de papel pergamino, y se refrigeraron por menos de dos horas hasta ser llevadas a procesar en el laboratorio.
Fase de laboratorio
Las egagrópilas se lavaron con etanol al 70 % y se desintegraron con la ayuda de pinzas y lancetas para separar los restos óseos como mandíbulas, otolitos, vértebras y demás restos del material. Las estructuras óseas encontradas se lavaron y almacenaron en etanol al 70 % (Olmos et al., 2000). Los otolitos de peces óseos se utilizaron para la identificación del componente íctico hasta el nivel taxonómico más bajo posible utilizando diferentes guías de identificación (Abilhoa y Correa, 1992; Volpedo y Echeverría, 2000; Hernández-García et al., 2004; Martínez et al., 2007; Espino-Barr et al., 2013) y las bases de datos de otolitos Anàlisi de FORmes d’Otòlits (AFORO) y COSS-BRASIL (Lombarte et al., 2006; Rossi-Wongtschowski et al., 2016). El trabajo de caracterización de otolitos de Rossi-Wongtschowski et al. (2016) fue utilizado para la descripción de los otolitos tipo sagitta. La descripción de los otolitos tipo asteriscus se basó en Assis (2003) y para los otolitos tipo lapillus se basó en Assis (2005). Para las descripciones de los otolitos se utilizó un microscopio estereoscópico Leica M205A y se fotografiaron con una cámara integrada Leica DFC450.
Análisis de datos
Para evaluar la representatividad o completitud de la muestra, estimado como la cobertura de muestreo según Chao et al. (2014), se empleó el estimador (Ĉind). Dicho análisis se realizó mediante el paquete estadístico iNEXT, en el entorno de programación RStudio V.1.3.959 (Hsieh et al., 2016; RStudio, 2020). Para ello se tomó como unidad de muestreo cada egagrópila, asumiendo que cada ave arroja generalmente una egagrópila en la mañana antes del forrajeo (Orta, 1992; Zijlstra y Van-Eerden, 1995). Para determinar la composición alimentaria de la dieta se utilizaron dos medidas relativas de cuantificación de presas, detalladas por Hureau (1970) e Hyslop (1980) para el análisis de contenidos estomacales:
(1) Frecuencia de ocurrencia (%FO), que expresa el porcentaje de ocurrencia de cada una de las presas y se calculó como:
Donde:
n es el número de egagrópilas en las que estuvo presente la presa i, y
N es el número total de egagrópilas observadas.
(2) Porcentaje en número (%N), que explica la proporción numérica de cada presa presente en relación al total de individuos de todas las presas y se calculó como:
Donde:
N n es el número de individuos de la presa i encontrados en la egagrópila j, y
N p es el número total de individuos de todas las presas encontrados en todas las egagrópilas.
Para calcular la amplitud del nicho trófico se usó el índice de Levins Estandarizado (B j ), a partir de la medición de la uniformidad en los individuos consumidos. Los valores de B j oscilan entre 0 y 1, siendo los valores superiores a 0,6 propios de especies generalistas, mientras que valores inferiores corresponden a especies especialistas (Krebs, 1989). Su ecuación es:
Donde:
n es el número de ítems presa consumidos por la especie, y
p es la probabilidad de hallar el ítem (i) en la muestra (j).
La riqueza de especies en la dieta, diversidad trófica y equitatividad de las presas se calcularon con los números Hill. Estos son una medida de diversidad que permite una interpretación unificada e intuitiva en unidades de especies efectivas con base en datos de abundancia relativa (Jost, 2006). Para la estimación de los números Hill se utilizó el modelo propuesto por Chao et al. (2014) para datos de frecuencia de incidencia incluido en la función “iNEXT()” del paquete iNEXT (Hsieh et al., 2016). Los números Hill presentan un exponente q que determina su sensibilidad a la frecuencia de incidencia, siendo q= 0 equivalente a la riqueza de especies, q= 1 a la diversidad y q= 2 la equitatividad (Hill, 1973; Chao et al., 2014).
RESULTADOS
Se colectó un total de 76 egagrópilas, en las cuales se encontraron restos de peces, moluscos y crustáceos, con un promedio de 4,4 ± 2,8 peces por egagrópila (Figura 2). La cobertura de la muestra (Ĉind = 0,94, IC = 0,95) indicó que los resultados fueron representativos de la dieta de N. brasilianus para el periodo de mayo-junio del 2017. El intervalo de confianza mostró que la probabilidad de encontrar una nueva especie si se agregara una nueva egagrópila a la muestra es de 0,06 (1-Ĉind) (Figura 3).

Figura 2 A) Egagrópilas de Nannopterum brasilianus sobre una raíz de Rhizophora mangle, L. B) Estructuras duras de las presas de N. brasilianus y parásitos que se observaron en una egagrópila procesada en laboratorio.

Figura 3 Curva de muestreo basada en la rarefacción (líneas continuas) y extrapolación (líneas punteadas) de la cobertura del muestreo de egagrópilas de Nannopterum brasilianus en la colonia de Punta Blanca, con intervalos de confianza del 95 % (áreas sombreadas) recolectadas en mayo y junio de 2017.
En las egagrópilas se encontraron restos de material no digerido de tres grupos: i) crustáceos, representado por un exoesqueleto; ii) moluscos, representado por una valva de bivalvo, y iii) peces teleósteos, representados por espinas, vertebras, aletas, cráneos y otolitos. Del total de egagrópilas recolectadas, se encontraron otolitos en 64 (84,2 %) identificando ocho morfoespecies, cinco a nivel de especie, dos a nivel de género y una a nivel de familia (Figura 4).

Figura 4 Otolitos encontrados en egagrópilas de Nannopterum brasilianus. (1-2) Otolito tipo lapillus de Cathorops mapale. (3-4) Otolito tipo lapillus de Ariopsis sp. (5-6) Otolito tipo sagitta de Anchovia sp. (7-8) Otolito tipo sagitta de Mugil liza. (9-10) Otolito tipo sagitta de Mugil curema. (11-12) Otolito tipo sagitta de Mugil cephalus. (13-14) Otolito tipo sagitta de Bairdiella ronchus. (15-16) Otolito tipo sagitta de Sciaenidae sp. Los otolitos están dispuestos con el borde dorsal hacia la parte superior de la imagen, excepto en las imágenes 8 y 10 donde el borde dorsal se dispone hacia abajo. La región anterior se señala con la letra A).
En cuanto a la frecuencia de ocurrencia, la familia Ariidae presentó los valores más altos (92,5 %FO), seguido de Mugilidae (17,9 %FO). A nivel de especie, Cathorops mapale (Ariidae) se destacó por su presencia en gran parte de las egagrópilas (92,1 %FO) (Tabla 1). En cuanto al porcentaje en número, se observó un total de 275 individuos presa en las muestras, la mayoría pertenecientes a la familia Ariidae, seguido de lejos por Mugilidae y Engraulidae (93,7, 4,9 y 0,4 %N, respectivamente). La especie con mayor representatividad en número fue C. mapale (89,5 %N), seguida de Mugil liza (Mugilidae) con un 2,2 %N. La amplitud del nicho estimada para Nannopterum brasilianus mostró un comportamiento especialista (Bj= 0,02) mientras que la riqueza de especies en la dieta (q = 0) fue de un número efectivo de 12 especies igualmente frecuentes, la diversidad trófica (q = 1) fue 3,9 y la equitatividad (q = 2) fue de 2,1.
DISCUSIÓN
La completitud de los muestreos es un parámetro importante a la hora de realizar comparaciones entre diferentes estudios (Chao et al., 2014). Sin embargo, las investigaciones revisadas sobre la dieta de N. brasilianus en Latinoamérica no precisan esta información (Tabla 2). En este sentido, los resultados obtenidos en el presente estudio pueden servir de línea base para futuras investigaciones que deseen evaluar con mayor certeza diferencias espaciales y temporales en la ecología trófica de la especie, especialmente cuando se tienen periodos o coberturas espaciales limitadas como en este estudio.
Tabla 2 Familias de peces encontradas en la dieta del cormorán neotropical en otras regiones de Suramérica y en la Ciénaga Grande de Santa Marta (CGSM). %N: frecuencia numérica. %FO: frecuencia de ocurrencia.
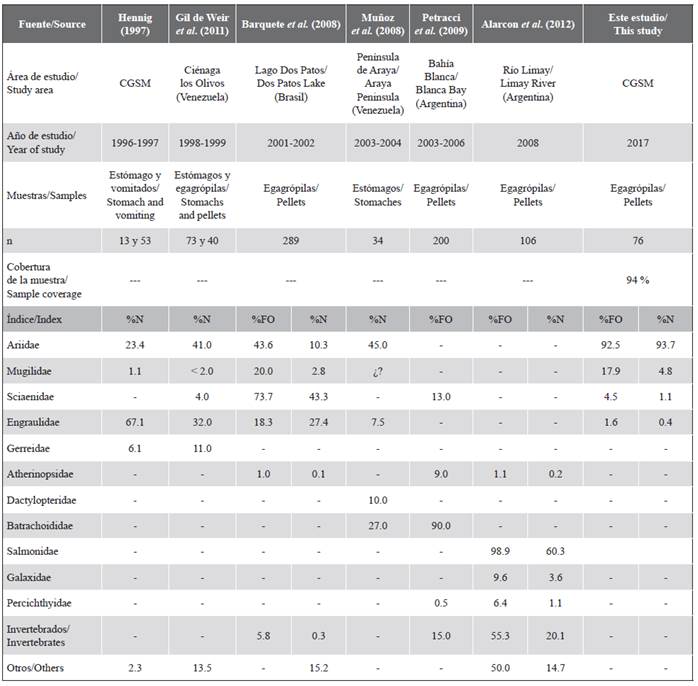
La dieta de N. brasilianus estuvo representada por peces bentónicos y demersales mientras que los moluscos y crustáceos se consideraron como ingesta indirecta, conforme a lo registrado en otros estudios (Regidor y Terroba, 2001; Barquete et al., 2008; Muñoz et al., 2008; Petracci et al., 2009). La familia Ariidae estuvo representada por dos especies en la dieta del cormorán, que significaron casi su totalidad tanto en frecuencia de ocurrencia como en porcentaje en número. Esta familia de peces tiene hábitos de vida bentónicos, ideales para el tipo de captura por buceo, característico de los cormoranes (Mejía-Ladino et al., 2002; Barquete et al., 2008). Los resultados corroboran la importancia de esta familia de peces en la dieta del cormorán neotropical, registrada en otros países tropicales como Brasil y Venezuela (Tabla 2).
El registro relativamente alto de C. mapale en la dieta del cormorán neotropical durante este estudio coincidió con los altos desembarcos pesqueros registrados para C. mapale en el CL CGSM durante el mes de mayo de 2017, cuando fue la segunda especie más capturada con un total de 330,5 toneladas (Invemar, 2020). Por su lado, Hening (1997) registró que la dieta de N. brasilianus durante la reproducción en agosto del 1996 estuvo dominada en un 92,99 % por individuos pertenecientes a la subfamilia Engraulidae (Anchovia clupeoides y Cetengraulis edentulus). Sin embargo, estas especies representaron menos del 1 % de las capturas registradas en el CL CGSM en ese mismo año. No obstante, Manjarrés et al. (2007) registraron que C. edentulus fue la especie más importante en los desembarcos pesqueros provenientes del área marina adyacente al CL CGSM, entre 1994 y 1998, siendo especialmente abundante en 1996 cuando se estimaron capturas de aproximadamente 484 toneladas. Esto indica que los individuos de N. brasilianus pertenecientes a la colonia ubicada al nororiente del SFF CGSM pueden alimentarse en el mar Caribe, en busca de individuos que tengan los tamaños adecuados para ser consumidos.
Es importante mencionar que el presente estudio, aunque complementario, no es comparable con el de Hennig (1997). Esto se debe principalmente a que ese autor analizó estómagos y vomitados durante condiciones climáticas influenciadas por una fase cálida del evento El Niño Oscilación Sur (ENOS), mientras que en el presente estudio se analizaron egagrópilas durante una fase neutral del ENOS (NOAA, 2020). En efecto, para el CL CGSM se ha registrado que el ENOS incide en la abundancia de las especies de peces e invertebrados capturadas por la flota pesquera artesanal (Invemar, 2019).
La importancia numérica de la familia Mugilidae en la dieta de N. brasilianus fue más significativa que en otros estudios; sin embargo, en términos de ocurrencia fue similar a Barquete et al. (2008) (Tabla 2). Esto corrobora la importancia de los mugilidos en la dieta de la familia Phalacrocoracidae, donde son presas recurrentes (Jahncke y Goya, 1997; Olmos et al., 2000). Cabe mencionar que Hennig (1997) identificó en la dieta del cormorán sólo una especie de esta familia (M. incilis), mientras que en el presente estudio se lograron identificar tres especies (M. liza, M. curema, y M. cephalus), cuyas dietas están dominadas por la producción primaria del complejo lagunar (detritos, diatomeas y sedimentos inorgánicos), por lo que desempeñan un rol importante en la transferencia de energía del sistema estuarino hacia los cormoranes (Jacot, 1920; Osorio, 1988).
Los peces de la familia Sciaenidae tuvieron una contribución menor en la dieta de N. brasilianus, indicando un consumo esporádico, similar a otros estudios (Hennig, 1997; Olmos et al. 2000; Gil de Weir et al. 2011). Por el contrario, Barquete et al. (2008) encontraron que la familia Sciaenidae hizo la mayor contribución en número y ocurrencia, lo cual coincidió con la alta abundancia de Micropogonia furnieri (Desmarest, 1823) en aguas profundas y sitios con mayor influencia marina (Marín et al., 2013). Esto se explica porque la importancia de esta familia en la dieta del cormorán es mayor en poblaciones que habitan en ecosistemas marinos (Petracci et al., 2009).
La familia Engraulidae tuvo poca ocurrencia e importancia numérica en la dieta, en contraste con estudios previos que registran una contribución mayor de esta familia en la dieta de N. brasilianus (Tabla 2). La disminución en la población de Cetengraulis edentulus (Cuvier, 1829), inferida por la tendencia decreciente de sus desembarcos y la captura de juveniles, llevaron a que fuese categorizada como casi amenazada en la región (Duarte et al., 2017), lo cual plantea una reducción en su oferta como alimento para el cormorán. Respecto a Anchovia clupeoides (Swainson, 1839), Hennig (1997) registra una talla media de consumo de 14 cm (entre 10-20 cm), y la talla media de captura por pescadores se ha reducido de 19 cm (longitud total en 1999) a 12 cm (longitud total en mayo y junio de 2017) (Invemar, 2020). Esto sugiere que la explotación pesquera de A. clupeoides podría haber afectado la disponibilidad de las presas con tallas apetecibles para N. brasilianus.
Con base en estudios de ecología trófica, se ha considerado que N. brasilianus es una especie generalista u oportunista que selecciona sus presas en función de la disponibilidad y la cual aprovecha los recursos más abundantes y fáciles de capturar (Conde-Tinco y Iannacone, 2013; Ovegård, 2017). La amplitud de nicho observada en el presente estudio sugiere un hábito especialista, lo cual se corrobora con los valores de diversidad y equitatividad trófica. Sin embargo, al considerar la riqueza de especies en la dieta y en conformidad a lo registrado por Hennig (1997), podría ser un caso de “especialización temporal” como el descrito por Barquete et al. (2008) para el cormorán neotropical en el lago Dos Patos al sur de Brasil y moldeado por la teoría de forrajeo optimo (Valdovinos et al., 2010). Para especies de cormoránes, se conoce que la puesta y la eclosión de los huevos son asíncronas y están probablemente relacionadas con la oferta de alimentos más disponibles y parecen permitir una respuesta rápida a las condiciones ambientales (Siegel-Causey, 1997). Este caso de la relación entre el éxito reproductivo y la oferta alimentaria se ha observado en otras aves piscívoras, como el caso de los pelícanos y su éxito reproductivo debido a los eventos de surgencia de aguas frías temporales que concentran agregaciones de peces presa en meses de manera predecible (Pelecanus occidentalis en México: Hernández-Vázquez et al., 2011; en Panamá: Martínez, 1983; en Gorgona: Falk-Fernández, 1993).
CONCLUSIONES
Nannopterum brasilianus presentó un hábito alimentario especializado durante su anidación del año 2017, pero los valores de riqueza en la dieta y los antecedentes sugieren que es un ave generalista y lo observado corresponde a una respuesta adaptativa moldeada por la disponibilidad de presas. Sin embargo, se requieren estudios más amplios en tiempo y espacio para corroborar lo planteado.
El uso de egagrópilas en el estudio de la dieta del cormorán es un método informativo, poco invasivo y no letal, pero presenta desafíos para su implementación optima en el CL CGSM, como es la ausencia de registros de otolitos de las presas potenciales presentes en el ecosistema, así como análisis de correlación entre el tamaño de los otolitos y las tallas de los peces. Debido a que no se cuentan con dichos insumos, no se pudieron identificar todos los componentes de la riqueza de presas, ni calcular las tallas de las presas consumidas.
AGRADECIMIENTOS
Los autores agradecen al SFF CGSM y a la Dirección Territorial Caribe de Parques Nacionales Naturales de Colombia (DTCA) por el apoyo técnico, logístico y administrativo ofrecido durante el transcurso de la investigación. También agradecen al grupo de investigación Evaluación y Ecología Pesquera de la Universidad del Magdalena (GIEEP) por facilitar sus laboratorios y equipos para el procesamiento de las muestras y a la Asociación para el Estudio y la Conservación de las Aves Playeras de Colombia (Calidris) por sus aportes durante la fase inicial de la investigación.
REFERENCIAS
Abilhoa, V. y M.F.M., Correa. 1992. Catálogo de otólitos de Carangidae (Osteichthyes-Perciformes) do litoral do Estado do Paraná, Brasil. Nerítica, 7(1-2):119-131. [ Links ]
Andrade-Amaya, C.A. 2000. The circulation and variability of the Colombian Basin in the Caribbean Sea. Tesis Ph. D., Univ. Wales. 223p. [ Links ]
Assis, C.A. 2003. The Lagenar otoliths of teleosts: their morphology and its application in species identification, phylogeny and systematics. J. Fish Biol., 62(6): 1268-1295. [ Links ]
Assis, C.A. 2005. The utricular otoliths, lapilli, of teleosts: their morphology and relevance for species identification and systematics studies. Sci. Mar., 69(2): 259-273. [ Links ]
Barquete, V., L., Bugoni ,y C.M. ,Vooren. 2008. Diet of Neotropic cormorant (Phalacrocorax brasilianus) in an estuarine environment. Mar. Biol., 153(3): 431-443. [ Links ]
BirdLife International. 2018. Important bird areas factsheet: Ciénaga Grande, isla de Salamanca and Sabana Grande Ramsar Biosphere Reserve. http://www.birdlife.org.17/07/2020. [ Links ]
Blanco, J.A., E.A., Viloria, and J.C., Narváez. 2006. ENSO and salinity changes in the Ciénaga Grande de Santa Marta coastal lagoon system, Colombian Caribbean. Estuar. Coast Shelf Sci., 66(1-2): 157-167. [ Links ]
Bó, M., A. ,Baladrón y L., Biondi. 2007. Ecología trófica de falconiformes y strigiformes: tiempo de síntesis. Hornero, 22(2): 97-115. [ Links ]
Botero, L. y H., Salzwedel. 1999. Rehabilitation of the Ciénaga Grande de Santa Marta, a mangrove-estuarine system in the Caribbean coast of Colombia. Ocean Coast Manage., 42(2-4): 243-56. [ Links ]
Chao, A., N.J. ,Gotelli, T.C. ,Hsieh, E.L. ,Sander, K.H., Ma, R.K. ,Colwell, and A.M., Ellison. 2014. Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecol. Monogr., 84(1): 45-67. [ Links ]
Conde-Tinco, M.A. y J., Iannacone. 2013. Bioecología de Phalacrocorax brasilianus (Gmelin, 1789) (Pelecaniformes: Phalacrocoracidae) en Sudamérica. Biologist, 11(1): 151-166. [ Links ]
Dias, E., P., Morais, M., Leopold, J., Campos, and C., Antune. 2012. Natural born indicators: Great cormorant Phalacrocorax carbo (Aves: Phalacrocoracidae) as monitors of river discharge influence on estuarine ichthyofauna. J Sea Res, 73: 101-108. [ Links ]
Duarte, L.O., L., Manjarrés y J., Leal. 2017. Cetengraulis edentulus (Cuvier, 1829). En: Chasqui ,L., A. ,Polanco, A., Acero ,P. ,Mejía-Falla, A., Navia, L.A., Zapata, J.P., Caldas (Eds.). Libro rojo de los peces marinos de Colombia. Ser. Publ. Gener. Invemar, (93). Santa Marta. 552 p. [ Links ]
Espino-Barr, E., M., Gallardo-Cabello, E.G., Cabral-Solís, M., Puente-Gómez y A., García-Boa. 2013. Otoliths analysis of Mugil curema (Pisces: Mugilidae) in Cuyutlan lagoon, Mexico. Av Investig. Agropecu., 17(1): 35-64. [ Links ]
Falk-Fernández, P. 1993. Variación poblacional y aspectos del ciclo reproductivo del pelícano (Pelecanus occidentalis murphy) en el Parque Nacional Natural Gorgona. Tesis Biol., Univ. Valle. 71 p. [ Links ]
García, C.B., L.O. ,Duarte y G., Ramírez. 2013. Fisiografía y oceanografía del golfo de Salamanca (mar Caribe, Colombia). 111-140. En: Melgarejo, L.M. y C.B., García-Ramírez (Eds.). Investigación en ciencias del mar: aportes de la Universidad Nacional de Colombia. Universidad Nacional de Colombia, Bogotá. 200 p. [ Links ]
Gil de Weir, K., E., Weir, C.L., Casler y S., Aniyar. 2011. Ecological functions and economic value of the Neotropic cormorant (Phalacrocorax brasilianus) in Los Olivitos estuary, Venezuela. Environ. Dev. Econ., 16(5): 553-572. [ Links ]
Hennig, V. 1997. Investigaciones sobre la biología del cormorán o pato cuervo (Phalacrocorax brasilianus) en la Ciénaga Grande de Santa Marta, Colombia. Deutsche Gesellschaft für Technische Zusammenarbeit (GTZ), Alemania. 41 p. [ Links ]
Hernández-García, R., J.A., Martínez-Pérez, T.A., Bautista-López y J.M., Reséndiz-Rodríguez. 2004. Descripción morfológica de los otolitos de las familias Engraulidae, Haemulidae y Achiridae del sistema estuarino de Tecolutla, Veracruz. Rev. Zool., 15: 7-13. [ Links ]
Hernández-Vázquez, S., E., Iñigo-Elías, J.Á., Hinojosa Larios, B., Durand Martínez, J.A., Rojo-Vázquez y C., Valadez-González. 2011. Abundancia y reproducción del pelícano pardo (Pelecanus occidentalis) en dos pequeñas bahías del Pacífico central, México. Acta Zool. Mex., 27(2): 257-271. [ Links ]
Hill, M.O. 1973. Diversity and evenness: a unifying notation and its consequences. Ecology, 54(2): 427-432. [ Links ]
Hsieh, T.C., K.H., M a., and A., Chao. 2016. iNEXT: An R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods Ecol. Evol., 7(12): 1451-1456. [ Links ]
Hureau, J.C. 1970. Biologie comparée de quelques poissons antarctiques (Nototheniidae). Expéditions Polaires Françaises, París. 244 p. [ Links ]
Hyslop, E.J. 1980. Stomach contents analysis- a review of methods and their application. J. Fish Biol., 17: 411-429. [ Links ]
Invemar. 2019. Monitoreo de las condiciones ambientales y los cambios estructurales y funcionales de las comunidades vegetales y de los recursos pesqueros durante la rehabilitación de la Ciénaga Grande de Santa Marta. Informe Técnico Final 2018, Invemar, Santa Marta. 214 p. [ Links ]
Invemar. 2020. Sistema de información pesquera de Invemar-SIPEIN [base de datos]. http://sipein.invemar.org.co/informes/cpue/externos/18/06/2020. [ Links ]
Jacot, A.P. 1920. Age, growth and scale characters of the mullet Mugil cephalus and M. curema. Trans. Amer. Micr. Soc., 39(3): 199-229. [ Links ]
Jahncke, J. y E., Goya. 1997. Variación latitudinal y estacional en la dieta del guanay (Leucocarbo bougainvilli) y el piquero peruano (Sula variegata) en la costa peruana. Bol. Inst. Mar Perú, 16(1): 22-41. [ Links ]
Jost, L. 2006. Entropy and diversity. Oikos, 113(2): 363-375. [ Links ]
Lombarte, A., O., Chic, V. ,Parisi-Baradad, R., Olivella, J., Piera y E., García-Ladona. 2006. A web-based environment for shape analysis of fish otoliths. The AFORO database. Sci. Mar., 70(1): 147-152. [ Links ]
López-Calleja, V. 1995. Dieta de Zonotrichia capensis (Emberizidae) y Diuca diuca (Fringillidae): efecto de la variación estacional de los recursos tróficos y la riqueza de aves granívoras en Chile central. Rev. Chil. Hist. Nat., 68: 321-331. [ Links ]
Lorenz, J.J. y J.E., Serafy. 2006. Subtropical wetland fish assemblages and changing salinity regimes: implications for everglades restoration. Hydrobiología, 569: 401-422. [ Links ]
Manjarrés, L., S., Sánchez, C.A. ,López-Anaya, A., Suárez, L., Martínez, Castro, A. y , L., Pacheco. 2007. Captura y esfuerzo de las pesquerías de pequeña escala en las áreas protegidas. En: Manjarrés, L. (Ed). Caracterización participativa de las pesquerías de pequeña escala de las áreas protegidas de la Territorial Caribe. Informe técnico final, Univ. Magdalena, Santa Marta . 86 pp. [ Links ]
Martínez, J.A., M.M.C., Arteaga, J.L.T., Musi y A.A.M., Aranda. 2007. Utilización de otolitos como herramienta en la determinación de especies. Rev. Zool., 1813-18. [ Links ]
Martínez, M.L. 1983. Biología reproductiva de Pelecanus occidentalis en relación con el afloramiento de la bahía de Panamá. Tesis Ph.D., Univ. Valle, Cali. [ Links ]
Muñoz, J., G., Marín, J., Andrade y R., Alzola. 2008. Notas sobre la dieta de la cotúa olivácea (Phalacrocorax olivaceus) en una laguna marino-costera de la península de Araya, Venezuela. Saber, 20(2): 253-258. [ Links ]
NOAA. 2020. Multivariate ENSO Index Version 2 (MEI.v2). https://psl.noaa.gov/enso/mei/2/10/2020. [ Links ]
Olmos, V., J., Aragoneses, J. L., Echevarrias y R., Oltra. 2000. Composición de la dieta e impacto del cormorán grande (Phalacrocorax carbo sinensis) de Santa Pola, Alicante, este de España. Ardeola, 47(2): 227-236. [ Links ]
Orta, J. 1992. Family Phalacrocoracidae (cormorants). 326-353. En: del Hoyo, J., A., Elliott y J., Sargatal (Eds.). Handbook of the birds of the world. Lynx Edicions, Barcelona. [ Links ]
Osorio, D. 1988. Ecología trófica de Mugil curema, M. incilis y M. liza (Pices: Mugilidae) en la Ciénaga Grande de Santa Marta, Caribe colombiano I. Análisis cualitativo y comparativo. An. Inst. Inv. Mar., 18: 113-126. [ Links ]
Ovegård, M. 2017. The interactions between cormorants and wild fish populations analytical methods and applications. Tesis Aquatic Resources. Univ. Agric. Sci., Lysekil. 55 p. [ Links ]
Petracci, P., J., Cereghetti, J., Martín y S., Obed. 2009. Dieta del biguá (Phalacrocorax olivaceus) durante la primavera en el estuario de bahía Blanca, Buenos Aires, Argentina. Hornero, 24(2): 73-78. [ Links ]
R Studio Team. 2020. R Studio: Integrated development environment for R. R Studio, Boston. http://www.rstudio.com/ [ Links ]
Ramsar. 2017. Misión Ramsar de asesoramiento n.° 82: Sitio Ramsar Sistema Delta Estuarino del río Magdalena Ciénaga Grande de Santa Marta. Informe. Convención Ramsar. 61 p. [ Links ]
Regidor, H. y A. ,Terroba. 2001. Hábitos alimentarios del biguá Phalacrocorax brasilianus (Gmelin 1789) (Aves, Phalacrocoracidae) en el noroeste de Argentina. Bol. Soc. Biol. Concepción, (72): 121-123. [ Links ]
Román-Palacios, C. y C., Román-Valencia. 2015. Hábitos tróficos de dos especies sintópicas de carácidos en una quebrada de alta montaña en los Andes colombianos. Rev Mex Biodivers, 86: 782-788 [ Links ]
Rossi-Wongtschowski, C.L.D.B., A., Chalom, C.C., Siliprandi, M.R., Brenha-Nunes, V.R.M., Conversani, C. ,Santificetur y M.B., Giaretta. 2016. COSS-Brasil: Coleção de otólitos de peixes marinhos da região sudeste-sul do Brasil. Instituto Oceanográfico Universidade de São Paulo, São Paulo. www.usp.br/cossbrasil [ Links ]
Ruiz-Guerra, C., D., Eusse, R. ,Johnston-González, L. ,Castillo, C., Angulo y A., González. 2012. Distribución de aves acuáticas de la ecorregión Ciénaga Grande de Santa Marta, costa Caribe colombiana. Calidris, Cali. 23 p. [ Links ]
Ruiz-Guerra, C., R., Johnston-González, L.F. ,Castillo-Cortés, Y., Cifuentes-Sarmiento, D., Eusse y F.A. ,Estela. 2008. Atlas de aves playeras y otras aves acuáticas en la Costa Caribe Colombiana. Calidris, Cali. 72 p. [ Links ]
Sánchez-Ramírez, C. y M., Rueda. 1999. Variación de la diversidad y abundancia de especies ícticas dominantes en el delta del río Magdalena, Colombia. Rev. Biol. Trop., 47(4): 1067-1079. [ Links ]
Siegel-Causey, D. 1997. The problems of being successful: managing interactions between humans and double-crested cormorants. Symposium on Double-Crested Cormorants: Population Status and Management Issues in the Midwest: 5-14. [ Links ]
Valdovinos, F., P. ,Urbani y R., Ramos-Jiliberto. 2010. Análisis de las consecuencias del comportamiento adaptativo individual sobre la estabilidad poblacional: el caso del forrajeo óptimo. Rev. Chil. Hist. Nat., 83: 207-218. [ Links ]
Vilardy, S.P., J.A., González, B., Martín-López, E., Oteros-Rozas y C., Montes. 2012. Los servicios de los ecosistemas de la reserva de biosfera Ciénaga Grande de Santa Marta. Revibec, 19: 66-83. [ Links ]
Volpedo, A.V y D.D., Echeverría. 2000. Catálogo y claves de otolitos para la identificación de peces del mar argentino, vol. 1. Dunken, Buenos Aires. 69 p. [ Links ]
Zijlstra, M. and M.R., Van-Eerden. 1995. Pellet production and the use of otoliths in determining the diet of Cormorants Phalacrocorax carbo sinensis: trials with captive birds. Ardea, 83: 123-131. [ Links ]
Recibido: 28 de Julio de 2020; Aprobado: 05 de Noviembre de 2020











 text in
text in