Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.49 supl.1 Santa Marta Dec. 2020 Epub Sep 06, 2021
https://doi.org/10.25268/bimc.invemar.2020.49.suplesp.1041
Notas
Aproximación a la dieta de Thalassoma lucasanum (familia Labridae) en el arrecife coralino de La Azufrada, isla Gorgona, Pacífico Oriental Tropical
1Departamento de Biología, Universidad del Valle, Cali, Colombia.,
2Departamento de Biología, Universidad del Valle, Cali, Colombia. bellineth.valencia@correounivalle.edu.co
3Instituto de Investigaciones en Ciencias del Mar y Limnología (Incimar), Universidad del Valle, Cali, Colombia. alan.giraldo@correounivalle.edu.co
The Cortez rainbow wrasse, Thalassoma lucasanum, is an abundant reef fish of the Eastern Tropical Pacific (ETP). Unlike other species of the genus Thalassoma that are recognized as cleaners, in T. lucasanum this behavior is rare, since it feeds mainly on invertebrates through foraging. However, information on the trophic ecology of this species is limited, especially in the ETP. In this study, we characterize the feeding habits of T. lucasanum in Gorgona Island (ETP) from analyzing its gut contents and calculating its trophic niche. Mollusks were the main food resource of T. lucasanum, being this the most important and frequent prey item found in 100 % of the stomachs analyzed (n = 5). In terms of biomass, crustaceans had the greatest contribution to the diet, which positioned them as the second most important food item. Other prey items included polychaetes, fish parts, and calcareous material. This study contributes to the knowledge of the trophic dynamics of coral reef ecosystems of the ETP.
KEY WORDS: coral reef fish; stomach content; trophic interactions; Colombian Pacific.
El arcoíris de Cortés, Thalassoma lucasanum, es un pez arrecifal abundante en el Pacífico Oriental Tropical (POT). A diferencia de otras especies del género Thalassoma que son reconocidas por ser limpiadoras, en T. lucasanum este comportamiento es poco frecuente, ya que se alimenta principalmente de invertebrados mediante forrajeo. No obstante, la información sobre la ecología trófica de esta especie es limitada, especialmente en el POT. En este estudio se caracterizan los hábitos alimentarios de T. lucasanum en la isla Gorgona (POT) a partir del análisis de su contenido estomacal y se calcula su nicho trófico. Los moluscos fueron el principal recurso alimentario de T. lucasanum, siendo este el ítem de presa más importante y frecuente al ser encontrado en 100 % de los estómagos analizados (n = 5). En términos de biomasa, los crustáceos presentaron la mayor contribución a la dieta, con lo cual se posicionaron como el segundo ítem alimentario más importante. Otras presas incluyeron poliquetos, partes de peces y material calcáreo. Este estudio contribuye al conocimiento de la dinámica trófica de los ecosistemas arrecifales del POT.
PALABRAS CLAVE: peces de arrecifes coralinos; contenido estomacal; interacciones tróficas; Pacífico colombiano.
Las especies del género Thalassoma son conocidas por su versatilidad trófica y amplia preferencia dietaria, así como por presentar un comportamiento de forrajeo generalizado en un amplio espectro de microhábitats arrecifales (Fulton et al., 2017; Dunkley et al., 2018). Aunque varias especies de este género son reconocidas por su comportamiento alimentario de limpieza (Arnal et al., 2006; Baliga y Mehta, 2014; Quimbayo et al., 2017), dicho comportamiento se presenta con menor frecuencia en T. lucasamun en el Pacífico Oriental Tropical (POT), región donde se alimenta mediante forrajeo principalmente de invertebrados (Quimbayo et al., 2017). La mayoría de la información disponible para esta especie se centra en sus patrones de reproducción, abundancia y distribución (Warner, 1982; Giraldo et al., 2001), pero poco se sabe sobre sus hábitos de alimentación (Foster, 1987; Robertson y Allen, 2015; Quimbayo et al., 2017). Con el propósito de contribuir al conocimiento sobre la ecología trófica de T. lucasanum en el POT, se caracterizó su dieta a partir del análisis del contenido estomacal de especímenes capturados en el arrecife coralino de La Azufrada, isla Gorgona, Pacífico colombiano.
La Azufrada es el arrecife coralino más grande (longitud: 780 m, ancho: 80-180 m) y continuo de la isla continental Gorgona (2°58′10″ N y 78°11′05″ W), localizada a 35 km de la costa del Pacífico colombiano (Glynn et al., 1982; Muñoz y Zapata, 2013). Los corales dominantes son duros ramificados del género Pocillopora, con presencia de grandes colonias de corales masivos de los géneros Pavona y Gardineroseris en las zonas profundas (Zapata y Vargas-Ángel, 2003).
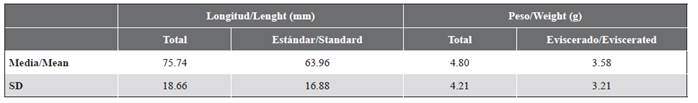
Durante septiembre de 2019 se capturaron cinco individuos de T. lucasanum sobre la planicie coralina del arrecife de La Azufrada, entre 10:00 y 12:00 h, empleando un trasmallo (longitud: 8 m, altura: 1.5 m, ojo de malla: 1,27 cm × 1,90 cm). En campo se realizaron varios intentos de captura empleando diferentes artes de pesca (v. g. arpón hawaiano, nasa de pesca manual, trasmallo); sin embargo, la agilidad y rapidez que caracteriza a estos peces dificultó su captura y resultó en un bajo tamaño de la muestra. Para cada individuo se registró la longitud total y estándar, el peso total y eviscerado (Tabla 1), y posteriormente se realizó la disección del estómago y el intestino, los cuales se preservaron en etanol al 70 %. En el laboratorio, todas las presas o fragmentos distinguibles fueron removidos de cada estómago (incluyendo la parte anterior del intestino) y luego fueron identificadas hasta el menor nivel taxonómico posible, contadas y pesadas en una balanza analítica (peso seco: 60 °C × 24 h) (Hyslop, 1980; Cortés, 1997; Mar-Silva et al., 2014). El material digerido con fragmentos no distinguibles también fue separado y pesado. Para cada ítem de presa se calculó el coeficiente de vacuidad (%V), la frecuencia de ocurrencia (%F), el porcentaje por número (%N), el porcentaje por peso seco (%W) y el índice de importancia relativa (%RI) (George y Hadley, 1979; Hyslop, 1980; Fabi et al., 2006). Para describir la amplitud del nicho trófico se calculó el índice de Levin (Bi) y su forma estandarizada (BA) (Krebs, 1999).
Tabla 1 Resumen de medidas morfométricas de Thalassoma lucasanum recolectados para análisis de contenido estomacal. n = 5 individuos. SD: desviación estándar.
Se registraron 20 ítems de presas en los estómagos de T. lucasanum (V%: 0). Debido al alto grado de digestión de la mayoría de las presas, solo un ítem fue identificado a nivel de género y cuatro a nivel de familia (Tabla 2). De las presas no identificadas, 12 fueron clasificadas en morfoespecies (un ostrácodo, dos bivalvos y nueve gasterópodos), pero debido a su pequeño tamaño, su peso individual no pudo ser cuantificado.
Tabla 2 Composición de la dieta de Thalassoma lucasanum en el arrecife coralino de La Azufrada, isla Gorgona, Pacífico colombiano. Frecuencia de ocurrencia (%F), porcentaje por número (%N) y peso (%W) e índice de importancia relativa (%RI) para cada presa.

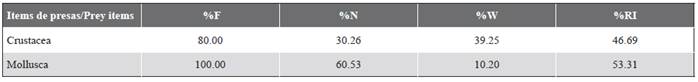
En La Azufrada, Thalassoma lucasanum se alimentó principalmente de pequeños invertebrados bentónicos, incluyendo moluscos, crustáceos y poliquetos (Tabla 2). Los moluscos conformaron el ítem de presa más frecuente (F%: 100) e importante de la dieta (%RI: 53,31). Entre los moluscos, los gasterópodos fueron las presas más frecuentes (100 %) y abundantes (50 %), seguidos por los quitones (%F: 60) y los bivalvos (%F: 20). Sin embargo, en términos de biomasa, la contribución de los moluscos fue baja (%W: 10,20) en comparación con los crustáceos (%W: 39,25). Los crustáceos conformaron el segundo ítem alimentario más frecuente (80 %) e importante (%RI: 46,69), destacándose por su frecuencia y abundancia los ostrácodos (F%: 60, %N: 27,63), los decápodos del género Alpheus (F%: 20) y los copépodos (F%: 20) (Tabla 3).
Tabla 3 Resumen de la composición de la dieta de Thalassoma lucasanum en el arrecife coralino de La Azufrada, isla Gorgona, Pacífico Colombiano, con los principales grupos de ítems de presas registrados. Frecuencia de ocurrencia (%F), porcentaje por número (%N) y peso (%W) e índice de importancia relativa (%RI) para cada presa.
Los resultados encontrados son consistentes con las descripciones de Robertson y Allen (2015), quienes describen una dieta variada para T. lucasanum basada en moluscos, erizos, crustáceos y poliquetos. Entre estos ítems de presa, los moluscos fueron el principal recurso alimentario de T. lucasanum en La Azufrada, mientras que otros estudios han registrado a los pequeños crustáceos herbívoros como el principal componente de la dieta (Goodson, 1988; Williams, 1991). El consumo de moluscos (de cuerpo blando y/o de concha dura) se ha registrado para otras especies de Thalassoma como T. duperrey, depredador efectivo de nudibranquios (Gochfeld y Aeby, 1997), y T. lutescens, cuyos dientes faríngeos en forma molar le permiten triturar conchas y organismos de cuerpo duro como quitones (Gushima et al., 1991). Debido a la alta preferencia por los moluscos que presentó T. lucasanum en La Azufrada, la amplitud de su nicho trófico fue estrecha (Bi: 1,20; BA: 0,01), lo que sugirió una dieta especializada (Krebs, 1999). Sin embargo, estos resultados contrastan con lo registrado para otras especies del género Thalassoma como T. bifasciatum, considerada como forrajeadora generalista que se alimenta principalmente del sustrato bentónico y que también presenta un comportamiento alimentario de limpieza facultativo (Dunkley et al., 2018). Es posible que la preferencia por moluscos encontrada en T. lucasanum en el presente estudio se deba a la alta disponibilidad de este recurso, relacionado con la gran diversidad y abundancia de moluscos que habitan los sustratos arrecifales (Robertson, 1970; Hadfield, 1976; Ramesh et al., 1996). En corales ramificados del género Pocillopora se han citado más de 100 especies de moluscos (Austin et al., 1980; Ramesh et al., 1996), lo que constituye uno de los grupos más abundantes en corales pocillopóridos, junto con los decápodos (Alvarado y Vargas-Castillo, 2012). De acuerdo con Fulton et al. (2017), la alta versatilidad trófica que caracteriza a peces del género Thalassoma podría facilitar el cambio de preferencia de sus presas hacia los recursos más comunes dentro de un hábitat dado, lo que permitiría a estas especies explotar rápidamente los recursos disponibles. Sin embargo, para determinar con mayor precisión la principal fuente de alimento de T. lucasanum y la amplitud de su nicho trófico, es necesario realizar un análisis de su dieta considerando un mayor tamaño de muestra.
La dieta de T. lucasamun también estuvo conformada por escamas y huesos de peces, encontrados en 80 % y 40 % de los estómagos analizados, respectivamente (Tabla 2). La presencia de escamas de peces puede ser resultado de las actividades de limpieza que ejercen con menor frecuencia como limpiadores facultativos (Baliga y Mehta, 2014). Cuando tienen este comportamiento, se alimentan de ectoparásitos presentes en peces, aunque esto es poco frecuente en T. lucasanum en comparación con otras especies limpiadoras (Quimbayo et al., 2017). Debido a que la mayoría de lábridos presenta una dentición que les permite explotar una amplia diversidad de presas, desde zooplancton hasta ectoparásitos de crustáceos y peces, así como bivalvos y gasterópodos de concha dura (Westneat y Alfaro, 2005; Parenti y Randall, 2011), también es posible que peces pequeños se encuentren en la dieta de T. lucasanum, aunque con menor frecuencia. Asimismo, la presencia de espinas de erizo y material calcáreo triturado sugiere que T. lucasanum se alimenta de erizos y podría estar ingiriendo trozos de coral durante la captura de sus presas. Un enfoque molecular para analizar el contenido estomacal podría proporcionar un análisis más robusto para la identificación de presas altamente degradadas, así como información nutricional necesaria para cuantificar con mayor precisión la importancia de cada ítem de presa para esta especie (Dunkley et al., 2018; Amundsen y Sánchez-Hernández, 2019).
En este estudio se encontró que T. lucasanum se alimenta principalmente de invertebrados bentónicos, en su mayoría moluscos de concha dura y crustáceos con estrecha asociación por el sustrato arrecifal (Figura 1). Debido al bajo tamaño de muestra, los resultados obtenidos representan una aproximación de la dieta para la especie, lo que contribuye a establecer la línea base del conocimiento de sus hábitos alimentarios en la región. Es importante mencionar que T. lucasanum es una de las especies de peces más abundantes del arrecife coralino de La Azufrada (Zapata y Morales, 1997; Alzate et al., 2014; Palacios et al., 2020) y, por lo tanto, caracterizar su dieta permite entender mejor las actividades de depredación y la dinámica de las redes tróficas en los arrecifes del POT.
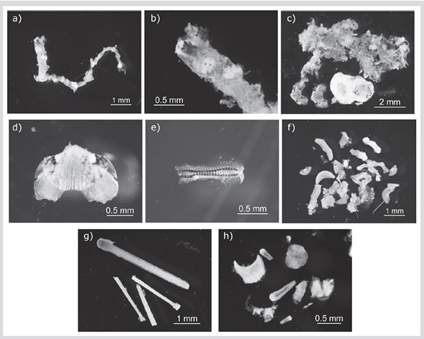
Figura 1 Ítems de presas encontrados en el contenido estomacal de Thalassoma lucasanum. Polychaeta: A) Eunicidae. B) Detalle de mandíbula de Eunicidae. Mollusca: Polyplacophora. C) Placas y tejido de Chitonida sp1 digerido. D) Detalle de placa de Chitonida sp1. E) Rádula de Chitonida sp1. F) Placas y tejido de Chitonida sp2 digerido. Otros: G) Espinas de erizo. H) Material calcáreo.
AGRADECIMIENTOS
Los autores agradecen a Diego Córdoba por apoyar los análisis de laboratorio, a Edgardo Londoño y Juan Felipe Lazarus por confirmar la identificación de los invertebrados, a Juan Pablo Erazo, Alejandro Perlaza, Kevin Steven Mendoza, Juan José Gallego y Olga Lucía Torres por su apoyo durante la salida de campo. Al laboratorio de imágenes de la Universidad del Valle por las tomas del contenido estomacal. Al personal de Parques Nacionales Naturales, especialmente a los funcionarios del PNN Gorgona, por el apoyo logístico brindado. Este estudio forma parte del proyecto de investigación “Estructura y función de los invertebrados crípticos móviles en dos arrecifes coralinos del Pacífico colombiano”, financiado por Minciencias y la Universidad del Valle a BV, y se realizó bajo el permiso de recolección n.° 20192000038341. Publicación 019 del Instituto de Ciencias del Mar y Limnología (Incimar) de la Universidad del Valle.
REFERENCIAS
Alvarado, J.J. y R., Vargas-Castillo. 2012. Invertebrados asociados al coral constructor de arrecifes Pocillopora damicornis en Playa Blanca, bahía Culebra, Costa Rica. Rev. Biol. Trop., 60(2): 77-92. https://doi.org/10.15517/rbt.v60i2.19965 [ Links ]
Alzate, A., F.A. ,Zapata, and A., Giraldo. 2014. A comparison of visual and collection-based methods for assessing community structure of coral reef fishes in the Tropical Eastern Pacific. Rev. Biol. Trop., 62: 359-371. [ Links ]
Amundsen, P.A. and J. ,Sánchez-Hernández. 2019. Feeding studies take guts - critical review and recommendations of methods for stomach contents analysis in fish. J. Fish Biol., 95: 1364-1373 [ Links ]
Arnal, C., O., Verneau, and Y., Desdevises. 2006. Phylogenetic relationships and evolution of cleaning behaviour in the family Labridae: importance of body colour pattern. J. Evol. Biol., 19(3): 755-763. https://doi.org/10.1111/j.1420-9101.2005.01059.x [ Links ]
Austin, A.D., S.A., Austin, and P.F., Sale. 1980. Community structure of the fauna associated with the coral Pocillopora damicornis (L.) on the Great Barrier Reef. Mar. Freshw. Res., 31(2): 163-174. https://doi.org/10.1071/MF9800163 [ Links ]
Baliga, V.B. and R.S., Mehta. 2014. Scaling patterns inform ontogenetic transitions away from cleaning in Thalassoma wrasses. J. Exp. Biol., 217: 3597-3606. https://doi.org/10.1242/jeb.107680 [ Links ]
Cortés, E. 1997. A critical review of methods of studying fish feeding based on analysis of stomach contents: application to elasmobranch fishes. Can. J. Fish. Aquat. Sci., 54: 726-738. https://doi.org/10.1139/cjfas-54-3-726 [ Links ]
Dunkley, K., J., Cable, and S.E., Perkins. 2018. The selective cleaning behaviour of juvenile blue-headed wrasse (Thalassoma bifasciatum) in the Caribbean. Behav. Proc., 147: 5-12. https://doi.org/10.1016/j.beproc.2017.12.005 [ Links ]
Fabi, G., S., Manoukian, and A., Spagnolo. 2006. Feeding behavior of three common fishes at an artificial reef in the northern Adriatic Sea. Bull. Mar. Sci., 78: 39-56. [ Links ]
Foster, S.A. 1987. Acquisition of a defended resource: a benefit of group foraging for the neotropical wrasse, Thalassoma lucasanum. Environ. Biol. Fishes, 19(3): 215-222. https://doi.org/https://doi.org/10.1007/BF00005350 [ Links ]
Fulton, C.J., P.C., Wainwright, A.S., Hoey, and D.R., Bellwood. 2017. Global ecological success of Thalassoma fishes in extreme coral reef habitats. Ecol. Evol., 7: 466-472. https://doi.org/10.1002/ece3.2624 [ Links ]
George, E. and W.F., Hadley. 1979. Food and habitat partitioning between rock bass (Ambloplites rupestris) and smallmouth bass (Micropterus dolomieui) young of the year. Trans. Am. Fish. Soc., 108: 253-261. https://doi.org/10.1577/1548-8659(1979)108<253:FAHPBR>2.0.CO;2 [ Links ]
Giraldo, A., C. ,Gómez, and F., Ospina. 2001. Abundance and spatial distribution of Thalassoma lucasanum (Gill, 1863) in a coral reef of the Eastern Tropical Pacific. Bull. Mar. Sci., 68(1): 147-152. [ Links ]
Glynn, P.W., H., von Prahl, and F., Guhl. 1982. Coral reefs of Gorgona Island, Colombia, with special reference to corallivores and their influence on community structure and reef development. An. Inst. Invest. Mar. Punta Betín, 12: 185-214 [ Links ]
Gochfeld, D.J. and G.S., Aeby. 1997. Control of populations of the coral-feeding nudibranch Phestilla sibogae by fish and crustacean predators. Mar. Biol., 130: 63-69. https://doi.org/10.1007/s002270050225 [ Links ]
Goodson, G. 1988. Fishes of Pacific coast. Stanford Univ. Press, California. 267 p. [ Links ]
Gushima, K., Y., Hazumi, and S., Kakuta. 1991. Growth-related changes in diet and foraging behavior of the yellow wrasse Thalassoma lutescens at Kuchierabu Island. Jap. J. Ichthyol., 38(3): 307-313. https://doi.org/10.11369/jji1950.38.307 [ Links ]
Hadfield, M.G. 1976. Molluscs associated with living tropical corals. Micronesica, 12: 133-148. [ Links ]
Hyslop, E.J. 1980. Stomach contents analysis-a review of methods and their application. J. Fish. Biol., 17: 411-429. https://doi.org/10.1111/j.1095-8649.1980.tb02775.x [ Links ]
Krebs, C. 1999. Ecological methodology. 2nd ed. Benjamin Cummings Press, California. 620 p. [ Links ]
Mar-Silva, V., R. ,Hernández y M. ,Medina. 2014. Métodos clásicos para el análisis del contenido estomacal en peces. Biologicas, 16:13-16. [ Links ]
Muñoz, C.G. y F.A., Zapata. 2013. Plan de manejo de los arrecifes coralinos del PNN Gorgona, Pacífico colombiano. Parques Nacionales Naturales y WWF-Colombia, Cali. 68 p. [ Links ]
Palacios, S., B., Valencia, and A., Giraldo. 2020. Diet of the coral hawkfish Cirrhitichthys oxycephalus (Family: Cirrhitidae) in a fringing coral reef of the Eastern Tropical Pacific. Coral Reefs, 39: 1503-1509. https://doi.org/10.1007/s00338-020-02007-4 [ Links ]
Parenti, P. and J., Randall. 2011. Checklist of the species of the families Labridae and Scaridae: an update. Smithiana Bull., 13: 29-44. [ Links ]
Quimbayo, J.P., M.S., Dias, O.R.C., Schlickmann, and T.C., Mendes. 2017. Fish cleaning interactions on a remote island in the Tropical Eastern Pacific. Mar. Biodivers., 47(2): 603-608. https://doi.org/10.1007/s12526-016-0493-2 [ Links ]
Ramesh, D.A., R., Jeyabaskaran, and A.L.P., Pandian. 1996. Gastropods and bivalves associated with reef building corals, palk bay, southeastern India. Res. Bull. Phuket Mar. Biol. Cent., 16: 257-260. [ Links ]
Robertson, R. 1970. Review of the predators and parasites of stony corals, with special reference to symbiotic prosobranch gastropods. Pac. Sci., 24: 828-830. [ Links ]
Robertson, R.D. y G.R., Allen. 2015. Peces costeros del Pacífico Oriental Tropical: sistema de información en línea. Instituto Smithsonian de Investigaciones Tropicales, Balboa, Panamá. https://biogeodb.stri.si.edu/sftep/es/thefishes/species/1675. 07/01/2020. [ Links ]
Warner, R. R. 1982. Mating systems, sex change and sexual demography in the rainbow wrasse, Thalassoma lucasanum. Copeia, 1982(3): 653-661. [ Links ]
Westneat, M.W. and M.E., Alfaro. 2005. Phylogenetic relationships and evolutionary history of the reef fish family Labridae. Mol. Phylog. Evol., 36(2): 370-390. https://doi.org/10.1016/j.ympev.2005.02.001 [ Links ]
Williams, D. 1991. Patterns and processes in the distribution of coral reef fishes. 437-474. En: Sale, P.F. (Ed.). The ecology of fishes on coral reefs. Academic Press, San Diego. 754 p. [ Links ]
Zapata, F.A. and Y.A., Morales. 1997. Spatial and temporal patterns of fish diversity in a coral reef at Gorgona Island, Colombia. Proc. 8th Internat. Coral Reef Symp., 1: 1029-1034. [ Links ]
Zapata, F.A. and B., Vargas-Ángel. 2003. Coral and coral reefs of the Pacific coast of Colombia. 419-447. En: Cortés, J. (Ed.). Latin American coral reefs. Elsevier Science B.V., Amsterdam. 508 p. [ Links ]
Recibido: 22 de Julio de 2020; Aprobado: 04 de Noviembre de 2020











 text in
text in 



