Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.1 Santa Marta Jan./June 2021 Epub Sep 17, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.1.1058
Artículos de Investigación
Los peces triple aletas del Santuario de Fauna y Flora Malpelo, Pacífico colombiano
1Universidad del Valle, Departamento de Biología, Grupo de Investigación en Sistemática, Evolución y Biogeografía Animal (SEyBA) , AA 25360, Cali, Colombia.
2Universidad del Valle, Departamento de Biología, Grupo de Investigación en Sistemática, Evolución y Biogeografía Animal (SEyBA), AA 25360, Cali, Colombia. bbeltranleon@yahoo.com
3Universidad del Valle, Departamento de Biología, Grupo de Investigación en Sistemática, Evolución y Biogeografía Animal (SEyBA), AA 25360, Cali, Colombia., jose.tavera@correounivalle.edu.co.
The fishes of the family Tripterygidae are commonly known as triplefins because its dorsal fin is divided into three segments. Of the 183 species recognized as valid only 16 are distributed in the eastern Pacific. Two endemic species and only members of the family are found in the FFS Malpelo Island: Axoclinus rubinoffi y Lepidonectes bimaculatus. In this work, additional data are provided on the adults and larvae of the triplefins of the sanctuary. The mean abundances of the larvae were 1,88 individuals/m2 for A. rubinoffi and 0.25 individuals/m2 for L. bimaculatus at the night stations where they were collected, 0.8 and 1.61 km to the west of the island and very close specifically on El Arrecife and La Nevera. The adults were collected around the island between 0-30 m depth and the abundance was 0.22 individuals/m2 for L. bimaculatus and 0.19 individuals/m2 for A. rubinoffi. The natural variability of the morphological traits of both species is extended and differences between the population densities with previous studies are found. To really understand the population dynamics of these species, it is necessary to evaluate long time series and include other methods such as genetic information.
KEY WORDS: Endemic; Malpelo Fauna and Flora Sanctuary; Reef fish; Tripterygiidae; TEP.
La familia Tripterygiidae incluye a los peces conocidos como triple aletas por la división en tres segmentos que caracteriza la aleta dorsal de sus especies. De las 183 especies reconocidas como válidas para la familia solamente 16 se distribuyen en el Pacífico oriental, incluyendo dos endémicas y únicas representantes de la familia en el Santuario de Fauna y Flora Isla Malpelo: Axoclinus rubinoffi y Lepidonectes bimaculatus. El presente trabajo aporta datos morfológicos y ecológicos de la etapa larval y adulta para las dos especies de triple aletas del santuario. Con respecto a las larvas, la abundancia promedio fue de 1,88 individuos/m2 para A. rubinoffi y 0,25 individuos/m2 para L. bimaculatus en las estaciones nocturnas donde fueron recolectadas, a 0,8 y 1,61 km de distancia al occidente y en localidades muy cercanas a la isla como El Arrecife y La Nevera. Los adultos fueron recolectados alrededor de la isla entre 0-30 m de profundidad y su abundancia fue de 0,22 individuos/m2 para L. bimaculatus y de 0,19 individuos/m2 para A. rubinoffi. Se amplía el conocimiento de la variabilidad natural de los rangos morfológicos de ambas especies y se evidencian diferencias entre las densidades poblacionales encontradas en previos estudios. Para entender las dinámicas poblacionales de estas especies es necesario evaluar series de tiempo más largas e incluir otras metodologías de estudio como las evaluaciones genéticas.
PALABRAS CLAVE: Endémico; Peces arrecifales; Santuario de Fauna y Flora Malpelo; Tripterygiidae; POT.
INTRODUCCIÓN
Tripterygiidae es una familia perteneciente al orden de los Blenniiformes que incluye 32 géneros y 183 especies válidas, 16 de las cuales han sido descritas en los últimos 10 años (Fricke et al., 2020). Los llamados triple aletas se encuentran tanto en océanos templados como tropicales alrededor del mundo y viven asociados a fondos coralinos o rocosos. La mayoría de sus especies son de tamaño pequeño (< 6 cm), característica que junto a sus colores crípticos los hace difíciles de detectar (Robertson y Allen, 2015; Nelson et al., 2016).
Se distinguen de otras familias por poseer la aleta dorsal dividida en tres segmentos distintivos, donde la primera y segunda porción están compuestas por espinas, mientras que la tercera presenta más de siete radios blandos. Carecen de cirros en la nuca, pero sí los presentan en las narinas y sobre los ojos; presentan escamas usualmente ctenoideas, membranas branquiales ampliamente unidas al istmo y los premaxilares protráctiles (Nelson et al., 2016). Poseen huevos bentónicos cuidados por el macho, unidos al sitio del nido a través de filamentos adhesivos (Ruck, 1973, 1980; Shiogaki y Dotsu, 1973; Wirtz, 1978), esféricos a ligeramente aplanados, de 0,7-1,4 mm de diámetro y con una yema incolora a rojo-naranja con 10 o más gotas pequeñas de aceite. Las larvas son alargadas de 3 a 10 mm, sin espinas en la cabeza, pigmentadas en el borde ventral postanal y poseen un pequeño saco vitelino (Ruck, 1973, 1980; Shiogaki y Dotsu, 1973, 1988, Beltrán-León y Ríos, 2000).
En la región Neotropical, comprendida en el Pacífico americano desde la región sur de México hasta América del Sur (Sclater, 1858), se distribuyen cuatro géneros y 24 especies, de las cuales ocho de ellas han sido descritas en el presente siglo (Rosenblatt et al., 2013; Victor, 2013). Para esta región, el género más diverso es Enneanectes, con 15 especies distribuidas entre el Pacífico oriental tropical (POT) y el Atlántico occidental (Rosenblatt, 1960; Robertson y Allen, 2015). Los tres géneros restantes son endémicos del POT: Axoclinus (seis especies), Lepidonectes (tres especies) y Crocodilichthys (una especie); de estas especies, cinco son únicas de las islas o archipiélagos que componen la provincia océanica del POT (Clipperton, Revillagigedo, Galápagos, isla del Coco e isla Malpelo; Robertson y Cramer, 2009).
El Santuario de Fauna y Flora (SFF) Malpelo alberga dos de las cinco especies endémicas de la provincia oceánica del POT: Axoclinus rubinoffiAllen y Robertson, 1992 y Lepidonectes bimaculatus Allen y Robertson, 1992, las cuales viven en profundidades inferiores a 30 m y están asociadas a fondos rocosos cubiertos por algas coralinas incrustantes (Chasqui-Velasco et al., 2011). Debido a su longitud corporal reducida y baja capacidad de natación, se asume poseen un limitado potencial de dispersión (Rocha y Bowen, 2008), al menos en sus estados juvenil y adulto. Estas dos especies representan los peces endémicos más abundantes en la isla (Chasqui-Velasco et al., 2011), en comparación con las otras tres especies endémicas: el chaenópsido Acanthemblemaria stephensi Rosenblatt y McCosker, 1988, el gobio Chriolepis lepidota Findley, 1975 y el lábrido Halichoeres malpelo Allen y Robertson, 1992.
Las especies endémicas han registrado altas tasas de extinción (Frankham, 1997) debido a sus características biológicas (dispersión limitada), ecológicas (poblaciones pequeñas, especialistas en hábitat) y genéticas (bajo flujo genético y baja diversidad genética) (Pimm y Pimm, 1991; Ellstrand y Elam, 1993) que las convierten en especialmente vulnerables a las perturbaciones y las sitúan en mayor riesgo de extinción que especies con amplias distribuciones (Hughes et al., 2002). Dada a esta vulnerabilidad, múltiples investigaciones se han realizado para entender y conservar sus poblaciones (Ellstrand y Elam, 1993; Hamrick y Godt, 1996). A pesar que los endémicos del SFF Malpelo están catalogados como vulnerables en el Libro Rojo de Peces Marinos de Colombia (Zapata y Chasqui-Velasco, 2017a, 2017b) y por la Unión Internacional para la Conservación de la Naturaleza (IUCN) (Hastings et al., 2010a,2010b), es poca la información disponible de estas especies. Los trabajos realizados hasta la fecha responden a la abundancia, distribución, ecología (Quimbayo et al., 2010; Chasqui-Velasco et al., 2011). La descripción original de las especies proporciona los únicos datos morfologícos disponibles de la fase adulta, estando limitados a los pocos individuos colectados para este fin (Allen y Robertson, 1992). El presente trabajo complementa información sobre la morfología, abundancia y distribución de la fase adulta de Axoclinus rubinoffi y Lepidonectes bimaculatus, y documenta los primeros registros y descripciones de estadios larvales para estas dos especies endémicas del SFF Malpelo.
ÁREA DE ESTUDIO
La isla oceánica de Malpelo está ubicada en el POT y se encuentra separada por aproximadamente 500 km de la costa colombiana. Constituye la cúspide de la dorsal Malpelo, una cresta submarina volcánica solitaria emergida probablemente hace 16 - 17 ma (Hoernle et al., 2002); y no ha estado conectada con la plataforma continental o alguna otra isla, ni siquiera en aguas poco profundas (Chase, 1968; Lonsdale y Klitgord, 1978). La isla Malpelo tiene paredes escarpadas y posee plataformas pequeñas con formación de corales poco desarrollados (Graham, 1975). Debido a sus características geomorfológicas y a una alta diversidad de especies marinas, la isla Malpelo junto con sus aguas circundantes fueron asignadas bajo la categoría de Santuario de Fauna y Flora desde 1995 (Rodríguez-Rubio y Giraldo, 2011). El SFF Malpelo hace parte de las 59 áreas protegidas del Sistema Nacional de Parques Nacionales Naturales de Colombia, fue reconocido en 2006 como Patrimonio Natural de la Humanidad por Unesco y recientemente integró la Lista Verde de Áreas Protegidas y Conservadas de la IUCN.
MATERIALES Y MÉTODOS
Entre 4 de julio y 20 de noviembre de 2018 se capturó un total de 11 individuos adultos para cada una de las especies alrededor la isla, incluidos los islotes que se encuentran al norte y al sur (Figura 1). La colecta se realizó utilizando redes de mano y los individuos se trasladaron a un acuario de vidrio, en donde fueron anestesiados con dosis letal de metasulfonato de Tricaína, aprobado por la Administración de Alimentos y Medicamentos para el manejo de peces (Carter et al., 2011). Los organismos se fijaron en etanol al 96 %, y fueron depositados en la Colección Ictiológica de la Universidad del Valle (CIR-UV) con los números de catálogo 18134-18146 para L. bimaculatus y 18148-18154 para A. rubinoffi.

Figura 1 Distribución de larvas y adultos de Axoclinus rubinoffi y Lepidonectes bimaculatus recolectados durante 2015 y 2017-2019 en el SFF Malpelo. Los triángulos corresponden a organismos capturados en estado adulto y los círculos a estadios larvales.
Las mediciones, conteos y descripción fueron realizadas siguiendo a Allen y Robertson (1992). Se consideraron las mediciones de longitud total (LT), longitud estándar (LE), altura del cuerpo (AL), ancho del cuerpo (AN), longitud de la cabeza (LC), longitud del hocico (LH), diámetro del ojo (DO), longitud interorbital (LI), altura del pedúnculo caudal (APC), longitud del pedúnculo caudal (LPC) y longitud de las aletas pectorales (LAP). Las medidas fueron realizadas usando un calibrador con precisión de 0,1 mm. Adicionalmente se realizaron conteos referentes a los elementos (radios y espinas) de la aleta dorsal (AD), anal (AA), pectorales (AP), pélvicas (APV) y caudales (AC).
Para estimar la densidad de adultos y juveniles (individuos/m2) de cada una de las especies se utilizaron los datos del monitoreo de peces endémicos de la isla Malpelo realizado en julio de 2018 por el grupo de investigación Ecología de Arrecifes Coralinos de la Universidad del Valle. El monitoreo fue efectuado en cuatro localidades de la isla: La Nevera, El Arrecife, La Pared del Náufrago y El Bajo de Junior. Se siguió el protocolo diseñado por Chasqui-Velasco et al. (2011) que consiste en censos visuales, utilizando equipo de buceo autónomo, a lo largo de transectos-cinturón de 20 m x 2 m, los cuales corresponden a 40 m2 y permiten realizar una estandarización con respecto al número de individuos por metro cuadrado.
Los individuos en estadio temprano (larvas) fueron recolectados durante marzo de 2015 en las estaciones MW-N y MW1-N (grilla establecida por Proyecto INPA - DIMAR 1993), ubicadas en el costado occidental a 0,8 y 1,61 km de Malpelo. Se capturaron también individuos durante septiembre de 2017 y mayo de 2019 en las localidades del Arrecife y la Nevera donde se realizaron arrastres superficiales muy cerca a la isla (Figura 1). Las muestras se obtuvieron mediante arrastres empleando redes bongo con mallas de 300 y 500 µm, copos colectores blandos y contadores de flujo análogos. Los arrastres fueron oblicuos hasta una profundidad máxima de 50 m en las estaciones MW-N y MW1-N y superficiales en las estaciones el Arrecife y La Nevera, siguiendo la metodología establecida por Smith y Richardson (1979). Posteriormente, las muestras se fijaron con formol al 10 % neutralizado con bórax en agua de mar. La descripción larvaria se realizó con cuatro ejemplares de A. rubinoffi y dos de L. bimaculatus.
La identificación de las larvas de A. rubinoffi y L. bimaculatus se realizó con base en los caracteres merísticos, morfométricos y de pigmentación, siguiendo las claves de identificación para la familia Tripterygiidae de Moser (1996) y Beltrán-León y Ríos (2000). Para todos los casos el número de organismos se estandarizó a individuos/m². Finalmente, los estadios larvales fueron fotografiados en el Laboratorio de Imágenes del Postgrado en Ciencias-Biología de la Universidad del Valle, utilizando un esteroscopio NIKON MNA43000 y una cámara NIKON MQA16050.
RESULTADOS
Triple aleta ojo negro
Axoclinus rubinoffi Allen yRobertson, 1992
Morfología.- La única larva encontrada en estado de flexión presentó una longitud total de 6,2 mm, longitud estándar de 5,3 mm, cuerpo alargado; longitud preanal (LpA) 43 % de LE; LC (20-33 % de LE) y DO (25-33 % de LC) moderados; durante este estadio se cuenta con la tercera aleta (radios blandos) formada con 10 radios, aleta anal con II espinas y 17 radios blandos. Durante esta etapa se inicia la formación de las dos primeras aletas dorsales (espinas) y de las pélvicas, hasta completar el desarrollo de todas las aletas; con 39 miómeros.
En la fase adulta el cuerpo es corto y robusto; cabeza con cirros en las narinas y sobre los ojos; tres aletas dorsales III-XII-10; aleta anal II-17; aletas pectorales con 15 radios, raramente 14; aleta pélvica I-2; línea lateral desciende desde el borde superior del opérculo al eje medio lateral; cinco escamas por encima de la línea lateral a la base del primer radio caudal; cuatro escamas por debajo de la línea lateral a la base de los radios anales; aleta caudal convexa con 13 radios. Los datos morfométricos y merísticos se muestran en detalle en la Tabla 1.
Tabla 1.Caracteres morfométricos y merísticos de individuos bentónicos de Axoclinus rubinoffi y de Lepidonectes bimaculatus.

Longitud total (LT), longitud estándar (LE), altura del cuerpo (AL), ancho del cuerpo (AN), longitud de la cabeza (LC), longitud del hocico (LH), diámetro del ojo (DO), longitud interorbital (LI), altura del pedúnculo caudal (APC) y longitud de las aletas pectorales (LAP). Conteos de radios y espinas de las aletas dorsales (AD), anal (AA), pectorales (AP), pélvicas (APV) y caudal (AC). Las medidas se presentan con respecto a LE o LC, a excepción de AN que es calculada en relación con AL y LI respecto a DO.
Coloración.- Las larvas son transparentes y en estado de flexión presentan cromatóforos en la cabeza sobre el cráneo y la sínfisis cleitral, en el cuerpo cerca al ano, en serie ventral postanal (17), uno más fuerte entre la serie y el pedúnculo caudal, tres sobre el pedúnculo caudal y el borde hipural; pigmentos internos en la nuca y la parte anterior del intestino (Figura 2 A, B, C, y D). Los adultos se caracterizan por tener la superficie ventral de la cabeza y cuerpo blanquecino; cuatro barras anchas cafés entre la base de las aletas pectorales y caudal, las dos posteriores más conspicuas que las anteriores, todas las barras con bordes blancos, los espacios entre ellas de color café pálido; una barra corta con bordes blancos detrás del extremo inferior del ojo; aletas dorsal, anal y pectorales translúcidas, aleta pectoral con mancha blanca en su base, primeros radios blancos; existen diferencias en la coloración de la aleta caudal entre los sexos, los machos la presentan de color negro y las hembras con aleta de una coloración naranja (Figura 2 E, F, G, y H).

Figura 2 Fotografías de Axoclinus rubinoffi en isla Malpelo, Colombia. A) Estadio larval vista lateral A). B) Estadio larval vista dorsal. C) Estadio larval vista ventral. D) Acercamiento vista lateral. E y H) Adultos sobre algas coralinas incrustantes. F) Coloración de los dos sexos, macho (inferior). G) Adulto sobre algas filamentosas. Créditos de fotografías A, B, C y D: ©Laboratorio Imágenes Postgrado Biología Univalle-Ortega, Beltrán-León; E: ©Paola María Sánchez; G: ©B Guenard; H: ©Andrés Felipe Acosta.
Hábitat.- Las larvas son planctónicas y se encuentran principalmente en aguas poco profundas y cercanas a la zona rocosa. Capturadas durante marzo de 2015, en MW-N y MW1-N (Figura 1), al oeste de Malpelo en la noche, con una temperatura superficial: 24,9 °C; salinidad superficial: 30,62-30,66 (media = 30,64); profundidad de muestreo: 27,9-29,3 m (media = 28,6 m); distancia de la isla: 0,8 y 1,61 km; hora: 21:12 - 21:55. Durante septiembre de 2017 capturadas en la noche en las localidades de El Arrecife y La Nevera,. Temperatura superficial: 26,1-26,2 °C (media = 26,15 °C); salinidad superficial: 31,2-31,3 (media = 31,25); profundidad de muestreo: 1 m; distancia de la isla: 20 m aproximadamente; hora: 19:34 - 20:13. Durante mayo de 2019 capturadas en la localidad La Nevera al oeste de la isla en la noche temperatura superficial: 28,05 °C; salinidad superficial: 32,98; profundidad de muestreo: 1 m; distancia de la isla: 20 m aproximadamente; hora: 18:35. Por el contrario, los adultos son bentónicos de fondos rocosos cubiertos con algas coralinas incrustantes y algas filamentosas (Figura 2E, G y H). Fueron colectados entre 0-30 m de profundidad, durante horas del día y en las localidades mostradas en la figura 1.
Abundancia.- La densidad de las larvas fue baja en las estaciones donde se capturaron. Con 5,8 individuos/m2 en MW-N y 2,7 individuos/m2 en MW1-N durante marzo de 2015, donde la familia Tripterygiidae presentó una abundancia relativa de 1,03 % del total de larvas colectadas. En la localidad del Arrecife fue de 0,1 individuos/m2 y en La Nevera de 0,3 individuos/m2, con abundancia relativa de 0,70 % durante septiembre de 2017. Durante mayo de 2019, en la localidad de La Nevera se registraron 0,5 individuos/m2, representando una abundancia relativa de 0,41 % del total de larvas colectadas.
La densidad de A. rubinoffi (adultos + juveniles) en la localidad del Arrecife (640 m2 muestreados) fue de 0,02 individuos/m2; en La Nevera (600 m2 muestreados) de 0,07 individuos/m2, en La Pared del Náufrago (600 m2 muestreados) de 0,10 individuos/m2 y en el Bajo del Junior (560 m2 muestreados) de 0,56 individuos/m2. Para las cuatro localidades muestreadas (2 400 m2) la densidad promedio de la especie fue 0,19 individuos/m2.
Estado de conservación.- Vulnerable D2 en la Lista Roja de la UICN de Especies Amenazadas y Libro Rojo de peces Marinos de Colombia la IUCN (Hastings et al. 2010a; Zapata y Chasqui-Velasco, 2017a).
Especies similares.- Las larvas de los tripterygiidos se parecen a las larvas de los labrisómidos pero generalmente se pueden distinguir por combinaciones de caracteres de pigmentación, merística y morfometría. Las tres aletas dorsales de las especies de esta familia las separan claramente de otras larvas de Blennioidei una vez alcanzan 10 mm de LT. Axoclinus rubinoffi (D III+XII+10; A II,17-18; Pc 15) es endémica de Malpelo y se puede separar de las otras especies similares por merística: Lepidonectes bimaculatus (D III+XIII,10-11; A II,19; Pc 17) y A. lucillae (D III+XII+9; A II, 17; Pc 15-16); esta última no se distribuye en la isla, pero si se encuentra en aguas someras de la costa del POT. En el estadio adulto, A. cocosensis Bussing (1991), endémico de isla del Coco, presenta una morfología y coloración similar; sin embargo, A. rubinoffi difiere de esta especie al no poseer una línea blanca que separa la barra del pedúnculo y la aleta caudales.
Triple aleta candela
Lepidonectes bimaculatusAllen y Robertson, 1992
Morfología.- La única larva encontrada en estado de flexión presentó una longitud total de 8,1 mm; longitud estándar de 7,1 mm; cuerpo alargado; LpA 45 % de la LE; LC (20-33 % de LE) y ojo (DO 25-33 % de LC) moderados; durante este estadio se cuenta con la tercera aleta (radios blandos) formada por 11 radios, aleta anal con II espinas y 20 radios; se inicia la formación de las dos primeras aletas dorsales (radios duros o espinas) y las pélvicas hasta completar el desarrollo de todas las aletas; con 43 miómeros.
La fase adulta presentó un cuerpo moderadamente alargado; cirro grande sobre el ojo; espínulas en la cabeza y en la base de los primeros radios dorsales; tres aletas dorsales III-XII-11, raramente 10; aleta anal II-19, raramente 18; aletas pectorales con 16 radios; línea lateral en dos secciones; dos escamas por encima de la línea lateral a la base del primer radio caudal; seis escamas por debajo de la línea lateral a la base de los radios anales; aleta pélvica I-2 y aleta caudal convexa con 14 radios. Los datos morfométricos y merísticos se muestran en detalle en la Tabla 1.
Coloración.- Las larvas son transparentes y en estado de flexión no presentan pigmento en la cabeza. Por el contrario, si presentan pigmento cerca a la sínfisis cleitral, en el cuerpo cerca al ano, en serie ventral postanal 22 cromatóforos, tres y uno sobre el pedúnculo caudal, uno pequeño en el centro del pedúnculo caudal y pigmentos internos en la parte anterior del intestino y sobre la vejiga natatoria (Figura 3 A, B, C, y D). Los juveniles presentan la mitad superior de la cabeza con coloración gris a azul oscura y líneas irregulares iridiscentes, la mitad inferior de la cabeza blanquecina; cuerpo con barras cafés oscuras que forman una franja medio lateral ancha; barras delgadas con coloración rojiza en la mitad superior del cuerpo y la mitad inferior blanca; dos manchas de color blanco en la mitad superior del cuerpo; primera aleta dorsal blanca; segunda y tercera aleta dorsal transparentes; aleta caudal transparente; aletas pectorales y pélvicas amarillas; mancha negra en el pedúnculo caudal (Figura 3 E y F). Los adultos presentan una coloración naranja en la mitad superior del cuerpo; mitad inferior con coloración amarilla; borde de la aleta anal y caudal blanco; dos manchas de color blanco en la mitad posterior del cuerpo; hembras con aleta dorsal con coloración naranja en la base y margen exterior blanquecino; machos con aleta dorsal de base amarilla, radios y margen exterior negros; aletas pectorales y pélvicas amarillas; mancha café en el pedúnculo caudal, la cual es más evidente en los machos (Figura 3 G y H).
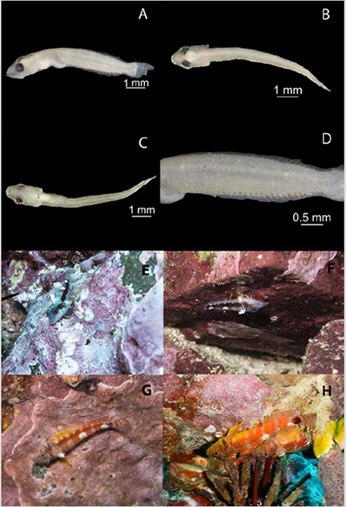
Figura 3 Fotografías de Lepidonectes bimaculatus en Isla Malpelo, Colombia. A) Estadio larval vista lateral. B) Estadio larval vista dorsal. C) Estadio larval vista ventral. D) Estadio larval acercamiento vista lateral. E y F) Juveniles. G) Fotografía de una hembra. H) Fotografía macho y hembra. Créditos de fotografías A, B, C y D: ©Laboratorio Imágenes Postgrado Biología Univalle-Ortega, Beltrán-León; E, F, G: ©Paola María Sánchez.
Hábitat.- Las larvas son planctónicas y se encontraron principalmente en aguas poco profundas sobre la zona rocosa, hábitat de los adultos. Capturadas en las localidades del Arrecife al este de la isla y La Nevera al oeste de la isla en la noche durante septiembre de 2017. Temperatura superficial: 26,1-26,2 °C (media = 26,15 °C); salinidad superficial: 31,2-31,3 (media = 31,25); profundidad de muestreo: 1 m; distancia de la isla: 20 m aproximadamente; hora: 19:34-20:13. Durante mayo de 2019 capturadas en la localidad La Nevera al oeste de la isla en la noche temperatura superficial: 28,05 °C; salinidad superficial: 32,98; profundidad de muestreo: 1 m; distancia de la isla: 20 m aproximadamente; hora: 18:35. Los adultos son bentónicos de fondos rocosos cubiertos con algas coralinas incrustantes (Figura 3E, F, G y H). Fueron colectados entre 0- 30 m de profundidad, durante horas del día y en las localidades mostradas en la figura 1. Es común encontrarse a los juveniles en rocas expuestas, mientras que los adultos permanecen más tiempo en grietas y en las caras internas de las rocas, usualmente en posición invertida (Figure 3F, G y H).
Abundancia.- La densidad larval fue baja en las estaciones donde se capturaron individuos. En la localidad del Arrecife fue de 0,2 individuos/m2 y en La Nevera 0,3 individuos/m2. Donde la familia Tripterygiidae presento una abundancia relativa del 0,87 % del total de larvas colectadas durante septiembre de 2017.
En cuanto a los adultos y juveniles, la densidad de L. bimaculatus en la localidad de La Nevera (600 m2 muestreados) fue de 0,12 individuos/m2, en el Arrecife (640 m2 muestreados) de 0,15 individuos/m2; en el Bajo del Junior (560 m2 muestreados) de 0,17 individuos/m2 y en La Pared del Náufrago (600 m2 muestreados) de 0,45 individuos/m2. Para las cuatro localidades muestreadas (2 400 m2) la densidad promedio de la especie fue de 0,22 individuos/m2.
Estado de conservación. - Vulnerable D2 en la Lista Roja de la UICN de Especies Amenazadas y Libro Rojo de peces Marinos de Colombia la IUCN (Hastings et al., 2010a; Zapata y Chasqui-Velasco, 2017a).
Especies similares.- Las larvas Lepidonectes bimaculatus (D III+XIII, 10-11 A II, 19 Pc 17) se pueden separar de las otras especies similares en la zona por merística: A. rubinoffi (D III+XII+10 A II, 17-18 Pc 15) y A. lucillae (D III+XII+9 A II, 17 Pc 15-16). Lepidonectes bimaculatus presenta forma y conteos similares a L. clarkhubbsi Bussing, 1991; sin embargo, difieren en cuanto a su coloración ya que los juveniles de L. clarkhubbsi presentan barras distintivas en la zona lateral del cuerpo y las hembras son de coloración blanquecina.
DISCUSIÓN
El presente trabajo aporta datos morfológicos de estadios larvales de las especies endémicas A. rubinoffi y L. bimaculatus en el Santuario de Fauna y Flora Malpelo. También proporciona información que complementa la abundancia, distribución y morfología de la fase adulta pues se incluyen mediciones de una serie mayor de individuos que aquella empleada en la descripción original realizada por Allen y Robertson (1992), lo cual permite conocer mejor la variabilidad morfológica y merística de estas especies endémicas.
Aunque se han realizado 27 expediciones científicas al SFF Malpelo en diferentes épocas del año para monitorear el ictioplancton desde 2006, solo en una (3,7 %) de las expediciones realizadas (marzo de 2015) fueron capturadas larvas de la familia Tripterygiidae, correspondiendo a dos de las seis estaciones tradicionalmente muestreadas. Adicionalmente, estas especies fueron capturadas en dos (50 %) de las expediciones donde se involucraron nuevas estaciones sobre El Arrecife y La Nevera. Lo anterior puede indicar que las larvas de esta familia son comúnmente encontradas en lugares cercanos a los sustratos duros, principalmente de roca en donde habitan los adultos.
Se resalta que los adultos de la especie A. rubinoffi fueron colectados en siete sitios, en dos de los cuales se encontró la especie a nivel larval. L. bimaculatus fue colectada en 11 sitios de los cuales en dos fueron encontradas sus larvas. Debido a la presencia de adultos en todos los sitios de colecta, se sugiere que la reproducción y por lo tanto las larvas, deben estar presentes en todos los lugares de la isla en donde se distribuyen los adultos, pero debido a la falta de muestreos larvales cercanos a la isla y asociados a los arrecifes y sustratos duros no habían sido colectadas antes. Realizar estos muestreos daría la oportunidad de obtener más estadios que permitan describir su desarrollo ontogénico completo, pues en los muestreos sólo se capturaron larvas en estado de flexión. A pesar de las pocas larvas encontradas, su estado de desarrollo indica que ha trascurrido poco tiempo desde su eclosión, por lo que se podría especular que los adultos presentan varios picos reproductivos al año durante los meses de marzo, mayo y septiembre.
El número de individuos examinados en este estudio permite ampliar el conocimiento que se tiene de la variabilidad natural de estas dos especies en cuanto a los rasgos morfológicos y merísticos. Los conteos de elementos en adultos de A. rubinoffi muestran valores similares en la aleta dorsal, anal, pélvica y caudal, pero algunas diferencias en los conteos de radios pectorales con respecto a la descripción original de Robertson y Allen (1992). La especie L. bimaculatus también presenta conteos similares en la aleta dorsal, pélvica y caudal, con leves diferencias en el número de radios de la aleta anal y pectoral. Las diferencias encontradas en la morfometría eran de esperarse debido al mayor número de individuos medidos en este trabajo, incluyendo un mayor rango de tamaño para ambas especies (14,8-24,5 mm LE en A. rubinoffi y 24,9-47,7 mm de LE en L. bimaculatus).
En cuanto a la abundancia de estas especies en Malpelo, se puede decir que la densidad promedio de A. rubinoffi (0,19 individuos/m2) y los valores obtenidos para la localidad de El Arrecife (0,02 individuos/m2) son similares a los encontrados hace casi una década por Chasqui-Velasco et al., 2011 (0,18 individuos/m2 y 0,024 individuos/m2 respectivamente). En contraste, se registran densidades de casi la mitad para las localidades del Bajo de Junior (0,56 individuos/m2), La Nevera (0,07 individuos/m2) y La Pared del Náufrago (0,10 individuos/m2). Con respecto a L. bimaculatus, se observaron valores similares en ambos trabajos para la localidad de La Nevera. Chasqui-Velasco et al. (2011) registran valores menores en las localidades Bajo del Junior (0,09 individuos/m2), La Pared del Náufrago (0,084 individuos/m2 ) y El Arrecife (0,043 individuos/m2), así como para la densidad promedio de la especie (0,08 individuos/m2 ). Los valores obtenidos en este trabajo para las mismas localidades fueron (0,17 individuos/m2; 0,45 individuos/m2 ; 0,15 individuos/m2 y 0,22 individuos/m2, respectivamente).
Las diferencias encontradas entre las densidades de ambos trabajos pueden deberse al esfuerzo de muestreo empleado en cada uno de ellos y a las variaciones demograficas inherentes a las especies durante las diferentes épocas de monitoreo. Se requiere realizar estudios con una mayor serie de tiempo e incluir en análisis posteriores otras metodologías como evaluaciones genéticas, las cuales estimen la diversidad genética y el tamaño poblacional efectivo. Dichos indicadores han sido reconocidos como importantes ya que permiten hacer inferencias de la persistencia de las especies endémicas a largo plazo (Ellstrand and Elam, 1993) pues procesos como la deriva genética, endogamia, cuellos de botella y eventos fundadores tienen un efecto sobre su diversidad y diferenciación (Lammi et al., 1999). Además han mostrado en algunos casos información que no es consistente con datos obtenidos en campo, por ejemplo, el tamaño poblacional efectivo puede ser menor que los tamaños poblacionales censuales (Turner et al. 2002). Es de suma importancia que la información existente pueda ser contrarestrada con indicadores genéticos, esto con el fin de comprender mejor las dinámicas de las especies e implementar medidas de conservación y manejo mas eficientes.
CONCLUSIONES
Las larvas de las especies A. rubinoffi y L. bimaculatus se encontraron en la columna de agua sobre el hábitat de los adultos, sustratos duros como fondos rocosos o coralinos, ratificando la importancia de mantener los muestreos en las nuevas estaciones que permiten capturar especies asociadas a los arrecifes y que difícilmente se podrán capturar en el resto de estaciones muestreadas.
El estadio inicial de desarrollo larval encontrado sugiere que los adultos presentan varios picos reproductivos al año durante los meses de marzo, mayo y septiembre.
Este estudio aporta información para el entendimiento de especies vulnerables que están definidas como objetos de conservación para el SFF Malpelo. En particular, se amplía el conocimiento de la variabilidad natural de los rangos morfológicos.y se aportan datos para la comprensión de factores biológicos que impulsan el éxito de las especies endémicas.
La densidad promedio de A. rubinoffi es similar a la encontrada por otros investigadores el 2011. Por el contrario, se detectan diferencias entre las densidades poblacionales para L. bimaculatus, presentando la especie mayores densidades que en el 2011. Para entender las dinámicas poblacionales de estas especies se hace necesario evaluar series de tiempo, implementar otras metodologías como las evaluaciones genéticas y continuar su monitoreo e investigación.
AGRADECIMIENTOS
La captura de las larvas se realizó en el marco de las expediciones científicas realizadas por la Fundación Malpelo y Parques Nacionales Naturales, con apoyo parcial de AG Consultores Ambientales y la Universidad del Valle. Por otro lado, los individuos adultos fueron capturados bajo el aval de investigación número 20182200001023 ante Parques Nacionales Naturales. Se agradece a las tripulaciones de la M/N “María Patricia” y M/N “FEROX” por el apoyo logístico. A Graciela Serna y a Marisol Rivera por su colaboración para la toma de muestras. A Parques Nacionales por apoyar financieramente la separación y análisis de las muestras de los cruceros de septiembre 2017 y mayo 2019. A Nancy Murillo y Paola Rojas, jefes del área por su constante apoyo. A Alan Giraldo y Katherine Muñoz por el apoyo administrativo del convenio con Parques Nacionales para la separación y análisis de las muestras del crucero de mayo 2019. A Fernando Zapata y su grupo de investigación Ecología de Arrecifes Coralinos por suministrar los datos de los monitoreos de peces endémicos. A Paola María Sánchez por suministrar fotos in situ de las especies endémicas y a Manuel Francisco Cano por la realización del mapa. A Juan Felipe Ortega Giraldo del Laboratorio de imágenes del postgrado en Ciencias-Biología de la Universidad del Valle por la toma de fotografías de los estadios larvales. Esta publicación corresponde al aporte número 17 del Instituto de Ciencias del Mar y Limnología (INCIMAR) de la Universidad del Valle.
REFERENCIAS
Allen, G. R. and D. R. Robertson. 1992. Three new species of triplefins (Pisces: Tripterygiidae) from Malpelo and Socorro Islands, in the tropical Eastern Pacific. Revue Fr. Aquariol., 19: 53-56. [ Links ]
Beltrán-León, B. S. y R. Ríos. 2000. Estadios tempranos de peces del Pacífico colombiano. Instituto Nacional de Pesca y Acuicultura-INPA, Buenaventura. 727 p. [ Links ]
Carter, K. M., C. M. Woodley and R. S. Brown. 2011. A review of tricaine methanesulfonate for anesthesia of fish. Rev. Fish Biol. Fisheries, 2:51-59. [ Links ]
Chase, R. E. 1968. Sea floor topography of the central eastern Pacific Ocean. BCF Circ. US Fish Wildlife Serv., 291: 33. [ Links ]
Chasqui-Velasco, L.,D. L. Gil-Agudelo and R. Nieto 2011. Endemic shallow reef fishes from Malpelo Island: abundance and distribution. Bol. Investig. Mar. Costeras, 40: 107-116. [ Links ]
Ellstrand, N. C. and D. R. Elam. 1993. Population genetic consequences of small population size: implications for plant conservation. Annu. Rev. Ecol. Evol. Syst, 24: 217-242. [ Links ]
Frankham, R .1997. Do island populations have less genetic variation than mainland populations?. J. Heredity, 78: 311-327. [ Links ]
Fricke, R., W.N. Eschmeyer and R. van der Laan. 2020. Eschmeyer´s catalog of fishes: genera,species,references.http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp [ Links ]
Graham, J.B. 1975. The biological investigation of Malpelo Island, Colombia. Smithson.Contr. Zool., 176: 52-54. [ Links ]
Hamrick, J. L. and M. J. W. Godt. 1996. Effects of life history traits on genetic diversity in plant species. Philos. Trans. R. Soc. Lond., B, Biol. Sci., 351: 1291-1298. [ Links ]
Hastings, P., A. Dominici-Arosemena and S. Bessudo. 2010a.Axoclinus rubinoffi . The IUCN Red List of Threatened Species 2010. https://dx.doi.org/10.2305/IUCN.UK.2010-3.RLTS.T183612A8144526.en . 14/07/2020. [ Links ]
Hastings, P., A. Dominici-Arosemena and S. Bessudo. 2010b.Lepidonectes bimaculatus. The IUCN Red List of Threatened Species 2010. https://dx.doi.org/10.2305/IUCN.UK.2010-3.RLTS.T183612A8144526.en. [ Links ]
Hoernle, K., P. van den Bogaard and R. Werner. 2002. Missing history (16-71 Ma) of the Galápagos hotspot: implications for the tectonic and biological evolution of the Americas. Geology, 30: 795-798. [ Links ]
Lammi, A., P. Siikamäki and K. Mustajärvi. 1999. Genetic diversity, population size and fitness in central and peripheral populations of a rare plant Lychnis viscaria. Conserv. Biol, 13: 1069-1078. [ Links ]
Lonsdale, P. and K. D. Klitgord. 1978. Structure and tectonic history of the eastern Panama Basin. Geol. Soc. Am. Bull., 89: 981-999 [ Links ]
Moser, H. 1996. The early stages of fish in the California current region. Cal. Coop. Ocean. Fish. Inv. Atlas, 1441 p. [ Links ]
Nelson, J. S., T. C. Grande and M. V. Wilson. 2016. Fishes of the world. John Wiley & Sons. 707 p. [ Links ]
Pimm, S.L. and S.L. Pimm. 1991. The balance of nature?: ecological issues in the conservation of species and communities. University of Chicago Press. 404 p. [ Links ]
Quimbayo, J. P., F. A. Zapata, S. R. Floeter, S. Bessudo and I. Sazima. 2010. First record of cleaning by a triplefin blenny in the Tropical Pacific. Coral Reefs. DOI 10.1007/s00338-010-0656-8. [ Links ]
Robertson, D. R. y G. R. Allen. 2015. Peces costeros del Pacífico Oriental Tropical: sistema de información en línea, ver. 2.0 https://biogeodb.stri.si.edu/sftep/es/pages. 1/07/2020 [ Links ]
Rocha, L. A. and Bowen, B. W. 2008. Speciation in coral-reef fishes. J Fish Biol., 72:1101-1121. [ Links ]
Rodríguez-Rubio, E. y A. Giraldo. 2011. Características oceanográficas en Isla Malpelo y su relación con la cuenca oceánica del Pacífico colombiano . Bol. Invest. Mar. Cost., 40:19-32. [ Links ]
Rosenblatt, R. H. 1960. The Atlantic species of the blennioid fish genus Enneanectes . Proc. Acad. Nat. Sci. Philadelphia, 112: 1-23. [ Links ]
Rosenblatt, R.H., E.C. Miller and P.A. Hastings. 2013. Three new species of triplefin blennies of the genus Enneanectes (Teleostei, Tripterygiidae) from the Tropical Eastern Pacific with a key to Pacific species of Enneanectes. Zootaxa, 3636: 361-373. [ Links ]
Ruck, J. G. 1973. Development of Tripterygion capito and T. robustum (Pisces, Tripterygiidae). Zool. Pub. Univ. Wellington, 63:1-10. [ Links ]
Ruck, J.G. 1980. Early development of Forsterygion varium, Gilloblennius decemdigitatus and G. tripennis (Pisces: Tripterygiidae). N. Z. J. Mar. Freshwater Res., 14:313-326. [ Links ]
Sclater, P.L.1858. On the general geographic distribution of the members of the class Aves. J. Proc. Linn. Soc., 2: 130-145. http://dx.doi.org/10.1111/j.1096-3642.1858.tb02549.x. [ Links ]
Shiogaki, M. and Y. Dotsu . 1973. The egg development and larva rearing of the tripterygiid blenny, Tripterygion etheostoma. Jpn. J. Ichthyol., 20:42-46. [ Links ]
Shiogaki, M. and Y. Dotsu. 1988. Tripterygiidae. 733-734. In Okiyama, M. (Ed.). An atlas of early stage fishes in Japan. Tokai Univ. Press, Tokyo. 1896 p. [ Links ]
Smith, L. y S. Richardson. 1979. Técnicas modelo para prospecciones de huevos y larvas de peces pelágicos. FAO. Doc. Tec. Pesca, 175, 107 p. [ Links ]
Turner, T. F., J. P. Wares and J. R. Gold. 2002. Genetic effective size is three orders of magnitude smaller than adult census size in an abundant, estuarine-dependent marine fish (Sciaenops ocellatus). J. Genet.,162: 1329-1339. [ Links ]
Victor, B. C . 2013. The Caribbean roughhead triplefin (Enneanectes boehlkei): DNA barcoding reveals a complex of four West Indian sympatric cryptic species (Teleostei: Blennioidei: Tripterygiidae). J. Ocean Sci. Found., 7: 44-73. [ Links ]
Wirtz, P. 1978. The behaviour of the Mediterranean Tripterygion species (Pisces, Blennioidei). Z. Tierpsychol., 48:142-174. [ Links ]
Zapata, F. A. y L. Chasqui-Velasco . 2017a. Axoclinus rubinoffi. En: Chasqui-Velasco, L., A. Polanco, A. Acero , P.A. Mejía-Falla, A. Navia, L.A. Zapata y J.P. Caldas (Eds.). [ Links ]
Zapata, F. A. y L. Chasqui-Velasco .2017b. Lepidonectes bimaculatus: 188-190. En: Chasqui-Velasco, L., A. Polanco, A. Acero, P.A. Mejía-Falla, A. Navia, L.A. Zapata y J.P. Caldas (Eds.). [ Links ]
Recibido: 25 de Julio de 2020; Aprobado: 08 de Noviembre de 2020











 text in
text in 



