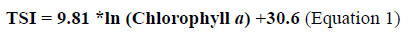Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.1 Santa Marta jan./jun. 2021 Epub 17-Set-2021
https://doi.org/10.25268/bimc.invemar.2021.50.1.980
Artículos de Investigación
Distribución espacial y aumento a través del tiempo de microplásticos en sedimentos de la Bahía de Buenaventura, Pacífico colombiano
1Centro Nacional de Electromagnetismo Aplicado (CNEA). Ave. de Las Américas s/n Esqu. I. Campus J. A. Mella, Universidad de Oriente, Santiago de Cuba, Cuba.
2Delegación del Ministerio de Ciencia Tecnología y Medioambiente (CITMA), Santiago de Cuba, Cuba.
3Delegación del Ministerio de Ciencia Tecnología y Medioambiente (CITMA), Santiago de Cuba, Cuba
4Delegación del Ministerio de Ciencia Tecnología y Medioambiente (CITMA), Santiago de Cuba, Cuba
5Empresa de Flora y Fauna. Delegación Santiago de Cuba, Santiago de Cuba, Cuba.
6Centro Oriental de Ecosistemas y Biodiversidad (BIOECO), Santiago de Cuba, Cuba.
The Baconao Lagoon is a tropical, coastal and littoral ecosystem which receives continuous natural and human perturbations; favoring the eutrophication process, and consequently, the phytoplankton proliferation. The starting point of this research begins with a massive fish kill report into the lagoon on May 2017, being the main objective to document the implementation of a risk management protocol for the phycotoxin presence, adapted to the ecosystem conditions, considering the characterization of the risk event, focusing on mitigation and prevention of negative impacts. The presence of a mix Harmful Algal Bloom (HAB) in remission was confirmed, with negative implications to the entire ecosystem. It was identified the presence of abundant motile cells of Gymnodinium sp., Karlodinium micrum and dinoflagellate cells rests, as well as high values of chlorophyll a, being the highest concentration 20.37 ± 0.04 µgL-1; low values of dissolved oxygen, and an important bacterial contamination, with the dominance of cyanobacteria. The implementation of a risk management protocol was documented with important methodological guidelines to follow to the management of similar risk events, where the intersectoral alliance performs a key success factor.
KEYWORDS: Cyanobacteria; Harmful Algal Bloom (HAB); Gymnodinium sp.; Karlodinium micrum; Baconao Lagoon.
La laguna de Baconao es una laguna tropical costero-litoral, con constantes perturbaciones antrópicas y naturales; escenario que favorece la eutrofización, con tendencia a la proliferación del fitoplancton. El desarrollo de esta investigación comienza con un registro de muerte masiva de peces en la laguna, en mayo de 2017, siendo el objetivo principal documentar la implementación de un protocolo de gestión del riesgo por contaminación con ficotoxinas, adaptado a las condiciones del ecosistema, a partir de la caracterización de la situación de riesgo, enfocado a la mitigación y prevención de impactos negativos. Se confirma la existencia de una Floración Algal Nociva (FAN) mixta en remisión, con implicaciones negativas en todo el ecosistema, así como la presencia de células vivas de Gymnodinium sp., Karlodinium micrum, y abundantes restos de células de otros dinoflagelados; altos valores de clorofila a, con una concentración máxima de 20,37 ± 0,04 µgL-1; bajos valores de oxígeno disuelto y elevada contaminación bacteriana, con predominio de cianobacterias. Se documenta la implementación de un protocolo de gestión del riesgo con importantes pautas metodológicas a seguir para el manejo de similares eventos de riesgo, donde la alianza intersectorial constituyó un factor clave de éxito.
PALABRAS CLAVE: Cianobacterias; Floraciones Algales Nocivas (FAN); Gymnodinium sp.; Karlodinium micrum; Laguna de Baconao.
INTRODUCCIÓN
El desarrollo socioeconómico de las ciudades costeras produce un impacto negativo significativo sobre la calidad de los recursos y servicios que ofrecen los ecosistemas. Especialmente las bahías y lagunas costeras constituyen ecosistemas en conflicto, ya que sirven como receptores de residuales, lo que les hace ser sistemas muy vulnerables al estar sometidos a una gran presión antrópica y a un acelerado ritmo de deterioro (Gómez, 2013), a la vez que desde el punto de vista estético juegan un papel relevante, constituyendo elementos clave de la paisajística local. Estos ecosistemas sustentan actividades turísticas y recreativas, así como el desarrollo de numerosas industrias y actividades costero-dependientes relacionadas con la comunicación, el turismo y el comercio marítimo.
La eutrofización es uno de los mayores problemas que enfrentan los ecosistemas acuáticos, entendida ésta como el proceso natural y/o antropogénico que consiste en el enriquecimiento de las aguas con nutrientes, a un ritmo tal que no puede ser compensado por la mineralización total. De esta manera la descomposición del exceso de materia orgánica produce una disminución progresiva del oxígeno disuelto, con implicaciones en la trama trófica y la salud ecosistémica. Las aguas eutróficas tienen un alto nivel de productividad y de biomasa en todos los niveles tróficos, favoreciendo la proliferación de algas; las aguas profundas se tornan pobres en oxígeno y hay un crecimiento intenso de las plantas acuáticas (Arce, 2007). Lo anterior impacta negativamente los servicios ecosistémicos, afectando los distintos usos que el hombre hace de éstos.
Entre los efectos colaterales de la eutrofización pueden mencionarse las Floraciones Algales Nocivas (FAN); eventos naturales multicausales, cada vez más registrados a nivel mundial en aguas superficiales (Carmichael, 2001; Anderson et al., 2008; Alawadi, 2010; Verity, 2010; Calandrino y Paerl, 2011), cuya diversidad e impacto representan un reto para el manejo de recursos costeros amenazados (Anderson, 2004).
Los organismos fitoplanctónicos causales de FAN incluyen dinoflagelados, cianobacterias, diatomeas y otros grupos del fitoplancton (prymnesiophytas y raphidophytas) de menor importancia. De manera general, existen los que producen toxinas y por lo tanto, pueden contaminar los alimentos marinos o producir mortandad de peces, y los que no las producen pero causan otros efectos nocivos, tales como mortandad de organismos por anoxia, mortandad de peces por daño físico a sus branquias u otros órganos, y producción de mucílagos u otros metabolitos que afectan la calidad del ambiente (Carreto et al., 2007). La mayor parte de las especies están asociadas a los eventos no tóxicos, mientras que solo unas pocas docenas producen toxinas (Anderson, 2004).
En Cuba, las FAN constituyen un problema que necesita ser aún más estudiado, si bien en el oriente cubano han sido objeto de investigación desde 2001 en varios ecosistemas, destacando las bahías de Santiago de Cuba y Guantánamo (Gómez et al., 2001, 2006, 2007, 2014; Gómez, 2007; CITMA, 2011), el río San Juan (Echavarría et al., 2002), reservorios de agua de abasto a la población (Gómez et al., 2010, 2011; Rodríguez-Tito et al 2017), y desde 2011, la laguna de Baconao.
La laguna de Baconao es una laguna tropical costero-litoral, ubicada en la costa suroriental de Cuba; separada del mar por un cordón litoral y un canal estrecho, con altos niveles de azolvamiento debido a constantes perturbaciones antrópicas y naturales. Dichas características imponen al ecosistema una dinámica que afecta el tiempo de residencia del agua, y por tanto, el gradiente de gases y nutrientes, la productividad primaria y la producción orgánica total. Este escenario favorece la eutrofización, con tendencia a la proliferación de especies fitoplanctónicas, que encuentran en estas aguas las condiciones tróficas, de iluminación y temperatura ideales. Las FAN han ocurrido en este ecosistema de forma recurrente desde 2011, acompañadas de discoloración de las aguas y muerte de peces en 2011, 2012, 2014 y 2017, identificándose en todos los casos la presencia de dinoflagelados tóxicos (Gómez et al., datos no publicados). La presencia recurrente de indicadores de riesgo hacen que este ecosistema necesite un sistema de control y seguimiento que permita tomar medidas efectivas, siendo importante el desarrollo de una cultura temprana a través de la percepción, que permita comprender el riesgo de manera integrada (Gómez, 2013). El desarrollo de esta investigación comienza con un registro de muerte masiva de peces en la laguna de Baconao en mayo de 2017; ante esta situación la Delegación del Ministerio de Ciencia, Tecnología y Medioambiente (CITMA) en Santiago de Cuba, toma la decisión de convocar a la Empresa Flora y Fauna, perteneciente al Ministerio de la Agricultura, con responsabilidad en el manejo del ecosistema; y al Laboratorio de Ecotoxicología y Servicios Ambientales (LESA), perteneciente al Centro Nacional de Electromagnetismo Aplicado (CNEA), entidad de ciencia e innovación tecnológica (ECIT) adscripta a la Universidad de Oriente, Santiago de Cuba, Cuba, con experiencia en la caracterización y manejo de FAN.
El objetivo general de este estudio consiste en establecer las bases científicas y metodológicas para la implementación de un protocolo de gestión del riesgo por contaminación con ficotoxinas marinas, adaptado a las características del ecosistema, estableciendo pautas metodológicas para su generalización. Se consideran como objetivos específicos: 1) caracterizar la situación de riesgo que dio origen al evento, 2) definir el procedimiento específico para la toma de decisiones, y 3) definir la metodología necesaria para la implementación del protocolo.
ÁREA DE ESTUDIO
La laguna de Baconao está localizada en el municipio Santiago de Cuba, a unos sesenta kilómetros de la ciudad (Latitud: 19,9097°, Longitud: -75,4667°) (Figura 1). Este es un ecosistema semicerrado con una superficie aproximada de 4 km², que recibe la influencia del río Baconao y el influjo de las mareas, con una heterogeneidad espacial visible y una profundidad media de 6 m. La laguna se ubica en los límites de la Reserva de la Biosfera homónima, situada en el macizo montañoso Sierra Maestra, con categoría 2 según el Sistema de Categorías de la UICN y clasificada como Área Protegida de Recursos Manejados (CNAP, 2004).
La laguna es un biotopo frágil, vulnerable a eventos extremos como huracanes, sequías, abundantes lluvias, aumento de la irradiación solar por pérdida de cobertura vegetal, alterándose no solo parámetros fisicoquímicos, sino la trama ecológica del acuatorio. Esta laguna sostiene una importante diversidad biológica, con elementos destacados como los manglares circundantes, afectados por variables ambientales y por la presión antrópica, por lo que han sido seleccionados como objetos de conservación (Figueredo y Acosta, 2008). El nivel de afectación antrópica que han recibido los manglares del área se debe fundamentalmente al vertimiento de residuales líquidos y sólidos, producidos por las comunidades cercanas, y la actividad turística, con implicaciones en sus procesos fisiológicos. Asimismo, la pérdida de hábitat, que se manifiesta en la reducción del área ocupada, es la amenaza que más afecta a los manglares, lo que se asocia fundamentalmente con la tala para la conversión de los sitios en zonas turísticas (Figueredo y Acosta, 2008), entre otros usos, observándose una disminución de la superficie total de la laguna.
Entre los principales usos del ecosistema se encuentra el recreacional, asociado a actividades de paseo y visualización; actividades de conservación, agricultura, así como la cría y reproducción del delfín Tursiops truncatus (especie introducida), lo que añade otro conflicto de uso al ecosistema, con implicaciones en los planes de manejo; además de un criadero de cocodrilos (Crocodylus acutus).
MATERIALES Y MÉTODOS
Elaboración e implementación del protocolo de gestión del riesgo
El referente metodológico utilizado para la elaboración del protocolo de gestión de riesgo por contaminación con ficotoxinas es el establecido por Gómez et al. (2012) (Figura 2), a partir del cual se elabora un esquema general de trabajo que se presenta como resultado de esta investigación. El protocolo incluye indicadores primarios y secundarios que, si bien no pueden sustituir la detección de toxinas, son análisis complementarios obligatorios, de gran valor para la implementación de cualquier alternativa de manejo basada en el principio precautorio, sobre todo en aquellos contextos donde no sea viable la detección de toxinas. Es importante considerar ambos indicadores ya que no todos los eventos causados por algas nocivas están asociados al desarrollo de grandes acumulaciones de biomasa capaces de producir un cambio de color en las aguas; existen especies que son nocivas aún en muy bajas concentraciones (Carreto et al., 2007). Las FAN pueden alcanzar concentraciones del orden de 106 célL-1 e incluso superiores; sin embargo, ha sido reportado que un episodio tóxico puede afectar a concentraciones celulares del orden de 102 célL-1 (Sar et al., 2002), lo que justificaría la necesidad de implementación del protocolo de gestión de riesgo en caso de presencia de especies potencialmente tóxicas.

Figura 2. Protocolo general para el manejo integrado del riesgo por contaminación con biotoxinas (Gómez et al., 2012; Gómez, 2013).
Metodología de muestreos y análisis cualitativos
Para los análisis de caracterización del riesgo fueron procesadas, en primera instancia, muestras obtenidas por terceros (especialistas del CITMA y Flora y Fauna) en el momento del primer aviso al Laboratorio de Ecotoxicología y Servicios Ambientales (LESA). Estas muestras fueron tomadas directamente en botellas de borosilicato sin preservo para observaciones en fresco. En el laboratorio se realizaron análisis cualitativos (identificación de especies fitoplanctónicas, y quistes de dinoflagelados) para elaborar un informe de inmediatez y garantizar la implementación de la primera fase del protocolo.
Posteriormente se realizaron análisis cuantitativos (recuento de fitoplancton, análisis de parámetros fisicoquímicos del agua) para caracterizar la situación de riesgo a partir de muestras tomadas por los expertos en puntos de muestreo específicos. Dichos puntos fueron establecidos a partir de un viaje exploratorio realizado al ecosistema, ubicándolos en los sitios donde se registró cambio de coloración o muerte de peces, así como puntos de referencia de otros estudios realizados en la laguna por intereses sectoriales, considerando para su selección criterios relacionados con los usos y posibles vertidos puntuales. Se incluye un punto de muestreo localizado en la vertical de la parte más profunda de la masa de agua (Punto 5, Figura 1).
Se establecen cinco puntos de muestreo: 1. El Fanguito 1; 2. El Fanguito 2; 3. Patana; 4. Canal y 5. Centro de la laguna. Otros muestreos fueron incorporados durante los días subsiguientes, en relación con la evolución de la FAN, la presencia de espumas, o zonas con discoloración intensa. Se analizaron, además, muestras biológicas (branquias) pertenecientes a peces muertos recogidos en las orillas del acuatorio como evidencia de la situación de riesgo.
La toma de muestras se realizó en horas de la mañana (8:00-9:00 am). Se realizó de forma directa en los primeros 30 cm de la columna de agua en cada uno de los puntos de muestreo, tomando tres muestras integradas (De la Cruz, 1984; Venrick, 1995). Para ayudar en la identificación del fitoplancton se realizó además un muestreo cualitativo con una red de 20 µm de luz de malla con un diámetro de 24 cm y 1 m de profundidad, con colector de PVC de 250 mL con ventanas laterales recubiertas de malla. Previamente se determinó la profundidad del punto de muestreo, con ayuda de una sonda YSI Pro DSS (USA), para evitar la remoción de sedimento durante el muestreo. La red se arrastró verticalmente en la columna de agua, hasta conseguir un filtrado visible.
Durante todo el muestreo se usaron las medidas de protección pertinentes (botas, guantes, nasobucos y gafas), considerando la situación de riesgo potencial. Las muestras fueron recolectadas en frascos de borosilicato estériles de 250 a 500 mL con tapas de rosca, dejando un espacio entre la superficie de la muestra y el tapón o cierre, para permitir el intercambio gaseoso, según sugieren diferentes protocolos de muestreos de fitoplancton (FWE et al., 2005; Greenberg et al., 2008). Convenientemente etiquetadas y fijadas con solución de Lugol (manteniendo al menos una muestra por punto sin fijar) las muestras fueron trasladadas al laboratorio en completa oscuridad, guardando las medidas asépticas pertinentes para no propiciar su contaminación, procediéndose de inmediato a su recuento y análisis. Toda la manipulación de las muestras se realizó con guantes de látex, siguiendo las medidas higiénico-sanitarias y de bioseguridad correspondientes.
Identificación de especies fitoplanctónicas
Se realizaron observaciones en fresco o de muestras fijadas (Lugol neutro al 1 %), utilizando un microscopio óptico Motic B profesional vertical (Alemania). Se observaron muestras concentradas a partir de la resuspensión en 1 mL de un filtrado de 20 mL, el que se realizó con ayuda de membranas filtrantes de acetato de celulosa de 25 mm y 0,2 µm, además de las tomadas con la red. Se incluyeron en estos análisis muestras previamente incubadas durante siete días después de haber sido enriquecidas con medio f2, mantenidas en condiciones de luz continua Day Light, Philips 40 W (TLT 40 W/54 RS), a una intensidad de 58,59 mE m-2s-1 y una temperatura de 20,12 ± 2 °C. Se colocaron 2 a 3 gotas de cada muestra en un portaobjeto para su observación al microscopio óptico, observando y fotografiando al menos cinco réplicas panorámicas por muestra, y fotografías individuales, mediante una cámara digital Panasonic DMC-LC50 de 3,2 Mpixs con 3X de zoom óptico y 9X de zoom digital.
A partir de estas observaciones se identificaron las microalgas presentes hasta especie, siempre que fuera posible, utilizando varias claves dicotómicas y criterios taxonómicos (Bold y Wynne, 1978; Biagini, 1980; Dillard, 1999; Faust y Gulledge, 2002; Wher y Sheath, 2003); además de consultas on-line en diferentes sitios: Infoseek (Japón), la galería de especies fitoplanctónicas del MIT (EUA); y las bases on-line: AlgaeBase y Algaterra (Yasumoto et al., 1980; Balech, 1988; Vasconcelos, 2001; Adolf et al., 2006; Brand, 2006; Badylak et al., 2007; Comas, 2007; Guiry y Guiry, 2014).
Complementariamente se realizaron tinciones con Lugol y observaciones de la estructura de las tecas de los dinoflagelados mediante tinción con Calcofluor White (Fritz y Triemer, 1985); realizando observaciones con un microscopio invertido equipado con epifluorescencia (Zeiss, Axiovert A1, Alemania). La longitud y ancho de las células en preparaciones en fresco o fijadas fueron medidos con un ocular previamente calibrado en el caso del microscopio Motic B, o usando el software Zeiss Auxiovision (Zeiss, Alemania) en el caso del microscopio invertido.
Análisis cualitativo de quistes de dinoflagelados
Se identifican quistes de dinoflagelados presentes tanto en la columna de agua como en el sedimento, con el objetivo de entender la dinámica y recurrencia del fenómeno. Las muestras de sedimento se tomaron en zonas someras con menos de 2 m de profundidad en los puntos 1, 2 y 3, con una sonda ligera de gravedad TCO (Matsuoka y Fukuyo, 2000). Se recolectaron tres muestras por punto, para un total de nueve. Cada muestra se fragmentó utilizándose los 2 cm superficiales de sedimento, los que se envasaron en recipiente plástico, utilizando como preservo formol neutro al 10 %. Estos puntos de muestreo fueron seleccionados para el análisis de sedimentos ya que debido a la dinámica del ecosistema presentan mayores tasas de sedimentación.
La limpieza y tamizado de los quistes se realizó siguiendo la técnica descrita por Matsuoka y Fukuyo (2000). Para la identificación de los quistes se realizó observación directa considerando aspectos como la forma del cuerpo principal, ornamentación, estructura, procesos, y color de la pared, según criterios de Matsuoka y Fukuyo (2000).
Metodología para analizar evolución de floraciones algales
Además de considerar los análisis cualitativos y cuantitativos, se realizaron entrevistas a voluntarios, y tomadores de decisión que visitaron el ecosistema durante el evento nocivo, basadas en preguntas abiertas orientadas al tiempo de evolución, evidencias generales y primeras evidencias. De forma complementaria se realizaron análisis de laboratorio confirmatorios, para poder describir los hechos con las evidencias correspondientes. Los indicadores primarios y los datos meteorológicos de 15 a 20 días antes y durante el evento, fueron considerados para este análisis.
Metodología para el recuento del fitoplancton
Se realizó el recuento total del fitoplancton (célmL-1) utilizando una cámara de recuento hematológico “Neubauer improved” (2,5×10-4 µL). Las muestras fueron fijadas con Lugol, realizando las diluciones pertinentes cuando fuese necesario. Se realizó, además, el recuento diferenciado de cianobacterias. En caso de presencia de una floración algal se realizó el recuento de especies dominantes (mayor del 50 %).
Análisis de muestras biológicas
Se analizaron branquias de seis peces con tallas entre 5 y 19 cm (n = 12), realizando observaciones de preparaciones histológicas directas en fresco del tejido branquial, frotis de secreciones y del filtrado del agua de tres lavados sucesivos del tejido branquial, con el objetivo de buscar evidencias de la presencia de células de especies fitoplanctónicas potencialmente tóxicas y mucus. Se utilizaron un microscopio óptico Motic B profesional vertical (Alemania) y un estereoscopio (URA Technic, Zuzi; CE).
Parámetros físicoquímicos
Se determinaron parámetros fisicoquímicos in situ en los primeros 50 cm de la columna de agua con un medidor multiparamétrico YSI Pro DSS (USA): temperatura (oC), oxígeno disuelto (mgL-1), salinidad, pH, conductividad (µScm-1). A las muestras de agua tomadas por terceros y las colectadas en los diferentes puntos durante el seguimiento del evento, se les realizaron determinaciones de oxígeno disuelto (mgL-1) con un medidor de Oxígeno Mettler Toledo (Alemania); además de conductividad (μScm-1), pH y salinidad mediante un medidor de pH y conductividad Mettler Toledo (Alemania). Fue determinada además la concentración de clorofila a (mg.m-3) con un fluorímetro digital portátil Aquafluor (EUA), realizando los ajustes pertinentes mediante un factor de corrección para la clorofila a in vivo.
Cálculo de índices tróficos
A partir de los valores de clorofila a se calculó el TSI (Trophic State Index, por sus siglas en inglés) según la OCDE (1982) (Ecuación 1).
A partir de este índice se clasifica el acuatorio según su estado trófico, considerando diferentes criterios (OCDE, 1982; Vollenweider y Kerekes, 1982; Contreras-Espinosa et al., 1994).
RESULTADOS
Procedimiento general para la toma de decisiones: aspectos metodológicos para su implementación
El procedimiento general para la toma de decisiones y la implementación posterior del protocolo de gestión del riesgo por contaminación con cianobacterias y cianotoxinas en la laguna de Baconao, se presenta en la figura 3, con los detalles metodológicos necesarios para su implementación. Se consideró como primera actividad la inspección visual, realizada en conjunto entre los actores clave del ecosistema, liderados por el CITMA (Ministerio de Ciencia, Tecnología y Medioambiente), teniendo en cuenta su encargo social.

Figura 3 Protocolo general para la toma de decisiones e implementación de un protocolo de manejo integrado del riesgo por contaminación con ficotoxinas en la laguna de Baconao.
Al ser positivo el análisis de los indicadores primarios o de aviso temprano, el protocolo se implementó de inmediato; involucrando al personal de atención primaria de salud desde las acciones tempranas. La implementación consta de cuatro subprocesos fundamentales: aplicación de medidas restrictivas; revisión y reelaboración de los planes de contingencia, implementación de una estrategia de comunicación y sensibilización, enfocada a mitigar impactos sobre el ecosistema, y diseño e implementación de plan de monitoreo para detección de indicadores secundarios.
Los indicadores tempranos de aviso predefinidos para activar el protocolo para la toma de decisiones ante la contaminación con ficotoxinas fueron: cambios de color del agua, presencia de natas, manchas o masas laxas de organismos en la superficie, fetidez, muerte de peces, comportamiento alterado de algunas especies presentes en el ecosistema (peces, mamíferos, aves), presencia de espumas; luminiscencia nocturna y/o alteraciones en el cuadro de salud de la población asentada en el ecosistema o usuaria de este. Los indicadores secundarios definen la existencia de una situación de contingencia y la extensión de la situación de riesgo que, de mantenerse, debe seguir activado el protocolo; de lo contrario, debe mantenerse la vigilancia sistemática del ecosistema, con el consiguiente fortalecimiento de la red de actores.
La creación de un grupo de trabajo para situaciones ambientales emergentes es una iniciativa necesaria ante el creciente impacto de las fluctuaciones drásticas del clima. Este grupo o comisión creado para la gestión de riesgos (CGR) debe integrar armónicamente a los actores del ecosistema, contribuyendo con la capacitación de la red de actores y de los especialistas involucrados a corto y largo plazo, para garantizar la sostenibilidad de las iniciativas propuestas. La CGR debe involucrar, fortalecer y consolidar la red de actores, realizando capacitaciones, conciliaciones, alianzas estratégicas; además de contribuir a la sensibilización de actores clave y tomadores de decisión. La capacitación en aspectos relacionados con la gestión del riesgo es relevante en el marco del nuevo escenario ambiental. En este contexto, implementar la legislación ambiental vigente y las buenas prácticas, constituye un ejercicio obligatorio y necesario, de manera que el coste ambiental de las actividades humanas sea mínimo.
Activación del protocol
El 29 de mayo de 2017 se activa el protocolo de toma de decisión, a partir de un aviso de cambios de indicadores primarios en el ecosistema (cambio de color de las aguas y existencia de peces muertos) en las orillas y en la superficie del agua, notificados por la empresa de Flora y Fauna al CITMA.
Confirmación del riesgo
Para confirmar el riesgo se realizaron entrevistas confirmatorias, así como el análisis de las primeras muestras entregadas por el CITMA y Flora y Fauna a LESA. Se confirma el riesgo a través de los siguientes indicadores tempranos de aviso: coloración pardo-rojiza y verdosa que ocupa aproximadamente 30 % del ecosistema; peces muertos de varias especies y tallas en la superficie y orillas de la laguna; marcada fetidez; características del sedimento alteradas con zonas coloreadas de verde intenso o verde-pardo, olor a azufre y fetidez; presencia de espumas y masas laxas flotando en la superficie del agua.
Como dato adicional a través de la observación y entrevistas al médico veterinario a cargo de la cría de delfines, se constató un discreto cambio de conducta en estos animales, mostrándose apáticos y poco activos, por lo que estuvieron monitoreados de forma intensiva. Estos se mantuvieron cerca de la margen contraria en la que se ubican los puntos de muestreo, prácticamente durante todo el evento.
Actores clave involucrados
En la primera inspección visual participaron tres actores clave: CITMA, Flora y Fauna, y miembros de las comunidades cercanas al ecosistema. Inmediatamente después de la inspección se involucraron otros actores: LESA, por su experticia en FAN, y el Acuario de Baconao (perteneciente a Flora y Fauna) por sus intereses en el ecosistema, específicamente en relación con la cría y mantenimiento de delfines en cautiverio.
Luego de confirmar el riesgo se crea la CGR, que comunica sobre la situación de riesgo a los actores clave (directivos de establecimientos gastronómicos, líderes comunitarios, pescadores, guías de turismo, PNR (Policía Nacional Revolucionaria), médicos encargados de la atención primaria, trabajadores de negocios privados y personas naturales con participación en la cadena de comercialización formal e informal de recursos del ecosistema). Durante el proceso de sensibilización se consideraron en primera instancia los directivos y especialistas de gestión ambiental de las empresas ubicadas en las cercanías del ecosistema, así como las entidades usuarias del ecosistema de forma directa o indirecta.
Los directivos de estas empresas fueron convocados a:
Evaluar alternativas para el desarrollo del proceso productivo en caso de situaciones de riesgo.
Actualizar los planes de gestión de riesgo, incluyendo el riesgo de contaminación con ficotoxinas.
Revisar los planes de contingencia incluyendo acciones de mitigación en caso de emergencias relacionadas con las FAN y sus impactos.
Documentar en un registro de incidencias las situaciones enfrentadas durante el evento de riesgo.
Implementar programas de educación ambiental y/o capacitación relacionados con la presencia de ficotoxinas.
Implementar una estrategia de comunicación que permita informar rápidamente a involucrados en caso de situación de riesgo.
Realizar análisis innovadores que garanticen la calidad y seguridad del producto que ofertan, considerando indicadores específicos del riesgo por presencia de ficotoxinas.
Acciones estratégicas tempranas
A partir de la confirmación de presencia de organismos potencialmente tóxicos se desarrollan acciones estratégicas tempranas, entre las que se consideró la elaboración de un informe oficial con inmediatez (en menos de 1h) para declarar la existencia de un riesgo inminente. Este informe, además de verificar los indicadores primarios, busca de forma prioritaria constatar la presencia de especies potencialmente tóxicas, o la existencia de crecimiento excesivo de alguna especie fitoplanctónica.
Inmediatamente después de la confirmación del riesgo se procede a la activación de la CGR, a la cual los expertos y el CITMA le presentan el informe y se procede a su capacitación intensiva, considerando elementos clave que contribuirán de forma favorable a la implementación del protocolo de gestión, una vez aprobado y asignados los fondos. En este punto, el liderazgo del CITMA fue relevante, al ser su encargo gubernamental velar por la calidad ambiental de los ecosistemas.
La CGR estableció un sistema de inspección ambiental integrado para la gestión del riesgo, a través de alianzas y conciliaciones, garantizando el monitoreo sistemático del ecosistema. La celeridad de las acciones estratégicas es lo que en última instancia garantizará la efectividad del manejo de la situación de riesgo.
Implementación del proceso
Para esta fase se consideran los cuatro subprocesos clave antes descritos, siendo relevante el diseño e implementación de un plan de monitoreo, liderado por expertos, con la participación de la CGR y otros actores clave. Se considera el muestreo participativo, previa capacitación de involucrados.
Los muestreos para el seguimiento se realizaron cada tres días durante veinticuatro días consecutivos, considerando los indicadores de aviso preestablecidos; paralelamente se efectuó la inspección visual del ecosistema (Figura 4). A los veinticinco días se consideró dar fin al proceso de contingencia, de acuerdo con los resultados del monitoreo realizado. Se mantienen a partir de este momento inspecciones visuales semanales durante dos meses, recomendándose realizar monitoreos mensuales para el seguimiento, considerando la posible recurrencia de la situación de riesgo.
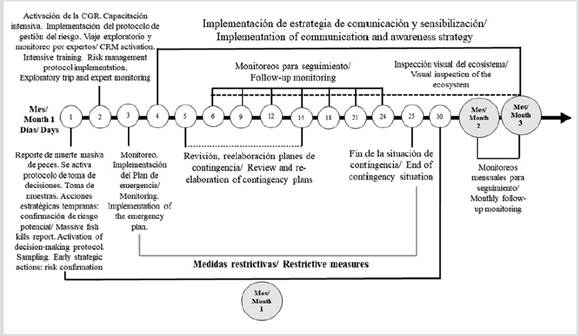
Figura 4 Temporalidad de las acciones desarrolladas para la implementación del protocolo de gestión del riesgo por contaminación con ficotoxinas en la laguna de Baconao.
Durante esta fase se elaboró el plan de emergencia para escenarios de riesgo con alerta máxima. Se restringen usos como la navegación, el baño, la pesca y la recreación, para evitar la exposición no solo directa sino a los aerosoles en las inmediaciones del ecosistema, por treinta días. Se revisaron y reelaboraron los planes de contingencia del acuatorio, en coordinación con el Acuario de Baconao, estableciendo con antelación, las medidas necesarias en caso de evacuación de los delfines. Se incluyeron acciones relacionadas con el seguimiento de la conducta de los animales.
Por último, en esta fase se consideró la implementación de una estrategia de comunicación y sensibilización, para mitigar impactos sobre el ecosistema, garantizando la información sistemática a las comunidades y autoridades locales; el contacto con actores clave, así como la comunicación directa con tomadores de decisión y líderes comunitarios. Durante el tiempo de implementación del protocolo se consideró el pronóstico meteorológico para la toma de decisiones, en estrecha coordinación con el INSMET (Instituto Nacional de Meteorología) en Santiago de Cuba. Resultó relevante crear alianzas con expertos para propiciar una dinámica adecuada en el proceso de toma de decisiones, lo que devino en factor clave de éxito al implementar el protocolo de gestión del riesgo, así como el liderazgo del CITMA.
Identificación de especies fitoplanctónicas
Los análisis permiten afirmar que las muestras analizadas son positivas a la presencia de dinoflagelados y cianobacterias, con abundantes quistes en algunos puntos de muestreo. Se identifican en total 19 especies fitoplanctónicas en todo el acuatorio, de ellas 10 de cianobacterias, 7 potencialmente tóxicas, además de 6 de dinoflagelados, una de ellas productoras de ictiotoxinas: Karlodinium micrum y otra asociada a la producción de ciguatotoxina o Veneno Ciguatérico de los Peces (VCP): Coolia sp. Se detectan además dos especies de heterokontophyta, una de ellas asociada a la producción del VCP: Coccinodiscus sp. y una Chrysophyta (Tabla 1).
Es importante señalar que, de las 19 especies identificadas, 12 son recurrentes (63 %), siendo en su mayoría cianobacterias. Asimismo, los géneros Microcystis y Karlodinium presentan también recurrencia.
Resultados de los análisis de las muestras biológicas
Se pudo confirmar en las muestras de branquias la presencia de células móviles de Karlodinium micrum (n = 10), y restos Oscillatoria nigro-viridis (n = 4), O. limosa (n = 8), Cylindrospermopsis sp. (n = 10) y Microcystis wesenbergii (n = 7). Si bien la presencia de especies potencialmente tóxicas podría explicar la muerte de los peces, es importante señalar que se confirma la presencia de abundante mucus, lo que puede ser indicador de muerte por asfixia. En la tabla 2 se presentan las toxinas potenciales de acuerdo con las especies fitoplanctónicas presentes en el ecosistema (Cronberg,1999; Minillo et al., 2000; Vasconcelos, 2001; Moreno et al., 2003; Aboal, 2005; Cameán et al., 2005; Delgado, 2005; Jos et al., 2005; Adolf et al., 2006; CDCP, 2006; Cronberg y Annadotter, 2006; Delgado et al., 2006; Andrinolo et al., 2007; Carrasco et al., 2007; Anderson et al., 2008; Da Silva, 2009; Faust, 2009; Moraes, 2009; Golubic et al., 2010).
Tabla 2 Toxinas potencialmente presentes en la laguna de Baconao, de acuerdo con el listado de especies fitoplanctónicas y clasificación según sus posibles efectos.

Durante los análisis microscópicos de las muestras de agua se observaron además restos celulares de dinoflagelados. Por otra parte, se observó abundante contenido expuesto de color pardo-rojizo con apariencia oleosa, y abundante materia micro-particulada de color pardo rojizo intenso.
Descripción de la evolución de la floración algal basada en evidencias
El evento debió manifestarse en un principio con discoloración marrón, con prevalencia de dinoflagelados; y parches verdes hacia la orilla en varias zonas de la laguna, constatándose la presencia de cianobacterias filamentosas en la zona intermareal en los puntos 1 y 2. La proliferación de dinoflagelados debe haber ocurrido unas dos semanas antes del reporte de la situación de riesgo, ya que se observan células envejecidas con abundante contenido celular y otras lisadas, con exposición del material celular.
Es importante considerar que en el ecosistema han ocurrido otros eventos similares desde 2011, siendo este un antecedente relevante para los análisis de caracterización del riesgo. En la tabla 3 se presentan los resultados de reportes previos de discoloración de las aguas en el ecosistema, obtenidos por LESA, con los organismos tóxicos involucrados.
Tabla 3 Antecedentes de floraciones algales en el ecosistema obtenidos por LESA (+: indicador cualitativo de abundancia).

Estos antecedentes han condicionado el análisis sistemático de la laguna, por intereses fundamentalmente sectoriales, y resultan importantes para poder entender la dinámica y/o recurrencia de estos eventos.
Los registros previos indican la presencia en el ecosistema de al menos 18 especies fitoplanctónicas, de ellas al menos 12 con potencial tóxico. Seis especies se mantienen en las floraciones previas desde 2011: Oscillatoria formosa, O. limosa, Synechocystis sp., Synechococcus sp., Ceratium furca y Gymnodinium sp.
Especies relevantes por su abundancia y toxicidad
Cuatro especies destacan por su abundancia y toxicidad: Cylindrospermopsis raciiborsky, Microcystis wesenbergii, Karlodinium micrum y Oscillatoria limosa. Su concentración en los diferentes puntos de muestreo se presenta en la figura 5.

Figura 5 Variación de la concentración de las especies relevantes en los diferentes puntos de muestreo.
Estas especies forman floraciones multiespecíficas en todo el acuatorio, con variaciones entre los diferentes puntos de muestreo. La concentración de C. raciiborsky varió entre los diferentes puntos con valores entre 10 × 103 y 75 × 103 célmL-1. Esta especie no fue detectada en el punto 3 (Figura 5). A los 24 días, su presencia en el sitio de mayor concentración (Punto 4) disminuyó a 120 célmL-1.
Karlodinium micrum se presentó en mayor concentración en los puntos 1 y 5 (33 × 103 y 72 × 103célmL-1, respectivamente) (Figura 5), siendo su mínima concentración 93 célmL-1 en el punto 4. No se detecta en el punto 3. A los 24 días su presencia en el punto 1 disminuyó hasta 50 célmL-1.
Respecto a M. wesenbergii (Figura 6A) se observan en el ecosistema células deformadas, probablemente por efecto de la salinidad, lo que puede indicar el aporte fluvial. Su concentración varió entre los diferentes puntos de muestreo entre 5 × 103 y 37 × 103 célmL-1, siendo el punto 1 el de mayor concentración. No se detecta en el punto 5. A los 24 días, su presencia en el punto 1 disminuyó hasta 11 célmL-1.
Las células de Oscillatoria limosa (Figura 6A) presentan en la mayoría de los puntos abundantes burbujas de aire, con un aspecto granulado, típico de las masas o natas flotantes. En el punto 3 aparece en mayor concentración (8,6 × 103 célmL-1), detectándose la menor concentración en el punto 5 (93 célmL-1). A los 24 días su concentración en el punto 3 fue de 22 célmL-1.

Figura 6 A. Imágenes de especies identificadas; B. Quistes de dinoflagelados. A1. Cianobacterias: Oscillatoria limosa y Spirulina subsalsa. A2. Coccinodiscus sp. A3. Microcystis wesenbergii. A4. Pyrophacus sp. A5. Ceratium furca. A6. Karlodinium micrum (arriba apariencia normal, abajo K. micrum teñido con Lugol). A7. Resto de dinoflagelado. B1. Quiste compatible con Gymnodinum catenatum. B2. Quiste compatible con Protoperidinium conicum. B4. Quiste compatible con Alexandrium affine. B3, B5-6 Otros quistes.
En los puntos 1 y 2 estas cuatro especies forman una floración mixta con Synechocystis sp., Synechococcus sp., y O. formosa, siendo la especie mayoritaria en el punto 1 K. micrum; mientras que en el punto 2 es mayoritaria C. raciiborsky.
En el punto 3, M. wesenbergii y O. limosa formaron una floración con Spirulina subsalsa, con predominio de la primera; mientras que en el punto 4 están presentes las cuatro especies, pero solo C. raciiborsky y M. wesenbergii, formaron una floración, con Gymnodinium sp. y Synechococcus sp., siendo notable el predominio de C. raciiborsky.
En el punto 5 se identificó una floración con presencia de tres de las cuatro especies: K. micrum, C. raciiborsky y O. limosa, con O. formosa y Oscillatoria nigro-viridis, siendo predominante K. micrum.
Resultado de los análisis del sedimento
En las muestras de sedimento analizadas se identificaron de forma mayoritaria especies de Oscillatoria (O. limosa, O. formosa y O. princeps). Se observan además células aisladas de Coccinodiscus sp., así como restos y quistes de dinoflagelados.
Al menos seis tipos diferentes de quistes fueron observados tanto en el sedimento como en la columna de agua:
Quistes con características distintivas como la forma esférica, carencia de ornamentos, color pardo oscuro de su envoltura, y apariencia ligeramente reticulada compatibles con los descritos para Gymnodinium catenatum.
Abundantes quistes ornamentados con envoltura y procesos en forma de espinas puntiagudas, con compresión anteroposterior compatibles con Protoperidinium conicum (Matsuoka y Fukuyo, 2000).
Quistes elipsoidales con ornamentos y procesos espinosos alargados, con puntas bifurcadas, y envoltura color pardo claro.
Quistes esféricos, sin ornamento, pared transparente, superficie lisa, compatible con Alexandrium affine.
Quistes esféricos con más de una capa, color pardo oscuro y arqueopilo apical con finos procesos en forma de agujas de pequeño tamaño en la pared ornamentada.
Quistes con más de una capa, envoltura color amarillo pálido, esféricos, con pequeños procesos en forma de espinas (Figura 6B).
Análisis fisicoquímicos de la columna de agua
Los resultados de los análisis realizados se presentan en la tabla 4. Los valores de oxígeno disuelto (OD) en el acuatorio fueron en general bajos, siendo los puntos más afectados 2, 3 y 4, con valores de 1,25 ± 0,01; 1,44 ± 0,01 y 1,34 ± 0,00 mgL-1, respectivamente, los que fueron significativamente mayores que los valores obtenidos en los puntos 1 y 5. Los máximos valores detectados se encuentran por debajo de lo regulado para cuerpos de agua de interés pesquero NC 25:1999, de lo que se infiere que el agua tiene calidad dudosa (2-5 mgL-1), a mala (˂2 mgL-1).
Los valores de pH tuvieron poca variación, manteniéndose en el rango de 8 a 8,40; lo que resulta adecuado para estos cuerpos de agua. La temperatura del agua mantuvo valores entre 25 y 25,9 °C. En el caso de la salinidad esta mantuvo valores entre 22 y 30 ups en todo el acuatorio, siendo mínima en el punto 3, lo que podría estar relacionado con vertimientos puntuales; mientras que en el punto 4 se registran los valores máximos.
Tabla 4 Resultados de análisis fisicoquímicos in situ. Se presentan los valores medios y desviaciones estándar. Letras diferentes indican diferencias significativas (p = 0,05).

Según los resultados obtenidos en los puntos 2, 3 y 5 la concentración de clorofila no varía significativamente; sin embargo, la concentración celular de cianobacterias difiere significativamente en cada uno de estos puntos, siendo el más afectado el punto 3, con los más altos niveles de clorofila a y cianobacterias (p = 0,05), seguido por el punto 5. Visualmente se detectó una masa laxa color verdoso de grandes dimensiones en el punto 3 y bajos valores de oxígeno disuelto. Los puntos 3 y 5 están comparativamente más afectados que el resto, en relación con los parámetros analizados. Los valores más bajos de clorofila a se registran en el punto 4 (3,97 ± 1,22 µgL-1) (p = 0,05).
Evaluación de las condiciones tróficas del acuatorio
En la tabla 5 se presentan los valores de TSI y la clasificación del estado trófico del ecosistema, considerando diferentes criterios (OCDE, 1982; Vollenweider y Kerekes, 1982; Contreras-Espinosa et al., 1994). El punto con menores valores de TSI fue el punto 4, siendo los valores altos en todos los puntos muestreados (p = 0,05), lo que permite su clasificación como ecosistema eutrófico.
DISCUSIÓN
Diagnóstico general
El creciente deterioro de los ecosistemas costeros involucra la calidad de sus aguas, la biodiversidad, el paisaje, tanto sumergido como emergido, y en general compromete sus servicios, generando conflictos de uso, además del impacto directo sobre los valores estéticos, los recursos pesqueros, la infraestructura y el patrimonio construido (Gómez, 2013).
La laguna de Baconao es un ecosistema de interés para el turismo local que debe ser observado sistemáticamente para evitar impactos negativos no deseados sobre la salud humana. Las FAN impactan la vida marina de este ecosistema, siendo uno de los indicadores de alerta la muerte de peces. Debido a los usos del ecosistema (turismo, recreación) estos eventos ponen en riesgo tanto la salud humana, como al propio ecosistema, relacionado ello con las condiciones anóxicas, fetidez y presencia de espumas.
Las evidencias permiten afirmar que el ecosistema es una laguna costera eutrófica en riesgo por contaminación con ficotoxinas, asociada a la presencia de especies formadoras de FAN, fundamentalmente cianobacterias y dinoflagelados, destacando la presencia de cuatro especies relevantes, potencialmente tóxicas, formadoras de FAN, lo que indudablemente tiene relación con la situación de riesgo identificada:
Cylindrospermopsis raciiborsky, especie invasora, cosmopolita, halotolerante, con preferencia por ambientes anóxicos y ricos en fósforo; productora de cilindrospermopsina, asociada a muerte de peces por parálisis, por presentar Veneno Paralítico de Peces (VPP), además de neo-saxitoxina, y saxitoxina (Antunes, 2015; EOL, 2017).
Microcystis wesenbergii, especie cosmopolita potencialmente tóxica, productora de microcistinas (Boyer et al.; 2004; Beresovsky et al., 2006; Belykh et al., 2011, 2013; Bittencourt-Oliveira et al., 2011) que crece en ecosistemas eutróficos, y se asocia a floraciones algales (Cronberg y Annadotter, 2006).
Karlodinium micrum, dinoflagelado móvil de pequeño tamaño; especie fitoplanctónica común en ecosistemas costeros. Usualmente presente en bajas concentraciones (102-103 célmL-1), pero capaz de formar floraciones algales (104-105 célmL-1). Su presencia está asociada a muerte de peces por la producción de ictiotoxinas y citotoxinas, generalmente denominadas karlotoxinas (Adolf et al., 2007).
Oscillatoria limosa especie toxigénica bentónica productora de microcistinas (Cronberg y Annadotter, 2006).
Espacialmente toda la laguna tiene un alto potencial de riesgo para la ocurrencia de FAN; específicamente la margen donde se establecen los puntos de muestreo, ya que de acuerdo con dinámica del ecosistema es la más vulnerable por ser zonas de remanso, con un lento recambio de las aguas. Sin embargo, es importante destacar el comportamiento heterogéneo de las especies en los diferentes puntos, formando floraciones diversas. Por otra parte, las evidencias indican que los dinoflagelados forman floraciones de forma recurrente en la laguna, contribuyendo a la productividad primaria, por lo que constituyen un componente importante del plancton.
Atendiendo a los registros meteorológicos este ecosistema recibió una perturbación por aportes pluviales desde la segunda decena de abril, con lapsos de calma, lo que pudo haber favorecido el evento de riesgo; acompañado de altas temperaturas y elevadas tasas de evapotranspiración, que caracterizan a la región.
En 2017, las precipitaciones estuvieron por encima de la norma en todo el país, constituyendo el quinto año más lluvioso de los últimos 57 años. Este comportamiento estuvo asociado a los acumulados de lluvia registrados en la región central y oriental del país, en las que constituyó el sexto y quinto año más lluvioso desde 1961 hasta la fecha, respectivamente (INSMET, 2017a). En la segunda decena del mes abril, destaca la ocurrencia de abundantes lluvias en todo el país. Por otra parte, abril y mayo registraron valores de temperatura por encima de la media histórica, con valores mínimos alterados desde la segunda quincena de abril hasta mayo; reportándose además valores de temperatura en la última decena del mes de mayo, por encima de los 31 °C (INSMET, 2017b; Fonseca-Rivero, 2018).
Las altas temperaturas reportadas durante el 2017, con condiciones particularmente cálidas durante el período lluvioso, corresponden a la tendencia al calentamiento observada en Cuba en los últimos años y a la tendencia global de calentamiento a largo plazo (Fonseca-Rivero, 2018) lo que, sin duda, favorece los eventos de riesgo por presencia de proliferaciones de especies fitoplanctónicas (Paerl et al., 2011).
Aunque el ecosistema es una típica laguna costera, dominada por condiciones costero-marinas, todo parece indicar que, debido a la estrecha conexión marina y las condiciones del canal, hay una influencia pluvial y fluvial importante, sobre la dinámica de los procesos de laguna, constatándose una variación de la salinidad de 3 a 2 %, que le confiere al ecosistema características oligohalinas.
Esta investigación permite confirmar una situación de contingencia ante la presencia de una floración algal multiespecífica prácticamente en todo el ecosistema, con varios microorganismos potencialmente tóxicos implicados, siendo las principales evidencias: la muerte de peces, alta concentración de cianobacterias, presencia de masas laxas verdosas en la superficie del acuatorio, presencia de varios microrganismos tóxicos asociados a la producción de ictiotoxinas, veneno ciaguatérico y paralizantes de peces; fetidez, bajos valores de oxígeno disuelto y alta concentración de clorofila a.
En algún momento debió haber una transición de la marea roja o parda a una marea verde, con especies tóxicas y no tóxicas de cianobacterias, esta última con más potencial letal al combinar la acción tóxica con las condiciones anóxicas del ecosistema, lo que justificaría la presencia de mucus en las branquias de peces, constatado en todas las muestras analizadas.
Contrastando los análisis realizados, la FAN pudo ocasionar la muerte de peces, previo registro, lo que pudo estar relacionado con cambios bruscos en las condiciones climatológicas, con aportes pluviales y fluviales al ecosistema, que propiciaron la proliferación de especies fitoplanctónicas. La muerte de peces pudo producirse por efecto de las toxinas y/o por asfixia ya que, si bien se corroboró la presencia de especies ictiotóxicas, en las branquias de los peces analizados se detectó, además, abundante secreción de mucus. La ingestión de peces muertos por los delfines pudo ocasionar su cambio de conducta.
Hay que destacar la presencia a partir del 16 de marzo de 2017 de una nube de polvo del desierto del Sahara sobre el área del Caribe, con persistencia hasta finales el mes de abril, según se pudo constatar después del análisis de las imágenes satelitales y el análisis de los boletines informativos del Instituto Nacional de Meteorología (INSMET, 2017a). Este polvo finamente particulado, viene cargado de hierro y tiene una coloración rojiza compatible con los restos de materia roja micro y nano particulada observados. Por lo que no se descarta una sinergia debido a la fertilización de las aguas por la presencia del polvo del Sahara (Walsh y Steidinger, 2001; Dorta et al.; 2002; Sellner et al., 2003; Langlois et al. 2012), con los factores climáticos condicionantes, que de conjunto permitieron el crecimiento acelerado de especies fitoplanctónicas presentes en el ecosistema, eutrófico per se. Todo ello unido a los valores de temperatura del agua registrados en el ecosistema, los que están por encima de 25 °C, favoreciendo la proliferación de especies fitoplanctónicas y cianobacterias (Kosten et al., 2012; Rosso y Giannuzzi, 2015; Yan et al., 2017; Nalley et al., 2018).
Los valores más bajos de clorofila a registrados en los puntos 1 y 4 podrían estar relacionados en el punto 1 con la cercanía a dos arroyos (Figura 1) y en el punto 4, posiblemente la cercanía a la entrada de agua proveniente del mar. Es importante señalar que los valores de la concentración de la clorofila a en la columna de agua van desde cantidades pequeñas (excepcionalmente 0,01 mgm-³) hasta cercanas a los 100 mgm-³. Si bien en algunos ecosistemas se han obtenido las máximas concentraciones puntuales que rebasan dichos límites (ej. 126 mgm-³) (Contreras-Espinosa et al., 1994).
Los mecanismos que pudieron estar relacionados con la remisión de la FAN pudieron ser los cambios de las condiciones climáticas, la propia dinámica del ecosistema, las pérdidas directas por herbivorismo, constatado a través de la presencia del abundante y diverso zooplancton.
Sobre la implementación del protocolo de gestión de riesgo
El protocolo de gestión de riesgo propuesto para la contaminación por ficotoxinas estuvo enfocado en la mitigación y prevención de impactos negativos; este tuvo como objetivo prioritario proteger la salud humana, considerando la existencia de actividades de turismo y la pesca furtiva de peces, mariscos y portúnidos, en dicho ecosistema; además de fortalecer la red de actores, con alternativas sostenibles a partir de la creación de un grupo de trabajo que incluyó directivos, técnicos a cargo del seguimiento al evento de riesgo, y personal científico o expertos en el tema (equipo interdisciplinario), siendo relevante la presencia de entidades como el gobierno, representado por el CITMA, los responsables del área (Flora y Fauna), la comunidad y las autoridades sanitarias.
La alianza estratégica intersectorial entre el CITMA, Flora y Fauna, y la Universidad (LESA) constituyó un factor clave para el éxito de la implementación del protocolo, lo que permitió la actuación conjunta y rápida de todos los actores, liderados por el CITMA; la aprobación del protocolo por las autoridades locales y la elaboración de un sistema de comunicación oportuno también constituyen factores de éxito. Por otra parte, resultó relevante involucrar al personal médico de atención primaria y secundaria para poder manejar la situación de riesgo y su impacto potencial en las comunidades aledañas. En general, las acciones desarrolladas contribuyeron al conocimiento del ecosistema en función de su manejo sostenible y a mejorar la percepción del riesgo por presencia de ficotoxinas entre los actores clave.
La primera etapa del protocolo se caracterizó por la detección visual del riesgo a través de indicadores primarios (nivel 1), e indicadores de alarma, como los reportes de toxicidad (nivel 2). Fue esencial a partir de este paso la coordinación con la red de actores, garantizando el flujo de la comunicación de los resultados de la caracterización del riesgo.
Considerando que estos eventos pueden ser recurrentes en el ecosistema es necesario implementar herramientas de control soportadas por las normativas correspondientes, cuestión que en la actualidad no está bien establecido a nivel país, en relación con el riesgo por FAN, lo que puede tener grandes impactos negativos de índole ambiental, económico y social (Anderson, 2009, Anderson et al., 2012).
En el caso que se documenta, no se registran afecciones en humanos, lo que constituye un aspecto a favor del protocolo de gestión implementado; sin embargo, debe garantizarse la preparación y asistencia médica en caso de intoxicación por este tipo de toxinas.
Los parámetros básicos que complementan la vigilancia sistemática deben ser de naturaleza física, química y biológica, tanto cualitativos como cuantitativos. Asimismo deben considerarse las variables meteorológicas, ya que el escenario de riesgo hay que verlo en su totalidad, considerando además que este tipo de evento es multicausal (Anderson et al., 1998, 2002; Ajani et al., 2001; Burkholder et al., 2008; Burns, 2008; Adolf et al., 2009). La dinámica de los episodios nocivos y/o tóxicos varía dependiendo de muchos factores, no sólo las características hidrogeográficas y topográficas de la zona, sino aspectos ecológicos y biológicos del o los organismos involucrados, así como las condiciones socioambientales del entorno.
Entre los factores físicos es relevante tener en cuenta los datos meteorológicos de la zona de estudio; las variables climáticas como vientos, precipitaciones, horas de insolación y nivel de irradiancia promedio; temperatura del agua, turbidez, régimen de mareas e incluso la presencia de polvo del Sahara (Sellner, 1997; Walsh y Steidinger, 2001; Sellner et al., 2003; Thomazeau et al., 2010; Rijkenberg et al., 2011), ya que al condicionar los parámetros de la atmósfera, modula el régimen de lluvia, las tormentas eléctricas, la ciclogénesis y la evolución de los ciclones tropicales (López et al., 2015). Entre los indicadores químicos resultan relevantes la concentración de pigmentos, especialmente la clorofila a; así como los valores de salinidad y nutrientes, específicamente nitratos, fosfatos, amonio, hierro y silicatos. Los análisis biológicos deben estar enfocados al fitoplancton y al fitobentos, considerando aspectos cualitativos y cuantitativos.
La documentación es un proceso clave durante la implementación del protocolo de gestión de riesgo; en este caso permitió describir detalladamente el episodio, complementado con el uso de instrumentos específicos como encuestas, entrevistas, grupos focales, entre otros, para poder entender la dinámica y estimar la duración del fenómeno a partir de su establecimiento inicial, y la percepción del fenómeno por los usuarios del ecosistema.
Al confirmarse la presencia de organismos potencialmente tóxicos, se deben establecer de inmediato medidas de restricción de usos del ecosistema. Es necesario interrumpir cualquier uso que pueda generar daños colaterales en personas o animales, y que comprometa el equilibrio y servicios del ecosistema; esto constituyó un elemento esencial para prevenir intoxicaciones en humanos.
A continuación, se exponen algunas recomendaciones importantes para entidades costero-dependientes ante el nuevo escenario ambiental y el riesgo que representa la contaminación por ficotoxinas, específicamente para ecosistemas costeros vinculados a la actividad turística, la pesca y/o actividades de ocio o recreativas:
Es un imperativo la búsqueda de indicadores tempranos que alerten sobre la contaminación del ecosistema con especies potencialmente tóxicas.
Deben establecerse programas de monitoreo y control para cada acuatorio con este tipo de evento o situación de riesgo.
La descripción hidromorfológica del acuatorio y un diagnóstico general de sus usos y conflictos deben complementar los análisis de riesgo.
Algunas especies producen potentes toxinas que pueden ser acumuladas por los organismos marinos filtradores, especialmente por los moluscos bivalvos. Los gasterópodos, cangrejos y ciertos peces tienen capacidad de acumular toxinas por la vía trófica. Su ingestión ha originado y es la causa de intoxicaciones humanas de suma gravedad que pueden llevar en algunos casos a la muerte (Carreto et al., 2007), por lo que debe garantizarse la sistematicidad en los análisis de riesgo y medidas de control oportunas para evitar impactos negativos.
Los tomadores de decisión deben estar asesorados directamente por expertos; sólo estos pueden confirmar la remisión total de una floración algal y el final de la fase de emergencia.
Al establecer regulaciones se debe tener en cuenta la importancia de los indicadores para la detección del riesgo desde etapas tempranas, durante la supervisión visual.
La capacitación y la comunicación deben formar parte de estrategias específicas que deben ser desarrolladas, con enfoque de sostenibilidad en función del manejo del ecosistema.
Debe considerarse de forma complementaria un cuadro para la toma de decisiones en caso de contaminación con ficotoxinas, el que debe considerar que las especies tóxicas pueden pertenecer a seis grupos diferentes, los que difieren en sus características morfológicas, fisiológicas y ecológicas (Okaichi, 2003). Atendiendo a que los microorganismos más abundantes en el ecosistema en cuanto a diversidad y densidad total fueron las cianobacterias se presenta un cuadro de decisión para el nivel de alerta, en caso de floraciones de cianobacterias, que complementa el protocolo de gestión del riesgo (Tabla 6).
Tabla 6 Cuadro de decisión para el nivel de alerta en caso de floraciones de cianobacterias planctónicas modificado para lagunas costeras (Gómez et al., 2012).

En todos los casos se sugiere, si se cuenta con los recursos necesarios, realizar análisis de toxicidad en vectores (mariscos, peces, bivalvos), el perfil de toxinas de la biomasa fitoplanctónica y del agua; realizar ensayos de toxicidad, como el de inhibición de la fosfatasa alcalina, e incluso se pueden aislar especies y establecer cultivos monoalgales para su estudio, aspectos que también han sido sugeridos previamente (Sar et al., 2002). El cuadro incluye la etapa de vigilancia y debe ser implementado por tomadores de decisión a diferentes niveles. Para cada nivel de acción se establecen tres condiciones (A, B y C), siendo la condición C la transición al próximo nivel.
El balance entre análisis de riesgos y la relación costo-beneficio, siempre va a estar presente en entidades que operan en ecosistemas contaminados, específicamente en aquellos donde existe documentación previa de floraciones algales recurrentes o brotes tóxicos. Sin embargo, debe entenderse que operar en condiciones de riesgo, implica un compromiso de los actores clave y tomadores de decisión, ya que ello puede implicar severos daños a la salud humana, además del deterioro progresivo del ecosistema hasta la total invalidez de sus servicios, de lo que ya existen casos documentados a nivel mundial (Murugan et al., 2013).
CONCLUSIONES
La laguna de Baconao es un ecosistema eutrófico en riesgo latente por la presencia de FAN. La presencia de una FAN mixta de cianobacterias y dinoflagelados tóxicos condicionó la muerte masiva de peces, implementándose de inmediato un procedimiento de toma de decisiones y un protocolo de gestión de riesgo enfocado en la mitigación y prevención de impactos negativos en las especies marinas y las comunidades aledañas.
Se desarrollaron acciones inmediatas entre las que destacan: la creación de una comisión de gestión del riesgo multisectorial e interdisciplinaria, la restricción de usos del ecosistema, la comunicación a todos los actores, la revisión y reelaboración de los planes de contingencia de entidades con intereses en el acuatorio y el desarrollo de un plan de monitoreo intensivo que permitió la participación de expertos y su interacción directa con tomadores de decisión.
La acción coordinada entre actores clave y el liderazgo del CITMA garantizó el éxito de la implementación del protocolo para una situación de continencia. El protocolo implementado y el cuadro de decisión para el nivel de alerta en caso de floraciones de cianobacterias planctónicas modificado para lagunas costeras puede ser aplicado en cualquier ecosistema con esta situación de riesgo.
En los ecosistemas donde las FAN son eventos recurrentes, la vigilancia debe ser sistemática; lo que se logra a través del fortalecimiento de la red de actores; la alianza entre los actores clave facilita el intercambio y la cooperación permanente, y la acción rápida durante la situación de contingencia, con la participación comunitaria.
BIBLIOGRAFÍA / LITERATURE CITED
Aboal, M.S. 2005. Producción de microcistinas en ecosistemas de regiones áridas: factores ambientales y efectos biológicos. I Jorn. Esp. Est. Microcistinas, Univ. Zaragoza, 37 p. [ Links ]
Adolf, J.E., T.R. Bachvaroff, D.N. Krupatkina, H. Nonogaki, P.J.P. Brown, A.J. Lewitus, H. R. Harvey and A.R. Place. 2006. Species specificity and potential roles ofKarlodinium micrumtoxin. Afr. J. Mar. Sci., 28(2): 415-419. https://doi.org/10.2989/18142320609504189 [ Links ]
Adolf, J.E., D. Krupatkina, T. Bachvaroff and A.R. Place. 2007. Karlotoxin mediates grazing byOxyrrhis marinaon strains ofKarlodinium veneficum. Harmful Algae, 6(3): 400-412. https://doi.org/10.1016/j.hal.2006.12.003. [ Links ]
Adolf, J.E., T. R. Bachvaroff and A. R. Place. 2009. Environmental modulation of Karlotoxin levels in strains of the cosmopolitan dinoflagellate,Karlodinium veneficum(Dinophyceae). J. Phycol., 45(1): 176-192. https://doi.org/10.1111/j.1529-8817.2008.00641.x. [ Links ]
Ajani, P., G. Hallegraeff and T. Pritchard. 2001. Historic overview of algal blooms in marine and estuarine waters of New South Wales, Australia. Proc. Linn. Soc. NSW, 123, 1-22. [ Links ]
Alawadi, F. 2010. Detection of surface algal blooms using the newly developed algorithm surface algal bloom index (SABI). Rem- Sens. Oc., Sea Ice, Large Water Reg., 7825. https://doi.org/10.1117/12.862096. [ Links ]
Anderson, A . D. Cembella and G.M. Hallegraef (Eds.). 1998. Physiological ecology of harmful algal bloom. Springer-Verlag, Heidelberg. 600 p. [ Links ]
Anderson, A . .D, Cembella and G.M. Hallegraeff. 2012. Progress in understanding harmful algal blooms: paradigm shifts and new technologies for research, monitoring, and management. Ann. Rev. Mar. Sci., 4: 143-176. [ Links ]
Anderson, D.M2004. Prevention, control and mitigation of harmful algal blooms: multiple approaches to HAB management. Harmful Algae Mana. Mitig., 123-130. [ Links ]
Anderson, D.M. 2009. Approaches to monitoring, control and management of harmful algal blooms (HABs). Oc. Coast. Manag., 52(7): 342-347. [ Links ]
Anderson, D.M. , P.M. Gilbert and J.M. Burkholder 2002. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences. Estuaries, 25: 704-726. [ Links ]
Anderson D.M., J.M. Burkholder, W.P. Cochlan, P.M. Glibertd, C.J. Goblere, C.A. Heilf, R.M. Kudelag, M.L Parsonsh, J.E. Renseli, D.W. Townsend, V.L. Trainerk and G.A. Vargol 2008. Harmful algal blooms and eutrophication: Examining linkages from selected coastal regions of the United States Harmful Algae. HABs Eutroph., 8(1): 39-53. [ Links ]
Andrinolo, D., P. Pereira, L. Giannuzzi, C. Aura, S. Massera, M. Caneo, J. Caixach, M. Barco and R. Echenique. 2007. Occurrence ofMicrocystis aeruginosaand microcystins in Rio de la Plata river (Argentina). Acta Toxicol. Arg., 15(1): 8-14. [ Links ]
Antunes, J.T., P.N. Leão and V.M. Vasconcelos. 2015.Cylindrospermopsis raciborskii: review of the distribution, V.M. Phytogeography, and ecophysiology of a global invasive species. Front. Microbiol., 6, 473. [ Links ]
Arce, O 2007. Eutrofización de cuerpos de agua. Tesis Maestría Ing. Amb., Univ. San Simón. Cochabamba.http://www.fcyt.umss.edu.bo/docentes/29/documentos/Eutrofizacion.pdf. 30 p [ Links ]
Badylak, S., E.J. Phlips, P. Baker, J. Fajans and R. Boler. 2007. Distributions of phytoplankton in Tampa Bay estuary, USA 2002-2003. Bull. Mar. Sci., 80(2): 295-317. [ Links ]
Balech, E. 1988. Los dinoflagelados del Atlántico Sudoccidental (Vol. I). Min. Agric. Pesca Aliment., Publ. Espec., Inst. Esp. Oceanogr. 310 p. [ Links ]
Belykh, O.I., E.G. Sorokovikova, G.A. Fedorova, O.V. Kaluzhnaya, E.S. Korneva, M.V. Sakirko and T.A. Sherbakova. 2011. Presence and genetic diversity ofmicrocystin-producing cyanobacteria (AnabaenaandMicrocystis) in Lake Kotokel (Russia, Lake Baikal Region). Hydrobiologia, 671(1): 241-252.https://doi.org/10.1007/s10750-011-0724-2. [ Links ]
Belykh, O.I., O.A. Dimitrieva, A.S. Gladkikh and E.G. Sorokovikova. 2013. Identification of toxigenic cyanobacteria of the genusMicrocystisin the Curonian Lagoon (Baltic Sea). Oceanology, 53(1), 71-79. https://doi.org/10.1134/S0001437013010025. [ Links ]
Beresovsky, D., O. Hadas, A. Livne, A. Sukenik, A. Kaplan and S. Carmeli. 2006. Toxins and biologically active secondary metabolites ofMicrocystissp. isolated from Lake Kinneret. Isr. J. Chem., 46(1), 79-87. https://doi.org/10.1560/Fe24-Vyuf-Ctbd-Hb7x. [ Links ]
Biagini, M. 1980. Valutazioni dell´inquinamento delle acque correnti per mezzo del fitoplancton. Biol. Ital., 10(9): 20. [ Links ]
Bittencourt-Oliveira, M., M. Oliveira and E. Pinto. 2011. Diversity of microcystin-producing genotypes in Brazilian strains ofMicrocystis(Cyanobacteria). Braz. J. Biol., 71(1): 209-216. [ Links ]
Bold, H.C. and M.J. Wynne. 1978. Introduction to the algae. Structure and Reproduction. Prentice Hall, New Jersey. 706 p. [ Links ]
Boyer, G. L., M.C. Watzin, A.D. Shambaugh, M.F. Satchwell, B.H. Rosen and T. Mihuc. 2004. The occurrence of cyanobacterial toxins in Lake Champlain. Lake Champlain: Partn. Res. earch New Mill., 241-257. [ Links ]
Brand, J.J. 2006. The Culture Collection of Algae. UTEX, University of Texas at Austin. UTEXwww.utex.org [ Links ]
Burkholder, J. M., B.W. Touchette, E.H. Allen, J.L. Alexander and P.A. Rublee. 2008. Environmental conditions, cyanobacteria and microcystin concentrations in potable water supply reservoirs in North Carolina, USA. Cyanobact. Harmful Algal Blooms: State Sci. Res. Needs, 619: 293-294. [ Links ]
Burns, J. 2008. Chapter 5: Toxic cyanobacteria in Florida waters. Cyanobact. Harmful Algal Blooms: State Sci. Res. Needs, 619: 127-137. [ Links ]
Calandrino, E.S. and H.W. Paerl. 2011. Determining the potential for the proliferation of the harmful cyanobacteriumCylindrospermopsis raciborskiiin Currituck Sound, North Carolina. Harmful Algae, 11: 1-9. https://doi.org/10.1016/j.hal.2011.04.003. [ Links ]
Cameán, A.M., I. Moreno, A. Jos, G. Repetto, S. Pichardo y A.I. Prieto. 2005. Cianobacterias y cianotoxinas: necesidad de su control en el agua de consumo humano. Rev. Salud Amb., 5(2): 137-141. [ Links ]
Carmichael, W.W. 2001. Health effects of toxin-producing cyanobacteria: “The CyanoHABs”. Human Ecol. Risk Asses., 7(5): 1393-1407.https://doi.org/10.1080/20018091095087. [ Links ]
Carrasco, D., E. 2007. Cianobacterias planctónicas y cianotoxinas en embalses españoles. Tesis Doctoral Univ. Aut. Madrid, Dep. Biol., Madrid. 320 p.https://repositorio.uam.es [ Links ]
Carreto, J.I., M. Carignan y N. Montoya. 2007. Florecimientos de algas nocivas. Atlas de Sensibilidad Ambiental del Mar y la Costa. 23 p. [ Links ]
CDCP. 2006. Ciguatera fish poisoning-Texas, 1998, and South Carolina, 2004. Morbidity Mortality Weekly Rep., (1545-861X).http://search.ebscohost.com/login.aspx?direct=true&db=cmedm&AN=16943762&lang=es&site=ehost-live [ Links ]
CITMA. 2011. Informe de proyecto: Manejo y control de especies exóticas invasoras. CITMA. Del. Terr. Guantánamo, Guantánamo. 25 p. [ Links ]
CNAP(Ed.). 2004. Las áreas protegidas de Cuba. Min. Cienc., Tecnol. Medio Amb. (CITMA). La Habana. 34 p.http://www.snap.cu/ [ Links ]
Comas, A.A. 2007. Cianoprocariotas (cianobacterias, cianofíceas) y microalgas como indicadores de la calidad del agua en el embalse, Paso Bonito, Cienfuegos. En: REDCIEN (Ed.), Principales resultados de la ciencia y la innovación tecnológica. Inst. Inf. Cient. Tecnol., Cienfuegos. [ Links ]
Contreras-Espinosa, F., O. Castañeda y A. García-Nagaya. 1994. La clorofila como base para un índice trófico en lagunas costeras mexicanas. An. Inst. Cienc. Mar Limnol. Univ. Nal. Aut. Méx., 21(1-2): 55-66. [ Links ]
Cronberg, G. 1999. Qualitative and quantitative investigations of phytoplankton in Lake Ringsjon, Scania, Sweden. Hydrobiologia, 404: 27-40.https://doi.org/10.1023/A:1003757504155 [ Links ]
Cronberg, G. and H. Annadotter (Eds.). 2006. Manual on aquatic cyanobacteria. A Photo guide and a synopsis of their toxicology. IOCUNESCO, Copenhagen. 106 p. [ Links ]
Da Silva, A. 2009. Bioacumulação de cianotoxinas e seus efeitos em organismos aquáticos. Oecol. Brasil., 13(2): 272-312. [ Links ]
De la Cruz, A. 1984. El muestreo integrado y el conteo inmediato de fitoplancton en ecosistemas limitados. Rev. Invest. Mar., 5(3): 15-24. [ Links ]
Delgado, G. 2005. Dinoflagelados bentónicos tóxicos asociados a la ciguatera: abundancia, toxicidad y relación con los factores ambientales de un área del litoral noroccidental de Cuba. Tesis Doctorado, CIBNOR, México. Tesis Digitales CIBNORhttp://dspace.cobnor.mx:8080/handle/123456789/96. 88 pp. [ Links ]
Delgado, G., C.H. Lechuga-Devéze, G. Popowski, L. Troccoli and C.A. Salinas. 2006. Epiphytic dinoflagellates associated with ciguatera in the northwestern coast of Cuba. Rev. Biol. Trop., 54(2). [ Links ]
Dillard, G. (Ed.). 1999. Common freshwater algae of the United States: an illustrated key to the genera (excluding the diatoms): Gebrider Bomtraeger. Cramer, Berlin, Stüttgart. 1st ed. 173 p. [ Links ]
Dorta, P., M.D. Gelado, P. Cardona, C. Collado, C. Criado, J. Hernandez, S. Mendoza, V. Siruela, M.E. Torres, D. Curbelo, P. López y E. Rodríguez. 2002. Algunas consideraciones sobre la importancia del polvo de origen sahariano en el clima del archipiélago canario y su aporte a las aguas superficiales oceánicas: el episodio de abril de 2002. Publ. Asoc. Esp. Climatol. Serie A, (3), 24 p. [ Links ]
Echavarría, E.P., A.C González Comas A.M. San Pedro y E.C. Veitía. 2002. Las microalgas como indicadoras de contaminación orgánica en el río San Juan. En: La directiva marco del agua: realidades y futuros: 482-486. EOL 2017.Cylindrospermopsis raciiborskii.http://eol.org/pages/919240/overview [ Links ]
Faust, M.A. 2009. Ciguatera causing dinoflagellates in a coral reef mangrove ecosystem, Belize. Atoll Res. Bull., 569. [ Links ]
Faust, M.A. 2009. Ciguatera causing dinoflagellates in a coral reef mangrove ecosystem, Belize. Atoll Research Bulletin, 569. [ Links ]
Faust, S. and D. Gulledge. 2002. Identifying harmful marine dinoflagellates. Contr. US Nat. Herb., 42, 144 p. [ Links ]
Figueredo L. y F. Acosta. 2008. Objetos de conservación de la flora y la vegetación de los cerros calizos costeros de la Reserva de la Biosfera Baconao, Santiago de Cuba. Foresta Veracruzana, 10(2): 9-16. [ Links ]
Fonseca-Rivero, A., V. Cutié-Cancino, I.T González-García, I.T., Hernández-Sosa, M.N. Valderá-Figueredo, D. Hernández González y A. Cabrera-Medina. 2018. Estado del clima en Cuba 2017. Resumen ampliado. Rev. Cub. Meteor., 24(2): 226-237. [ Links ]
Fritz, L. and R.E. Triemer. 1985. A rapid simple technique utilizing CalcofluorWhiteM2R for the visualization of dinoflagellate thecal plates. J. Phycol.21: 662-664. [ Links ]
Golubic, S., R.M.M. Abed, K. Palinska, S. Pauillac, M. Chinain and D. Laurent. 2010. Marine toxic cyanobacteria: Diversity, environmental responses and hazards , Toxicon 56(5): 836-841. https://doi.org/10.1016/j.toxicon.2009.07.023. [ Links ]
Gómez, L. 2007. Primer reporte deProrocentrum micansEhrenberg 1833 asociado a un bloom mixto de Ceratium lineatum y C. fusus, en aguas de la bahía de Santiago de Cuba. Rev. Invest. Mar., 28(2): 177-179. [ Links ]
Gómez, L. 2013. Propuesta de un protocolo para la gestión del riesgo por contaminación con biotoxinas en industrias costero-dependientes asociadas a bahías. Invest. Saber., 2(1): 63-72. [ Links ]
Gómez, L., B. Álamo y J.C. Rodríguez-Tito. 2010. Riesgo de contaminación con cianobacterias en tres embalses de agua de Santiago de Cuba. Medisan, 14(2): 175-183. [ Links ]
Gómez, L., H.I. Álvarez, J.C. Rodríguez-Tito y B. Álamo. 2011. Cianobacterias: un riesgo emergente en embalses de agua de Santiago de Cuba. Univ. Oriente (Ed.) 76 p.http://www.cnea.uo.edu.cu/index.php?option=com_remository&Itemid=130&func=select&id=3 [ Links ]
Gómez, L., I. Álvarez y J.C. Rodríguez-Tito. 2012. Cuba: Toxic cyanobacteria risk assessment, research and management:40-48. In Chorus, I. (Ed.), Current approaches to cyanotoxin risk assessment, risk management and regulations in different countries. Germany: Fed. Environ. Ag., Germany. [ Links ]
Gómez, L., O. Asín e Y. Ortega. 2014. Primer reporte deOxyrrhis marinaDujardin 1841 en la bahía de Guantánamo, Cuba. Rev. Invest. Mar.34(1): 1-8. [ Links ]
Gómez, L., U. Díaz, A. Fernández, Y. Licea y I. Álvarez, I. 2006. Floraciones algales nocivas en la bahía de Santiago de Cuba. IV Taller Internal. Contam. Protec. Medio Amb., Conyma, La Habana.https://www.oceandocs.org/handle/1834/2251 [ Links ]
Gómez, L., Y. Larduet, Y., y N. Abrahantes. 2001. Contaminación y biodiversidad en ecosistemas acuáticos. El fitoplancton de la bahía de Santiago de Cuba. Rev. Invest. Mar., 22(3): 191-197. [ Links ]
Gómez, L., Y. Licea, U. Díaz y I. Álvarez. 2007. Primer reporte deCochlodinium polykrikoides(Margalef, 1961) en aguas cubanas. Rev. Invest. Mar., 28(1): 87-89. [ Links ]
Greenberg, T., H. Shear, J.D. Sánchez and M.A. Ortiz-Jiménez. 2008. Preliminary analysis of water pollution in a small lake in Western Mexico. Water Poll., 11: 13-21. https://doi.org/10.2495/Wp080021 [ Links ]
Guiry, M.D. and G.M. Guiry. 2014. Algaebase. Retrieved 8 julio 2013. Nat. Univ. Ireland Irelandhttp://www.algaebase.org/index.lasso [ Links ]
INSMET. 2017a. Boletín de la Vigilancia del Clima. Mayo. Vol. 29. Inst. Meteor., La Habana. 19 p. [ Links ]
INSMET. 2017b. Resumen mensual. Diciembre.http://www.insmet.cu/asp/genesis.asp?TB0=PLANTILLAS&TB1=MES&TB2=/Mes/Diciembre2015. [ Links ]
Jos, Á., A. M. Cameán, A. I. Prieto, I. Moreno, L. Atencio, M. Puerto y S. Pichardo. 2008. Efectos tóxicos producidos por las microcistinas en peces. Rev. Toxicol., 25(1-3): 1-72. [ Links ]
Kosten, S., V.L. Huszar, E. Becares, L.S. Costa, E. van Donk, L.A. Hansson, E. Jeppesenk, C. Kruk, G. Lacerot, N. Mazzeo, L. De Meester, B. Moss, M. Lurling, T. Noges, S. and M. Scheffer. 2012. Warmer climates boost cyanobacterial dominance in shallow lakes. Global Change Biol., 18(1): 118-126. https://doi.org/10.1111/j.1365-2486.2011.02488.x. [ Links ]
Langlois, R.J., M.M. Mills, C. Ridame, P. Croot and J. LaRoche. 2012. Diazotrophic bacteria respond to Saharan dust additions. Mar. Ecol. Progr. Ser., 470:1-14. https://doi.org/10.3354/Meps10109. [ Links ]
López, E.M., T.A. González, E.F.C. Vega y J.L. Santos. 2015. Nubes de polvo del Sahara. Su presencia en Cuba. Rev. Cub. Meteor., 21(1): 120-134. [ Links ]
Matsuoka, K. and Y. Fukuyo. 2000. Technical guide for modern dinoflagellate cyst study. Westpac-hab, Jap. Soc. Prom. Sci., Tokyo. 72 p. [ Links ]
Minillo, A., A.H.F. Ferreira, G.T. Yogui y J.S. Yunes. 2000. Concentrações de microcistinas e toxicidade nas formas coloniais deMicrocystis aeruginosade florações no estuário da Lagoa dos Patos, RS. En: Espíndola, E.L.G., C.M.R. Botta-Paschoal, O. Rocha, M.B.C. Bohrer y A.L. De Oliveira-Neto (Eds.), Ecotoxicologia:Perspectivas para o Século XXI, São Carlos, RiMa, 521 p. [ Links ]
Moraes, R.. 2009. Toxicología de cianotoxinas: microcistinas as estrelas do tema. Oecol. Austr., 13(2). [ Links ]
Moreno, I., G. Repetto y A. Cameán. 2003. Interés toxicológico de las microcistinas. Rev.Toxicol., 20: 159-165. [ Links ]
Murugan, N.J., L.M. Karbowski, R.M. Lafrenie and M.A. Persinger. 2013. Temporally-patterned magnetic fields induce complete fragmentation in planaria. PLoSOne, 8(4), e61714. [ Links ]
Nalley, J.O., D.R. O’Donnell and E. Litchman. 2018. Temperature effects on growth rates and fatty acid content in freshwater algae and cyanobacteria. Algal Res., 35: 500-507. [ Links ]
OCDE. 1982. Eutrophisation des eaux. Méthodes de surveillance d’évaluation et de lutte. Paris: ODCE. [ Links ]
Okaichi, T. (Ed.). 2003. Red tides. Kluwer, Tokyo. 439 p. [ Links ]
Paerl, H.W., N.S. Hall and E.S. Calandrino. 2011. Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change.Sci. Total Environ., 409(10), 1739-1745. https://doi.org/10.1016/j.scitotenv.2011.02.001. [ Links ]
Rijkenberg, M.J.A., R.J. Langlois, M.M. Mills, M.D Patey, P.G. Hill, M.C. Nielsdottir, T. J. Compton, J. LaRoche and E.P. Achterberg. 2011. Environmental forcingof nitrogen fixation in the eastern tropical and sub-tropical North Atlantic Ocean. PLoS One, 6(12). https://doi.org/10.1371/journal.pone.0028989. [ Links ]
Rodríguez-Tito, J.C., R.M. Pérez-Silva. L.M. Gómez-Luna e I. Álvarez- Hubert. 2017. Evaluación químico-analítica y microbiológica de los embalses Chalons yParada de Santiago de Cuba. Rev. Cub. Quím., 29(3): 418-435. [ Links ]
Rosso, L. y L. Giannuzzi. 2015. Factores ambientales y antropogénicos que afectan la formación de floraciones de cianobacterias y cianotoxinas: 79-93. En: Cianobacterias como determinantes ambientales de la salud. Univ. Nal. La Plata, Argentina. [ Links ]
Sar, E., M. Ferrario y B. Reguera (Eds.). 2002. Floraciones algales nocivas en el Cono Sur americano. Inst. Esp. Oceanogr Madrid. 311 p. [ Links ]
Sellner, K.G. 1997. Physiology, ecology, and toxic properties of marine cyanobacteria blooms. Limnol. Oceanogr., 42(5): 1089-1104. [ Links ]
Sellner, K.G., G.J. Doucette and G.J. Kirkpatrick. 2003. Harmful algal blooms: causes, impacts and detection. J. Ind. Microbiol. Biotech., 30(7): 383-406. [ Links ]
Thomazeau, S., A. Houdan-Fourmont, A. Coute, C. Duval, A. Couloux, F. Rousseau and C. Bernard. 2010. The contribution of Sub-Saharan African strains to the phylogeny of cyanobacteria: Focusing on the Nostocaceae (Nostocales, Cyanobacteria). J. Phycol., 46(3): 564-579. https://doi.org/10.1111/j.1529-8817.2010.00836.x. [ Links ]
Vasconcelos, V. 2001. Cyanobacteria toxins: diversity and ecological effects. Limnetica, 20(1): 45-58. [ Links ]
Venrick, E.L.. 1995. Muestreo y submuestreo del fitoplancton marino y dulceacuícola. Scripps Inst. Oceanogr., Univ. of California, San Diego. 26 p. [ Links ]
Verity, P.G. 2010. Expansion of potentially harmful algal taxa in a Georgia Estuary (USA). Harmful Algae, 9(2), 144-152. https://doi.org/10.1016/j.hal.2009.08.009. [ Links ]
Vollenweider, R.A. and J. Kerekes. 1982. Eutrophication of waters. Monit., Asses. Contr.. OECD, Paris, 156 p. [ Links ]
Walsh, J.J. and K.A. Steidinger. 2001. Saharan dust and Florida red tides: the cyanophyte connection. J. Geophys. Res.: Oceans, 106(C6): 11597-11612. [ Links ]
Water Environmental Federation (WEF) and American Public Health Association (APHA). 2005. Standard Methods for the examination of water and wastewater. 21st ed. Am. Publ. Health Assoc. (APHA), Washington. 874 p. [ Links ]
Wher, J., R. Sheath and J.P. Kociolek (Eds.). 2015. Freshwater algae of North America. Academic, San Diego. 1049 p. [ Links ]
Yan, X., X. Xu, M. Wang, G. Wang, S. Wu, Z. Li, H. Sun, A. Shi and Y. Yang. 2017. Climate warming and cyanobacteria blooms: Looks at their relationships from a new perspective. Water Res., 125: 449-457. [ Links ]
Yasumoto, T., M. Inoue, T. Ochi, K. Fujimoto, Y. Oshima, Y. Fukuyo, R. Adachi y R. Bagnes. 1980. Environmental studies on a toxic dinoflagellate responsible for ciguatera. Bull. Jap. Soc. Scient. Fish., 46(11): 1397-1404. [ Links ]
Recibido: 26 de Noviembre de 2019; Aprobado: 19 de Diciembre de 2020











 texto em
texto em