Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.1 Santa Marta Jan./June 2021 Epub Sep 18, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.1.999
Artículos de Investigación
Determinación de dimorfismo sexual usando técnicas morfométricas en Rachycentron canadum (Perciformes: Rachycentridae) cultivados en cautiverio
1University of Cartagena, Faculty of Exact and Natural Sciences, Biology Program, Applied and Descriptive Biology Research group, Campus San Pablo, Carrera 49B No. 50-230, Barrio Zaragocilla, Cartagena de India, Colombias.rgonzalezg1@unicartagena.edu.co
2University of Cartagena, Faculty of Exact and Natural Sciences, Biology Program, Applied and Descriptive Biology Research group, Campus San Pablo, Carrera 49B No. 50-230, Barrio Zaragocilla, Cartagena de India, Colombias abermudezt@unicartagena.edu.co
3University of Cartagena, Faculty of Exact and Natural Sciences, Biology Program, Hydrobiology Research group, Campus San Pablo, Carrera 49B No. 50-230, Barrio Zaragocilla, Cartagena de Indias, Colombia.
Rachycentron canadum is an economically important fish in aquaculture due to its resistance to environmental variations, the feasibility of culture in confinement, high growth rates, and good acceptance by consumers. The profitability of their cage culture is negatively affected by the difficulty of implementing monosex cultures due to the apparent similarity between sexes. In this study, morphometric techniques were used to determine sexual dimorphism by analyzing measurements and the fish’s shape. Differences were found between the sexes in the position of the eyes, lips, pectoral fin and ventral fin, and the body’s general shape. The sexing precision of the individuals was 75.4 % with distances and 82.7 % with geometric morphometry.
KEYWORDS: Cobia; Geometric morphometry; Distances morphometrics; Colombian Caribbean.
Rachycentron canadum es un pez con importancia económica en la acuacultura debido a su resistencia a variaciones ambientales, factibilidad de cultivo en confinamiento, altas tasas de crecimiento y buena aceptación de los consumidores. La rentabilidad de su cultivo en jaulas se ve afectada negativamente por la dificultad de implementar cultivos monosexo debido a la aparente semejanza entre los sexos. En este estudio se utilizaron técnicas morfométricas para determinar el dimorfismo sexual mediante el análisis de medidas y la forma de los peces. Se encontraron diferencias entre sexos en la posición de los ojos, labios, aleta pectoral y aleta ventral, y en la forma general del cuerpo. La precisión del sexado de los individuos fue de 75,4 % con distancias y 82,7 % con morfometría geométrica.
PALABRAS CLAVE: Cobia; Morfometría geométrica; Morfometría de distancias; Caribe colombiano.
INTRODUCCIÓN
La acuacultura marina ha crecido constantemente y puede suplir parte de la demanda creciente de peces. Particularmente, las especies marinas en ambientes controlados han sido una alternativa efectiva para pesca puramente extractiva. Cada año se estudia un número cada vez mayor de especies con usos potenciales en la industria de la acuacultura, y Rachycentron canadum (Linnaeus, 1766), comúnmente conocido como cobia, es uno de ellos (Franks et al., 1999; Liao et al., 2004; Sun et al., 2006; Holt et al., 2007; Mosqueira et al., 2011).
Esta especie ha ganado importancia debido a la viabilidad de su producción, dadas características como la tolerancia a un amplio rango de temperaturas (entre 16,8 y 32,2 °C) y salinidad (entre 5,0 y 44,5 ups), una buena adaptación a espacios cerrados (por ejemplo, a cultivos en jaulas flotantes), tasas altas de crecimiento (peso promedio de 6 kg en el primer año de cultivo), una tasa excelente de conversión de alimentos, carne de buena calidad nutricional y buena recepción de parte de los consumidores dadas su apariencia y características organolépticas, así como una reproducción relativamente fácil a los dos años de edad (Flores, 2017; Carmona et al., 2019).
En comparación con cuerpos de agua cerrados, el cultivo en jaulas flotantes es respetuoso con el medio ambiente, dado que el mar abierto puede asimilar cargas altas de contaminantes y tiene una gran disponibilidad de agua de buena calidad y bien oxigenada. Asimismo, una vez que la estructura ha sido implementada, en muchos casos, esta permite una reducción en los costos de comida y transporte, por lo cual ha habido diferentes experiencias de cultivo en países del Caribe como Colombia y Cuba (Flores, 2017; Carmona et al., 2019).
En cultivos en jaula, donde los animales están muy cerca unos de otros, la implementación de cultivos de un solo sexo es ampliamente utilizada en la industria de la acuacultura (Franks et al., 1999; Franks y Brown-Peterson, 2002; Dutney et al., 2017). Budd et al. (2015) resumen algunas de las ventajas de este tipo de cultivo, que permite lo siguiente: usar tasas de crecimiento y/o valores económicos diferenciales entre sexos para maximizar ganancias; reducir la variación en el tamaño de los peces al momento de cosechar; lograr una tasa de crecimiento promedio más alta reduciendo el comportamiento sexual/territorial; reducir el impacto en la calidad del producto, dado, por ejemplo, que a medida que las hembras alcanzan la madurez sexual, desvían la energía (e.g., lípidos); incrementar la estabilidad de sistemas de apareamiento; y reducir el riesgo de impacto ambiental que resulta del escape de especies exóticas. La reducción en la maduración precoz merece especial mención, pues lleva a un crecimiento lento, dado que la energía es desviada hacia la reproducción; crea una gran variación en el tamaño del producto cosechado; y resulta en la sobrepoblación de jaulas y, por lo tanto, en la inhabilidad de controlar las densidades y tasas de alimentación de los animales (Budd et al., 2015).
El desarrollo sexual en peces es un proceso complejo, resultado de la interacción entre los genes involucrados en el desarrollo sexual (características genéticas y epigenéticas) y los mecanismos por medio de los cuales los modificadores ambientales pueden inducir cambios fenotípicos. Esto a menudo depende de procesos particulares de las especies y del sistema de cultivo. Por lo tanto, las innovaciones tecnológicas que controlan con éxito el sexo de una especie no tienen garantías de funcionar con otra. Por consiguiente, la primera aproximación es la detección manual o automática del sexo y la remoción selectiva de individuos. El segundo paso es la investigación subsiguiente de varios enfoques tecnológicos para producir poblaciones para cultivo de un solo sexo (e.g., tratamiento hormonal exógeno, manipulación de ploidía de cromosomas, herramientas moleculares o hibridación) (Budd et al., 2015).
No se ha descubierto un dimorfismo sexual evidente en cultivos de cobia, y la maduración sexual precoz en jaulas flotantes es un problema, puesto que reduce la tasa de conversión de alimento y genera un costo adicional (Fontaine et al., 1997; Leclercq et al., 2010; Cerviño, 2014). En esta especie, y en otras que aún no han alcanzado la producción a escala industrial, elucidar la diferenciación del sexo sigue siendo un área clave de la investigación aplicada (Budd et al., 2015).
La morfometría es la descripción, el análisis y la interpretación cuantitativa de la forma y su variación entre muestras (Adams et al., 2004; Zelditch et al., 2004), cuyos resultados pueden interpretarse en términos de geometría, morfología, dimorfismo sexual, medio ambiente, diferencias genéticas y/o microevolución, entre otros (Hammer, 2002; van de Wouw et al., 2003).
La morfometría tradicional es el estudio de la forma basado en longitudes y ángulos de especímenes individuales, mientras que la morfometría geométrica está basada en referentes anatómicos. Un referente anatómico es un punto de referencia que puede ser reconocido en todos los especímenes a comparar. Estos están ubicados de manera que son fáciles de reconocer (e.g., en la yuxtaposición de tejidos, demarcando estructuras internas conspicuas o máximos de curvatura) y describen la forma de la estructura a comparar, evitando la sobreinfluencia de cualquiera de ellos (Bookstein, 1991). Los referentes morfológicos se ubican en imágenes digitalizadas de especímenes y se transforman en coordenadas en un plano bidimensional usando algoritmos matemáticos. Por ende, cualquier variación relacionada con la posición, orientación y escala de la imagen se elimina por medio de software de computadora. Se pueden encontrar diferencias en lo que respecta a la forma de los organismos o entre promedios de grupos diferentes (Kendall, 1989; Rohlf, 1990; Marcus et al., 1993; Adams et al., 2004; Zelditch et al., 2004; Calle et al., 2008). Esta investigación tuvo como objetivo determinar el dimorfismo sexual de R. canadum usando morfometría tradicional y geométrica.
MATERIALES Y MÉTODOS
El material biológico creció en el Centro Colombiano de Investigación en Acuacultura (CENIACUA), ubicado en el departamento de Bolívar, Colombia (10°34’16,7”N 75°30’40,6”W). En total, se usaron 57 peces sanos del cultivo, seleccionados al azar. Fueron sacrificados por asfixia, removiendo la fuente de oxígeno del tanque en el que estaban almacenados, y después fueron preservados en un refrigerador a -20 °C. La longitud de horquilla promedio fue de 45,78 cm (mín = 28,4 cm; máx = 71,9 cm), con edad mínima de cuatro meses y máxima de 12 meses. Se excluyeron cuatro muestras debido a que la forma se vio comprometida por factores externos.
Morfometría tradicional
Las variables morfométricas utilizadas se basaron en Gandhi et al. (2013) y fueron escaladas dividiendo cada una entre la longitud estándar de cada pez. Las variables medidas (Figura 1) fueron: longitud de horquilla (Fl), longitud estándar (Sl), longitud de aletas ventrales (VF) y pectorales (PF), diámetro de los ojos (Ed), separación de fosas nasales (nn), distancia entre la hendidura del labio superior (uL) y la inserción de la aleta caudal (CF), distancia entre uL y el extremo anterior de la boca (Ma), separación entre uL y la inserción inferior de la aleta pectoral (iPF), distancia entre uL y la inserción superior de la aleta pectoral (sPF), distancia entre iPF y sPF (isPF), distancia entre la fosa nasal (n) y uL, longitud desde VF hasta Ma, distancia entre las inserciones posteriores de la aleta ventral (ppVF), distancia entre las inserciones (posteriores y anteriores) de una VF (paVF), distancia entre la inserción dorsal de la cabeza (Hd) y la inserción anterior de la aleta dorsal (aDF), y la distancia entre el ojo (E) y sPF. En el opérculo, se seleccionaron tres semi-referentes anatómicos: Op 1 , Op 2 y Op 4 . Basado en estos, se analizaron las distancias entre Op 4 y uL, Op 4 y sPF, Op 4 y Hd, Op 2 y uL, Op 1 y uL, Op 1 y sPF y Op 1 y iPF.
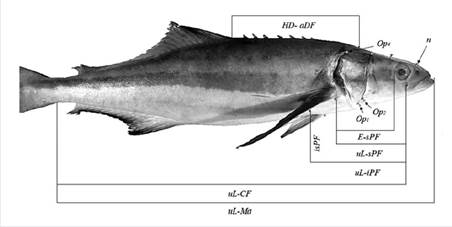
Figura 1 Siete de las 24 medidas y cuatro puntos tomados de los especímenes utilizados en este estudio. En la figura, las abreviaciones son uL: hendidura de labio superior; Ma: extremo anterior de la boca; CF: aleta caudal; iPF: inserción inferior de la aleta pectoral; sPF: inserción superior de la aleta pectoral; E: ojo; PF: distancia entre iPF y sPF; Op1, 2, 4: hendidura cerca al opérculo; n: fosas nasales, HD: inserción dorsal de la cabeza, aDF: inserción anterior de la aleta dorsal.
Morfometría geométrica
Los referentes anatómicos se escogieron siguiendo los criterios de Corti y Crosetti (1996) y Zelditch et al. (2004). En total, se colocaron doce referentes en las fosas nasales (L 1 ), la hendidura del labio superior (L 2 = uL), la segunda hendidura cerca al opérculo (L 3 = Op 2 ), la inserción posterior de la aleta anal (L 4 ), la inserción posterior de la aleta dorsal (L 5 ), la cuarta hendidura cerca al opérculo (L 6 = Op 4 ), la inserción de la aleta ventral (L 8 ), la inserción superior de la aleta pectoral (L 9 = sPF), la primera vértebra de la región dorsal (L 10 ) y la inserción anterior de las aletas dorsales y anales (L 11 , L 12 ). Un pseudo-referente se ubicó en la intersección entre margen posterior del ojo y la línea transversal entre L 1 y L 3 (L 7 ) (Figura 2). Estos referentes fueron digitalizados y convertidos a coordenadas en un plano bidimensional usando el software tpsDig de Rohlf (disponible en https://life.bio.sunysb.edu/ee/rohlf/software.html).

Figura 2 Referentes anatómicos (círculos abiertos) establecidos para el análisis de morfometría geométrica.
Para la toma de imágenes, los especímenes fueron fijados usando pines y ubicados en el mismo lado, de manera que todas las aletas estuvieran extendidas y la boca cerrada. Se tomaron aproximadamente 10 fotos por espécimen, únicamente con cambios pequeños en la posición de las aletas y la inclinación de la cabeza y el abdomen. Todas las imágenes del mismo individuo fueron comparadas y se eligieron para inclusión aquellas que demostraban posiciones idénticas.
Se utilizó un Análisis de Procrustes Generalizado (APG) para procesar la matriz de coordenadas de los referentes, superponiendo las configuraciones de todos los individuos ajustadas al tamaño del centroide (raíz cuadrada de la suma de distancias, al cuadrado, desde cada referente hasta el centroide). El APG utiliza los criterios de cuadrados mínimos para obtener la superimposición óptima, evitando variaciones no relacionadas con la forma. Las superimposiciones se usaron para calcular los componentes de deformación relativa utilizados en los análisis estadísticos. El APG también calcula una configuración de consenso (promedio) que resume las configuraciones de todos los referentes, permitiendo describir y comparar la forma promedio del espécimen y/o sus grupos (Rohlf, 1990; Adams et al., 2004; Zelditch et al., 2004; Calle et al., 2008). Este análisis se llevó a cabo usando el software TpsRelw de Rohlf (disponible en https://life.bio.sunysb.edu/ee/rohlf/software.html).
Determinación del sexo
Los especímenes fueron sexados por observación directa de las gónadas (Holden y Raitt, 1974). Se realizó una incisión en forma de L entre el ano y las aletas ventral y pectoral; el tejido se estiró hasta que se observaron las gónadas desde la inserción de la aleta dorsal y sobre el intestino. Los peces con gónadas pequeñas y apariencia tubular fueron considerados machos, y aquellos con gónadas más grandes, anchas y planas fueron considerados hembras.
Análisis estadístico
En el caso de la morfometría tradicional, para cada sexo, la distribución normal de los datos fue probada mediante la prueba de Kolmogorov-Smirnov (p < 0,05); la independencia de variables, trazando cada variable hasta su pareja; y la homogeneidad de variaciones, por medio de la prueba de Levene (p > 0,05). Se usó una prueba t de Student para muestras independientes (p ≤ 0,05) con el objetivo de determinar diferencias significativas entre sexos. Cada variable biométrica se consideró como independiente, y cada sexo como variable dependiente. Se calculó una correlación lineal, y se hizo un análisis discriminante usando las variables con diferencias significativas y sin correlación cruzada. El análisis discriminante se validó de forma cruzada, y se calcularon las funciones lineales discriminantes, el cuadrado de la distancia entre grupos y el porcentaje de clasificación adecuada.
En la morfometría geométrica, los datos del APG se utilizaron para identificar cuáles referentes anatómicos daban más información sobre la forma de la cobia y para hacer un segundo análisis discriminante por medio de las deformaciones relativas como variables independientes. Se calculó el porcentaje de clasificación adecuada, y cada coordenada de los referentes se transformó en un único valor, multiplicándolos unos con otros. Se calculó, además, la correlación entre la función discriminante y los referentes transformados, y aquellos que tenían la correlación más alta con la función fueron analizados. El dimorfismo sexual se expresó como una ecuación lineal de variables biométricas y una imagen de los vectores de las geométricas.
RESULTADOS
Morfometría tradicional
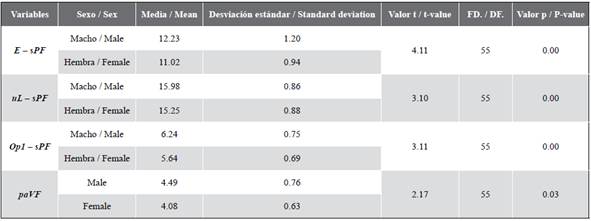
Con base en la observación directa de las gónadas, 56,14 % de los individuos fue identificado como hembras y 43,86 % como machos. Después de corroborar la independencia de las variables, la normalidad, y la homocedasticidad (p > 0,05), la prueba t de Student mostró que E - sPF, paVF, uL - sPF, n - uL, sPF - Op 1 y paVF eran significativamente diferentes entre sexos (p < 0,05; Tabla 1). Estas variables resumen la información sobre los ojos, boca, opérculo y las aletas ventral y pectoral, y no estaban correlacionadas las unas con las otras (p < 0,05), lo cual las hace aptas para el análisis discriminante.
Tabla 1 Estadísticas descriptivas de probabilidades de la prueba t de Student (n = 57). Ver Figura 1 para la descripción completa de las variables.
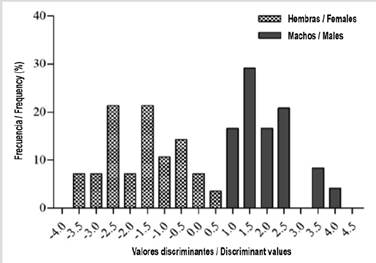
Este análisis discriminante validado de forma cruzada con variables biométricas agrupó correctamente a 75,4 %. Tiene un cuadrado de la distancia entre grupos de 2,18. Mientras el valor de la primera función discriminante (I) sea más bajo que el segundo (II), el individuo será clasificado como macho. Si I es más alto que II, el individuo es considerado como hembra.
Funciones discriminantes:
Morfometría geométrica
El APG calculó 20 deformaciones relativas de variación de forma. Los referentes 7, 2 y 9 contribuyeron más a las deformaciones relativas: 29 % de la contribución para el referente 7, 22 % de la contribución para el referente 2 y 15 % para el referente 9. El análisis discriminante validado de forma cruzada con base en ejes principales de variación de forma (deformaciones relativas) agrupó a 82,7 % de los individuos (Figura 4). Las variables transformadas (el producto de las coordenadas bidimensionales de cada referente) explicaron el 97,6 ± 0,01 % de su variación.
Los referentes 9 y 7 tuvieron correlaciones intragrupales combinadas más altas con la función discriminante que los otros referentes. Si se alinean el consenso de los machos con el de las hembras y se analiza la variación de forma, L 9 es el referente con la mayor diferencia entre sexos (Figura 3). Las hembras tienen un ángulo de 135,35 ± 7,01 ° y los machos de 141,92 ± 8,60 ° entre L9 y L7 con origen en L3. La diferencia entre estos ángulos es significativa (p = 0,004), lo cual indica que las posiciones del ojo y la aleta pectoral son importantes para el dimorfismo sexual en la cobia.

Figura 3 Variación de los vectores de la forma de las hembras con respecto al consenso de la configuración de los machos. las líneas representan la posición de los referentes en el consenso de la configuración de las hembras.
DISCUSIÓN
Las relaciones morfológicas estudiadas permitieron asignar correctamente los sexos en 75 % de los especímenes analizados. Existen individuos en poblaciones naturales cuyas características son muy similares a las del sexo opuesto, o hay pocas diferencias entre sexos, lo que hace que el porcentaje de asignación correcta en análisis discriminantes rara vez alcance 100 %. Esto puede deberse a que el fenotipo de los individuos depende de su sexo y de factores ambientales, genéticos y sociales (Márquez, 1995; Sanabria et al., 2011; Peckmann et al., 2015; U-Yong et al., 2015; Jónsdóttir et al., 2016).
En los análisis de morfometría geométrica, el 23 % cuyo sexo no fue determinado puede ser también el resultado de un error en el posicionamiento de los peces al momento de tomar imágenes. Sin embargo, dado que la covarianza/matriz de varianza es igual en todos los grupos, el análisis no pierde validez. Los porcentajes de asignación correcta en el análisis discriminante basado en distancias (75,4 %) y en morfometría geométrica (82,7 %), además de la carencia de los efectos perturbadores de la edad usados en esta investigación (4-12 meses), hacen que esta técnica sea útil en la acuacultura de cobia y otras especies (Bonino y Donadio, 2010; Peckmann et al., 2015; U-Yong et al., 2015; Jónsdóttir et al., 2016).
Los referentes ubicados en la cobia pueden ser usados para sexar individuos con base en algoritmos de reconocimiento en peces. Actualmente se está desarrollando un método para determinaciones en peces como Sebastes constellatus, S. levis, S. miniatus, S. rubrivinctus, y Prognathodes falcifer por medio del análisis automatizado de capturas fotográficas. Sin embargo, aún no es claro cuáles algoritmos son los mejores, y no hay ninguna base de datos con información suficiente para hacerlos (Dujardin et al., 2010; Matai et al., 2012; Williams et al., 2012; NOAA, 2013; Dujardin et al., 2014). La cantidad necesaria de información para diferenciar especies es más grande que la que se necesita para distinguir entre los sexos de una. Por lo tanto, desarrollar este tipo de técnica para sexar individuos es ciertamente alcanzable y no debería ser complicado.
El nivel de distinción de sexo obtenido en este estudio podría incrementar la eficiencia de la acuacultura marina de cobia en un solo sexo en jaulas en el Caribe colombiano, lo cual incrementaría su rentabilidad.
CONCLUSIÓN
Las variables biométricas que pueden usarse como dimorfismo sexual son E - sPF, VF y Op 4 - Hd. Los referentes en el ojo y la aleta pectoral son las fuentes más precisas para extraer información sobre el sexo. Visualmente, la diferencia entre sexos puede verse en cabezas más pequeñas y un espacio mayor, así como en un ángulo más estrecho entre los ojos y la aleta pectoral para las hembras.
AGRADECIMIENTOS
Los autores agradecen a la Gobernación de Bolívar por el apoyo a los proyectos del Sistema General de Regalías, en específico al Convenio Especial de Cooperación de Ciencia y Tecnología No 58 celebrado entre la Gobernación de Bolívar y Ceniacua (Contrato 05 de 2014 suscrito entre Ceniacua y Universidad de Cartagena), del cual hacen parte los resultados acá presentados. A la Universidad Metropolitana de Mánchester, a través del proyecto Improving Local Management of Tropical Coastal Resources in The Face of Climate Change for Economic Wellbeing of Local and Vulnerable Communities [Mejorando la gestión local de recursos costero-tropicales ante el cambio climático para el bienestar económico de comunidades locales y vulnerables]; y a la Vicerrectoría de Investigación de la Universidad de Cartagena por el proyecto con acta de compromiso N° 136-2018
REFERENCIAS
Adams, D.C., F.J. Rohlf and D.E. Slice. 2004. Geometric morphometrics: ten years of progress following the ‘Revolution’. Ital. J. Zool., 71: 5-16. doi: 10.1080/11250000409356545. [ Links ]
Bonino, N. y E. Donadio 2010. Parámetros corporales y dimorfismo sexual en el conejo silvestre europeo (Oryctolagus cuniculus) introducido en Argentina. Mastozool. Neotrop., 17(1): 123-127. [ Links ]
Bookstein, F.L. 1991. Morphometric tools for landmark data: Geometry and biology. Cambridge University Press, New York, 435 p. [ Links ]
Budd A.M., Q.Q. Banh, J.A. Domingos and D.R. Jerry. 2015. Sex control in fish: Approaches, challenges and opportunities for aquaculture. J. Mar. Sci. Eng., 2015, 3, 329-355. doi:10.3390/jmse3020329 [ Links ]
Calle, D.A., M.L. Quiñones, H.F. Erazo y N. Jaramillo. 2008. Discriminación por morfometría geométrica de once especies de Anopheles (Nyssorhynchus) presentes en Colombia. Biomédica, 28(3): 371-385. doi: https://doi.org/10.7705/biomedica.v28i3.75. [ Links ]
Carmona J.C., E. R. Flores, R. Castelo, Y. Armas, M. F. Hoyum, R. Engelsen y B. T. Lunestad 2019. Factibilidad del engorde y comercialización de la cobia (Rachycentron canadum) en la provincia de Matanzas, Cuba. Rev. Cub. Invest. Pesq., 36 (2), 38-42. [ Links ]
Cerviño, S. 2014. Estimating growth from sex ratio-at-length data in species with sexual size dimorphism. Fish. Res., 160: 112-119. doi: https://doi.org/10.1016/j.fishres.2013.11.010. [ Links ]
Corti, M. and D. Crosetti 1996. Geographic variation in the grey mullet: a geometric morphometric analysis using partial warp scores. J. Fish Biol., 48: 255-269. [ Links ]
Dujardin, J.P., A.B. Henry and D. Kaba 2010. The exchangeability of shape. BMC Res. Notes, 3(266): 1-7. doi: 10.1186/1756-0500-3-266. [ Links ]
Dujardin, J., D. Kaba, P. Solano, M. Dupraz, K.D. McCoy and N. Jaramillo-O. 2014. Outline-based morphometrics, an overlooked method in arthropod studies?. Infect. Genet. Evol., 28: 704-714. doi: 10.1016/j.meegid.2014.07.035. [ Links ]
Dutney, L., A. Elizur and P. Lee 2017. Analysis of sexually dimorphic growth in captive reared cobia (Rachycentron canadum) and the occurrence of intersex individuals. Aquaculture, 468(1): 348-355. doi: https://doi.org/10.1016/j.aquaculture.2016.09.044. [ Links ]
Flores E.R. 2017. La cobia (Rachycentron canadum). Rev. Cub. Invest. Pesq., 34(2): 74-83. [ Links ]
Fontaine, P., J.N. Gardeur, P. Kestemont and A. Georges 1997. Influence of feeding level on growth intraspecific weight variability and sexual growth dimorphism of Eurasian perch Perca fluviatilis L. reared in a recirculation system. Aquaculture, 157: 1-9. doi: https://doi.org/10.1016/S0044-8486(97)00092-6. [ Links ]
Franks, J.S. and N.J. Brown-Peterson 2002. A review of age, growth and reproduction of cobia, Rachycentron canadum from U.S. waters of the Gulf of Mexico and Atlantic Ocean. Gulf Carib. Fish. Inst., 53: 553-569. [ Links ]
Franks, J.S., J.R. Warren and M.V. Buchanan 1999. Age and growth of cobia, Rachycentron canadum. from the northeastern Gulf of Mexico. Fish. Bull., 97(3): 459-471. [ Links ]
Gandhi, V., V. Venkatesan and P. Zacharia 2013. Biometry analysis, length-weight relationship and sexual dimorphism of the Spotted Scat, Scatophagus argus (Linnaeus, 1766) (Perciformes: Scatophagidae) from Gulf of Mannar southeast coast of India. J. Mar. Biol. Assoc. India, 55(1): 12-16. doi: 10.6024/jmbai.2013.55.1.01743-02. [ Links ]
Hammer, Ø. 2002. Morphometrics - brief notes. Paläont. Inst. Mus., Zürich, 49 p. [ Links ]
Holden, M. and D. Raitt 1974. Manual of fisheries science, Part 2 - Methods of resource investigation and their application. FAO, Rome. Available at http://www.fao.org/3/f0752e/F0752E00.HTM [ Links ]
Holt, G.J., C.K. Faulk and M.H. Schwarz 2007. A review of the larviculture of cobia Rachycentron canadum, a warm water marine fish. Aquaculture, 268: 181-187. doi:https://doi.org/10.1016/j.aquaculture.2007.04.039. [ Links ]
Jónsdóttir, I.G., A.K. Gudlaugsdóttir and H. Karlsson 2016. Morphometric differences between sub-populations of northern shrimp (Pandalus borealis). A case study from two adjacent fjords in Iceland. Reg. Stud. Mar. Sci., 3: 42-48. doi: https://doi.org/10.1016/j.rsma.2015.04.002. [ Links ]
Kendall, D.G. 1989. A survey of the statistical theory of shape. Stat. Sci., 4(2): 87-120. [ Links ]
Leclercq, E., J.F., Taylor, D. Hunter and H. Migaud 2010. Body size dimorphism of sea-reared Atlantic salmon (Salmo salar L.): Implications for the management of sexual maturation and harvest quality. Aquaculture, 301: 47-56. doi: https://doi.org/10.1016/j.aquaculture.2010.01.029. [ Links ]
Liao, I.C., H. Ting-Shih., T. Wann-Sheng, H. Cheng-Ming., C. Su-Lean and E.M. Leaño 2004. Cobia culture in Taiwan: current status and problems. Aquaculture, 237: 155-165. doi: 10.1016/j.aquaculture.2004.03.007. [ Links ]
Marcus, L.F., M. Corti, A. Loy, G.J.P. Naylor and D.E. Slice 1993. Advances in morphometrics. Tuscany, Italy: NATO ASI Series. Series A. Life Sci., 284: 588. doi: 10.1007/978-1-4757-9083-2. [ Links ]
Márquez, C. 1995. Historia natural y dimorfismo sexual de la tortuga Kinosternos scorpioides en Palo Verde Costa Rica. Rev. Ecol. Lat., 2(1-3): 37-44. [ Links ]
Matai, J., R. Kastner, G.R. Cutter and D.A. Demer 2012. Automated techniques for detection and recognition of fishes using computer vision algorithms. Available at: Available at: https://swfsc.noaa.gov/publications/CR/2012/2012Matai.pdf Accessed 26 10 2015. [ Links ]
Mosqueira, J.R., P. Pinzón, H. Calderón y R. Vieira 2011. Producción de alevines de cobia Rachycentron canadum (Linnaeus, 1766) en el centro de investigación, educación y recreación - Ceiner - (Cartagena. Colombia). AquaTic, 35: 35-42. [ Links ]
NOAA. 2013. Facial recognition technology and the future of fisheries management. Available at: Available at: http://www.nmfs.noaa.gov/stories/2013/06/6_5_13video_monitoring.html Accessed 26 10 2015. [ Links ]
Peckmann, T.R., K. Orr, S. Meek and S.K. Manolis 2015. Sex determination from the talus in a contemporary Greek population using discriminant function analysis. J. For. Leg. Med., 33: 14-19. Doi: 10.1016/j.jflm.2015.03.011. [ Links ]
Rohlf, F.J. 1990. Morphometrics. Annu. Rev. Ecol. Syst., 21: 299-316. doi: https://doi.org/10.1146/annurev.es.21.110190.001503. [ Links ]
Sanabria C., L.C. Polo y M.C. Botella 2011. Dimorfismo sexual en primera vértebra cervical en una muestra de población colombiana. Rev. Españ. Med. Leg., 37 (4): 140-145. [ Links ]
Sun, L., H. Chen and L. Huang 2006. Effect of temperature on growth and energy budget of juvenile cobia (Rachycentron canadum). Aquaculture, 261: 872-878. doi: 10.1016/j.aquaculture.2006.07.028 [ Links ]
U-Yong, L., K. In-Beom and K. Dai-Soon. 2015. Sex determination using discriminant analysis of upper and lower extremity bones: New approach using the volume and surface area of digital model. For. Sci. Int., 253: 135. e1-4. doi: 10.1016/j.forsciint.2015.05.017. [ Links ]
Williams, K., C. Rooper and J. Harms. 2012. Photographic and videographic imagery collection and analysis activities at the coral reef ecosystem division of the NOAA Pacific Islands Fisheries Science Center. Rep. Nat. Mar. Fish. Serv. Automated Imaged Processing Workshop, 18-20. [ Links ]
van de Wouw, M., N. Maxted y B.V. Ford-Lloyd. 2003. A multivariate and cladistic study of Vicia L. ser. Vicia (Fabaceae) based on analysis of morphological characters. Plant System. Evol., 237:19-39. [ Links ]
Zelditch M., D. Swiderski, D. Sheets and W. Fink. 2004. Geometric morphometrics for biologists: A primer. Academic. 437 p. [ Links ]
Recibido: 09 de Marzo de 2020; Aprobado: 24 de Diciembre de 2020











 text in
text in