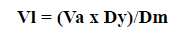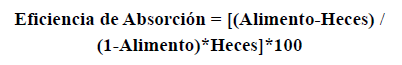Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 no.2 Santa Marta July/Dec. 2021 Epub Dec 03, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.2.1012
Artículos de Investigación
Eficiencia de absorción en postlarvas de camarón blanco del Pacífico, Litopenaeus vannamei, alimentadas con una dieta de levadura marina de marismas de manglar
1BioMar Alimentsa Ecuador SA., Tambo, Guayaquil, Ecuador. fulso@biomar.com
2Facultad de Ciencias Agropecuarias, Universidad Técnica de Machala, Machala. Ecuador. colon.velasquez@gmail.com
The present study investigated marine yeast as a food source in the Pacific white shrimp Litopenaeus vannamei. Yeast absorption efficiency was determined by measuring the proportion of organic matter assimilated by shrimp post-larvae (PLs). The yeast was isolated and propagated in the laboratory from a sediment sample obtained from a mangrove mudflat. Shrimp post-larvae at six stages, from PL-5-days-old to PL-35-days-old were fed exclusively with yeasts, at three concentrations (1.5 × 105, 3 × 105, 5 × 105cell/mL). The overall average of yeast absorption was around 65.85 ± 11.42 %. The two-way analysis of variance ANOVA (p < 0.05) showed that the efficiency of yeast absorption was not affected by the concentrations of yeasts as a food source: none of the yeast concentrations interacted with the age of the post-larvae. The absorption efficiency of 67.30 % registered in young post-larvae (PL 5-days-old to PL15-days old) was significantly different than the efficiency registered for older post-larvae (PL 20 days old to PL 35 days-old) with an average of 60.21 % (p < 0.05). The relatively high absorption efficiency of yeast in L. vannamei post-larvae contributes to a better understanding of the potential role of microorganisms as complementary feedstuffs in coastal aquaculture.
KEYWORDS: Estuarine aquaculture; food absorption; mangroves; microorganisms; Pacific white shrimp.
El presente estudio investigó la levadura marina como fuente de alimento en el camarón blanco Litopenaeus vannamei. Se determinó la eficiencia de absorción de levaduras midiendo la proporción de materia orgánica asimilada por las postlarvas de camarón. La levadura marina se aisló y se propagó en laboratorio a partir de una muestra de sedimento obtenida en una marisma de manglar. Seis etapas de desarrollo de postlarvas de camarón, desde PL-5 días hasta PL-35 días fueron alimentadas exclusivamente con tres concentraciones de levaduras (1,5 × 105, 3 × 105, 5 × 105cel/mL). El promedio general de la absorción de levadura fue de 65,85 ± 11,42 %. El análisis de varianza de dos vías ANOVA (p < 0,05) mostró que la eficiencia de absorción de levadura en post-larvas de camarón no se vio afectada por las concentraciones de levaduras; tampoco las concentraciones de levaduras interactuaron con la edad de las postlarvas. La eficiencia de absorción de 67,30 % registrada en postlarvas jóvenes (PL-5 a PL-15) fue significativamente diferente a la absorción registrada en post-larvas de mayor edad (PL-20 a PL-35) con un promedio de 60,21 % (p < 0,05). La eficiencia de absorción relativamente alta de levadura en postlarvas de L. vannamei contribuye a una mejor comprensión del rol de los microorganismos como complemento nutricional en la acuicultura costera.
PALABRAS CLAVE: Absorción de alimento; acuicultura estuarina; manglares; microorganismos; camarón blanco del Pacífico.
INTRODUCCIÓN
El camarón blanco del Pacífico, Litopenaeus vannamei, es una de las principales especies acuáticas empleadas en la acuicultura costera. Su cultivo corresponde a cerca de 15 % de la producción pesquera mundial y tiene un valor en el mercado global de casi US $18 mil millones (FAO, 2017). El camarón L vannamei tiene varias etapas de desarrollo: larva, postlarva, prejuvenil, juvenil y etapa adulta final. La etapa de postlarva ocurre después de las fases larvales de nauplio, zoea y mysis. En las etapas de zoea y mysis los camarones blancos del Pacífico son organismos planctónicos que se alimentan de restos de materia orgánica, algas y pequeños invertebrados. En las operaciones comerciales de acuicultura, el alimento para las larvas de camarón consiste en una o dos especies de diatomeas, tales como Chaetoceros gracilisyThalasiosira weissflogii(Kiatmetha et al., 2011), cuya concentración en el tanque de cría fluctúa alrededor de 1 × 105cel/mL (Müller-Feuga et al., 2003). Las fases mysis y postlarva se alimentan con microcrustáceos Artemia salina; sin embargo, muchas operaciones de criadero reemplazan el alimento vivo con alternativas artificiales. Las postlarvas producidas en criaderos se transportan a instalaciones de cultivo bajo condiciones semicontroladas, bien sea en estanques invernaderos o en piscinas terrestres preengorde.
Por lo general, el cultivo de camarón se realiza en o cerca de ecosistemas de manglares. Por ejemplo, Ecuador, el principal productor de camarón de las Américas, tiene aproximadamente 2.200 km de costa, y alrededor de 75 % del cultivo de camarón se realiza cerca de bosques de manglares. Las levaduras se encuentran en la zona costera marina como parte de una gran comunidad microbiana (Chi et al., 2012). Varios investigadores han revisado el uso de microorganismos como potencial fuente de alimento en sistemas de acuicultura, estos autores han explorado la importancia de bacterias, levaduras, hongos y microalgas para el mantenimiento de diferentes animales acuáticos. La composición de las levaduras sugiere que podrían ser una fuente de alimento alternativa y confiable para los organismos marinos, pues contienen polímeros, ácidos grasos poliinsaturados, y grandes concentraciones de vitaminas y minerales (Shelby et al., 2019). La pared celular de la levadura consta de 57 % de β-glucano, 6,6 % de oligosacáridos y 22 % de glucoproteína Sahlmann et al. (2009), Chi et al. (2010) y Kupetz et al. (2015) registran que la levadura tiene un alto valor nutricional para peces y camarones en condiciones de cultivo. Así mismo, Lara-Flores (2003) sostiene que la levadura puede reemplazar de manera efectiva otras fuentes de proteína y lograr un mejor crecimiento y desarrollo de los peces. Por su parte, Farzanfar (2006), Sukumaran et al. (2010) y Zheng (2017) registraron que alimentar con levadura a los peces y mariscos reduce las enfermedades al disminuir la presencia de bacterias patógenas en el tracto intestinal. El valor nutricional de las levaduras hace que sean apropiadas como alimento complementario para peces y crustáceos (Pathissery, 2016; Sarlin et al., 2016). Por ejemplo, Zhao et al. (2017) proporcionaron extracto de levadura, mezclado con aceite de pescado, fósforo y calcio, como un reemplazo de proteína para la harina de pescado utilizada para alimentar al camarón L. vannamei. Una cantidad considerable de los inmunoestimulantes comerciales utilizados en la acuicultura se derivan de levadura, lo que refleja la importancia de estos microorganismos para la industria (Villamil-Díaz y Martínez-Silva, 2009). Además, debido al tamaño y a la composición de nutrientes de las levaduras, varios investigadores han propuesto el uso de levadura viva para bioenriquecer organismos de presa como los rotíferos y el camarón de salmuera (Lavens et al., 1996; Patra y Mohamed, 2003), aunque esta práctica apenas se está empezando a usar en sistemas de acuicultura.
A pesar de todos los efectos positivos de las levaduras, se han realizado pocos estudios sobre su utilidad como alimento vivo para el cultivo de camarón (Villamil-Díaz y Martínez-Silva, 2009). No se han realizado estudios para evaluar la ingestión, colonización o digestibilidad de la levadura marina en el camarón blanco del Pacífico L. vannamei. Adicionalmente, el conocimiento sobre la eficiencia de absorción de alimentos de las larvas de camarón se limita a la ingestión de microalgas (Urabe, 1991; Evjemo, 2000). La información sobre el rendimiento de las postlarvas de camarón alimentadas exclusivamente con una dieta de levadura es escasa. El objetivo de este estudio fue obtener levadura de las marismas de manglares y probarla como fuente dietética para las postlarvas de camarón blanco del Pacífico. Se investigó el uso de la levadura marina como fuente de alimento midiendo la eficiencia de absorción de la levadura por parte de L. vannamei en etapas de postlarva, y empleando diferentes concentraciones de levadura. La eficiencia de absorción de los alimentos, también conocida como eficiencia digestiva o digestibilidad de los alimentos, es la proporción de materia orgánica asimilada por un organismo (Lucas y Watson, 2002). Por lo tanto, para que la levadura sea un alimento eficaz para los camarones, esta debe ser asimilada y sus compuestos orgánicos deben degradarse. Debido a que el alimento disponible para los camarones se presenta como materia orgánica, su absorción indica la capacidad del camarón de absorber sus compuestos naturales. Este estudio evalúa la eficiencia de la absorción de la levadura marina mediante la proporción de materia orgánica presente en la levadura (alimento) y en las heces del camarón, en la cual el componente orgánico del alimento ingerido es asimilado a través del proceso de digestión (Conover, 1966).
MATERIALES Y MÉTODOS
La investigación incluyó una etapa de toma de muestras (en el área de manglar-camarón) y una experimental (propagación de levaduras y alimentación de postlarvas). Para obtener la levadura se tomó una sola muestra de sedimento de una marisma de manglar en el área costera de cultivo de camarón cerca de Machala, provincia de El Oro, Ecuador (longitud 9636225, latitud 620861). Las fases de tratamiento de sedimentos, mantenimiento de postlarvas y establecimiento de las pruebas experimentales se llevaron a cabo en el laboratorio de acuicultura de la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Machala, ubicada aproximadamente a 45 km del lugar donde se tomaron las muestras.
Muestreo de sedimentos; aislamiento y cultivo de levadura
Utilizando una espátula estéril se recolectaron asépticamente muestras de 500 g tomadas a 10 cm de la capa superior de sedimento del bosque de manglar. La muestra de sedimento se colocó en recipientes plásticos esterilizados herméticamente cerrados, se mantuvo en condiciones frías de entre 4 y 10 º C y se transportó al laboratorio inmediatamente después de la recolección. Bajo condiciones de laboratorio, se suspendió 1g de sedimento en 10 mL de solución de peptona. Posteriormente, se colocó 1 mL de solución fresca en placas de cultivo de agar Saboraud y se incubó a 30º C durante dos días. Tras el período de incubación, después de que aparecieron colonias de microorganismos, algunas de las unidades formadoras de colonias se transfirieron a un tubo de ensayo que contenía una solución concentrada de peptona. De esta manera, obtuvimos un caldo de levadura primario. La propagación de la levadura procedió de los 250 mL de cultivo madre a etapas intermedias de 1 y 3 L. Las levaduras se cultivaron en un medio compuesto por una solución preparada con agua de mar filtrada a través de una microfibra de borosilicato (0,47 µm). El agua se enriqueció con 0,65 g/L de fosfato de sodio, 1,0 g/L de nitrato de sodio y 10 ml/L de melaza. El medio de cultivo de levadura se acidificó con ácido muriático hasta un pH de 4,5, condición recomendada para la cepa Saccharomyces cerevisiae (Vieira et al., 2013). El cultivo estuvo listo para su uso cuando los 5 L de cultivo resultantes alcanzaron la fase de crecimiento exponencial. Para asegurar la pureza de la melaza, ésta se obtuvo directamente de una finca de caña de azúcar ubicada en tierras altas de la provincia de El Oro, Ecuador.
Se recolectó una porción de la masa de levadura y se transfirió a un filtro de fibra de vidrio. Luego, se enjuagaron las levaduras con agua destilada en un sistema de filtrado al vacío. Se conservaron seis muestras del caldo de levadura para posterior análisis de materia orgánica.
Mantenimiento de postlarvas de L. vannamei y diseño experimental
Las postlarvas de L. vannamei (de tres a cuatro días de edad) se obtuvieron de un laboratorio comercial ubicado cerca del laboratorio de experimentos en la Universidad Técnica de Machala. Durante la operación del cultivo de larvas, los organismos fueron alimentados con fitoplancton durante la fase zoea y con una combinación de Artemia salina y dieta microparticulada durante la de mysis (Figura 1).
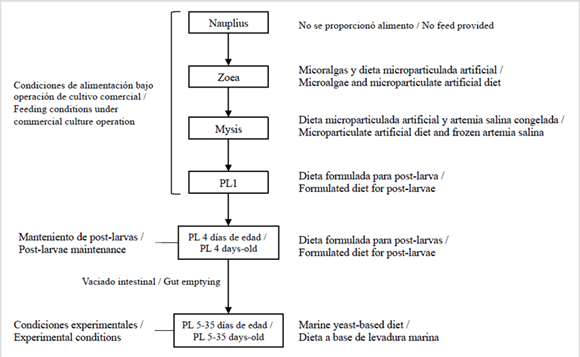
Figure 1 Diagrama de flujo de larvicultura de camarón adoptado en operaciones de cultivo comercial y mantenimiento de postlarvas para experimentos de alimentación con levadura marina.
Durante las etapas de postlarva, el régimen nutricional consistió exclusivamente en alimentos formulados. A los tres o cuatro días de edad, las postlarvas fueron transportadas al área de bioensayos de la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Machala. Las postlarvas se aclimataron y se mantuvieron en un tanque de cultivo de 500 L. Siguiendo el protocolo de alimentación del laboratorio comercial, las postlarvas fueron alimentadas con una dieta ad libitum compuesta por alimento 100 % formulado (52 % proteína). Las postlarvas se mantuvieron en agua de mar natural filtrada y conservada a temperatura ambiente. La salinidad del agua fue de 26 y la temperatura fluctuó entre 26 y 28º C. Las postlarvas se mantuvieron bajo estas condiciones hasta 35 días.
La Figura 2 muestra el diseño experimental del estudio. Para cada etapa de postlarva, a partir de los cinco días de edad, se seleccionaron al azar aproximadamente 5.000 postlarvas del tanque de cría y se depositaron en acuarios de fibra de vidrio con 60 L de agua de mar esterilizada. Antes de introducir el alimento (levaduras) en los acuarios, las postlarvas se mantuvieron en reposo (sin alimentación) en agua 100 % pura durante 12 h para permitir la evacuación total de los alimentos que habían consumido en el tanque de mantenimiento. Durante el período de descanso, el agua se reemplazó en un 100 %, para asegurar la eliminación de la materia fecal de los acuarios. En cada etapa de postlarva (5, 10, 15, 20 y 35 días) los organismos fueron colocados en los acuarios durante 24 h para la exposición a la alimentación con levadura. Cada grupo de postlarvas se alimentó de forma diferente, según el diseño.
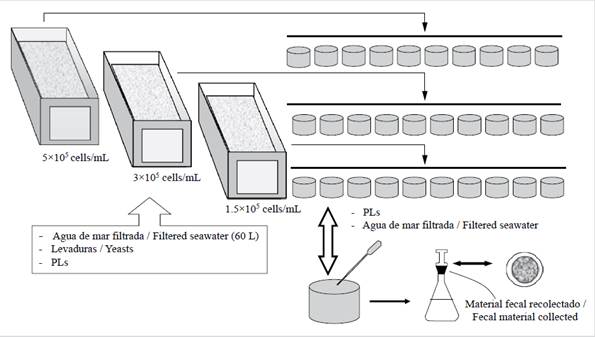
Figura 2 Diagrama esquemático del diseño experimental, que muestra los tres acuarios experimentales para sembrar postlarvas de Litopenaeus vannamei alimentadas durante 24 h marinas con una dieta a base de levaduras, los 10 recipientes para la excreción de las post-larvas y el procedimiento de recolección de la materia fecal.
Las postlarvas se alimentaron con tres concentraciones diferentes de levadura: 1,5 × 105, 3 × 105 y 5 × 105cel/mL. La densidad de la levadura se calculó usando un hemocitómetro y un microscopio Nikon Optiphot. La densidad de la levadura se determinó cada tres horas tanto en los acuarios experimentales como en los matraces de propagación de levadura. Todos los acuarios tenían aireación permanentemente para mantener las levaduras en suspensión en la columna de agua.
Las levaduras se adicionaron utilizando el método recomendado por el Northeastern Regional Aquaculture Center (1993), y ajustando la siguiente fórmula:
Vl: volumen de levaduras para alimentar postlarvas
Va: volumen del acuario con postlarvas
Dy: densidad objetivo de levaduras en el acuario con post-larvas
Dm: densidad de levaduras en el cultivo masivo de levaduras
Las postlarvas se revisaron durante cada fase para examinar el contenido intestinal y el comportamiento general. Las levaduras se introdujeron en los recipientes de forma continua mediante inyección por goteo, utilizando un kit de suero fisiológico y ajustando la cantidad de la solución del cultivo de levadura para mantener la concentración deseada en cada fase experimental. Para determinar la eficiencia de absorción de la levadura en cada etapa, se recolectaron 10 grupos de postlarvas luego de las 24 h de alimentación, y se transfirieron a recipientes llenos de agua de mar esterilizada. Durante la hora siguiente, las postlarvas evacuaron sus heces y se retiraron de los matraces con una micropipeta de plástico. La materia fecal se colocó en pequeñas cápsulas de aluminio y se almacenaron para su posterior análisis.
Determinación de la eficiencia de absorción de la levadura
La eficiencia de absorción de la levadura se evaluó midiendo la proporción de materia orgánica en la levadura (alimento) y en las heces del camarón, en la cual el componente orgánico del alimento ingerido es asimilado (Conover, 1966). La materia fecal y las levaduras recolectadas se filtraron por separado en un filtro de fibra de vidrio GF/C Whatman (previamente calcinado). El filtro de fibra de vidrio se enjuagó con agua destilada, y se mantuvo un sistema de filtrado al vacío. Después del proceso de filtración, los filtros se colocaron en cápsulas de aluminio previamente pesadas. Se determinó el peso seco usando una balanza analítica Denver Instrument (modelo X-100). La levadura y los productos fecales se secaron en un horno a 60 °C durante 48 h hasta que se alcanzó un peso constante. A continuación, se transfirió el producto a un desecador para enfriarlo durante 15 min. El peso de la materia seca se calculó midiendo la diferencia entre el peso del filtro más el producto seco (levadura o heces) y el peso del filtro. El peso de los componentes inorgánicos (cenizas) se obtuvo colocando los filtros más el material seco en capsulas de aluminio e incinerándolos en una mufla a 450 °C durante cuatro horas. Luego, el material se colocó en el desecador antes de volverlo a pesar. Finalmente, se estimó la proporción de materia orgánica midiendo el peso seco y el contenido orgánico del alimento (levadura) y las heces. La eficiencia de absorción se calculó utilizando el método propuesto por Conover (1966) según la fórmula:
donde “Alimento” representa la proporción de materia orgánica y cenizas en el alimento, y “Heces” representa la proporción de materia orgánica y cenizas en las heces.
Captura y procesamiento de imágenes
Se obtuvieron imágenes de las células de levadura, el intestino de las postlarva y las heces usando un microscopio Nikon Optiphot equipado con una cámara Plumix modelo TMC-7. Las imágenes se digitalizaron utilizando una tarjeta de captura de imágenes (ATI All-in-Wonder). Las fotos digitalizadas se procesaron utilizando el software Scion Image 3.0b. La levadura se midió siguiendo las instrucciones incluidas con el programa.
Análisis estadístico
Los análisis estadísticos se realizaron con el software SPSS para Windows. Se utilizó el análisis de varianza de dos vías (ANOVA) con arreglo factorial para determinar si existían diferencias significativas (p < 0,05) entre las diferentes concentraciones de levadura (1,5 × 105, 3 × 105 y 5 × 105cel/mL) y la edad de los grupos de postlarvas. Se utilizaron múltiples rangos de la prueba de Tukey (p < 0,05) para identificar tratamientos que podrían ser significativamente diferentes.
RESULTADOS
Levaduras marinas fueron obtenidas del sedimento de una marisma de manglares localizada en los alrededores de una granja camaronera de la zona costera del sur de Ecuador. Bajo condiciones de laboratorio, las células de levadura se purificaron en aproximadamente 10 días. Las colonias de levadura fueron reconocidas por su color marfil y su morfología redondeada (Figura 3).
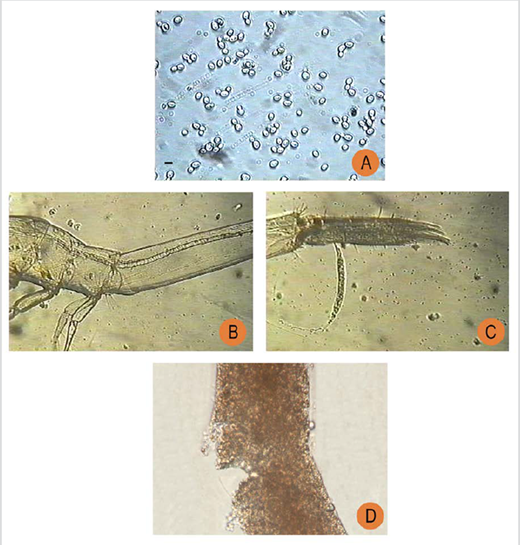
Figura 3 Microfotografías que muestran la absorción de levadura por las postlarvas de Litopenaeus vannamei durante los experimentos de alimentación. (A) Células de levadura; (B) el intestino de una postlarva de Litopenaeus vannamei llena de levadura; (C) la excreción de levadura; y (D) el producto o las heces (Fuente: colección de los autores).
Las células de levadura aisladas se propagaron utilizando melaza (subproducto de la caña de azúcar) como sustrato de crecimiento primario hasta que se alcanzó una fase de crecimiento exponencial, con una concentración superior a 70 × 106cel/mL. El tamaño medio de las levaduras fue de 3,56 µm con un contenido de materia orgánica de 0,87 ± 0,04 %.
Durante los ensayos, se observó una colonización microbiana en el intestino de las postlarvas, lo que demostró que la levadura había sido ingerida y se había adherido a la mucosa intestinal. Se observó que las células de levadura fueron destruidas por las postlarvas de camarón, lo que sugiere un proceso enzimático eficiente durante la digestión. Es importante destacar que no se observó canibalismo durante los experimentos de alimentación con levadura.
Después del período de alimentación de 24 h en cada tratamiento, se recolectó el material fecal que consistía en levaduras digeridas por las postlarvas. En total, se obtuvieron 180 muestras de materia fecal de postlarvas de L. vannamei para determinar el contenido de materia orgánica. La Figura 4 muestra la eficiencia de absorción para diferentes etapas de postlarvas y las tres concentraciones de levadura. En general, la eficiencia de absorción de levadura de las postlarvas de L. vannamei fue de 63,71 ± 2,56 %.
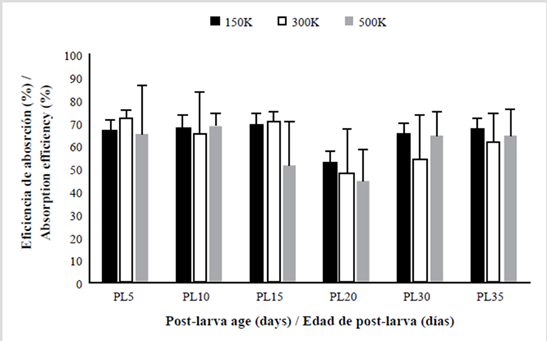
Figure 4 Eficiencia de absorción de levadura (% media ± DE) en seis etapas de vida de postlarvas de L. vannamei de camarón alimentadas con tres concentraciones de levadura marina. El eje X representa el porcentaje de eficiencia de absorción y el eje Y muestra la edad postlarva.
El análisis de varianza (p < 0,05) mostró que la eficiencia de absorción de la levadura en diferentes concentraciones no varió significativamente. De manera similar, los niveles de concentración de levadura y la edad de las postlarvas no tuvieron un efecto interactivo significativo sobre la eficiencia de absorción. La prueba ANOVA mostró que la eficiencia de absorción dependía de la edad de las postlarvas. El análisis estadístico (prueba de Tukey, p < 0,05) identificó dos grupos distintos. El primer grupo estuvo conformado por postlarvas de 5 días (67,85 ± 10,31 %), 10 días (67,22 ± 11,25 %) y 15 días (66,84 ± 9,05 %). El segundo grupo estuvo conformado por postlarvas de 20 días (55,29 ± 9,44 %), 30 días (63,7 ± 10,65 %) y 35 días (61,63 ± 11,43 %). Las postlarvas jóvenes (de 5 a 15 días) tuvieron una eficiencia de absorción promedio de 67,30 %, significativamente diferente al promedio de 60,21 % registrado para las postlarvas de mayor edad (de 20 a 35 días).
DISCUSIÓN
Las levaduras marinas son un componente esencial de la comunidad microbiana de los ambientes costeros, y contribuyen significativamente al equilibrio de los ecosistemas de manglares y a las dietas naturales de peces, crustáceos y moluscos. En los ecosistemas de manglar existen varias especies de levaduras de los géneros Candida, Devaryomyces, Saccharomyces y Schizosaccharomyces (Ahmed et al., 2019). Los peces que habitan en ecosistemas marinos absorben partículas y microorganismos, incluyendo bacterias, fitoplancton y levaduras, que se encuentran en suspensión o adheridas a sustratos (Wasielesky et al., 2006; Gatesoupe, 2007). Por lo tanto, las marismas de manglar que rodean las áreas de cultivo de camarón son una fuente vital de alimento vivo para las postlarvas de L. vannamei.
En el sur de Ecuador, la mayoría de los productores de camarón usan melaza, siguiendo diferentes protocolos para activar compuestos biológicamente activos que contienen levadura y otras cepas bacterianas como lactobacillus. Esta tendencia del uso de microrganismos en el cultivo del camarón se ha incrementado durante la última década. A la hora de producir levadura, los productores de camarón aprovechan la disponibilidad de melaza -un subproducto obtenido de la caña de azúcar en los países tropicales- como fuente de carbono (Martínez et al., 2015). El uso de microorganismos comerciales y sustancias añadidas al alimento exógeno en todas las fases del sistema de cultivo estimula el crecimiento de microorganismos benéficos e inhibe la colonización de bacterias patógenas (Villamil-Díaz y Martínez-Silva, 2009). En el presente estudio, no se identificó la especie de levadura extraída y utilizada para los experimentos; sin embargo, los ambientes ácidos, los niveles de saturación de glucosa y las condiciones totalmente aeróbicas que se emplearon son ideales para la masificación de Saccharomyces cerevisiae (Vieira et al., 2011).
Las postlarvas de 5, 10, 15, 20 y 35 días de edad demostraron un comportamiento eficiente en el manejo e ingestión durante la exposición a corto plazo de la alimentación con levadura. Este estudio demostró que las postlarvas de camarón son capaces de absorber componentes orgánicos de las células de levadura marina, lo que implica que todos sus constituyentes biológicos, como proteínas, ácidos orgánicos, carbohidratos y vitaminas, son incorporados por los camarones marinos. Cuando los camarones procesaron y asimilaron la materia orgánica de levaduras, la eficiencia de absorción permitió medir el componente orgánico del alimento asimilado. Si bien el método tiene algunas limitaciones, resultó práctico para experimentos de exposición a corto plazo con niveles constantes de levaduras para estimar la eficiencia de absorción. La medición de la eficiencia de absorción junto con la observación microscópica reveló las interacciones de las postlarvas de camarón y el papel de la levadura marina como componente alimenticio. En experimentos similares, Conover (1996) ha sugerido que la digestión de los alimentos en organismos acuáticos acarrea la producción de heces ricas en nutrientes que pueden volver a ser ingeridas como parte del comportamiento alimenticio de la especie. En el presente estudio, otras sustancias, como excrementos y mucosidades, pudieron estar presentes en el acuario experimental durante el período de alimentación a corto plazo. Por lo tanto, las postlarvas pudieron haber vuelto a ingerir materia orgánica, incluyendo levadura muerta o digerida.
En relación con la concentración de levadura, este estudio encontró que, en el rango analizado (1,5 × 105, 3 × 105 y 5 × 105cel/mL), la eficiencia de asimilación de la levadura no dependía de la concentración. Piña et al. (2005) evaluaron el desarrollo y crecimiento del estadio larvario zoea de L. vannamei alimentados con Chaetoceros muelleri, y encontraron que el porcentaje de ingestión no variaba con las raciones suministradas ni con la edad de las larvas de zoea, este oscilaba entre 74 % y 86 %. Sin embargo, llegaron a la conclusión de que la ingestión de alimento depende del suministro continuo de alimento. En el presente estudio, al alimentar con levadura a las postlarvas de L. vannamei, la intención fue simular la estrategia de alimentación utilizada en los criaderos comerciales, donde las larvas de camarón se alimentan con fitoplancton como Chaetoceros sp. o Thalassiosira sp. Los resultados sugieren que mantener una densidad de levadura mínima de 1,5 × 105 resultaría ventajoso para las postlarvas de camarón, incluso si las levaduras se proporcionan solo o como complemento de otros alimentos naturales o artificiales. Investigaciones adicionales sobre crustáceos afines indican que la eficiencia de asimilación de alimentos disminuye a medida que aumenta la concentración de alimentos. Por ejemplo, Evjemo (2000), al medir el contenido de carbono de los alimentos, demostró una disminución en la eficiencia de asimilación de varios estadios larvarios de Artemia franciscana cuando aumentaba la concentración de Isochrysis galvana. Antes de esto, Urabe (1991) registró una disminución en la eficiencia de asimilación de Bosmia longistris cuando aumentaban las concentraciones de Scenedesmus sp. y Chlorella sp. Utilizando dietas artificiales y diatomeas, Condrey et al. (1972) registraron un rango de eficiencia de absorción de alimentos del 55 al 87 % para Penaeus aztecus y P. setiferus.
Con respecto a la eficiencia de absorción y la edad de las postlarvas, los estadios postlarvarios tempranos de L. vannamei asimilaron la levadura marina de manera más eficiente que los estadios postlarvarios de mayor edad. La eficiencia de absorción de las postlarvas jóvenes de L. vannamei (de 5 a 15 días) fue aproximadamente 7 % mayor que en las etapas de mayor edad (de 20 a 35 días), y las postlarvas de 20 días de edad mostraron la menor eficiencia. Aunque se sugiere que 5,23 um es el tamaño mínimo para las postlarvas de camarón (Gelabert y Pacheco, 2011), el comportamiento del camarón blanco de alimentarse por filtración parece ser un mecanismo eficiente para la absorción de levaduras. Las etapas tempranas de postlarvas parecen ser más eficientes para digerir la levadura que las etapas posteriores de postlarvas. Esta disminución en la eficiencia de absorción de postlarvas de 20 a 35 días de edad podría atribuirse a un cambio en el comportamiento alimentario, lo que lleva a una menor ingesta de levadura durante las etapas posteriores.
Los resultados de eficiencia de absorción de levadura para las postlarvas de L. vannamei de 63,71 ± 2,56 % concuerdan con los resultados anteriores reportados para otras especies de crustáceos y peces. El uso de levadura como fuente de proteína para L. vannamei fue examinado por McLean et al. (2006), quienes registraron un desempeño de desarrollo exitoso. Zhenming et al. (2006) y Rumsey et al. (2009) encontraron que la digestión, por parte de peces, de proteínas unicelulares provenientes de levaduras marinas generalmente es superior a 80 %. En comparación con otros productos nutricionales, varios investigadores confirmaron que para L. vannamei la digestibilidad de la proteína de la harina de soja fluctúa aproximadamente entre 80 % y 98 % (Zhou et al., 2015; Fang et al., 2016). En otros estudios, Qui y Davis (2016) examinaron el uso de levadura seca instantánea como alimento complementario para L.vannamei, así como sus efectos sobre el crecimiento y la capacidad digestiva. Sus resultados demostraron que la aparente digestibilidad de la materia seca de la harina de soja, la harina de pescado y la levadura seca instantánea fluctuaba alrededor de 75 %, 68 % y 58 %, respectivamente. La digestibilidad de la proteína de la levadura seca instantánea fue significativamente menor que la de la harina de pescado y la de la harina de soja. Terrazas y Fierro (2010) también registraron que la digestibilidad por parte de L. vannamei de las proteínas de la harina de pescado osciló entre 62 % y 84 %. Así mismo, Brunson et al. (1997) indicaron que la digestibilidad de las proteínas de la harina de pescado, por parte de Penaeus setiferus, es de alrededor de 75 %. Athitahn y Ramadhas (2000) investigaron la eficiencia de conversión alimenticia del camarón blanco de la India, Fenneropenaeus indicus, alimentado con hojas de manglares descompuestas. Los investigadores observaron que los camarones consumían hojas descompuestas y encontraron una eficiencia de asimilación de 87,96 %, lo cual fue atribuido al alto contenido proteico de las hojas de manglar. Adicionalmente, se ha probado el valor nutricional de la levadura mediante células que han sufrido inactivación y disrupción celular, y se ha demostrado una eficiencia de alimentación favorable en peces y camarones. Por ejemplo, Shalmann et al. (2019) utilizaron Candida subtilis inactivada por calor e investigaron su uso como alimento complementario para los smolts de salmón del Atlántico. Sus resultados mostraron que los peces alimentados con una dieta basada exclusivamente en levadura tenían una tasa de crecimiento y una ingesta de alimento eficientes. En los sistemas de cultivo de camarón, comúnmente se agregan levaduras al alimento o se inocula biomasa de levadura en el sistema de cultivo. Rivera et al. (2018) extrajeron la levadura Saccharomyces cerevisiae del lodo de un estanque de camarones, y unieron las células de levadura a un portador. Sus resultados demostraron fortalecimiento del sistema inmunológico en L. vannamei jóvenes. Por su parte, Sarlin y Philip (2016) probaron el uso de levadura de biomasa en F. indicus y reportaron una mejora significativa en las tasas de crecimiento. Y descubrieron que Candida sake, C. utilitis y Debaryomysis hanseniistrains tuvieron los mejores resultados.
Los resultados del presente estudio apoyan el uso de levadura como parte de la dieta del camarón en estanques de cultivo, esencialmente su uso en criaderos y la etapa de vivero es prometedor. Las postlarvas de camarón ingieren y digieren levaduras cuando estos microorganismos están presentes en cantidades suficientes en la columna de agua. Aunque este estudio no confirma que las postlarvas puedan mantenerse exclusivamente con levadura por largos periodos de tiempo, sí demuestra que la levadura puede usarse como parte del alimento vivo que se les pone a disposición. Por ejemplo, Liao (1985) recomendó el uso de alimentos vivos para el envío y transporte conveniente y eficiente de postlarvas. Por tanto, la levadura viva se puede utilizar como alimento durante el transporte y la aclimatación de las postlarvas antes de colocarlas en el sistema de cría (Lavens et al., 2000). Adicionalmente, en sistemas con alta producción de materia orgánica, como los de cultivo de camarón en viveros, es necesario establecer un protocolo de alimentación microbiana para formar detrito orgánico de alto valor nutricional (Martínez et al., 2015). Si bien la levadura es una fuente de alimento viable para las primeras etapas del camarón, su uso para mejorar la digestión de alimentos exógenos también puede beneficiar la metabolización de los alimentos, aumentando la productividad y disminuyendo los efectos adversos en los ecosistemas costeros (Bender y Philips, 2004). Finalmente, la producción de levadura como parte de un método integrado asociando el cultivo de camarón y el bosque de manglar, puede ayudar a establecer estándares para las interacciones ecológicas y la sostenibilidad de la acuicultura costera en los países tropicales (Bush, 2013).
Si bien las conclusiones del presente estudio se limitaron a la eficiencia de digestión de las postlarvas de L. vannamei durante la asimilación orgánica de la levadura, este trabajo confirmó lo que se sabe en la actualidad sobre los beneficios de la levadura marina extraída de los ecosistemas de manglar. La asimilación de la levadura marina por las postlarvas del camarón, demostrada en este estudio, sugiere su uso como una posible alternativa alimenticia para mantener las primeras etapas de la vida del camarón, contribuyendo a su desarrollo y crecimiento. Es preciso realizar más estudios para comprender otras ventajas prácticas de las levaduras vivas y sus interacciones con el medio ambiente costero cuando se utilizan como parte de la dieta en las operaciones de acuicultura.
AGRADECIMIENTOS
Esta investigación fue apoyada por la Secretaría Nacional de Educación Superior, Ciencia y Tecnología de Ecuador, bajo el auspicio del proyecto de investigación PFN-190. Los autores expresan su agradecimiento al Dr. Oscar Chaparro Navarro, profesor de la Universidad Austral de Chile, por su apoyo y generosidad con su conocimiento, que benefició enormemente este trabajo de investigación. Así mismo, se reconoce y agradece a los técnicos y propietarios de los criaderos comerciales de camarón por el apoyo brindado durante la preparación del estudio.
REFERENCIAS
Ahmed, I., A. Haroon, M.N. Khan, H.S. Asadullah, H. Sahah, A. Nadeem, F. Saeed, S. Rehmat, U. Sahah, M. A. Abassi and M. A. Buzdar. 2019. Occurrence and biodiversity of marine yeast in mangrove ecosystem of Shabi Creek, Gwadar-Pakistan. Pure App. Biol., 8(1): 680-687. http://dx.doi.org/10.19045/bspab.2019.80008 [ Links ]
Athitahn, S. and V. Ramadhas. 2000. Bioconversion efficiency and growth in the white shrimp, Penaeus indicus (Milne Edwards) fed with decomposed mangroves leaves. ICLARM Quart., 23(1): 17-18. [ Links ]
Bender, J. and P. Phillips. 2004. Microbial mats for multiple applications in aquaculture and bioremediation. Biores. Technol., 94(3): 229-238. https://doi.org/10.1016/j.biortech.2003.12.016 [ Links ]
Breteler, W.K. 1975. Food consumption, growth and energy metabolism of juvenile shore crabs, Carcinus maenas. Netherl. J. Sea Res., 9(3-4): 255-272. https://doi.org/10.1016/0077-7579(75)90002-2 [ Links ]
Brunson, J. F., R.P. Romaire and R.C. Reigh. 1997. Apparent digestibility of selected ingredients in diets for white shrimp Penaeus setiferus L. Aquacult. Nutr., 3(1): 9-16. [ Links ]
Bush, S. R., B. Belton, D. Hall, P. Vandergeest, F. J. Murray, S. Ponte and P. Oosterveer. 2013. Certify Sustainable Aquaculture? Science, 341 (6150): 1067-1068. DOI: 10.1126/science.1237314 [ Links ]
Chi, Z., G. Liu, S. Zhao, J. Li and Y. Peng. 2010. Marine yeasts as biocontrol agents and producers of bio-products. Appl. Microbiol. Biotechnol., 86(5): 1227-1241. [ Links ]
Chi, Z ., T. Liu, Z. Chi, G. Liu and Z. Wang. 2012. Occurrence and diversity of yeasts in the mangrove ecosystems in Fujian, Guangdong and Hainan provinces of China. Ind. J. Microbiol., 52(3): 346-353. doi:10.1007/s12088-012-0251-5 [ Links ]
Condrey, R. E., J. G. Gosselink and H.J. Bennett. 1972. Comprison of the assimilation of different diets by Penaeus setiferus and Penaeus aztecus. Fish. Bull., 70: 1281-1291 [ Links ]
Conover, R. J. 1966. Factors affecting the assimilation of organic matter by zooplankton and the question of superfluous feeding. Limnol. Oceanogr., 11(3): 346-354. https://doi.org/10.4319/lo.1966.11.3.0346 DOI: 10.1007/s00253-010-2483-9. [ Links ]
Evjemo, J. O., O. Vadstein and Y. Olsen. 2000. Feeding and assimilation kinetics of Artemia franciscana fed Isochrysis galbana (clone T. Iso). Mar. Biol., 136(6): 1099-1109. https://doi.org/10.1007/s002270000306 [ Links ]
Fang, X., D. Yu, A. Buentello, P. Zeng and D. A. Davis. (2016). Evaluation of new non-genetically modified soybean varieties as ingredients in practical diets for Litopenaeus vannamei. Farzanfar A. 2006. The use of probiotics in aquaculture. FEMS Immunol. Med. Microbiol.. Blackwell Pub, 48(2): 149-58. https://doi.org/10.1111/j.1574-695X.2006.00116.x [ Links ]
Food and Agriculture Organization of the United Nations (FAO). 2019. FAO yearbook. Fish. Aquacult. Stat. 2017/FAO. Rome. 80 p. [ Links ]
Gatesoupe, F. J. 2007. Live yeasts in the gut: natural occurrence, dietary introduction, and their effects on fish health and development. Aquaculture, 267(1): 20-30. https://doi.org/10.1016/j.aquaculture.2007.01.005 [ Links ]
Gelabert, R. and A. Pacheco. 2011. Selectivity of particle size by the shrimp Litopenaeus vannamei (Boone, 1931) larvae. Aquacult. Nutr., 17(3): 244-247. [ Links ]
Kiatmetha, P., W. Siangdang, B. Bunnag, S. Senapin and B. Withyachumnarnkul. 2011. Enhancement of survival and metamorphosis rates of Penaeus monodon larvae by feeding with the diatom Thalassiosira weissflogii. Aquacult. Internat., 19(4): 599-609. https://doi.org/10.1007/s10499-010-9375-Y [ Links ]
Kupetz, M., S. Procopio, B. Sacher and T. Becker. 2015. Critical review of the methods of β-glucan analysis and its significance in the beer filtration process. Eur. Food Res. Technol, 241: 725. doi:10.1007/s00217-015-2498-7 [ Links ]
Lara-Flores, M., M. A. Olvera-Novoa, B. E. Guzmán-Méndez and W. López-Madrid. 2002. Use of the bacteria Streptococcus faecium and Lactobacillus acidophilus, and the yeast Saccharomyces cerevisiae as growth promoters in Nile tilapia (Oreochromis niloticus). Aquaculture, 216: 193-201. https://doi.org/10.1016/S0044-8486(02)00277-6 [ Links ]
Lavens, P. and P. Sorgeloos. 2000. Experiences on importance of diet for shrimp postlarval quality. Aquaculture, 191(1-3): 169-176. https://doi.org/10.1016/S0044-8486(00)00426-9 [ Links ]
Liao, I. 1985. A brief review of the larval rearing techniques of penaeid prawns. In First International Conference on the Culture of Penaeid Prawns/Shrimps, 4-7 December 1984, Iloilo City, Philippines. Aquaculture Department, Southeast Asian Fisheries Development Center. 65-78 p. [ Links ]
Liu, X. H., J. D. Ye , J. H. Kong, K. Wang and A. L. Wang. 2013. Apparent digestibility of 12 protein-origin ingredients for Pacific white shrimp Litopenaeus vannamei. NA J. Aquacult., 75(1): 90-98. [ Links ]
Lucas, A. and J. J. Watson. 2002. Bioenergetics of aquatic animals. CRC Press.169 p. [ Links ]
Martínez-Córdova, L. R., M. Emerenciano, A. Miranda-Baeza and M. Martínez-Porchas. 2015. Microbial-based systems for aquaculture of fish and shrimp: an updated review. Rev. Aquacult., 7: 131-148. doi:10.1111/raq.12058. [ Links ]
McLean, E., B. Reid, D. Fegan, D. Kuhn and S. Craig. 2006. Total replacement of fishmeal with an organically certified yeast-based protein in pacific white shrimp (Litopenaeus Vannamei) diets: laboratory and field trials. Croatian J. Fish., 64(2): 47-58. [ Links ]
Meena, D. K., P. Das, S. Kumar, S. C. Mandal, A. K. Prusty, S. K. Singh, M.S. Akhtar, B. K. Behera, K. Kumar, A.K. Pal and S. C. Mukherjee. 2013. Beta-glucan: An ideal immunostimulant in aquaculture (a review). Fish Physiol. Biochem., 39(3): 431-457. doi:10.1007/s10695-012-9710-5 [ Links ]
Muller-Feuga, A., R. Robert, C. Cahu, J. Robin and P. Divanach. 2003. Uses of microalgae in aquaculture. Live Feeds in Marine Aquaculture. 1: 253-299. [ Links ]
Northeastern Regional Aquaculture Center NRAC. 1993. Growing microalgae to feed bivalve larvae. Univ. Massachusetts. Norht Darmouth. NRAC Fact Sheet. No. 160. 8p. [ Links ]
Pathissery J. S. and P. Rosamma. 2016. Marine yeasts as feed supplement for Indian white prawn Fenneropenaeus indicus: screening and testing the efficacy. Int. J. Curr. Microbiol. App. Sci, 5(1): 55-70. doi:http://dx.doi.org/10.20546/ijcmas.2016.501.005 [ Links ]
Patra, S. and K. Mohamed. 2003. Enrichment of Artemia nauplii with the probiotic yeast Saccharomyces boulardii and its resistance against a pathogenic Vibrio. Aquacult. Internat., 11: 505. doi:10.1023/B:AQUI.0000004193.40039.54 [ Links ]
Piña, P., M. Nieves, L. Ramos-Brito, C.O. Chavira-Ortega and D. Voltolina. 2005. Survival, growth and feeding efficiency of Litopenaeus vannamei protozoea larvae fed different rations of the diatom Chaetoceros muelleri. Aquaculture, 249(1-4); 431-437. [ Links ]
Qiu, X. and D.A. Davis. 2017. Evaluation of flash dried yeast as a nutritional supplement in plant-based practical diets for Pacific white shrimp Litopenaeus vannamei. Aquacul. Nutr., 23(6): 1244-1253. [ Links ]
Rivera, L. M., L. E. Trujillo, J. M. Pais-Chanfrau, J. Nunez, J. Pineda, H. Romero, O. Tinoco, C. Cabrera and V. Dimitrov. 2018. Functional foods as stimulators of the immune sSystem of Litopenaeus vannamei cultivated in Machala, Province of El Oro, Ecuador. It. J. Food Sci., SI: 227-232. [ Links ]
Rosas, C. and C. Vanegas. 1993. Energy balance of Callinectes ratbunae in floating cages in a tropical coastal lagoon. J. World Aquacult. Soc., 21: 257-262 [ Links ]
Rumsey, G. L., S. G. Hughes, R. R. Smith, J. E. Kinsella and K. J. Shetty. 1991. Digestibility and energy values of intact, disrupted and extracts from brewer’s dried yeast fed to rainbow trout (Oncorhynchus mykiss). An. Feed Sci. Technol., 33(3): 185-193. doi:10.1016/0377-8401(91)90059-2 [ Links ]
Sahlmann, C., B. Djordjevic, L. Lagos, L. T. Mydland, B. Morales-Lange, J. Hansen, R. Anestad, L. Mercado, M. Bjalonovic, C. McLean and M. Øverland. 2019. Yeast as a protein source during smoltification of Atlantic salmon (Salmo salar), enhances performance and modulates health. Aquaculture, 513: 734396. https://doi.org/10.1016/j.aquaculture.2019.734396 [ Links ]
Sarlin, P. J. and R. Philip. 2016. Marine yeasts as feed supplement for Indian white prawn Fenneropenaeus indicus: screening and testing the efficacy. Int. J. Curr. Microbiol. App. Sci, 5(1): 55-70. doi: http://dx.doi.org/10.20546/ijcmas.2016.501.005 [ Links ]
Shelby, R. A., C. Lim, M. Yildirim-Aksoy, T. L. Welker and P. H. Klesius. 2009. Effects of yeast oligosaccharide diet supplements on growth and disease resistance in juvenile nile tilapia, Oreochromis niloticus. J. App. Aquacult., 21(1): 61-71. doi:10.1080/10454430802694728 [ Links ]
Sorgeloos, P., P. Dhert and P. Candreva. 2001. Use of the brine shrimp, Artemia spp., in marine fish larviculture. Aquaculture, 200(1): 147-159. https://doi.org/10.1016/S0044-8486(01)00698-6 [ Links ]
Sukumaran, V., D. W. Lowman, T. P. Sajeevan and R. Philip. 2010. Marine yeast glucans confer better protection than that of baker’s yeast in Penaeus monodon against white spot syndrome virus infection. Aquacult. Res., 41(12): 1799. doi:10.1111/j.1365-2109.2010.02520.x [ Links ]
Terrazas-Fierro, M., R. Civera-Cerecedo, L. Ibarra-Martínez, E. Goytortúa-Bores, M. Herrera-Andrade and A. Reyes-Becerra. 2010. Apparent digestibility of dry matter, protein, and essential amino acid in marine feedstuffs for juvenile whiteleg shrimp Litopenaeus vannamei. Aquaculture, 308(3-4): 166-173. [ Links ]
Urabe, J. 1991. Effect of food concentration on the carbon balance of Bosmina longirostris. Freshwat, Biol., 26: 57-68. [ Links ]
Vieira, É. D., M. D. G. S. Andrietta and S. R. Andrietta. 2013. Yeast biomass production: a new approach in glucose-limited feeding strategy. Braz. J. Microbiol., 44(2): 551-558. http://dx.doi.org/10.1590/S1517-83822013000200035 [ Links ]
Villamil-Díaz, L., and M. A. Martínez-Silva. 2009. Probiotics as a biotechnological tool in shrimp culture: a review. Bol. Invest. Mar- Cost., 38(2): 165-187. [ Links ]
Wasielesky, W., H. Atwood, A. Stokes and C. L. Browdy. 2006. Effect of natural production in a zero exchange suspended microbial floc based super-intensive culture system for white shrimp Litopenaeus vannamei. Aquaculture, 258(1): 396-403. doi:10.1016/j.aquaculture.2006.04.030 [ Links ]
Zhao, L., W. Wang, X. Huang, T. Guo, W. Wen, L. Feng and L. Wei. 2017. The effect of replacement of fish meal by yeast extract on the digestibility, growth and muscle composition of the shrimp Litopenaeus vannamei. Aquacult. Res., 48(1): 311-320. doi:10.1111/are.12883 [ Links ]
Zheng, C. N . and W. Wang. 2017. Effects of Lactobacillus pentosus on the growth performance, digestive enzyme and disease resistance of white shrimp, Litopenaeus vannamei (Boone, 1931). Aquac. Res., 48: 2767-2777. doi:10.1111/are.13110 [ Links ]
Zhenming, C., L. Zhiqiang, G. Lingmei, G. Fang, M. A. Chunling, W. Xianghong and L. I. Haifeng. 2006. Marine yeasts and their applications in mariculture. J. Oc. Univ. China, 5(3): 251-256. https://doi.org/10.1007/s11802-006-0010-5 [ Links ]
Zhou, Y. G., D. A. Davis and A. Buentello. 2015. Use of new soybean varieties in practical diets for the Pacific white shrimp, Litopenaeus vannamei. Aquacult. Nutr., 21(5): 635-643. [ Links ]
Recibido: 29 de Mayo de 2020; Aprobado: 17 de Junio de 2021











 text in
text in