Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 supl.1 Santa Marta Dec. 2021 Epub Dec 13, 2021
https://doi.org/10.25268/bimc.invemar.2021.50.suplesp.959
Artículos de Investigación
Lista anotada e ilustrada de los equinodermos recolectados durante las expediciones científicas colombianas a la Antártica (2016-2019)
1Instituto de Investigaciones Marinas y Costeras-Invemar, Museo de Historia Natural Marina de Colombia - MHNMC, El Rodadero, Santa Marta , Colombia. giomar.borrero@invemar.org.co
2Grupo de Ecologia Bêntica, Departamento de Oceanografia e Ecologia, Universidade Federal do Espírito Santo, Vitória, Brasil.
In order to contribute to the base line of knowledge that is being built of the Gerlache Strait and the adjacent areas, the echinoderms collected during the Scientific Expeditions from Colombia to Antarctica carried out between 2016 and 2019 as part of the project “Biodiversity and oceanographic conditions of the Gerlache Strait, Biogerlache-Antártica” are presented. Eleven stations between 54 and 523 m deep were sampled, using sediment dredgers that captured incidentally some individuals from the mega and macro-epifauna, which were separated, reviewed and identified. Twentynine (29) individuals were obtained in five of the sampled stations, belonging to 13 morphotypes. Ophiuroidea was the richest class (five morphotypes), followed by Holothuroidea (four), Asteroidea (two) and Crinoidea (two). Morphological and distribution comments are presented, as well as general and detailed images of each morphotype. Among the contributions to the inventory of echinoderms in the area, it is highlighted the sea cucumber genus Taeniogyrus Semper, 1867 that is registered for the first time for the Antarctic peninsula and the crinoid species Anthometrina adriani (Bell, 1908) that extends its geographical distribution, confined to the high-Antarctic shelf, up to the Gerlache Strait ( 64° 39S).
KEYWORDS: Crinoidea; Asteroidea; Ophiuroidea; Holothuroidea; Biogerlache project.
Con el objetivo de aportar a la línea base de conocimiento que se está construyendo del estrecho de Gerlache y las zonas adyacentes, se presentan los equinodermos recolectados durante las Expediciones Científicas de Colombia a la Antártica realizadas entre 2016 y 2019, en el marco del proyecto “Biodiversidad y condiciones oceanográficas del Estrecho de Gerlache, Biogerlache-Antártica”. Se muestrearon once estaciones entre 54 y 523 m de profundidad, utilizando dragas de sedimentos que capturaron de forma incidental algunos individuos de la mega y la macro-epifauna, los cuales fueron separados, revisados e identificados. Se obtuvieron 29 individuos en cinco de las estaciones muestreadas, pertenecientes a 13 morfotipos. Ophiuroidea fue la clase con mayor riqueza (cinco morfotipos), seguida por Holothuroidea (cuatro), Asteroidea (dos) y Crinoidea (dos). Se presentan comentarios morfológicos y de distribución, así como imágenes generales y detalles de cada morfotipo identificado. Entre los aportes al inventario de los equinodermos del área se destaca el género de pepino de mar Taeniogyrus Semper, 1867 que se registra por primera vez para la península Antártica y la especie de crinoideo Anthometrina adriani (Bell, 1908) que amplía su distribución geográfica, confinada a la plataforma antártica alta, hasta el estrecho de Gerlache (64° 39S).
PALABRAS CLAVE: Crinoidea; Asteroidea; Ophiuroidea; Holothuroidea; Proyecto Biogerlache.
INTRODUCCIÓN
El filo Echinodermata es el taxón de la megafauna dominante en las comunidades de fondos duros y blandos de la región Antártica y Subantártica en términos de abundancia, biomasa y diversidad (Moles et al., 2015). Así mismo, su variedad de hábitos tróficos hace que estos invertebrados desempeñen un papel importante en la transferencia de energía trófica y por lo tanto en la estructura de las comunidades en los sistemas bentónicos antárticos (McClintock, 1994; Moles et al., 2015). El océano Antártico es actualmente foco de muchas investigaciones en las cuales se ha mostrado que el cambio climático y las influencias antropogénicas han afectado el medio ambiente en esta región y por lo tanto estas alteraciones son relevantes para comprender la evolución y las estructuras biológicas actuales de la comunidad que allí habita y, por consiguiente, su conectividad con la biota fuera del Frente Polar (Vaughan et al., 2003; Barboza et al., 2011). Los equinodermos han sido un buen componente para estos estudios, dadas sus características evolutivas, su gran dispersión y su variedad de hábitos, siendo estudiados no solo en investigaciones de conectividad y endemismo, sino también de acidificación oceánica y redes tróficas (McClintock, 1994; Dahm, 1999; Barboza et al., 2011; Duquette et al., 2018). En cuanto a su diversidad, se sabe actualmente que alrededor de 10 % de las especies macrozoobentónicas conocidas en la Antártica son equinodermos (Moles et al., 2015). Se cuenta con inventarios de las clases Asteroidea (299 especies, Moreau et al., 2018), Ophiuroidea (126 especies, Stöhr et al., 2012), Echinoidea (201 especies, Fabri-Ruiz et al., 2017) y Holothuroidea (187 especies, O’Loughlin et al., 2011). La clase Crinoidea aunque está bien representada (Eléaume et al., 2014) no cuenta con un inventario de especies compilado. Específicamente alrededor de la península Antártica, los estudios se han centrado principalmente en las islas Shetland del Sur y el mar de Weddell (Gutt and Piepenburg, 1991; Massin 1992; Piepenburg et al., 1997; Martínez et al., 2015; Moles et al., 2015;), y en muchos estudios la información se registra de forma general para la península sin detallar localidades. Pocos trabajos incluyen de manera específica información sobre el archipiélago Palmer o la isla Trinidad que forman el estrecho de Gerlache (Greig, 1929; Manjón-Cabeza et al., 2001; Manjón-Cabeza y Ramos, 2003). Teniendo en cuenta la diversidad y la importancia ecológica de los equinodermos en las comunidades antárticas y sub-antárticas, así como la poca información específica para el estrecho de Gerlache y las islas adyacentes, el presente trabajo hace un aporte al inventario de los equinodermos presentes en esta área de la península Antártica, ampliando el conocimiento de las especies especialmente en cuanto a su distribución geográfica y batimétrica. Se aprovechan muestras recolectadas de forma incidental con el fin de aportar a la línea base que se está construyendo para generar nuevos aportes a los inventarios y a la información biológica del estrecho de Gerlache, con el fin de definir posibles áreas de conservación en esta región. Estos resultados hacen parte del proyecto “Biodiversidad y Condiciones Oceanográficas del Estrecho de Gerlache, Biogerlache-Antártica”, que está incluido en la agenda científica Antártica del Instituto de Investigaciones Marinas y Costeras - Invemar, que inició en 2014 con tres frentes de trabajo enfocados a cambio climático, conservación y biodiversidad.
MATERIALES Y METODOS
Área de estudio
El estrecho de Gerlache, se encuentra ubicado al oeste de la península Antártica, separando ésta del archipiélago Palmer, extendiéndose en dirección suroeste a noreste incluyendo la isla Trinidad, posee una profundidad entre los 270 y 1100 m, con pendientes de 20° (Figura 1) (Anderson, 1999). Este, junto con el estrecho de Bransfield (Figura 1), de 220 km de largo y 120 km de ancho entre la península Antártica y las numerosas islas que conforman el archipiélago islas Shetland del Sur, constituyen sitios de interés para la comunidad científica; dado que ofrecen la oportunidad de estudiar la composición, estructura y dinámica de varias comunidades marinas, especialmente de la fauna bentónica (Secretariat of the Antarctic Treaty, 2009).
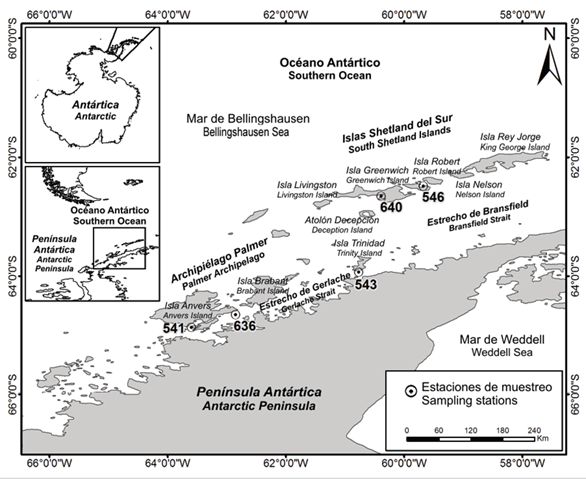
Figura 1 Área de estudio presentando la ubicación de las estaciones en las que se recolectaron equinodermos durante las expediciones científicas colombianas a la Antártica: III Expedición Almirante Padilla (2016- 2017) -Estaciones 541, 543 y 546 y V Expedición Almirante Campos (2018-2019) - Estaciones 636 y 640.
Recolección de muestras
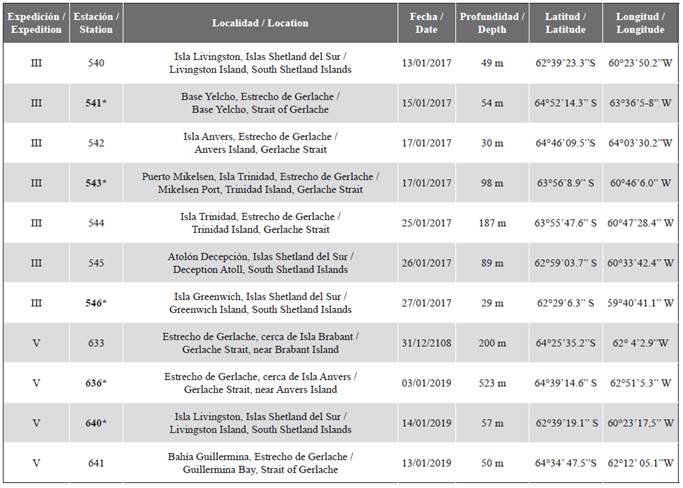
Durante las expediciones científicas colombianas a la Antártica realizadas entre 2016 y 2019 (III - Expedición Almirante Padilla y V - Expedición Almirante Campos) se muestrearon 11 estaciones con el fin de caracterizar la comunidad bentónica de fondos blandos (Tabla 1). Los muestreos se hicieron utilizando muestreadores de sedimentos: una draga Shipek (0,04 m2) durante la III Expedición y una draga Van Veen (0,066 m2) durante la V Expedición. Una vez lanzadas y recuperadas las dragas, antes de tamizar y preservar el sedimento, la mega-epifauna y el material de la capa superior del dragado fue separado manualmente (restos vegetales, rocas pequeñas, entre otros), con el fin de aprovechar estas recolectas incidentales. La mega-epifauna fue anestesiada en una solución de agua de mar filtrada con cloruro de magnesio a 10 % en oscuridad y posteriormente fijada y preservada en etanolal 96 %. El material de la capa superior fue preservado directamente en etanol al 96 %.
Tabla 1 Estaciones muestreadas durante las expediciones científicas colombianas a la Antártica: III Expedición Almirante Padilla (2016-2017) y V Expedición Almirante Campos (2018-2019). En las estaciones indicadas en negrita y con asterisco se recolectaron equinodermos.
Los ejemplares y las muestras fueron almacenados en bolsas o recipientes rotulados y transportados al Invemar. En el laboratorio los equinodermos mega-epifaunales se revisaron y se separaron por morfotipos. Así mismo, la macro-epifauna presente en el material de la capa superior de los sedimentos se revisó utilizando estereoscopios y se separaron los ejemplares observados organizándolos por morfotipos. Todos los morfotipos encontrados se identificaron y se les realizó el registro fotográfico de acuerdo a las características morfológicas de interés de cada uno. Para la identificación taxonómica se utilizaron las siguientes referencias para cada clase: Crinoidea: Messing (2019, 2020a, 2020b, 2020c, 2020d), Antarctic Underwater Field Guide (2019); Asteroidea: Clark y Downey (1992), Janosik y Halanych (2010), Peck et al. (2018); Ophiuroidea: Bell (1902), Koehler (1912), Matsumoto (1915, 1917), Mortensen (1927, 1936), Fell (1960), A.M. Clark (1970);y Holothuroidea: Miller y Pawson (1984), O’Loughlin y VandenSpiegel (2010), O’Loughlin et al. (2010, 2015), Thandar (2013), Martínez (2014) and Moura et al. (2015). Los ejemplares recolectados fueron depositados en la colección de equinodermos del Museo de Historia Natural Marina de Colombia (MHNMC) del Invemar (INV EQU) enriqueciendo las colecciones biológicas y generando la posibilidad de participar en trabajos taxonómicos comparativos.
RESULTADOS
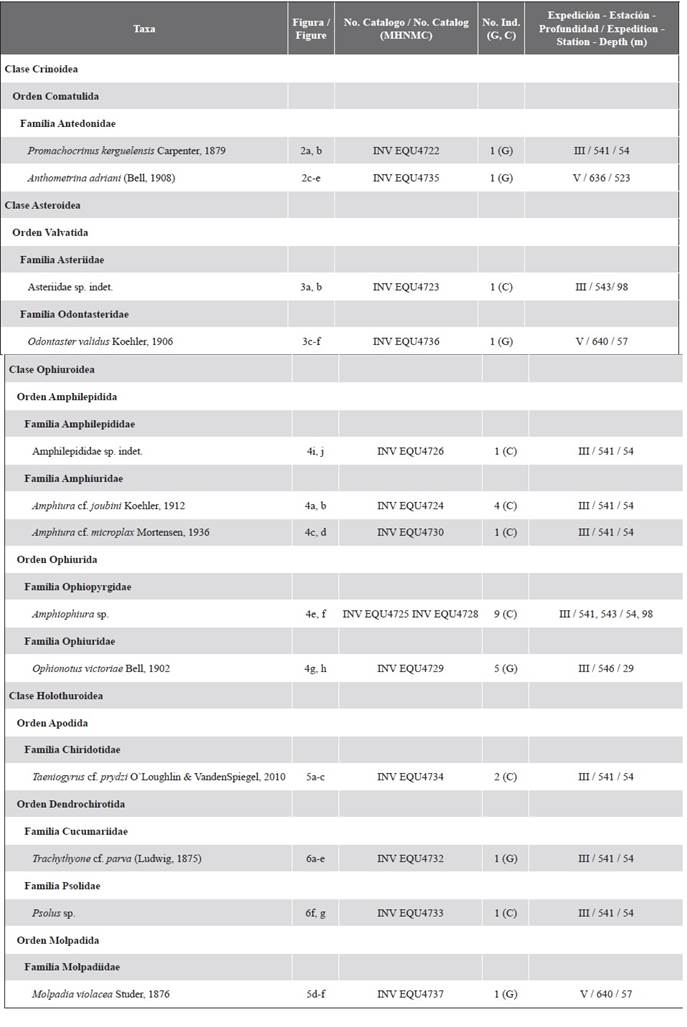
De las once estaciones muestreadas solo se encontraron equinodermos en cinco de ellas (Figura 1, Tabla 1), recolectando un total de 29 individuos los cuales se identificaron en 13 morfotipos que pertenecieron a las clases Ophiuroidea (cinco morfotipos), Holothuroidea (cuatro), Asteroidea (dos) y Crinoidea (dos) (Tabla 2). En la estación 541, ubicada en la Base Yelcho en el estrecho de Gerlache, se encontró la mayor cantidad de morfotipos (nueve en total), en las otras estaciones del estrecho se encontraron dos morfotipos en la 543 (isla Trinidad) y uno en la 636 (isla Anvers) (Figura 1, Tabla 2). En las estaciones muestreadas en las islas Shetland del Sur se recolectaron tres morfotipos, dos en la estación 640 (isla Livingston) y uno en la 546 (isla Greenwich) (Figura 1, Tabla 2). Seis de los morfotipos identificados son organismos de la mega-epifauna que fueron separados directamente en campo, los siete morfotipos restantes se encontraron después de hacer la revisión con estereoscopios del material de la capa superior de los dragados (Tabla 2). A continuación se describen las principales características morfológicas, así como la distribución geográfica y batimétrica de las especies recolectadas y algunos comentarios.
Tabla 2 Listado de los equinodermos recolectados. Expediciones: III - Expedición Almirante Padilla (2016-2017); V - Expedición Almirante Campos (2018-2019); Estaciones: 541, 543 y 636 Estrecho de Gerlache; 546 y 640 Islas Shetland del Sur (Figura 1, Tabla 1); G-Mega-epifauna; C-Macro-epifauna.
Clase Crinoidea
Se recolectaron dos individuos identificados como Promachocrinus kerguelensis Carpenter, 1879 y Anthometrina adriani (Bell, 1908) (Figura 2, Tabla 2). Promachocrinus kerguelensis se recolectó en el estrecho de Gerlache a 54 m de profundidad. Se caracteriza por presentar 20 brazos que surgen a partir de diez osículos radiales (Figura 2a, b). Su distribución es circumpolar entre 65 y 1162 m de profundidad y es una especie común en la península Antártica, registrada en las islas Shetland del Sur (Hemery et al., 2012; Eléaume et al., 2014). Se considera la especie de crinoideo más abundante y la más variable morfológicamente en el océano Austral (Hemery et al., 2013). Actualmente es la única especie aceptada en el género, varias especies descritas previamente se han sinonimizado (Messing, 2019, 2020a, 2020b). Sin embargo, con base en datos moleculares (ADN mitocondrial) se han encontrado siete linajes simpátricos en la Antártica (Hemery et al., 2012; Eléaume et al., 2014).

Figura 2 Clase Crinoidea. Promachocrinus kerguelensis a. Vista oral y b. Vista lateral; Anthometrina adriani c. Vista general y d. - e. Detalle de los brazos, el centrodorsal y los cirros.
Anthometrina adriani también se recolectó en el estrecho de Gerlache a 523 m de profundidad. Se caracteriza por presentar 10 brazos que surgen a partir de cinco osículos radiales, segmentos distales de las pínulas orales con una estructura en forma de peine, centro dorsal cónico con numerosos cirros que lo cubren en su mayor parte, y tubérculos “sinartriales” bien desarrollados (Figura 2d-e) (Messing, 2019, 2020d). Al igual que P. kerguelensis, es una especie circumpolar, aunque se encuentra en la península Antártica sus poblaciones en esta área presentan pocos individuos en comparación con las de la Antártica oriental (Eléaume et al., 2014). Además, es una especie confinada a la plataforma antártica alta (aproximadamente por encima de 67 °S), que no se ha registrado en las islas Shetland del Sur, en el arco de Escocia, ni en las islas subantárticas (Eléaume et al., 2014), por lo que este registro extiende su distribución geográfica hasta 64° 39’ S.
Clase Asteroidea
Se recolectaron dos individuos, uno se identificó como Odontaster validus Koehler, 1906 y el otro se identificó hasta el nivel taxonómico de familia (Asteriidae) (Figura 3, Tabla 2). El ejemplar identificado enla familia Asteriidae se recolectó en Puerto Mikelsen (isla Trinidad, estrecho de Gerlache) a 98 m de profundidad. Podría ser un juvenil considerando su talla (R=4 mm), sin embargo, la distribución de las espinas del área abactinal, en dos hileras laterales y una central (Figura 3a, b) es una característica con base en la cual podría hacerse una identificación hasta un nivel taxonómico más bajo. Asteriidae es una de las familias más diversas en la Antártica, en algunos trabajos se ha registrado con el mayor número de especies, superior a Astropectinidae y Goniasteridae (Majón-Cabeza et al., 2001).

Figura 3 Clase Asteroidea. Asteriidae sp. a. Vista dorsal y b.Vista ventral; Odontaster validus c. Vista dorsal, d. Vista ventral, e. Detalle de las paxilas, f. Detalle de las áreas interradiales.
Odontaster validus se recolectó en la isla Livingston (islas Shetland del Sur) a 57 m de profundidad. Esta estrella se caracteriza por presentar las paxilas del área abactinal radial con aproximadamente 12 espinas pequeñas, lisas, delgadas y cónicas (Figura 3e), placas marginales cubiertas por espinas, no gránulos (Figura 3c), placas actinales cubiertas por hasta siete espinas pequeñas delgadas, y dos o tres espinas del surco (Figura 3d, f). Janosik y Halanych (2010) describieron dos especies estrechamente relacionadas O. roseus y O. pearsei las cuales se han confirmado utilizando códigos de barras del ADN; sin embargo, Peck et al. (2018) han registrado una alta variabilidad en algunas de las características morfológicas que distinguen a las tres especies. Odontaster validus es la especie de estrella de mar más común y abundante en los ambientes poco profundos del continente antártico (Dearborn, 1977; Neill et al., 2016), su distribución es circumpolar, incluyendo la isla Georgia del Sur y la isla Bouvet (Janosik y Halanych, 2010). Moles et al.(2015) la registran en el atolón Decepción (islas Shetland del Sur) y en el mar de Weddell.
Clase Ophiuroidea
Se recolectaron 20 ejemplares de esta clase que pertenecieron a cinco morfotipos, uno de ellos se identificó hasta familia (Amphilepididae), otro hasta género (Amphiophiura) y los demás se identificaron hasta especie: Ophionotus victoriaeBell, 1902, Amphiura cf. joubiniKoehler, 1912 y Amphiura cf. microplaxMortensen, 1936, aunque dos de ellos están por confirmar (Figura 4, Tabla 2). Ophionotus victoriae se recolectó en la isla Greenwich (islas Shetland del sur) a 29 m de profundidad; los otros cuatro morfotipos se recolectaron en la Base Yelcho en el estrecho de Gerlache a 54 m de profundidad. Entre ellos Amphiophiura sp. fue el único morfotipo que se encontró en más de una estación, en Puerto Mikelsen-Isla Trinidad, también en el Estrecho a 98 m; además es el morfotipo con el mayor número de individuos en los muestreos.
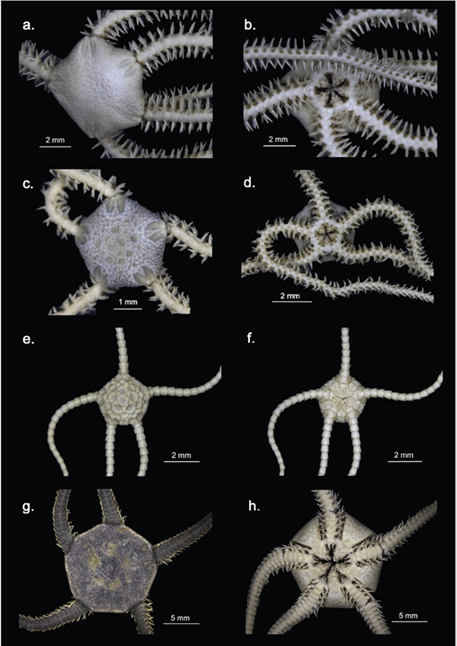
Figura 4 Clase Ophiuroidea. Amphiura cf. joubini a. Vista dorsal y b. Vista ventral; Amphiura cf. microplax c. Vista dorsal y d. Vista ventral; Amphiophiura sp. e. Vista dorsal y f. Vista ventral; Ophionotus victoriae g. Vista dorsal y h. Vista ventral; Amphilepididae i. Vista dorsal y j. Vista ventral.
Amphiura joubini (Figura 4a, b) se caracteriza por presentar un disco cubierto de escamas pequeñas y finas, siendo más pequeñas en la superficie ventral; escudos radiales alargados y estrechos (cuatro veces más largos que anchos); escudos orales pequeños, triangulares, tan largos como anchos; papilas orales proximales gruesas en forma de bloque y papilas orales distales espiniformes; escama bucal grande; placas braquiales dorsales grandes y pentagonales, más anchas que altas; seis espinas braquiales y dos escamas tentaculares pequeñas, de las cuales, la externa es más grande. Los ejemplares recolectados concuerdan con todas las características mencionadas, sin embargo, poseen cuatro espinas braquiales y toda la superficie ventral del disco está cubierta por escamas pequeñas (Figura 4a, b), lo que difiere con la diagnosis y con algunas descripciones de esta especie donde se menciona que la zona cerca al escudo oral es “parcialmente desnuda” (Koehler, 1912; Brogger y O’Hara, 2015). Amphiura joubini es una especie común en la Antártica, siendo registrada en grava y arena de 15 a 2345 m de profundidad en la península Antártica, mar Bellingshausen y el mar de Weddell e islas adyacentes (Koehler, 1912; Moles et al., 2015). Frecuentemente es confundida con A. princeps Koehler, 1907 debido a su gran similitud morfológica; sin embargo, esta última presenta papilas orales distales redondeadas (Brogger y O’Hara, 2015) y parece tener una distribución batimétrica más somera en el hemisferio sur (Alitto et al., 2018). No obstante, Brogger y O’Hara (2015) enfatizan en la necesidad de revisar los registros de estas especies a fin de establecer correctamente sus distribuciones geográficas y batimétricas.
Amphiura microplax (Figura 4c, d) se caracteriza por presentar un disco pentagonal cubierto de escamas medianas, entre las que se destacan las seis placas primarias (roseta); escudos radiales cortos, separados en su parte proximal; superficie ventral del disco cubierto de escamas pequeñas; escudos orales pentagonales; escudos adorales triangulares y grandes, tocándose en su extremo proximal; placas braquiales ventrales cuadradas; placas braquiales dorsales romboidales; cinco espinas braquiales cortas y cónicas en los segmentos basales y una escama tentacular pequeña, el tamaño de esta escama diferencia a A. microplax de las demás especies del género con una sola escama tentacular que están registradas para aguas Antárticas (Mortensen, 1936). Los ejemplares recolectados concuerdan con esta diagnosis; sin embargo, al no contar con fotografías y bibliografía suficiente para comparar, aún no se ha confirmado su identificación (Figura 4c, d). Esta especie es vivípara y partenogénica (Mortensen, 1936), siendo registrada en la península Antártica, el mar de Weddell, la planicie Enderby, las islas Georgias del Sur, las islas Orkney del Sur, islas Shetland del Sur y las islas Sandwich del Sur, entre 96 y 486 m de profundidad (Dahm, 1999; Moles et al., 2015). Una vez confirmada esta identificación, el presente registro correspondería al más somero de A. microplax (54 m).
Las especies del género Amphiophiura se caracterizan por presentar un disco abultado, cubierto de escamas y placas, entre las cuales, las primarias son muy prominentes, al igual que los escudos radiales; peines de los brazos y papilas genitales presentes; segundo poro tentacular por fuera de la hendidura oral y bordeado por varias escamas tentaculares; brazos no muy largos y con terminación roma; placas braquiales dorsales y ventrales bien desarrolladas; placas braquiales laterales altas, con espinas cortas y poros tentaculares grandes con numerosas escamas (Matsumoto, 1915). Los ejemplares recolectados presentan los caracteres diagnósticos del género y corresponden a un mismo morfotipo aún sin determinar hasta el nivel taxonómico de especie; por lo cual, se presenta como Amphiophiura sp. (Figura 4e, f). Este género contiene especies carroñeras y depredadoras (Frensen et al., 2010), de las cuales, hay cuatro registradas para aguas antárticas a profundidades entre 66 y 4773 m (Frensen et al., 2010; Moles et al., 2015).
Ophionotus victoriae (Figura 4g, h) se caracteriza por presentar un disco cubierto por varias escamas pequeñas y finas; cinco brazos; segundo poro tentacular por fuera de la cavidad oral y bordeado por varias escamas tentaculares; placas braquiales laterales pequeñas, placas braquiales dorsales fragmentadas en una placa central con tres a cuatro placas pequeñas a los lados y papilas genitales a lo largo de las hendiduras genitales, las cuales alcanzan el borde del disco (Bell, 1902; Koehler, 1912) (Figura 4g, h). Ophionotus victoriae es circumpolar y posiblemente el ofiuroideo más abundante y común en el bentos antártico, contando con una amplia distribución en la parte alta de la Antártica, en las islas Shetland del Sur, las islas Georgiasdel Sur, islas Orkney del Sur, islas Sandwich del Sur, la península Antártica, el estrecho de Gerlache, el mar de Ross, el mar de Wedell, el mar de Amundsen, isla Bouvet y en la planicie Enderby (Dahm, 1999; Moya et al., 2003; Moles et al., 2015). Habita una variedad de sustratos, siendo encontrada en fondos blandos (lodo y grava) y fondos rocosos; entre 0 y 1704 m de profundidad (Grange et al., 2004; Moles et al., 2015). Su dieta es muy variada, ya que, al ser oportunista, se alimenta de gran variedad de invertebrados como esponjas, poliquetos, bivalvos, copépodos, diatomeas, asteroideos, entre otros; también es carroñero y caníbal de juveniles de su misma especie (Fratt y Dearborn, 1984; Dahm, 1996; Grange et al., 2004); incluso, si es necesario, consume material orgánico particulado depositado sobre el fondo como la materia fecal, incluyendo sus propios desechos. Esta plasticidad en la estrategia alimentaria le ha proporcionado ciertas ventajas como el crecimiento acelerado en los primeros años (Dahm, 1996).
Los familia Amphilepididae se caracteriza por presentar un disco cubierto de escamas intercaladas, entre las cuales, las primarias son muy evidentes; los escudos radiales a diferencia de su grupo hermano la familia Amphiuridae, son amplios y bien desarrollados; presenta papilas orales triangulares, las papilas infradentales no están dispuestas en bloque y presenta una papila apical, además, el segundo poro tentacular se encuentra fuera de la cavidad oral (Matsumoto, 1915, 1917; Mortensen, 1927). El ejemplar recolectado presenta los caracteres diagnósticos de la familia (Figura 4i, j); sin embargo, debido a la dificultad taxonómica de las especies dentro de la superfamilia Amphiuroidea aún no se llegado a una categoría taxonómica más baja. Desde que Matsumoto (1915) erigió la familia Amphilepididae basándose en caracteres de la mandíbula para diferenciarla de la familia Amphiuridae, ha presentado numerosos cambios taxonómicos a lo largo de la historia, lo que ha dificultado la correcta identificación de los géneros y especies que la componen (Koehler, 1922; A.M. Clark, 1970). Incluso, debido a su gran similitud con ejemplares de los géneros Histampica, Amphiura y Amphioplus, algunos autores como A.M. Clark (1970) han propuesto tratar a Amphilepididae como una subfamilia de Amphiuridae. Sin embargo, actualmente Amphilepididae se considerauna familia válida con dos géneros aceptados: Amphilepis Ljungman, 1867 y Ophiomonas Djakonov, 1952 (Stöhr et al., 2018), distribuyéndose principalmente en el hemisferio norte, pero con algunos registros en el hemisferio sur, incluyendo América del Sur, Madagascar y la Antártica (Mills y O’Hara, 2010). El individuo recolectado presenta el disco pentagonal cubierto por escamas; escudos radiales abultados y triangulares; escudos orales triangulares; dos papilas orales en cada lado de la mandíbula, la proximal es triangular y presenta también una papila apical o diente ventral; brazos delgados, insertados ventralmente al disco; poros tentaculares grandes, el segundo poro tentacular se encuentra por fuera de la boca y está provisto de una escama tentacular grande, los siguientes poros tentaculares no presentan escamas (Figura 4i, j).
Clase Holothuroidea
Se recolectaron cuatro ejemplares de esta clase los cuales se identificaron como Taeniogyrus cf. prydziO`Loughlin y VandenSpiegel, 2010, Trachythyone cf. parva (Ludwig, 1875), Psolus sp. y Molpadia violacea Studer, 1876 (Figura 5, 6, Tabla 2). Molpadia violacea se recolectó en la isla Livingston (islas Shetland del Sur) a 29 m de profundidad; los otros tres morfotipos se recolectaron en la Base Yelcho en el estrecho de Gerlache a 54 m de profundidad.
Moura et al. (2015) describieron la nueva especie Taeniogyrus yvonnae Moura, Campos y Esteves, 2015,; como parte de ese trabajo presentaron una revisión del género, el cual se distribuye principalmente en el Indo-Pacífico, con algunas especies en la Antártica, el Mediterráneo y el Atlántico. El género incluye 24 especies, de las cuales dos se distribuyen en la Antártica: T. prydziO’Loughlin y VandenSpiegel, 2010 y T. antarticus Heding, 1931. Otras dos especies distribuidas en la Antártica, según O’Loughlin et al. (2010), actualmente son aceptadas como especies del género Sigmodonta Studer, 1876 (WoRMS, 2020). Los ejemplares recolectados en el estrecho de Gerlache a 54 m de profundidad coinciden con T. prydzi en la longitud del cuerpo (máximo 50 mm) (Figura 5a) y en el tamaño de los ganchos sigmoideos (232-272 µm) y las ruedas (90 µm) (Figura 5c), sin embargo, presentan de tres a cuatro pares de dígitos en los tentáculos, difiriendo de T. prydzi que presenta seis pares (Figura 5b). Taeniogyrus prydzi se distribuye en la Antártica oriental en la plataforma MacRobertson entre 109 y 830 m de profundidad, por lo que este sería el primer registro de la especie para la Antártica occidental y específicamente para la península Antártica. Para el género este registro es el primero en la península considerando que T. antarticus Heding, 1931 se distribuye en las islas Georgias del Sur, el mar de Scotia, las islas Orkney del Sur y en las islas Aurora (Moura et al., 2015). Además, la profundidad a la que fueron recolectados los ejemplares incrementaría el intervalo de distribución batimétrica de la especie de 109 m de profundidad, registrado por Moura et al. (2015) hasta 54 m.
Molpadia violacea era considerada sinónimo de M. musculus Risso, 1826, la cual es una especie de distribución cosmopolita, que incluía la Antártica, y con un amplio intervalo batimétrico de 35 a 5205 m (Pawson, 1977; O’Loughlin et al., 2010). Sin embargo, O’Loughlin et al. (2015) establecieron nuevamente a M. violacea como una especie válida para referirse a los ejemplares del género Molpadia de la Antártica previamente referidos a M. musculus. Esta decisión se basó en evidencias moleculares presentadas por O’Loughlin et al. (2010) y a características morfológicas que incluyen el color del cuerpo, con los extremos oral y caudal blanquecino (Figura 5d), la ausencia de espiras en los barrotes fusiformes de la región caudal (Figura 5f) y la presencia de cuerpos fosfáticos en la pared del cuerpo (Figura 5e, f). En el ejemplar recolectado se observan muy pocos osículos en la parte media del cuerpo, coincidiendo con lo descrito por O’Loughlin et al. (2015) sobre la fosfatación y desaparición de los osículos en esta especie. Molpadia violacea se distribuye entre 112 y 628 m de profundidad en el océano del Sur y en la Antártica donde se ha registrado en la bahía Prydz, el mar de Ross, cerca de la isla Orkney del Sur y en las islas Shetland del Sur (O’Loughlin et al., 2015), en donde se recolectó el ejemplar que se registra en este trabajo. El presente es uno de los pocos registros de la especie después de haber sido separada de M. musculus y además amplía su distribución batimétrica de 112 m de profundidad hasta 57 m.
Trachythyone parva se caracteriza por presentar el cuerpo en forma de U, pies ambulacrales restringidos a los ambulacros aunque pueden estar presentes en los inter ambulacros al menos en la parte dorsal (Figura 6a-c); pared corporal con osículos en forma de canastas desarrolladas como cuencos curvos, borde con proyecciones espinosas cortas (Figura 6d); cruces presentes, a veces excluyendo las canastas (Figura 6d); placas pequeñas (hasta 1,5 mm), lisas, con numerosos agujeros pequeños en series usualmente dobles (Thandar, 2013; Martínez, 2014). Aunque la mayoría de estas características se han encontrado en el ejemplar recolectado, se observan diferencias en las placas, en las cuales los agujeros se distribuyen de forma irregular (Figura 6d). Además, las placas presentan proyecciones en los extremos, las cuales no se mencionan en la diagnosis de T. parva. O’Loughlin et al. (2010) listan nueve especies del género Trachythyone en la Antártica, dos de ellas encontradas en ese trabajo y aun no descritas, una de ellas “Trachythyone species 1” se distribuye en las islas Shetland del Sur, cerca al estrecho de Gerlache donde fue recolectado el ejemplar que se describe en este trabajo. Sin embargo, si la especie fuera confirmada como T. parva, este sería el primer registro para la península Antártica, los registros anteriores son de Tierra del Fuego, islas Malvinas hasta 38ºS (Martínez, 2014), el mar de Weddell y otras localidades de la Antártida oriental (GBIF, 2020).
El ejemplar identificado como Psolus sp. tiene una longitud de 2 mm, por lo que podría ser un juvenil (Figura 6f, g), la revisión de características morfológicas como la forma de las espículas, necesarias para identificar la especie, implicaría su destrucción. De acuerdo con O’Loughlin et al. (2010) existen 21 especies del género Psolus en la Antártica. Se necesitan más ejemplares para revisar su morfología con más detalle y hacer una identificación más precisa.
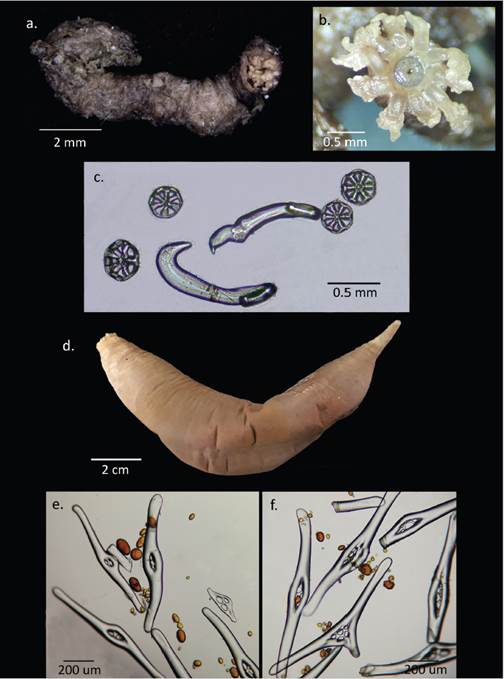
Figura 5 Clase Holothuroidea. Taeniogyrus cf. prydzi. a. Vista general (Individuo 1), b. Detalle de la boca y los tentáculos (Individuo 2), c. Osículos de la pared corporal en forma de ganchos sigmoideos y ruedas; Molpadia violacea d. Vista general, e. Osículos de la pared corporal anterior, f. Osículos de la pared corporal posterior, en las dos imágenes se observan cuerpos fosfáticos
DISCUSIÓN
Los estudios e inventarios sobre los equinodermos de la Antártica han mostrado a este grupo como uno de los más diversos en las comunidades de fondos someros y profundos de esta región (O’Loughlin et al., 2010; Stöhr et al., 2012; Eléaume et al., 2014; Martín-Ledo y López-González, 2014; Fabri-Ruiz et al., 2017; Moreau et al., 2018). En el caso de los pepinos de mar, O’Loughlin et al. (2010) propusieron la región Antártica como un “hotspot” de biodiversidad para la clase Holothuroidea, las cifras que presentan equivalen a 4 % de la diversidad marina documentada en la Antártica y 10 % de la diversidad de la clase Holothuroidea en el mundo. Asimismo, la clase Asteroidea en la región Antártica y Sub-Antártica está bien representada, con 12 % de la riqueza total de especies de los grupos bénticos en esta área (Moreau et al., 2018).
El número de morfotipos identificados, 13 en total, con base en 29 ejemplares recolectados en cinco estaciones confirma la alta riqueza de este grupo en la Antártica; sin embargo, este es un número bajo de especies en comparación con otros trabajos que incluyen información de áreas cercanas al estrecho de Gerlache, como las islas Shetland del Sur, e incluso si se tiene en cuenta que no se recolectaron equinodermos en seis de las once estaciones muestreadas y no se encontraron representantes de la clase Echinoidea. Este resultado se debe a que los muestreos realizados estaban dirigidos a caracterizar la macrofauna bentónica y no la mega y la macro-epifauna. Martínez et al. (2015) con base en 13 estaciones en las islas Shetland del Sur, cuatro en el extremo sur de la península Antártica, y dos en las islas Orkney del Sur (Campaña CAV-III), registran equinodermos en todas las estaciones, siendo Ophiuroidea la clase mejor representada encontrándose en 100 % de las estaciones, seguida de Asteroidea con 90,5 %, Holothuroidea con 81 %, Crinoidea con 66,7 % y por último Echinoidea con el porcentaje más bajo, recolectándose en el 62,4 % de las estaciones.
Sin embargo, desde otra perspectiva, si se tiene en cuenta que la información presentada en este trabajo proviene de cinco estaciones y a partir de un muestreo que no estaba dirigido a estos organismos, es de destacar el alto número de morfotipos encontrados y la importancia de estos registros para el conocimiento de algunas de las especies, así como para la elaboración del inventario de especies del estrecho de Gerlache. El presente registro del crinoideo Anthometrina adriani amplía su distribución geográfica hasta los 64° 39’ S. En el caso del pepino de mar Taeniogyrus cf. prydzi este es el primer registro del género para el estrecho de Gerlache y para la península Antártica, y en caso de confirmarse la especie este sería su primer registro para la Antártica occidental. En algunos casos como el de la especie Amphiura cf. microplax este podría ser su primer registro para el estrecho de Gerlache; sin embargo, a veces es difícil establecer estos primeros registros porque en la distribución de muchas especies se incluye la península Antártica sin especificar las localidades. Además, no hay muchos inventarios específicos para el estrecho de Gerlache o las islas adyacentes, como si los hay para otras áreas de la Antártica. En cuanto a la distribución batimétrica de Promachocrinus kerguelensis, Amphiura cf. microplax, Taeniogyrus cf. prydzi y Molpadia violacea los registros que se presentan en este trabajo amplían su intervalo de profundidad, siendo los más someros para estas especies (Estación 541: 54 m de profundidad y 640: 57 m). Estos resultados resaltan la necesidad e importancia de realizar en próximas expediciones muestreos enfocados en la caracterización de la mega y la macro-epifauna del estrecho de Gerlache y las islas adyacentes, siendo una de las áreas menos estudiadas en la península Antártica, sobretodo en comparación con otras localidades como las islas Shetland del Sur.
Algunas de las especies que se han identificado hasta ahora también son de las más comunes y abundantes en los ecosistemas someros de esta región, especialmente el crinoideo P. kerguelensis, la estrella de mar Odontaster validus y el ofiuro Ophionotus victoriae de las cuales se conocen aspectos ecológicos, reproductivos, biogeográficos, entre otros, como se ha mencionado en los comentarios presentados en los resultados. En las expediciones realizadas O. victoriae sólo se recolectó en las islas Shetland del Sur, donde al parecer la estructura comunitaria de la clase ofiuroidea es heterogénea y claramente determinada por la variación de la abundancia de O. victoriae, que al ser una especie con hábitos oportunistas, exhibe un dominio evidente en el archipiélago (Manjón-Cabeza y Ramos, 2003; Moya et al., 2003). No obstante, en otras zonas antárticas y subantárticas esta especie presenta una abundancia similar a representantes de los géneros Ophioplinthus y Ophiacantha (Manjón-Cabeza y Ramos, 2003). A pesar de que la metodología de muestreo no permite hacer inferencias sobre la abundancia de los ofiuros, vale la pena resaltar estudios anteriores, donde la estructura comunitaria de la clase Ophiuroidea en la península Antártica difiere de las islas Shetland del Sur (Manjón-Cabeza y Ramos, 2003; Moya et al., 2003).
En varios casos no ha sido posible la identificación taxonómica hasta especie debido a varias razones, entre ellas que los ejemplares posiblemente son juveniles o a que no se han podido confirmar algunas características por falta de referencias para comparar o por el tamaño de algunos ejemplares únicos. En el caso de los pepinos de mar, O’Loughlin et al. (2010) con base en datos moleculares utilizando la secuencia del gen mitocondrial COI, revelaron la existencia de 57 especies cripticas, de las 187 especies que registraron. Algunas de estas especies ya fueron estudiadas aclarando su taxonomía como es el caso de Molpadia violacea Studer, 1876 (O’Loughlin y VandenSpiegel, 2010), o describiendo nuevas especies como ocurre con Taeniogyrus prydzi O’Loughlin & VandenSpiegel, 2010. Sin embargo, en el caso del género Trachythyone las especies cripticas encontradas no se han descrito como nuevas especies, o las referencias no fueron localizadas para incluirlas en este trabajo. Los resultados que se presentan constituyen un aporte relevante al proyecto “Biogerlache - Antártica” y al trabajo continuado de las Expediciones de Colombia a la Antártica, confirmando una alta riqueza de equinodermos en el estrecho de Gerlache y zonas adyacentes y generando información para la elaboración de los inventarios taxonómicos de esta área y la creación de una línea base de conocimiento biológico, que contribuyan en la definición de posibles áreas de conservación.
AGRADECIMIENTOS
Agradecimientos a la tripulación científica y de la Armada durante las expediciones científicas Colombianas a la Antártica: III - Expedición Almirante Padilla (2016-2017) y V - Expedición Almirante Campos (2018-2019). A la Dirección General Marítima de Colombia (DIMAR). A la Comisión Colombiana del Océano (CCO) por su gestión en el Programa Antártico Colombiano (PAC). A Manuel Garrido Linares, Cristina Cedeño Posso y Héctor Fabián Bustos (Invemar)y Andrés Franco Herrera (Universidad Jorge Tadeo Lozano), quienes realizaron el muestreo de sedimentos y fijación de las muestras durante las expediciones. A Laura Moreno y Fernando Dorado por la colaboración con algunas de las fotografías. Agradecemos también al -Invemar por el financiamiento y apoyo durante el análisis de las muestras. Este trabajo fue financiado por el Invemar y el Ministerio de Medio Ambiente y Desarrollo Sostenible de Colombia Resolución 0092 de 2016, Código BPIN 2014011000405 (III Expedición) y Resolución 0129 de 2018, Código BPIN 2017011000113 (V Expedición). Contribución del Invemar N° 1301
REFERENCIAS
Alitto, R.A.S, M.L. Bueno, P.D.B. Guilherme, M. DiDomenico, A.B. Christensen and M. Borges. 2018. Shallow-water brittle stars (Echinodermata: Ophiuroidea) from Araçá Bay (Southeastern Brazil), with spatial distribution considerations. Zootaxa, 4405 (1): 001-066. doi: 10.11646/zootaxa.4405.1.1. [ Links ]
Anderson, J.B. 1999. Antarctic marine geology. Cambridge University Press, Cambridge. 289 p. doi: 10.1017/CBO9780511759376. [ Links ]
Antarctic Underwater Field Guide. 2019. http://www.oikonos.org/apfieldguide/album/index.html. 01/09/2019. [ Links ]
Barboza, C.A., R. de Moura, A. Lanna, T. Oackes and L.S. Campos. 2011. Echinoderms as clues to Antarctic ~ South American connectivity. Oecologia Australis, 15 (1): 86-110. [ Links ]
Bell, F.J. 1902. VIII. Echinoderma: 214-220. In: British Museum and E. Ray Lankester (Eds.). Reports on the collections of natural history made in the Antarctic regions during the voyage of the “Southern Cross”. Smithsonian, London. 344 p. https://doi.org/10.5962/bhl.title.12292 [ Links ]
Brogger, M.I. and T.D. O’Hara. 2015. Revision of some ophiuroid records (Echinodermata: Ophiuroidea) from Argentina. Zootaxa, 3972 (3): 432-440. [ Links ]
Clark, A.M. 1970. Notes on the family Amphiuridae (Ophiuroidea). Bull. etin British Mus. Nat. Hist., 19: 1-81. [ Links ]
Clark, A.M and M.E. Downey. 1992. Starfishes of the Atlantic. Nat. Hist. Mus. Publ.. Chapman & Hall, London. 794 p. [ Links ]
Dahm, C. 1996. Ökologie und Populationsdynamik antarktischer Ophiuroiden (Echinodermata). Berichte zur Polarforschung, Alfred-Wegener-Institut für Polar- und Meeresforschung, Bremerhaven. 194 p. [ Links ]
Dahm, C. 1999. Ophiuroids (Echinodermata) of southern Chile and the Antarctic: Taxonomy, biomass, diet and growth of dominant species. Scientia Mar., 63 (1): 427-432. [ Links ]
Dearborn, J.H. 1977. Foods and feeding characteristics of Antarctic asteroids and ophiuroids; 293-326. In: Llano, G.A. (Ed.). Adaptations within Antarctic Ecosystems, Proc. Of the 3rd SCAR Symposium on Antarctic Biology. Smithsonian Institution. Gulf Publishing Company, Houston. 1252 p. [ Links ]
Duquette, A., K.M. Halanych, R.A. Angus and J.B. McClintock. 2018. Inter and intraspecific comparisons of the skeletal Mg/Ca ratios of high latitudee Antarctic echinoderms. Antarctic Sci., 30(3): 160-169. [ Links ]
Eléaume, M., L.G. Hemery, N. Améziane and M. Roux. 2014. Phylogeographic patterns of the Southern Ocean crinoids; 448-455. In: De Broyer, C., P. Koubbi, H. J. Griffiths, B. Raymond, C. d’ Udekem d’Acoz, a.P. Van de Putte, B. Danis, B. David, S. Grant, J. Gutt, C. Held, G. Hosie, F. Huettmann, A. Post and Y. Ropert-Coudert. (Eds.). Biogeographic atlas of the Southern Ocean. Scient. Com. Antarctic Res., Cambridge. 498 p. [ Links ]
Fabri-Ruiz, S, T. Saucède, B. Danis, B. David.2017. Southern Ocean Echinoids database - An updated version of Antarctic, Sub-Antarctic and cold temperate echinoid database. ZooKeys 697: 1-20. https://doi.org/10.3897/zookeys.697.14746 [ Links ]
Fell, H.B. 1960. Synoptic keys to the genera of Ophiuroidea. Zool. Publ.Victoria Univ. Wellington, New Zealand, 26: 1-44. [ Links ]
Fratt, D.B. and J.H. Dearborn. 1984. Feeding biology of the Antarctic brittle star Ophionotus victoriae (Echinodermata: Ophiuroidea). Polar Biol., 3: 127-139. [ Links ]
Frensen, R., C.A.M. Barboza, R.B. Moura and L.S. Campos. 2010. Southwest Atlantic deep-sea brittle stars (Echinodermata: Ophiuroidea) from Campos Basin, Brazil:173-180. In: Durham - Harris, L.G., S.A. Boetger, M.P. Lesser and C.W. Walker (Eds.). Echinoderms. Taylor & Francis Group, London. 700 p. [ Links ]
GBIF. 2020. GBIF Occurrence Download. Available from https://doi.org/10.15468/dl.pgk6uz. 28/06/2020. [ Links ]
Grange, L.J., P.A. Tyler, L.S. Peck and N. Cornelius. 2004. Long-term interannual cycles of the gametogenic ecology of the Antarctic brittle star Ophionotus victoriae. Mar. Ecol. Progr. Ser., 278: 141-155. [ Links ]
Grieg, J.A. 1929. Echinodermata from the Palmer Archipelago, South Shetlands, South Georgia, and the Bouvet Island. With description of a new species of the molluscan genus Montacuta. Sci. Res. Norweg. Antarctic Exp., 1(2): 1-16. [ Links ]
Gutt, J. and D. Piepenburg. 1991. Dense aggregations of three deep-sea holothurians in the southern Weddell Sea, Antarctica. Mar. Ecol. Progr. Ser., 68: 277-285 [ Links ]
Hemery, L.G., M. Eléaume, V. Roussel, N. Améziane, C. Gallut, D. Steinke, C. Cruaud, A. Couloux and N.G. Wilson. 2012. Comprehensive sampling reveals circumpolarity and sympatry in seven mitochondrial lineages of the Southern Ocean crinoid species Promachocrinus kerguelensis (Echinodermata). Mol. Ecol., 21: 2502-2518. doi: 10.1111/j.1365-294X.2012.05512.x [ Links ]
Hemery, L.G ., N. Améziane and M. Eléaume . 2013. Circumpolar dataset of sequenced specimens of Promachocrinus kerguelensis (Echinodermata, Crinoidea). ZooKeys, 315: 55-64. doi: 10.3897/zookeys.315.5673 Resource ID: GBIF key: http://gbrds.gbif.org/browse/agent?uuid=9dae1fa0-5800-4f18-8f4e-a87f05c73eb1. [ Links ]
Janosik, A.M. and K.M. Halanych. 2010. Unrecognized Antarctic biodiversity: a case study of the genus Odontaster (Odontasteridae; Asteroidea). Integr. Comp. Biol., 50(6): 981-992. doi:10.1093/icb/icq119. [ Links ]
Koehler, R. 1907. Revision of the Ophiures collection at the Museum of Natural History Paris. Scient. Bull. France Belgium, 41: 279-351. [ Links ]
Koehler, R. 1912. Echinoderms (Asteria, Ophides and Echinoids). Second French Antarctic Exp. (1908-1910): 1 -270. [ Links ]
Koehler, R. 1922. Contributions to the biology of the Philippine Archipelago and adjacent regions. Ophiurans of the Philippine seas and adjacent waters. Bull.US Nat. Mus., 100: 1-486. [ Links ]
Manjón-Cabeza, M.E. and A. Ramos. 2003. Ophiuroid community structure of the South Shetland Islands and Antarctic Peninsula region. Polar Biol., 26: 691-699. [ Links ]
Manjón-Cabeza, M.E ., Y. Lirio and A. Ramos. 2001. Distribution of asteroid genera (Echinodermata) off South Shetland Islands and the Antarctic Peninsula. Bol. Inst. Esp. Oceanografía, 17 (3 y 4): 263-270. [ Links ]
Martínez, M.I. 2014. Diversity of Dendrochirotida in the Argentine Sea (Echinodermata: Holothuroidea); taxonomic, phylogenetic, ecological and biogeographic aspects. Faculty Exact Natural Sciences, Univ.Buenos Aires. 150 p. [ Links ]
Martínez, M.I., L.P. Arribas, J.J. Berecoechea, M.I. Brogger and P.E. Penchaszadeh. 2015. Echinoderm diversity in the Southwestern Atlantic. Rev. Biol. Trop., 63(2): 115-120. [ Links ]
Martín-Ledo, R. and P.J. López-González. 2014. Brittle stars from Southern Ocean (Echinodermata: Ophiuroidea). Polar Biol., 37: 73-88. [ Links ]
Massin, C. 1992. Three new species of Dendrochirotida (Holothuroidea, Echinodermata) from the Weddell Sea (Antarctica). Bull.l’Institut roy. Sci. nat. Belg. Biol., 62: 179-191. [ Links ]
Matsumoto, H. 1915. A new classification of the Ophiuroidea: with description of new genera and species. Proc. Acad. Nat. Sci. Phila., 68: 43-92. [ Links ]
Matsumoto, H. 1917. A monograph of Japanese Ophiuroidea, arranged according to a new classification. J. Coll. Sci., Imperial Univ., Tokyo, 38: 1-408. [ Links ]
McClintock, J.B. 1994. Trophic biology of Antarctic shallow-water echinoderms. Mar. Ecol. Progr. Ser., 111: 191-202. [ Links ]
Messing, C. 2019. Artificial key to the families of living crinoids. https://cnso.nova.edu/messing/crinoids/artificial_key_crinoids.pdf. 10/09/2018. [ Links ]
Messing, C. 2020a. World list of Crinoidea. Promachocrinus Carpenter, 1879. Accessed through: World Register of Marine Species at: http://www.marinespecies.org/aphia.php?p=taxdetails&id=173828 on 2020-03-16. [ Links ]
Messing, C. 2020b. World list of Crinoidea. Promachocrinus kerguelensis Carpenter, 1879. Accessed through: World Register of Marine Species at: http://www.marinespecies.org/aphia.php?p=taxdetails&id=173830 16/03/2020. [ Links ]
Messing, C. 2020c. World list of Crinoidea. Anthometrina Eléaume, Hess & Messing, 2011. Accessed through: World Register of Marine Species at: http://www.marinespecies.org/aphia.php?p=taxdetails&id=710747 16/03/2020. [ Links ]
Messing, C. 2020d. World list of Crinoidea. Anthometrina adriani (Bell, 1908). Accessed through: World Register of Marine Species at: http://www.marinespecies.org/aphia.php?p=taxdetails&id=710749 16/03/2020. [ Links ]
Miller, J.E. and D.L. Pawson. 1984. Holothurians (Echinodermata: Holothuroidea). Mem. Hourglass Cruis., 7(1): 1-79. [ Links ]
Mills, V.S. and T. O’Hara, 2013. Ophiuroids (Echinodermata; Ophiuroidea) of biogenic habitats on the continental shelf of New Zealand. Zootaxa, 3613 (5): 401-444. doi: 10.11646/zootaxa.3613.5.1. [ Links ]
Mills, V.S . and T. O’Hara. 2010. Amphilepis neozelandica sp. nov., the first record of the Amphilepididae in New Zealand waters (Echinodermata: Ophiuroidea). Zootaxa, 2514: 47-54. [ Links ]
Moles, J., B. Figuerola, N. Campanyà-Llovet, T. Monleón-Getino, S. Taboada and C. Avila. 2015. Distribution patterns in Antarctic and Subantarctic echinoderms. Polar Biol., 38 (6): 799-813. doi: 10.1007/s00300-014-1640-5. [ Links ]
Moreau, C., C. Mah, A. Agüera, N. Améziane, D. Barnes, G. Crokaert, M. Eléaume, H. Griffiths, C. Guillaumot, L.G. Hemery, A. Jażdżewska, Q. Jossart, V. Laptikhovsky, K. Linse, K. Neill, C. Sands, T. Saucède, S. Schiaparelli, J. Siciński, N. Vasset and B. Danis. 2018. Antarctic and Sub-Antarctic Asteroidea database. ZooKeys, 747: 141-156. doi: 10.3897/zookeys.747.22751. [ Links ]
Mortensen, T. 1927. Handbook of the echinoderms of the British Isles. Oxford University Press, London, 471 p. [ Links ]
Mortensen, T. 1936. Echinoidea and Ophiuroidea. Discov. Rep., 12: 199-348. [ Links ]
Moura, R.B.D., L.D.S. Campo and A.M. Esteves. 2015. Hooked from the deep: a rare new species of Taeniogyrus (Holothuroidea, Chiridotidae) from the continental slope of Brazil, southwestern Atlantic. Zootaxa, 3972 (4): 535-548. [ Links ]
Moya, F., A. Ramos and M.E. Manjón-Cabeza. 2003. Distribution and ecology of Ophionotus victoriae Bell, 1902 (Ophiuroidea, Echinodermata) in the South Shetland Islands area (Antarctica). Bol. Inst. Esp. Oceanogr., 19: 49-55. [ Links ]
Neill, K., M. Kelly and B. Herr. 2016. Amazing Antarctic asteroids, a guide to the starfish of the Ross Sea. NIWA, 49 p. [ Links ]
O’Loughlin, P.M. and D. VandenSpiegel. 2010. A revision of Antarctic and some Indo-Pacific apodid sea cucumbers (Echinodermata: Holothuroidea: Apodida). Mem. Mus. Victoria, 67: 61-95. [ Links ]
O’Loughlin, P.M ., G. Paulay, N. Davey and F. Michonneau. 2010. The Antarctic region as a marine biodiversity hotspot for echinoderms: Diversity and diversification of sea cucumbers. Deep Sea Res. Part II, Top. Stud. Oceanogr., 58 (1-2): 264-275. doi: 10.1016/j.dsr2.2010.10.011. [ Links ]
O’Loughlin, P.M ., J. Skarbnik-López, M. Mackenzie and D. VandenSpiegel. 2015. Sea cucumbers of the Kerguelen Plateau, with descriptions of new genus and species (Echinodermata: Holothuroidea). Mem. Mus. Victoria, 73: 59-93. [ Links ]
Pawson, D.L. 1977. Molpadiid sea cucumbers (Echinodermata: Holothuroidea) of the southern Atlantic, Pacific and Indian Oceans. Biology of the Antarctic Seas VI. Antarctic Res. Ser., 3(26): 97-123. [ Links ]
Peck, L., M. Clark and N. Dunn. 2018. Morphological variation in taxonomic characters of the Antarctic starfish Odontaster validus. Polar Biol., 41 (10): 2159-2165. doi: 10.1007/s00300-018-2344-z. [ Links ]
Piepenburg, D., J. Vo and J. Gutt. 1997. Assemblages of sea stars (Echinodermata: Asteroidea) and brittle stars (Echinodermata: Ophiuroidea) in the Weddell Sea (Antarctica) and off Northeast Greenland (Arctic): a comparison of diversity and abundance. Polar Biol., 17: 305-322. [ Links ]
Secretariat of Antarctic Treaty. 2009. Management Plan for Antarctic Specially Protected Area No. 149. ATCM XXXII Final Report: Measure 10. [ Links ]
Stöhr, S., T. O’Hara and B. Thuy. 2018. World Ophiuroidea database. Amphilepididae Matsumoto, 1915. Accessed at: http://www.marinespecies.org/ophiuroidea/aphia.php?p=taxdetails&id=123205 24/03/2020. [ Links ]
Stöhr, S., T.D. O’Hara and B. Thuy. 2012. Global diversity of brittle stars (Echinodermata: Ophiuroidea). PLoS One 7:e31940. [ Links ]
Thandar, A.S. 2013. Trachythyone flaccida, a new sea cucumber species from southern Angola (Echinodermata: Holothuroidea: Dendrochirotida: Cucumariidae) with a key to the genus. Zootaxa, 3693(3): 395-400. [ Links ]
Vaughan, D.G., G.J. Marshall, W.M. Connolley, C. Parkinson, R. Mulvaney, D.A. Hodgson, J.C. King, C.J. Pudsey and J. Turner. 2003. Recent rapid regional climate warming on the Antarctic Peninsula. Clim. Change, 60: 243-274. [ Links ]
WoRMS. 2020. Taeniogyrus Semper, 1867. Available from http://www.marinespecies.org/aphia.php?p=taxdetails&id=174000. 29/06/2020. [ Links ]
Recibido: 30 de Septiembre de 2019; Aprobado: 10 de Agosto de 2020











 text in
text in 




