Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 supl.1 Santa Marta dic. 2021 Epub 13-Dic-2021
https://doi.org/10.25268/bimc.invemar.2021.50.suplesp.972
Artículos de Investigación
Ensamblaje de eufáusidos epipelágicos en el estrecho de Gerlache (península Antártica) durante enero 2015
1Universidad del Valle, Departamento de Biología, Grupo de Investigación en Ciencias Oceanográficas, Cali, Colombia. marisol.rivera.gomez@correounivalle.edu.co
2Universidad del Valle, Departamento de Biología, Grupo de Investigación en Ciencias Oceanográficas, Cali, Colombia. alan.giraldo@correounivalle.edu.co
3Centro de Investigaciones Oceanográficas e Hidrográficas, Dirección General Marítima. Cartagena de Indias, Colombia. dmojica@dimar.mil.co
The spatial distribution of the epipelagic Euphausiids was investigated during the first Colombian Scientific Expedition to Antarctica -Expedición Caldas- in the Gerlache Strait during the austral summer of 2015. Surface zooplankton was collected at 20 oceanographic stations with a simple conical net of 0.6 m in diameter mouth and 200 µm of mesh net. Four euphausiid species were collected in 70 % of the sampling stations: Euphausia crystallorophias Holt and Tattersall 1906, Euphausia superba Dana 1850, Thysanoessa sp. and Thysanoessa macrura Sars 1883. Euphausia crystallorophias was the most abundant species with maximum density of 818 ind 1000 m-3 associated with the entrance of the Wilhelmina Bay, in the central area of the Gerlache Strait. The northern and southern sectors of the strait had significant differences in surface temperature and salinity associated with significant differences in the composition of the euphausiid species assemblages between both sectors. Although E. crystallorophias was the numerically dominant euphausiid species in the Gerlache Strait, E. superba was mostly distributed in the northern sector while Thysanoessa sp. was only distributed in the southern sector.
KEYWORDS: Euphausiacea; Temperature; Salinity; Antarctic Ocean; Austral summer.
La distribución espacial de los eufáusidos en la zona epipelágica del estrecho Gerlache, Antártica capturados durante el verano austral de 2015, fue investigada durante la “Expedición Caldas”, primera expedición científica de Colombia a la Antártica. En 20 estaciones de muestreo oceanográfico se realizaron arrastres superficiales para recolectar zooplancton utilizando una red cónica simple de 0,6 m de diámetro y 200 µm de luz de malla. Cuatro especies de eufáusidos fueron recolectados en 70 % de las estaciones: Euphausia crystallorophias Holt y Tattersall 1906, Euphausia superba Dana 1850, Thysanoessa sp. y Thysanoessa macrura Sars 1883. La especie más abundante fue E. crystallorophias con abundancia máxima de 818 ind 1000 m-3 asociada a la entrada de la bahía Wilhelmina, en la zona central del estrecho Gerlache. Los sectores norte y sur del estrecho mostraron diferencias significativas en la temperatura y salinidad superficial y variaciones en la composición de los conjuntos de eufáusidos entre estos dos sectores. Aunque, E. crystallorophias fue la especie numéricamente dominante en todo el estrecho Gerlache, E. superba se distribuyó principalmente en el sector norte mientras que Thysanoessa sp. sólo en el sur.
PALABRAS CLAVE: Euphausiacea; Kril antártico; Temperatura; Salinidad; Verano austral.
INTRODUCCIÓN
Los eufáusidos son crustáceos exclusivamente marinos que se alimentan de material particulado, fitoplancton y microzooplancton (Cleary et al., 2018; Kohlbach et al., 2019). Algunas de las especies que conforman este grupo taxonómico cumplen una función ecológica relevante en la trama trófica pelágica antártica debido a que son presas de peces (Hudson et al., 2014), aves marinas (Rogers et al., 2012; Rombolá et al., 2012; Santora et al., 2017), lobos marinos (Yamanaka, 1983) y ballenas Balaenopteridae (Stone y Hamner, 1988; Murase et al., 2002; Nowacek et al., 2011), acortando el proceso de transferencia de energía de la producción primaria a los niveles tróficos superiores. Además, estos organismos realizan amplios desplazamientos verticales en la columna de agua, por lo que son considerados elementos claves en la bomba biológica e incluso un elemento fundamental en el proceso de acoplamiento bento-pelágico en la región Antártica (Schmidt et al., 2011; Conroy et al., 2020).
En la Península Antártica, los eufáusidos en sus etapas larvarias y juveniles junto con los copépodos y las salpas son uno de los tres grupos principales que componen el zooplancton (Schnack-Schiel y Mujica, 1994), aunque algunas especies de eufáusidos durante su etapa adulta son considerados organismos micronectónicos. Este es un grupo taxonómico que ha sido ampliamente estudiado en la región antártica, particularmente Euphausia superba debido a su elevada abundancia en la zona (Piatkowski, 1985; Hosie et al., 1988; Cavan et al., 2019). Para el estrecho de Gerlache, el conocimiento de los eufáusidos incluye: distribución geográfica, comportamiento migratorio vertical, estructura de tallas de la población (Nordhausen, 1994a; Zhou et al., 1994; Lawson et al., 2008; Wiebe et al., 2011; Cleary et al., 2016), tasas metabólicas de herbívora y respiración, su aporte al flujo de carbono (Huntley y Brinton, 1991; Hernández-León et al., 2000, 2001, 2013; Reiss et al.2017) así como la relación entre las tasas de reclutamiento y abundancia con los eventos ENOS de origen en el Pacífico tropical (Loeb et al., 2009).
El estrecho de Gerlache, ubicado en la zona noroccidental de la Península Antártica, presenta una geomorfología y batimetría que promueve el desarrollo de patrones de circulación particulares en las zonas norte y sur, que traen como consecuencia condiciones hidrográficas diferentes (Rodríguez et al., 2002; Zhou et al., 2002, 2006; Torres-Parra et al., 2020). Considerando que las condiciones de temperatura y salinidad determinan en gran medida la estructura y composición de la comunidad planctónica en una localidad (Rodríguez et al., 2002; Leonori et al., 2017), es de esperar que las especies que conforman el conjunto de eufáusidos epipelágicos en el estrecho Gerlache exhiban una tendencia particular de variación espacial, la cual estaría relacionada con las condiciones térmicas y salinas propias de cada sector del estrecho, de tal manera que la estructura del conjunto de eufáusidos será diferente entre estos sectores.
Para poner a prueba esta hipótesis, se evaluaron aspectos relacionados con la ecología espacial del conjunto de eufáusidos epipelágicos en el estrecho Gerlache durante el verano austral de 2015 en el marco de la primera expedición científica de Colombia a la Antártica - “Expedición Caldas”. Se abordaron las siguientes preguntas de investigación: 1. ¿Es similar la composición taxonómica del conjunto de eufáusidos presente en la zona epipelágica en el sector norte y sur del Estrecho Gerlache? y 2. ¿Es homogénea la distribución espacial de la abundancia de eufáusidos en la zona epipelágica del estrecho Gerlache durante el periodo de estudio?
ÁREA DE ESTUDIO
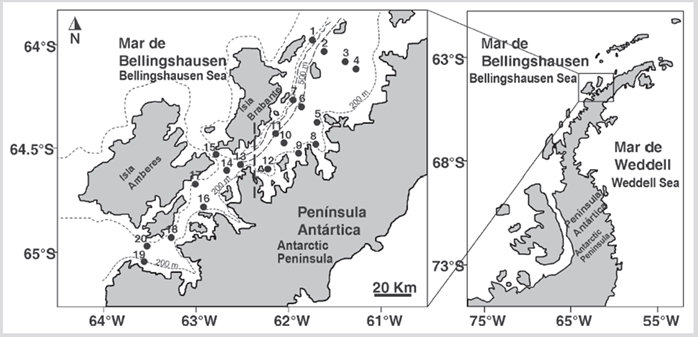
El Estrecho de Gerlache se encuentra ubicado en el sector noroccidental de la Península Antártica, delimitado por el archipiélago Palmer en el que destacan dos formaciones insulares, las islas de Amberes y Brabante (Figura 1).
El estrecho tiene una longitud de 180 km y entre 8 y 60 km de ancho, con profundidad de 300 m en el extremo sur y 1000 m en el extremo norte (García et al., 2002). La circulación superficial en el Estrecho de Gerlache fluye hacia el nororiente con velocidades superiores a 30 cm s-1 alimentando la Corriente del Estrecho de Bransfield (Zhou et al., 2002). En esta región se desarrolla un dinámico sistema de giros anticiclónicos costeros debido a la gran cantidad de bahías someras a lo largo del estrecho (Zhou et al., 2002). Durante el verano austral de 2015, la estructura térmica y salina en la parte superficial de la columna de agua mostró condiciones distintas en cada una de las entradas del estrecho, en la entrada del norte prevalecieron condiciones de estratificación térmica con salinidad homogénea, mientras que la entrada sur mostró mayor mezcla y baja salinidad en los primeros 30 m (Giraldo et al., 2019; Torres-Parra et al., 2020).
MATERIALES Y MÉTODOS
Las muestras de zooplancton fueron obtenidas durante la Expedición Caldas a bordo del buque “ARC 20 de Julio” de la Armada Nacional de Colombia. El muestreo se realizó del 17 al 22 de enero de 2015, en 20 estaciones oceanográficas (Figura 1). En cada estación se realizó el registro vertical continuo de temperatura, conductividad y profundidad utilizando un perfilador Seabird® CTD (SBE 19plus SeaCat profiler CTD y SBE 25plus Sealogger CTD). La distribución horizontal de la temperatura y la salinidad fue analizada a profundidades estándar (1, 10, 50 y 100 m) para inferir las condiciones termohalinas en la zona de estudio, utilizando el método de interpolación krigging del programa Surfer®.
Se realizaron arrastres superficiales para recolectar zooplancton en cada estación de muestreo utilizando una red cónica simple de 0,6 m de diámetro y 200 µm de luz de malla con un flujómetro Hydrobios® instalado en el centro de la boca, para estimar el volumen de agua filtrado. Las muestras fueron fijadas en formol al 4 % de concentración buferizado con borato de sodio a saturación. Todos los arrastres se realizaron bajo condiciones de luz de día. Las muestras fueron etiquetadas y analizadas en el laboratorio del grupo de Investigación en Ciencias Oceanográficas de la Universidad del Valle. En el laboratorio, se fraccionó la muestra en cuatro partes iguales utilizando un submuestreador de plancton tipo Motoda, se utilizó un cuarto de la muestra de zooplancton para estimar la biomasa seca. De la fracción de las tres cuartas partes restantes se separaron, identificaron, contaron y clasificaron por estadio de desarrollo los eufáusidos, siguiendo las claves taxonómicas de Antezana et al. (1976), Baker et al. (1990), Gibbons et al. (1999) y Brinton et al. (2000). Todos los conteos fueron estandarizados (individuos 1000 m-3) a partir del volumen de agua filtrado.
Para cuantificar la biomasa seca del zooplancton de cada estación de muestreo se utilizó el método de peso seco constante (Postel et al., 2000), concentrando la muestra en un filtro de celulosa previamente secado y pesado, siendo llevada a peso constante en un horno a 60 °C durante 24 h, para ser posteriormente pesada en una balanza analítica de precisión 0,0001 g. Los registros de peso fueron multiplicados por 1,25 para ajustar la pérdida de tejido en el formaldehído (Hopkins, 1971). Para cuantificar el aporte en biomasa de las diferentes especies de eufáusidos identificados en el área de estudio, se estableció el peso promedio de los individuos adultos de cada especie (excluyendo juveniles) y se multiplicó por su abundancia, estableciendo el porcentaje de aporte de cada especie a la biomasa total del zooplancton.
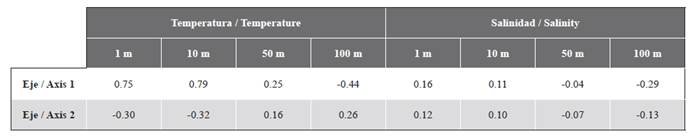
Se realizó el análisis de las condiciones de temperatura, salinidad y el conjunto de eufáusidos en los sectores norte y sur del estrecho como unidades de comparación de acuerdo con la caracterización geomorfológica y oceanográfica descritas por Zhou et al. (2002) y Giraldo et al. (2019). Se realizaron pruebas t-student previa comprobación de los supuestos de normalidad y homogeneidad de varianzas con los datos transformados con box-cox para establecer sí existían diferencias entre la temperatura y la salinidad de los sectores norte y sur del estrecho de Gerlache. Para evaluar diferencias en la abundancia de eufáusidos entre los dos sectores del estrecho se efectuó un análisis no paramétrico de Mann-Whitney y se realizó un análisis de correlación no paramétrico de Spearman para evaluar la correlación entre la abundancia de los eufáusidos en función de la temperatura y la salinidad en las profundidades evaluadas. Estos análisis estadísticos fueron ejecutados con Statistica 7.
Se realizó un análisis de escalamiento no métrico multidimensional (nMDS) a partir de una matriz de similitud establecida con el algoritmo de Bray Curtis, para inferir la variación espacial del conjunto de eufáusidos comparando los sectores norte y sur. Además, se evaluó la diferencia entre los conjuntos utilizando un análisis de Similitud (Anosim) y se estableció el aporte de cada especie a la similitud de los conjuntos de cada sector y a la disimilitud entre los sectores del estrecho utilizando un análisis de porcentaje de similitud (SIMPER) (Clarke, 1993; Clarke y Ainsworth, 1993; Clarke y Warwick, 1994, 2001). Todos los análisis comunitarios se realizaron utilizando el programa Primer 6 (Clarke y Gorley, 2006).
RESULTADOS
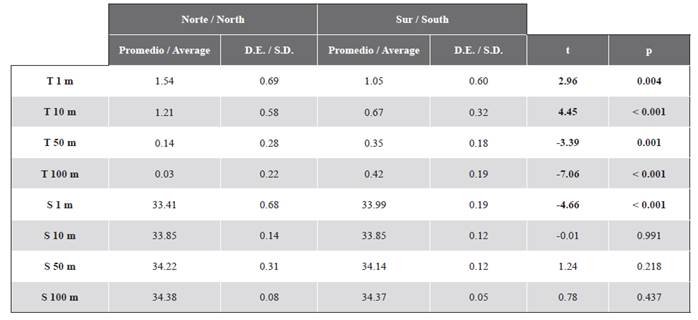
La temperatura de los primeros 100 m de profundidad tuvo diferencias significativas entre el sector norte y el sur del estrecho (Tabla 1). El estrato superficial y a 10 m de profundidad del sector norte presentó valores de temperatura más altos que el sur, mientras que entre 50 - 100 m de profundidad la temperatura fue menor en el sector norte (Figura 2). La salinidad fue homogénea en ambos sectores para la mayoría de las profundidades excepto en el estrato superficial donde las salinidades más bajas se registraron en la región oriental del sector norte (Figura 3). La salinidad a 1 m de profundidad fue significativamente diferente entre los sectores norte y sur (Tabla 1).
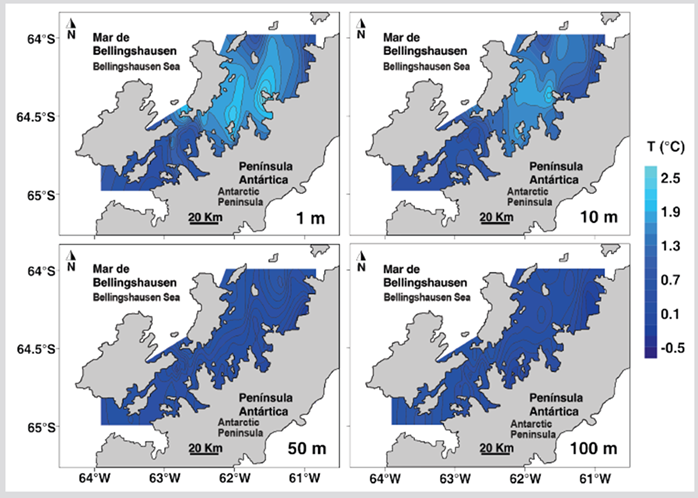
Figura 2 Distribución de la temperatura del mar a 1, 10, 50 y 100 m de profundidad durante el verano austral de 2015 en el estrecho de Gerlache, península Antártica.
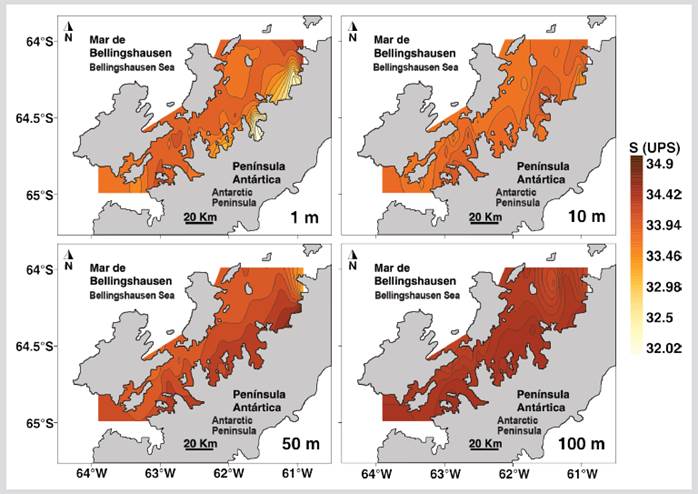
Figura 3 Distribución de la salinidad a 1, 10, 50 y 100 m de profundidad durante el verano austral de 2015 en el estrecho de Gerlache, península, Antártica.
Tabla 1 Pruebas de t para contrastar diferencias entre la temperatura (°C) y la salinidad (UPS) entre los sectores norte y sur del Estrecho de Gerlache durante el verano austral de 2015.
Las mayores concentraciones de biomasa zooplanctónica fueron registradas en la entrada de la bahía Wilhelmina (estación 12= 2246,87 mg 100 m-3) y entre la isla Lion e isla Amberes (estación 17= 1194,50 mg 100 m-3) (Figura 4). La concentración de biomasa de zooplancton fue entre uno a dos órdenes de magnitud menor en el resto del área de estudio (5,32 - 697,24 mg 100 m-3) (Figura 4).
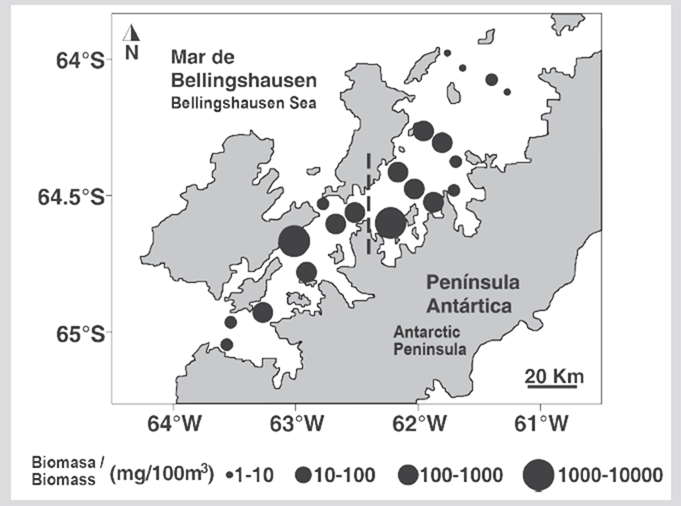
Figura 4 Distribución de la biomasa de zooplancton (mg 100 m-3) estimada durante el verano austral de 2015 en el estrecho de Gerlache, península Antártica.
Los eufáusidos fueron capturados en 70 % de las estaciones de muestreo, identificando cuatro especies: Euphausia crystallorophias Holt y Tattersall 1906 (79,7 %), E. superba Dana 1850 (11,4 %), Thysanoessa sp. (7,6 %) y T. macrura Sars 1883 (1,3 %). La máxima abundancia de eufáusidos fue de E. crystallorophias registrada en la estación 12 en la entrada de la bahía Wilhelmina (818 ind 1000 m-3) (Figuras 5 y 6). Todos los individuos presentes en las muestras correspondieron a juveniles, machos y hembras. Las larvas no fueron capturadas. La proporción entre machos y hembras de E. crystallorophias fue 48,5 % machos y 51,5 % hembras, para E. superba 68,7 % machos y 31,3 % hembras, para Thysanoessa sp. 65,3 % machos y el 34,7 % hembras, y para T. macrura todos los individuos fueron hembras.
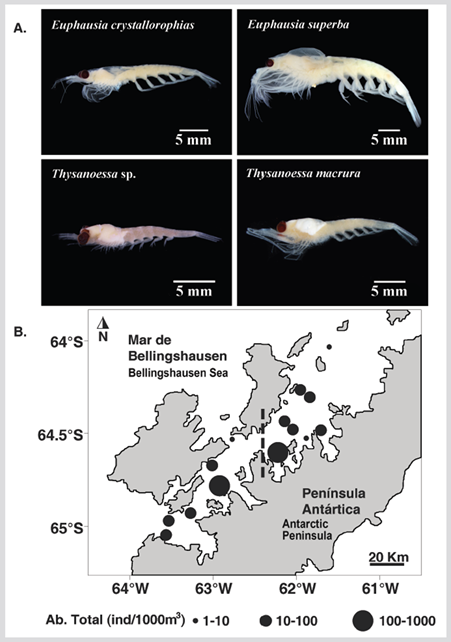
Figura 5 A. Fotografías de las especies recolectadas. B. Distribución de la abundancia total de eufáusidos (ind 1000 m-3) durante el verano austral de 2015 en el estrecho de Gerlache, península Antártica.
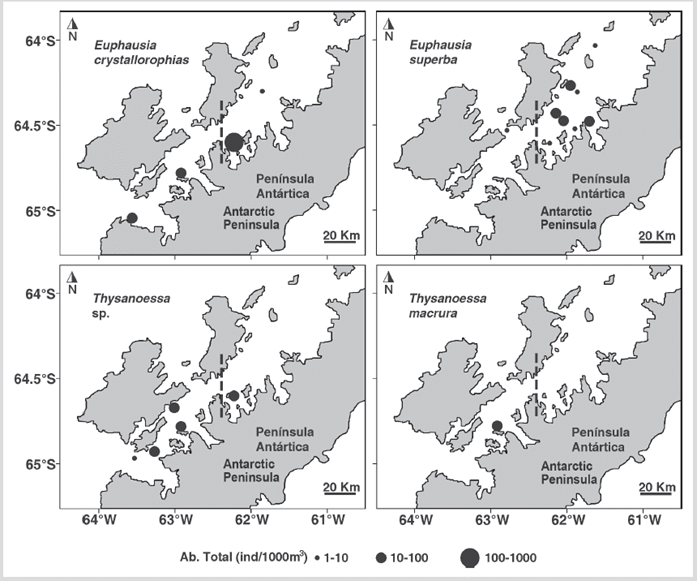
Figura 6 Distribución de la abundancia de eufáusidos por especie (ind 1000 m-3) durante el verano austral de 2015 en el estrecho de Gerlache, península Antártica.
La abundancia de las especies no tuvo diferencias estadísticas significativas entre los sectores norte y sur (Mann-Whitney, U=749, p=0,852). Sin embargo, E. crystallorophias fue más abundante en la estación 12 ubicada en el norte. Además, las capturas de E. superba se realizaron principalmente en ese sector, mientras que las especies del género Thysanoessa se registraron casi exclusivamente en el sur, con excepción de la estación 12 (Figura 6). No se encontró una relación significativa de la abundancia de ninguna de las especies con la temperatura o la salinidad, excepto E. superba correlacionada positivamente con la temperatura superficial (R=0,57, p < 0,05) y de 10 m de profundidad (R=0,64, p < 0,05).
Euphausia crystallorophias tuvo un aporte de biomasa de zooplancton equivalente a 32,1 %, E. superba 12,7 %, T. macrura 0.4 % y Thysanoessa sp. 0,3 %. En cuanto a los sectores norte y sur E. crystallorophias representó 50,1 % de la biomasa del zooplancton en el norte y 6,7 % en el sur. Euphausia superba representó 20,2 % en el norte y 2,1 % en el sur. Thysanoessa sp. representó 0,2 % en el norte y 0,4 % en el sur. Thysanoessa macrura solo fue registrada en el sur del estrecho, representando 0,9 % de la biomasa del zooplancton.
El conjunto de especies de eufáusidos en el estrecho de Gerlache mostró dos grupos significativamente diferentes (Anosim, R=0,52, p=0,005), uno conformado por la mayoría de las estaciones del sector sur del estrecho y otro con las estaciones del norte (Figura 7). Para la solución bidimensional obtenida por el nMDS, las correlaciones de Spearman únicamente fueron altas y positivas entre la temperatura a 1 y 10 m y el eje 1 (Tabla 1). El análisis Simper sugirió que la disimilitud entre el norte y el sur fue del 89,19 %. Euphausia superba (41,0 %), E. crystallorophias (32,4 %) y Thysanoessa sp. (24,6 %) fueron las especies que contribuyeron a la mayor parte de la disimilitud entre los sectores, mientras que E. superba fue la especie que más contribuyó a la similitud del norte (99,8 %) y Thysanoessa sp. la que tuvo la mayor contribución a la similitud del sur (89,7 %).
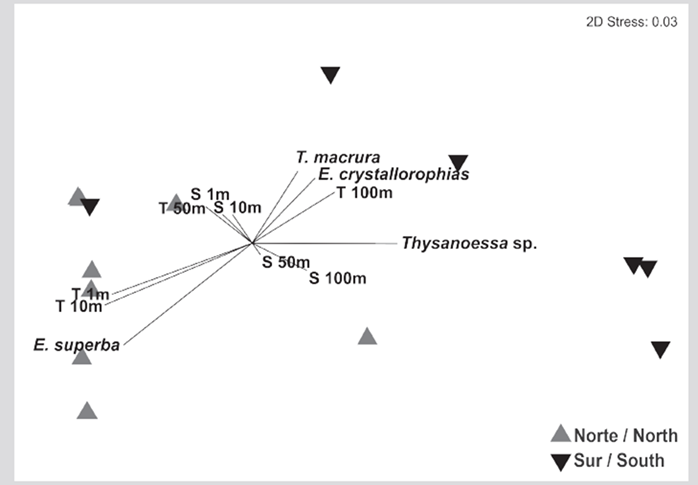
Figura 7 Análisis no métrico multidimensional utilizando el algoritmo de Bray Curtis, con base en la matriz de abundancia de las especies de eufáusidos registradas durante el verano austral de 2015 en el estrecho de Gerlache, península Antártica.
DISCUSIÓN
Cuatro especies de eufáusidos fueron registradas en la zona epipelágica del estrecho Gerlache durante el verano austral de 2015. Esta baja riqueza específica coincide con estudios previos en bahía Margarita, al sur del estrecho Gerlache (Marrari et al., 2011; Parker et al., 2011), en donde registraron a T. macrura, E. crystallorophias y E. superba. Para el mar de Escocia, Ward et al. (2004) registraron a E. superba, T. macrura y T. vicina, especies que habían sido previamente halladas en el Estrecho Gerlache durante el invierno (Nordhause, 1994a).
En las aguas neríticas antárticas, E. crystallorophias es la especie de eufáusido más común (Mauchline y Fisher, 1969; Thomas y Green, 1988; Pakhomov y Perissinotto, 1996; Sala et al., 2002; La et al., 2015). Esta es una especie con un amplio espectro de alimentación, que incluye diatomeas, bacterias, detrito orgánico y algas que crecen debajo del hielo (Mauchline y Fisher, 1969; Melnikov y Spiridonov, 1996; Pachamov y Perissinotto, 1996; Ju y Harvey, 2004; Lee et al., 2013) y que alcanza densidades promedio entre 450 a 1400 ind 100 m-3 (Everson, 1987; Pakhomov et al., 1998). La mayor abundancia de E. crystallorophias en el verano de 2015 fue 818 ind 1000 m-3 en la zona central del estrecho, siendo la especie que dominó en número y en aporte de biomasa el conjunto de eufáusidos en el área de estudio, similar a lo mencionado por Daly y Zimmerman (2004) y Marrari et al. (2011) para el sector occidental de la península Antártica. Incluso, la abundancia registrada en el presente estudio fue mayor a la que había sido registrada para la zona nerítica del mar de Bellingshausen (bahía Margarita) por Siegel y Harm (1996).
Euphausia superba es quizás la especie de eufáusido más ampliamente estudiada en el mundo (Nicol, 2006; Siegel, 2016). Esta especie, endémica del océano Antártico, no solo es el eufáusido de mayor talla (adultos: 42-65 mm) o el más abundante en el área, sino que es una especie clave en el flujo biogeoquímico del carbono y hierro y en la dinámica trófica del ecosistema pelágico antártico (Everson, 2000; Nowacek et al., 2011; Gleiber et al., 2012; Schmidt et al., 2016; Trathan y Hill, 2016). Euphausia superba sostiene una extensa actividad pesquera internacional desde hace 50 años (Nicole et al., 2012; Nicole y Foster, 2016). Aunque esta especie habita principalmente el ambiente oceánico antártico (Siegel y Watkins, 2016), Gerlache se conoce como una de las regiones de mayor abundancia en la península Antártica (Huntley y Brinton, 1991), probablemente asociado con el patrón de circulación local que favorece el tiempo de residencia de las larvas en un ambiente protegido con alta productividad (Varela et al., 2002; Zhou et al., 2002, 2006; Jiang et al., 2013), como también ha sido registrado en el estrecho de Bransfield (Hofmann y Murphy, 2004). Sin embargo, la mayoría de los grandes enjambres de E. superba se distribuyen en aguas oceánicas, acercándose a zonas costeras durante el verano (Atkinson et al., 2008; Tarling et al., 2009).
Thysanoessa macrura es la especie de eufáusido con mayor consistencia en su distribución espacial en el océano Antártico, y puede llegar a sobrepasar en abundancia los enjambres de E. superba (Kittel y Stepnik, 1983; Daly y Macaulay, 1988; Nordhausen et al., 1994a). Thysanoessa macrura realiza cortas migraciones verticales en ciclo día-noche, concentrándose en la zona epipelágica de la columna de agua (Loeb y Shulenberger, 1987; Lancraft et al., 1989; Nordhausen, 1992), en el estrecho se le ha hallado en profundidades de hasta 120 m (Nordhausen et al., 1994b).
Alrededor de los 60° S Thysanoessa vicina y T. macrura presentan un traslape de rango de distribución geográfico, por lo que es posible que el tipo de Thysanoessa sp. registrado en este estudio corresponda a alguna de estas dos especies considerando que son morfológicamente similares y su identificación taxonómica tradicional depende de caracteres diagnósticos como el tamaño corporal de los adultos, que para T. vicina es de aproximadamente 16 mm y para T. macrura es de unos 30 mm. De acuerdo con Thiriot-Quiévreux et al. (1998), estas especies tienen un número diferente de cromosomas por lo que se recomienda implementar análisis de cariotipos para establecer con total certeza la potencial presencia de T. vicina en el estrecho.
En el presente estudio no fueron capturadas larvas de ninguna especie. Thysanoessa macrura desova al final de invierno y para la época de verano los individuos ya corresponderán a juveniles (Wallis et al., 2018). Sin embargo, E. crystallorophias y E. superba presentan la temporada de desove durante el verano (Zhou et al., 2002), por lo que la ausencia de estadios iniciales de desarrollo de estas dos especies durante el periodo de muestreo puede ser consecuencia de condiciones climáticas atípicas registradas en la península Antártica durante el primer semestre del 2015, que retardaron el ingreso de condiciones características del verano en la región (Blunden y Arndt, 2016).
Las proporciones de sexos registradas en el presente estudio fueron diferentes para cada una de las especies. Para el caso de E. superba se ha registrado que los machos crecen más rápido que las hembras (Kawaguchi et al., 2007), lo cual podría explicar la mayor tasa de machos con respecto a las hembras registrada en este estudio. Para E. crystallorophias la proporción de sexos fue cercana a uno, lo cual coincide con lo registrado por Pakhomov y Perissinoto (1996), quienes registraron esta misma proporción para esta especie en diferentes ambientes neríticos del continente Antártico durante verano. Para T. macrura se registraron únicamente hembras, posiblemente debido a los pocos individuos que fueron capturados de esta especie. Para esta especie se ha reportado una dominancia de las hembras, llegando a representar hasta 75 % de la población adulta durante verano (Nordhausen, 1992; Haraldsson y Siegel, 2014).
Pocos estudios han demostrado de manera específica una relación entre la temperatura o la salinidad y la abundancia de los eufáusidos en la Antártica (Weber et al., 1986; Trathan et al., 2003; Lee et al., 2013 Leonori et al., 2017). En una escala espacial de 1 - 100 km, las agregaciones de eufáusidos pueden depender de las condiciones batimétricas locales, por ejemplo, en zonas como el talud continental o al interior del estrecho, las mayores concentraciones de eufáusidos serán el resultado del efecto de las características topográficas sumado al patrón local de circulación que favorece los procesos de retención local (Zhou et al., 2002, 2006; Jiang et al., 2013). Esta podría ser una de las razones por las que en la estación 12 del presente estudio se registraron las mayores abundancias de eufáusidos, debido a su ubicación en un área protegida y con poca velocidad en las corrientes que se forman en la zona (Zhou et al., 2002; Torres-Parra et al., 2020).
Las condiciones termohalinas en la zona epipelágica del estrecho de Gerlache durante el verano austral de 2015 fueron similares a las registradas durante el verano austral de 1995 (Rodríguez et al., 2002), con mayor temperatura en el estrato de 1 - 10 m que en el estrato de 50 - 100 m, mientras que en el sector sur la temperatura fue similar en los primeros 100 m de profundidad. La baja salinidad superficial registrada en el sector norte de Gerlache, particularmente cerca de bahía Charlotte y bahía Hughes del sector norte de la costa de Danco, probablemente sea debida al aporte de agua de deshielo, condición que es frecuente durante el verano austral en las zonas costeras del continente antártico (Smith y Klinck, 2002; Eveleth et al., 2017), aunque las condiciones climáticas durante el periodo de muestreo promovieron condiciones de baja tasa de deshielo (Blunden y Arndt, 2016).
La distinción del conjunto de eufáusidos epipelágicos en los dos sectores del estrecho, podría estar influenciado por recursos tróficos distintos en cada sector. Los cambios en la temperatura y salinidad en la columna de agua pueden llegar a tener efectos importantes en el tipo de fitoplancton dominante (Mendes et al., 2018). Rodríguez et al. (2002) registraron que el sector sur estuvo dominado por ultraflagelados, mientras que el norte estuvo dominado por diatomeas microplanctónicas. Asimismo, Giraldo et al. (2019), reportaron diferencias en cuanto al tamaño de los copépodos presentes en los sectores norte y sur del estrecho, siendo los adultos del norte un orden de magnitud más pequeños que los del sector sur del estrecho. Esta condición podría estar modulando la estructura y composición del conjunto de eufáusidos en esta localidad, considerando además que E. superba ha presentado una preferencia por copépodos pequeños (Atkinson y Snÿder, 1997), lo cual podría explicar la presencia exclusiva de esta especie en el sector norte del Estrecho Gerlache
AGRADECIMIENTOS
A Melissa Moreno, Isabel Cristina Calle, Andrés Cuellar y Juan José Gallego por su apoyo en la separación de las muestras biológicas. A la tripulación del buque “ARC 20 de Julio” por su valiosa colaboración durante el desarrollo del muestreo. Agradecimientos especiales al Vicealmirante Juan Manuel Soltau Ospina, Director General Marítimo. Este trabajo fue cofinanciado por el Programa Antártico Colombiano, la Armada Nacional de la República de Colombia, la Dirección General Marítima, la Comisión Colombiana del Océano, la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, la Universidad del Valle y el programa Jóvenes Investigadores e Innovadores de Colciencias convocatoria 706-2015 del cual fue beneficiaria la primera autora.
REFERENCIAS
Antezana, T., N. Aguirre y R. Bustamante. 1976. Clave ilustrada y distribución latitudinal de los eufáusidos del océano Antártico (Crustacea, Zooplancton). Ser Cient. Inst. Antárt. Chil., 4: 53-68. [ Links ]
Atkinson, A. and R. Snÿder, 1997. Krill-copepod interactions at South Georgia, Antarctica, I. Omnivory by Euphausia superba. Mar. Ecol. Prog. Ser., 160: 63-76. [ Links ]
Atkinson. A., V. Siegel, E.A. Pakhomov, P. Rothery, V. Loeb, R.M. Ross, L.B. Quetin, K. Schmidt, P. Fretwell, E.J. Murphy, G.A. Tarling and A.H. Fleming. 2008. Oceanic circumpolar habitats of Antarctic krill. Mar. Ecol. Prog. Ser., 362: 1-23 [ Links ]
Baker, A. de C., B.P. Boden and E. Brinton. 1990. A practical guide to the euphausiids of the world. Brit. Mus. (Nat. Hist.), London. 96 p. [ Links ]
Blunden, J. and D.S. Arndt. 2016. State of the climate in 2015. Bull. Am. Meteorol. Soc., 97: Si-S275. [ Links ]
Brinton, E., M.D. Ohman, A.W. Townsend, M.D. Knight and A.L. Bridgeman. 2000. Euphausiids of the world ocean, CD-ROM. Windows version 1.0 ed. (2000). UNESCO Publishing and ETI (Expert Center for Taxonomic Identification, University of Amsterdam). [ Links ]
Cavan, E.L., A. Belcher, A. Atkinson, S.L. Hill, S. Kawaguchi, S. McCormack, B. Meyer, S. Nicol, L. Ratnarajah, K. Schmidt, D.K. Steinberg, G.A. Tarling and P.W. Boyd. 2019. The importance of Antarctic krill in biogeochemical cycles. Nat. Commun., 10(1): 1-13. [ Links ]
Clarke, K.R. 1993. Non-parametric multivariate analyses of changes in community structure. Aust. J. Ecol., 18: 117-143. [ Links ]
Clarke, K. R. and M. Ainsworth. 1993. A method of linking multivariate community. Mar. Ecol. Prog. Ser., 92: 205-219. [ Links ]
Clarke, K.R. and R.M. Warwick. 2001. Change in marine communities: an approach to statistical analysis and interpretation. Primer-E. Plymouth, UK. [ Links ]
Cleary, A.C., E.G. Durbin, M.C. Casas and M. Zhou. 2016. Winter distribution and size structure of Antarctic krill Euphausia superba populations in-shore along the West Antarctic Peninsula. Mar. Ecol. Progr. Ser., 552: 115-129. [ Links ]
Cleary, A.C, E.G Durbin and M.C. Casas. 2018. Feeding by Antarctic krill Euphausia superba in the West Antarctic Peninsula: differences between fjords and open waters. Mar. Ecol. Progr. Ser., 595: 39-54. [ Links ]
Conroy, J.A., D.K. Steinberg, P.S. Thibodeau and O. Schofield. 2020. Zooplankton diel vertical migration during Antarctic summer. Deep Sea Res. Part I Oceanogr. Res. Pap., 103324. [ Links ]
Daly, K.M. and M.C. Macaulay. 1988. Abundance and distribution of krill in the ice edge zone of the Weddell Sea, austral spring 1983. Deep-Sea Res. Part I Oceanogr. Res. Pap., 35: 21-41. [ Links ]
Daly, K.M . and J.J. Zimmermman. 2004. Comparisons of morphology and neritic distributions of Euphausia crystallorophias and Euphausia superba furcilia during autumn and winter west of the Antarctic Peninsula. Polar Biol., 28: 72-81. [ Links ]
Eveleth, R., N. Cassar, R.M. Sherrell, H. Ducklow, M.P. Meredith, H.J. Venables, Y. Lin and Z. Li. 2017. Ice melt influence on summertime net community production along the Western Antarctic Peninsula. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 139: 89-102. [ Links ]
Everson, I. 1987 Some aspects of the small scale distribution of E. crystallorophias. Polar Biol., 8: 9-15. [ Links ]
Everson, I. 2000. Role of krill in marine food webs: the Southern Ocean. 194-201. In: Everson, I. (Ed.) Krill: biology, ecology and fisheries. Blackwell Science, Oxford. 373 p. [ Links ]
García, M.A., C.G. Castro, A.F. Ríos, M.D. Doval, G. Rosón, D. Gomis and O. López. 2002. Water masses and distribution of physico-chemical properties in the Western Bransfield Strait and Gerlache Strait during Austral summer 1995/96. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 49: 585-602. [ Links ]
Gibbons, M., V. Spiridonov and G. Tarling.1999. Euphausiacea:1241-1279. En: Boltovskoy, D (Ed.) South Atlantic zooplankton. Backhuys Publishers, The Netherlands. 1706 p. [ Links ]
Giraldo, A., M.I. Críales-Hernández, M. Jerez-Guerrero y D.F. Mojica-Moncada. 2019. Biomasa del mesozooplancton y ensamblaje de copépodos epipelágicos en el estrecho de Gerlache (Antártica) durante el verano austral de 2015. Bol. Invest. Mar. Costeras. 48(1): 9-26. [ Links ]
Gleiber, M.R., D.K. Steinberg and H.W. Ducklow. 2012. Time series of vertical flux of zooplankton fecal pellets on the continental shelf of the western Antarctic Peninsula. Mar. Ecol. Progr. Ser., 471: 23-36. [ Links ]
González, H. E., G. Daneri, J.L. Iriarte, B. Yannicelli, E. Menschel, C. Barría, S. Pantoja and L. Lizárraga. 2009. Carbon fluxes within the epipelagic zone of the Humboldt Current System off Chile: The significance of euphausiids and diatoms as key functional groups for the biological pump. Progr. Oceanogr., 83(1-4): 217-227. [ Links ]
Haraldsson, M. and V. Siegel. 2014. Seasonal distribution and life history of Thysanoessa macrura (Euphausiacea, Crustacea) in high latitude waters of the Lazarev Sea, Antarctica. Mar. Ecol. Prog. Ser., 495: 105-118. [ Links ]
Hernández-León, S., A. Portillo-Hahnefeld, C. Almeida, P. Bécognée and I. Moreno. 2001. Diel feeding behaviour of krill in the Gerlache Strait, Antarctica. Mar. Ecol. Progr. Ser., 223: 235-242. [ Links ]
Hofmann, E.E. and E.J. Murphy. 2004. Advection, krill, and Antarctic marine ecosystems. Antarct Sci., 16: 487-499 [ Links ]
Hopkins, T.L. 1971. Zooplankton standing crop in the Pacific Sector of the Antarctic. 347-362. In: Llano G.W. and I.E. Wallen (Eds.) Biology of the Antarctic seas IV. Antarct. Res. Ser., 362 p. [ Links ]
Hosie, G.W., T. Ikeda and M. Stolp. 1988. Distribution, abundance and population structure of the Antarctic krill (Euphausia superba, Dana) in the Pridz Bay Region, Antarctica. Polar Biol., 8: 213-224. [ Links ]
Hudson, J.M., D. Steinberg, T. Sutton, J. Graves and R. Latour. 2014. Myctophid feeding ecology and carbon transport along the northern Mid-Atlantic Ridge. Deep-Sea Res. Part I Oceanogr. Res. Pap., 93: 104-116. [ Links ]
Huntley, M. and E. Brinton. 1991. Mesoscale variation in growth and early development of Euphausia superba Dana in the western Bransfield Strait region. Deep-Sea Res. Part I Oceanogr. Res. Pap., 38(8-9): 1213-1240. [ Links ]
Jiang, M., M.A. Charette, C.I, Measures, Y. Zhu and M. Zhou. 2013. Seasonal cycle of circulation in the Antarctic Peninsula and the off-shelf transport of shelf waters into southern Drake Passage and Scotia Sea. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 90: 15-30. [ Links ]
Ju, S.J. and H.R. Harvey. 2004. Lipids as markers of nutritional condition and diet in the Antarctic krill Euphausia superba and Euphausia crystallorophias during austral winter. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 51(17-19): 2199-2214. [ Links ]
Kawaguchi, S., T. Yoshida, L. Finley, P. Cramp and S. Nicol. 2007. The krill maturity cycle: a conceptual model of the seasonal cycle in Antarctic krill. Polar Biol., 30: 689-698. [ Links ]
Kittel, W. and R. Stepnlk. 1983. Distribution of Euphausia crystallorophias, E frigida, E. triacantha and Thysanoessa macrura (Crustacea, Euphausiacea) in the southern Drake Passage and Bransfield Strait in February and March 1981. Pol. Polar Res., 4: 7-19. [ Links ]
Kohlbach, D., B.A. Lange, M. Graeve, M. Vortkamp and H. Flores. 2019. Varying dependency of Antarctic euphausiids on ice algae-and phytoplankton-derived carbon sources during summer. Mar. Biol., 166(6): 79. [ Links ]
La, H.S., H. Lee, S. Fielding, D. Kang, H.K. Ha, A. Atkinson, J. Park, V. Siegel, S.H. Lee and H.C. Shin. 2015. High density of ice krill (Euphausia crystallorophias) in the Amundsen Sea coastal polynya, Antarctica. Deep-Sea Res. Part I Oceanogr. Res. Pap., 195: 75-84. [ Links ]
Lancraft, T.M., J.J. Torres and T.L. Hopkins. 1989. Micronekton and macrozooplankton in the open waters near Antarctic ice edge zones (AMERIEZ 1983 and 1986). Polar Biol., 9: 225-233. [ Links ]
Lawson, G.L., P-H. Wiebe, C.J. Ashjian and T.K. Stanton. 2008. Euphausiid distribution along the Western Antarctic Peninsula—Part B: distribution of euphausiid aggregations and biomass, and associations with environmental features. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 55(3-4): 432-454. [ Links ]
Lee, D.B., K.H. Choi, H.K. Ha, E.J. Yang, S.H. Lee, S. Lee and H.C. Shin. 2013. Mesozooplankton distribution patterns and grazing impacts of copepods and Euphausia crystallorophias in the Amundsen Sea, West Antarctica, during austral summer. Polar Biol., 36: 1215-1230. [ Links ]
Leonori, I., A. De Felice, G. Canduci, I. Costantini, I. Biagiotti, G. Giuliani and G. Budillon. 2017. Krill distribution in relation to environmental parameters in mesoscale structures in the Ross Sea. J. Mar. Syst., 166: 159-171. [ Links ]
Loeb, V. and J. Santora. 2015. Climate variability and spatiotemporal dynamics of five Southern Ocean krill species. Progr. Oceanogr., 134: 93-122. [ Links ]
Loeb, V. J. and E. Shulenberger. 1987. Vertical distributions and relations of euphausiid populations off Elephant Island, March 1984. Polar Biol., 7(6): 363-373. [ Links ]
Loeb, V ., E. Hofmann, J. Klinck, O. Holm-Hansen and W. White. 2009. ENSO and variability of the Antarctic Peninsula pelagic marine ecosystem. Antarctic Sci., 21(2): 135-148. [ Links ]
Marrari, M., K.L. Daly, A. Timonin and T. Semenova. 2011. The zooplankton of Marguerite Bay, Western Antarctic Peninsula - Part I: Abundance, distribution and population response to variability in environmental conditions. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 58: 1599-1613. [ Links ]
Mauchline, J. and L.R. Fisher. 1969. The biology of euphausiids. Adv. Mar. Biol., 7: 1-454. [ Links ]
Melnikov, I.A. and V.A. Spiridonov. 1996. Antarctic krill under perennial sea ice in the western Weddell Sea. Antarc. Sci., 8(4): 323-329. [ Links ]
Mendes, C.R.B., V.M. Tavano, T.S. Dotto, R. Kerr, M.S. de Souza, C.A.E. García and E.R. Secchi. 2018. New insights on the dominance of cryptophytes in Antarctic coastal waters: a case study in Gerlache Strait. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 149: 161-170. [ Links ]
Murase, H., K. Matsuoka, T. Ichii and S. Nishiwaki. 2002. Relationship between the distribution of euphausiids and baleen whales in the Antarctic examined using JARPA data. Polar Biol., 25(2): 135-145. [ Links ]
Nicol, S. 2006. Krill, currents, and sea ice: Euphausia superba and its changing environment. Bioscience, 56(2): 111-120. [ Links ]
Nicol, S. and J. Foster. 2016. The fishery for Antarctic krill: its current status and management regime: 387-422. In: Siegel, V. (Ed.). Biology and ecology of Antarctic krill. Springer, Cham.441 p. [ Links ]
Nicol S, J. Foster and S. Kawaguchi. 2012. The fishery for Antarctic krill - recent developments. Fish Fish., 13(1): 30-40 [ Links ]
Nordhausen, W. 1992. Distribution and growth of larval and adult Thysanoessa macrura (Euphausiacea) in the Bransfield Strait Region, Antarctica. Mar. Ecol. Progr. Ser., 83(2): 185-196. [ Links ]
Nordhausen, W. 1994a. Winter abundance and distribution of Euphausia superba, E. crystallorophias, and Thysanoessa macrura in Gerlache Strait and Crystal Sound, Antarctica. Mar. Ecol. Progr. Ser., 109: 131-142. [ Links ]
Nordhausen, W. 1994b. Distribution and diel vertical migration of the euphausiid Thysanoessa macrura in Gerlache Strait, Antarctica. Polar Biol., 14: 219-229. [ Links ]
Nowacek, D., A. Friedlaender, P. Halpin, E. Hazen, D. Johnston, A. Read, B. Espinasse, M. Zhou and Y. Zhu. 2011. Super-aggregations of krill and humpback whales in Wilhelmina Bay, Antarctic Peninsula. PLoS One, 6(4): 1-5. [ Links ]
Pakhomov, E. A . and R. Perissinotto. 1996. Antarctic neritic krill Euphausia crystallorophias: spatio-temporal distribution, growth and grazing rates. Deep-Sea Res. Part I Oceanogr. Res. Pap., 43(1): 59-87. [ Links ]
Pakhomov, E .A., R. Perissinotto and P.W. Froneman. 1998. Abundance and trophodynamics of Euphausia crystallorophias in the shelf region of the Lazarev Sea during austral spring and summer. J. Mar Syst., 17: 313-324. [ Links ]
Parker, M., J. Donnelly and J. Torres. 2011. Invertebrate micronekton and macrozooplankton in the Marguerite Bay region of the Western Antarctic Peninsula. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 58: 1580-1598. [ Links ]
Piatkowski, U. 1985. Distribution, abundance and diurnal migration of macrozooplankton in Antarctic surface waters. Meeresforschung/Rep. Mar. Res., 30: 264-279. [ Links ]
Piatkowski, U. 1989. Macrozooplankton communities from Weddell Sea surface waters, Antarctica. Pesq. Antartica Bras., 1(1): 1-10. [ Links ]
Postel, L., H. Fock and W. Hagen. 2000. Biomass and abundance. 83 -192. In: Harris, R. P., P.H. Weibe, J. Lenz, H. R. Skjoldal and M. Huntley. ICES Zooplankton methodology manual. Academic, London. 684 p. [ Links ]
Reiss, C.S., A. Cossio, J.A. Santora, K.S. Dietrich, A. Murray, B.G. Mitchell, J. Walsh, E. L. Weiss, C. Gimpel, C.D. Jones and G.M. Watters. 2017. Overwinter habitat selection by Antarctic krill under varying sea-ice conditions: implications for top predators and fishery management. Mar. Ecol. Progr. Ser., 568: 1-16. [ Links ]
Rodríguez, J., F. Jiménez-Gómez, J.M. Blanco and F.L. Figueroa. 2002. Physical gradients and spatial variability of the size structure and composition of phytoplankton in the Gerlache Strait (Antarctica). Deep-Sea Res. Part II. Top. Stud. Oceanogr., 49: 693-706. [ Links ]
Rogers, A.D., N.M. Johnson, E.J. Murphy and A. Clarke. 2012. Antarctic ecosystems: an extreme environment in a changing world. Wiley, Noida. 756 p. [ Links ]
Rombolá, E., E. Marschoff and N. Coria. 2012. Analysis of the sources of variance in the mean size of krill consumed by Chinstrap and Adélie penguins at South Orkney Islands. Polar Biol., 35: 1601-1606. [ Links ]
Sala, A., M. Azzali and A. Russo. 2002. Krill of the Ross Sea: distribution, abundance and demography of Euphausia superba and Euphausia crystallorophias during the Italian Antarctic Expedition (January-February 2000). Sci. Mar., 66(2): 123-133. [ Links ]
Santora, J.A., R.R. Veit, C.S. Reiss, I.D. Schroeder and M. Mangel. 2017. Ecosystem oceanography of seabird hotspots: environmental determinants and relationship with Antarctic krill within an important fishing ground. Ecosystems, 20(5): 885-903. [ Links ]
Schmidt, K., A. Atkinson, S. Steigenberger, S. Fielding, M.C. Lindsay, D.W. Pond, G.A. Tarling, C.S. Allen, S. Nicol and E.P. Achterberg. 2011. Seabed foraging by Antarctic krill: implications for stock assessment, bentho-pelagic coupling, and the vertical transfer of iron. Limnol. Oceanogr., 56(4): 1411-1428. [ Links ]
Schmidt, K , C. Schlosser, A. Atkinson, S. Fielding, H.J. Venables, C.M. Waluda and E.P. Achterberg. 2016. Zooplankton gut passage mobilises lithogenic iron for ocean productivity. Curr. Biol., 26: 2667-2673. [ Links ]
Schnack-Schiel, S. B. and A. Mujica. 1994. The zooplankton of the Antarctic Peninsula region. 79-92. In: El-Sayed, S. Z. (Ed.). Southern Ocean Ecology: the BIOMASS Perspective. Cambridge University Press. Cambridge. 391 p. [ Links ]
Seyboth, E., S. Botta, C.R.B. Mendes, J. Negrete, L. Dalla-Rosa and E.R. Secchi. 2018. Isotopic evidence of the effect of warming on the northern Antarctic Peninsula ecosystem. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 149: 218-228. [ Links ]
Siegel, V. 2016. Introducing Antarctic krill Euphausia superba Dana, 1850: 1-19. In: Siegel, V. (Ed.) Biology and ecology of Antarctic krill. Advances in Polar Ecology. Springer, Cham. 441 p. [ Links ]
Siegel, V. and U. Harm. 1996. The composition, abundance, biomass and diversity of the epipelagic zooplankton communities of the southern Bellingshausen Sea (Antarctic) with special reference to krill and salps. Arch. Fish. Mar. Res., 44(1/2): 115-139. [ Links ]
Siegel, V . and J.L. Watkins. 2016. Distribution, biomass and demography of Antarctic krill, Euphausia superba. 21-100. In: Siegel,V. (Ed.). Biology and ecology of Antarctic krill. Springer, Cham. 441 p. [ Links ]
Steinberg, D.K., K.E. Ruck, M.R. Gleiber, L.M. Garzio, J.S. Cope, K.S. Bernard, S.E. Stammerjohn, O.M.E. Schofield, B.Q. Langdon and R.M. Ross. 2015. Long-term (1993-2013) changes in macrozooplankton off the Western Antarctic Peninsula. Deep- Sea Res. Part I Oceanogr. Res. Pap., 101: 54-70. [ Links ]
Stone, G. and W. Hamner. 1988. Humpback whales Megaptera novaeangliae and southern right whales Eubalaena australis in the Gerlache Strait, Antarctica. Polar Rec., 24(148): 15-20. [ Links ]
Tarling, G.A., T. Klevjer, S. Fiedling, J. Watkins, A. Atkinson, E. Murphy, R. Korb, M. Whitehouse and R. Leaper. 2009. Variability and predictability of Antarctic krill swarm structure. Deep-Sea Res. Part I Oceanogr. Res. Pap., 56: 1994-2012. [ Links ]
Thiriot-Quiévreux, C., A. Leitāo and J. Cuzin-Roudy. 1998. Chromosome diversity in Mediterranean and Antarctic euphausiid species (Euphausiacea). J. Crust. Biol., 18(2): 290-297. [ Links ]
Thomas, P.G. and K. Green. 1988. Distribution of Euphausia crystallorophias within Prydz Bay and its importance to the inshore marine ecosystem. Polar Biol., 8(5): 327-331. [ Links ]
Torres-Parra, R.R., A.L. Caicedo-Laurido and J.D. Iriarte-Sánchez. 2020. Hydrographic conditions during two austral summer situations (2015 and 2017) in the Gerlache and Bismarck straits, northern Antarctic Peninsula. Deep- Sea Res. Part I Oceanogr. Res. Pap., 161: 103278. [ Links ]
Trathan, P. N . and S.L. Hill. 2016. The importance of krill predation in the Southern Ocean: 321-350. In: Siegel, V. (Ed.) The biology and ecology of Antarctic krill. Springer, Cham. 441 p. [ Links ]
Trathan, P. N., A.S. Brierley, M.A. Brandon, D.G. Bone, C. Goss, S.A. Grant, E.J. Murphy and J.L. Watkins. 2003. Oceanographic variability and changes in Antarctic krill (Euphausia superba) abundance at South Georgia. Fish. Oceanogr., 12(6): 569-583. [ Links ]
Varela, M., E. Fernández and P. Serret. 2002. Size-fractionated phytoplankton biomass and primary production in the Gerlache and south Bransfield Straits (Antarctic Peninsula) in Austral summer 1995-1996. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 49(4): 749-768. [ Links ]
Wallis, J.R., S. Kawaguchi and K.M. Swadling. 2018. Sexual differentiation, gonad maturation, and reproduction of the Southern Ocean euphausiid Thysanoessa macrura (Sars, 1883) (Crustacea: Euphausiacea). J. Crust. Biol., 38(1): 107-118. [ Links ]
Ward, P., S. Grant, M. Brandon, V. Siegel, V . Sushin, V. Loeb and H. Griffiths. 2004. Mesozooplankton community structure in the Scotia Sea during the CCAMLR 2000 survey: January - February 2000. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 51: 1351-1367. [ Links ]
Weber, L.H., S.Z. El-Sayed and I. Hampton. 1986. The variance spectra of phytoplankton, krill and water temperature in the Antarctic Ocean south of Africa. Deep-Sea Res. Part I Oceanogr. Res. Pap., 33: 1327-1343 [ Links ]
Wiebe, P., C. Ashjian, G. Lawson, A. Piñones and N. Copley. 2011. Horizontal and vertical distribution of euphausiid species on the Western Antarctic Peninsula U.S. GLOBEC Southern Ocean study site. Deep-Sea Res. Part II. Top. Stud. Oceanogr., 58: 1630-1651. [ Links ]
Yamanaka, I. 1983. Interaction among krill, whales and other animals in the Antarctic ecosystem. Mem. Natl. Inst. Polar Res., Spec. is., 27: 220-232. [ Links ]
Zhou, M., P.P. Nieler and J-H. Hu. 2002. Surface currents in the Bransfield and Gerlache Straits, Antarctica. Deep-Sea Res. Part I Oceanogr. Res. Pap., 49: 267-280. [ Links ]
Zhou, M ., P.P. Nieler, Y. Zhu and R.D. Dorland. 2006. The western boundary current in the Bransfield Strait, Antarctica. Deep-Sea Res. Part I Oceanogr. Res. Pap., 53(7), 1244-1252. [ Links ]
Recibido: 03 de Octubre de 2019; Aprobado: 05 de Octubre de 2020











 texto en
texto en