Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 supl.1 Santa Marta dic. 2021 Epub 13-Dic-2021
https://doi.org/10.25268/bimc.invemar.2021.50.suplesp.967
Artículos de Investigación
Moluscos bentónicos recolectados en la Antártida occidental durante las expediciones “Caldas”, “Almirante Padilla” y “Almirante Campos” en los veranos australes de 2014-2015, 2016-2017 y 2018-2019
1Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis- Invemar, Programa de Biodiversidad y Ecosistemas Marinos- BEM. Calle 25 No. 2-55, Playa Salguero, Santa Marta, Colombia. adriana.osorno@invemar.org.co
2Universidad del Valle, Departamento de Biología, Facultad de Ciencias Naturales y Exactas, Instituto de Ciencias del Mar, INCIMAR. Ciudad Universitaria Meléndez, Calle 13 No. 100-00, Cali, Colombia. jaime.cantera@correounivalle.edu.co
This research is part of the results of the three first expeditions of Colombia to West Antarctica and it focused on the systematics and taxonomic diversity of the benthic community of molluscs collected between 5 and 400 m deep. The Sampling sites where mollusks were collected were located along the Gerlache and Bransfield straits, around the Palmer Archipelago and the South Shetland Islands, adjacent to the Antarctic Peninsula. The list of identified species that are deposited in the Museum of Marine Natural History of Colombia - Makuriwa, of the Institute of Marine and Coastal Research “José Benito Vives de Andréis” -Invemar, is presented. This inventory consisted of 15 specimens distributed in 10 taxa, of which 7 were shelled gastropods (including 5 microgastropods) and 3 were bivalves. Four microgastropods were placed in greater taxonomic categories due to the low knowledge of these taxa in the region (Anatoma sp., Cingulopsoidea sp., Truncatelloidea sp. and Eatoniella sp.). The other gastropod species (3) were Margarella antarctica, Prosipho turritus and Nacella concinna. The bivalves found were Philobrya sublaevis, Adacnarca nitens and Thracia meridionalis. The identified species have previously been recorded in West Antarctica. Some of them, like the bivalves, show a circumantarctic distribution. Nacella concinna was the most abundant taxon. In coherence with the general objective of the “BioGerlache-Antarctica” project, the results generate contributions to the biological inventories of Antarctica, contributing to expand the information to define possible conservation areas in the future.
KEYWORDS: Mollusca; West Antarctica; Gerlache Strait; Bransfield Strait; Southern Ocean.
La presente investigación hace parte de los resultados de las tres primeras expediciones de Colombia a la Antártida occidental y se enfocó en la sistemática y diversidad taxonómica de la comunidad bentónica de moluscos recolectados entre 5 y 400 m de profundidad. Las estaciones de muestreo se ubicaron en los estrechos de Gerlache y Bransfield, alrededor del archipiélago Palmer y las islas Shetland del Sur, adyacentes a la península Antártica. Se presenta el listado de especies identificadas que se encuentran depositadas en el Museo de Historia Natural Marina de Colombia -Makuriwa, del Instituto de Investigaciones Marinas y Costeras José Benito Vives de Andréis -Invemar. Este inventario constó de 15 ejemplares distribuidos en 10 taxa, de los cuales 7 fueron gasterópodos con concha (incluidos 5 microgasterópodos) y 3 fueron bivalvos. Cuatro microgasterópodos fueron ubicados en categorías taxonómicas superiores a especie debido al bajo conocimiento de estos taxa en la región (Anatoma sp., Cingulopsoidea sp., Truncatelloidea sp. y Eatoniella sp.). Los demás gasterópodos (3) correspondieron a Margarella antarctica, Prosipho turritus y Nacella concinna. Los bivalvos encontrados fueron Philobrya sublaevis, Adacnarca nitens y Thracia meridionalis. Las especies identificadas se han registrado previamente en la Antártida occidental. Algunas, como los bivalvos, presentan una distribución circumantártica. Nacella concinna fue el taxón más abundante. En coherencia con el objetivo general del proyecto “BioGerlache-Antártica”, los resultados generan aportes a los inventarios biológicos de la Antártida, contribuyendo a ampliar la información para definir a futuro posibles áreas de conservación.
PALABRAS CLAVE: Mollusca; Antártida occidental; Estrecho de Gerlache; Estrecho de Bransfield; Océano Austral.
INTRODUCCIÓN
El proceso de radiación adaptativa de los moluscos ha sido extenso. La evolución divergente de este phylum, como producto de procesos de selección natural y mutaciones adquiridas a lo largo de una historia geológica que data desde el precámbrico, hace 550 millones de años, ha llevado a los moluscos a colonizar exitosamente nichos ecológicos desde los trópicos hasta los mares polares (Parkhaev, 2008, 2017; Haszprunar y Wanninger, 2012; Castillo-Rodríguez, 2014; Vinther, 2014, 2015; MolluscaBase, 2019; Wanninger y Wollesen, 2019). La presente investigación, producto de las primeras expediciones de Colombia a la Antártida, ha trascendido las fronteras de los mares tropicales del Pacífico y Caribe colombiano para ampliar la capacidad científica del país hasta los mares del océano Austral.
Colombia se adhirió al Tratado Antártico en 1989 y posteriormente, en 1991 firmó el Protocolo al Tratado Antártico sobre Protección del Medio Ambiente, también conocido como Protocolo de Madrid (Secretariat of the Antarctic Treaty, 2018). Frente a dicho compromiso se creó el “Programa Antártico Colombiano” que dio origen a la primera expedición científica de Colombia a la Antártida, denominada “Expedición Caldas” durante el verano austral 2014-2015 a bordo del buque “ARC 20 de Julio”. En dicha expedición participó el Instituto de Investigaciones Marinas y Costeras “José Benito Vives de Andreis”-Invemar, mediante un proyecto concebido inicialmente con un enfoque oceanográfico y climático. En 2015 Invemar continuó implementando la agenda científica antártica de Colombia con tres frentes de trabajo enfocados hacia cambio climático, conservación y biodiversidad. De esta forma, el instituto también participó en las expediciones “Almirante Padilla” (verano austral 2016-2017) y “Almirante Campos” (2018-2019). Las dos últimas expediciones mencionadas estuvieron enmarcadas dentro del proyecto Biodiversidad y Condiciones Oceanográficas del Estrecho de Gerlache “BioGerlache-Antártica”, cuyo objetivo es la caracterización de la fauna antártica del estrecho y sitios aledaños, con el fin de crear una línea base de conocimiento biológico del área, que genere nuevos aportes a los inventarios biológicos de la Antártida y contribuya a ampliar la información para definir posibles áreas de conservación en la región. La presente investigación es uno de los productos de las expediciones mencionadas anteriormente y aporta información al objetivo general del proyecto “BioGerlache-Antártica” con un enfoque en la diversidad de la comunidad bentónica de moluscos recolectados entre 5 y 400 m de profundidad.
A nivel histórico, como resultado de diferentes expediciones llevadas a cabo desde finales del siglo XIX por parte de países pioneros en la exploración del continente antártico, se comenzaron a publicar trabajos relacionados con el área de estudio y la malacofauna local (Smith, 1885; Watson, 1886; Pelseneer, 1903; Lamy, 1906; Strebel, 1908; Powell, 1951; Soot-Ryen, 1951; Dell, 1964; Hain, 1990). Otros trabajos más recientes tienen un enfoque más biogeográfico (Linse et al., 2006; Aldea y Troncoso, 2008; Aldea et al., 2009; González-Wevar et al., 2017) o taxonómico, basado en revisiones de grupos específicos de moluscos que incluyen filogenia molecular (Oliver y Picken, 1984; Criscione y Ponder, 2013; Urcola y Zelaya, 2017; González-Wevar et al., 2018). De esta forma, se presenta un listado de los taxa de moluscos identificados en el área de estudio (gasterópodos con concha y bivalvos); su sistemática, distribución y algunos caracteres.
ÁREA DE ESTUDIO
Las estaciones de muestreo en donde fueron recolectados los moluscos se ubicaron alrededor de las islas del archipiélago Palmer y de las islas Shetland del Sur, en los estrechos de Gerlache y Bransfield respectivamente, adyacentes a la costa noroeste de la península Antártica (océano Austral, Antártida occidental) (Figura 1). El ambiente físico en la plataforma de la península Antártica occidental está fuertemente influenciado por la Corriente Circumpolar Antártica que fluye a lo largo de la ladera de la plataforma del continente antártico y transporta agua relativamente más cálida y rica en nutrientes que las aguas circundantes; también por las aguas frías que inundan el norte del estrecho de Bransfield desde el mar de Weddell y por una extensa red de glaciares y plataformas de hielo; además, por una fuerte variabilidad estacional a interanual en la formación de hielo marino y en las interacciones aire-mar, con modulación significativa de fenómenos climáticos como ‘El Niño-Oscilación del Sur’ y el ‘Modo Anular del Sur’ u oscilación Antártica (Moffat y Meredith, 2018).
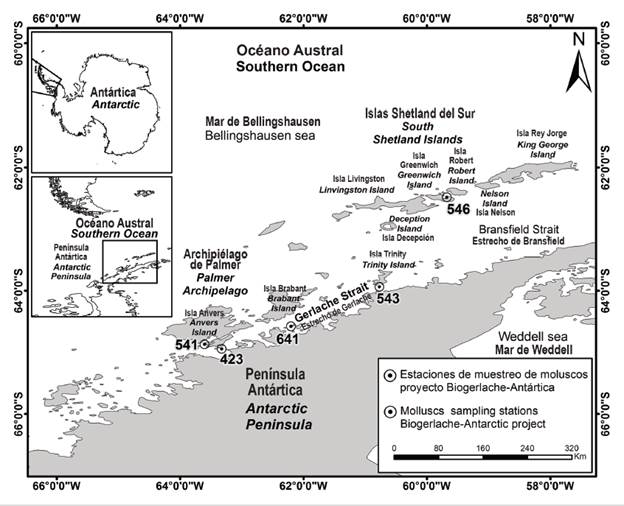
Figura 1 Área de estudio y estaciones de colecta de moluscos. Elaborado en el Laboratorio de Servicios de Información - Labsis - Invemar.
El estrecho de Bransfield es un mar semicerrado ubicado entre el archipiélago de las islas Shetland del Sur y la costa de la península Antártica. La extensión del estrecho es de aproximadamente 50000 km2 y se puede dividir en tres cuencas principales, separadas entre sí por profundidades mínimas del suelo submarino menores de 1000 m. La cuenca occidental del estrecho de Bransfield está conectada con el mar vecino de Bellingshausen a través de pasajes que existen entre las islas Shetland del Sur más occidentales y a través del estrecho de Gerlache; y está también conectada al pasaje de Drake a través del estrecho de Boyd principalmente (García et al., 2002). Desde el punto de vista hidrográfico, el estrecho de Bransfield se define mejor como una zona de transición entre el mar de Bellingshausen y el mar de Weddell. Las cuencas de este estrecho están ocupadas principalmente por masas de agua cuyas propiedades son controladas por las características de los flujos de los mares adyacentes, un flujo cálido y relativamente bajo en salinidad del mar de Bellingshausen (típicamente 0,5-3,0 °C y 33,1-33,9 en verano), y un flujo relativamente salado de la superficie del mar de Weddell y aguas profundas (generalmente con temperaturas negativas y salinidad que varía de 34,1 a 34,6 en verano) (García et al., 2002).
El estrecho de Gerlache se encuentra entre la costa occidental de la península Antártica y el archipiélago Palmer. El agua fluye desde el mar de Bellingshausen hacia el estrecho de Gerlache a través de múltiples vías, pasando sobre umbrales cuyas profundidades son inferiores a 400 m, lo cual impone una restricción importante al agua profunda circumpolar. La mayor parte de esta capa de agua profunda circumpolar se pierde y es reemplazada por aguas zonales transitorias con influencia del mar de Weddell. En la superficie, se observa una transición más nítida de agua superficial antártica a aguas zonales transitorias con influencia del mar de Bellingshausen. Este último tipo de agua mencionada en el estrecho de Gerlache es más fría y más dulce que en el estrecho de Bransfield. De vuelta a las capas profundas, se observa una temperatura máxima aislada (θ > 0,2 °C) cerca del extremo oriental del estrecho de Gerlache a profundidades del orden de 200 m (García et al., 2002). Los patrones de circulación en los estrechos de Bransfield y Gerlache cambian estacionalmente (Zhou et al., 2002). Las aguas poco profundas y las bahías del sudoeste de los estrechos de Bransfield y Gerlache son áreas muy productivas para la diversidad de biota en muchos niveles tróficos (Huntley et al., 1990; Brinton, 1991; Zhou et al., 1994).
MATERIALES Y MÉTODOS
La recolección de moluscos bentónicos (macro y meiofauna) en el área de estudio se llevó a cabo durante tres veranos australes (2014-2015, 2016-2017 y 2018-2019) en tres expediciones científicas a la Antártida a bordo del buque ARC 20 de Julio de la Armada de la República de Colombia. En cada estación la toma de muestras se hizo mediante lanzamientos de una draga Shipek de 3 L (0,04 m2) (Tabla 1). A partir de la caída libre de la draga, la cual se cierra mecánicamente al contacto con el fondo, se tomaron aproximadamente 500 g de sedimento marino para el cual se separó la epifauna. Dichas submuestras (500 g) se tomaron ya que el resto del material proveniente de la draga se destinó para el desarrollo de otros proyectos de investigación en el marco de la Agenda Científica Antártica de Colombia (CCO y CTN AA, 2014).
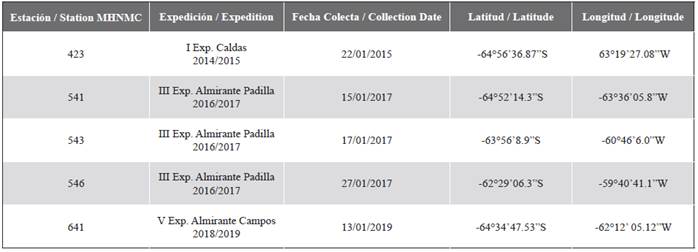
Tabla 1 Estaciones de muestreo de moluscos, nombre de las expediciones científicas de Colombia a la Antártida, fechas de colecta y coordenadas.
Una vez obtenidas las muestras de sedimento, éstas se introdujeron en bolsas plásticas gruesas con solución narcotizante (70 g de cloruro de magnesio/1 L agua) que se dejó actuar durante 15 minutos. Se añadió una solución de formalina al 10 % preparada con agua de mar microfiltrada (tamiz de 40 μm) y neutralizada con bórax (pH= 7,2).
Además de los organismos bentónicos colectados mediante draga Shipek, también se obtuvieron otros catalogados como epifauna, los cuales correspondieron a especímenes adheridos al mareógrafo (utilizado para medir o registrar las mareas). Todas las muestras fueron debidamente rotuladas y transportadas al laboratorio óptico del Invemar (Santa Marta, Colombia), en donde se utilizó etanol al 96 % para conservarlas.
La identificación de los especímenes se llevó a cabo mediante examen visual de su morfología. Se utilizó un estéreo-microscopio triocular marca Leica S6D y un estéreo-microscopio marca Leica M205-A con ópticas de fusión y zoom con enfoque motorizado (modelo MDG41), más el hardware complementario para fotografía digital científica (Leica Microsystems Application Suite LAS Versión 4.5.0). Durante dicho proceso se revisó literatura científica especializada y se consultaron portales web derivados de proyectos globales de bioinformática, con revisiones de sistemática, bases de datos biológicas, y fotografía científica, incluyendo Biodiversity Heritage Library -BHL (2019), World Register of Marine Species -WORMS (2019), Encyclopedia of Life -EOL (2019); Marine Biodiversity Information Network -SCAR -MarBin (Griffiths et al., 2011), el cual forma el nodo OBIS regional Antártico (Ocean Biogeographic Information System -OBIS, 2019), y que a su vez interactúa con Census of Marine Life -COML (2019) y Global Biodiversity Information Facility -GBIF (2019). Adicionalmente, se comparó material fotográfico en sitios web proveniente de especímenes registrados en diferentes museos de historia natural del mundo, como lo son: Natural Museum of Natural History -NMNH, Instituto Smithsonian, Estados Unidos de América (números de catálogo con el acrónimo USNM); National Museum Wales (NMW), Reino Unido; Natuurhistorish Museum Rotterdam (NMR), Holanda; Muséum National d´histoire Naturelle (MNHN), Francia. Los especímenes recolectados se encuentran depositados en el Museo de Historia Natural Marina de Colombia (MHNMC) - Makuriwa, del Invemar.
RESULTADOS
A los moluscos incluidos en este listado les fue asignado en el MHNMC -Makuriwa un número de catálogo con el acrónimo ‘INV MOL’ (Invemar Moluscos). En total se recolectaron 15 especímenes, 10 de los cuales fueron gasterópodos (incluidos 5 microgasterópodos) y 5 bivalvos. La especie más abundante fue el gasterópodo Nacella concinna, de la cual se recolectaron cuatro ejemplares, seguida por los bivalvos Philobrya sublaevis y Adacnarca nitens, con dos ejemplares cada una. La mayoría de especímenes se recolectaron en la estación 541 en el estrecho de Gerlache, alrededor de isla Anvers (archipiélago Palmer), durante el verano austral 2016-2017.
Sistemática
Para los 10 especímenes de gasterópodos se identificaron siete taxa (dos de ellos hasta superfamilia, dos hasta género y tres hasta especie). Los taxa identificados hasta género y especie se distribuyeron en cinco familias. Para los cinco especímenes de bivalvos se identificaron tres especies pertenecientes a dos familias.
Clase Gastropoda Cuvier, 1795
Subclase Patellogastropoda Lindberg, 1986
Superfamilia Patelloidea
Familia Nacellidae Thiele, 1891
Género Nacella Schumacher, 1817
Nacella concinna (Strebel, 1908)
Material examinado. 4 especímenes:
INV MOL10873. Un espécimen recolectado vivo que corresponde a epifauna sobre el mareógrafo. Profundidad: 54 m; dimensiones: 4,9 x 3,5 mm; E541: alrededor de isla Anvers (archipiélago Palmer). Figura 2a.
INV MOL10873. Un espécimen con concha vacía recolectado como muestra de bentos. Profundidad: 54 m; dimensiones: 0,8 x 0,5 mm; E541: alrededor de isla Anvers (Archipiélago Palmer).
INV MOL10874. Un espécimen recolectado vivo que corresponde a epifauna sobre el mareógrafo. Profundidad 5,31 m; dimensiones: 3,9 x 2,5 mm; E641: estrecho de Gerlache, en frente de península Antártica.
INV MOL10874. Un espécimen colectado vivo que corresponde a epifauna sobre el mareógrafo. Profundidad: 5,31 m; dimensiones: 2,95 x 1,9 mm, E641: estrecho de Gerlache, en frente de península Antártica.
Sinonimia: ver Aldea y Troncoso (2008); González-Wevar et al. (2018); WORMS (2019).
Observaciones: en general concha cónica, ovoide y lateralmente comprimida en su lado anterior. Ápice ubicado más allá de la mitad longitudinal de la concha hacia el borde anterior. Según González-Wevar et al. (2018), la forma de la concha y la escultura son muy variables en esta especie. Esto fue tenido en cuenta durante el proceso de identificación de los cuatro ejemplares de N. concinna revisados, así como el concepto del autor anteriormente citado con respecto a la identidad de los especímenes identificados (Claudio González-Wevar, Com. Pers., 11 de octubre de 2019).
Distribución: Océano Austral, Antártica occidental, en islas Antárticas y península Antártica, además de algunas islas subantárticas. Principalmente en mares de Bellingshausen y Weddell. También hay registros en el mar de Escocia (GBIF, 2019). Gónzalez-Wevar et al. (2018) examinaron especímenes provenientes de isla Adelaida (península Antártica), isla Anvers, isla Doumer (archipiélago Palmer, península Antártica), isla James Ross (península Antártica oriental), isla Livingstone e isla King George (islas Shetland del Sur), isla Deception, isla Elephant, isla Orkney del Sur, isla Signy (islas Orkneys del Sur) e isla Georgia del Sur. Se ha registrado además en islas Sandwich del Sur (Gónzalez-Wevar et al., 2010, 2017) e isla Bouvet (González-Wevar et al., 2017).
Rango batimétrico: entre 0 y 150 m de profundidad (González-Wevar et al., 2018).
Hábitat: rocoso, intermareal y submareal (Suda et al., 2015; González-Wevar et a1., 2018). Fondos sedimentarios, submareal (presente estudio).
Gremio trófico: herbívoro (Suda et al., 2015; WORMS, 2019).
Referencias y otro material utilizado para identificación: Powell (1973), Valdovinos y Rüth (2005), Nakano y Ozawa (2007), Gónzalez-Wevar et al. (2010, 2017, 2018), GBIF (2019), WORMS (2019). Fotografías: USNM897627, USNM897851, USNM897627; NMR50329 y NMR6574.
Subclase Vetigastropoda Salvini-Plawen, 1980
Orden Trochida
Superfamilia Trochoidea Rafinesque, 1815
Familia Calliostomatidae Thiele, 1924 (1847)
Subfamilia Margarellinae S. T. Williams, 2013
Género Margarella Thiele, 1893
Margarella antarctica (Lamy, 1906)
Material examinado: INV MOL10875. Un espécimen colectado vivo como bentos. Profundidad: 54 m; dimensiones: 9 x 7 mm; E641: estrecho de Gerlache, península Antártica. Figura 2b.
Sinonimia: ver Aldea y Troncoso (2008) y WORMS (2019).
Observaciones: concha orbicular provista de visos nacarados blanco-crema y azul-violeta. El labio se interrumpe finalizando en la última vuelta. Ombligo profundo y opérculo corneo con giros espirales.
Distribución: Antártica occidental, islas Orkney del Sur (Melvill y Standen, 1907; Powell, 1951; Linse, 2002), islas Shetland del Sur (Powell, 1951), península Antárctica (Lamy, 1906b, 1911; Thiele, 1912; Powell, 1951; Linse, 2002; Aldea y Troncoso, 2008) y el mar de Bellingshausen (Lamy, 1911).
Rango batimétrico: entre 0 (Powell, 1951) y 460 m (Lamy, 1911) de profundidad.
Hábitat: bentos (WORMS, 2019), fondos sedimentarios, además de otros especímenes recolectados sobre mareógrafo (presente estudio).
Gremio trófico: según WORMS (2019) es depredador sobre presas sésiles (deducido de Calliostomatidae Thiele, 1924 (1847)); sin embargo, no se descartan otros tipos de alimentación (ver Zelaya, 2004).
Referencias y otro material utilizado para identificación: Aldea y Troncoso (2008); WORMS (2019). Fotografías: NMR65742, MNHN-IM-2000-31126, USNM 886686.
Orden Lepetellida Moskalev, 1971
Superfamilia Scissurelloidea Gray, 1847
Familia Anatomidae McLean, 1989
Género Anatoma Woodward, 1859
Anatoma sp.
Material examinado: INV MOL10876. Un espécimen vivo recolectado como bentos. Profundidad: 400 m; dimensiones: 2 x 1 mm; E423: estrecho de Gerlache, al frente de isla Anvers. Figura 2c.
Sinonimia: Scissurella (Anatoma) (Woodward, 1859) -rango original (WORMS, 2019), Anatomus (Adams, 1862); Schizotrochus (Monterosato, 1877), Hainella (Bandel, 1998); Thieleella (Bandel, 1998).
Observaciones: microgasterópodo. Concha en mal estado, quebrada en la abertura. Forma involuta, discoidal, traslúcida, moderadamente lisa (en comparación con la familia Scissurellidae - Gray 1847, cuya escultura es más prominente), frágil y con ápice cóncavo. Selenizona presente en la periferia de las vueltas.
Distribución: Pacífico noroeste, Atlántico nororiental y Mediterráneo, océanos meridionales de América del Sur, océanos australes de África, océano Pacífico que rodea Nueva Zelanda y aguas que rodean Australia (Geiger, 2019).
Rango batimétrico: desde plataformas continentales (0 m) hasta profundidades batiales y abisales (Geiger, 2019).
Hábitat: a menudo sobre sustratos blandos (Geiger, 2019), fondos sedimentarios (presente estudio).
Referencias y otro material utilizado para identificación: Geiger (2003, 2019), Geiger y McLean (2010), GBIF (2019).
Subclase Caenogastropoda Cox, 1960
Orden Neogastropoda Wenz, 1938
Superfamilia Buccinoidea Rafinesque, 1815
Familia Buccinidae Rafinesque, 1815
Género Prosipho Thiele, 1912
Prosipho turritus P. G.Oliver y Picken, 1984
Material examinado: INV MOL10877. Un espécimen vivo recolectado como bentos. Profundidad: 54 m; dimensiones: 2,45 x 1,20 mm; E541: alrededor de isla Anvers (archipiélago Palmer). Figura 2d.
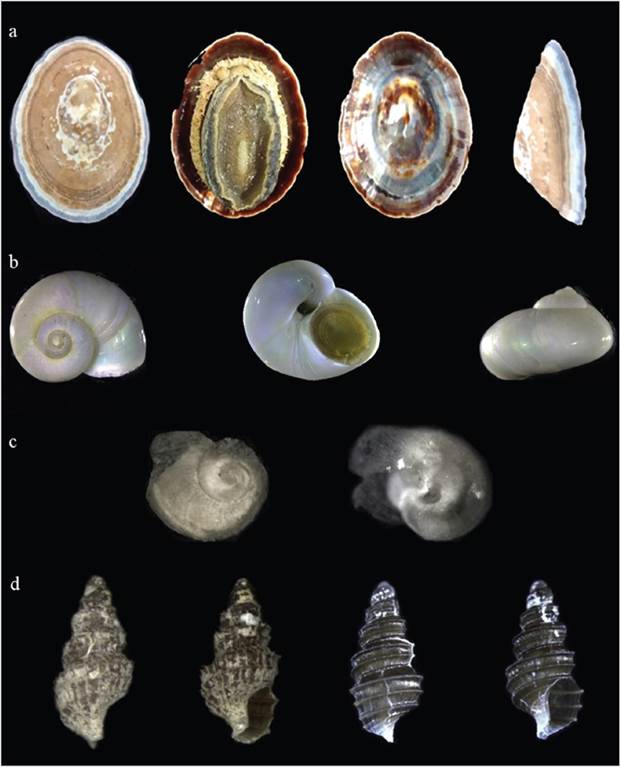
Figura 2 Gasterópodos recolectados en el presente estudio: a. Nacella concinna INV MOL10873, 4,9 x 3,5 mm; b. Margarella antarctica INV MOL10875, 9 x 7 mm; c. Anatoma sp. INV MOL10876, 2 x 1 mm; d. Prosipho turritus INV MOL10877, 2,45 x 1,20 mm. Izquierda: ejemplar con periostraco provisto de estructuras pilosas, derecha: el mismo ejemplar sin estructuras pilosas.
Sinonimia: ver Aldea y Troncoso (2008), WORMS (2019).
Observaciones: microgasterópodo. Concha elongada, fusiforme, sin ombligo, periostraco color café. Labio interno liso, desprovisto de pliegues. Labio externo provisto de cordones y costillas espirales similares a las que conforman el resto de la concha, las cuales se disponen en forma casi paralelas entre sí. Éstas sobresalen por fuera del labio externo, dándole a éste una apariencia crenulada, y siendo además visibles en la parte interna. Dos costillas espirales en cada vuelta, separadas por una sutura delgada. Líneas radiales finas sobre los cordones espirales. Protoconcha lisa, blanquecina, semi-traslúcida y enrollada sobre sí. Canal sifonal curvo y corto. Inicialmente la concha del espécimen recolectado estaba cubierta de estructuras pilosas del periostraco, las cuales se cayeron durante el proceso de identificación, haciendo más evidente la ornamentación. A partir de ese momento el espécimen fue comparado con P. astrolabiensis (Strebel, 1908), que posteriormente se descartó basándose en la descripción y dibujos originales del holotipo (sinonimia Sipho (Mohnia) astrolabiensis) en Strebel (1908) y en USNM 886664.
Distribución: océano Austral. Antártida occidental. Cam Rocks, bahía Borge, isla Signy (islas Orkney del Sur) (Oliver y Picken, 1984). Mar de Weddell (Hain, 1990), península Antártica, mar de Bellingshausen (Aldea y Troncoso, 2008).
Rango batimétrico: de 2 (Oliver y Picken, 1984) a 300 m (Hain, 1990) de profundidad.
Hábitat: bentos (WORMS, 2019), fondos sedimentarios (presente estudio).
Gremio trófico: depredador (WORMS, 2019).
Referencias y otro material utilizado para identificación: Oliver y Picken (1984), Hain (1990), Aldea y Troncoso (2008), WORMS (2019), holotipo NMW.Z.1979.002.00078, NMW M013549.
Orden Littorinimorpha Golikov y Starobogatov, 1975
Cingulopsoidea sp.
Material examinado: INV MOL10878. Un espécimen recolectado vivo como bentos. Profundidad: 54 m; dimensiones: 1,15 x 0,75 mm; E541: alrededor de isla Anvers (archipiélago Palmer). Figura 3a.
Observaciones: microgasterópodo. Concha ovoide, turbinada, globosa, gris, casi lisa, con leves líneas radiales gris oscuro. Borde del labio externo plegado hacia adentro de la abertura en la parte media de esta. Dicho pliegue presenta una proyección de tipo convexo en la mitad, y por encima de éste hay cinco pequeños dientes en el borde superior del labio externo. Parte superior del labio externo finaliza sobre última vuelta. Es probable que el espécimen recolectado pertenezca a la familia Cingulopsidae (Fretter y Patil, 1958); sin embargo, se requiere una mayor evaluación para ahondar en la categoría taxonómica, lo cual se dificulta debido al pequeño tamaño y fragilidad de la concha.
Hábitat: bentos (WORMS, 2019), fondos sedimentarios (presente estudio).
Referencias y otro material utilizado para identificación: Golikov y Starobogatov (1975), Ponder (1983), Criscione y Ponder (2013). Fotografías: familia Cingulopsidae (NMR).
Truncatelloidea sp.
Material examinado: Un espécimen recolectado como bentos. Profundidad: 54 m; dimensiones: 1 x 0,75 mm; E541: alrededor de isla Anvers (archipiélago Palmer). Figura 3b.
Observaciones: microgasterópodo. Concha turbinada, elongada, cónica, blanca, lisa y de ápice romo. Borde del labio ligeramente retraído hacia afuera. Parte superior del labio externo finaliza sobre la última vuelta. Es probable que el espécimen recolectado pertenezca a la familia Hydrobiidae (Stimpson, 1865); sin embargo, se requiere una mayor evaluación para comprobarlo.
Hábitat: bentos (WORMS, 2019), fondos sedimentarios (presente estudio).
Referencias y otro material utilizado para identificación: Stimpson (1865), Golikov y Starobogatov (1975), Ponder (1983), Criscione y Ponder (2013). Fotografías: Familia Hydrobiidae (NMR).
Superfamilia CingulopsoideaFretter y Patil, 1958
Familia Eatoniellidae Ponder, 1965
Género Eatoniella Dall, 1876
Eatoniella sp.
Material examinado: INV MOL10879. Un espécimen recolectado vivo como bentos. Profundidad: 54 m; dimensiones: 0,75 x 0,58 mm; E541: alrededor de isla Anvers (Archipiélago Palmer). Figura 3c.

Figura 3 a. Cingulopsoidea sp. INV MOL10878, 1,15 x 0,75 mm; b. Truncatelloidea sp., 1 x 0,75 mm; c. Eatoniella sp. INV MOL10879, 0,75 x 0,58 mm.
Observaciones: microgasterópodo. Concha ovoide, turbinada y globosa, blanca y de ápice romo. Labio redondo, continuo, sin terminación en la última vuelta y con borde retraído hacia afuera de la abertura. La concha es casi traslúcida después de la última vuelta (blanca) hasta el ápice.
Sinonimia: ver WORMS (2019).
Distribución: en GBIF (2019) el género Eatoniella está registrado casi que exclusivamente en costas y mares del hemisferio Sur.
Hábitat: fondos sedimentarios (presente estudio).
Gremio trófico: Según WORMS (2019), el género Eatoniella es detritívoro y/o herbívoro.
Referencias y otro material utilizado para identificación: Ponder (1983), Troncoso et al. (2007), Aldea y Troncoso (2008), Criscione y Ponder (2013). Fotografías: E. kerguelensis regularis: NMR 65743, familia Eatoniellidae (NMR), E. kerguelensis: USNM 881555, E. cana: holotipo NMW.Z.1979.002.00031, E. varicifera: holotipo NMW.Z.1979.002.00038.
Clase Bivalvia Linnaeus, 1758
Subclase Autobranchia Grobben, 1894
Infraclase Pteriomorphia Beurlen, 1944
Orden Arcida Stoliczka, 1871
Superfamilia Limopsoidea Dall, 1895
Familia Philobryidae F. Bernard, 1897
Género Philobrya J. G. Cooper, 1867
Philobrya sublaevisPelseneer, 1903
Material examinado. 2 especímenes:
a) Un espécimen vivo recolectado como bentos. Profundidad: 98 m; dimensiones: 7 x 6,1 mm; E543: isla Trinity, entre el estrecho de Gerlache y el estrecho de Bransfield.
b) INV MOL10880. Un espécimen vivo recolectado como bentos. Profundidad: 54 m; dimensiones: 8 x 5 mm; E541: alrededor de isla Anvers (archipiélago Palmer). Figura 4a.
Sinonimia: Philobrya antarctica (Thiele, 1931). Ver WORMS (2019).
Observaciones: Ambos ejemplares similares. Concha frágil, de color crema blanquecino e inequilateral. Periostraco semibrillante con tendencia a sequedad y descamado; una parte de éste sobresale más allá de las valvas calcáreas como una lámina semi-traslúcida y fácilmente quebradiza. Presenta costillas radiales que se van haciendo más prominentes del umbo hacia el margen de la concha, interceptadas por líneas de crecimiento. Prodisoconcha con apariencia granular al estereoscopio.
Distribución: océano Austral. Es uno de los bivalvos circumantárticos más comunes, su distribución se extiende alrededor del continente antártico incluyendo la península Antártica. Islas Shetland del Sur, islas Orkneys del Sur, islas Sandwich del Sur, isla Georgia del Sur e isla Bouvet. Mar de Ross (GBIF, 2019). No parece extenderse a la región de Magallanes (Dell, 1990). Al sur del Frente Polar, islas Falkland, mar de Weddell, mar de Escocia y península Antártica. Común en Nueva Zelanda y Australia (Jackson et al., 2015).
Rango batimétrico: desde la zona intermareal hasta aguas profundas > 1000 m (Jackson et al., 2015) de profundidad.
Hábitat: bentos (WORMS, 2019). Poseen un biso con el cual son capaces de unirse a sustratos como rocas, algas, hidrozoos o erizos (Jackson et al., 2015). Fondos sedimentarios (presente estudio).
Gremio trófico: alimentador en suspensión (EOL, 2019).
Referencias y otro material utilizado para identificación: Aldea y Troncoso (2008), Jackson et al. (2015), WORMS (2019). Fotografías: USNM 882415(EOL, 2019), USNM 904336.
Género Adacnarca Pelseneer, 1903
Adacnarca nitens Pelseneer, 1903
Material examinado: INV MOL10881. Dos especímenes recolectados vivos como bentos. Profundidad: 98 m; dimensiones: 5,1 x 5 mm y 5 x 5 mm, cada uno unido al mismo pedazo de madera mediante un biso; E543: isla Trinity, entre el estrecho de Gerlache y el estrecho de Bransfield. Figuras 4b, 4c y 4d.
Sinonimia: ver WORMS, 2019.
Observaciones: concha brillante de coloración blanco crema con tonalidades entre amarillo y verde oliva. Ornamentada con costillas radiales poco prominentes interceptadas por líneas concéntricas aún más leves, exhibiendo una apariencia reticulada muy delicada. Se ve casi lisa sin estereoscopio. La ornamentación de la prodisoconcha es característica (ver Jackson et al., 2015). Borde interno de las valvas dentado, charnela recta y provista de pequeños dientes. Valvas ligeramente traslúcidas. A través de éstas, como internamente en uno de los especímenes, se observó la presencia de ovocitos en avanzado estado de desarrollo, algunos en fase velígera con concha en desarrollo, rasgo característico de esta especie (Higgs et al., 2009).
Distribución: océano Austral, Antártida, islas Falkland, mar de Weddell, mar de Escocia y península Antártica. En todo el hemisferio sur (distribuida en parches), común en Nueva Zelanda y Australia (Jackson et al., 2015).
Rango batimétrico: intermareal (Jackson et al., 2015) a 2350 m (Dell, 1990) de profundidad.
Hábitat: bentos (WORMS, 2019). Poseen un biso con el cual se adhieren a sustratos como rocas, algas, hidrozoos o erizos (Jackson et al., 2015). Ejemplares adheridos a un pedazo de madera encontrado sobre fondo sedimentario (presente estudio).
Referencias y otro material utilizado para identificación: Dell (1990), Aldea y Troncoso (2008), Higgs et al. (2009), Jackson et al. (2015), WORMS (2019). Fotografías: USNM 898190.
Infraclase Heteroconchia J. E. Gray, 1854
Subterclase Euheterodonta Giribet & Distel, 2003
Superorden Anomalodesmata Dall, 1889
Superfamilia Thracioidea Stoliczka, 1870 (1839)
Familia Thraciidae Stoliczka, 1870 (1839)
Género Thracia Blainville, 1824
Thracia meridionalis E. A.Smith, 1885
Material examinado: INV MOL10882. Un espécimen con concha vacía recolectado como bentos. Profundidad: 29 m; 3,7 x 3 mm; E546: isla Greenwich (archipiélago de las islas Shetland del Sur), en frente del estrecho de Bransfield. Figura 4e.

Figura 4 a. Philobrya sublaevis INV MOL10880, 8 x 5 mm; b. Adacnarca nitens, uno unido a pedazo de madera mediante biso (INV MOL10881); c. A. nitens INV MOL10881, 5,1 x 5 mm; d. A. nitens INV MOL10881, 5 x 5 mm; e. Thracia meridionalis INV MOL10882, 3,7 x 3 mm.
Sinonimia: Mysella truncata, Mysella frigida (Thiele, 1912).
Observaciones: ejemplar en mal estado, quebrado. Concha inequilateral, erosionada. Ambas valvas presentes. Coloración blanco crema, opaca. Valvas dorsalmente ornamentadas con líneas de crecimiento comarginales desde el umbo hacia el borde. Ligamento segundario con periostraco engrosado y charnela heterodonta.
Distribución: océano Austral. Mar de Weddell (Hain, 1990). Alrededor del continente Antártico, a lo largo de la península Antártica, islas Shetland del Sur, islas Orkneys del Sur, islas Sandwich del Sur, isla Georgia del Sur hasta la región Magallánica. Islas Falkland, Kerguelen, Marion y Prince Edward. Mar de Ross (Dell, 1990). Isla Bouvet (Thiele y Jaeckel, 1931; Linse, 2006). Isla Peter I (Soot-Ryen, 1951; Aldea y Troncoso, 2008) y mar de Bellingshausen hasta los alrededores de isla Thurston (Aldea y Troncoso, 2008), canal de Beagle (Linse, 1997), plataforma de Shackleton Ice (Hedley, 1916), mar de Davis (Thiele, 1912; Egorova, 1982).
Rango batimétrico: de 4 m a 836 m (Dell, 1990) de profundidad.
Hábitat: variedad de fondos blandos, lodo, arena lodosa, arena y grava (Nicol, 1966; Mühlenhardt-Siegel, 1989). Fondos sedimentarios (presente estudio).
Gremio trófico: alimentador en suspensión (Sartori y Domaneschi, 2005).
Referencias y otro material utilizado para identificación: Sartori y Domaneschi (2005), Aldea y Troncoso (2008). Fotografías: USNM 886980.
DISCUSIÓN
Tres expediciones del Programa Antártico colombiano realizadas en veranos australes, colectaron moluscos en las estaciones muestreadas en el área geográfica del Estrecho de Gerlache. Si bien son muestreos puntuales de expediciones que tenían diferentes objetivos y no específicamente muestreos bentónicos, esto son los primeros moluscos antárticos que se registran en una colección de fauna marina en Colombia. Los registros más cercanos corresponden a la zona subantártica del océano Indico, colectados en 1982 y que se encuentran depositados en la colección de moluscos de la Universidad del Valle. Los moluscos identificados se encuentran previamente registrados en algunas localidades de la Antártida occidental, pero los registros de algunas especies en las estaciones realizadas por las tres expediciones colombianas constituyen nuevos lugares en su distribución, como es el caso de Philobrya sublaevis y Adacnarca nitens en la estación E543 de la expedición III “Almirante Padilla” 2016/2017 realizada cerca a isla Trinity.
La mayoría de las especies de moluscos que se encuentran al sur de la convergencia subantártica tienen distribución en toda la franja que rodea al continente antártico (Cantera y Arnaud, 1984; Hain, 1990), y si bien se reconocen provincias biogeográficas, la corriente circumpolar Antártica (Jackson et al., 2015), junto con la posibilidad de que algunas especies se adhieran a material flotante “rafting” (Gutt, 2007; Higgs et al., 2009) y la existencia de especies con estados larvales relativamente largos permiten una amplia distribución geográfica de las especies que habitan en esta región del mundo (Linse et al., 2006; Heilmayer et al., 2008).
Los gasterópodos del género Nacella, que junto con los bivalvos de la familia Philobryidae fueron los taxa más abundantes encontrados en las expediciones colombianas, también son unos de los moluscos más dominantes en el océano Austral, en donde se distribuyen ampliamente (Linse et al., 2006; Higgs et al., 2009; Jackson et al., 2015; González-Wevar et al., 2017). Sin embargo, las especies del género Nacella presentan una marcada regionalización en esta área, tal como lo establecieron González-Wevar et al. (2010) quienes, basados en análisis moleculares, determinaron que las especies de Nacella geográficamente distantes pertenecen a diferentes linajes genéticos. Las especies patagónicas están claramente separadas de las de la península Antártica, el centro de Chile y la isla subantártica Heard en el océano Índico de Antártida oriental. Nacella concinna, especie hallada en el presente estudio con cuatro ejemplares, exhibió además una considerable plasticidad fenotípica, dificultando su identificación y haciendo confusa su identidad, la cual solo se hizo evidente al relacionarla con el área de estudio (cf. González-Wevar et al., 2017). Esta particularidad hace que su determinación taxonómica a nivel específico presente dificultades.
Las otras especies fueron encontradas en números bajos, a veces un solo individuo. En esta área geográfica, las dificultades para colectar material bentónico son grandes, debido a la existencia de fondos muy diferentes con abundancia de rocas de gran tamaño y se requiere usar equipos diversos, además de muestreos bentónicos intensos para lograr una recolección sistemática de los organismos. Debe resaltarse que las expediciones colombianas tuvieron diferentes objetivos y las recolecciones de moluscos fueron realizados con draga Shipek. Para moluscos de esta región es necesario combinar (Arnaud, 1974; Cantera y Arnaud, 1984) la utilización de dragas de tamaño mediano a grande (por ejemplo, las dragas Charcot Picard, Okean SIPAN) y redes de pesca de arrastre (Blake, “de percha”). Estos dos factores (sustratos difíciles y uso de un solo tipo de draga) pueden explicar la baja abundancia de especímenes y especies de moluscos. Igualmente, algunos de los especímenes, especialmente los más pequeños han sido conservados en el museo en mal estado de conservación, presentando las conchas bastante erosionadas, muy probablemente debido al sistema de fijación utilizado durante la expedición (formalina, por ejemplo) que, para organismos calcáreos en general, pero en mayor medida para micromoluscos no es conveniente. Además, los caenogasterópodos diminutos y pequeños constituyen una gran proporción de la diversidad de gasterópodos en el mundo, pero aún más en la Antártida (Bouchet et al., 2002). La clasificación de prosobranquios diminutos ha demostrado ser usualmente difícil y probablemente la menos comprendida, siendo estos libremente identificados como “Rissoacea” (Ponder, 1983). Su morfología pequeña y simple puede hacer que la identificación, incluso a nivel de familia, sea difícil (Hershler y Ponder, 1998; Geiger et al., 2007; Criscione y Ponder, 2013). Sin embargo, los especímenes encontrados han permitido la identificación de manera conservadora, a nivel de superfamilia a los más deteriorados (Cingulopsoidea sp. y Truncatelloidea sp.), de género a dos de los microgasterópodos (Anatoma sp. y Eatoniella sp.), y de especie a Prosipho turritus.
La continuidad de este tipo de investigación básica, tanto a nivel local, como regional y global es muy importante. La región antártica ha sido clave para establecer patrones globales de diversidad marina, y uno de los taxa pioneros que han permitido el establecimiento de dichos patrones ha sido el phylum Mollusca (Linse et al., 2006), más específicamente los bivalvos y gasterópodos. Dichos autores, al analizar la base de datos de los moluscos del océano austral (i.e. Southern Ocean Molluscan Database -SOMBASE, Griffiths et al., 2003) indicaron que en el océano Austral la biodiversidad de gasterópodos y bivalvos está distribuida por parches (a escala de 1000 km) y que, para casi todas las áreas de su estudio y en todos los niveles taxonómicos, los gasterópodos presentan mayor riqueza que los bivalvos. Esta tendencia se puede observar en el presente trabajo y también en los trópicos y a nivel global (Bouchet et al., 2002; Rosenberg, 2014). De igual manera determinaron que a la fecha del estudio se conocían en el océano austral aproximadamente 895 gasterópodos con concha y 379 especies de bivalvos. En el mismo trabajo, los autores dividieron el área en 12 subregiones utilizando análisis multivariados de los registros recientes de dichos moluscos. Dos de las 12 subregiones fueron la península Antártica y las islas Shetland del Sur, dentro de las cuales estuvieron localizadas las estaciones de colecta de moluscos del presente estudio. Dentro de la subregión de la península Antártica se incluyen el archipiélago Palmer, el estrecho de Gerlache y la región más cercana a la península del estrecho de Bransfield. La otra parte del estrecho de Bransfield está comprendida dentro de la subregión de las islas Shetland del Sur.
Con base en SOMEBASE se registran, para la península Antártica, 131 especies, 81 géneros y 47 familias de moluscos (incluyendo solamente gasterópodos con concha y bivalvos). Para la subregión de las islas Shetland del Sur, están registradas 160 especies, 90 géneros y 56 familias de moluscos. En otras subregiones de los mares que tienen relación con el área estudiada, se sabe que el mar de Bellingshausen está “muy pobremente muestreado”, con 11 especies, 9 géneros y 7 familias de bivalvos (ningún gasterópodo). El mar de Weddell, al contrario, representa uno de los tres “hotspots” de la Antártida occidental, en cuanto a riqueza de moluscos (junto con Georgia del Sur y el mar de Ross), con 301 especies, 126 géneros y 69 familias de moluscos (Linse et al., 2006).
La presente investigación constituye una pequeña fracción de las especies de moluscos registradas para la Antártida, pero representa para Colombia su primera incursión en los estudios malacológicos del océano austral, sumándose a inventarios de especies catalogadas en los museos de historia natural que tienen material de esta región y a plataformas de proyectos bio-informáticos globales (e.g. Ocean Biodiversity Information System - OBIS y SCAR-MarBIN). A futuro, se busca que el análisis de datos consignados en conjunto en estas plataformas contribuya tanto a explicar patrones biogeográficos en el tiempo, como a aportar bases para definir posibles áreas de conservación, en concordancia con el objetivo del Proyecto “BioGerlache-Antártida” del Invemar y de las expediciones colombianas a la Antártida.
AGRADECIMIENTOS
Se agradece al Capitán Francisco Arias Isaza, Constanza Ricaurte, Manuel Garrido y Cristina Cedeño (Invemar) por traer las muestras de moluscos desde la Antártida para su identificación. A David Alonso (BEM-Invemar) por el apoyo e interés en el proyecto “BioGerlache-Antártida”. Igualmente, a la tripulación científica y de la Armada de la República de Colombia por el apoyo brindado durante las expediciones “Caldas” (I), “Almirante Padilla” (III) y “Almirante Campos” (V). A la Dirección Marítima de Colombia (DIMAR) y a la Comisión Colombiana del Océano (CCO) por su gestión en el Programa Antártico Colombiano (PAC). Este trabajo fue financiado por Invemar y el Ministerio de Medio Ambiente y Desarrollo Sostenible, Resolución 0092 de 2016, Código BPIN 2014011000405 (III Expedición) y Resolución 0129 de 2018, Código BPIN 2017011000113 (V Expedición). Este trabajo constituye la publicación No. 1293 del Invemar. La primera autora dedica este trabajo a Juan Manuel Díaz Merlano, Adriana Gracia y Néstor Ardila (malacólogos colombianos), en agradecimiento al conocimiento transmitido y al interés que sus enseñanzas despertaron sobre los moluscos.
REFERENCIAS
Adams, A. 1862. On some new species of Scissurellidae from the Seas of China and Japan. Ann. Mag. nat. Hist., 10(3): 346-348. https://doi.org/10.1080/00222936208681336 [ Links ]
Aldea, C. and J.S. Troncoso. 2008. Systematics and distribution of shelled molluscs (Gastropoda, Bivalvia and Scaphopoda) from the South Shetland Islands to the Bellingshausen Sea, West Antarctica. Iberus, 26(2): 43-117. [ Links ]
Aldea, C., C. Olabarria and J. Troncoso. 2009. Bathymetric zonation and diversity gradient of gastropods and bivalves in West Antarctica from the South Shetland Islands to the Bellingshausen Sea. Deep-Sea Res. 1 Oceanogr. Res. Pap., 55: 350-368. [ Links ]
Alroy, J. 2010. The shifting balance of diversity among major animal groups. Science, 329: 1191-1194. [ Links ]
Bandel, K. 1998. Scissurellidae als Modell für die Variationsbreite einer natürlichen Einheit der Schlitzbandschnecken (Mollusca, Archaeogastropoda). Mitteil. Geologisch-Paläontolog. Inst. Univ. Hamburg, 81: 1-120. [ Links ]
Biodiversity Heritage Library -BHL. 2019. Smithsonian Institution. https://www.biodiversitylibrary.org 20/09/2019. [ Links ]
Brinton, E. 1991. Distribution and population structures of immature and adult Euphausia superba in the western Bransfield Strait region during the 1986-87 summer. Deep-Sea Res., 38: 1169-1194. [ Links ]
Bouchet, P., P. Lozouet, P. Maestratiand V. Heros. 2002. Assessing the magnitude of species richness in tropical marine environments: exceptionally high numbers of molluscs at a New Caledonia site. Biol. J. Linn. Soc., 75: 421-436. [ Links ]
Castillo-Rodríguez, Z. 2014. Biodiversidad de moluscos marinos en México. Rev. Mex. Biod. Supl., 85: 419 - 430. [ Links ]
Census of Marine Life - COML. 2019. www.coml.org 3/10/2019. [ Links ]
Clarke, A. and J.A. Crame. 1989. The origin of the Southern Ocean marine fauna. In: Crame, J.A. (Ed.), Origins and Evolution of the Antarctic Biota, Geol. Soc. London Spec. Publ., 47: 253-268. [ Links ]
Clarke, A. and J.A. Crame. 1992. The Southern Ocean benthos fauna and climate change: a historical perspective. Phil. Trans. R. Soc. B., 338: 299-309. [ Links ]
Clarke, A., E.J. Murphy, M.P. Meredith, J.C. King, L.S. Peck, D.K.A. Barnes and R.C. Smith. 2007. Climate change and the marine ecosystem of the Western Antarctic Peninsula. Phil. Trans. R. Soc. B., 362: 149-166. DOI:10.1098/rstb.2006.1958. [ Links ]
Comisión Colombiana del Océano (CCO) - Comité Técnico Nacional de Asuntos Antárticos (CTN AA). 2014. Agenda Científica Antártica de Colombia 2014 - 2035. Secretaría Ejecutiva de la CCO, Bogotá, D.C. 75 p. [ Links ]
Crame, J.A., A.G. Beu, J.R. Ineson, J.E. Francis, R.J. Whittle and V.C. Bowman. 2014. The early origin of the Antarctic marine fauna and its evolutionary implications. PLoS ONE 9(12): e114743. DOI:10. 1371/journal.pone.0114743. [ Links ]
Criscione, F. and W.F. Ponder. 2013. A phylogenetic analysis of rissooidean and cingulopsoidean families (Gastropoda: Caenogastropoda). Mol. Phylogenet. Evol., 66: 1075-1082. [ Links ]
Dall, W.H. 1876. Mollusks. Contributions to the Natural History of Kerguelen Island, made in connection with the United States Transit-of-Venus Expedition, 1874-75. Bull. U.S. Natl. Mus. -Smithsonian Instit., 3: 42-48. [ Links ]
Dell, R. K. 1964. Antarctic and sub-Antarctic Mollusca: Amphineura, Scaphopoda and Bivalvia. Discov. Rep., 33: 99-250. [ Links ]
Dell, R. K. 1990. Antarctic Mollusca with special reference to the fauna of the Ross Sea. J. R. Soc. NZ., 27: 1- 311. [ Links ]
Egorova, E. N. 1982. Biological results of the Soviet Antarctic expeditions, 7, Mollusca of the Davis Sea. Explor. Faunas Seas, 26 (34): 1-142. [ Links ]
Encyclopedia of Life - EOL. http://eol.org.17/09/2019. [ Links ]
Fretter, V. and A. M. Patil. 1958. A revision of the systematic position of the prosobranch gastropod Cingulopsis (= Cingula) fulgida (J. Adams). Proc. Malacol. Soc. Lond., 33(3): 114−126. [ Links ]
Geiger, D.L. 2003. Phylogenetic assessment of characters proposed for the generic classification of Recent Scissurellidae (Gastropoda: Vetigastropoda) with a description of one new genus and six new species from Easter Island and Australia. Moll. Res., 23: 21-83. [ Links ]
Geiger, D.L. 2019. The families Scissurellidae, Anatomidae, and Sutilizonidae in the northeast Pacific. Zoosymposia, 13: 044 - 052. [ Links ]
Geiger, D.L. and J.H. McLean. 2010. New species and records of Scissurellidae and Anatomidae from the Americas (Mollusca: Gastropoda: Vetigastropoda). Zootaxa, 2356: 1-35. [ Links ]
Geiger, D.L., B.A. Marshall, W.F. Ponder, T. Sasaki and A. Warén. 2007. Techniques for collecting, handling, preparing, storing and examining small molluscan specimens. Molluscan Res., 27: 1-50. [ Links ]
Global Biodiversity Information Facility -GBIF. 2019. https://www.gbif.org 05/10/2019. [ Links ]
Golikov, A.N. and Y.I., Starobogatov. 1975. Systematics of prosobranch gastropods. Malacologia, 15(1): 185-232. [ Links ]
González-Wevar, C.A., T. Nakano, J.I. Cañete and E. Poulin. 2010. Molecular phylogeny and historical biogeography of Nacella (Patellogastropoda: Nacellidae) in the Southern Ocean. Mol. Phylogenet. Evol., 56: 115-124. [ Links ]
González-Wevar, C.A., M. Hüne, N.I. Segovia, T. Nakano, H.G. Spencer, S. Chown, T. Saucède, G. Johnstone, A. Mansilla and E. Poulin. 2017. Following the Antarctic Circumpolar Current: patterns and processes in the biogeography of the limpet Nacella (Mollusca: Patellogastropoda) across the Southern Ocean. J. Biogeogr., 44: 861-874. [ Links ]
González-Wevar, C.A., M. Hüne, S. Rosenfeld, T. Nakano, T. Saucède, H. Spencer and E. Poulin. 2018. Systematic revision of Nacella (Patellogastropoda: Nacellidae) based on a complete phylogeny of the genus, with the description of a new species from the southern tip of South America. Zool. J. Linn. Soc., XX: 1-34. DOI: 10.1093/zoolinnean/zly067. [ Links ]
Gray, J. E. 1840. Shells of molluscous animals. Syn. Cont. Brit. Mus., 42: 105−152. [ Links ]
Gray, J.E. 1847. A list of the genera of the recent Mollusca, their synonyms and types. Proc. Zool. Soc. Lond., 15: 129—219. [ Links ]
Griffiths, H.J., K. Linse and J.A Crame. 2003. SOMBASE— Southern Ocean Mollusc Database: a tool for biogeographic analysis in diversity and ecology. Org. Divers. Evol., 3: 207-213. [ Links ]
Gutt, J. 2007. Antarctic macro-zoobenthic communities: a review and an ecological classification. Antarct. Sci. 19:165-182. [ Links ]
Hain, S. 1990. Die beschalten benthischen Mollusken (Gastropoda und Bivalvia) des Weddellmeeres, Antarktis. Berich. Polarforsch., 70: 1-181. [ Links ]
Haszprunar, G. and A. Wanninger. 2012. Molluscs Curr. Biol., 22: 510-514. [ Links ]
Hedley, C. 1916. Mollusca. Australian Antarctic Expedition. Ser. C. Zoology and Botany, 4(1): 1-80. [ Links ]
Heilmayer, O., S. Thatje, C. McClelland, K. Conlan and T. Brey. 2008. Changes in biomass and elemental composition during early ontogeny of the Antarctic isopod crustacean Ceratoserolis trilobitoides. Polar Biol., 31: 1325-1331. DOI: 10.1007/s00300008-0470-8. [ Links ]
Hershler, R. and Ponder, W.F. 1998. A review of morphological characters of hydrobioid snails. Smithson. Contr. Zool., 600 (i-iii): 1-55. [ Links ]
Higgs, N.D, A.J. Reed, R. Hooke, D.J. Honey, O. Heilmayer and S. Thatj. 2009. Growth and reproduction in the Antarctic brooding bivalve Adacnarca nitens (Philobryidae) from the Ross Sea. Mar Biol., 156:1073-1081. [ Links ]
Huntley, M.E., E. Brinton, M.D.G. López, A. Townsend and W. Nordhausen. 1990. RACER: Fine-scale and mesoscale zooplankton studies during the spring bloom, 1989. Antarct. J. US, 25: 157-159. [ Links ]
Jackson, J.A., K. Linse, R. Whittle and H.J. Griffiths. 2015. The evolutionary origins of the Southern Ocean philobryid bivalves: hidden biodiversity, ancient persistence. PLoS ONE 10(4): e0121198. DOI:10.1371/journal.pone.0121198. [ Links ]
Lamy, E. 1906 «1905». Gastropodes, Prosobranches et Pélécypodes. Expédition Antarctique Française (1903-05), Sci. Nat., Paris, 20 p. [ Links ]
Lamy, E. 1911. Gastropodes Prosobranches, Scaphopode et Pélécypodes. Deuxième Expédition Antarctique Française (1908-1910), Sci. Nat., Paris, 32 p. [ Links ]
Linse, K. 1997. Die Verbreitung epibenthischer Mollusken im chilenischen Beagle-Kanal. Ber. Polarforsch., 228: 1-131. [ Links ]
Linse, K. 2002. The shelled magellanic Mollusca: with special reference to biogeographic relations in the Southern Ocean. Theses Zool., 34: 1-252. [ Links ]
Linse, K., 2006. New records of shelled marine molluscs at Bouvet Island and preliminary assessment of their biogeographic affinities. Polar. Biol., 29: 120-127. [ Links ]
Linse, K., H.J. Griffiths, D.K.A. Barnes and A. Clarke. 2006. Biodiversity and biogeography of Antarctic and sub-Antarctic mollusca. Deep-Sea Res., II, 53: 985-1008. [ Links ]
Moffat, C. and M. Meredith. 2018. Shelf-ocean exchange and hydrography west of the Antarctic Peninsula: a review. Phil. Trans. R. Soc. A, 376: 20170164, 17 p. http://dx.doi.org/10.1098/rsta.2017.0164 [ Links ]
MolluscaBase. 2019. MolluscaBase. http://www.molluscabase.org 28/08/2019. [ Links ]
Monterosato, T. A. 1877. Notizie sulle conchiglie della rada di Civitavecchia. Ann. Mus. Civ. Genova, 9 (1876-1877): 407-428. [ Links ]
Mühlenhardt-Siegel, U. 1989. Antarktische Bivalvia der Reisen des FS “Polarstern” und des FFS “Walther Herwig” aus den Jahren 1984 bis 1986. Mitt. Hamb. Zool. Mus. Inst., 86: 153-178. [ Links ]
Nakano, T. and T. Ozawa. 2007. Worldwide phylogeography of limpets of the order Patellogastropoda: molecular, morphological and palaentological evidence. J. Molluscan Stud., 73: 79-99. [ Links ]
Nicol, D. 1966. Descriptions, ecology and geographic distribution of some Antarctic pelecypods. Bull. Am. Paleontol., 51: 1-102. [ Links ]
Ocean Biogeographic Information System - OBIS. 2019. https://obis.org/ 9/09/2019. [ Links ]
Oliver, P. G. and G. B. Picken. 1984. Prosobranch gastropods from Signy Island, Antarctica: Buccinacea and Muricacea. Brit. Antarct. Surv. Bull., 62: 95-115. [ Links ]
Parkhaev, P. Y. 2008. The early Cambrian radiation of Mollusca. In Ponder, W. F.and D. R. Lindberg (Eds). 2008. Phylogeny and evolution of the Mollusca. University of California Press, Berkeley, 480 p. [ Links ]
Parkhaev, P. Y. 2017. Origin and the early evolution of the phylum Mollusca. Paleontol. J., 51: 663-686. [ Links ]
Pelseneer, P. 1903. Zoologie: Mollusques (Amphineures, Gastropodes et Lamellibranches). Résultats du Voyage du S.Y. Belgica en 1897-1898-1899 sous le commandement de A. de Gerlache de Gomery: Rapports Scientifiques (1901-1913). Buschmann, Anvers. 85 p. [ Links ]
Picken, G. 1980. The distribution, growth, and reproduction of the Antarctic limpet Nacella (Patinigera) concinna (Strebel, 1908). J. Exp. Mar. Biol. Ecol., 42(1): 71-85. [ Links ]
Ponder, W.F. 1965. The family Eatoniellidae in New Zealand. Rec. Auckland Inst. Mus., 6(2): 47-100. [ Links ]
Ponder, W. F. 1983. Rissoaform gastropods from the Antarctic and Sub-Antarctic: the Eatoniellidae, Rissoidae, Barleeidae, Cingulopsidae, Orbitestellidae and Rissoellidae (Mollusca: Gastropoda) of Signy Island, South Orkney Islands, with a review of the Antarctic and sub-Antarctic (excluding southern South America and the New Zealand sub-Antarctic islands) species. Brit. Antarct. Surv. Scient. Rep., 108: 1-96. [ Links ]
Powell, A.W.B. 1951. Antarctic and Subantarctic Mollusca: Pelecypoda and Gastropoda. Discov. Rep., 26: 47-196. [ Links ]
Rosenberg, R. 2014. A new critical estimate of named species-level diversity of the recent Mollusca. Amer. Malac. Bull., 32(2): 308-322. [ Links ]
Sartori, A. F. and O. Domaneschi. 2005. The functional morphology of the Antarctic bivalve Thracia meridionalis [ Links ]
Secretariat of the Antarctic Treaty. 2018. Rules of Procedure of the Antarctic Treaty Consultative Meeting and the Committee for Environmental Protection. Buenos Aires, Argentina, 43 p. [ Links ]
Sepkoski J.J. , Jr. 2002. A compendium of fossil marine animal genera. Bull. Am. Paleont., 363, 1-560. [ Links ]
Smith, E. A., 1885. Report on the Lamellibranchiata collected by H.M.S. Challenger during the years 1873-1876. Rep. Scient. Res. Expl. Voy. H.M.S. Challenger, Zool., 13(35): 1-341. [ Links ]
Soot-Ryen, T. 1951. Antarctic Pelecypoda. Scient. Results Norw. Antarct. Exped., 32: 1-46. [ Links ]
Stimpson, W. 1865. Researches upon the Hydrobiinae and allied forms chiefly made upon materials in the museum of the Smithsonian Institution. Smithson. Misc. Collect., 201: 1−59. [ Links ]
Strebel, H. 1908. Die Gastropoden (mit Ausnahme de nackten Opisthobranchier). Wissensch. Ergebn. Schwedisch. Südpolar-Exp. 1901-1903, 6: 1-111. [ Links ]
Suda, C.N.K., G.S. Vani, M. Feijo de Oliveira, E. Rodrigues Jr. , E. Rodrigues and H.P. Lavrado. 2015. The biology and ecology of the Antarctic limpet Nacella concinna. Pol. Biol., 38(12): 1949-1969. [ Links ]
Thiele, J. 1912. Die antarktischen Schnecken und Muscheln. In Drygalski, E. von (Ed.): Deutsche Südpolar-Expedition (1901-1903), 13: 183-286. [ Links ]
Thiele J. and S. Jaeckel. 1931. Muscheln der Deutschen Tiefsee Expedition. Wissensch. Ergebn. Deutschen Tiefsee-Exp. Dampfer 1898-1899, 21: 158-268. [ Links ]
Troncoso, J., C. Aldea, P. Arnaud, A. Ramos and F. García. 2007. Quantitative analysis of soft-bottom molluscs in the Bellingshausen Sea and around Peter I Island. Polar Res., 26(2): 126-134. DOI: 10.1111/j.1751-8369.2007.00033.x. [ Links ]
Urcola, M.R. and D.G. Zelaya. 2018. The genus Cyamiocardium Soot-Ryen, 1951 (Bivalvia: Cyamiidae) in sub-Antarctic and Antarctic waters. Polar Biol., 41(6):1157-1174. DOI: 10.1007/s00300-018-2275-8. [ Links ]
Valdovinos, C. and M. Rüth. 2005. Nacellidae limpets of the southern end of South America: taxonomy and distribution. Rev. Chil. Hist. Nat., 78: 497-517. [ Links ]
Vinther, J. 2014. A molecular palaeobiological perspective on aculiferan evolution. J. Nat. Hist., 48: 2805-2823. [ Links ]
Wanninger, A. and T. Wollesen. 2019. The evolution of molluscs. Biol. Rev., 94: 102-115. DOI: 10.1111/brv.12439. [ Links ]
Watson, R. B. 1886. Report on the Scaphopoda and Gasteropoda collected by H.M.S. Challenger during the years 1873-76. Rep. Scient. Res. Voy. M.S. Challenger, 1873-1876, Zool., 15: 1-756. [ Links ]
Woodward, S. P. 1859. On a new species of mollusk of the genus Scissurella d’Orb. Proc. Zool. Soc. Lond., 27: 202-204. [ Links ]
World Register of Marine Species -WoRMS Editorial Board. 2019. http://www.marinespecies.org (DOI: 10.14284/170). 24/09/2019. [ Links ]
Zelaya, D. 2004. The genus Margarella Thiele, 1893 (Gastropoda: Trochidae) in the southwestern Atlantic Ocean. Nautilus, 118(3):112-120. [ Links ]
Zhou, M., W. Nordhausen and M.E. Huntley. 1994. ADCP measurements of the distribution and abundance of euphausiids near the Antarctic Peninsula in winter. DeepSea Res. I., 41: 1425-1445. [ Links ]
Zhou, M., P.P. Niiler and J.H. Hu. 2002. Surface currents in the Bransfield and Gerlache Straits, Antarctica. Deep-Sea Res. I., 49: 267-280. [ Links ]
Recibido: 30 de Septiembre de 2019; Aprobado: 11 de Diciembre de 2020











 texto en
texto en 



