Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta Jan./June 2022 Epub Aug 01, 2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1083
Artículos de Investigación
Nuevos registros de anélidos del banco de las Ánimas, Caribe colombiano
1Grupo de Investigación, Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia, scshanly@gmail.com
2Grupo de Investigación, Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia, silore10.se@gmail.com
3Universidad de Bogotá Jorge Tadeo Lozano, Sede El Rodadero, Santa Marta, Colombia pedror.duenasr@utadeo.edu.co
4Grupo de Investigación, Ecología y Diversidad de Algas Marinas y Arrecifes Coralinos, Universidad del Magdalena, Santa Marta, Colombia, rgarciau@unimagdalena.edu.co
The banco de las Ánimas is a poor studied underwater environment with a characteristic reef fauna and an unknown large number of cryptic species. Annelids are one of the most common invertebrate groups in the coral formations of the Colombian Caribbean; these organisms are very abundant and variable in their body shapes (parapodia, setae, and gill structures), which imply a great evolutionary radiation. In order to know the diversity of annelids in the reef ecosystem in the Banco de las Ánimas, four artificial structures (known as autonomous reef monitoring structures) used as fauna collectors were located at a depth of 14 m in the Montículo sector. The first records for the Colombian Caribbean of 23 species of annelids of the families Amphinomidae, Eunicidae, Polynoidae, Lumbrineridae, Sabellidae, Serpulidae, Sigalionidae, Syllidae, and Terebellidae. The contribution to the knowledge of the fauna of reef annelids of a little poor known area of the Colombian Caribbean is highlighted.
Keywords: annelids; coral formations; autonomous monitoring structures; cryptic species.
El banco de las Ánimas es un ambiente submarino poco estudiado que posee una fauna arrecifal característica y una gran cantidad de especies crípticas desconocidas. Los anélidos son uno de los grupos de invertebrados más comunes en las formaciones coralinas del Caribe colombiano, estos organismos son muy abundantes y variables en sus formas corporales (parapodia, setas y estructuras branquiales), lo cual implica una gran radiación evolutiva. Con el fin de conocer la diversidad de anélidos del ecosistema arrecifal en el banco de las Ánimas se ubicaron cuatro estructuras artificiales (conocidas como estructuras autónomas de monitoreo arrecifal) utilizadas como colectores de fauna a 14 m de profundidad en el sector de Montículo. Se presenta el primer registro para el Caribe colombiano de 23 especies de anélidos de las familias Amphinomidae, Eunicidae, Lumbrineridae, Polynoidae, Sabellidae, Serpulidae, Sigalionidae, Syllidae y Terebellidae. Se resalta la contribución al conocimiento de la fauna de anélidos arrecifales de una zona poco conocida del Caribe colombiano.
Palabras clave: anélidos; formaciones coralinas; estructuras autónomas de monitoreo arrecifal; especies crípticas.
INTRODUCCIÓN
Los anélidos (phylum Annelida) son un componente importante de las comunidades bentónicas de los mares alrededor del mundo (Struck, 2011). Estos organismos marinos pueden llegar a ser los invertebrados más abundantes y representativos en el arrecife (Londoño-Mesa et al., 2016), cumplen un papel clave en el reciclaje de nutrientes, son generadores de oquedades y escondites para otros invertebrados, y algunas familias pueden ser indicadoras de la salud del ecosistema.
El cuerpo de los anélidos se divide generalmente en tres regiones básicas: acrón (donde se encuentran el prostomio y el peristomio), el tronco donde está la mayoría de segmentos y la parte posterior donde se encuentra el pigidio (Harris et al., 2009). Existe una gran variedad de formas dentro de la clase que van desde aquellas de vida errante como las familias Eunicidae y Nereididae, o los de la familia Amphinomidae comúnmente llamados gusanos de fuego, animales coralívoros que tienen una gran variedad de tamaños (Grimes et al., 2020). Las formas de vida sésiles viven en tubos, adheridas al sustrato como los representantes de las familias Sabellidae y Serpulidae, normalmente conocidos como gusanos plumero o flores de mar; su nombre se debe a la forma y coloración de la corona branquial ubicada en la región anterior del cuerpo, que cuando se encuentra extendida se asemeja a un abanico (Piazzolla et al., 2020).
Su distribución incluye todos los mares del mundo, desde la zona intermareal hasta las profundidades abisales (Lagos et al., 2018). El estudio de los anélidos en Colombia se ha enriquecido con nuevos registros para el Caribe colombiano de localidades como las bahías de Santa Marta, Nenguanje y Cartagena, Cispatá y las islas de Providencia y Tortuguilla (Dueñas, 1981, 1999; Rodríguez-Gómez, 1988; Báez y Ardila, 2003; Quirós-Rodríguez et al., 2013; Dueñas-Ramírez y Dueñas-Lagos, 2016; Lagos et al., 2018; León et al., 2019). Se conoce que el estudio de anélidos inició con menos de 50 especies en los años 60, aumentando gradualmente y, concordando con el descubrimiento y aplicación de las técnicas moleculares, aumentó el registro con más de 253 especies para 2003. La lista más reciente construida por León et al. (2019) muestra alrededor de 293 especies distribuidas en 230 géneros y 51 familias asociadas a diferentes regiones de Colombia (Magdalena, San Andrés y Providencia, Guajira, Golfo de Morrosquillo, Archipiélagos coralinos y Darién) y en diferentes tipos de ecosistemas (manglares, fondos blandos, fondos duros, estuarios y lagunas costeras, algas y pastos marinos, entre otros).
El banco de las Ánimas es una formación arrecifal de poca extensión y difícil acceso (Díaz et al., 2000). Recientemente se han realizado estudios que han permitido conocer aspectos sobre la conformación del fondo de areniscas (Zea et al., 2019), así como una aproximación sobre su biodiversidad (García-Urueña et al., 2020). Sin embargo, aún se requieren investigaciones en grupos no estudiados hasta ahora, como los anélidos, pertenecientes a la criptofauna arrecifal. Este trabajo es un aporte al conocimiento de la fauna anélida del país, y es un primer intento en caracterizar este grupo en áreas poco exploradas como el banco de las Ánimas. Se hallaron 23 especies no registradas previamente para el Caribe colombiano. Se recomienda para estudios futuros considerar un enfoque que incluya técnicas morfológicas adicionales como microscopia de barrido laser confocal y microscopia electrónica, con el propósito de obtener información adicional sobre aspectos ecológicos, geográficos y de relaciones filogenéticas que puedan enriquecer la información obtenida (Di Domenico et al., 2014; Lagos et al., 2018).
MATERIALES Y MÉTODOS
Área de studio
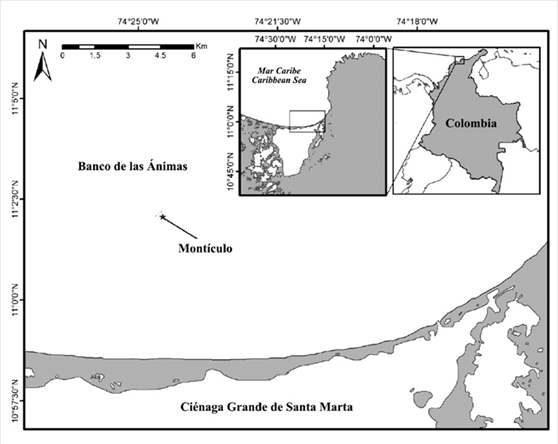
El banco de las Ánimas (11° 02’04 0”N-74° 24’ 22,8”O) está ubicado aproximadamente a 12 km de distancia al norte de la costa de la isla Salamanca, frente a la Ciénaga Grande de Santa Marta (CGSM; Figura 1) (Díaz et al., 2000), Caribe colombiano, en una zona con marcada influencia por las descargas de la CGSM. Las condiciones oceánicas son similares a las que se presentan en el Parque Nacional Natural Tayrona (PNNT) (Bula-Meyer y Díaz-Pulido, 1995; Arévalo-Martínez y Franco-Herrera, 2008), con dos épocas climáticas marcadas y una intermedia. La época seca comprende de diciembre hasta abril, la lluviosa de agosto a noviembre y una fase de transición en mayo y junio. La región también está influenciada por el comportamiento de la zona de convergencia intertropical (ZCIT) y los sistemas regionales de alta presión (Franco, 2005).
Fase de campo
En el sector de Montículo y a 14 m de profundidad se dispusieron cuatro estructuras autónomas de monitoreo arrecifal (ARMS; Figura 2), metodología propuesta por la NOAA (Moews-Asher et al., 2018). Estas consisten en una placa base de 35 x 45 cm en la que se sustentan nueve placas removibles de PVC de 22,5 x 22,5 cm. Las ARMS fueron retiradas a los 6, 8, 12 y 18 meses (mayo, agosto y noviembre de 2017 y junio de 2018).
Fase de laboratorio
El desmontaje de las estructuras se realizó siguiendo el protocolo de Leray y Knowlton (2015), separando cuidadosamente los ejemplares de las placas, los cuales fueron narcotizados en cloruro de magnesio 7%, fotografiados y finalmente fijados en formalina a 10%. Se identificaron y documentaron las características taxonómicas diagnósticas para determinar la identidad de los especímenes, hasta el nivel taxonómico más bajo posible. Como referentes morfológicos fueron empleadas guías taxonómicas y libros (Fauchald y Reimer, 1975; Fauchald, 1977; Uebelacker y Johnson, 1984; Solis-Weiss, 1995; Beesley et al., 2000; De León-González, 2009; Ferreira-Gil, 2011) y las consultas en bases de datos especializadas como World Polychaeta Data Base (http://www.marinespecies.org/polychaeta/), para la revisión de las descripciones originales.
Como resultados importantes se presenta una breve diagnosis de las especies, información adicional del material examinado y los sinónimos de cada especie consultados en la página WoRMS (http://www.marinespecies.org/index.php), además, se consigna el material fotográfico en donde se resaltan algunas de sus estructuras. Las fotografías fueron tomadas con un estereoscopio Leica LMT260 XY Scanning Stage y procesadas con el software Multistep de Leica Application Suite. Los organismos pertenecientes al phylum Annelida fueron depositados en el Centro de Colecciones German Bula Meyer de la Universidad del Magdalena, registrados en la colección de Invertebrados no insectos (Macrofauna) bajo los números de catálogo del CBUMAG:MAC:02036 al CBUMAG:MAC:02129.
RESULTADOS
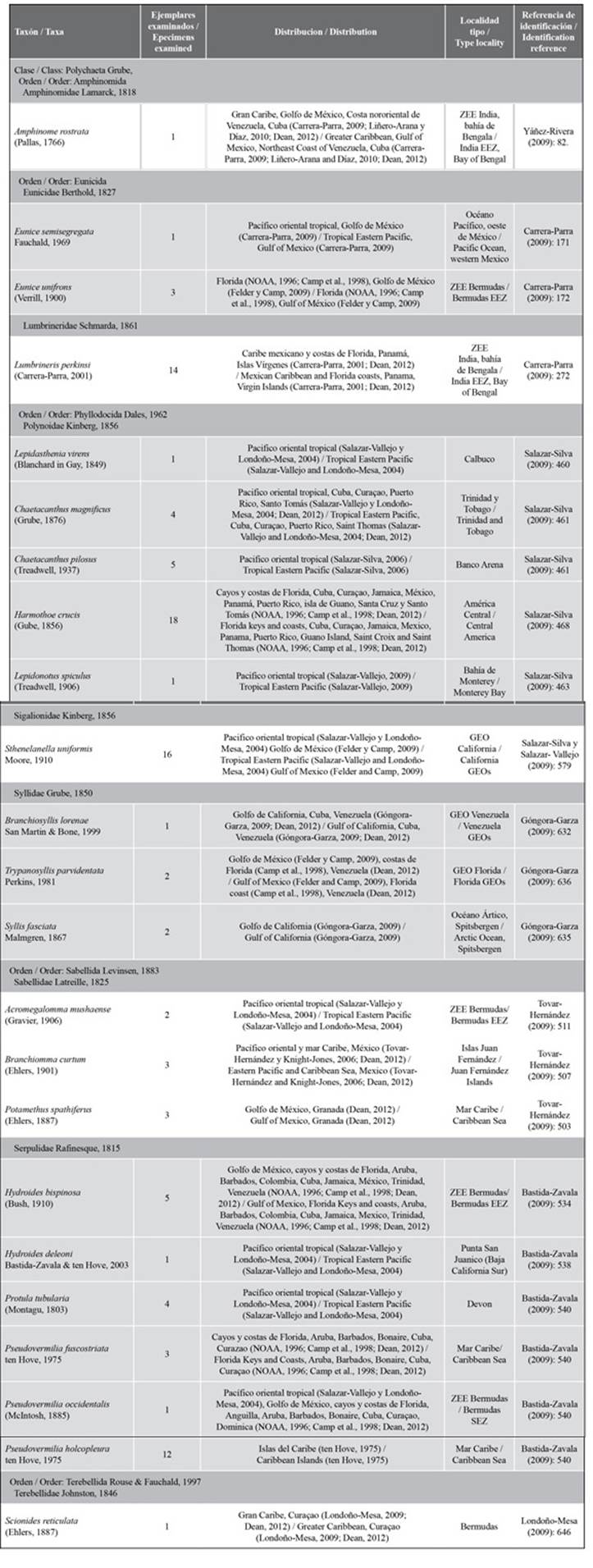
Se recolectaron e identificaron 104 individuos agrupados en nueve familias; 23 especies son nuevos registros de anélidos para el Caribe colombiano (Tabla 1). El polinoideo Harmothoe crucis fue el más abundante con 18 ejemplares. A continuación, en la tabla 1 se consigna la taxonomía, se incluye su distribución geográfica, localidad tipo y la referencia de identificación para los especímenes estudiados.
Tabla 1 Nuevos registros de anélidos para el Caribe colombiano asociados a las estructuras ARMS (Estructuras Autónomas de Monitoreo Arrecifal) del Banco de las Ánimas. Algunas localidades tipo se expresan como ZEE (Zonas Económicas Exclusivas, las cuales comprenden un área marina en la cual ciertas naciones tienen derechos especiales de investigación y de uso de recursos marinos) y GEO (regiones marinas establecidas).
Familia Amphinomidae Lamarck, 1818
Amphinome rostrata (Pallas, 1766)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=129825).
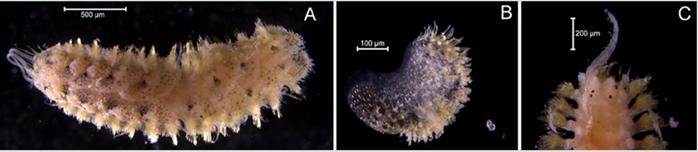
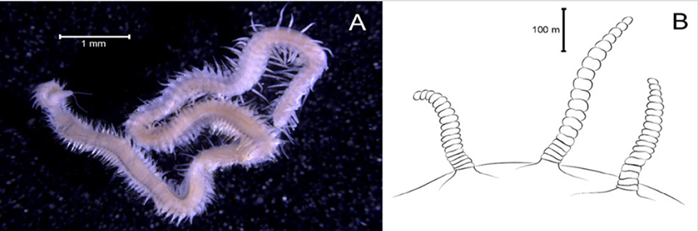
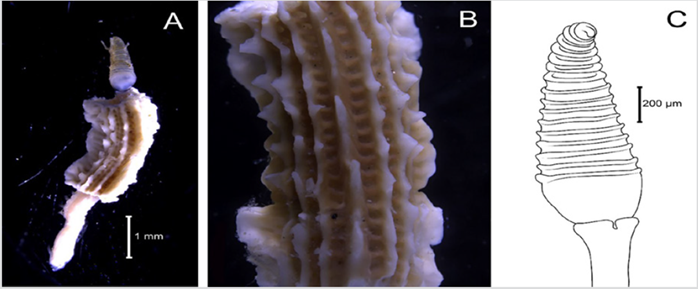
Material examinado. Individuo 2,2 mm de longitud y 0,5 mm de ancho (Figura 3A). Un ejemplar depositado bajo el número de catálogo CBUMAG:MAC:02050.
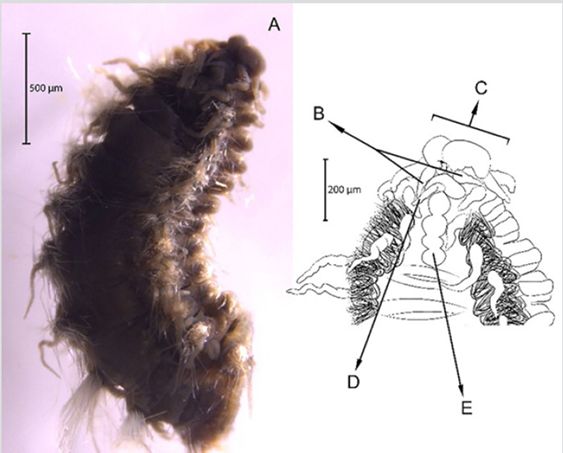
Diagnosis. Prostomio con antena media y dos laterales (Figura 3B, 3C, 3D), con carúncula sinuosa que sobrepasa el tercer setígero (Figura 3E). Cuerpo alargado y corpulento, parapodios birrámeos y setas simples. Branquias en el notopodio.
Familia Eunicidae Berthold, 1827
Eunice semisegregata Fauchald, 1969
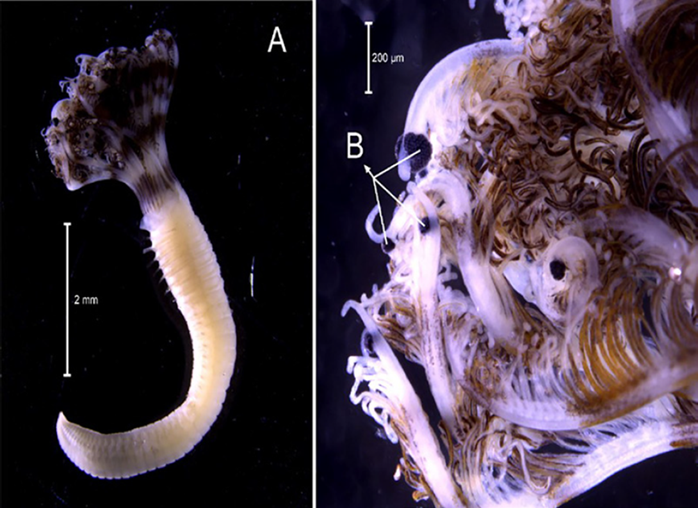
Material examinado. Individuo incompleto 12,2 mm de longitud y 0,5 mm de ancho (Figura 4A). Un ejemplar depositado bajo el número de catálogo CBUMAG:MAC:02062.
Diagnosis. Prostomio con cinco antenas y dos cirros peristomiales articulados (Figura 4B, 4C, 4D, 4F). Sin palpos divididos. Cuerpo alargado, incompleto. Con ganchos subaciculares negros, bidentados. Las setas adicionales son simples, espinígeras y pectinadas, las compuestas son falcígeras.
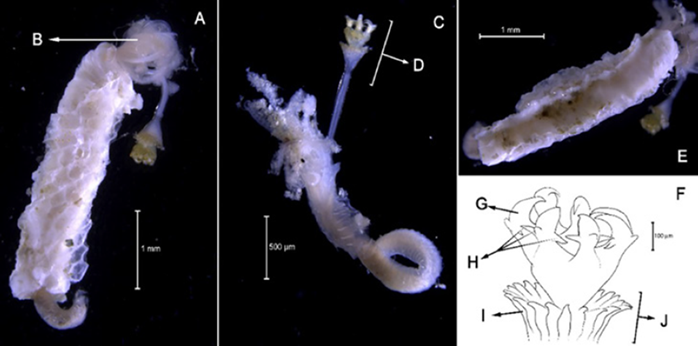
Eunice unifrons (Verrill, 1900)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333349)
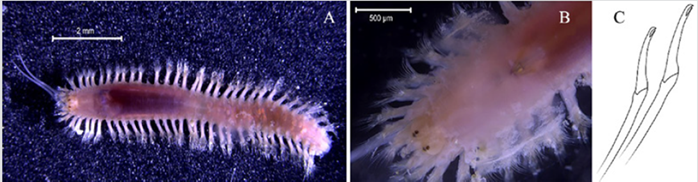
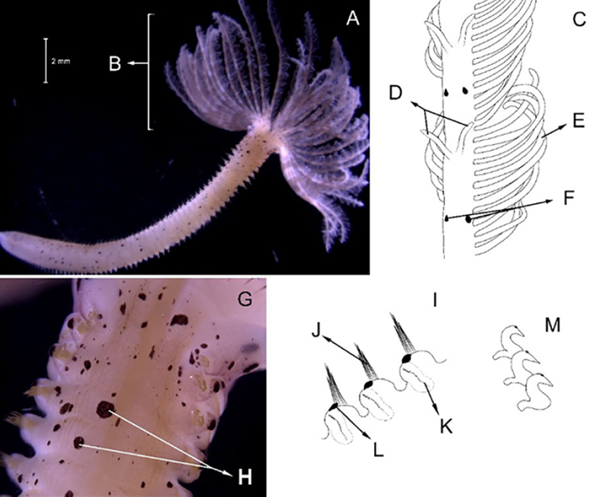
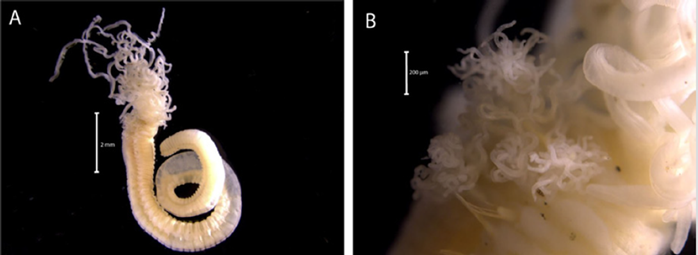
Material examinado. Individuo 16,6 mm de longitud y 0,6 mm de ancho (Figura 5A). Tres ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02048.
Diagnosis. El prostomio cuenta cinco apéndices prostomiales articulados (Figura 5B, 5F, 5J), antena media alcanza el parápodo número dos (Figura 5K). Dos cirros peristomiales cortos y articulados (Figura 5C, 5D, 5E, 5I) que no alcanzan el margen anterior del peristomio. Ganchos subaciculares amarillos tridentados (Figura 5H), con setas simples espinígeras y pectinadas y falcígeros compuestos. Acícula sin mucrón. Las branquias son más largas que el cirro dorsal y presenta mandíbula (Figura 5G).
Familia Lumbrineridae Schmarda, 1861
Lumbrineris perkinsi (Carrera-Parra, 2001)
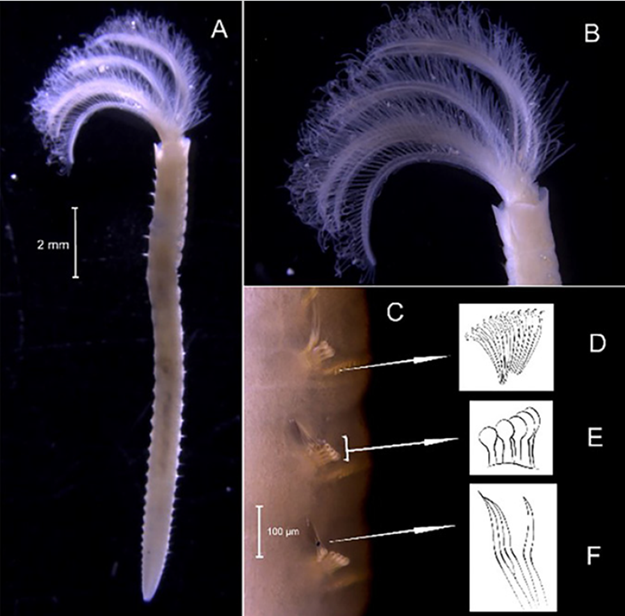
Material examinado. Individuo 18,1 mm de longitud y 4,6 mm de ancho (Figura 6A). 15 ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02070.
Diagnosis. Prostomio ligeramente cónico redondeado con un par de bandas dorsales obscuras longitudinales. Cuerpo alargado, peristomio entero, sin apéndices o antenas (Figura 6B). Las setas son ganchos simples encapuchados multidentados (Figura 6D) y ventralmente en la región media posterior presenta una línea central de manchas oscuras. Los parápodos anteriores no presentan branquias y presenta un aparato maxilar (Figura 6C).
Familia Polynoidae Kinberg, 1856
Lepidasthenia virens(Blanchard in Gay, 1849)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333804).
Material examinado. Individuo 3,6 mm de longitud y 0,7 mm de ancho (Figura 7A). Un ejemplar depositado con el número de catálogo CBUMAG:MAC:02057.
Diagnosis. Prostomio con antena media dorsal y segmento tentacular no fusionado (Figura 7B, 7C, 7D). Cuerpo largo, el organismo posee escamas en el dorso (Figura 7A), pares de élitros presentes en los segmentos 2, 4, 5 y 7, alternan segmentos a 23, y a partir de entonces cada tercer segmento. Élitros pequeños, sin cubrir el dorso y un patrón de bandas oscuras transversales (Figura 7E). En la base de los cirros laterales y los notópodos presentan setas.
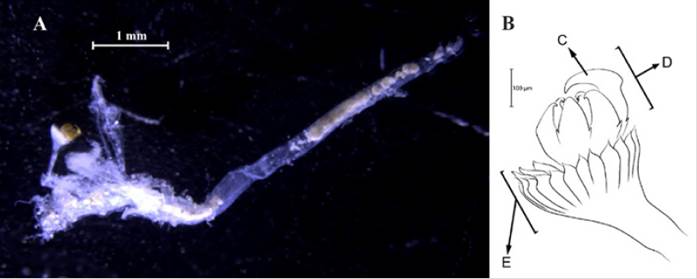
Chaetacanthus magnificus (Grube, 1876)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333251).
Material examinado. Individuo 2,1 mm de longitud y 0,4 mm de ancho (Figura 8A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02054.
Diagnosis. Prostomio con antena media frontal, segmento tentacular fusionado (Figura 8C). Con antenas laterales con ceratóforos. Cuerpo corto y robusto, cubierto dorsalmente por escamas (Figura 8A). Élitros con macrotubérculos globulares (Figura 8B), los anteriores con macrotubérculos no pedunculados formando una línea; y los posteriores con macrotubérculos planos, irregulares formando un parche como una costra vítrea. Notosetas espinosas no lanceoladas. Los filamentos branquiales se encuentran dorsolaterales a los parápodos.
Chaetacanthus pilosus (Treadwell, 1937)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333252).
Material examinado. Individuo 2,0 mm de longitud y 0,3 mm de ancho (Figura 9A). Cinco ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02055.
Diagnosis. Prostomio con antena media frontal, segmento tentacular fusionado (Figura 9C). Ceratóforos de las antenas laterales terminales. Notosetas espinosas no lanceoladas. Élitros con microtubérculos ovoides y macrotubérculos pedúnculados dispersos en toda la superficie (Figura 9B). Los filamentos branquiales ubicados dorsolateralmente a los parápodos.
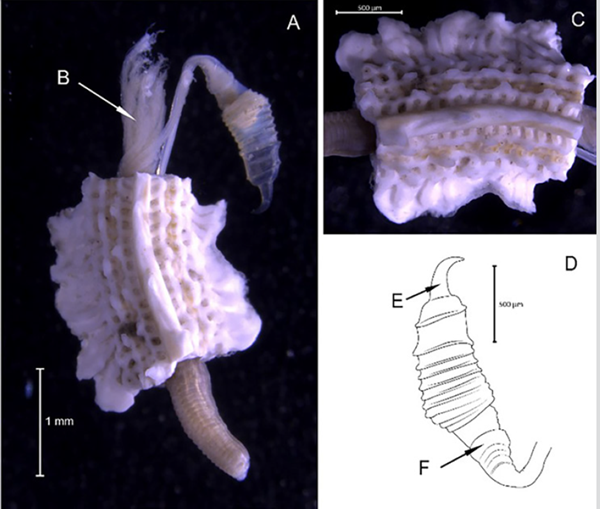
Harmothoe crucis (Gube, 1856)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333563).
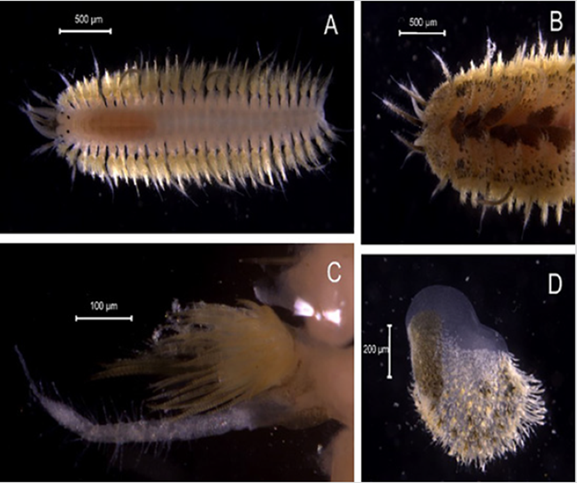
Material examinado. Individuo 2,5 mm de longitud y 0,2 mm de ancho (Figura 10A). Dieciocho ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02061.
Diagnosis. Prostomio con un tubérculo facial y antena media insertada en ceratóforo frontal (Figura 10B). Individuo con cuerpo robusto cubierto dorsalmente por élitros (Figura 10A). La mayoría de las neurosetas con punta bidentada (Figura 10C). La superficie de los élitros anteriores sin una cubierta esclerotizada, notosetas abundantes y posee hasta 15 pares de élitros. Los 6 a 8 segmentos posteriores con cirros dorsales no alternados con élitros. La superficie de los élitros con abundantes microtubérculos, con papilas marginales abundantes (Figura 10D); macrotubérculos de élitros medios y posteriores cilíndricos, con la punta expandida en cuatro proyecciones bifurcadas.
Lepidonotus spiculus (Treadwell, 1906)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333826).
Material examinado. Individuo 3,7 mm de longitud y 0,7 mm ancho (Figura 11A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02085.
Diagnosis: Prostomio con antena media y laterales con abultamientos subdistales globosos, las tres sobre ceratóforos terminales. Segmento tentacular fusionado al prostomio (Figura 11C). Cuerpo con 26 segmentos y 12 pares de élitros (Figura 11B). Palpos con papilas diminutas. Notosetas espinígeras y lanceoladas lisas. Neurosetas simples lanceoladas. Pigidio con dos cirros anales similares en forma a las antenas y demás cirros.
Sthenelanella uniformis (Moore, 1910)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=332194).
Material examinado. Individuo 5,7 mm de longitud y 0,5 mm ancho (Figura 12A). 14 ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02081.
Diagnosis: El prostomio es redondeado, tan largo como ancho y el área ocular no está elevada. Cuerpo robusto (Figura 12A) con palpos largos con ceratóforos. Antena media y laterales con cirróforos; posee cuatro ojos (Figura 12B). Con antenas laterales fusionadas a los parápodos tentaculares, el ceratóforo de la antena media con aurículas. Los parápodos con ctenidias, notosetas espinosas y neurosetas son compuestas falcígeras de hoja larga (Figura 12C).
Familia Syllidae Grube, 1850
Branchiosyllis lorenae San Martin & Bone, 1999
Material examinado. Individuo 14,12 mm de longitud y 0,41 mm ancho (Figura 13A). Un ejemplar depositado con el número de catálogo CBUMAG:MAC:02081.
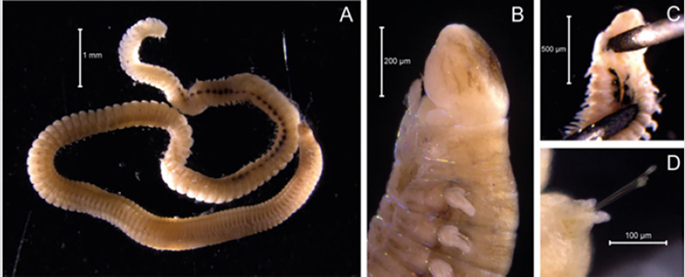
Descripción. El cuerpo es sub-cilíndrico, aplanado ventralmente (Figura 13A) y con palpos fusionados en la base. Presenta órganos nucales y antenas, cirros tentaculares y dorsales (Figura 13B). La faringe se encuentra armada con un trepan y falcígeros bidentados. Cirros anales articulados.
Trypanosyllis parvidentata (Perkins, 1981)
Material examinado. Individuo 4,96 mm de longitud y 0,31 mm de ancho (Figura 14A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02059.
Diagnosis. El prostomio cuenta con órganos nucales, antenas, cirros tentaculares articulados y palpos fusionados en la base. El cuerpo es sub-cilíndrico (Figura 14A), aplanado ventralmente (Figura 14B). Cirros dorsales articulados. La faringe se encuentra armada con un trepan, el cual presenta 10 dientes diminutos y un diente medio-dorsal grande. Cirros anales articulados.
Syllis fasciata Malmgren, 1867
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=131429).
Material examinado. Individuo 12,6 mm de longitud y 0,2 mm ancho (Figura 15A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02059.
Descripción. Cuerpo sub-cilíndrico, con zona ventral aplanada (Figura 15A). Las antenas, cirros tentaculares y dorsales articulados, además, presenta órganos nucales. Palpos fusionados en la base y setas principalmente compuestas. Los artejos de algunas setas compuestas se encuentran en forma de garra, dobladas generalmente en contra del mango. Todos los cirros tienen aproximadamente la misma forma (Figura 15B) y la faringe se encuentra armada por un diente medio-dorsal, en la parte anterior. Sin branquias y tampoco falcígeros en los setígeros anteriores. Cirros anales articulados.
Familia Sabellidae Latreille, 1825
Acromegalomma mushaense (Gravier, 1906)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=994115).
Material examinado. Individuo 5,53 mm de longitud y 0,88 mm ancho (Figura 16A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02036.
Descripción. Radiolas con bandas oscuras transversales y con ojos compuestos subdistales (Figura 16B), los lóbulos branquiales se encuentran fusionados dorsalmente. Con numerosos segmentos abdominales, tori abdominales forman crestas transversales someras, uncinos torácicos aviculares con tres dientes en la parte apical y con el manubrio corto. Sin neurosetas paleadas, notosetas torácicas inferiores alargadas con una cubierta ancha y o fusiforme, puntas largas. Los márgenes dorsales del collar no fusionados al surco fecal, sin sacos dorsales.
Branchiomma curtum (Ehlers, 1901)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=333130).
Material examinado. Individuo 51,46 mm de longitud y 1,12 mm ancho (Figura 17A). Tres ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02038.
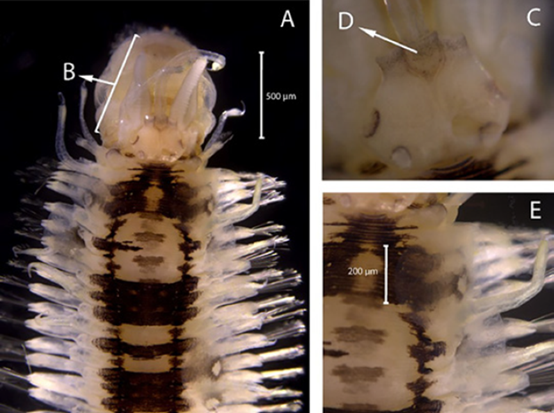
Diagnosis. Radiolas con estilodos pares, que se alternan con ojos compuestos, pareados (Figura 17B) y se distribuyen a lo largo de su longitud (Figuras 17C, 17D, 17E, 17F). Máculas presentes a lo largo de todo el cuerpo del individuo (Figura 17H). En cada parapodio se encuentra una mancha negra en la base de las setas notopodiales limbadas (Figuras 17I, 17J, 17K, 17L). El tórax (Figura 17G) presenta uncinos torácicos aviculares con manubrio corto y presentan dos espinas en la parte apical (Figura 17M). Con numerosos segmentos abdominales, con tori de uncini formando lóbulos cónicos, sin setas acompañantes (Figura 17K).
Potamethus spathiferus (Ehlers, 1901)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=130953).
Material examinado. Individuo 5,53 mm de longitud y un ancho de 0,89 mm (Figura 18A). Tres ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02075.
Diagnosis. Con corona branquiotentacular sin estilodos ni ojos compuestos, sus radios no están fusionados dorsalmente. Abdomen con numerosos segmentos. Los uncinos torácicos aviculares con manubrio muy largo y setas notopodiales del tórax simples paleadas y simples limbadas (Figuras 18C, 18D, 18E, 18F), los lóbulos ventrales del collar son prolongados (Figura 18B).
Familia Serpulidae Rafinesque, 1815
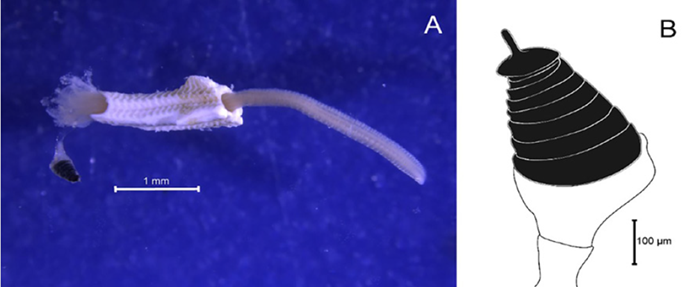
Hydroides bispinosa Bush, 1910
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=421083).
Material examinado. Individuo 4,12 mm de longitud y 0,28 mm ancho (Figura 19A, 19C). Cinco ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02052.
Descripción. Con corona branquiotentacular (Figura 19B), opérculo complejo con un embudo basal y un verticilo distal (Figura 19A, 19D, 19F, 19G, 19H, 19I, 1J). Las espinas del verticilo se encuentran curvándose hacia adentro y el pedúnculo opercular es suave y no se encuentra calcificado, sin alas ni procesos digitales. Los radios del embudo opercular tienen la punta redondeada. Setas abdominales con forma de trompeta aplanada. Espinas del verticilo con un par de espínulas laterales. Tubo fuertemente ornamentado sin costillas longitudinales internas (Figura 19E).
Hydroides deleoni (Bastida-Zavala & ten Hove, 2003)
Material examinado. Individuo 5,10 mm de longitud y 0,23 mm de ancho (Figura 20A). Un ejemplar depositado bajo el número de catálogo CBUMAG:MAC:02058.
Diagnosis. Corona branquiotentacular con un radiolo modificado en opérculo, el cual presenta un embudo basal y un verticilo distal (Figura 20A). El pedúnculo opercular es suave sin calcificar, sin alas ni procesos digitales. Embudo opercular con terminación aguda en cada radio (Figura 20E). Setas abdominales con forma de trompeta aplanada. Las espinas del verticilo sin espínulas laterales (Figuras 20B, 20C, 20D), además, el verticilo tiene un gancho dorsal libre, con una o más espinas dorsales más grandes que las otras y con puntas variables, además se encuentran apicalmente curvadas hacia adentro, sin ninguna protuberancia pronunciada. Tubo fuertemente ornamentado, sin costillas longitudinales internas.
Protula tubularia (Montagu, 1803)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=131035).
Material examinado. Individuo 4,76 mm de longitud y 0,43 mm de ancho (Figura 21A). Tres ejemplares depositados con el número de catálogo CBUMAG:MAC:02076.
Diagnosis. Este género y Subprotula son los únicos representantes de la familia sin opérculo. Radiolas sin procesos al final de la membrana interradiolar, corona con 12 a 15 radiolas por lóbulo. Las setas del collar son limbadas y los uncinos tienen un diente principal muy largo. La membrana torácica está bien desarrollada (Figura 21B). Setas abdominales conformadas por uncinos aciculares notopodiales y espinígeras limbadas en el neuropodio. Tubo calcáreo liso, poco ornamentado, simple y de color blanco, sin costillas longitudinales (Figura 21A).
Pseudovermilia fuscostriata (ten Hove, 1975)
Material examinado. Individuo 2,92 mm de longitud y 0,39 mm de ancho (Figura 22A). Tres ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02077.
Diagnosis. Región anterior con corona branquiotentacular y una de sus radiolas modificada en pedúnculo cilíndrico sin calcificar (Figura 22B). El opérculo no es negro, endurecido, rematado con una espina curva simple (Figura 22D, 22E), con surcos anulados profundos, su base es engrosada (Figura 22F). Setas abdominales geniculadas y tórax con setas tipo “apomatus”. El collar con setas, y la membrana torácica finaliza en el segundo setígero, uncinos torácicos con el diente anterior bifurcado. El tubo presentó bandas transversales de color pardo (Figura 22C).
Pseudovermilia occidentalis (McIntosh, 1885)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=131036).
Material examinado. Individuo 4,17 mm de longitud y 0,22 mm ancho (Figura 23A). Un ejemplar depositado con el número de catálogo CBUMAG:MAC:02079.
Diagnosis. Con pedúnculo opercular cilíndrico sin calcificar. El opérculo es negro con una espina simple (Figura 23B) que en algunos casos puede tener varias espinas menores o no tenerlas. Setas abdominales geniculadas y tórax con setas tipo “apomatus”. El collar con setas, la membrana torácica finaliza en el segundo setígero; los uncinos torácicos con el diente anterior bifurcado. Tubo blanco con una cresta longitudinal y surcos transversales a veces con peristomas (Figura 23A).
Pseudovermilia holcopleura (ten Hove, 1975)
Material examinado. Individuo 4,30 mm de longitud y 0,46 mm de ancho (Figura 24A). 15 ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02078.
Diagnosis. Pedúnculo opercular cilíndrico sin calcificar. El opérculo es transparente o blanco, con surcos anulados sutiles, en algunos casos con una espina distal (Figura 24C). Setas abdominales geniculadas y tórax con setas tipo “apomatus”. El collar con setas, y la membrana torácica finaliza en el segundo setígero; uncinos torácicos con el diente anterior bifurcado. Tubo calcáreo con una combinación blanca, parda, muy ornamentado, con anulaciones que en algunos casos pueden faltar (Figura 24B).
Familia Terebellidae Johnston, 1846
Scionides reticulata (Ehlers, 1887)
Sinónimos en:Read y Fauchald (2021) (acceso a través de https://www.marinespecies.org/aphia.php?p=taxdetails&id=334736).
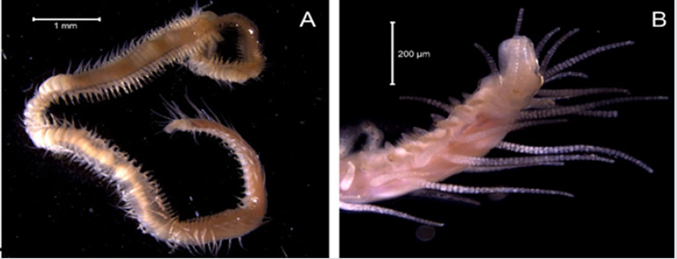
Material examinado. Individuo 14,9 mm de longitud y 0,9 mm de ancho (Figura 25A). Dos ejemplares depositados bajo el número de catálogo CBUMAG:MAC:02056.
Diagnosis. Cuerpo alargado, con 31 segmentos torácicos, es dorsalmente convexo y aplanado latero-ventralmente, estrechándose en el abdomen (Figura 25A). Tentáculos orales, numerosos y muy largos. Los uncinos torácicos en hileras dobles en algunos setígeros, como cremallera. Sin faringe eversible papilada y las notosetas tienen las puntas aserradas, limbadas. Tres pares de branquias filamentosas con tallos muy reducidos o en algunos casos sin tallos (Figura 25B).
DISCUSIÓN
Se adicionaron 23 nuevos registros para el mar Caribe colombiano a las especies listadas por Dueñas (1999), Báez y Ardila (2003), Dean (2012) y León et al. (2019). Algunas de ellas se encontraban registradas para la costa Pacífica de México y Estados Unidos, Caribe y el Golfo de México (Uebelacker y Johnson, 1984). Los géneros registrados en este estudio son de distribución variable en muchos sectores del Caribe y el Pacífico y hasta el momento, ninguna de las especies registradas es considerada como invasora.
El mayor número de especies pertenecen a la familia Serpulidae, reconocida como una de las más conspicuas en los ambientes arrecifales del Caribe colombiano (Bastida-Zavala, 2009). Los serpúlidos se destacan por la diversidad de formas de los opérculos y la variedad de ornamentaciones de los tubos calcáreos como las costillas longitudinales o transversales con mayor o menor grado de desarrollo, que pueden encontrarse en los géneros Hydroides y Pseudovermilia (Uebelacker y Johnson, 1984). Se encuentran principalmente asociados a sustratos duros o también pueden asentarse donde encuentren un sustrato sólido disponible como el constituido por las ARMS. Este tipo de arrecife artificial se considera como promotor para el reclutamiento y reproducción de organismos marinos (Seaman y Jensen, 2000) y las comunidades que se asientan pueden ser muy diferentes a las de su entorno (comúnmente arrecifal o rocoso).
Se resalta la presencia de algunas especies que han sido registradas previamente para el océano Pacífico (E. semisegregata, C. pilosus, L. virens, S. uniformis y A. mushaense), incluso algunas especies del género Hydroides y Pseudovermilia. Este patrón es compartido con otras investigaciones de anélidos pertenecientes a la meiofauna, como el caso de Lagos et al. (2018), quienes mencionaron que muchas de las especies presentadas como nuevos registros tienen un ámbito de distribución muy amplio y han sido halladas previamente en diferentes áreas del Caribe o incluso pueden tener registros en diferentes océanos (Rocha, 2003; Floeter et al., 2008; Luiz et al., 2012). Estos patrones de distribución geográfica se han encontrado también en otros organismos crípticos como ascidias (Nóbrega et al., 2004) y peces arrecifales (Floeter et al., 2008; Luiz et al., 2012) y pueden ser explicados por las etapas de dispersión que permiten el flujo de genes entre poblaciones distantes. Aun así, es importante profundizar en este aspecto en investigaciones futuras, debido a que Di Domenico (2014) menciona que algunas especies de anélidos de la macrofauna pueden tener larvas pelágicas que logran dispersarse, pero podría ser poco probable para otras especies como las intersticiales lograr hacer una dispersión tan amplia debido a que son desarrolladores directos (Schmidt y Westheide, 1999).
La metodología de las estructuras ARMS propuesta por la NOAA promueve un buen sustrato de asentamiento para organismos bentónicos móviles y sésiles (Leray y Knowlton, 2015), principalmente para anélidos que normalmente son considerados como pioneros en procesos de colonización y pueden ser contribuyentes substanciales entre los organismos que se adhieren a las placas (Pearman et al., 2016; Ransome et al., 2017). Los anélidos poseen larvas pelágicas que pueden mantenerse en la columna de agua desde 24 horas hasta 15 días en algunos casos, hasta encontrar un sustrato adecuado donde asentarse (García-Alonso et al., 2014); de esta forma, es posible que las larvas sean desplazadas hacia otros sitios, permitiendo ampliar su distribución geográfica. Teniendo en cuenta lo anterior, es necesario realizar mayores estudios en sustratos artificiales como recolectores de fauna arrecifal y comparar con lo que puede ser encontrado en un entorno natural y así enriquecer la información de la biodiversidad de anélidos del Caribe colombiano, además de incluir aspectos de la taxonomía integrativa con el fin de llegar a resultados más robustos. Se denota así la enorme diversidad de vida existente no solo en el área del banco de las Ánimas, sino en toda la plataforma del golfo de Salamanca, sobre todo si se considera la alta carga sedimentaria y la salinidad variable producto del aporte de la Ciénaga Grande de Santa Marta.
CONCLUSIONES
Las estructuras artificiales ARMS se constituyeron en una oportunidad de fijación para las larvas de muchas especies, para el caso del phylum Annelida, permitieron el hallazgo de 23 nuevos registros. Esto es una muestra potencial que invita a seguir investigando el sector de Montículo del banco de las Ánimas, su diversidad la biodiversidad marina y a continuar con programas de muestreo regulares que permitan incrementar el conocimiento de este grupo, así como el de otros pertenecientes a la criptofauna.
AGRADECIMIENTOS
Al apoyo financiero del fondo patrimonial de la Universidad del Magdalena-FONCIENCIAS. Especialmente, a la bióloga Adibe Cárdenas-Oliva por la valiosa ayuda con la revisión de los ejemplares. A la Dra. Paula Sepúlveda y a la bióloga Tania Franco por el préstamo y apoyo logístico de equipos en el uso del Laboratorio de Entomología de la Universidad del Magdalena
REFERENCIAS
Arévalo-Martínez, D. y A. Franco-Herrera. 2008. Características oceanográficas de la surgencia frente a la ensenada de Gaira, departamento del Magdalena, época seca menor de 2006. Bol. Inv. Mar. Cost., 37:1312-162. DOI: https://doi.org/10.25268/bimc.invemar.2008.37.2.195 [ Links ]
Báez, D.P. y N.E. Ardila. 2003. Poliquetos (Annelida: Polychaeta) del mar Caribe colombiano. Biota Col., 4: 89-109. [ Links ]
Bastida-Zavala, L.F. 2009. Capítulo 43: Serpulidae: 521. En: De León-González, J.A., J. Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y S. Solís-Weiss (Eds). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Beesley, P., G. Ross and C. Glasby. 2000. Polychaetes and allies: The southern synthesis. Fauna of Australia. Vol. 4. Polychaeta, Myzostomida, Pogonophoram, Echiura, Sipuncula. CSIRO Publishing, Melbourne. 465 p. [ Links ]
Bula-Meyer, G. y G. Díaz-Pulido. 1995. Macroalgas del banco de las Ánimas y nuevos registros para el Caribe colombiano. An. Inst. Invest. Mar. Punta Betín, 24: 173-183. [ Links ]
Camp, D.K., W.G. Lyons and T.H. Perkins. 1998. Checklists of selected shallow-water marine invertebrates of Florida. Fla. Mar. Res. Inst. Techn. Rep. TR-3, 238 p. [ Links ]
Carrera-Parra, L.F. 2001. Lumbrineridae (Annelida: Polychaeta) from the Grand Caribbean region with the description of six new species. J. Mar. Biol. Assoc. UK., 81(4): 599-621. DOI: https://doi.org/10.1017/S0025315401004271 [ Links ]
Carrera-Parra, L.F. 2009. Capítulo 15: Eunicidae: 171. En: De León-González, J.A., J. Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y S. Solís-Weiss. (Eds). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Dean, H.K. 2012. A literature review of the Polychaeta of the Caribbean Sea. Zootaxa, 3596: 1-86. DOI:https://doi.org/10.11646/zootaxa.3596.1.1 [ Links ]
De León-González, J. A., J. Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y S. Solís-Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731p. [ Links ]
Díaz, J., L. Barrios, J. Cendales, J. Garzón-Ferreira, G. Geister, M. López-Victoria, J. Ospina, B. Parra-Velandia, F. Pinzón, A. Vargas-Ángel, F. Zapata y S. Zea. 2000. Áreas coralinas de Colombia. Invemar, Ser. Publ. Esp., 5. 176 p. [ Links ]
Di Domenico, M., A. Martínez. P. Lana and K. Worsaae. 2014. Molecular and morphological phylogeny of Saccocirridae (Annelida) reveals two cosmopolitan clades with specific habitat preferences. Mol. Phyl. Evol., 75: 202-218. DOI: https://doi.org/10.1016/j.ympev.2014.02.003 [ Links ]
Dueñas, P.R. 1981. Inventario preliminar de los poliquetos (Annelida) de aguas someras de la bahía de Cartagena y áreas adyacentes. Bol. Mus. Mar, 10: 82-138. [ Links ]
Dueñas-Ramírez, R. 1999. Algunos poliquetos (Annelida) del Caribe colombiano. Rev. Milenio Fac. Cien. Bas. Univ. Córd., 1(2): 9-18. [ Links ]
Dueñas-Ramírez, R. y A. Dueñas-Lagos. 2016. Primer registro de Branchiomma coheni (Polychaeta: Sabellidae) en las costas del Caribe colombiano. Rev. Mar. Cost., 8(2): 101-105. DOI: https://doi.org/10.15359/revmar.8-2.7 [ Links ]
Fauchald, K. 1977. The polychaete worms. Definitions and keys to the orders, families and genera. Nat. Hist. Mus. LA County. Sci. Ser., 28: 1-190. DOI: https://doi.org/10.15359/revmar.8-2.7 [ Links ]
Fauchald, K. y A.A. Reimer. 1975. Clave de poliquetos panameños con la inclusión de una clave para todas las familias del mundo. Bol. Inst. Oceanogr. Univ. Oriente., 14:71-94. [ Links ]
Felder, D.L. and D.K. Camp. (Eds). 2009. Gulf of Mexico origin, waters, and biota: biodiversity: 762-788. Texas A&M Univ., Texas. [ Links ]
Ferreira-Gil, J.C. 2011. The European fauna of Annelida Polychaeta. Stein Girona S.L, Girona. 1545 p. [ Links ]
Floeter, S. R., L.A. Rocha, D.R. Robertson, J.C. Joyeux, W.F. Smith-Vaniz, P. Wirtz, A. J. Edwards, J. P. Barreiros, C. E. L. Ferreira, J. L. Gasparini, A. Brito, J. M. Falcón, B. W. Bowen and G. Bernardi. 2008. Atlantic reef fish biogeography and evolution. J. Biogeogr., 35: 22-47. DOI: https://doi.org/10.1111/j.1365-2699.2007.01790.x [ Links ]
Franco, A. 2005. Oceanografía de la ensenada de Gaira: El Rodadero, más que un centro turístico en el Caribe colombiano. Univ. Bogotá Jorge Tadeo Lozano, Santa Marta. 58 p. [ Links ]
García-Alonso, J.N., S. Rodríguez-Sánchez, E. Misra, M. Valsami-Jones, S. Croteau, S. Luoma and P. Rainbow. 2014. Toxicity and accumulation of silver nanoparticles during development of the marine polychaete Platynereis dumerilii. Sci. Total. Environ., 476-477: 688-695. DOI: https://doi.org/10.1016/j.scitotenv.2014.01.039 [ Links ]
García-Urueña, R., A. Acero P., S. Zea, N. Ardila, H.A. Hernández, M. Cabarcas y E. Pineda-Munive. 2020. El banco de las Ánimas: Valoración de su biodiversidad. Unimagdalena, Santa Marta. 136 p. [ Links ]
Góngora-Garza, G. 2009. Capítulo: 48, Syllidae: 615. En: De León-González, J.A., J. Bastida-Zavala, J. García-Garza, M. Peña-Rivera, A. Salazar-Vallejo, S. Solís y V. Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Grimes, C.J., C. Capps. L.H. Petersen and A. Schulze. 2020. Oxygen consumption during and post-hypoxia exposure in bearded fireworms (Annelida: Amphinomidae). J. Comp. Physiol. B., 190: 681-689. DOI: https://doi.org/10.1007/s00360-020-01308-y [ Links ]
Harris, L., J. León-González y S. Salazar-Vallejo. 2009. Capítulo 2: Morfología, métodos, clave para familias y clasificación: 3. En: De León-González, J.A., J. Bastida-Zavala, J. García-Garza, M. Peña-Rivera, A. Salazar-Vallejo, S. Solís y V. Weiss (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Lagos, A.M., M.V. León, S. Quiroga and A. Martínez. 2018. Interstitial annelids from the Caribbean coast of Colombia. Rev. Biol. Trop., 66(2): 658-673. DOI: http://dx.doi.org/10.15517/rbt.v66i2.33399 [ Links ]
León, M.V., A.M. Lagos, S. Quiroga and P.R. Dueñas. 2019. Polychaetes of the Caribbean coast of Colombia: an update checklist and some taxonomic annotations. Rev. Acad. Colomb. Cienc. Ex. Fis. Nat., 43(169): 646-652. DOI: https://doi.org/10.18257/raccefyn.802 [ Links ]
Leray, M. and N. Knowlton. 2015. DNA barcoding and metabarcoding of standardized samples reveal patterns of marine benthic diversity. Proc. Natl. Acad. Sci. USA., 112(7): 2076-2081. DOI: https://doi.org/10.1073/pnas.1424997112 [ Links ]
Liñero-Arana, I. y O. Díaz. 2010. Amphinomidae y Euphrosinidae (Annelida: Polychaeta) de la costa nororiental de Venezuela. Lat. Am. J. Aquat. Res., 38: 107-120. DOI: https://doi.org/10.3856/vol38-issue1-fulltext-10 [ Links ]
Londoño-Mesa, M.H. 2009. Capítulo 49: Terebellidae: 641. En: De León-González, J.A., J. Bastida-Zavala, M. García-Garza, A. Peña-Rivera, S. Salazar-Vallejo y V. Solís-Weiss. (Eds.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Londoño-Mesa, M., E. Montoya-Cadavid y C. Arteaga-Flórez. 2016. Gusanos marinos (Poliquetos) de la Biosfera de Seaflower. In: Vides, M., D. Alonso, E. Castro y N. Bolaños (Eds.) Biodiversidad del mar de los siete colores. Inst. Invest. Mar. Cost.- Invemar, Corp. Desarr. Sost. Archipiélago de San Andrés, Providencia y Santa Catalina-Coralina. Ser. Publ. Gen. Invemar, 84. 228 p. [ Links ]
Luiz, O. J., J.S. Madin, D.R. Robertson, L.A. Rocha, P. Wirtz and S.R. Floeter. 2012. Ecological traits influencing range expansion across large oceanic dispersal barriers: insights from tropical Atlantic reef fishes. Proc. R. Soc. Lond., 279: 1033-1040. DOI: https://doi.org/10.1098/rspb.2011.1525 [ Links ]
Moews-Asher, M., C. Castor, K. Reardon and M. Timmers. 2018. Field guide to cryptic marine invertebrates of the Philippines: a sample of biodiversity from Autonomous Reef Monitoring Structures. NOAA Pacific Islands Fisheries Science Center, PIFSC Special Publication, Philippines. 86 p. [ Links ]
NOAA. 1996. Strategy for stewardship: Florida Keys National Marine Sanctuary Final Management Plan/Environmental Impact Statement, Volume III: Appendices. Nat. Ocean. Atmosph. Admin. Nat. Ocean Serv. Silver Spring, USA. 319 p. [ Links ]
Nóbrega, R., A.M. Solé-Cava and C.A.M. Russo. 2004. High genetic homogeneity of an intertidal marine invertebrate along 8000 km of the Atlantic coast of the Americas. J. Exp. Mar. Biol. Ecol., 303(2): 173-181. DOI: https://doi.org/10.1016/j.jembe.2003.11.009 [ Links ]
Pearman, J.K., H. Anlauf, X. Irigoien and S. Carvalho. 2016. Please mind the gap e Visual census and cryptic biodiversity assessment at central Red Sea coral reefs. Mar. Environ. Res., 118: 20-30. DOI: https://doi.org/10.1016/j.marenvres.2016.04.011 [ Links ]
Piazzolla, D., V. Cafaro, E. Mancini, S. Scanu, S. Bonamano and M. Marcelli. 2020. Preliminary investigation of microlitter pollution in low-energy hydrodynamic basins using Sabella spallanzanii (Polychaeta: Sabellidae) tubes. Bull. Environ. Contam. Toxicol., 104:345-350. DOI: https://doi.org/10.1007/s00128-020-02797-x [ Links ]
Quirós-Rodríguez, J., R. Dueñas-Ramírez y N.H. Campos. 2013. Poliquetos (Annelida: Polychaeta) asociados a algas rojas intermareales de Córdoba, Caribe colombiano. Rev. Biol. Mar. Oceanogr., 48: 87-98. DOI: http://dx.doi.org/10.4067/S0718-19572013000100008 [ Links ]
Ransome, E., J.B. Geller, M. Timmers, M. Leray, A. Mahardini, A. Sembiring, A.G. Collins and C.P. Meyer. 2017. The importance of standardization for biodiversity comparisons: A case study using autonomous reef monitoring structures (ARMS) and metabarcoding to measure cryptic diversity on Mo’orea coral reefs, French Polynesia. PLoS ONE, 12(4): e0175066. DOI: 10.1371/journal.pone.0175066 [ Links ]
Read, G. and K. Fauchald (Eds). 2021. World polychaeta database. http://www.marinespecies.org/polychaeta 01/07/2021. [ Links ]
Rocha, L. A. 2003. Patterns of distribution and processes of speciation in Brazilian reef fishes. J. Biogeogr., 30: 1161-1171. https://doi.org/10.1046/j.1365-2699.2003.00900.x [ Links ]
Rodríguez-Gómez, H. 1988. Contribución al conocimiento de los anélidos (Annelida: Polychaeta) de aguas someras en la bahía de Nenguange, Parque Nacional Natural Tayrona, Colombia. Trianea, 2: 403-443. [ Links ]
Salazar-Silva, P. 2006. Scaleworms (Polychaeta: Polynoidae) from the Mexican Pacific and some other eastern Pacific sites. Lat. Am. J. Aquat. Res., 34(2): 143-161. DOI: http://dx.doi.org/10.4067/S0717-71782006000200014 [ Links ]
Salazar-Silva, P y S. Salazar-Vallejo. 2009. Capítulo 48: Sigalionidae, pág. 579. En: De León-González, J., J. Bastida-Zavala, M. García-Garza, A. Peña-Rivera, S. Salazar-Vallejo y V. Solís-Weiss (Eds). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Salazar-Vallejo, S. 2009. Capítulo 39: Polynoidae, pág. 449. En: De León-González, J., J. Bastida-Zavala. M. García-Garza. A. Peña-Rivera. S. Salazar-Vallejo y V. Solís-Weiss. (Ed.). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Universidad Autónoma de Nuevo León, México. 731 p. [ Links ]
Salazar-Vallejo, S.I. y M.H. Londoño-Mesa. 2004. Lista de especies y bibliografía de poliquetos (Polychaeta) del Pacífico Oriental Tropical. An. Inst. Biol. Ser. Zool., 75: 9-97. [ Links ]
Schmidt, H. and W. Westheide. 1999. Genetic relationships (RAPD-PCR) between geographically separated populations of the “cosmopolitan” interstitial polychaete Hesionides gohari (Hesionidae) and the evolutionary origins of the freshwater species Hesionides riegerorum. Biol. Bull., 196: 116-126. [ Links ]
Seaman, W. and A. Jensen. 2000. Purposes and practices of artificial reef evaluation: 1-19. In: Seaman, W. (Ed). Artificial reef evaluation: with application to natural marine habitats. CRC Press. [ Links ]
Solís-Weiss, V. 1995. Atlas de anélidos poliquetos de la plataforma continental del sur del golfo de México. Univ. Nal. Aut. México, Inst. Cienc. Mar Limnol., México. 425 p. [ Links ]
Struck, T.H. 2011. Direction of evolution within Annelida and the definition of Pleistoannelida. J. Zool. Syst. Evol. Res., 49(4): 340-345. DOI: https://doi.org/10.1111/j.1439-0469.2011.00640.x [ Links ]
ten Hove, H.A. 1975. Serpulinae (Polychaeta) from the Caribbean: III-The genus Pseudovermilia (including species from other regions). Stud. Fauna Curaçao Carib. Isl., 47: 46-101. [ Links ]
Tovar-Hernández, M. 2009. Capítulo 42: Sabellidae: 482. En: De León-González, J.A., J. Bastida-Zavala, M. García-Garza, A. Peña-Rivera, S. Salazar-Vallejo y V. Solís-Weiss. (Eds). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Tovar-Hernández, M. A. and P. Knight-Jones. 2006. Species of Branchiomma (Polychaeta: Sabellidae) from the Caribbean Sea and Pacific coast of Panama. Zootaxa, 1189: 1- 37. DOI: https://doi.org/10.11646/zootaxa.1189.1.1 [ Links ]
Uebelacker, J.M. and P.G. Johnson. 1984. Taxonomic guide to the polychaetes of the northern Gulf of Mexico. Minerals Management Service U.S. Depart. Interior, Mobile. 202 p. [ Links ]
Yáñez-Rivera, B. 2009. Capítulo 7: Amphinomidae: 77. En: De León-González, J.A., J. Bastida-Zavala, M. García-Garza, A. Peña-Rivera, S. Salazar-Vallejo y V. Solís-Weiss. (Eds). Poliquetos (Annelida: Polychaeta) de México y América Tropical. Univ. Aut. Nuevo León, México. 731 p. [ Links ]
Zea, S., G. Bernal, G. López, M. Weber y R.P. García-Urueña. 2019. Arrecifes de arenisca en el golfo de Salamanca, plataforma continental del Caribe colombiano. Bol. Inv. Mar. Cost., 48: 153-158. DOI: https://doi.org/10.25268/bimc.invemar.2019.48.1.762 [ Links ]
Recibido: 01 de Septiembre de 2020; Aprobado: 15 de Julio de 2021











 text in
text in