Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versão impressa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.51 no.1 Santa Marta jan./jun. 2022 Epub 01-Ago-2022
https://doi.org/10.25268/bimc.invemar.2022.51.1.1016
ARTICULO DE INVESTIGACIÓN
Cultivo suspendido de la ostra perlera alada Pteria colymbus (Röding), en diferentes condiciones hidrográficas y métodos de cultivo
1Doctorado en Acuicultura. Programa Cooperativo Universidad de Chile, Universidad Católica del Norte, Pontificia Universidad Católica de Valparaíso, Chile. jormilesteban@gmail.com
2Facultad de Medicina, Universidad Católica del Norte, Campus Guayacán, Larrondo 1281, Coquimbo, Chile. jhpj85@hotmail.com
3Escuela Superior Politécnica del Litoral (ESPOL), Centro Nacional de Acuicultura e Investigaciones Marinas (CENAIM), Campus Gustavo Galindo, Km 30,5 vía Perimetral P.O. Box 09-01-5863, Guayaquil, Ecuador. ajmm16@hotmail.com
4Grupo de Investigación en Biología y Cultivo de Moluscos, Escuela de Acuicultura y Pesquerías, Facultad de Ciencias Veterinarias, Universidad Técnica de Manabí, Bahía de Caráquez, Manabí, Ecuador. cesarlodeirosseijo@yahoo.es
5Centro de Investigaciones Biológicas del Noroeste, S.C. La Paz, Baja California Sur 23000, México. psaucedo04@cibnor.mx
6Instituto Oceanográfico de Venezuela, Universidad de Oriente, Apartado Postal 245, CP: 6101, Cumaná, Venezuela
The performance of the winged pearl oyster Pteria colymbus juveniles under suspended culture conditions was evaluate, including five culture methods and two seasons: upwelling and non-upwelling. Culture methods comprised enclosures confining the oysters: BTBC, BBO and BTO; and two other unconfined-oyster: OFOB and FNS. The initial shell height of the oysters ranged between 31-35 mm in both seasons. The increase in shell size and dry mass of soft tissues showed significant differences between seasons. Greatest growth occurred with the OFOB and FNS unconfined methods. The ANOVA II analysis showed significant differences between the variables obtained in both stations and culture methods. Principal Component Analysis showed that the interactions between the variables: temperature (inverse relationship), and UI, chl-a and POM (direct relationship) explained 89 % of the variability of the growth of the oysters. Given the low survival rates, attributed to the presence of predators within the closed enclosures and the higher growth seen in the culture methods without confinement, we recommend using the FNS and OFOB methods, taking advantage of the byssus produced by P. colymbus.
Keywords: Caribbean Sea; winged oysters; shellfish farming; survival; coastal upwelling
El desempeño de los juveniles de ostra perla alada Pteria colymbus fue evaluado bajo condiciones suspendidas, en cinco métodos de cultivo y en los periodos hidrográficos de surgencia y no surgencia. Los métodos de cultivo comprendieron recintos que confinaban las ostras (BTBC, BBO y BTO); y otros dos que no las confinaban (OFOB y FNS). La altura inicial de la concha de las ostras osciló entre 31 y 35 mm, en ambas temporadas. El incremento en la concha y la masa seca de los tejidos blandos mostraron diferencias significativas entre estaciones. El mayor crecimiento se produjo con los métodos no confinados OFOB y FNS. El análisis ANOVA II mostró diferencias significativas entre las variables obtenidas tanto en las estaciones como en los métodos de cultivo. El Análisis de Componentes Principales mostró que las interacciones entre las variables: temperatura (relación inversa), UI, Clorofila y POM (relación directa) explicaron 89 % de la variabilidad del crecimiento de las ostras. Dadas las bajas tasas de supervivencia, atribuidas a depredadores observados dentro de los recintos cerrados y al mayor crecimiento observado en los métodos de cultivo sin confinamiento, se recomienda el empleo de los métodos FNS y OFOB, aprovechando el biso producido por P. colymbus.
Palabras claves: Mar Caribe; ostra alada; cultivo de moluscos; supervivencia; surgencias costeras
INTRODUCCIÓN
En el mar Caribe, los moluscos bivalvos siempre han mantenido la expectativa de su cultivo masivo, particularmente en la costa nororiental de Venezuela. Se ha prestado especial atención al cultivo de algunas especies como el mejillón marrón Perna perna, la ostra de mangle Crassostrea rhizophorae y la ostra americana C. virginica, los cuales han sido objeto de cultivo comercial por décadas. De manera similar, otras especies para las cuales se han desarrollado cultivos experimentales incluyen las vieiras Euvola ziczac, Nodipecten nodosus y Argopecten nucleus, el mejillón verde Perna viridis y las ostras perlíferas Pteria colymbus y Pinctada imbricata (Lodeiros y Freites, 2008).
Una de las especies de ostra perlífera con doble meta de producción (fuente de proteínas para humanos y producción de perlas) es la ostra alada perlera del Atlántico, P. colymbus (Röding, 1798). Esta especie epibéntica de la familia Pteriidae alcanza una altura máxima de la concha de 60-70 mm, habita la zona submareal a profundidades entre 3 y 10 m, se adhiere a substratos duros como las rocas y los octocorales y está distribuida a lo largo del Atlántico occidental, desde Carolina del Norte hasta el sur de Brasil (Díaz y Puyana, 1994; Lodeiros et al, 1999a). En Colombia, Brasil y Venezuela se han realizado algunos estudios encaminados a determinar la viabilidad biológica del cultivo de P. colymbus, específicamente para obtener semillas con recolectores artificiales y para cultivarlos en el campo hasta un tamaño comercial de 5-6 cm (Lodeiros et al., 1999b; Márquez et al., 2000; Urban, 2000; Mengual et al., 2011; Freites et al., 2017). Asimismo, Lara et al. (2009) y Romero et al. (2009) adaptaron y transfirieron esta tecnología de cultivo a las comunidades indígenas de La Guajira, en el área del Caribe colombiano. Hasta el momento, los resultados de la integración de esta tecnología como parte de programas de capacitación para el sustento han sido alentadores.
El desarrollo de métodos óptimos de cultivo para maximizar el crecimiento y la supervivencia de las ostras perlíferas juveniles ha sido importante para reducir el tiempo que se requiere para alcanzar un tamaño operable para la producción de perlas (Millione y Southgate, 2011). En el caso de la P. sterna, una especie emparentada con P. colymbus, algunos autores han determinado un crecimiento y supervivencia diferenciales en individuos ubicados en distintos tipos de recinto en cultivos suspendidos (Millione y Southgate, 2011) o entre el cultivo suspendido y el cultivo en el fondo del mar (Gaytán-Mondragón et al., 1993). Por ejemplo, Gaytán-Mondragón et al. (1993) reportaron un 99 % de supervivencia de ostras en cestas tipo bolsillo, 84 % en las linternas y 98 % en jaulas de fondo. Concluyeron que el tipo de cesta y la ubicación tienen un rol importante en el cultivo de la especie. Millione y Southgate (2011) mostraron que la elección del sitio y el método de cultivo son parámetros importantes para optimizar el crecimiento y supervivencia de P. penguin durante la fase de criadero de su cultivo. El método de cultivo también tiene influencia sobre la calidad de las medias perlas (mabés) producidas por P. sterna (Ruiz-Rubio et al., 2006), ya que no hubo diferencias significativas en el crecimiento de las ostras perlas contenidas en jaulas de plástico y redes de bolsillo, pero hubo un mayor rendimiento de perlas de calidad comercial para las que se cultivaron en jaulas de plástico.
El sur del mar Caribe, y en particular la costa nororiental de Venezuela, se encuentra bajo la influencia de la surgencia costera (Okuda et al., 1978; Jury, 2018). Las altas concentraciones de nutrientes durante periodos específicos del año estimulan la productividad del fitoplancton, y se ha planteado la hipótesis de que los ciclos de ausencia y presencia de surgencia modulan la disponibilidad de alimento planctónico para algunas especies bentónicas, que a su vez influyen en sus patrones de crecimiento (Puccinelli et al., 2016). Los vientos alisios predominantes que soplan paralelos a la costa y la topografía de la plataforma continental favorecen la surgencia de aguas subtropicales ricas en nutrientes, con una intensificación estacional entre diciembre y abril (Müller-Karger y Aparicio-Castro, 1994; Freites et al., 2017). Hace poco, Rueda-Roa et al. (2018) mostraron la presencia de un ciclo de surgencia a mitad de año (junio-agosto) en la costa nororiental de Venezuela, que se atribuye a la intensificación de la corriente del Caribe durante este periodo. Este patrón ayuda a mantener un ecosistema de alta productividad y variabilidad en la columna de agua, que a su vez afecta las características de la temperatura y la clorofila (Okuda et al., 1978; Rueda-Roa, 2012; Müller-Karger et al., 2013).
El objetivo de este estudio fue evaluar el crecimiento y supervivencia de juveniles de P. colymbus (hasta talla comercial) en cinco métodos de cultivo suspendido, durante dos temporadas hidrográficas que ocurren en el Golfo de Cariaco (surgencia y sin surgencia), como una estrategia para avanzar en la optimización de un método viable de cultivo para esta especie de bivalvo, en el marco de la producción de mariscos del Mar Caribe.
MATERIALES Y MÉTODOS
Fuente de juveniles y diseño experimental
Los juveniles se obtuvieron del desove natural en 2014 por medio de bolsas (bolsas de cebolla verde llenas de cinco bolsas de cebolla verde) y después se suspendieron de una línea larga de 100 m de largo, ubicada en Turpialito (Figura 1), estado de Sucre, Venezuela (10° 26’56 “N; 64° 02’00” W). Esta línea larga se ubicó de manera paralela y a 50 m de la costa, en un lugar con una profundidad de 7-8 m, donde se sumergieron cinco métodos de cultivo a 4 m de profundidad.
Cada método de cultivo estudiado incluyó tres recintos (réplicas) que contenían las ostras: canastas con tapas arriba y abajo (BTBC), canastas sin tapas abajo (BBO) y canastas sin tapas arriba (BTO); así como dos métodos sin confinamiento: ostras fijadas sobre canastas (OFOB) y ostras fijadas sobre cuerdas de redes de pesca (FNS), mediante un soporte de malla diseñado para este fin. Se utilizaron tres réplicas con 15 juveniles cada una en cada uno de los cinco métodos de cultivo (225 ostras). Para el muestreo inicial de las variables biométricas de las ostras, se tomaron tres réplicas adicionales de cinco juveniles cada una (15 ostras adicionales para un total de 240 ostras por temporada). Las dimensiones de los distintos métodos de cultivo (con un área aproximada de 1500 cm²) y sus principales características se muestran en la Figura 2. Todas las canastas se fabricaron con redes de plástico de propileno Ø de 2×2 cm2, con un diseño que permitió la evaluación del método menos afectado por la acción depredadora de gasterópodos de la familia Ranellidae. Esto, teniendo en cuenta que los bivalvos no confinados suelen mostrar tasas menores de depredación que los bivalvos confinados (Semidey et al., 2010).
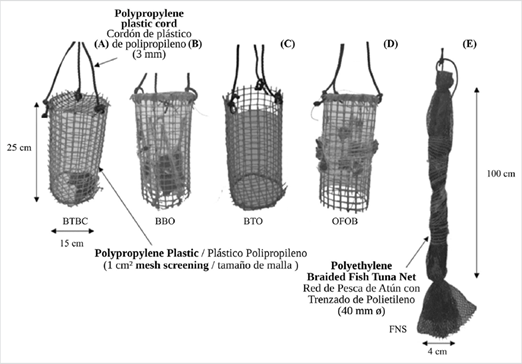
Figura 2 Diferentes tipos de métodos de cultivo suspendido utilizados para el crecimiento de juveniles de la ostra perlífera P. colymbus con individuos confinados: A) canastas con tapas arriba y abajo; B) canastas sin tapas abajo; canastas sin tapa arriba (BTO); e individuos no confinados: D) ostras fijadas sobre canastas (OFOB); y E) sobre cuerdas de redes de pesca (FNS).
Crecimiento y supervivencia
La altura inicial de la concha de las ostras era de 33,28 ± 2,2 mm, tanto para la temporada de surgencia como para la temporada sin surgencia. Las características de crecimiento y supervivencia se evaluaron por 90 días durante cada temporada, de julio a septiembre de 2014 (sin surgencia) y de marzo a mayo de 2015 (surgencia), que fueron establecidas por los regímenes de vientos alisios y la corriente del Caribe, lo cual permitió evaluar la influencia de la variabilidad ambiental. Durante ambos periodos de cultivo, no se llevaron a cabo controles de depredadores y competidores; estos solo se realizaron al final de ambos periodos.
Para medir el crecimiento de las ostras en cada tratamiento, se tomaron de manera aleatoria tres réplicas con cinco ostras de cada uno de los tratamientos. Después de remover toda la fauna incrustada de la superficie de la concha, se midió su altura con un calibre digital (Mitutoyo, ± 0,01 mm). La masa seca de las incrustaciones, la concha y los tejidos blandos (STDM) de las ostras se obtuvieron mediante deshidratación en un horno a 60 °C por 72 h y se pesaron en una balanza digital (OHAUS Adventurer, ± 0,001 g).
Se evaluó la supervivencia por medio del conteo de especímenes vivos al final de cada temporada para los distintos métodos de cultivo. La presencia o ausencia de depredadores se tuvo en cuenta para cada caso, en aras de establecer su influencia en el rendimiento de las ostras. El índice de condición adimensional (CI) se calculó como la relación de la masa seca de los tejidos blandos dividida entre la masa seca total de la ostra, por 100 (Narváez et al., 2008).
Factores ambientales
La temperatura del agua se midió continuamente en intervalos de 60 min utilizando un termógrafo electrónico (Minilog, Vemco, Canadá, 0,01 °C). Se tomaron muestras de agua semanales (a las profundidades de cultivo) con una botella Niskin (5-L). Se incluyó una submuestra para determinar la concentración de oxígeno con el método Winkler, de acuerdo con las recomendaciones de Strickland y Parsons (1972). El agua restante de la botella Niskin se transfirió a contenedores opacos de plástico para transportarla al laboratorio, después de lo cual se prefiltraron dos réplicas de 1,5-L (153 μm) para remover el material de partículas grandes y el zooplancton y después determinar la clorofila a y el material particulado orgánico (POM). Estas muestras se filtraron con filtros pre-quemados GF/F de 0,7-μm (450 °C por 4 h), se pesaron y se enjuagaron con formiato isotónico de amonio (0,5 M). Se deshidrataron los filtros a 60 °C/24 h para determinar el POM usando métodos gravimétricos. Luego de incinerar los filtros a 450 °C/4 h en un horno de mufla, se determinó el seston inorgánico. Se estimó la abundancia de fitoplancton como la clorofila a (Chl-a) por medio del método espectrofotométrico, siguiendo las recomendaciones de Strickland y Parsons (1972). Al final de cada sesión, se extrajeron con cuidado las incrustaciones de las conchas y se pesaron después de secarlas a 80 °C/72 h.
Para determinar el índice de surgencia, se consideró la metodología propuesta por Freites et al. (2017), utilizando la fórmula descrita por Bowden (1983) y modificada por Lavin et al. (1991). Para determinar la velocidad del viento y la altura de las olas (H) durante las temporadas evaluadas, se utilizó la base de datos de la plataforma virtual Windguru (https://www.windguru.cz/67638).
Análisis estadístico
La homogeneidad de la varianza de los datos se confirmó con el test de Levene. A continuación se realizó un análisis de varianza de un solo factor (ANOVA I) para buscar diferencias significativas en los incrementos del tamaño y la masa de la concha, la masa de tejidos blandos, las incrustaciones biológicas, la supervivencia y el índice de condición de las ostras, de los cinco tratamientos de cultivo para en cada temporada de cultivo (surgencia o sin surgencia) y las variables ambientales que se observaron en ambas temporadas. Las variables biométricas que mostraron diferencias significativas (p< 0,05) se evaluaron mediante un análisis de Tukey a posteriori. Los datos de tamaño y biomasa se transformaron previamente a Log10 (Zar, 1996). Además, se ejecutó un análisis de varianza de dos factores (ANOVA II) para detectar si la temporada, los métodos de cultivo y la interacción de estas dos fuentes de variación influenciaban los resultados que se obtuvieron. Cuando se observaron diferencias significativas en algunas interacciones, se realizó un análisis ortogonal de contraste siguiendo las recomendaciones de Yossa y Verdegem (2015). En este caso, se evaluaron las diferencias significativas entre medias usando el test de Duncan y el software SPPS 23.0 (IBM SPSS Statitstics). Todos los análisis restantes se llevaron a cabo con el paquete estadístico SYSTAT 12.02.A.
El método de gestión gráfica, o Análisis de Componentes Principales (PCA), se utilizó para identificar la modulación de la variabilidad ambiental y su influencia en la masa de tejidos blandos, el CI y la mortalidad entre las dos temporadas de estudio y los métodos de cultivo (Chatfield y Collins, 1980). En este caso se utilizó el paquete estadístico CANOCO (v. 4) (Ter y Smilauer, 1998).
RESULTADOS
Crecimiento de la concha
En general, los aumentos en la altura de la concha durante la temporada sin surgencia fueron significativamente más altos (ANOVA I, p< 0,05) en las ostras cultivadas en canastas BTBC (13,76 ± 0,35 mm), BTO (12,95 ± 0,29 mm) y FNS (11,50 ± 0,67 mm), en comparación con aquellas cultivadas en canastas OFOB (10,71 ± 1,00 mm) y BBO (10,20 ± 0,18 mm), donde el crecimiento fue más bajo (Figura 3). Durante la temporada de surgencia, las ostras con incrementos más altos en la altura de la concha (ANOVA I, p< 0,05) fueron aquellas que se cultivaron en FNS (30,98 ± 0,69 mm) y OFOB (30,24 ± 1,09 mm), lo cual contrasta con aquellas cultivadas en canastas BTBC (28,49 ± 0,24 mm), BTO (28,42 ± 0,24 mm) y BBO (27,63 ± 0,19 mm), donde el crecimiento fue más bajo (Figura 3).
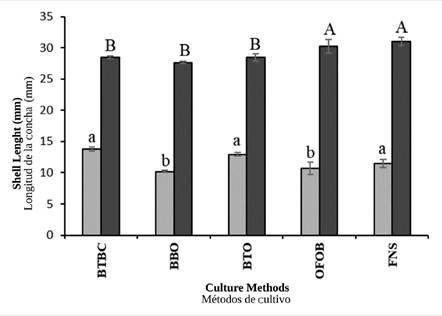
Figura 3 Incrementos que se observaron en la altura de la concha de la ostra perlífera P. colymbus para cada método de cultivo y temporada hidrográfica (barras claras: sin surgencia; barras oscuras: con surgencia). Las letras idénticas en superíndice indican la falta de diferencias significativas a p < 0,05. Las líneas verticales indican la desviación estándar.
Masa seca de tejidos blandos (STDM)
Durante la temporada sin surgencia, el incremento de la masa seca de tejidos blandos fue significativamente mayor (ANOVA I, p< 0,05) en las ostras cultivadas en canastas BTBC (0,63 ± 0,04 g), FNS (0,61 ± 0,01 g) y OFOB (0,58 ± 0,01 g), en comparación con aquellas cultivadas en BTO (0,52 ± 0,03 g) y BBO (0,50 ± 0,04 g), donde el crecimiento fue menor (Figura 4A). Durante la temporada de surgencia, las ostras que mostraron incrementos significativamente más altos en la masa seca de tejidos blandos (ANOVA I,p< 0,05) fueron las cultivadas en FNS (5,28 ± 0,03 g) y OFOB (5,19 ± 0,11 g); las ostras con el menor crecimiento fueron las cultivadas en BTBC (4,77 ± 0,22 g), BBO (4,67 ± 0,29 g) y BTO (4,66 ± 0,30 g) (Figura 4A).
Masa seca de la concha
Durante la temporada sin surgencia, el incremento de la masa seca de la concha fue significativamente más alto (ANOVA I, p< 0,05) en ostras cultivadas en canastas BTBC (4,45 ± 0,19 g), OFOB (4,44 ± 0,31 g), FNS (4,19 ± 0,35 g) y BTO (3,94 ± 0,45 g), en comparación con aquellas cultivadas en BBO (3,66 ± 0,41 g), donde el crecimiento fue menor (Figura 4B). Al final de la temporada de surgencia, las ostras que mostraron incrementos significativamente más altos en la masa seca de la concha (ANOVA I, p< 0.05) fueron las cultivadas en FNS (10,20 ± 0,11 g), OFOB (9,91 ± 0,16 g) BTBC (9,47 ± 0,59 g); y las ostras con el crecimiento más bajo fueron las cultivadas en BTO (8,93 ± 0,70 g) y BBO (8,73 ± 0,25 g) (Figura 4B).
Índice de condición (CI)
En la temporada sin surgencia, el CI no mostró diferencias significativas (ANOVA I, p> 0.05) entre los métodos FNS (14,53 ± 0,31), BTBC (14,25 ± 0,37), BBO (13,93 ± 0,72), BTO (13,62 ± 0,48) y OFOB (13,57 ± 0,29) (Figura 4C). Durante la temporada de surgencia, las ostras que mostraron incrementos significativamente mayores en el CI (ANOVA I, p< 0,05) fueron aquellas cultivadas en OFOB (37,63 ± 0,59) y FNS (37,48 ± 0,09), mientras que las ostras con el menor crecimiento fueron las cultivadas en BTO (36,23 ± 0,47), BTBC (35,58 ± 0,22) y BBO (35,33 ± 0,35) (Figura 4C).
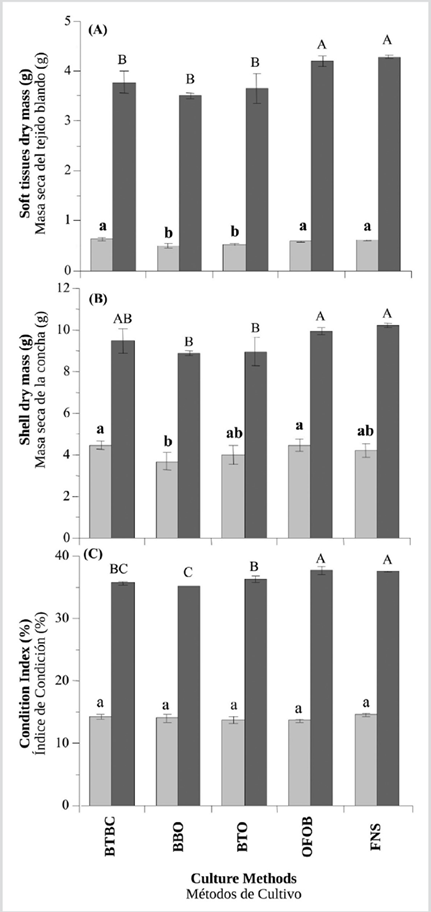
Figura 4 A) Masa seca de los tejidos blandos, B) concha e C) índice de condición de los juveniles de la ostra perlífera P. colymbus, en cada método de cultivo y durante las dos temporadas (barras claras: sin surgencia; barras oscuras: surgencia). Las letras idénticas en superíndice denotan la falta de diferencias significativas a p < 0,05. Las líneas verticales indican la desviación estándar.
Supervivencia
No se observaron diferencias significativas entre los métodos de cultivo (ANOVA I, p> 0,05), independientemente de la variabilidad en cada tratamiento, en especial durante la temporada sin surgencia (Figura 5A). Las canastas BTBC mostraron la supervivencia más alta (52,78 ± 9,62 %) durante la época sin surgencia, mientras que las canastas BTO (88,90 ± 10,18 %) hicieron lo mismo durante la temporada de surgencia.
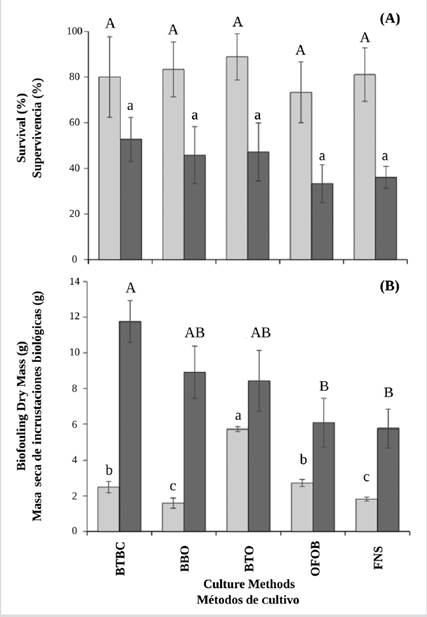
Figure 5 A) Supervivencia y B) masa seca de las inscrustaciones biológicas fijadas sobre la superficie de la concha de la ostra alada P. colymbus en cada método de cultivo y durante las dos temporadas (barras claras: sin surgencia; barras oscuras: surgencia). Las letras idénticas en el superíndice denotan la falta de diferencias significativas a p < 0,05. Las líneas verticales indican la desviación estándar.
Incrustaciones biológicas
Durante la temporada sin surgencia se observaron diferencias significativas en la biomasa de las incrustaciones biológicas entre los métodos de cultivo (ANOVA I, p< 0,05), con las más altas masas de incrustaciones observadas en el tratamiento BTO (5,73 ± 0,125 g) (Figura 5B). Durante la temporada de surgencia se observó una biomasa seca de incrustaciones significativamente más alta (ANOVA I, p < 0,05) en las ostras cultivadas con los tratamientos BTBC (11,76 ± 1,18 g), BBO (8,91 ± 1,47 g) y BTO (8,43 ± 1,71 g).
Crecimiento, incrustaciones biológicas, índice de condición y supervivencia entre temporadas
Todas las variables biométricas (altura de la concha, supervivencia, masa seca de tejidos blandos, masa seca de la concha, incrustaciones e índice de condición) mostraron diferencias significativas entre temporadas y métodos de cultivo, así como en la interacción entre estos dos factores (ANOVA II, p< 0,05, Tablas 1, 2), a excepción de la supervivencia, que no mostró diferencias significativas (p> 0,05) entre métodos de cultivo ni en la interacción entre temporadas y métodos de cultivo. Estos resultados se deben a que todas las variables biométricas estudiadas mostraron tasas mayores en la temporada de surgencia que en la temporada sin surgencia, así como en la interacción entre ambas fuentes de variación (temporada y método de cultivo), que mostraron una sinergia evidente.
Tabla 1 Resultados del ANOVA de dos factores que evalúa el efecto de los factores temporada (surgencia y sin surgencia) y los métodos de cultivo sobre los parámetros de crecimiento y supervivencia en la ostra perlífera alada P. colymbus.
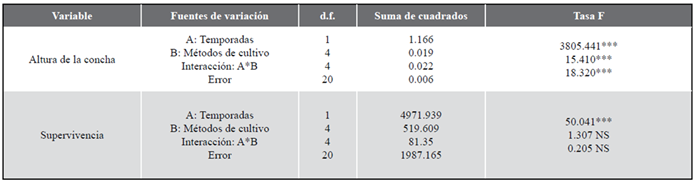
NS: no es significativo/ not significant; *P< 0,05; **P< 0,01; ***P< 0,001
Tabla 2 Resultados del ANOVA de dos factores que evalúan el efecto de la temporada (surgencia y sin surgencia) y el método de cultivo como factores sobre los parámetros de crecimiento, incrustaciones biológicas y el índice de condición en la ostra perlífera P. colymbus.
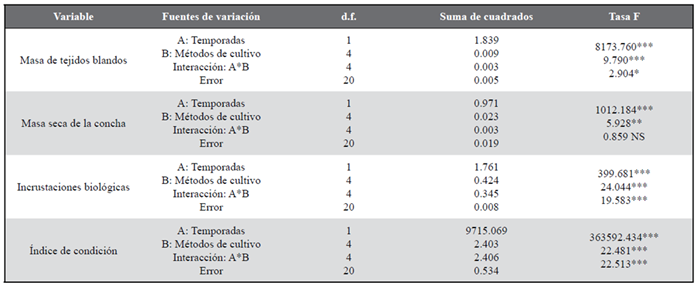
NS: no es significativo/ not significant; *P < 0,05; **P < 0,01; ***P < 0,001
Variables ambientales
Todas las variables ambientales, excepto la temperatura observada durante la temporada de surgencia (Figura 6E), mostraron fluctuaciones notables durante las dos temporadas de cultivo (Fig. 6A, B, C, D). A excepción de los datos de la Chl-a, el resto de los parámetros fisicoquímicos y biológicos mostraron diferencias significativas entre temporadas (ANOVA I, p< 0,05).
Índice de surgencia: este índice, representado por el registro gráfico del transporte de Ekman (Km3 s-1.1000), mostró un valor mayor (2,4±0,24) durante la temporada de surgencia (marzo, abril y mayo de 2015) (Figura 6A) y disminuyó (0,3±0,31) durante la temporada sin surgencia (julio, agosto y septiembre de 2014), lo cual indica una fuerte estratificación de la columna de agua. Oxígeno disuelto: las concentraciones más altas, que iban desde 6,1 mg L-1 hasta 9,6 mg L-1, ocurrieron durante la temporada sin surgencia, mientras que los valores mínimos (3,5 mg L-1) ocurrieron durante la temporada de surgencia (Figura 6B). Clorofilaa: los valores de Chl-a más altos se observaron durante la temporada de surgencia (Figura 6C), específicamente en marzo y mayo (52 μg L-1 y 5,1 μg L-1, respectivamente). Las concentraciones más bajas de Chl-a se registraron durante la temporada sin surgencia en agosto (0,3 μg L-1). Seston: el material orgánico particulado (POM) mostró variabilidad en ambas temporadas, con promedios de 2,8±1,35 mg L-1 para la surgencia y 3,8 ± 1,01 mg L-1 para la temporada sin surgencia (Figura 6D). Temperatura: esta variable mostró los valores máximos en septiembre, durante la temporada sin surgencia (29,2 °C), y los mínimos en marzo, durante la temporada de surgencia (24,2 °C) (Figura 6E.
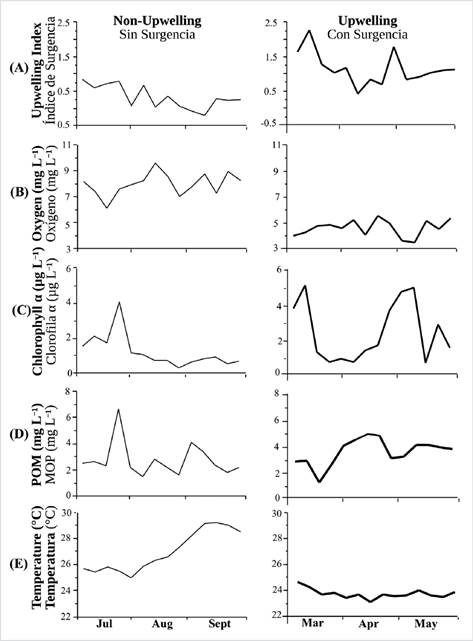
Figura 6 Variación semanal de factores fisicoquímicos en el sitio Turpialito y durante las dos estaciones hidrográficas. A) índice de surgencia; B) oxígeno disuelto; C) clorofila a; D) materia orgánica particulada (POM); y E) temperatura. Líneas gruesas: temporada de surgencia (marzo a mayo); líneas delgadas: temporada sin surgencia (julio a septiembre).
Relación entre las variables ambientales, el crecimiento de las ostras, las incrustaciones biológicas, el CI y la mortalidad
El Análisis de Componentes Principales (PCA) mostró que los dos primeros componentes de la representación ortogonal (Figura 6) explicaban 89,7 % de la variación, lo que indica que la representación gráfica es confiable. Las variables que presentaron una correlación positiva mayor con el primer componente fueron la altura de la concha, la biomasa seca de tejidos blandos (STDM), el índice de condición (CI) y el índice de surgencia (UI), mientras que la supervivencia y la temperatura se correlacionaron en forma negativa con estas variables (Figura 7). La ecuación que explica la varianza observada es la siguiente:
0,373101*altura de la concha + 0,377168*STDM + 0,377216*CI + 0,302155*Incrustaciones-0,352164*Supervivencia + 0,207782*Chl-a-0,352679*Temperatura + 0,285581*POM + 0,334394*UI
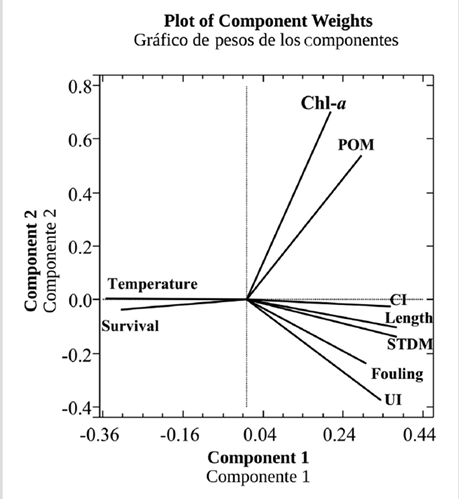
Figura 7 Gráfico bidimensional del Análisis de Componentes Principales de las variables; masa seca de tejidos blandos (STDM), altura de la concha, índice de condición (CI), supervivencia, clorofila a (Chl-a), materia orgánica particulada (POM), temperatura, índice de surgencia (UI) e incrustaciones, temporadas de surgencia y sin surgencia.
DISCUSIÓN
Varios estudios muestran que el método de cultivo tiene un efecto importante en el crecimiento y supervivencia de diferentes especies de ostra perlífera de los géneros Pinctada (Southgate y Beer, 2000; Urban, 2000; Lodeiros et al., 2002) y Pteria (Saucedo y Monteforte, 1997; Fu et al., 2007; Millione y Southgate, 2011). Estos hallazgos son consistentes con nuestros resultados, los cuales muestran que el método de cultivo tuvo un efecto significativo en el crecimiento de la concha, la masa de tejidos blandos y el índice de condición de ostras juveniles. Así, nuestros resultados indican que la selección del método de cultivo es un parámetro importante para optimizar el crecimiento y supervivencia de P. colymbus en cultivos suspendidos.
El rendimiento (crecimiento/supervivencia) de las ostras cultivadas en el exterior de las canastas (OFOB) es similar al registrado por Mengual et al. (2011), en la bahía de Mochima (en el nororiente de Venezuela) y con la misma especie. Los autores atribuyeron el uso exitoso del método de cultivo tubular (sin confinamiento) a una tasa más baja de depredación por parte de caracoles y cangrejos. Sin embargo, la desventaja de este método tubular es la pérdida de ostras por el desprendimiento del biso, probablemente debido a las fuertes olas causadas por los vientos alisios presentes durante la temporada de surgencia. El efecto de la acción de las olas en el crecimiento y supervivencia del cultivo de vieiras Euvola ziczac y Nodipecten nodosus fue demostrado por Freites et al. (1999). Se observó un caso similar en las cuerdas de red de pesca (FNS), donde no se registró la presencia de depredadores (caracoles y cangrejos). Aun así, la supervivencia fue de < 60 %, no pudiendo atribuir claramente la mortalidad a la depredación o al desprendimiento de individuos.
Se recomienda realizar más estudios enfocados en mejorar las técnicas de cultivo por medio del aprovechamiento de la capacidad de asentamiento de las ostras con la fuerza de su biso. En comparación con cualquier otro método, FNS fue el único que no favoreció la agregación de ostras, probablemente a causa de una menor competencia intraespecífica, lo cual podría estar relacionado con los valores más altos de crecimiento que allí se observaron. De manera concordante, la ostra perlífera de labio negro Pinctada margaritifera también mostró mayores tasas de crecimiento en redes de bolsillo, donde cada individuo está confinado en un único compartimiento (Friedman y Southgate, 1999a, 1999b; Southgate y Beer, 2000).
Los resultados de este trabajo muestran una variación marcada en el crecimiento y la supervivencia de juveniles de P. colymbus, a consecuencia de los factores ambientales que se registraron en el área de Turpialito durante las dos temporadas. Estos resultados contrastan con lo registrado por Lodeiros et al. (1999b), indicando que P. colymbus solo se vio poco afectada por cambios marcados en las condiciones ambientales de la misma localidad. Freites et al. (2017) discutieron que el estudio de Lodeiros et al. (1999b) cubrió sobretodo la temporada de surgencia y alta productividad (enero a julio) y mostraron que P. colymbus alcanzó su altura máxima de la concha (60 mm) y la masa del tejido somático durante la temporada de surgencia, pero no compararon las tasas de crecimiento alcanzadas en ambas temporadas o periodo de cultivo. Estos resultados contrastan con los del presente estudio, donde se establecieron diferencias claras en el crecimiento de P. colymbus al comparar ambas temporadas (surgencia y sin surgencia), lo cual indica que la variabilidad ambiental ejerce una influencia importante en el patrón de crecimiento de la ostra perlífera alada P. colymbus durante las dos temporadas.
Durante los meses de mayor surgencia costera, el crecimiento de la altura de la concha y la masa seca de tejidos blandos escaló en 246 y 862 % respectivamente, en comparación con lo que se registró durante los meses de recesión de dicha surgencia. Estos aumentos están estrechamente relacionados con la alta disponibilidad de biomasa de fitoplancton, lo cual responde a una mayor magnitud de los vientos alisios que causas la surgencia costera, la mezcla de la columna de agua y la disminución de la temperatura, con su correspondiente aumento en las concentraciones de nutrientes (amonio, nitrito, fosfato y silicato) y en la producción general de fitoplancton (Calvo-Trujillo et al., 2015). En este estudio, la contribución general de los factores ambientales que explican un gran porcentaje de la variabilidad en el crecimiento de los compartimientos corpóreos durante las dos temporadas fue alta (> 85 %) y mantuvo una relación negativa con la temperatura del agua y una positiva con la Chl-a y la materia orgánica particulada.
En este estudio, la fracción orgánica del seston (POM) y la Chl-a (que fueron > 1 μg L-1) modularon la mayoría de los parámetros de crecimiento de las ostras en ambas temporadas, considerando que, para Saxby (2002), dicha concentración de Chl-a no es una limitante para el crecimiento del organismo. Lodeiros y Himmelman (2000) subrayaron el efecto que tiene la energía contenida en el fitoplancton sobre el crecimiento de la vieira Euvola ziczac en condiciones de cultivo suspendido en el golfo de Cariaco en Venezuela. Los autores analizaron las variabilidades temporales y espaciales en las comunidades de productores primarios (dominadas por nanoflagelados) durante la temporada sin surgencia (de octubre a diciembre) y las compararon con lo que se observó durante la temporada de surgencia, cuando las diatomeas dominan la comunidad de fitoplancton. En consecuencia, el estudio del rol que desempeña la calidad de la energía contenida en la fracción orgánica de la materia particulada, que incluye al fitoplancton, en la dieta de los bivalvos es muy recomendable para suministrar información que se pueda comparar con el conocimiento existente sobre los mecanismos de alimentación de las especies.
También quedó claro que las ostras experimentaron una baja mortalidad cuando la productividad primaria descendió (temporada sin surgencia), circunstancias confirmadas por el resultado del PCA, donde se observa una relación directa entre la supervivencia y la temperatura. En nuestro estudio se observaron tasas bajas de supervivencia, y estas estuvieron probablemente relacionadas con la presencia de depredadores como los caracoles gasterópodos Linatella caudata y Cymatium pileare y el cangrejo decápodo Pilumnus caribaeus. Este patrón se hizo más evidente en las canastas cerradas, donde las ostras se mantuvieron confinadas (datos cualitativos no mostrados), que en los artefactos donde las ostras estaban fijadas afuera. De manera consistente, Malavé et al. (2012) reportaron un aumento en las tasas de reclutamiento de caracoles depredadores de la familia Cymatiidae durante las temporadas de surgencia en el golfo de Cariaco, Venezuela. Esto probablemente ocurre porque los depredadores se aprovechan de la protección que brinda la cesta cuando la colonizan para continuar con sus acciones depredadoras, lo cual probablemente no sucede cuando las ostras se fijan por fuera del contenedor.
Además, una vez el depredador mata a una ostra no confinada, esta cae al lecho marino, y es probable que esto cause que el depredador caiga con ella, alejándolo del resto de bivalvos y cesando su efecto negativo sobre el resto de las ostras. De manera similar, Freites et al. (2000) describieron cómo el cangrejo depredador Calappa cinerea se aprovecha del refugio que proveen los contenedores de cultivo de fondo de la vieira Euvola ziczac, causando una mortalidad 27 % más alta que la que ocurre con otros métodos de cultivo donde el cangrejo está expuesto a ciertos depredadores. Estos resultados concuerdan con numerosas investigaciones que resaltan el efecto nocivo de algunos depredadores para el cultivo de bivalvos, en su mayoría peces de las familias Balistidae y Monacanthidae (Alagarswami, 1987; Freites et al., 2017) y cangrejos y caracoles (Monteforte y García-Gasca, 1994; Freites et al., 2000; Lodeiros et al., 2002; Villarroel et al., 2004; Semidey et al., 2010).
Dados estos resultados, se pueden considerar dos estrategias relativamente efectivas para contrarrestar la presencia de depredadores: 1) ubicar el sitio de cultivo para las especies de bivalvos objetivos como ostras y mejillones de manera que resista períodos de desecación en la zona intermareal (Buitrago et al., 2009; Núñez et al., 2010) y 2) introducir ciertos organismos invertebrados como erizos de mar en los artefactos de cultivo como mecanismos de biocontrol de incrustaciones biológicas en las canastas (Lodeiros y García, 2004; Sonnenholzner et al., 2017), así como para reducir la incidencia de especies identificadas como depredadoras (Malavé et al., 2012).
Teniendo en cuenta que se ha observado un reclutamiento continuo de larvas de P. colymbus a lo largo del año, con picos en agosto y diciembre (Márquez et al., 2000), sugerimos desplegar los colectores de larvas en noviembre para cosechar los juveniles en enero. Asimismo, se recomienda colgar los artefactos de cultivo en los meses siguientes para aprovechar la alta productividad primaria en el área, estimulada por la surgencia costera (enero-agosto). Esta es una estrategia para disminuir el tiempo requerido (dentro de los primeros seis a ocho meses) cosechando las ostras que tengan un tamaño apto para el consumo humano (Lodeiros et al., 1999b) o para la producción de medias perlas (mabé) y redondas.
La viabilidad del cultivo de P. colymbus es posible mediante elementos de bajo costo, específicamente aquellos que reducen el riesgo de incidencia de depredadores (para organismos no confinados), aprovechando la producción natural de bisos de esta especie. Dados estos resultados, recomendamos las cuerdas de redes de pesca (FNS) como el artefacto ideal para el cultivo suspendido de juveniles de P. colymbus hasta el crecimiento final a un tamaño comercial (consumo e implantación, injerto). Esto, de acuerdo con Southgate (2008), quien concluye que los métodos de cultivo sin el confinamiento de una jaula o red aumentan la disponibilidad de alimento y la circulación del agua, favoreciendo, a su vez, el rendimiento de la ostra.
CONCLUSIONES
Estos resultados mostraron mayores tasas de crecimiento en ostras cultivadas durante los periodos de surgencia. Sin embargo, las tasas de supervivencia fueron más bajas en esta temporada, como consecuencia de una mayor presencia de depredadores. Con esto en mente, se recomienda mantener el cultivo bajo revisiones constantes durante este periodo para controlar la incidencia de depredadores, lo cual incrementaría el rendimiento (crecimiento/supervivencia) de las ostras en el cultivo.
El método de cultivo que mostró el mayor crecimiento de las ostras aladas P. colymbus fue el método sin confinamiento sobre cuerdas de redes de pesca (FNS), seguido del método que involucra ostras fijadas sobre canastas (OFOB).
Las interacciones entre la temperatura (relación inversa), la clorofila a y el material orgánico particulado (POM) (relación directa) fueron capaces de explicar un alto porcentaje en la varianza del crecimiento de los individuos, mostrando el efecto modulador del medio ambiente en los rendimientos de las ostras perlíferas aladas P. colymbus.
AGRADECIMIENTOS
Este estudio fue financiado por el proyecto “Estación Hidrobiológica de Turpialito del Instituto Oceanográfico de Venezuela. Universidad de Oriente and Centro de Monitoreo Ambiental y Producción de Semillas de Moluscos Bivalvos” (Subvención Fonacit-UDO 2011000344). Los autores agradecen a Luis G. Freites-Estrella por mejorar el manuscrito en inglés
REFERENCIAS
Alagarswami, K. 1987. Cultured pearls-production and quality. In: Alagarswami, K. (ed). Pearl Culture. Bull. Cent. Mar. Fish. Res. Inst. Cochin. India., 39: 107-111. http://eprints.cmfri.org.in/id/eprint/2674 [ Links ]
Bowden, K.F. 1983. Physical oceanography of coastal waters. Ellis Horwood Ltd, England, 302 p. [ Links ]
Buitrago, E., J. Buitrago, L. Freites y C. Lodeiros. 2009. Identificación de factores que afectan al crecimiento y la supervivencia de la ostra de mangle. Crassostrea rhizophorae (Guilding. 1828). bajo condiciones de cultivo suspendido en la laguna de La Restinga. Isla de Margarita. Venezuela. Zootecnia Trop., 27(1): 079-090. [ Links ]
Calvo-Trujillo, A., J. Díaz-Ramos, S. Subero-Pino, L. Charzeddine-Charzeddine, K. Rincones-Reyes, L. Troccoli-Ghinaglia, M. Elguezabal-Méndez, B. Marín y B. Márquez. 2015. Variación a corto plazo del fitoplancton en la bahía de Turpialito. Golfo De Cariaco, Venezuela, durante la época de lluvias. Bol. Inst. Oceanogr. Venezuela, 53(1): 13-24. [ Links ]
Díaz. J. y M. Puyana. 1994. Moluscos del Caribe colombiano. Un Catálogo Ilustrado. Colciencias. Fundación Natura-Invemar. Bogotá. 367p. [ Links ]
Freites, L., J. Côté., J.H. Himmelman and C.J. Lodeiros. 1999. Effect of wave action on the growth and survival of scallops Euvola ziczac and Lyropecten nodosus in hanging culture. J. Exp. Mar. Biol. Ecol., 239: 47-59. https://doi.org/10.1016/S0022-0981(99)00029-5 [ Links ]
Freites, L. , C. Lodeiros and J. Himmelman . 2000. Impact of predation by gastropods and decapods recruiting onto culture enclosures on the survival of the scallop Euvola (=Pecten) ziczac (L.) in suspended culture. J. Exp. Mar. Biol. Ecol., 244: 297-303. https://doi.org/10.1016/S0022-0981(99)00149-5 [ Links ]
Freites, L. , M. Rojas, A.W. Dale, A. Márquez, J. Revilla, C. Lodeiros and L. Troccoli. 2017. Influence of environmental variables during seasonal upwelling on growth of the winged oyster Pteria colymbus in a tropical ecosystem. Aquac. Intern., 25: 1653-1666. https://doi.org/10.1007/s10499-017-0141-2 [ Links ]
Freites, L. , F. Jara, M. Gregori, J. Villón, A. Márquez and D. Rodríguez-Pesantes. 2019. Hanging culture of juveniles of the winged oyster Pteria sterna in two baskets of different design. AquaTechnica, 1: 28-39. [ Links ]
Friedman, K.J. and P.C. Southgate. 1999a. Grow-out of blacklip pearl oysters. Pinctada margaritifera collected as wild spat in Solomon Islands. J. Shellfish Res., 18: 159-168. [ Links ]
Friedman, K.J. and P.C. Southgate. 1999b. Grow-out of blacklip pearl oysters. Pinctada margaritifera (Linnaeus, 1758) on chaplets in suspended culture in Solomon Islands. J. Shellfish Res., 18: 451-458. [ Links ]
Fu, S., C. Deng, F. Liang, H. Huangand and R. Xie. 2007. Study on techniques of round-pearl and artificial cultivation in Pteria penguin (Roding). J. Guangdong Ocean. Univ., 27: 34-37. [ Links ]
Gaytán-Mondragón, I., C. Cáceres-Martínez and M. Tobías-Sánchez. 1993. Growth of the pearl oyster Pinctada mazatlanica and Pteria sterna in different culture structures at La Paz Bay. Baja California Sur. Mexico. J. World Aquac. Soc., 24 (4): 541-546. https://doi.org/10.1111/j.1749-7345.1993.tb00585.x [ Links ]
Jury, M.R. 2018. Eastern Venezuela coastal upwelling in context of regional weather and climate variability. Reg. Stud. Mar. Sc., 18: 219-228. https://doi.org/10.1016/j.rsma.2017.10.010 [ Links ]
Lara, O.L., J.C. Gómez-León y C. Romero. 2009. Cultivo piloto experimental de los bivalvos (Pinctada imbricata. Pteria colymbus y Argopecten nucleus) en bahía Portete. Departamento de la Güajira, Caribe colombiano. Foro Iberoam. Rec. Mar. Acui., II. 437-445. [ Links ]
Lodeiros, C. y L. Freites. 2008. Estado actual y perspectivas del cultivo de moluscos bivalvos en Venezuela: 135-150. En A. Lovatelli, A. Farías e I. Uriarte (Eds). Estado actual del cultivo y manejo de moluscos bivalvos y su proyección futura: factores que afectan su sustentabilidad en América Latina. FAO Actas Pesca Acuicutura. [ Links ]
Lodeiros, C. and N. García. 2004. The use of the sea urchins to control fouling during suspended culture of bivalves. Aquaculture, 231: 293-298. https://doi.org/10.1016/j.aquaculture.2003.10.022 [ Links ]
Lodeiros, C. J. and J.H. Himmelman. 2000. Identification of factors affecting growth and survival of the tropical scallop Euvola (Pecten) ziczac in the Golfo de Cariaco. Venezuela. Aquaculture, 182: 91-114. https://doi.org/10.1016/S0044-8486(99)00245-8 [ Links ]
Lodeiros, C., B. Marín y A. Prieto. 1999a. Catálogo de moluscos de las costas nororientales de Venezuela: Clase Bivalvia. Ediciones Apudons, Caracas. 109 p. [ Links ]
Lodeiros, C. , J. Rengel and J.H. Himmelman. 1999b. Growth of Pteria colymbus (Röding. 1798) in Golfo de Cariaco. Venezuela. J. Shellfish Res., 18. 155-158. [ Links ]
Lodeiros, C. , D. Pico, A. Prieto, N. Narváez and A. Guerra. 2002. Growth and survival of the pearl oyster Pinctada imbricata (Röding 1758) in suspended and bottom culture in the Golfo de Cariaco. Venezuela. Aquac. Intern., 10 (4): 327-339. https://doi.org/10.1023/A:1022451608405 [ Links ]
Malavé, C., L. Freites, C. Lodeiros, J. Mendoza, L. Troccoli and A.W. Dale . 2012. Annual recruitment. predation rates and biocontrol of Linatella caudata (Mollusca: Gastropoda) in suspended enclosure culture of the pearl oyster Pinctada imbricata Aquaculture, 355: 75-83. https://doi.org/10.1016/j.aquaculture.2012.03.037 [ Links ]
Márquez, B., C. Lodeiros, M. Jiménez y J.H. Himmelman. 2000. Disponibilidad de juveniles por captación natural de la ostra alada Pteria colymbus (Bivalvia: Pteriidae) en el Golfo de Cariaco. Venezuela. Rev. Biol. Trop., 48 (1): 151-158. [ Links ]
Mengual, M., C. Lodeiros y A. Marquez. 2011. Crecimiento y supervivencia de la ostra alada Pteria colymbus (Röding. 1798). en estructuras tubulares en la Bahía de Mochima. estado Sucre. Venezuela. Zootecnia Trop., 29: 219-229. [ Links ]
Milione, M. and P.C. Southgate. 2011. Environmental conditions and culture method effects on growth and survival of juvenile winged pearl oyster. Pteria penguin. J. Shellfish Res., 30(2): 223-229. https://doi.org/10.2983/035.030.0205 [ Links ]
Monteforte, M. and A. García-Gasca. 1994. Spat collection studies on pearl oysters Pinctada mazatlanica and Pteria sterna (Bivalvia. Pteriidae) in Bahía de La Paz, South Baja California, Mexico. Hydrobiologia, 291: 21-34. https://doi.org/10.1007/BF00024236 [ Links ]
Müller-Karger, F.E. and R. Aparicio-Castro. 1994. Mesoscale processes affecting phytoplankton abundance in the southern Caribbean Sea. Cont. Shelf Res., 14: 199-221. https://doi.org/10.1016/0278-4343(94)90013-2 [ Links ]
Müller-Karger, F., G.T. Taylor, Y. Astor, R.C. Thunnell, M.I. Scranton, R. Varela, L. Troccoli, L. Lorenzoni, E. Montes, K.A. Fanning and C. Benítez-Nelson. 2013. The CARIACO Basin ocean time-series. LOICZ Inprint, 1: 3-17. https://doi.org/10.1002/palo.20034 [ Links ]
Narváez, M., L. Freites, M. Guevara, J. Mendoza, H. Guderley, C. Lodeiros and G. Salazar. 2008. Food availability and reproduction affects lipid and fatty acid composition of the brown mussel. Perna perna (Linné. 1758). raised in suspension culture. Comp. Biochem. Physiol. (B), 149: 293-302. https://doi.org/10.1016/j.cbpb.2007.09.018 [ Links ]
Núñez, M.P., C. Lodeiros, E. Ramirez, N. Narváez y C. Graziani. 2010. Crecimiento y sobrevivencia de la ostra de mangle Crassostrea rhizophorae bajo condición de cultivo intermareal y submareal. Zootecnia Trop., 28 (2): 239-254. [ Links ]
Okuda, T., J. Benítez-Álvarez, J. Bonilla y G. Cedeño. 1978. Características hidrográficas del Golfo de Cariaco. Venezuela. Bol. Inst. Oceanogr. Venezuela, 17: 69-88. [ Links ]
Puccinelli, E., C. D. McQuaid and M. Noyon. 2016. Spatio-temporal variation in effects of upwelling on the fatty acid composition of benthic filter feeders in the southern Benguela ecosystem: Not all upwelling is equal. PloS One, 11. e0161919. https://doi.org/10.1371/journal.pone.0161919 [ Links ]
Romero, C., J. Gómez-León y O. Lara. 2009. Cultivo experimental de bivalvos (Pinctada imbricata, Pteria colymbus y Argopecten nucleus): proyecto piloto con la comunidad Wayuu en bahía Portete. Departamento de la Guajira. Caribe colombiano. Foro Iberoam. Rec. Mar. Acuic., II: 433-445. [ Links ]
Rueda-Roa, D. 2012. On the spatial and temporal variability of upwelling in the Southern Caribbean Sea and its influence on the ecology of phytoplankton and of the Spanish sardine (Sardinella aurita). Ph.D. Thesis. University of South Florida. Tampa, USA. [ Links ]
Rueda-Roa, D.T., T. Ezer and F.E. Müller-Karger. 2018. Description and mechanisms of the mid-year upwelling in the southern Caribbean Sea from remote sensing and local data. J. Mar. Sci. Eng., 6: 36. https://doi.org/10.3390/jmse6020036 [ Links ]
Ruiz-Rubio, H., H. Acosta-Salmón, A. Olivera, P.C. Southgate and C. Rangel-Dávalos. 2006. The influence of culture method and culture period on quality of half-pearls (“mabé”) from the winged pearl oyster Pteria sterna Gould. 1851. Aquaculture, 254: 269-274. https://doi.org/10.1016/j.aquaculture.2005.09.030 [ Links ]
Saucedo, P. and M. Monteforte. 1997. Repopulation experiments of pearl oyster Pteria sterna (Gould. 1851) natural beds at Bahia de La Paz. Baja California Sur. Mexico. Ambio, 26. 522-528. https://www.jstor.org/stable/4314660 [ Links ]
Saxby, S.A. 2002. A review of food availability. sea water characteristics and bivalve growth performance at coastal culture sites in temperate and warm temperate regions of the world. Fish. Res. Rep. Dep. Fish. Western Australia., 132. 42 p. [ Links ]
Semidey, D., A. Márquez y C. Lodeiros. 2010. Crecimiento y supervivencia de la madre perla Pinctada imbricata (Röding 1798) bajo condiciones de cultivo suspendido. en cuerdas y cestas perleras. Zootecnia Trop., 28(4): 521-533. [ Links ]
Sonnenholzner, J., G. Alcivar, A. Márquez y C. Lodeiros. 2017. Los erizos Arbacia incisa y Eucidaris thouarsii (Echinodermata) como agentes de biocontrol del “fouling” en canastas de cultivo de Crassostrea gigas (Mollusca: Ostreidae). Rev. Biol. Trop., 65: 35-41. [ Links ]
Southgate, P.C. 2008. Pearl oyster culture: 231-272. In: P. C. Southgate and J. S. Lucas (Eds). The pearl oyster. Oxford: Elsevier Science. The Netherlands. [ Links ]
Southgate, P.C. and A.C. Beer. 2000. Growth of blacklip pearl oyster (Pinctada margaritifera L.) juveniles using different nursery culture techniques. Aquaculture, 187: 97-104. https://doi.org/10.1016/S0044-8486(99)00392-0 [ Links ]
Strickland, J. and T. Parsons. 1972. A practical handbook of seawater analysis. Second edition. Fish. Res. Board of Canada. Bull., 167. [ Links ]
Ter. B.C.J.F. and P. Šmilauer. 1998. CANOCO reference manual and user s guide to CANOCO for Windows: software for canonical community ordination (v. 4). Microcomputer Power. New York. 351 p. [ Links ]
Urban, H.J. 2000. Culture potential of the pearl oyster Pinctada imbricata from the Caribbean. II. Spat collection. and growth and mortality in culture systems. Aquaculture, 189: 375-388. https://doi.org/10.1016/S0044-8486(00)00393-8 [ Links ]
Villarroel, E., E. Buitrago and C. Lodeiros. 2004. Identification of environmental factors affecting growth and survival of the tropical oyster Crassostrea rhizophorae in suspended culture in the Golfo de Cariaco. Venezuela. Rev. Cient. Fac. Cienc. Vet. Luz, 14 (1): 28-35. [ Links ]
Yossa, R. and M. Verdegem. 2015. Misuse of multiple comparison tests and underuse of contrast procedures in aquaculture publications. Aquaculture, 437: 344-350. https://doi.org/10.1016/j.aquaculture.2014.12.023 [ Links ]
Zar, J. 1996. Biostatistical analysis. Prentice Hall. New Jersey. 940 p. [ Links ]
Recibido: 18 de Mayo de 2020; Aprobado: 11 de Agosto de 2021











 texto em
texto em